MASTER EN SCIENCES – TECHNOLOGIES - SANTE
Mention : ECOLOGIE
Spécialité : Écosystèmes Tropicaux Naturels et Exploités
La fluorescence des anthères de Mimosa pudica :
Impact dans les interactions interspécifiques avec le lycène Hemiargus hanno et analyses phytochimiques/photophysiques des fluorophores
Pierre Freyre
Directeurs de stage :
Christophe Duplais et Julien Renoult
Laboratoire des Substances Naturelles Amazoniennes
UMR EcoFoG à l’Institut Pasteur de la Guyane 23 Avenue Pasteur, 97300 Cayenne Juin 2013
Pour commencer, j’aimerais remercier,
Christophe Duplais de m’avoir accueilli au sein de son équipe et de m’avoir fait confiance pendant toute la durée de mon stage. Merci pour tes conseils et tes idées, pour ton encadrement, et merci pour ton enthousiasme même quand les manips ne fonctionnent pas. Merci de m’avoir donné la chance de participer à un congrès et d’y présenter nos travaux.
Julien Renoult, pour son aide et ses idées, pour ses conseils en écologie et pour le traitement des résultats, pour sa vision toujours très juste. Le peu de temps que nous avons passé ensemble m’a été très profitable.
L’équipe du LSNA, Michael, Arnaud, Jean, Emeline et Guillaume. Merci pour vos conseils, vos réponses, et votre disponibilité lorsque j’ai eu besoin d’un coup de main ou d’un renseignement. Merci à Michael pour tes discussions sur tout et rien et pour tes nombreuses anecdotes qui donnent de la vie au labo et en font un lieu où il fait bon d’y venir travailler. Merci à Jean pour ton regard critique toujours constructif et pour tes conseils dès que je cherche des réponses et essaye de comprendre où je vais.
Toutes les personnes souriantes que j’ai croisées à Pasteur, à la pause repas ou à la pause-café au labo. Vos présences rendent le LSNA un peu moins isolé du reste du monde, au fond de ce grand campus de Pasteur.
Toutes les personnes avec qui j’ai passé de bons moments cette année, Manu ma coloc, Mélaine, joyeuse thésarde toujours souriante, Jm, Axel, Adrien, Clément, Flavio, et tous mes ex-colocs d’Ebène, la joyeuse confrérie du campus de Kourou et les gens qui gravitent non loin, chien et chats y compris.
INTRODUCTION ... 1
MATÉRIEL ET MÉTHODE ... 7
Sites et méthode d’échantillonnage ... 7
Modèles d’étude ... 7
Élevage ... 9
Test de choix ... 10
Analyses statistiques ... 13
Préparation des anthères ... 14
Extraction des composés fluorescents ... 15
Séparation des composées sur colonne chromatographique de silice. ... 16
Chromatographie sur couche mince (CCM) ... 16
Analyses par HPLC (High Pressure Liquid Chromatography) ... 16
Hydrolyse par reflux acide ... 16
Tests pH métriques ... 17
RMN (Résonance Magnétique nucléaire) ... 17
Analyses photophysiques ... 17 RESULTATS ... 18 Elevage ... 18 Tests comportementaux ... 18 Rendements d’extraction ... 22 Purification ... 22 Hydrolyse ... 23 CCM ... 24 RMN ... 25
Préparation des anthères. ... 27
Spectres d’émissions ... 28 DISCUSSION ... 30 Elevage ... 30 Test comportementaux ... 30 Phytochimie / Photophysique ... 33 BIBLIOGRAPHIE ... 36
Table des illustrations :
Tableau 1 : Coordonnées GPS des 3 sites d’echantillonnages. ... 7
Tableau 2 : Résultats du modèle linéaire généralisé à effets mixtes.. ... 19
Figure 1 : a- Spectre de la lumière visible par l’homme et par l’abeille. b- Sensibilité spectrale des trois types de cônes chez l’homme . c- Sensibilité spectrale des types des photorécepteurs chez la crevette-mante. ... 3
Figure 2 : structures de substances naturelles fluorescentes ... 3
Figure 3 : a. Fluorescence chez Cosmophasis umbratica et b. chez P. utahensis. c. Fluorescence chez Melopsittacus undulatu. d. Fluorescence chez Erechtias prazina et Erechtias zebrina . ... 4
Figure 4 : Ornithogalum thyrsoides sous lumière blanche et sous lumière UV. ... 5
Figure 5 : a. Inflorescence de Mimosa pudica à la lumière blanche et à la lumière UV. b. Anthères de M. pudica à la lumière blanche et à la lumière UV ... 5
Figure 6 : Mimosa pudica. ... 5
Figure 7: Etapes de la croissance d’Hemiargus hanno ... 8
Figure 8 : Hemiargus hanno, individu mâle et individu femelle. ... 8
Figure 9 : Cage d’élevage de Hemiargus hanno et Ministrymon azia. ... 9
Figure 10 : Système de Y. ... 10
Figure 11 : Test 2 : fleurs de M .pudica sous plexiglass UV transparent et UV bloquant à la lumière du jour et sous lumière UV ... 11
Figure 12 : Test de choix de différentes cibles. ... 11
Figure 13 : Mimosa Pigra. ... 12
Figure 14 : a- Fleurs avec anthères et œuf grossie au microscope. b- Anthères grossis au microscope.c- anthères grossis au microscope électronique à balayage. ... 15
Figure 15: Répartition des touches en fonction du type de cible. ... 19
Figure 16 : Répartition des touches/papillons/minutes en fonction du type de cible ... 20
Figure 17 : Répartition des touches/papillons/minutes en fonction du type de cible ... 21
Figure 18 : Répartition des touches en fonction du type de cible ... 21
Figure 19 : Séparation des molécules sur colonnes de silice. ... 22
Figure 20 : Fluorescence de la solution avant hydrolyse acide à différents pH. ... 23
Figure 21 : Migration de la fraction 1 et de l’extrait méthanolique de graminée ... 24
Figure 22 : migration de la fraction 2 sur CCM préparative. ... 25
Figure 23 : Structure et spectre 1H de l’isorhamnetine 5-O-β-D-glucopyranoside ... 26
Figure 25 : spectre 1H de l’sorhamnetine 3-O-β-D-glucopyranoside après purification par
CCM préparative ... 27
Figure 26 : Anthères hydrolysées, anthères partiellement hydrolysées, anthères sans traitements, sous lampe UV et sous lumière du jour. ... 27
Figure 27 : Analyses d’absorption des anthères ... 28
Figure 28 : Spectres des anthères sèches ... 28
Figure 29 : Spectre de l’extrait purifié sur colonne chromatographique. ... 29
Figure 30 : Spectre dans de l’extrait purifié par HPLC ... 29
Figure 31 : Différentes forme d’isorhamnetine en solution. ... 34
Figure 32 : Structures des flavonols fluorescents et non fluorescents…………...…………. 35
Annexe 1: Diagramme de Jablonski……… 40
Annexe 2 : Infusion de lignum nephriticum………. 40
Annexe 3 : Spectre RMN du mélange de deux flavonols glycosylés……….……… 41
Annexe 4 : Spectres 1H du flavonol non fluorescent………..……… 41
1
I- INTRODUCTION
Une diversité importante des systèmes de vision s’est développée dans le règne animal au cours de l’évolution. Les différences morphologiques, anatomiques et moléculaires de l’œil permettent à chaque espèce d’extraire de manière unique et adaptée les informations sur les caractéristiques spatiales, temporelles, chromatiques (relatives aux couleurs) ou achromatiques (relatives à la luminosité) de la lumière qui lui sont nécessaire pour interagir avec son environnement (Lythgoe, 1979). Chez l’homme par exemple, la rétine est composée de cônes et de bâtonnets (Osorio et al, 2008). Les premiers sont sensibles aux couleurs et les seconds sont sensibles à la luminosité et sont utilisés essentiellement dans la vision crépusculaire (Jacobs et al, 2003 ; Jacobs et al, 2009 ; Fujun et al, 2012). Les humains ont une vision diurne trichromatique, c’est-à-dire que les couleurs sont perçues à l’aide de trois types de cônes dans une gamme d’onde allant de 400 nm à 700 nm (figure 1) (Jacobs, 2007). Chez les arthropodes, la vue est basée sur un système d’ommatidies. Les ommatidies contiennent un ensemble de cellules photoréceptrices entourées par des cellules de soutien et des cellules pigmentaires. Ces cellules sont rassemblées autour d’un axe principal appelé rhabdome (Briscoe et Chitkka, 2001). Les arthropodes peuvent avoir des visions dichromatiques, trichromatiques et même tétrachromatiques (Osorio et al, 2008). Certaines espèces sont capables de percevoir des longueurs d’ondes invisibles pour l’œil humain et de détecter un signal chromatique dans l’ultraviolet (UV) ou dans l’infrarouge (IR) (Andersson et Amudsen, 1997). A notre connaissance la vision la plus développée du règne animal est celle des crevettes-mantes du genre Stomatopoda. Leur œil, composé de trois pupilles interdépendantes, contient 16 types de photorécepteurs lui permettant d’être sensible de l’UV jusqu’à l’IR. De plus certains de ces photorécepteurs sont utilisés pour visualiser séparément les différents types de polarisation de la lumière (rectiligne, elliptique ou circulaire). Stomatopoda est le seul genre du règne animal à ce jour identifié comme possédant de telles caractéristiques (Cronin, 1989, 2001 ; Marshall, 1988, 1999 ; Mazel, 2004).
Ces multiples variations de perception visuelle offrent la possibilité à certains animaux de discriminer une lumière émise particulière ; notamment, dans le cas de cette étude, celle issue de la fluorescence.
2
b- c-
Figure 1 : a- Spectre de la lumière visible par l’homme et par l’abeille. Le visible pour l’œil humain est situé entre 400 nm et 700 nm. Au-dessus de 780 nm le rayonnement est dit dans l’infrarouge (IR) et au-dessous de 400 nm le rayonnement est dit dans l’ultraviolet (UV). b- Sensibilité spectrale des trois types de cônes chez l’homme (Osorio et al, 2008). c- Sensibilité spectrale des types des photorécepteurs chez la crevette-mante (Marshall et al, 2008).
La fluorescence est une émission de lumière spontanée provoquée lors d’un processus de désexcitation d'une molécule ayant absorbée un photon (annexe 1). Ce terme est introduit par Stokes G.G. en 1853 (Stokes, 1853) cependant les premières observations de ce phénomène par Monardes remontent à 1565 (Monardes, 1565). Il s’agit de l’infusion de Lignum nephriticum, un diurétique traditionnel dérivé du bois de deux espèces d’arbres : le narra (Pterocarpus indicus) et le kidneywood Mexicain (Eysenhadtia polystacha) (Muyskens, 2006) (annexe 2). La réaction chimique de formation de la molécule fluorescente, la matlaline (figure 2), a été décrite récemment (Ulises Acuna et al, 2009). Son rendement quantique est de 100 %. Depuis d’autres familles de molécules fluorescences ont été isolées dans la nature (figure 2). Notons que certaines de ces structures sont découvertes pour la première fois par voie chimique et elles seront identifiées quelques années après en milieu naturel. Les molécules de la famille des coumarines et des fluorescéines sont des métabolites biosynthétisés respectivement par les scorpions et par les bactéries Pseudomonas fluorescens (Fet et Selden, 2007 ; Palleroni, 1984). Ces structures sont particulièrement connues pour leur utilisation comme sonde médicale dans diverses applications en biologie telles que la
3 microscopie à fluorescence, la cytométrie en flux etc. (Chen et al, 2013 ; Yan et al, 2013). Les molécules de la famille des xanthones, constituants des plantes de la famille des Clusiaceae et des Bonnetiaceae, sont notables de part leur fluorescence en milieu aqueux. Cette propriété est très recherchée dans le domaine médical notamment pour une utilisation dans les milieux biologiques (Heinz et al, 2006). Les pigments des végétaux tels que les chlorophylles ou les bétaxanthines (Gandia-Herrero et al, 2004 ; Gandia-Herrero et al, 2010 ; Maxwell et al, 2000) ont également été identifiés tout comme la quinine issue de l’écorce d’arbres de Cinchona. Certains flavonoïdes sont fluorescents et cette propriété est couramment utilisée en physiologie végétale (Buer et al, 2010). Cependant la faible intensité du signal de fluorescence nécessite l’utilisation de DAPI (4’,6’-diamidino-2-phénylindole) et DPBA (dérivé boré). Ces molécules créaient des liaisons chimiques avec les flavonoïdes pour former des complexes dont l’émission est bien plus intense que celle des flavonoïdes seuls.
Enfin, la structure du fluorophore de la Green Fluorescent Protein (GFP) a été découverte en 1962 dans la méduse Aequorea victoria (Shimomura, 1962), ce qui valut un prix Nobel à l’équipe responsable de cette découverte.
Figure 2 : structures de substances naturelles fluorescentes.
Certains organismes vivants, animaux, végétaux et bactéries ont été identifiés comme étant fluorescents. Une question se pose alors : quel est l’intérêt de la fluorescence pour ces êtres vivants?
Les recherches actuelles font état de fonctions abiotiques associées au mécanisme de biofluorescence. Par exemple la cuticule des scorpions présente une fluorescence intense (figure 3) dont un des intérêts supposés est une protection contre les rayonnements UV (Fet et Selden, 2007 ; Fasel et al, 1997; Wankhede, 2004). D’autres recherches mettent en avant des
4 fonctions impliquées dans les interactions biotiques. Ainsi il a été démontré récemment que la biofluorescence joue un rôle dans la communication visuelle (Lim et al, 2007 ; Andrews et al, 2007 ; Arnold et al, 2002). Cette communication intervient au niveau de la sélection sexuelle ou au niveau de la reconnaissance spécifique. Par exemple, chez les araignées sauteuses Cosmophasis umbratica la présence de stimuli fluorescents (figure 3) chez les femelles est un prérequis à la copulation (Lim et al, 2007, Andrews et al, 2007). Chez les perruches ondulées du genre Melopsittacus undulatus, les motifs fluorescents au niveau de la tête jouent un rôle dans l’attractivité sexuelle du partenaire (Arnold et al, 2002). Les poissons de récifs diurnes issus de 32 espèces de 5 familles différentes possèdent une fluorescence rouge associée à de la communication intraspécifique (Michiels et al, 2008). Notons qu’aucun des fluorophores des trois exemples précédents n’a été identifié à ce jour.
a- b-
c- d-
Figure 3: a. Fluorescence chez Cosmophasis umbratica (Lim, Land, Li D., 2007) et b. chez P. utahensis (Gaffin, 2012). c. Fluorescence chez Melopsittacus undulatus (Arnold et al, 2012). d. Fluorescence chez Erechtias prazina et Erechtias zebrina (Michiels et al, 2008).
Il existe donc chez certains êtres vivants une communication intraspécifique par biofluorescence. Mais qu’en est-il au niveau interspécifique ? Chez de nombreuses plantes à fleurs, la fluorescence du nectar et des anthères a été observée. Plusieurs hypothèses ont alors été avancées. Cette fluorescence pourrait être un signal de communication entre les plantes et les pollinisateurs (Thorp, 1975 ; Gandia-Herrero et al, 2005) au même titre que la couleur
5 produite par réflexion de la lumière, l’odeur, la forme, la texture (Dyer et al, 2007 ; Whitney et al 2009) ou encore les champs électriques (Clarke et al, 2013).
Figure 4 : Photographie d’Ornithogalum thyrsoides sous lumière blanche (à droite) et sous lumière UV (à gauche) (Iriel et Lagorio, 2010).
D’autres auteurs réfutent cette hypothèse et en avancent une autre : la fluorescence serait un trait fonctionnel issu de l’évolution de ces espèces végétales pour protéger l’ADN des gamètes mâles contre les radiations UV (Kevan P. G., 1976), une protection similaire à celle supposée de la cuticule des scorpions. Iriel et Lagorio (2010) ont récemment mesuré le rendement quantique des fleurs appartenant à dix espèces distinctes (figure 4). En photophysique le rendement quantique est défini comme étant la fraction de molécules excitées qui retournent à l’état fondamental avec émission de photons, c’est-à-dire le rapport entre le nombre de photons émis et le nombre de photons absorbés (Valeur, 2004). Les résultats montrent que ces rendements quantiques sont faibles (<1%) et la plus haute valeur obtenue est de 3%. La fluorescence semble négligeable en comparaison de la lumière totale réfléchie. Les auteurs en concluent que ce signal ne peut donc pas être détecté par un photorécepteur animal et ne peut donc être impliqué dans une biocommunication.
Une approche expérimentale est désormais nécessaire pour déterminer la capacité de certains animaux à percevoir ou non ces signaux biofluorescents.
Figure 5 : a. Inflorescence de Mimosa pudica à la lumière blanche (à droite) et à la lumière UV (à gauche). b. Anthères de M. pudica à la lumière blanche (à droite) et à la lumière UV (à gauche).
6 La fluorescence des anthères de Mimosa pudica (L.) a été observée récemment au Laboratoire des Substances Naturelles Amazoniennes (UMR EcoFoG) à Cayenne (figure 5). Parmi les 250 articles publiés sur cette espèce depuis plus d’un siècle, aucun ne relève cet aspect fluorescent. Ces différentes études portent en effet majoritairement sur la compréhension du reflexe sensitif de cette espèce. Pourtant la fluorescence de cette plante est intense et cette espèce comporte de nombreux avantages pour les expériences en laboratoire. En effet M. pudica fleurit de manière journalière quasiment toute l’année en Guyane Française et dans de nombreux pays d’Amérique du sud, particulièrement en saison des pluies (de janvier à juillet) (Ahmad et al, 2012). Mimosa pudica est une plante rudérale souvent qualifiée d’espèce invasive qui se retrouve en importante quantité sur de nombreux sites, en bord de route comme en plein champ. Lors des cueillettes des inflorescences visant à récolter les anthères fluorescentes, de nombreuses larves de papillons ont été observées sur les fleurs. Ces larves sont celles de deux espèces de la famille des Lycènes, Ministrymon azia (Hewitson, 1873) et Hemiargus hanno (Stoll, 1790). Ces lycènes au stade mature sont également observés en quantité importante autour des plants de M. pudica, en train de butiner ou de pondre. Mimosa pudica est donc une plante nourricière pour ces papillons mais également une niche pour la ponte de leurs œufs et la croissance de leurs larves. L’interaction entre M. pudica et les deux espèces de Lycènes représentent un modèle pertinent et adéquat pour mettre en place une expérience de biocommunication interspécifique dont le but est de déterminer le rôle de la fluorescence chez M. pudica.
Dans un premier temps, nous avons cherché à déterminer la capacité des lycènes à discriminer des cibles fluorescentes. Pour cela, nous avons réalisé un test comportemental au cours duquel les lycènes avaient le choix entre des fleurs de M. pudica dont les anthères sont fluorescentes et d’autres fleurs de cette espèce dont la fluorescence a été inhibée. Parallèlement à ces travaux en écologie, une étude chimique a été réalisée afin d’identifier les molécules fluorescentes. Les différents fluorophores présents ont été séparés et identifiés dans le but de déterminer la structure des molécules responsables des signaux biofluorescents.
Le but de ces expériences est donc de savoir : i- si les deux lycènes détectent le signal de fluorescence, ii – quel(s) est/sont le(s) fluorophore(s) impliqué(s) ainsi que ses/leurs propriétés photophysiques.
7 II- MATÉRIEL ET MÉTHODE
1- Sites et méthode d’échantillonnage
Les papillons et les larves ont été récoltés sur trois sites à Cayenne (Guyane Française) ou proche de Cayenne, présentés ci-dessous.
Tableau 1 : Coordonnées GPS des 3 sites d’echantillonnages.
Zone Campus de Troubiran Institut Pasteur Lycée Melkior
Latitude N 4° 56' 35.5842'' N 4° 55' 51.4848'' N 4° 56' 29.1366''
Longitude W 52° 19' 33.207'' W 52° 18' 2.289'' W 52° 18' 9.7812''
Les fleurs de M. pudica sont récoltées une à une à la main puis triées au laboratoire (UMR EcoFoG à l’Institut Pasteur de la Guyane, 23 Avenue Pasteur, 97300 Cayenne) afin de trouver les larves présentes sur les fleurs.
Apres récolte, les larves sont déposées dans une caisse contenant des branches et des fleurs de M. pudica. De nouvelles fleurs sont ajoutées chaque jour. Le lendemain de leur éclosion, les papillons sont isolés dans une seconde caisse pour effectuer les tests de choix (cf matériel et méthode) Les papillons isolés restent à jeun jusqu’au test de choix.
Parallèlement des papillons sont également capturés au filet et introduits dans une cage d’élevage.
L’élevage et les tests sur les papillons se déroulent sur le campus de l’Institut Pasteur de Guyane, derrière le bâtiment du laboratoire LSNA (coordonnées GPS : N 4° 55' 51.4848'' ; W 52° 18' 2.289'').
2- Modèles d’étude Mimosa pudica
Egalement appelée sensitive, cette plante est une Fabaceae, sous-famille des Mimosoidées à base ligneuse, à tiges herbacées grêles, rampantes ou ascendantes, épineuses, parfois grimpantes (Barneby, 1991; Fournet, 2002). Ses feuilles sont persistantes, alternes, composées et bipennées. Ses fleurs sont roses ou blanches, avec des corolles roses à 4 lobes et 4 étamines (Ahmad, 2012). Elle est originaire d’Amérique du sud et d’Amérique centrale et a été introduite dans de nombreuses autres régions ou elle est parfois qualifiée de plante envahissante. Sa taille peut aller jusqu’à 1,5 m. La particularité de M. pudica qui la place au centre de notre étude est la présence d’anthères fluorescentes sur ses fleurs (figure 6). Ses fleurs sont de rose pâle à violet clair, parfois blanche, et ont une durée de vie très courte. La plante fleurit au levé du jour et les fleurs commencent à faner à partir de la fin de matinée.
8 Figure 6 : Mimosa pudica.
Lycénidés
Il existe environ 6 450 espèces de Lycènes réparties dans le monde entier et notamment dans les régions tropicales. Leurs ailes ont une envergure de 15 à 80 mm et une coloration métallique caractéristique, bleue ou rouge cuivré, sur la face supérieure. Elles se terminent souvent par une queue.
Les œufs des Lycènes sont en forme de disque plat ou de dôme strié ou dentelé (figure 7). Les chenilles sont aplaties, aux extrémités effilées (figure 7). Les chrysalides sont courtes, attachées aux feuilles des plantes nourricières par un fil de soie. Plusieurs espèces de lycénidés ont été classées dans les catégories « vulnérables » et « en danger » par l'U.I.C.N. Initialement le lycène étudié pour nos expériences devait être Ministrymon azia (Thécla de la sensitive), mais la présence surnuméraire d’une seconde espèce (Hemiargus hanno) ayant le même cycle et le même milieu de vie a grandement facilité le travail de prélèvements. Nous avons donc décidé d’étudier ce second lycène.
a- b-
c-Figure 7: étapes de la croissance d’Hemiargus hanno : a-œuf, b-larve et c- nymphe
Hemiargus hanno
Ce lycène (figure 8) vit en Amérique du sud et en Amérique centrale sur de nombreux Fabaceae et Mimosaceae. Cette espèce décrite en 1790 sous le nom de Papilo hanno vole toute l’année en milieu tropical. Egalement appelé l’Azuré de l’indigo, ce petit papillon mesure entre 16 mm et 25 mm d’envergure.
9
Figure 8 : Hemiargus hanno, extérieur des ailes (droite) et intérieur des ailes (gauche). Individu mâle en haut et individu femelle en bas (crédits photos http://butterfliesofamerica.com).
Partie écologie
3- Élevage
Les papillons sont placés dans une cage d’élevage située à l’extérieur.
Figure 9 : cage d’élevage de Hemiargus hanno et Ministrymon azia.
Des plants de Mimosa pudica sont placés dans des bacs, à l’intérieur de la volière de manière à ce que le papillon puisse se nourrir du nectar des fleurs de façon journalière et pondre ses œufs. Une bâche a été attachée de manière à couper le vent et à procurer un abri aux individus en cas de forte pluie. La bâche n’empêche pas les plantes d’avoir accès à la lumière et de fleurir. On estime que l’entraînement à l’alimentation pour les papillons issus de l’élevage ou du milieu naturel se fait de manière automatique et autonome sur les fleurs fournies dans la caisse d’émergence et sur les fleurs trouvées en milieu naturel.
10 4- Test de choix
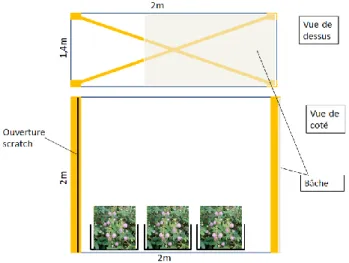
Test N°1
Un premier test de choix utilise un labyrinthe en Y (figure 10) aux dimensions permettant le vol de H. hanno. Les ouvertures des deux branches terminales sont munies d’un plexiglass transparent aux UV. Le labyrinthe est placé à l’extérieur les jours ensoleillés et les papillons sont introduits un par un par le couloir d’entrée et le nombre touche à la paroi d’un des plexiglass est compté. Aucune récompense n’est proposée derrière les plexiglass.
Dans une seconde phase, des fleurs M. pudica avec anthères fluorescentes et des fleurs de M. pudica avec anthères non fluorescentes sont placées chacune derrière le plexiglace, à l’extérieur du labyrinthe.
Figure 10 : système de Y. Du dessus (à droite), de profile (au milieu) et de face (à droite).
Test N°2
Les individus sont placés dans une caisse disposée à l’extérieur les jours ensoleillés et recouverte d’une moustiquaire aux mailles larges avec deux types de cibles différentes. La première cible est une boite Pétri recouverte d’un plexiglass UV transparent contenant des fleurs de M. pudica avec anthères fluorescentes. La seconde boite de Pétri contenant des fleurs de M. pudica avec anthères fluorescentes, est recouverte d’un plexiglass UV bloquant. Un autre dispositif contient des boites de plus petites tailles. Les cibles sont placées de façon aléatoire à chaque expérience.
11 Figure 11 : Test 2 : fleurs de M .pudica sous plexiglass UV transparent et UV bloquant à la lumière du jour (a) et sous lumière UV (b) sur différentes tailles de cibles (c et d).
Test N°3
Les individus sont placés dans une caisse, disposée à l’extérieur par jour ensoleillé et recouverte par une moustiquaire aux mailles larges avec quatre types de cibles différentes. Les quatre cibles sont :
1- M. pudica avec les anthères fluorescentes // Fluorescence +
2- M. pudica avec la fluorescence des anthères inhibées // Fluorescence - 3- Coton fluorescent avec une fleur sans anthères // Fluorescence ++ 4- Coton non fluorescent avec une fleur sans anthères // Fluorescence -
12 Toutes les anthères des fleurs sont enlevées avant que ces dernières soient positionnées sur les cibles (figure 12). La moitié des anthères est introduite sur la cible 1 tandis que l’autre moitié, après traitement (cf partie chimie, 6-Extraction des composés fluorescents), est introduite sur la cible 2. La quantité d’anthères introduite sur les cibles (50 mg) est équivalente. Aucune anthère n’est ajoutée aux cibles 3 et 4 (coton). Le coton fluorescent est obtenu suivant la procédure de la partie chimie (cf partie chimie, 7-Extraction des composés fluorescents).
Le nombre de touches sur chaque type de cible est comptabilisé. On considère qu’un papillon fait une touche lorsqu’il se pose sur la cible au minimum 2 secondes et qu’il la quitte à un temps donné. Cette méthode permet de comptabiliser uniquement les papillons qui viennent sur la cible pour se nourrir ou pondre, et non ceux qui la frôle par hasard ou qui descendent de manière aléatoire pour mourir. Le test dure 9h15 répartie sur 9 jours (entre 30 et 105 minutes par jour).
Test N°4
Par la suite un second test est mis en place. Les individus sont placés dans la même caisse que précédemment et peuvent faire le choix entre 2 cibles.
- Cible 1 : fleurs de M. pudica avec les anthères fluorescentes
- Cible 2 : fleurs d’une autre espèce (Mimosa pigra), morphologiquement proche mais dont les anthères ne sont pas fluorescentes
13 Au cours de la première phase du test le nombre de touches sur chaque type d’inflorescence est comptabilisé afin d’évaluer le choix naturel des lycènes.
Dans un second temps, des anthères fluorescentes sont ajoutées sur les fleurs de M. pigra initialement non fluorescentes. De nouveau le nombre de touches sur chaque type d’inflorescence est comptabilisé.
5- Analyses statistiques
Des incidents nous ayant empêché de mener à bien les tests N°1 et N°2 (voir la section résultats), nous n’avons pas obtenu de résultat à analyser pour ces expériences. Les nombres de touches sur chacune des quatre cibles étudiées dans le test N°3 ont été analysés à l’aide d’un modèle linéaire généralisé à effets mixtes. La variable à expliquer par le modèle est le nombre de touche au cours d’une matinée d’expérience. Le temps d’observation variant entre les matinées (de 30 à 105 minutes), nous avons utilisé comme variable à expliquer le nombre de touches ramené à une durée fixe (120 minutes). Nous avons préféré cette méthode plutôt que celle consistant à diviser le nombre de touches par minute d’observation car cette deuxième approche rendait la distribution des résidus du modèle non modélisable ni par une loi normale ni par une loi de Poisson (nombres non-entier). Au regard du type de données analysées (données de comptage), nous avons supposé une distribution de type Poisson des résidus avec une fonction de liaison (link function) de type logarithmique. Nous n’avons pas observé de sur-dispersion dans le modèle (déviance résiduelle à peu près égale au nombre de degrés de liberté résiduels) et n’avons donc pas eu recours à une distribution de type quasi-poisson ou binomiale négative.
Les quatre cibles au choix étaient : fleurs de M. pudica avec anthères fluorescentes, fleurs de M. pudica avec anthères non fluorescentes, fleurs de M. pudica sans anthère sur coton fluorescent et fleurs de M. pudica sans anthère sur coton non fluorescent. Nous avons alors défini les deux variables explicatives suivantes (effets fixes) : fluorescence (variable catégorielle à deux niveaux, oui ou non) et support (variable catégorielle à deux niveaux, fleur ou coton). Nous avons ajouté une troisième variable explicative catégorielle à deux niveaux, l’ensoleillement qui prend soit la valeur soleil soit la valeur nuageux. Nous avons également considéré les interactions de premier et second ordre entre ces trois variables. Par ailleurs, le nombre de papillons n’était pas constant entre les jours d’observations (ce nombre était contraint par la facilité à trouver les papillons dans la nature). Nous avons alors inclus le nombre de papillons en variable compensatoire (« offset ») ; c’est-à-dire une variable dont les valeurs sont déterminées à l’avance par l’expérimentateur et donc pour laquelle le modèle
14 n’estime aucun paramètre. Enfin, les nombres de touches sur chacune des quatre cibles pour une matinée de test donnée ne peuvent être considérés comme indépendants. Par exemple, on peut supposer que les papillons ont une réserve énergétique limitée à dédier à l’activité de vol et donc qu’un grand nombre de touches sur une cible se fera au détriment du nombre de touches sur une autre cible. Afin de prendre en compte cette non-indépendance, nous avons traité le numéro de matinée (allant de 1 à 9) en variable catégorielle à effet aléatoire dont les résidus a sont supposés suivre une distribution normale de moyenne 0 et de variance σa². Le
modèle final peut donc s’écrire :
μ ~ ) . ( ⇒ ) μ Poisson( ~ .touches E nbtouches nb η = ) μ log( ) σ N(0, ~ + × sup × × β + × sup × β + × × β + sup × × β + × β + sup × β + × β + ) . ( = η 2 a 7 6 5 4 3 2 1 a a ment ensoleille port ce fluorescen ment ensoleille port ment ensoleille ce fluorescen port ce fluorescen ment ensoleille port ce fluorescen papillons nb offset
Ce modèle saturé est ensuite simplifié en retirant successivement l’effet fixe le moins significatif (en commençant par les interactions) et en comparant à chaque étape de la simplification les critères d’information d’Akaike (AIC) et en testant si le modèle simplifié est significativement moins bon que le modèle plus complet (test de Chi-deux). L’estimation des paramètres du modèle fut effectuée par Maximum de Vraisemblance à l’aide de la fonction glmer du package nlme de R (R Core Developpment Team 2011).
Partie chimie
6- Préparation des anthères
Après avoir effectué les prélèvements et le tri pour récolter les larves, les anthères (figure 14) sont séparées du reste des fleurs en frottant délicatement les fleurs. Des gants en latex sont utilisés afin d’éviter d’introduire de la graisse présente sur les mains et pour empêcher les anthères d’adhérer à la peau.
Pour les tests comportementaux, une partie des anthères ne subit aucun traitement. L’autre partie est mise dans une boite de pétri en présence d’eau et chauffer à 80 °C pendant 1 h à l’étuve. Ce traitement permet d’inhiber la fluorescence (cf. résultat).
15 Pour les analyses chimiques les anthères fraiches sont introduites dans un erlenmeyer contenant 200 mL de méthanol et la solution est mise sous agitation pendant plusieurs jours afin d’en extraire les fluorophores. Les rendements lors des étapes d’extraction et de purification seront comparés à ceux obtenus dans le cas d’anthères retirées des fleurs séchées à l’air ambiant pendant 2 jours sans précaution particulière.
Figure 14 : a- Fleurs avec anthères et œufs grossis au microscope. b- Anthères grossis au microscope. c- anthères grossis au microscope électronique à balayage.
Les étapes suivantes décrivent le protocole mis en place afin d’extraire et de purifier les molécules responsables de la fluorescence.
7- Extraction des composés fluorescents
Les anthères sont ajoutées dans un erlenmeyer de 250 mL contenant 200 mL de méthanol. L’erlenmeyer est bouché à l’aide d’un coton et d’un film paraffine et la solution est mise sous agitation à température ambiante pendant plusieurs jours. Le coton alors obtenu après plusieurs jours en présence des vapeurs de la solution méthanolique possède une fluorescence intense. Il est utilisé dans le test N°3. La solution est ensuite versée dans un ballon monocole de 500 mL de façon délicate afin de ne pas introduite le matériel végétal solide. Un volume de 200 mL est à nouveau introduit dans l’erlenmeyer afin de réaliser une deuxième extraction. Trois extractions successives sont généralement nécessaires et la solution n’est plus fluorescente à partir de la quatrième extraction. Le méthanol est évaporé à l’aide d’un évaporateur rotatif et l’opération est arrêtée quand un volume de 50 mL est atteint. La solution est prélevée à l’aide d’une seringue de 20 mL qui une fois remplie est surmontée d’un filtre circulaire de 0,45 µm. Le filtrat est introduit dans un ballon monocole de 50 mL puis le solvant est évaporé pour obtenir la masse de l’extrait sec.
16 8- Séparation des composées sur colonne chromatographique de silice.
Le produit est dissout dans le méthanol et 1 g de silice (Merck 60-F) par gramme d’extrait sec est introduit dans le ballon. Après évaporation totale du solvant la silice imprégnée d’extrait est ajoutée à un gel de silice (80 à 100 g/g d’extrait sec) dans colonne chromatographique pré-remplie. L’éluant utilisé est constitué d’un mélange éthanol, acétate d’éthyle et éther de pétrole, dans les proportions respectives suivantes : 20%, 30% et 50%. La fraction fluorescente jaune/verte est suivie lors de son élution avec une lampe UV et elle est récoltée en une seule fois dans un ballon monocole de 500 mL pour ensuite être évaporée à l’évaporateur rotatif. Le produit sec est suspendu de nouveau dans quelques mL de méthanol et il est introduit dans un speed vacuum jusqu’à évaporation totale du solvant pour obtenir une masse de produits fluorescents purifiés prête pour de nouvelles purifications (CCM préparative ou HPLC) ou pour analyse RMN.
9- Chromatographie sur couche mince (CCM)
La fraction fluorescente est déposée sur une plaque de silice afin de réaliser cette fois une purification par chromatographie sur couche mince (CCM) préparative. La migration des produits sur la plaque de silice est réalisée avec différents éluants afin d’obtenir une séparation optimale. Les ratios des différents mélanges de solvants sont inspirés de la littérature (Bilia et al, 1994 ; Atta et al, 2011). Les bandes fluorescentes sont prélevées en grattant délicatement la silice. Cette dernière est mise en suspension dans le méthanol afin de solubiliser les produits élués. Après filtration à l’aide d’un filtre circulaire de 0,45 µm la solution est introduite dans un speed vacuum jusqu’à évaporation totale du solvant pour obtenir une masse de produits fluorescents purifiés. Trois plaques successives sont réalisées pour obtenir une masse de produits suffisante pour l’analyse RMN.
10- Analyses par HPLC (High Pressure Liquid Chromatography)
La purification de l’extrait après colonne chromatographique a été effectuée par Christophe Molinier et Christophe Long au centre de recherche et développement des laboratoires Pierre Fabre à Toulouse.
11- Hydrolyse par reflux acide
Une partie de la fraction fluorescence évaporée (100 mg) est introduite dans un ballon monocole de 10 mL surmonté d’un condenseur, contenant une solution de 5 mL d’acide chlorhydrique (HCl) à 2 M et de méthanol (50/50). Le mélange HCL/méthanol/produits est
17 chauffé à reflux, sous agitation, pendant environ 3 h. La phase aqueuse est séparée de la phase organique dans une ampoule à décanter par extraction à acétate d’éthyle (10 mL). La phase organique est ensuite évaporée à l’évaporateur rotatif puis au speed vacuum.
12- Tests pH métriques
Un volume de 2 mL de la solution méthanolique d’extraction des anthères ou de la solution méthanolique résultant de la réaction d’hydrolyse est introduit dans des tubes à essais. Le pH est ajusté soit avec une solution d’acide chlorhydrique (1 M) soit avec une solution d’hydroxyde sodium (1 M) afin d’obtenir un gradient de pH allant de 1 à 13. Le pH est mesuré par lecture colorimétrique à l’aide d’un papier filtre. Les mesures n’ont pas été corrigées.
13- RMN (Résonance Magnétique nucléaire)
Les analyses RMN des produits purifiés après colonne chromatographique et après CCM préparative sont effectuées à l’aide d’un spectromètre Varian 400 MHz. Le solvant d’analyse utilisé est le méthanol deutéré.
Partie photophysique
14- Analyses photophysiques
Les analyses photophysiques sont réalisées par Rémi Métivier au laboratoire de Photophysique et Photochimie Supramoléculaires et Macromoléculaires (PPSM), CNRS-UMR 8531, ENS Cachan. Les spectres d’excitation et d’émission corrigés des anthères solides et des solutions ont été obtenus à l’aide d’un spectromètre Horiba Fluorolog®-3. Les rendements quantiques des anthères solides ont été réalisés en utilisant une sphère d’intégration tandis que les spectres d’excitation et d’émission ont été réalisés en utilisant un dispositif « front-face ». Les rendements quantiques en solution sont mesurés en utilisant le sulfate de quinine comme référence dont le rendement quantique dans le méthanol est de 54%. Les extraits à tester et la référence sont dilués dans le méthanol de façon obtenir un rendement absorption proche de 10%.
18
III- RESULTATS
1- ElevageApres plusieurs semaines de tentative d’élevage, les rendements sont faibles et la mortalité est élevée. La courte durée de vie des papillons dans la cage ne permet pas un renouvellement de la population. En l’absence d’un élevage d’une taille suffisamment importante, les expériences comportementales n’ont pu être initiées pendant les premières semaines de ce stage. Une alternative a donc été trouvée. Les papillons sont capturés chaque jour dans un des lieux décrit précédemment à l’aide d’un filet à papillon (cf matériel et méthode). Ils sont utilisés pour les tests journaliers et les survivants sont relâchés sur le campus de l’Institut Pasteur de la Guyane. Chaque individu participe donc à une unique journée de test. Une vingtaine d’individus sont capturés chaque jour.
2- Tests comportementaux
La première phase du test N°1 (labyrinthe en Y) sert à vérifier l’équiprobabilité des choix en l’absence de récompense. Sur 50 individus testés les pourcentages obtenus sont de 51% et 49%, respectivement pour la sortie « droite » et la sortie « gauche ». La différence entre les deux sorties n’est pas significative (χ²=0.02 ; P = 0.887). Lors de la phase expérimentale, pour une raison non déterminée, peut-être liées au stress, les papillons mettent un temps anormalement long à faire un choix ou n’en font pas. L’expérience est finalement arrêtée après plusieurs jours d’échecs.
Au cours du test N°2, constitué par les fleurs mises dans les boites de Pétri recouvertes de plexiglass, les papillons font peu de touches et ils ne visitent quasiment pas les cibles. Seulement 2 touches sont comptées en 90 min pour une vingtaine d’individu le premier jour. Durant les jours consécutifs la même observation est faite. Les reflets provoqués par les plexiglass peuvent altérer et perturber la visualisation des cibles par les papillons. L’expérience est arrêtée après quelques jours d’échecs.
19 Figure 15: Répartition des touches en fonction du type de cible parmi 4 choix cible 1 « fleurs de M. pudica fluorescentes », cible 2 « fleurs de M. pudica non fluorescentes », cible 3 « coton fluorescent », et cible 4 « coton non fluorescent » : Le test est réalisé sur 9 jours, avec un total de 210 papillons (environ 20 individus par jours) réalisant 263 touches. Les jours ensoleillés et non ensoleillés ne sont pas séparés sur cette représentation.
Quel que soit le jour de l’expérience, on observe une nette majorité d’individus se rendant sur les cibles 1 « fleurs de M. pudica fluorescentes ». Ce type de cible représente entre 40% et 70% des choix selon le jour, avec une moyenne de 48% soit une touche toute les 4 minutes 35 secondes (sur le bilan total du test, on observe une touche toute les 2 minutes 14 seconde). Les cibles 2 « fleurs de M. pudica non fluorescentes » sont le second type de cible le plus visité (10% à 40% de touches selon les jours). Les cibles 3 « coton fluorescent » sont visitées avec une proportion de touche variant de 0 à 35% et finalement les cibles 4 « coton non fluorescent » possèdent un nombre faible de touche (entre 0 et 10%). Il semble se dégager de ses résultats des différences entre les cibles en fonction de la nature du support et de leur fluorescence.
Tableau 2 : Résultats du modèle linéaire généralisé à effets mixtes. 0 50 100 1 2 3 4 5 6 7 8 9 En % Jour d'echantillonage Anthères fluorescentes Anthères non fluorescentes
20 a- b-
Figure 16 : Répartition des touches/papillon/minute en fonction du type de cible parmi 2 choix : « cibles 1 et 3 fluorescentes » ou « cibles 2 et 4 non fluorescentes ». a- résultats les jours ensoleillés. Réalisé sur 7 jours, 139 papillons et 153 touches. b- résultats les jours non ensoleillés. Réalisé sur 4 jours, 71 papillons et 110 touches. Notez que la variable à expliquer analysée par le modèle n’est le nombre de touches/papillon/120minutes (voir Matériel et Méthodes)
Le modèle linéaire confirme l’importance de ces deux facteurs et démontre en outre l’importance de l’ensoleillement. La procédure de simplification du modèle nous a conduits à retirer l’interaction de second ordre entre les trois effets fixes ainsi que l’interaction de premier ordre entre le niveau d’ensoleillement et le support (fleur ou coton). La fluorescence (absente ou présente ; β=-1.35 ; P<0.001), le support (β=0.93 ; P<0.001) et le niveau d’ensoleillement (ensoleillé ou nuageux ; β=-4.03 ; P<0.001) sont tous les trois significatifs en effet simple (Tableau 2). Ces résultats peuvent dans l’ensemble s’interpréter ainsi : le papillon H. hanno est attiré préférentiellement par les cibles fluorescentes, qui ressemblent à des fleurs, et ce lorsque le temps est nuageux. Fait intéressant, nous observons également un effet significatif de l’interaction entre la fluorescence et le support (β=0.61 ; P=0.007) et entre la fluorescence et l’ensoleillement (β=0.61 ; P=0.007 ; Tableau 2). D’après les figures 16 et 17, il apparait que l’effet significatif de l’interaction provient essentiellement du fait que le nombre de touches sur les cibles non fluorescentes est proportionnellement élevé uniquement par temps gris (alors que le nombre touches sur cibles non fluorescentes est proportionnellement élevé par temps ensoleillé tout comme par temps gris).
21
b-
d-
Figure 17 : Répartition des touches/papillons/minutes en fonction du type de cible parmi 2 choix : cible « fleurs de M. pudica fluorescente » ou « fleurs de M. pudica non fluorescente » (a et b) et cible « coton fluorescent » ou « coton non fluorescent » (c et d). a- résultats les jours ensoleillés. Réalisé sur 7 jours, 139 papillons et 111 touches. b- résultats les jours non ensoleillés. Réalisé sur 4 jours, 71 papillons et 89 touches. c- résultats les jours ensoleillés. Réaliser sur 7 jours, 139 papillons et 42 touches. d- résultats les jours non ensoleillés. Réalisé sur 4 jours, 71 papillons et 27 touches.
La seconde série de tests porte sur le choix entre les inflorescences de M. pudica et celles d’une autre Mimosaceae, M. pigra, très proche morphologiquement mais dont les anthères ne sont pas fluorescentes. Notons qu’en milieu naturel ni les larves et ni les adultes de Hemiargus hanno sont observés sur les fleurs de M. pigra. Dans un premier temps le test consiste à mesurer la répartition des touches pour ces deux cibles. Rappelons que pour cette première phase du test N°2 les fleurs ne sont pas manipulées et aucune anthère n’est retirée ni ajoutée.
Figure 18 : répartition des touches en fonction du type de cible choisit parmi 2 choix : « cibles 1 fleur de M. pudica » et «cibles 2 fleurs de M. pigra ». Réalisé sur 5 journées, 97 papillons, et 160 touches. On observe ici un nombre de visites significativement plus important des cibles « fleurs de M. pudica », qui ont les anthères fluorescentes, que sur M. pigra.
Dans un second temps, des anthères fluorescentes sont ajoutées sur M. pigra.
Malheureusement, les conditions météorologiques et les problèmes de cycle des plantes ne permettant pas de réaliser des tests réguliers. Les résultats de cette expérience ne sont pas encore obtenus. Cependant il semble se dégager des premières observations une augmentation
22 de la fréquentation des cibles M. pigra une fois que des anthères fluorescentes y ont été ajoutées.
Phytochimie
3- Rendements d’extraction
Les rendements d’extraction des anthères retirées des fleurs séchées à l’air ambiant sans précaution particulière et ceux obtenus à partir d’anthères fraiches (non séchées), sont respectivement de 20.84% (2.47 g) et 12.20% (1.17 g) à partir des masses initiales de 11.85 g et 9.75 g.
4- Purification
La purification sur colonne de silice nous permet de séparer deux bandes distinctes fluorescentes. La première bande est éluée rapidement et possède une fluorescence rouge (fraction 1). La seconde fraction, éluée plus tardivement, présente une fluorescence jaune (fraction 2) (figure 19).
Figure 19 : Séparation des molécules sur colonnes de silice. Suivit de l’élution sous lumière ultra-violette.
23 Les rendements de purification de la fraction 2 issus de l’extraction des anthères séchées sans précaution particulière et ceux issus de l’extraction des anthères fraîches sont de 3.76% (0.093 g) et de 7.38% (0.086 g) respectivement.
5- Hydrolyse
Il est suspecté d’après les premiers spectres RMN que les molécules fluorescentes des extraits soient des flavonoïdes glycosylés. Nous avons donc effectué une réactions de rupture des liaisons glycosyliques en hydrolyse acide afin d’obtenir les aglycones. Ces derniers sont plus facilement purifiés que les hétérosides correspondants. Une partie de la fraction fluorescente est donc introduite dans une solution de MeOH/HCl à reflux pendant 3 h. Après extraction à l’acétate d’éthyle la phase organique contenant les aglycones et la phase aqueuse contenant les glycosides ne sont pas fluorescents. Les extraits secs issus de ces phases dissouts dans le méthanol ne présentent pas non plus de fluorescence.
Il est possible que plusieurs formes coexistent en solution après le traitement acide et qu’une seule forme soit fluorescente. Nous avons décidé d’effectuer un test pH métrique afin de favoriser le déplacement de l’équilibre vers l’une de ces formes fluorescences.
Figure 20 : Fluorescence de la solution avant hydrolyse acide (en haut), et après (en bas) à différents pH. La gamme de pH va de 1 (à gauche) à 13(à droite).
La faction 2 de l’extrait purifié sur colonne diluée un mélange méthanol/eau possède un pH de 7. Cependant cette mesure n’est pas précise car aucune correction n’a été faite et l’incertitude
24 de la lecture colorimétrique du papier pH est grande. Néanmoins à ce pH approximatif la solution est fluorescence (jaune/verte) et ce jusqu’à un pH de 1. En pH basique une fluorescence intense jaune est observée autour de pH 8. La solution reste fluorescente en milieu basique cependant l’intensité est moins importante et la couleur observée, d’intensité faible, est verte bleutée sous un rayonnement UV. Les solutions contenant le brut issu de l’hydrolyse en milieu acide ne possède aucune caractéristique de fluorescence quel que soit le pH (figure 20).
6- CCM
La fraction 1 (fluorescence rouge) montre une migration identique à celle obtenue dans le cas d’un extrait méthanolique de graminée composé de chlorophylle (figure 21). Cette fraction est donc composée majoritairement de molécules de la famille des chlorophylles. La présence d’une couleur verte à la lumière naturelle confirme cette identification.
Figure 21 : migration de la fraction 1 (à gauche) et de l’extrait méthanolique de graminée (à droite).
Après optimisation le mélange de solvant acétate d’éthyle/méthanol/eau (77:13:10) donne une séparation optimale. Il est maintenant possible de distinguer en CCM deux tâches fluorescentes distinctes à partir de la tache fluorescente initiale que ce soit à partir de l’extrait brut ou à partir de la fraction 2 (Figure 22). Le(s) produit(s) (m1=3 mg et m2=3,5 mg)
contenu(s) dans les deux bandes de silice de 3 plaques CCM différentes sont analysées par RMN.
25 Figure 22 : migration de la fraction 2 sur CCM préparative. Séparation en deux bandes.
7- RMN
Les extraits fluorescents obtenus après une première purification sur colonne chromatographique sont introduits dans un appareil HPLC (High Performance Liquid Chromatography) dans les laboratoires de recherche et de développement de Pierre Fabre. Cette appareil analytique permet de séparer les molécules de polarité différentes à partir d’un mélange complexe. Les molécules ainsi purifiées sont ensuite analysées en RMN. La RMN est une analyse spectrométrique basée le signal intrinsèque des spins des atomes (hydrogène, carbone, phosphore, azote etc.) dans une population donnée de molécules. L’information obtenue permet de connaître précisément l’environnement chimique de chaque atome et de reconstituer la structure moléculaire. Dans le cas d’un mélange de molécules les informations sont complexes et elles ne permettent pas d’identifier la structure de chacune des structures présentes dans l’échantillon. Une première fraction fluorescente est composée d’un mélange de deux flavonols glycosylés (annexe 3). Une seconde purification HPLC consécutive a permis de séparer ces deux molécules. L’une d’entre elle est fluorescente. Il s’agit de l’isorhamnetine 5-O-β-D-glucopyranoside (figure 23). Les déplacements chimiques
caractéristiques des protons aromatiques (séquence 1H) ainsi que les couplages proton-carbone (séquence HSQC) correspondent aux données de la littérature (Kajjout, 2011).
26 Figure 23 : Structure et spectre 1H de l’isorhamnetine 5-O-β-D-glucopyranoside, molécule responsable de la fluorescence des anthères de M. pudica.
Les spectres 1H (annexes 4) du deuxième flavonol non fluorescent correspondent aux données de la littérature (Kajjout, 2011) de l’isorhamnetine 3-O-β-D-glucopyranoside:
Figure 24 : Structure de l’isorhamnetine 3-O-β-D-glucopyranoside, molécule non fluorescente.
L’analyse des masses moléculaires (spectre de masse) confirment les analyses structurales : M = 478 g.mol-1 (annexes 5). Notons qu’un deuxième produit fluorescent en trop faible quantité n’a pu être identifié par RMN au sein des laboratoire de recherche et développement des laboratoire Pierre Fabre.
Les spectres 1H obtenus en Guyane issus des extraits deux bandes fluorescentes de la CCM préparative sont plus difficilement interprétables. En effet la purification sur plaque CCM
27 possède une résolution de séparation plus faible qu’une purification effectuée sur colonne HPLC. Néanmoins le spectre 1H de la première bande présente les déplacements chimiques caractéristiques des protons aromatiques de l’isorhamnetine 5-O-β-D-glucopyranoside. La pureté estimée est inférieure à 40 %. La faible quantité de produits ne permet pas d’envisager une nouvelle purification.
Figure 25 : spectre 1H de l’sorhamnetine 5-O-β-D-glucopyranoside après purification par CCM préparative
Les spectres 1H de la seconde bande ne sont pas interprétables en raison de signaux trop faibles de plusieurs produits en petites quantités. Le produit de cette deuxième bande semble corresponde au produit non identifié par Christophe Long des Laboratoires Pierre Fabre.
Photophysique
8- Préparation des anthères.
Figure 26 : De gauche à droite : anthères hydrolysées, anthères partiellement hydrolysées, anthères sans traitements. En haut, sous lampe UV, en bas, sous lumière du jour.
28 Le séchage des anthères modifie de manière importante leur fluorescence. Ainsi il est possible d’obtenir un gradient de fluorescence en fonction des conditions expérimentales. Le chauffage à 80°C en présence d’eau pendant 1 heure inhibe totalement la fluorescence. A température ambiante pendant 24 heures et en présence d’eau, les anthères deviennent partiellement fluorescentes. Enfin le séchage sous atmosphère sèche (séchoir) permet de conserver la fluorescence initiale. A la lumière naturelle le gradient de couleur entre les anthères ayant subies différents traitements semble nettement moins marqué. Les analyses d’absorption confirment ces observations visuelles et aucune différence significative des courbes d’absorption des échantillons ayant subi les différents types de séchage n’est détectée.
Figure 27 : Analyses d’absorption des anthères avec traitement et sans traitement.
9- Spectres d’émissions
Les spectres d’émission ont été obtenus selon les techniques énoncées dans la partie matériel et méthode.
F = 0,3-0,4%
Figure 28 : Spectres des anthères sèches, mesures en mode « sphère d’intégration », et rendement quantique mesuré.
29 Le spectre d’émission des anthères sèches est calculé selon la méthode de sphère d’intégration. Le spectre est composé de deux principaux pics d’émission, le premier d’intensité moyenne autour de 480 nm, et le second de plus forte intensité autour de 550 nm. Une faible émission vers 670 nm est également observée. Le rendement quantique mesuré des anthères sèches est compris entre 0,3 et 0,4%.
F = 1,23%
Figure 29 : Spectre dans le méthanol de l’extrait purifié sur colonne chromatographique et rendement quantique mesuré.
Le spectre d’émission dans le méthanol de l’extrait des anthères purifié sur colonne chromatographique est composé des deux émissions principales, la première à 480 nm et la seconde à 550 nm. Notons qu’une pollution au sein de la sphère d’intégration est responsable de l’émission parasite à 390 nm. Le profil est très proche à celui des anthères sèches, seule l’absence de l’émission à 670 nm différencie les deux spectres d’émission. Le rendement quantique mesuré de l’extrait des anthères est de 1,23% dans le méthanol.
F = 5%
30 Le spectre d’émission dans le méthanol de l’extrait purifié des anthères HPLC est identique au précédent. Cette molécule présente le même spectre d’émission que celui des anthères sèches. Les rendements quantiques augmentent au fur et à mesure de la purification du produit. En effet les anthères ont initialement un rendement quantique proche de 0.3 %, après purification sur gel de silice le rendement est de 1,23%, enfin la molécule pure purifiée par HPLC possède un rendement quantique modéré de 5 %.
IV- DISCUSSION
1- ElevagePlusieurs hypothèses peuvent être avancées pour expliquer les difficultés de l’élevage dans la cage réalisée et située à l’extérieur. Premièrement le vent en bord de mer est suffisamment important pour plaquer les papillons sur la paroi de la cage d’élevage. L’ajout d’une bâche pour réduire l’influence du vent n’a pas permis d’amélioration notable. En conséquence les ailes fragiles du Lycène sont fortement abimées. Une seconde raison possible est la forte salinité de l’air sur le campus de l’Institut Pasteur de la Guyane qui entraine d’importants dépôts de sel sur les parois et augmente la mortalité. Dans ces conditions, il est difficile de maintenir plus de 48 heures un papillon vivant. Notons que l’absence dans la littérature d’exemple d’élevage de lycènes ne nous permet pas d’apporter de solutions à ces problèmes. Une 3ème possibilité pourrait également être une très courte durée de vie de l’individu adulte, étant donné que la littérature ne nous permet pas de connaitre le cycle de vie exact de H. hanno. L’alternative trouvée est la capture quotidienne d’individus pour nos expériences. Cette solution nous a permis de nous affranchir d’un élevage. Chaque jour, des papillons d’endroits distincts et de populations distincts sont utilisés dans les tests de choix. Cette méthode évite également de biaiser les résultats par une éventuelle sélection d’individus possédant une sensibilité visuelle propre à une population. La capture journalière est par conséquent une méthode efficace et reproductible pour se procurer un nombre de papillons suffisant à la réalisation des tests de choix.
2- Test comportementaux
Lorsque toutes les journées de tests sont confondues, quelle que soit l’intensité de la lumière arrivant sur la boite expérimentale (figure 15), notre première série d’expérience nous montre que les individus ont majoritairement choisit les fleurs de M. pudica avec des anthères
31 fluorescentes (48%) plutôt que d’autres types de cible. Le second choix, dans des proportions plus faibles (27%), est celui des fleurs de M. pudica avec anthères non fluorescentes. Ce classement est valable pour tous les jours du test. On remarque alors que les lycènes utilisées semblent pouvoir différencier les cibles de manière significative sur la base de la fluorescence.
Le nombre de touche rapporter au nombre de papillons et de minutes est maximum pour les cibles fleurs fluorescentes. Les jours non ensoleillés, cette valeur ne subit qu’une très faible variation. L’attractivité ne varie donc pas pour les fleurs fluorescentes selon l’ensoleillement. Par contre, pour les fleurs non fluorescentes, l’attractivité est élevée seulement les jours non ensoleillé. L’une des propriétés de la fluorescence est de réémettre de la lumière dans toutes les directions et ceci quel que soit l’orientation du rayonnement incident. C’est probablement pour cette raison que la perception du signal fluorescent est peu influencé par les différences d’ensoleillement, alors que la perception du signal non fluorescent diffère.
La variabilité du rayonnement UV dans les zones équatorial qui atteint la surface de la terre est principalement contrôlée par des changements dans la couverture nuageuse (Anton et al, 2012 ; Calbó et al, 2005 ; Alados-Arboledas et al, 2003). En effet si la quantité de rayons UV est estimée à 10.3 W/m2 au plus haut de l’atmosphère (Anton et al, 2009), les valeurs à la surface du sol diminuent et atteignent un maximum de 0.25 W/m2 pour un ciel non couvert, et entre 30% et 70% de moins lorsque la couverture nuageuse est importante (Martínez-Lozano, 2002; Marín et al, 2005), selon le type de nuages, la profondeur optique et l'angle d'élévation solaire (Anton et al, 2012 ; Calbó et al., 2005). Il est donc logique que la couverture nuageuse influe sur la perception des différents types de cible. Dans leur ensemble, ces résultats appuient fortement notre hypothèse selon laquelle le papillon H. hanno a la capacité de détecter la fluorescence.
Cependant les cibles M. pudica avec anthères fluorescentes réalisent plus de touches que les cibles coton fluorescentes. Pourtant le signal fluorescent du coton et plus puissant que celui des fleurs à anthères. La fluorescence n’est donc pas le seul facteur qui attire H. hanno, et d’autres facteurs sont à prendre en compte telles que l’odeur de la fleur, sa morphologie et sa structure dans l’espace, sa couleur etc. La reconnaissance se fait par un ensemble de critères et non sur un seul. On sait néanmoins que chez les papillons, la vision est très développée et l’aspect d’une fleur pourrait avoir autant d’importance que son odeur pour le choix (Takeuchi et al, 2006 ; Stavenga et al, 2006 ; Frentiu et al, 2007 ; Matsushita et al, 2012). Le signal fluorescent est important que lorsqu’il est associé spécifiquement à la fleur et à ses critères
32 énoncés ci-dessus. H. hanno est donc avant tout attiré par une fleur, et cette attraction est largement accrue lorsque celle-ci présente une fluorescence de ses anthères.
Les expériences réalisées ne nous permettent toujours pas de trancher quant au rôle de la fluorescence, c’est-à-dire de savoir si la fluorescence exprimée est une propriété fortuite de la structure physico-chimique d’une molécule, si elle a un rôle dans la protection des gamètes, ou alors si elle joue un rôle dans la communication. Le fluorophore identifié à une structure de base ubiquiste mais la glycosylation en position 5- est thermodynamiquement très défavorable et il est donc peu probable que l’apparition du mécanisme responsable soit fortuite. La fluorescence a donc vraisemblablement évolué de sorte qu’elle est une fonction précise. Une extension intéressante à cette étude serait d’étudier s’il y a une différence entre les mâles et les femelles de papillon face à la fluorescence, et si oui l’impact de chaque sexe sur la valeur sélective de la plante. En effet les sexes n’ont pas les même raisons d’interagir avec la plantes. Les males ne pondent pas et ont donc une action uniquement bénéfique pour la plante (pollinisation). Les femelles quant à elles sont des pollinisateurs et pondent leurs œufs ; œufs donnant naissance à des larves qui dégradent par la suite fortement la plante en se nourrissant des inflorescences de M. pudica. Du fait de l’interaction double des femelles, celles-ci peuvent être mutualistes ou antagonistes. Si les femelles s’avèrent antagonistes et qu’elles sont les seules à être attirées par la fluorescence, alors pour ce papillon la fluorescence n’est pas un signal, c’est-à-dire un trait ayant évolué à l’origine dans le contexte d’une fonction de communication, mais un indice utilisé pour mieux détecter ou reconnaitre la plante hôte. La fluorescence pourrait très bien alors avoir la protection contre les UV comme fonction première. Par contre si les femelles sont mutualistes et que les mâles tout comme les femelles sont attirées par la fluorescence, la fluorescence pourrait avoir une fonction de signal de communication. Quoi qu’il en soit, la présente étude constitue déjà la première mise en évidence du rôle de la fluorescence comme médiateur d’interactions interspécifiques.
Les résultats de nos tests contredisent la conclusion d’Iriel et Lagorio (2010) selon laquelle la fluorescence des fleurs est trop faible pour jouer un rôle de communication (au sens large selon leur définition, c’est-à-dire incluant la notion d’indice). Tout d’abord, les calcules théoriques de ces auteurs ne prennent pas en compte le fait que des adaptations aient pu évoluer chez les individus récepteurs ; adaptation permettant de maximiser la détection de la fluorescence. Sachant que les photorécepteurs des papillons sont connus pour être phylogénétiquement plastiques (Briscoe et al, 2003), il n’est pas impossible que les photorécepteurs d’H. hanno aient évolué de sorte que leur sensibilité maximale coïncide avec le pic d’émission la fluorescence de M. pudica. La capacité à détecter un signal chromatique