HAL Id: tel-02985183
https://tel.archives-ouvertes.fr/tel-02985183
Submitted on 2 Nov 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Le récepteur Sigma 1 : implication dans la prolifération
et la stéatose des hépatocytes
Laure Villemain Le Hagre
To cite this version:
Laure Villemain Le Hagre. Le récepteur Sigma 1 : implication dans la prolifération et la stéatose des hépatocytes. Organisation et fonctions cellulaires [q-bio.SC]. Université Paris Saclay (COmUE), 2019. Français. �NNT : 2019SACLS370�. �tel-02985183�
Le récepteur Sigma 1 : implication
dans la prolifération et la stéatose
des hépatocytes
Thèse de doctorat de l'Université Paris-Saclay
Préparée à l’Université Paris-Sud
École doctorale n°568 Biosigne
Spécialité de doctorat : aspects moléculaires et cellulaires de la biologieThèse présentée et soutenue à Orsay, le 29 octobre 2019, par
Laure Villemain Le Hagre
Composition du Jury : Pr. Simon Saule
Professeur Universitaire, Institut Curie Orsay (UMR3347/U1021) Président
Dr. Catherine Postic
Directeur de recherche, Institut Cochin (UMR_S1016) Rapporteur
Dr. Franck Borgèse
Directeur de recherche, Université de Nice (UMR7277/U1091) Rapporteur
Dr. Alexandra Motagner
Chargée de recherche, I2MC (UMR 1048) Examinateur
Dr. Benjamin Delprat
Chargé de recherche, MMDN (UMR 1198) Examinateur
Dr. Laurent Combettes
Directeur de Recherche, Université Paris Sud (UMR_S1174) Directeur de thèse
NNT
:
2
0
1
7
S
A
CL
E
0
3
5
1
Remerciements
Je tiens d’abord à remercier le Docteur Catherine Postic et le Docteur Franck Borgèse pour l’intérêt qu’ils ont porté à mon travail en acceptant de le rapporter, pour le temps qu’ils m’ont consacré et leurs remarques constructives et bienveillantes. Je remercie aussi les autres membres de mon jury qui ont accepté d’examiner mes travaux de thèse, Docteur Alexandra Montagner et Docteur Benjamin Delprat ainsi que le Professeur Simon Saule qui me fait l’honneur de présider ce jury.
Je remercie bien sûr le Docteur Laurent Combettes de m’avoir fait confiance en me confiant ce projet Sigma 1. Un sujet complexe et parfois difficile mais passionnant. Merci Laurent de m’avoir fait découvrir le métier de chercheur pendant un peu plus de 3 ans en m’intégrant dans ton équipe. Je sors de cette thèse grandie et enrichie d’une expérience qui, j’en suis sûre, me sera bien utile au cours de ma vie professionnelle.
Je remercie Sylvie Thietry, ma coéquipière dans l’aventure Sigma 1. Merci pour les manips que nous avons faites ensemble, pour celles que tu as faites sans moi et qui m’ont bien rendu service. Merci, enfin, pour ton soutien sans faille durant ces 3 ans et demi.
Un grand merci à Magali Chiral pour sa gentillesse et sa patience au cours de manips difficiles. Merci Magali pour ton accueil et j’espère à bientôt.
Je remercie Raphaël Pineau pour les manips qu’il a fait à Rennes pour l’article ainsi que Fabienne Foufelle et toute son équipe qui m’ont accueillie plusieurs fois aux Cordeliers au cours de ma thèse.
Merci à toute l’unité 1174 qui m’a accueillie pendant ces quelques années avec gentillesse et bonne humeur. Mauricette, merci pour tous ces conseils et explications qui m’ont été bien utiles et toujours faits avec un grand sourire. Je te souhaite une bonne retraite « au vert » bien méritée ! Olivier merci pour ton aide et tes conseils pour les WB et bien sûr pour les séances de sport. A bientôt coach ! Emilie, le PBS 10X est fait pour être dilué et utilisé à 1X mais pas pour la culture, pour la culture on utilise le 1X stérile. A très vite pour un échange de bonnes adresses (ou de goûters) ! Greg c’est avec émotion que je te lègue ma poire dédicacée, fais-en bon usage. En revanche je pars avec mon serre tête ! A tous les autres que je n’oublie pas : Khadi, Latifa, Pascale, Martine, Isabelle D, Thierry, Boris et tous ceux qui on fait partie de cette unité, merci et j’espère à bientôt.
Spéciale dédicace à Isabelle, ma colloc’ de bureau. Merci d’abord de m’avoir accueillie et d’avoir égayée mes journées pendant 2 ans. Je trouve que notre entreprise d’organisation d’évènements marche super bien. Si un jour tu en as marre de la recherche... Ce bureau et nos conversations me manqueront, j’espère que tu trouveras un ou une remplaçante qui aime aussi les Bjorg Fourrés chocolat noir ® (si ce n’est pas le cas méfie-toi c’est louche).
A mes « compagnons de galère », Amine, Camille, Rachida, Nicolas, Tom et Elodie, merci. J’ai été ravie de partager cette aventure avec vous et j’espère que nous aurons l’occasion de nous revoir dans d’autres circonstances. Bon vent à tous, je vous souhaite le meilleur pour la suite de votre vie professionnelle. Elodie, courage, tu vas voir, un jour on arrive au bout !
Je voudrais aussi remercier toute l’équipe de la Cité des Enfants à la Cité des Sciences et de l’Industrie chez qui j’ai effectué une mission doctorale pendant deux et qui m’ont très bien accueillie. Fawzila merci pour ces programmes, pour ces carambars dans ton bureau et ton oreille attentive dans
2 toutes les situations. Cyrielle et Isabelle, mes tutrices de rêve, pour tout ce que j’ai découvert avec vous ! Merci pour Pizzly, Rouages au Moyen âge, les paillettes de welcome to the jungle, le blob, les méduses et j’en passe !! Je ne sais pas si on m’embaucherait pour mes compétences en art plastique... Je garde un excellent souvenir de toutes mes journées passées à la Villette, merci pour cette belle expérience.
Elodie et Pauline, je tiens à vous remercier pour votre soutien et tous les bons moments que nous avons partagés à la cité des sciences et ailleurs. Mention spéciale à la moquette de l’ancien bureau des doctorants de la CDE, rien de plus efficace comme séance de psy. RIP moquette, tu nous manqueras. J’espère que nos soirées Corco et Caratello seront encore nombreuses (je n’en doute pas). Un immense merci pour l’EVJF de folie que vous m’avez offert. Trop fière de toi Dr Bardin, et Elodie c’est quand la thèse du coup ?
Enfin, je remercie mes parents pour leur soutien et leurs encouragements depuis le début de mes études et, bien évidemment, Bertrand pour tout ce qu’il a fait pour ma thèse.
3
Table des matières
Liste des abréviations ... 6
Liste des figures ... 9
Introduction ... 11
I) Le Récepteur Sigma 1 ... 12
1) Généralités (historique et caractéristiques) ... 12
2) Structure ... 16
3) Une protéine chaperonne des MAMs ... 18
a. Les MAMs ... 18
b. Une protéine chaperonne ... 22
4) Les pathologies associées à SigR1 ... 23
a. Dans le SNC ... 23
b. Dans les tissus périphériques ... 25
II) Les partenaires connus de SigR1 impliqués dans les cancers ... 26
1) Les canaux ioniques ... 27
a. A la membrane plasmique ... 27
i. Les canaux voltage dépendants : VGKC, VGNC et VGCC ... 27
ii. Les canaux potassiques dépendants du calcium : SK3 et SK4 ... 29
iii. Canaux chlores dépendants du volume : VRCC ... 29
4
i. Le récepteur IP3 ... 30
ii. Voltage Dependant Anion Channels (VDAC) ... 30
2) Autres partenaires ... 31
a. Intégrine β1 ... 31
b. IRE1 ... 32
III) Généralités sur le foie ... 36
IV) Tumeurs du foie hormonodépendantes : adénomes hépatocellulaires ... 38
1) Caractéristiques et facteurs de risques ... 39
2) Les œstrogènes ... 40 3) HNF1α ... 41 a. Caractéristiques ... 41 b. Les mutations d’HNF1α ... 44
Objectifs de la thèse ... 46
Résultats ... 47
1) Article : Sigma 1 receptor: is overexpressed in hepatocellular adenoma: involvement of ER and HNF1. ... 48
a. Résumé de l’article ... 48
b. Article ... 50
2) Résultats non publiés ... 93
a. La surexpression de SigR1 modifie la signalisation calcique dans l’hépatocyte... 93
b. SigR1 interagit avec apoB100 dans l’hépatocyte ... 99
5
1) Effet des œstrogènes sur l’expression de SigR1 ... 104
2) Effet de la perte de fonction HNF1α sur l’expression de SigR1 ... 106
a. Un effet inhibiteur ... 106
b. HNF1α agit-il directement sur l’expression de SigR1 ? ... 106
3) SigR1 et prolifération ... 111
4) SigR1 et lipides... 113
Conclusion et perspectives ... 116
6
Liste des abréviations
α : alpha β : bêta γ : gamma
ADN : Acide DésoxyriboNucléique AES : Amino-terminal Enhancer of Split AFM : Atomic Force Microscopy ALS : Amyotrophic Lateral Scleoris
AMPC : Adénosine MonoPhosphate cyclique ARNm: Acide RiboNucléique messager ATF6 : Activating Transcription Factor 6 ATP : Adénosine TriPhosphate
AVD : Apoptosis Volume Decrease
BDNF : Brain Derived Neurotrophic Factor BiP : Binding Immunoglobuline Protein Ca2+ : Calcium Cl- : Chlore CANX : Calnexine CYP : Cytochrome DMSO : Diméthylsulfoxyde DR2 : Dopamin Receptor 2
eiF2α : Eukaryotic translation Initiation Factor 2 α ERα : Estrogen Receptor α
ERβ : Estrogen Receptor β
ERK : Extracellular signal-Regulated Kinases FOXA : Forkhead Box A
GFP : Green Fluorescent Protein
GPR30 : G-Protein Coupled Receptor for estrogen 30 GRP78 : Glucose Related Protein
7 HCC : HépatoCellular Carcinoma
hERG : human Ether a-go-go Related Gene HNF1: Hepatocyte Nuclear Factor 1
HNF4 : Hepatocyte Nuclear Factor 4 HRP : Horse Radish Peroxidase
HTRF : Homogeneous Time Resolved Fluorescence
INSIG : Insuline-Induced Gene 1 protein
IP3 : Inositol 1, 4, 5-trisPhosphate
IP3R : Récepteur à l’Inositol 1, 4, 5-trisPhosphate IRE1 : Inositol Requiring Enzyme 1
K+ : potassium KO : Knock-Out
MAM : Mitochondria Associated Membrane MCU : Mitochondrial Ca2+ Uniporter
MEC : Matrice Extra Cellulaire
MODY : Maturity Onset Diabetes of the Young mTOR : mammalian target of rapamycin NASH : Non Alcoholic SteatoHepatitis NHE1 : Na+/H+ Exchanger
NMDA : N-Methyl-D-Aspartate OC1 : One Cut homebox PE : Phosphatidyl Ethanolamine PERK : PKR-like ER Kinase
PGRMC1 : Progesterone Receptor Membrane Component 1 PI3K : Phosphatidylinositol-3 Kinase
PKA : Protéine Kinase A, PKC : Protéine Kinase C
PMCA : Plasma Membrane Calcium ATPase
PPARγ : Peroxisome Proliferator-Activated Receptor γ PTDSS : PhosphaTidylSérine Synthase
8 PSD : PhosphatidylSérine Décarboxylase
PXR : Pregnane-X-Receptor
qPCR : Quantitative Polymerase Chain Reaction RCPG : Récepteur Couplé aux Protéines G RE : Réticulum Endoplasmique
RIDD : Regulated-IRE1 Dependant Decay ROS : Reactive Oxygen Species
SERCA : Sarcoplasmic/Endoplasmic Reticulum Calcium pump SNC : Sytsème Nerveux Central
SigR1 : Sigma Receptor 1 SigR2 : Sigma Receptor 2
siRNA : small interfering RiboNucleic Acid UPR : Unfolded Protein Response
VDAC : Voltage Dependent Anion Channel VGCC : Voltage Gated Ca2+ Channel
VGNC : Voltage Gated Na+ Channel
VGKC : Voltage Gated K+ Channel
VLDL : Very Low Density Lipoprotein VRCC : Volume Regulated Cl- Channel
9
Liste des figures
Figure 1 : Schéma représentant la localisation subcellulaire de SigR1...14
Figure 2 : Localisation cellulaire de SigR1 dans des cellules hépatocytaires surexprimant ou non SigR1...15
Figure 3 : Image obtenue par scanner après injection d’un ligand radioactif de SigR1...16
Figure 4 : Schéma représentant SigR1 avec deux domaines transmembranaires...17
Figure 5 : Schéma proposé après la cristallographie de SigR1...18
Figure 6 : Schéma de la signalisation calcique dans les MAMs...19
Figure 7 : Synthèse de novo des phospholipides et stéroïdogenèse dans les MAMs...21
Figure 8 : Schéma récapitulatif des partenaires de SigR1 impliqués dans les cancers à la membrane plasmique...33
Figure 9 : Schéma récapitulatif des partenaires de SigR1 impliqués dans les cancers dans les MAMs...34
Figure 10 : Voie UPR en réponse au stress du RE...35
Figure 11 : Schéma représentant la circulation sanguine hépatique...36
Figure 12 : Schéma représentant les 5 domaines d’un récepteur nucléaire...41
Figure 13 : schéma résumant le réseau de régulation de HNF dans le foie au stade embryonnaire et chez l’adulte...42
Figure 14 : Schéma représentant la structure du gène HNF1α...44
Figure 15 : La surexpression de SigR1 entraine une augmentation de la [Ca2+]i de base dans les HepG2...94
Figure 16 : SigR1 co-précipite avec la SERCA2b dans les Clones 9...95
Figure 17 : SigR1 et la SERCA2b interagissent in vivo...96
Figure 18 : Schéma représentant les interactions entre SigR1 et la signalisation calcique dans l’hépatocyte...97
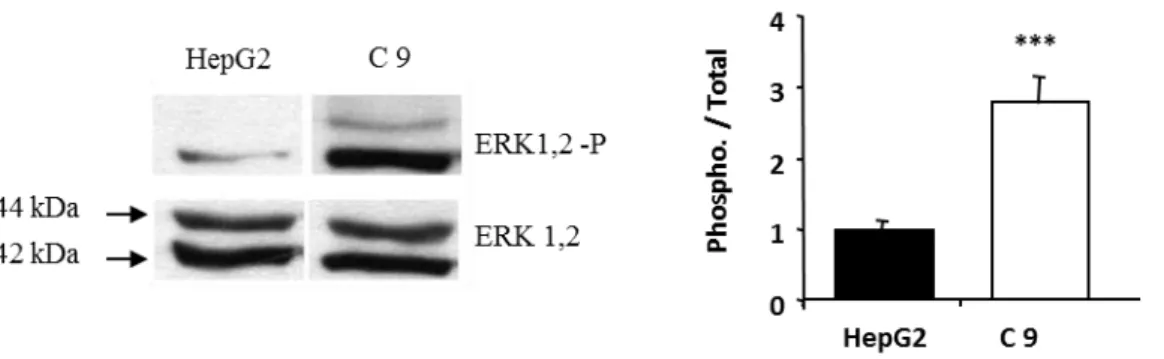
Figure 19 : Activation constitutive de la voie ERK dans les Clones 9...98
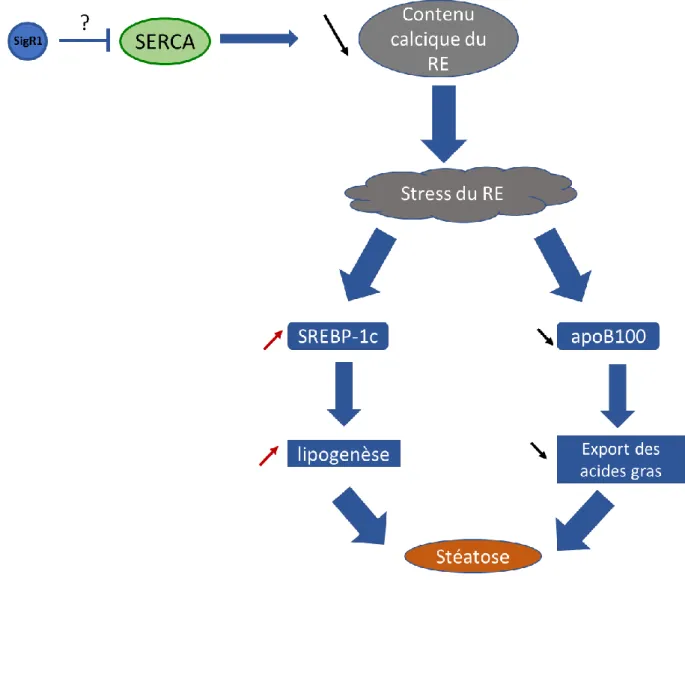
10 Figure 21 : Corrélation inverse entre l’expression de SigR1 et l’expression et la sécrétion d’apoB100...102 Figure 22 : Schéma représentant la signalisation des œstrogènes dans l’hépatocyte...105 Figure 23 : Schéma représentant l’hypothèse selon laquelle les effets d’HNF1α sont indirects en augmentant l’œstradiol actif dans l’hépatocyte...108 Figure 24 : Schéma représentant l’hypothèse selon laquelle PPARγ serait l’intermédiaire entre HNF1α et SigR1...110 Figure 25 : Expression de l’ARNm de SigR1 dans les HCA et les HCC...113 Figure 26 : Le stress du RE induit une stéatose...115
11
12
I)
Le Récepteur Sigma 1
1) Généralités (historique et caractéristiques)
Le récepteur Sigma est décrit pour la première fois en 1976 comme l’un des trois types de récepteurs aux opioïdes, µ, κ et σ (Martin et al. 1976). Martin propose trois types de récepteurs capables de fixer la morphine et ses analogues structuraux pour induire des effets différents. Les récepteurs aux opioïdes σ, en fixant le SKF-10047 (N-normetazocine) induiraient des effets psychotomimétiques, c’est-à-dire qui simulent et provoquent des manifestations psychotiques. C’est en 1982 que Su le décrit comme un type propre de récepteur (Su et al. 1982) et identifie deux sous types : le récepteur Sigma 1 (SigR1) et le récepteur Sigma 2 (SigR2). En effet, il met en évidence que le récepteur sigma n’a aucune affinité pour le Naloxone, antagoniste des opioïdes, suggérant qu’il s’agit d’un autre type de récepteur. Le récepteur sigma a la capacité de fixer un certain nombre de ligands tels que les benzomorphans, l’halopéridol, la fluovoxamine, le propranolol mais aussi les neurostéroïdes tels que la progestérone et la testostérone (Su et al. 2003 ; Monnet et al. 2006). Les neurostéroïdes auraient une affinité plus forte pour SigR1 que pour SigR2. Il est intéressant de noter qu’à ce jour, il n’existe pas de consensus pour une notion d’agoniste ou d’antagoniste de SigR1, ce dernier ne remplissant pas les caractéristiques habituelles d’un récepteur. SigR1 et SigR2 présentent une distribution différente dans les tissus et notamment dans le cerveau mais encore très peu de recherches ont été faites sur SigR2. La nature même de SigR2 est encore discutée. Il existe une hypothèse selon laquelle SigR2 ferait partie du complexe PGRMC1 (Progesterone Receptor Membrane component 1). PGRMC1, récepteur de la progestérone, est surexprimé dans de nombreux cancers et régule la prolifération (Xu et al., 2011). Xu démontre son hypothèse en utilisant des ligands spécifiques de SigR2. En 2015, en utilisant la méthode de CRISPR/Cas 9, SigR2 est décrit comme une protéine distincte de PGRMC1 (Chu et al., 2015). Il n’existe aujourd’hui aucun consensus sur la nature de SigR2. Cette thèse portera sur SigR1.
13 SigR1 a été cloné pour la première fois en 1996 (Hanner et al., 1996) à partir de foie de cochon d’Inde puis en utilisant des tissus de rats, de souris et des tissus humains (Kekuda et al., 1996 ; Pan et al. 1998). La séquence de SigR1 est hautement conservée au sein des espèces et entre les différents tissus de l’organisme. Elle ne présente aucune homologie avec des protéines connues si ce n’est environ 30% avec la C8-C7 isomérase de levure, mais SigR1 n’a cependant pas d’activité enzymatique connue (Hanner et al., 1996). Le gène de SigR1 nommé SIGMAR1 (anciennement OPRS1) se trouve sur le chromosome 9 humain et 2 murin et contient 4 exons et 3 introns (Prasad et al. 1998). Il compte 223 acides aminés avec trois sections hydrophobes et une séquence de rétention dans le réticulum endoplasmique (RE) en N-terminale (Hanner et al., 1996). Hanner propose dans son étude un modèle avec un seul domaine transmembranaire et deux courtes séquences hydrophobes en C-terminal. Ces séquences hydrophobes seraient impliquées dans la liaison aux ligands. En 2002, Aydar analyse à nouveau la séquence par bio-informatique et propose 2 domaines transmembranaires (Aydar et al., 2002). Dans la cellule, SigR1 est majoritairement une protéine ancrée dans la membrane du RE au niveau des MAMs (mitochondria associated membrane) (Fig. 1 et 2). Il a aussi été montré que SigR1 à la suite notamment de traitements pharmacologiques ou de stress cellulaire, pouvait se transloquer à la membrane plasmique pour y interagir avec des protéines (Su et al., 2010 ; Chu et al., 2016). SigR1 a aussi été observé dans la membrane nucléaire (Mavlyutov et al., 2015). A l’état physiologique, SigR1 forme un complexe avec la protéine chaperonne BiP (Binding Immunoglobuline Protein), aussi connue sous le nom de GRP78 (glucose regulated protein 78) (Ortega-Roldan et al., 2013). BiP est une protéine chaperonne, exprimée de façon constitutive par la membrane du RE, impliquée dans le repliement, la translocation et l’assemblage des protéines. Plusieurs stimuli peuvent engendrer la dissociation du complexe SigR1/BiP tels que la diminution de la concentration en Ca2+ du RE ou la fixation de ligands
14 Figure 1. Schéma représentant la localisation subcellulaire de SigR1. SigR1 qui interagit avec la protéine BIP, réside dans la membrane du RE, et serait enrichi au niveau des MAMs. SigR1 a aussi été observé à la membrane plasmique et dans la membrane du noyau après stimulation par un stress du RE ou la fixation d’un ligand.
15 Dans l’organisme SigR1 est ubiquitaire mais particulièrement exprimé dans le foie et le système nerveux central (Fig. 3). Dans le système nerveux central (SNC), SigR1 est exprimé dans les neurones, les oligodendrocytes, les cellules épendymaires et les cellules de Schwan (Alonso et al., 2000 ; Hayashi and Su, 2004).
Bien que le foie soit l’organe qui l’exprime le plus, son rôle dans cet organe est inconnu.
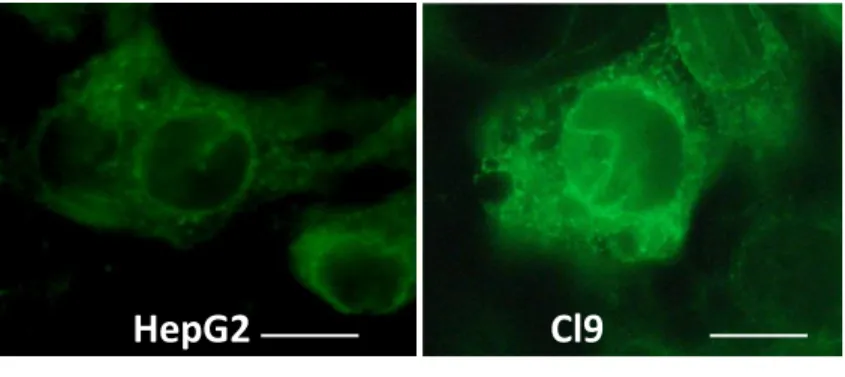
Figure 2. Localisation cellulaire de SigR1 dans des cellules hépatocytaires surexprimant ou non SigR1. (Haut) Microscopie optique sur des cellules HepG2 et HepG2-Clone 9 (surexpression de SigR1 taggé c-Myc) après marquage avec un anticorps anti SigR1 (HepG2) ou anti c-Myc (Clone 9). (Bas) Microscopie confocale sur des Clone 9 après un marquage anti c-Myc ou anti Calnexine (CANX), marqueur du RE. On observe un marquage de SigR1 qui correspond à la localisation du RE. Ce marquage est plus intense lorsque SigR1 est surexprimé.
HepG2
Cl9
16
2) Structure
La structure de SigR1 est aujourd’hui encore discutée. Les avis divergent sur la position des domaines N et C terminaux. Sont-ils orientés vers le cytosol ou vers la lumière du RE ? De même, SigR1 possède-t-il un ou deux domaines transmembranaires ?
En 2002, en se basant sur l’accessibilité des anticorps, Aydar décrit les domaines N et C terminaux orientés vers le cytosol (Aydar et al., 2002), proposant une structure avec deux domaines transmembranaires (Fig. 4) Dans cette étude des ovocytes de xénopes sont transfectés avec une construction de SigR1 exprimant la GFP sur ses extrémités N et C terminales. Des anticorps anti-GFP montrent dans les 2 cas un marquage cytosolique. En 2007 ces domaines sont décrits au contraire comme Figure 3. Image obtenue par scanner après injection d’un ligand radioactif de SigR1. On observe un signal plus intense dans les zones correspondant au cerveau et au foie. Stone et al., 2006
17 étant orientés vers la lumière du RE (Hayahis and Su, 2007). En 2016 la cristallographie de SigR1 propose une organisation trimérique avec un seul domaine transmembranaire dans chaque protomère (Fig. 5). Les trois protomères formeraient une sorte de triangle sur lequel se fixeraient les ligands de SigR1, dans le cytosol (Schmidt et al., 2016). En 2018 la technique de marquage APEX2 confirme un seul domaine transmembranaire mais observe les extrémités N et C terminales dans le sens inverse de celui obtenu par la cristallographie (Mavlyutov et al., 2018). En parallèle, un modèle d’homologie 3D est proposé avec deux domaines transmembranaires et les deux extrémités vers le cytosol (Laurini et al., 2017). Il n’existe donc aujourd’hui aucun consensus pour la structure de SigR1, on pourrait suggérer une structure dynamique de la protéine dépendant de sa localisation dans la cellule, son état lié/non lié à un ligand ou encore dépendant du type cellulaire étudié.
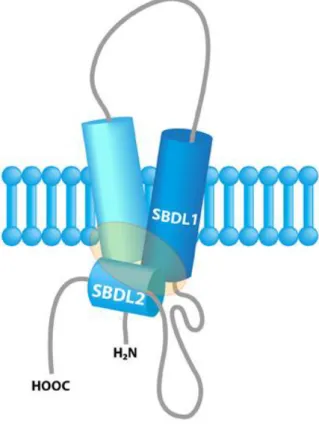
Figure 4. Schéma représentant SigR1 avec deux domaines transmembranaires. SBDL : steroid binding domain like. Crottès et al., 2013
18
3) Une protéine chaperonne des MAMs
a. Les MAMs
Les interactions inter-organelles sont indispensables au bon fonctionnement de la cellule et notamment les interactions physiques. Les MAMs définissent la zone d’interaction physique entre le RE et la mitochondrie. Décrites pour la première fois dans les années 1990, elles sont constituées de morceaux de membrane du RE et de membrane externe de la mitochondrie (Soltys and Gupta, 1992 ; Wieckowski et al., 2009). La distance entre ces deux membranes a été estimée entre 10 et 25 nm ce qui permettrait une interaction directe entre les protéines du RE et les lipides et protéines de la membrane externe de la mitochondrie (Csordás et al., 2006). Bien que cette interaction soit indépendante de l’intégrité du cytosquelette (Soltys and Gupta, 1992), elle est sensible au Ca2+ (Wang et al., 2000 ;
Csordás et al., 2006). En effet, en fonction de la concentration cytosolique en Ca2+, la distance
RE/mitochondrie évoluerait de façon à adapter la signalisation inter-organelle (Csordás et al., 2006). Figure 5. Schéma proposé après la cristallographie de SigR1. SigR1 serait sous forme de trimère, avec un domaine transmembranaire par protomère. Schmidt et al. 2016
19 Les MAMs sont le siège de plusieurs fonctions cellulaires essentielles dont la signalisation calcique et le transport des lipides. (Vance, 2003; Hajnoczky et al., 2003; Rizzuto et al., 2004; Voelker, 2005; Raturi and Simmen, 2013).
La régulation du Ca2+ mitochondrial est indispensable à la production d’ATP par la mitochondrie. En
effet, trois enzymes du cycle de Krebs sont calcium dépendantes (Duchen, 1992). La concentration calcique de la mitochondrie est régulée notamment par le récepteur de l’IP3 (IP3R), VDAC (voltage-dependent anion channel) et le complexe MCU (mitochondrial Ca2+ uniporter). IPR3 est une protéine
résidente du RE et qui permet le transfert du Ca2+ du RE vers la mitochondrie (Mendes et al., 2005).
VDAC est une protéine résidente de la membrane externe de la mitochondrie qui régule l’entrée du Ca2+
dans la mitochondrie (Rizzuto et al., 2004) et le complexe MCU protéine de la membrane interne de la mitochondrie qui transporte les ions Ca2+ importés par VDAC, vers la matrice mitochondriale (Marchi
et Pinton, 2014) (Fig. 6).
Figure 6. Schéma de la signalisation calcique dans les MAMs. Le récepteur à l’InsP3, IP3 est un canal calcique du RE qui fait sortir le Ca2+ du RE vers le cytosol. La Ca2+ est capté par VDAC, canal
20 Les MAMs ont aussi un rôle important dans la synthèse et le transport des lipides entre la mitochondrie et le RE dans la mesure où l’on y retrouve en grand quantité les enzymes de la lipogenèse. Par exemple, l’intégrité des MAMs est indispensable à la synthèse de novo des phospholipides car l’enzyme phosphatidylsérine synthase (PTDSS), permettant la synthèse de phosphatidylsérine à partir de sérine, réside exclusivement dans les MAMs. La phosphatidylsérine (PS) doit ensuite être transportée vers la mitochondrie pour la synthèse de phosphatidyléthanolamine (PE) par la phosphatidylsérine décarboxylase (PSD) qui, elle, réside dans la mitochondrie (Voelker et al., 1989 b). Les MAMs sont aussi indispensables à la stéroïdogenèse. En effet, le cholestérol, une fois synthétisé par le RE est transporté dans la mitochondrie pour former la prégnénolone, première étape de la stéroïdogenèse à partir de cholestérol. La prégnénolone est ensuite transportée vers le RE pour la suite de la stéroïdogenèse (Baulieu et al., 2001) (Fig. 7). Ces voies métaboliques empruntent un système de transport non vésiculaire (Voelker et al., 1989 a) mais calcium dépendant (Hayashi et al., 2009), ce qui démontre l’intérêt de cette zone d’interaction que ce sont les MAMs.
21 Figure 7. Synthèse de novo des phospholipides et stéroïdogenèse dans les MAMs. Synthèse de novo des phospholipides : la sérine est transformée en phosphatidylsérine (PS) par la phosphatidylsérine synthase (PTDSS), enzyme du RE enrichie dans la MAMs. La PS est ensuite transportée dans la mitochondrie pour être transformée par la phosphatidylsérine décarboxylase (PSD) en phosphatidyléthanolamine (PE). Stéroïdogenèse : le cholestérol (C), synthétisé dans les RE est transporté dans la mitochondrie pour être transformé en prégnénolone (Pr). La prégnénolone est transportée dans le RE pour la suite de la stéroïdogenèse.
22
b. Une protéine chaperonne
Bien que son mécanisme d’action soit encore mal connu, SigR1 apparait comme une protéine chaperonne du RE (Hayashi and Su, 2007 ; Hayashi et al., 2009). Le RE, en plus de son rôle dans l’homéostasie calcique est impliqué dans le bon repliement des protéines néosynthétisées par la cellule. Pour ce faire, les protéines sont aidées par des protéines résidentes du RE dites chaperonnes telles que BiP (GRP78), la calréticuline et la calnexine (Hendershot, 2004). En cas de stress du RE, l’activation de la voie UPR (décrite p27) induit une augmentation de leur expression afin de lutter contre le mauvais repliement des protéines (Schroder and Kaufman, 2005). Les protéines chaperonnes participent aussi au maintien des concentrations calciques dans la cellule comme c’est le cas de SigR1(Hayashi et al., 2009). En effet, après avoir été activé par l’IP3, le récepteur de l’IP3 (IP3R) est ubiquitiné et dégradé par le protéasome (Bhanumathy et al., 2006). La modification de la concentration calcique dans le RE induit la dissociation du complexe BiP/SigR1 et ce dernier pourrait agir comme chaperonne (Hayashi et al., 2009). SigR1 peut alors s’associer à l’IP3R et stabiliser son expression dans les MAMs. Dans leur article, Hayashi et al., montrent dans des cellules CHO que, contrairement aux autres protéines chaperonnes connues, SigR1 ne chaperonne pas les IP3Rs néosynthétisés mais maintiendrait les IP3Rs déjà actifs dans les MAMs (Hayashi et al., 2009). SigR1 serait donc une chaperonne avec un mécanisme d’action différent de celui des chaperonnes décrites jusqu’ici.
En 2016, Su va encore plus loin et décrit SigR1 comme un nouveau type de protéine (Su et al., 2016). SigR1 serait un modulateur pluripotent des organismes vivants, un carrefour entre les grandes voies de signalisation. Cette théorie s’appuie sur le grand nombre de protéines que SigR1 serait capable de fixer et ce, dans différentes parties de la cellule, ainsi que sa structure transmembranaire qui diffère des autres chaperonnes.
23
4) Les pathologies associées à SigR1
a. Dans le SNC
La majeure partie des recherches effectuées sur SigR1 concernent le SNC. En effet, SigR1 serait impliqué dans plusieurs maladies affectant cet organe et en particulier les maladies neurodégénératives telles que la sclérose latérale amyotrophique, la maladie d’Alzheimer, la maladie de Huntington et la maladie de Parkinson.
La sclérose latérale amyotrophique (ALS) est une maladie neurodégénérative caractérisée par une paralysie musculaire progressive due à une dégénérescence des motoneurones du cortex moteur primaire, de la voie corticospinale, du tronc cérébral et de la moelle épinière. Cette neurodégénération résulte d’un ensemble d’évènements tels qu’une fonction mitochondriale altérée menant à une baisse de la production d’ATP, une mauvaise régulation des flux calciques et la production d’espèces réactives de l’oxygène (ROS) convergeant vers l’apoptose, mais aussi un stress du RE (Benarroch, 2018). Un cas familial d’ALS juvénile montrant la mutation d’un acide aminé hautement conservé situé dans la partie transmembranaire de SigR1 fut décrite (Al-Saif et al., 2011 ; Mavlyutov et al., 2015 ; Benarroch, 2018). Cette mutation induit une distribution subcellulaire aberrante de SigR1 et une diminution de la résistance à l’apoptose induite par un stress du RE dans les NSC34, modèle cellulaire de motoneurones.
La maladie d’Alzheimer est une autre sorte de dégénérescence nerveuse, caractérisée par une perte de connexion entre les neurones due à une accumulation de protéine βamyloïde à l’extérieur de ces cellules. Cette pathologie entraine une perte de la mémoire et des fonctions cognitives chez le patient. SigR1 est sous exprimé chez ces patients et son inhibition entraine une neurodégénérescence dans les modèles cellulaires (Hedskog et al., 2013). D’autre part, il a été montré que l’intégrité des MAMs et particulièrement de l’interaction SigR1/VDAC/IP3 jouait un rôle important dans la pathologie d’Alzheimer pour maintenir une bonne communication entre le RE et la mitochondrie (Hedskog et al., 2013).
24 La maladie de Huntington, maladie génétique due à une accumulation de la protéine Huntingtin entraine un défaut du transport vésiculaire des neurones. SigR1 pourrait, ici, être une cible thérapeutique du fait de son interaction avec l’un des récepteurs à la dopamine, DR2 (Navarro et al., 2013). La dopamine et ses récepteurs sont directement impliqués dans le développement de la maladie de Huntington. Dans cette pathologie c’est un déséquilibre du taux de dopamine qui est responsable des mouvements incontrôlés observés chez les patients. De plus, SigR1 a une très forte affinité pour la Pridopidine, molécule utilisée dans le traitement de cette maladie, qui elle-même se fixe à DR2 (Sahlholm et al., 2015 ; Navarro et al., 2013). L’ensemble de ces résultats présentent SigR1 comme une acteur potentiel dans le développement et le traitement de cette maladie.
La maladie de Parkinson quant à elle est due à la dégénérescence des neurones dopaminergiques de la substance noire. Dans cette pathologie, il a été montré qu’un traitement avec le PRE-084, considéré comme ayant un effet agoniste sur SigR1 induisait une neuro-restauration dans des modèles expérimentaux. Ces résultats laissent supposer que SigR1 pourrait être une cible thérapeutique dans la maladie de Parkinson (Francardo et al., 2014).
Au-delà des maladies neurodégénératives, SigR1 est impliqué dans les mécanismes de douleur. SigR1 serait un modulateur endogène de la douleur. Il a été montré que l’activation de SigR1 avait un effet atténuateur sur l’analgésie induite par la morphine (Mei et al., 2002 ; Kim est al., 2010). Sont donc développés aujourd’hui des analgésiques combinant morphine et un ligand considéré comme un antagoniste de SigR1 de manière à pouvoir diminuer la dose de morphine tout en obtenant le même niveau d’analgésie.
SigR1 est aussi impliqué dans le phénomène de la dépression par son action stabilisatrice de la maturation post traductionnelle du facteur neurotrophique BDNF (Fujimoto et al., 2012). BDNF est connu pour son action antidépressive en améliorant la communication entre les neurones (Duman et al., 2007).
25 Enfin, SigR1 jouerait un rôle dans l’addiction à la cocaïne via son interaction avec Kv1.2, un canal potassique voltage dépendant. En augmentant cette interaction, la cocaïne augmente la sensibilité du neurone à ses effets (Kourrish et al., 2013).
b. Dans les tissus périphériques
Dans les tissus périphériques, des études de liaison réalisées dans les années 90 ont mis en évidence une surexpression des récepteurs Sigma dans de nombreuses cellules tumorales humaines (John et al., 1995 ; Vilner et al., 1995 ; Aydar et al., 2004). Un anticorps spécifique dirigé contre SigR1 a permis de mettre en évidence une surexpression de SigR1 dans des lignées cellulaires issues de tumeurs humaines du poumon, du sein et de la prostate (Aydar et al., 2006). Il est à noter que le niveau d’expression de SigR1 est lié à l’agressivité de la tumeur, plus SigR1 est surexprimé, plus la tumeur est agressive (Aydar et al., 2006). Dans cette étude, l’utilisation d’un siRNA dirigé contre SigR1 dans une lignée de cancer du sein humain réduit de façon significative la prolifération des cellules suggérant que SigR1 ait un effet pro-tumoral. De plus, la transfection de SigR1 dans des HEK293 réverse l’apoptose induite par Bax ou p53 (Spruce et al., 2004). Cependant, d’autres études suggèrent l’effet inverse de SigR1 sur le processus tumoral, c’est-à-dire un effet anti prolifératif (Maurice and Su, 2009). En 2000, Simony-Lafontaine montre que pour des tumeurs du sein, le niveau d’expression de SigR1 est corrélé à la survie du patient, suggérant, ici encore, un effet anti-tumoral de SigR1 (Simony-Lafontaine et al., 2000). Le mode d’action de SigR1 dans les tumeurs cancéreuses est encore inconnu. La surexpression de SigR1 est-elle une cause ou une conséquence du processus tumoral ? Cette question n’a pas encore de réponse mais il a été montré que SigR1 pouvait interagir avec un certain nombre de partenaires cellulaires eux même déjà connus comme ayant un rôle dans la tumorigenèse (Aydar et al., 2004). SigR1 peut interagir ainsi avec des canaux ioniques dont l’expression est modifiée dans les cellules tumorales tels que les canaux K+, Cl- et Na+ ainsi que le récepteur IP3 (Aydar et al., 2004 ; Crottès et al., 2013). En
26 s’adapter à un nouvel environnement. Les interactions entre SigR1 et ces protéines seront étudiées dans le chapitre suivant.
Dans le cas des tumeurs hormono-dépendantes, tumeurs du sein et de la prostate, l’expression de SigR1 est corrélée respectivement à l’expression du récepteur de la progestérone et au statut androgénique (Simony-Lafontaine et al., 2000 ; Vilner et al., 1995). Dans les tumeurs du sein, SigR1 est étudié comme potentiel marqueur de diagnostic et de pronostic (Simony-Lafontaine et al., 2000), de même pour le cancer de la prostate (John et al., 1998). Ces observations suggèrent un rôle potentiel des hormones dans la surexpression de SigR1.
II) Les partenaires connus de SigR1 impliqués dans les
cancers
L’expression des canaux ioniques dans les cellules tumorales diffère généralement de celle observée dans le tissu sain correspondant (Prevarska et al., 2010). Ceci suggère que ces canaux sont impliqués dans les mécanismes tumoraux et dans l’adaptation de la cellule aux conditions environnementales. En effet, au sein d’un tissu tumoral, les conditions telles que le pH et l’apport en nutriments sont modifiées (Wulf et al., 2009 ; Arcangeli, 2011). Plusieurs études ont mis en évidence une interaction entre SigR1 et certains canaux ioniques (Aydar et al., 2004 ; Crottès et al., 2013). Ces partenaires pourraient expliquer le rôle de SigR1 dans les cancers, décrits plus haut. Les partenaires de SigR1 ont, jusqu’à ce jour, été identifié dans la membrane plasmique, dans les MAMs et dans le RE suggérant une mobilité de SigR1.
27
1) Les canaux ioniques
a. A la membrane plasmique
i.
Les canaux voltage dépendants : VGKC, VGNC et VGCC
Les canaux voltage dépendants, en plus de leur rôle dans les cellules excitables, sont impliqués dans des processus tumoraux. Des études rapportent une implication de ces canaux dans l’apoptose (Lang et al., 2004), la migration (Gillet et al., 2009 ; Becchetti and Archangeli, 2010), l’adhésion à la matrice extra cellulaire (MEC) (Pillozzi and Archangeli, 2010) et l’angiogenèse (Pillozzi et al., 2007). Il existe trois sous types de canaux voltages dépendants : les canaux potassiques, sodiques et calciques.
Les canaux potassiques voltage dépendant (VGKC) participent à de nombreuses fonctions dans la cellule et notamment au potentiel d’action dans les cellules excitables. Il a été montré que les VGKC sont inhibés par certains ligands de SigR1 (Soriani et al., 1998 ; Wilke et al., 1999 ; Kourrich et al., 2012). Cependant, on ne sait pas s’il s’agit d’une interaction directe ou indirecte. Une première étude propose une interaction directe (Wilke et al., 1999) en utilisant la méthode du Inside Out Patch clamp. Une autre étude au contraire suggère une interaction indirecte via une protéine couplée aux protéines G (RCPG). Dans le SNC il a été montré que SigR1 pouvait interagir avec des RCPG (Kim et al., 2010). SigR1 pourrait former des complexes avec les VGKC et les RCPG. C’est d’ailleurs le cas dans le SNC, où SigR1 forme un complexe avec Kv2.1, canal de la famille des VGKC et un RCPG, le récepteur aux opioïdes µ (He et al., 2012). Les ligands SigR1 pourraient alors altérer ces interactions ou moduler l’activité de ces complexes. Au sein des VGKC, le canal hERG est particulièrement intéressant. En effet, cette protéine est utilisée comme marqueur de tumeurs (Pillozzi et al., 2007 ; Arcangeli 2011). Il a été montré qu’en formant un complexe avec la βintégrine, hERG facilite la communication entre la cellule cancéreuse et son microenvironnement. De ce fait, hERG faciliterait le phénomène d’invasion des cellules tumorales (Felipe et al., 2012). SigR1 co-immunoprécipite avec hERG (Crottès et al., 2011) soutenant l’hypothèse selon laquelle SigR1 agirait comme une chaperonne avec ses protéines cibles. De plus, la technique de microscopie de force atomique (AFM) et le transfert d’énergie entre des molécules fluorescentes (HTRF) a montré l’interaction entre SigR1 et hERG (Balasuriya et al., 2014). SigR1
28 favoriserait la maturation de hERG et sa translocation RE-Golgi (Crottès et al., 2011). Enfin il a été montré que l’extinction de SigR1 ou le traitement des cellules par l’igmésine, un ligand de SigR1, diminuait l’adhésion des cellules via le complexe formé par hERG et l’intégrine β (Crottès et al., 2011). Dans cette situation, SigR1 favoriserait donc le processus tumoral en favorisant l’activité de hERG.
Les canaux sodiques voltage dépendant (VGNC) comptent neuf membres et sont impliqués dans la signalisation neuronale, le rythme cardiaque, la contraction musculaire et la sécrétion endocrine (Hille, 1984 ; Harmar et al., 2009). On retrouve une forte expression de ces canaux dans les cellules métastasiques et ils ont été impliqués dans l’invasion tissulaire (Yang et al., 2012 ; Brisson et al., 2011 ; 2012). Il a été montré que SigR1 pouvait moduler les canaux Nav1.2, Nav1.4 et Nav1.5 de la famille des VGNC (Johannessen et al., 2009). Nav1.5 stimule NHE1 (Na+/H+ échangeur) ce qui entraine une acidification de l’espace péri cellulaire entrainant une dégradation de la MEC (Brisson et al., 2011 ; 2012). Nav1.5 est d’ailleurs utilisé comme marqueur de cellule cancéreuse (Yang et al., 2012). Une étude par microscopie de force atomique (AFM) a montré que SigR1 peut lier Nav1.5 via ses domaines transmembranaires (Balasuriya et al.2009). Cependant cette interaction n’est retrouvée que dans un contexte cancéreux, suggérant un rôle de SigR1 uniquement dans un contexte pathologique. SigR1 augmente l’expression de Nav1.5 dans les membranes des cellules de cancers du sein (Gillet et al., 2009) stimulant l’activité de NHE1. Dans cette situation, SigR1 favoriserait donc le processus tumoral en favorisant l’expression de Nav1.5.
Les canaux calciques voltage dépendants (VGCC) sont impliqués dans la transmission synaptique, la contraction des cardiomyocytes et des muscles striés. Les VGCC sont impliqués dans la prolifération et la différenciation de lignées cancéreuses (Becchetti et al., 2011). Il a été montré que SigR1 co-immunoprécipitait avec le L-Type channel, sous type des VGCC, dans une lignée de ganglion rétinal. De plus, le SKF-10047, ligand considéré agoniste de SigR1, inhibe le courant du L-Type channel (Tchedre et al., 2008). Ces premiers résultats suggèrent que les VGCC seraient des clients de SigR1 dans les cellules cancéreuses. L’effet de SigR1 proposé ici serait antitumoral.
29
ii.
Les canaux potassiques dépendants du calcium : SK3 et SK4
Les canaux potassiques dépendants du calcium régulent l’entrée du calcium dans la cellule. Leur interaction avec SigR1 n’a pas encore été démontrée mais ces canaux représentent une cible potentielle de ce dernier dans le cadre du cancer. En effet, il a été montré dans le SNC, que les ligands SigR1 potentialisent les réponses des récepteurs NMDA (N-Méthyl-D-Aspartate) qui, une fois activé par le glutamate, laissent entrer du Ca2+ dans le neurone en inhibant les canaux SK. Les canaux SK sont des
membres de la famille des canaux potassiques dépendants du calcium. Or SK3 joue un rôle important dans le mélanome et le cancer du sein dans lesquels il est surexprimé (Potier et al., 2006 ; Girault et al., 2012), et SK4 est impliqué dans le phénomène de migration des glioblastomes (Ruggieri et al., 2012).
iii.
Canaux chlores dépendants du volume : VRCC
Les canaux chlores dépendants du volume (VRCC) sont fonctionnellement couplés aux canaux potassiques et sont impliqués dans la régulation du volume cellulaire (Hoffman et al., 2009). De ce fait, ils participent à la progression tumorale en agissant sur le cycle cellulaire, la motilité et l’apoptose (Lang et al., 2000 ; Huang et al., 2012). Il a été montré dans des lignées de leucémie et de cancers du sein que les ligands SigR1 inhibaient l’activité des VRCC (Crottès et al., 2013). La diminution de l’activité des VRCC protège les cellules de l’apoptose en retardant l’AVD (apoptosis volume decrease), une des premières étapes de l’apoptose (Bortner et al., 2012). Il a été montré que les cellules surexprimant SigR1 étaient moins sensibles à l’apoptose induite par la staurosporine (Renaudo et al., 2007). En intéragissant avec les VRCC, SigR1 aurait donc un effet pro tumoral.
L’ensemble des partenaires connus de SigR1 impliqués dans les cancers à la membrane plasmique est résumé dans la figure 8.
30
b. Dans les MAMs
i.
Le récepteur IP3
Le récepteur de l’inositol triphosphate (IP3R), est une protéine qui joue le rôle de récepteur et de canal calcique. Il se situe dans la membrane du RE et permet notamment les flux calciques dans les MAMs, du RE vers la mitochondrie. L’homéostasie calcique joue un rôle primordial dans les phénomènes d’apoptose, de survie cellulaire et d’autophagie (Parys et al., 2012 ; Hamadi et al., 2013). Ces phénomènes sont impliqués dans le processus tumoral. En effet, la cellule tumorale a pour caractéristique, entre autres, de détourner certains mécanismes cellulaires à son avantage, comme résister à l’apoptose, favoriser la survie cellulaire et la prolifération (Hanahan et Weinberg, 2000). L’autophagie, par exemple, est un processus de dégradations lysosomales qui permet à la cellule d’éliminer ce qu’elle ne peut pas éliminer par le protéasome telles que des grosses protéines, des macromolécules ou même des organelles entiers (Parys et al., 2012). En situation physiologique ce phénomène hautement régulé permet notamment à la cellule de lutter contre le stress cellulaire. Une dérégulation de l’autophagie a été observé dans de nombreuses cellules cancéreuses (Parys et al., 2012). IP3R est donc un acteur potentiel du processus tumoral. En situation de stress cellulaire, il a été montré que SigR1 se dissociait de BiP et pouvait alors fixer IP3R, prévenant la dégradation d’IP3R. Ce complexe permet alors le transfert du flux calcique RE/mitochondrie (Hayashi and Su 2007). Dans cette situation, SigR1 participe au maintien de la survie cellulaire. La fixation de SigR1 sur l’IP3R induit la dissociation du complexe IP3R/ankyrine augmentant le flux calcique RE/mitochondrie (Hayashi and Su, 2001). En effet, l’ankyrine, est une protéine qui inhibe le flux calcique RE/mitochondrie en fixant IP3R (Bourguignon and Jin, 1995). Dans ce cas encore, SigR1 favorise la survie cellulaire.
ii.
Voltage Dependant Anion Channels (VDAC)
Les canaux anioniques voltage dépendant, VDAC, résident dans la membrane externe de la mitochondrie et forment un complexe avec IP3R qui lui réside dans le RE. Ce complexe a pour rôle de réguler le flux calcique entre le RE et la mitochondrie. Il a été montré que SigR1 pouvait interagir avec VDAC et ainsi moduler le transport du cholestérol dans la mitochondrie (Marriott et al., 2012). En effet,
31 le calcium est indispensable au bon fonctionnement de la mitochondrie. Le transport de cholestérol dans la mitochondrie est la première étape de la synthèse de stéroïdes (voir schéma p. 17). La mitochondrie utilise le cholestérol comme substrat initial. Dans cette étude, l’extinction de SigR1 par siRNA entraine une diminution de 95% de la synthèse de prégnénolone. La prégnénolone est le premier stéroïde de la voie de biosynthèse. Ces résultats suggèrent que SigR1 pourrait être indispensable au maintien de l’intégrité de la fonction des MAMs dans la synthèse des lipides. La modification du métabolisme énergétique de la cellule est une étape de la tumorigenèse pour la cellule qui doit répondre à de nouveaux besoins (Swinnen et al., 2006). L’environnement dans un tissu tumoral est pauvre en nutriments. C’est pourquoi, pour survivre et répondre à sa division accrue la cellule tumorale doit modifier son métabolisme énergétique, on parle de l’effet Warburg (Razungles et al., 2013).
L’ensemble des partenaires de SigR1 impliqués dans les cancers dans les MAMs est résumé dans la figure 9.
2) Autres partenaires
a. Intégrine β1
Les intégrines sont des protéines transmembranaires qui assurent l’adhésion de la cellule à la matrice extracellulaire. Les intégrines sont des hétérodimères composés d’une sous-unité α et d’une sous-unité β. Il a été montré que SigR1 était associé avec l’intégrine β1 dans des cellules de tumeurs du sein (Palmer et al., 2007). Cette association est retrouvée dans les radeaux lipidiques enrichis en cholestérol. Un traitement avec le SKF-10047, considéré comme agoniste de SigR1, inhibe l’interaction de ces deux protéines et entraine une diminution de la densité d’intégrine β1 dans les radeaux lipidiques. De plus, l’extinction de SigR1 par siRNA, diminue l’adhésion des cellules en diminuant la densité d’intégrine β1 des radeaux lipidiques (Palmer et al., 2007). Il est aussi suggéré que SigR1 faciliterait la formation de macro-complexes entre hERG et l’intégrine β1, favorisant la migration et l’angiogenèse
32 des cellules cancéreuses (Crottès et al., 2013). L’ensemble de ces résultats suggèrent un rôle de SigR1 dans le processus tumoral via l’adhésion cellulaire à la matrice (Fig. 6).
b. IRE1
IRE1 (Inositol requiring enzyme 1) est une protéine transmembranaire du RE senseur du stress UPR (unfolded protein response). Le RE a pour rôle de maintenir un environnement propice au bon déroulement de la maturation des protéines. Sous le contrôle de protéines chaperonnes, les protéines subissent des modifications post traductionnelles et acquièrent une conformation correcte. En cas d’accumulation de protéines mal repliées, la réponse UPR est induite (Fig. 8). La réponse UPR est un processus adaptatif qui induit d’une part la diminution de la synthèse protéique et d’autre part l’augmentation de la transcription de protéines chaperonnes ou impliquées dans le processus de dégradation des protéines mal repliées. La réponse UPR compte 3 protéines effectrices : PERK (PKR-like ER kinase), ATF6 (activating transcription factor 6) et IRE1, protéines transmembranaires du RE, associées à BiP à l’état inactif. La dissociation de la protéine BiP entraine leur activation. Après homodimérisation et autophosphorylation, PERK phosphoryle eiF2α (eukaryotic translation initiation factor 2, subunit α) qui entraine une diminution globale de la traduction. IRE1 est activé par autophosphorylation ce qui révèle son activité d’endonucléase. L’action principale d’IRE1 est alors l’épissage de l’ARNm du facteur de transcription XBP1 (X box-binding protein 1) qui, avec ATF6 une fois activé par clivage protéolytique, va induire la transcription de protéines impliquées dans la maturation des protéines chaperonnes ou impliquées dans le processus de dégradation des protéines mal repliées. IRE1 par son activité d’endonucléase permet aussi la dégradation de certains ARNm, il s’agit du mécanisme appelé RIDD (regulated-IRE1 dependent decay). Si la réponse UPR ne suffit pas à rétablir l’homéostasie, elle induit l’apoptose (Flamment et Foufelle, 2013).
De ces trois protéines, IRE1 est la seule résidente dans les MAMs, ce qui en fait un client potentiel de SigR1. Il a été montré que SigR1 pouvait en effet interagir avec IRE1 (Mori et al., 2013) et le stabiliser de façon à favoriser la survie cellulaire. Ces résultats suggèrent donc aussi un rôle de SigR1 dans le phénomène de stress du RE (Fig. 10).
33 Figure 8. Schéma récapitulatif des partenaires connus de SigR1 à la membrane plasmique et impliqués dans les cancers. En interagissant avec ces divers partenaires, SigR1 peut avoir une action pro ou anti tumorale. Les effets pro-tumoraux : SigR1 peut interagir avec la β intégrine et diminuer l’adhésion des cellules à la matrice. De plus SigR1 pourrait favoriser la formation de macro complexes intégrine/hERG pour favoriser la migration des cellules cancéreuses. SigR1 peut interagir avec hERG et les canaux Nav1.5 pour favoriser l’invasion tissulaire par les cellules cancéreuses. Enfin, en inhibant l’activité des VRCC, SigR1 protège la cellule de l’apoptose. Les effets anti-tumoraux : en interagissant avec les VDCC, SigR1 inhibent leurs effets sur la prolifération et la différenciation des cellules cancéreuses. Enfin, SigR1 inhiberait l’activité des canaux SK, impliqués dans la migration des cellules tumorales.
34 Figure 9. Schéma récapitulatif des partenaires connus de SigR1 impliqués dans les cancers dans les MAMs. Après stimulation, SigR1 peut se dissocier de BiP et interagir avec d’autres protéines des MAMs : SigR1 peut se lier à IP3R et stabiliser son expression dans les MAMs, de même avec IRE1 pour favoriser la survie cellulaire. SigR1 peut aussi interagir avec VDAC de façon à faciliter les flux calciques entre le RE et la mitochondrie et donc favoriser la synthèse de lipides.
35 Figure 10. Voie UPR en réponse au stress du RE. En situation de stress du RE, la réponse UPR repose sur l’activation de trois protéines : PERK, ATF6 et IRE1. Ces protéines sont associées à la protéine BiP à l’état physiologique. Une fois activées, donc dissociées de BiP, PERK s’autodimérise et s’autophosphoryle pour phosphoryler eiF2 ce qui entraine une diminution globale de la traduction. IRE1 est aussi autophosphorylé pour libérer son activité d’endonucléase qui permet l’épissage de XBP1. XBP1, associé à ATF6 activé par clivage protéolytique entraine une augmentation de la transcription de protéines chaperonnes et de protéines impliquées dans la dégradation des protéines mal repliées. IRE1 par son activité d’endonucléase entraine aussi la dégradation d’autres ARNm pour diminuer leur traduction, ce mécanisme est appelé RIDD. D’après Flamment et Foufelle, 2013.
36
III) Généralités sur le foie
Le foie est l’organe qui exprime le plus SigR1. Cependant peu de recherche a été effectuée sur le rôle de SigR1 dans cet organe et son rôle y est inconnu. C’est pourquoi nous nous y intéressons. Le foie est l’organe abdominal le plus volumineux de l’organisme (1.5kg en moyenne chez l’adulte) et occupe une place stratégique entre le tube digestif et la circulation sanguine (Fig. 11). Il se situe dans le quadrant supérieur droit de l’abdomen, sous le diaphragme. Il est irrigué à la fois par l’artère hépatique qui lui fournit la majorité de son oxygène et par la veine porte qui, elle, apporte les nutriments depuis l’intestin. D’un point de vue anatomique le foie est divisé en deux parties principales appelées lobe droit qui représente 2/3 du volume du foie et lobe gauche qui en représente 1/3. Le foie est constitué de quatre principaux types cellulaires : les hépatocytes, les cellules endothéliales, les cellules étoilées et les cellules de Kupffer. Ces cellules présentent une organisation spécifique afin de garantir le bon fonctionnement hépatique.
37 Les hépatocytes représentent 60 à 80% de la masse cellulaire du foie, ils sont le siège des fonctions principales du foie telles que le stockage et la transformation du glucose sous forme de glycogène, la synthèse protéique, la synthèse du cholestérol, des sels biliaires et de phospholipides et la détoxification. Ces cellules sont de forme polyédrique (6 à 8 faces) et ont la particularité d’être souvent binucléées. Les cellules endothéliales facilitent les échanges entre le plasma et les hépatocytes grâce à leurs nombreux pores. Les cellules étoilées, quant à elles, stockent la vitamine A et sous certaines conditions peuvent se transformer en myofibroblastes et fabriquer et secréter du collagène, entrainant un phénomène de fibrose. Enfin, les cellules de Kupffer sont des macrophages résidents du foie qui permettent l’élimination des toxines bactériennes.
Les fonctions hépatiques sont nombreuses, parmi lesquelles se trouvent le métabolisme des hydrates de carbone, le métabolisme des lipides, la synthèse de protéine et la sécrétion des acides biliaires. Le métabolisme des hydrates de carbone, ou glucides est une des fonctions principales du foie. Le foie assure l’homéostasie glucidique en stockant les glucides apportés par l’intestin, sous forme de glycogène, il s’agit de la glycogénèse. Le foie peut aussi synthétiser du glycogène à partir de substrats non glucidiques tels que les acides aminés, il s’agit de la néoglucogénèse. Le foie peut ensuite libérer du glucose dans la circulation après stimulation par le glucagon, hormone pancréatique, c’est le phénomène de glycogénolyse. Le foie participe aussi au métabolisme des lipides en réalisant de la lipogenèse, c’est-à-dire la synthèse d’acide gras à partir d’Acétyl-Coenzyme A, de façon à constituer des réserves de lipides. Les acides gras peuvent être estérifiés en triglycérides, ces triglycérides seront liés à du cholestérol et à une apolipoprotéine pour former des lipoprotéines qui seront sécrétées par l’hépatocyte dans la circulation sanguine. L’hépatocyte est aussi le lieu prédominant de synthèse du cholestérol. Le cholestérol est le point de départ de la synthèse de stéroïdes et des acides biliaires. En captant les acides aminés essentiels, non synthétisés par l’organisme, le foie prend part au métabolisme des protéines. Le foie est un centre de synthèse de protéines important, y sont synthétisées la plupart des protéines plasmatiques telles que l’albumine, les globulines et les gammaglobulines. Enfin, un autre rôle essentiel du foie est la production et la sécrétion des acides biliaires. Les acides biliaires sont synthétisés
38 par le foie et sécrétés par les hépatocytes dans la bile. La bile est stockée par la vésicule biliaire et sera libérée dans le duodénum afin de permettre l’absorption des graisses alimentaires par l’intestin.
IV) Tumeurs du foie hormonodépendantes : adénomes
hépatocellulaires
Les tumeurs hépatiques peuvent être malignes ou bénignes. La tumeur hépatique primitive maligne la plus répendue est le carcinome hépatocellulaire (HCC) qui se développe sur un foie malade. Les causes les plus courantes sont les virus des hépatites B et C, l’intoxication alcoolique, et la stéatohépatite non-alcoolique connue sous le nom de NASH. L’obésité et le diabète peuvent aussi entrainer le développement d’un HCC. Ils représentent la 4ème cause de mortalité par cancer dans le monde (Bray et
al., 2018). Les tumeurs hépatiques primitives malignes peuvent aussi atteindre les cholangiocytes, il s’agit alors d’un cholangiocarcinome qui lui se développe souvent dans un foie sain. Ces tumeurs représentent 10 à 15 % des cancers du foie (Bray et al., 2018). Les tumeurs hépatiques bénignes regroupent les hémangiomes, les hyperplasies nodulaires, les adénomes dont nous allons parler et les kystes biliaires. Ces tumeurs se développent le plus souvent dans un foie sain. Comme décrit plus haut, SigR1 est surexprimé dans les tumeurs cancéreuses et en particulier dans les tumeurs hormonodépendantes. Dans l’objectif de comprendre son rôle dans l’hépatocyte, nous nous sommes penchés sur une éventuelle surexpression de SigR1 dans les tumeurs hépatiques. Au sein des différents types de tumeurs hépatiques, nous avons porté notre attention sur les adénomes hépatocellulaires car ils sont fortement associés à la prise de contraceptifs oraux (Nault et al., 2013).
39
1) Caractéristiques et facteurs de risques
Les adénomes hépatocellulaires (HCA) sont des tumeurs hépatiques bénignes rares dérivant d’une prolifération d’hépatocytes matures (Nault et al., 2013). 90% des tumeurs sont observées chez la femme jeune (entre 15 et 45 ans) et leur développement est associé à une prise de contraceptifs oraux. Les HCA représentent 10 à 20% des tumeurs hépatocytaires et ont une incidence de 3 pour 100000 femmes exposées à une forte dose de contraceptif oraux (Edmondson et al., 1976 ; Rooks et al., 1979). Ces tumeurs étaient exceptionnelles jusqu’à l’arrivée des contraceptifs oraux dans les années 1970 (Baum et al., 1973). Les contraceptifs oraux étaient alors fortement concentrés en œstrogènes. Depuis les années 1990, les quantités d’œstrogènes contenues dans les contraceptifs oraux ont baissées mais il n’existe pas encore de données sur les effets de cette baisse vis-à-vis de l’incidence des HCA. La prise d’œstrogène est donc le facteur de risque principal dans l’apparition d’un HCA. D’autres facteurs, moins fréquents, ont été identifiés. Certains cas ont été associés à la prise de stéroïdes androgéniques anabolisants (Sale and Lerner, 1977). Des maladies ont aussi été identifiées comme étant des facteurs de risque dans le développement d’HCA. C’est le cas de maladies métaboliques comme les glycogénoses de type I et de type III (Howell et al., 1976). La glycogénose de type I, ou maladie de von Gierke est une maladie du métabolisme du glycogène qui se traduit par une accumulation du glycogène dans le foie, les reins et l’intestin. Elle est causée par une anomalie de la glucose-6-phosphatase. La glycogénose de type III ou maladie de Cori est, elle, causée par un déficit en amylo-1-6-glucosidase. Le développement d’un HCA est une complication fréquente de ces maladies. Sont répertoriés aussi des cas d’HCA associés à des maladies hépatiques vasculaires (Van Alten SM et al., 2012).
Les HCA sont caractérisés par une prolifération d’hépatocytes et une stéatose marquée dans un foie sain. La stéatose hépatique correspond à une accumulation de triglycérides dans l’hépatocyte. Les nodules peuvent mesurer de 1 à 15 cm de diamètre. S’il y a plus de dix nodules au sein de la tumeur, on parle d’adénomatose hépatique (Flejou et al., 1985).
La classification moléculaire des HCA permet d’identifier six sous-groupes (Nault et al., 2017) répertoriés dans le tableau ci-dessous :
40
Nom Caractéristique Facteurs de risque
H-HCA Mutation inactivatrice du gène HNF1α Œstrogènes, mutation germinale du gène HNF1α bex3 HCA Mutation de l’exon 3 de la βcaténine Non spécifique
bex7,8 HCA Mutation de l’exon 7/8 de la βcaténine Œstrogènes, obésité, alcool et
glycogénose IHCA Activation constitutive de la voie
IL6/JAK/STAT menant à une inflammation
Androgènes, sexe masculin et maladie hépatique vasculaire shHCA Activation constitutive de sonic hedgehog Œstrogènes et obésité
UHCA Non classés Œstrogènes
Les H-HCA, portant une mutation inactivatrice du gène HNF1α représentent 40 à 50% des HCA. Ils forment le groupe le plus important, suivi de près par le groupe de IHCA. Les œstrogènes, quant à eux représentent le facteur de risque le plus important dans le développement d’un HCA.
2) Les œstrogènes
Les œstrogènes sont des hormones de la famille des hormones stéroïdiennes. Les hormones stéroïdiennes sont caractérisées un noyau stéroïde dérivé du cholestérol. Il existe cinq groupes d’hormones stéroïdiennes, les glucocorticoïdes, les minéralocorticoïdes, les androgènes, les œstrogènes et les progestatifs. Les œstrogènes sont produits en majorité par les follicules des ovaires et le placenta mais aussi en quantité moindre, par le foie, les glandes surrénales et le tissu adipeux. Les œstrogènes ont un rôle dans la fonction de reproduction mais aussi dans le développement du SNC, dans l’homéostasie osseuse et du système cardio vasculaire. Les trois formes endogènes des œstrogènes sont l’estradiol, l’estriol et l’estrone qui dérivent toutes trois des androgènes.
Les œstrogènes peuvent agir via trois récepteurs : deux récepteurs nucléaires ERα et ERβ et un récepteur membranaire GPR30. Les récepteurs nucléaires sont composés de cinq domaines : une région N-terminale (A/B) impliquée dans la transactivation, un domaine de liaison à l’ADN (C), un domaine
41 charnière impliqué dans la dimérisation qui contient une séquence de localisation nucléaire (D), un domaine de liaison au ligand (E) et un second domaine de transactivation en C-terminal (F) (Fig. 12). Une fois leur ligand fixé, les récepteurs nucléaires changent de conformation afin de fixer le promoteur de leur gène cible. ERα et ERβ sont considérés comme les récepteurs aux œstrogènes classiques car ils sont les premiers décrits (Jensen and DeSombre, 1973 ; Kuipper et al., 1996). Dans l’hépatocyte, seul ERα est exprimé. Ce n’est que plus tard, après avoir observé des effets non génomiques médiés par les œstrogènes, que GPR30, le récepteur membranaire des œstrogènes a été décrit (Prossnitz et al., 2008). GPR30 est un récepteur couplé aux protéines G, activé par les œstrogènes qui pourrait activer notamment la voie de l’AMPc (Prossnitz et al., 2008). ERα est le récepteur aux œstrogènes le plus exprimé dans l’hépatocyte.
3) HNF1α
a. Caractéristiques
Les facteurs nucléaires hépatocytaires (HNF) comptent 4 familles : • HNF1 (Hepatocyte Nuclear Factor 1)
Figure 12. Schéma représentant les 5 domaines d’un récepteur nucléaire. A/B : domaine de transactivation ; C : domaine de liaison à l’ADN ; D : séquence de localisation nucléaire ; E : domaine de liaison au ligand ; F : domaine de transactivation
42 • FOXA (Forkhead Box A) ou HNF3
• HNF4
• OC1 (One cut homebox) ou HNF6.
Ils sont impliqués dans la différenciation tissulaire au cours du développement puis dans la fonction des tissus dans lesquels ils sont exprimés. Initialement observés dans le foie ils sont aussi exprimés dans d’autres tissus tels que le pancréas et le rein (pour revue : Lau et al., 2018). Les HNF sont organisés en réseau de régulation au stade embryonnaire puis à l’âge adulte. Ce réseau dans le foie est résumé par la figure 13.
HNF1α est une homéoprotéine de la famille HNF1. Cette famille compte deux membres, HNF1α et HNF1β. Les deux gènes codants pour ces protéines se trouvent sur deux chromosomes Figure 13. Schéma résumant le réseau de régulation de HNF dans le foie au stade embryonnaire et chez l’adulte. HNF1β est chronologiquement le premier exprimé dans l’embryon. FOXA2 et OC1 sont exprimés chez l’embryon et chez l’adulte, ils activent l’expression d’HNF4α lui aussi exprimé chez l’embryon et chez l’adulte. HNF1α apparait plus tard au cours du développement et devient majoritaire par rapport à HNF1β. Il est activé par HNF4α et exerce un rétro contrôle négatif sur ce dernier. D’après Lau et al., 2018
43 différents. HNF1α et HNF1β partagent une forte homologie dans leur domaine de dimérisation et de fixation à l’ADN mais pas dans leur domaine de transactivation (Mendel et al., 1991). Ces deux protéines reconnaissent les mêmes séquences ADN mais diffèrent par leur expression dans les différents organes au cours du développement.
HNF1α est initialement identifié comme un facteur de transcription impliqué dans le développement hépatocytaire (Courtois et al., 1987). Il contrôle l’expression de gènes spécifiques du foie tels que le β-fibrinogène, l’α1-antitrypsine et l’albumine. Son gène, appelé TCF, LF-B1 ou AFP se trouve sur le bras long du chromosome 12 (Bach et al., 1991). HNF1α compte 631 acides aminés codés par 10 exons. Sa structure est la suivante : un domaine Nterminal de dimérisation, un domaine de liaison à l’ADN et un domaine de transactivation en Cterminal (Fig. 12) (Vaxillaire et al., 1999). HNF1α se fixe à l’ADN par son homéodomaine appelé POU-H et l’homéodomaine POU-S assure la spécificité de la fixation aux séquences cibles. HN1α reconnait des séquences nucléotidiques palindromiques dans les régions promotrices de ses gènes cibles. La plupart des gènes cibles d’HNF1α ne sont que peu impactés par son inactivation (Pontoglio et al., 1996) ce qui suggère que son absence est compensée par HNF1β d’autres facteurs nucléaires hépatocytaires (Ryffel et al., 2001). Il a été montré que la plupart des gènes cibles d’HNF1α possèdent un site de fixation pour HNF4α sur leur promoteur (Odom et al., 2004). Il existe cependant plusieurs gènes cibles d’HNF1α fortement impactés par son inactivation. Par exemple, le gène de la glucose-6-phosphatase, enzyme hépatique qui catalyse la dernière étape de la glycogénolyse (Hiraiwa et al., 2000) et le gène de la phénylalanine hydroxylase (PAH) enzyme permettant l’élimination de l’excès de phénylalanine (Pontoglio et al., 1997). Sa dimérisation est indispensable à son interaction avec l’ADN. HNF1α peut former des homodimères ou des hétérodimères avec HNF1β (Bach et al., 1990 ; Mendel et al., 1991). L’expression des protéines HNF1 n’est pas strictement hépatique. On les retrouve aussi dans les épithéliums polarisés de différents organes tels que l’intestin, le pancréas, le rein et l’estomac (Pontoglio et al., 1996). Dans le foie adulte, l’expression d’HNF1α est largement majoritaire par rapport à HNF1β.