République Algérienne Démocratique et Populaire
Ministère de !'Enseignement Supèrieur et de la Recherche Scientifique
Université de Jijel
~~~ Faculté des Sciences Exactes et Sciences
de la Nature et de La vie ~~l_j ~! ~~-.9 ~.lll ~.jl=ùl ~
Département de Biologie Moléculaire et
Cellulaire r--~---=~-..:.-=!-
...
--:_-.i ..u..aJ--;-· -<io.W-.... -... -::_...---~---._""' ~~°"':J1_3 ;:~~~I ?~ ~..
At~\· ~~'Î;:>.J,IQ-
--
ï-
-:J
---
:
~~~
·
1 ~.)
~1-.9 ~.?.JI 1*-Jl~I ~
Mémoire De Fin D'études Pour L'obtention Du Diplôme
Master II en Biologie
Option : Pharmacologie
Expérimentale
Intitulée
EFFET
DE L'ENCAPSULATION SUR LES PERFORMANCES
DES
BACTÉRIES PROBIOTIQUES
~
.
-
!~"::-, ..
,.
.
'Membres de Jury:
.i~
-'r ·, 1 • Président: Mr. BOUHOUS Mostefa 1 l..• Examinateur: Dr. IDOUI Tayeb '
:~
':..\... · !Réalisé par : • Encadreur : Dr. OULED HADDAR Houria ' , "---Année Universitaire: 2009- 2010
BOUTABET J\!lessaouda GUEZIRA Messaouda
Tout d'abord, nous tenons à remercier Allah le Tout Puissant qui nous a donné la capacité afin d'accomplir ce modeste travail et nous a toiijours guidé vers le bon chemin.
Nous remercions vivement notre encadreur Docteur Ouled Haddar Houria pour ces aides et
conseils durant la réalisation de ce travail.
Nous remercions sincèrement monsieur Bauhaus Mustapha qui nous a fait l'honneur de présider
cejwy.
Nous remercions vivement le docteur ldoui Tayeb d'avoir accepté de faire partie du jwy afin
d'examiner ce travail.
Un Grand Aferci à monsieur Sifour Mohammed pour son aide précieuse dans la réalisation de
INTRODUCTION GENERALE . . . . .. . .. . . ... 1
Partie I: Analyse bibliographique CHAPITRE I: LES PROBIOTIQUES I.1. Histoire et définition des pro biotiques ... .. I.2. Microorganismes pro biotiques ... .. I.3. Propriétés générales des pro biotiques ... .. I.4. Critères de sélection des pro biotiques ... .. l 4.1. Résistance à l'acidité ... . 14.2. Résistance à la bile ..... . 14.3. Capacité d'adhérence à la muqueuse intestinale ... . l 4.4. Pouvoir antagoniste ... . I.5. Mécanismes d'action des pro biotiques ... . I.5 .1. Action sur les troubles intestinaux ... . 15.1.1. Maintien de l'équilibre de la barrière intestinale ............ .......... .. l 5.1. 2. Amélioration de l'intolérance au lactose ...... .. 15.1.3. Traitement des diarrhées ... . 15.1.4. Traitement des maladies inflammatoires chroniques de l'intestin (MJCJ, .... .. I.5.2. Action sur le système immunitaire ... . I.5.3. Autres applications thérapeutiques ... . 15.3.1. Les maladies cardiovasculaires ............................. . 15.3.2. Cancer ... .. I.6. Pharmacologie des pro biotiques ... . CHAPITRE II: LES PROBIOTIQES ENCAPSULÉS II.1. Définition et applications ... . II.2. Les différentes techniques de la micrœncapsulation des pro biotiques ... .. II.2.1. L'extrusion ... .. II.2.2. L'émulsion ... . II.2.3. Le séchage ... . 3 3 4
6
6 7 8 8 8 99
10 10 11 12 13 13 14 14 15 16 16 17 17 II.3. Les principaux supports utilisés pour l'encapsulation des probiotiques . .. .. .. .. .. . .. .... 17II.4. L'effet de différents matériels d'encapsulation sur la stabilité des pro biotiques . . . 19
II.5. Avantages de la technologie de la microencapsulation des probiotiques.... .. .. ... 20
II.6. Pharmacologie des pro biotiques encapsulés . . . 20
Partie II: Étude expérimentale Il.MATÉRIEL ET METHODE II.1. Matériel . . . 23
II.1.1. Matériel biologique . . . .. . 23
II.1.2. Produits et réactifs . . . 23
II.1.3. Appareillage . . . .. 24
II.2.3 .. Évaluation de l'activité antimicrobienne des bactéries pro biotiques... 25
II.2.4. Encapsulation des souches pro biotiques dans un gel d'alginate de sodium à 1 % . . . 25
II.2.5. Évaluation des aptitudes pro biotiques des bactéries lactiques in vitro ... ... ... ... .. . ... 26
II.2.5 .1. La tolérance aux acides . . . .. 26 II.2.5.2. La tolérance aux sels biliaires . . . 26
II.2.6. La survie des Lb. plantarum libres et encapsulées dans le TGI des
lapins... 27
ID. RÉSULTATS ET DISCUSSION
III.1. Étude de la sensibilité des bactéries pro biotiques aux antibiotiques ... .
III.2. Évaluation de l'activité antimicrobienne des bactéries probiotiques ... .
28
29
III.2. 1. Activité antibactérienne des cultures bactériennes ... . 30
III.2.2.Activité inhibitrice des surnageants natifs... 30
III.2.3. Activité inhibitrice des surnageants neutres ... . 32
III.3. Évaluation de quelques aptitudes probiotiques des bactéries lactiques libres et
encapsulées in vitro... 33
III.3.1. La tolérance des pro biotiques libres et encapsulées aux conditions acides . . . .. 34
III.3.2. La tolérance des pro biotiques libres et encapsulées aux sels biliaires ... . 36
III.4. La survie de Lb. plantarum dans le TGI des lapins ... . 39
IV. CONCLUSION . . . . .. 41 V. RÉFÉRENCES BIBLIOGRAPIDQUES . . . . . . . . .. 43
TGI Lb B UFC g BSH
c
MICI IL LDL HDL HMG CF02
N M Nm TrCa Ch
h Tractus gastrointestinal Lactobacillus Bifidobacterium Unité formant colonie GrammeBile Salt Hydrolase Clostridium
Maladies inflammatoires chroniques de l'intestin Interleukines
Lipoprotéine de faible densité Lipoprotéine de haute densité Hydroxyle méthylglutaryl Carboxyflourexine Oxygène Normalité Molarité Nanomètre Tour Chloride de calcium Heure
Tableau 1. Micro-organismes considérés comme pro biotiques... 4 Tableau 2. Encapsulation des cellules/ Applications biotechnologiques....... ... 16 Tableau 3. Résistance et sensibilité de Lb. plantarum et Lb. curvatus aux antibiotiques.. 28 Tableau 4. Activité antibactérienne des cultures probiotiques brutes sur les souches testées... 30 Tableau 5. Effet du surnageant natif des souches probiotiques sur les souches testées .. . 31 Tableau 6. Effet du surnageant neutre des souches probiotiques sur les souches testées .. .
32 Tableau 7. Effet des antibiotiques sur Lb. plantarum et Lb. curvatus ... . annexe Tableau 8. L'effet du pH acide sur la viabilité de Lb. plantarum libre et encapsulée .... . annexe Tableau 9. L'effet du pH acide sur la viabilité de Lb. curvatus libre et encapsulée ... . annexe Tableau 10. L'effet de 0.3% de sels biliaires sur la viabilité de Lb. plantarum libre et
encapsulée ... annexe Tableau 11. L'effet de 0.3% de sels biliaires sur la viabilité de Lb. curvatus libre et
encapsulée ... annexe Tableau 12. La présence de Lb. plantarum dans la matière fécale des lapins ... annexe
Figurel. La base théorique pour le choix des micro-organismes probiotiques... ... 6
Figure2. Mécanisme d'actions possibles des bactéries probiotiques pour améliorer la résistance aux bactéries pathogènes... 9
Figure3. Structure détaillée de micro bille . . . .. 15
Figure4. Structure des unités chimiques d'alginate (M =acide mannuronique et G
=
acide guluronique) . . . 18
Figures. Activité inhibitrice de Lb. plantarum et Lb. curvatus sur Klebsiella et E. coli... 30 Figure6. Activité inhibitrice des surnageants natifs de Lb. plantarum et Lb. curvatus sur Klebsiella et E. coli ... ... ... ... ... ... ... . .. ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... .. 32
Figure?. Aspect des billes d'alginate . . . 33
Figures. Photomicrographie des cellules bactériennes de Lb. plantarum encapsulées
dans un gel d'alginate de sodium (G xlOO)... .. . . ... 34
Figure9. Effet de l'acidité (pH 2) sur la survie de Lb. plantarum libre et encapsulé dans l'alginate de sodium... 35
FigurelO. Effet de l'acidité (pH 2) sur la survie de Lb. curvatus libre et encapsulé dans l'alginate de sodium . . . 3 5
Figurell. Survie de Lb. plantarum libre et encapsulée dans l'alginate incubées à 0.3% de sels biliaires . . . 3 8 Figure12. Survie de Lb. curvatus libre et encapsulée dans l'alginate incubées à 0.3% de sels biliaires . . . 3 8 Figure13. La présence de Lb. plantarum dans le TGI des lapins ....... .. ... 40
INTRODUCTION GENERALE
La possibilité que l'ingestion de certaines bactéries sélectionnées peut influencer bénéfiquement l'appareil gastro-intestinal humain", a proposé Elie Metchnikoff, lauréat du prix Nobel, au début du 20ème siècle (Morelli, 2000), à partir d'une hypothèse qui suggère que
la longévité et la bonne santé des paysannes Bulgares est le résultat de consommation de produits laitiers fermentés contenant des ferments du geme Lactobacillus (Sanders, 1999). Il a également affirmé que « la dépendance des microbes intestinaux dans l'alimentation permet d'adopter les mesures et de modifier la flore dans notre corps et de remplacer les microbes nocifs par des microbes utiles» (Morelli, 2000).
A cette époque, Henry Tissier, pédiatre Français, a observé que les selles des enfants souffrant de diarrhée contenaient un petit nombre de bactéries caractérisées par une morphologie particulière, ces bactéries étaient au contraire abondantes chez des enfants sains. A son avis, ces bactéries pourraient être administrées aux patients soufrant de diarrhée pour les aider à établir une flore intestinale saine (FAO/OMS, 2001). Après, d'autres recherches démontraient la possibilité de l'utilisation clinique de ces agents et proposent le terme d'agents biothérapeutiques pour décrire des microorganismes qui ont des propriétés thérapeutiques tels que l'inhibition des pathogènes (D'souza et al., 2002).Actueilement, les microorganismes, nommés probiotiques, sont utilisés largement dans différentes préparations alimentaires fermentées ainsi que dans des préparations pharmaceutiques (Doleyers et al., 2002).
L'effet bénéfique des probiotiques apparaît lorsqu'ils peuvent arriver au milieu intestinal viables et avec un nombre suffisant. Cependant, plusieurs recherches ont montré que la viabilité et la capacité de survie des probiotiques dans le tractus gastrointestinal (TGI)
et dans les produits fermentés sont diminuées à cause de leur exposition à des tress env ironn-ementaux et aux conditions défavorables telles que les acides, les ions hydrogènes, l'oxygène,
.... etc. La diminution de la viabilité des pro biotiques dans les produits alimentaires et dans les conditions (acide-bile) du TGI a encouragé les chercheurs à trouver de nouvelles méthodes pour améliorer la viabilité des probiotiques (Anal et Singh, 2007 ; Mortazavian et al., 2007).
La microencapsulation est l'une de ces nouvelles méthodes, et semble étre la plus
livraisondes bactéries viables ou des éléments bioactifs vers les sites d'actions concernés (Anal et Singh, 2007 ; Mortazavian et al., 2007).
Dans ce travail, on s'intéresse à mettre le point sur une technique d'encapsulation des cellules dans un gel d'alginate et son effet sur certaines performances des bactéries probiotiques, notamment son effet sur leur tolérance aux conditions hostiles similaires à celles du TGI.
I. LES PROBIOTIQUES
I.i. Histoire et définition des probiotiques
Le mot probiotique vient du grec (n:po ~ioç: pro bios), qui signifie "en faveur de la vie" et qui est actuellement utilisé pour désigner des bactéries associées à des effets bénéfiques chez l'Homme et les animaux (FAO/OMS, 2001). La notion probiotique est née grâce aux travaux de Eli Metchnikoff en 1907, qui a suggéré que l'ingestion du lait fermenté contenant des bacilles (Lactobacillus) influence positivement la flore intestinale en réduisant les activités de la toxicité des microbes nocifs (Fuller, 1991; Sanders, 1999 ; Rolfe, 2000).
Plusieurs autres définitions ont été développées au cours du temps. Ce terme a été pour la première fois utilisé par Lilly et Stillwellen en 1965 pour désigner : « Une substance produite par un microorganisme et qui stimule la croissance d'autres microorganismes»
(Senok et al., 2005; Ninane et al., 2009). Depuis, la définition des probiotiques a évolué au
gré de l'état des connaissances de leurs mécanismes d'action sur la santé. En 1974, Parker élargit la notion de probiotiques aux : « microorganismes qui contribuent au maintien de l'équilibre de la flore intestinale», englobant ainsi les microorganismes et les métabolites microbiens produits (Fuller, 1991; Ninane et al., 2009). En 1989, Fuller propose une autre définition : « Supplément microbien vivant qui affecte bénéfiquement la santé de l'hôte en améliorant sa balance microbienne» (Salminen et al., 2002; Kacem et Karam, 2006; Raz et
al., 2007). C'est dans cette définition où est exigé que les microorganismes soient vivants.
Une dizaine d'années plutard, une définition fait consensus, cette définition est donnée par un comité d'experts de la FAO et l'OMS, et qui précise que: « Les probiotiques sont des microorganismes vivants qui, lorsqu'ils sont administrés en quantité adéquate, confèrent un bénéfice santé à l'hôte» (FAO/OMS, 2001).
I.2. Microorganismes probiotiques
Les principaux microorganismes utilisés en tant qu'agents probiotiques sont les bactéries lactiques (Reque et al., 2000) , spécifiquement ceux qui appartiennent aux genres Lactobacillus et Bifidobacterium. Cependant, d'autres genres comme Escherichia, Enterococcus (Streptocoques) et Saccharomyces, ont été également considérés comme probiotiques (Isolauri et al., 2000; Senok et al., 2005 ; Kumar et al., 2009) (Tableau 1).
Tableau 1: Micro-organismes considérés comme probiotiques (d'après Hozalpfel et al., 1998).
1-·
---
-
-i ·-·~-., ... c-~·~ • '~ - ~"c-~-·-i
1 1 L. acidophilus!
L. amy/ovirusB. adolescentis Enterococcus faeca/is
Enterococcus faecium Lactococcus lactis
Baci/lus spp, L. brevis L. casei L. cellobius L. crispatus L. curvatus L. delbrueckii L. farciminis L. fermentum L. gallinarum L. gasseri L. johnsonii L. paracasei L. plantarum
i
L. reuteri!
L. rhamnosus L----·-··--·--- ---· B. animalis B. bifidum B. breve B. infantis B. /actis B. longwn B. thermophilum Leuconstoc mesenteroidesPediococcus acidilactici
Streptococcus thermophilis Streptococcus diacetylactis Streptococcus intermedius
Escherichia coti s1rain Nissle Propionibacterium ji-eudenreichii Saccharomyces cerevisae Saccharomyces bourlardii
Sporolactobaci/lus inulinus
Les bactéries lactiques sont des micro-organismes à Gram positif, elles se présentent le plus souvent sous forme de coques ou de bacilles, non sporulants, non mobiles, anaérobies, négatifs à la catalase et dépourvus de cytochrome. Elles sont en outre résistantes à l'acide et aérotolérantes (Ait Belgnaoui, 2006).Toutes les bactéries lactiques possèdent un métabolisme fermentaire leur permettant, en utilisant des sucres, de produire principalement de l'acide lactique mais aussi d'autres acides organiques (acide acétique, acide formique), elles sont devenues ainsi les principaux candidats probiotiques. Elles peuvent être homofermentaires (70% du produit métabolique est l'acide lactique) ou hétérofem1entaires (50 % acide lactique complété par d'autres composés tels que l'acide acétique, le C02 ou l'éthanol) (Raynaud, 2006).
1.3. Propriétés générales des probiotiques I.3.1. Vivants et actifs :
Les probiotiques sont souvent consommés dans des produits fermentés. Pendant la fermentation plusieurs métabolites apparaissent dans le produit alimentaire, y compris l'acide
acétique, l'acide lactique, et probablement des bactériocines, et le pH est abaissé. De tels
changements peuvent affecter la stabilité et la viabilité des microorganismes probiotiques
ainsi que leurs propriétés fonctionnelles (Tuomola et al., 2001). Essentiellement, il est
suggéré que les souches choisies doivent:
• Etre résistantes aux traitements technologiques que va subir le produit vecteur.
• Maintenir la viabilité et la stabilité lors de la conservation et le stockage.
•Maintenir les qualités organoleptiques (saveur, arome).
• Maintenir une acidité douce pendant tout le stockage.
• Maintenir les propriétés de colonisation intestinales pendant le traitement et le stockage.
• Démontrer la stabilité et la fonctionnalité après lyophilisation et après les méthodes de séchage.
• Il est aussi important qu'ils restent vivants et métaboliquement actifs dans l'appareil
gastro-intestinal afin d'exercer un impact sanitaire sur la santé de l'hôte (Mosilhey, 2003).
1.3.2. Administrés en quantité adéquate:
Lors de leurs arrivées dans le colon, les probiotiques ingérées vont subir une perte
allant jusqu'à 70% à plus de 90%. Dans l'intestin, les microorganismes probiotiques se
retrouvent en compétition avec une flore extrêmement abondante, et doivent donc être
présentes en quantité suffisante pour y faire face. La moyenne recommandée pour la
consommation des probiotiques est d'environ 108-109 UFC/g par jour. Il semble qu'une
espèce bactérienne présente à moins de 107 UFC/g n'ait que des effets métaboliques minimes,
en dessous de 105 UFC/g, ses effets seraient totalement réprimés (Lie et salminen, 1996).
1.3.3. Innocuité pour l'hôte :
Les probiotiques doivent être capables d'exercer leurs effets bénéfiques sur l'hôte par
leurs croissances et/ou leurs activités dans le corps humain. De plus, ils doivent être non
pathogènes, d'origine humaine, et génétiquement stables (Hariche et Verghese, 2006;
Sanders, 2008). Les bénéfiques attribués aux probiotiques sont la modulation de la flore
intestinale, la prévention contre l'adhérence des pathogènes, le changement des activités
enzymatiques trouvées dans l'intestin et l'influence sur le système immunitaire de l'hôte
1.4. Critères de sélection des probiotiques
Le criblage initial et le choix d'un probiotique exigent la présence de critères
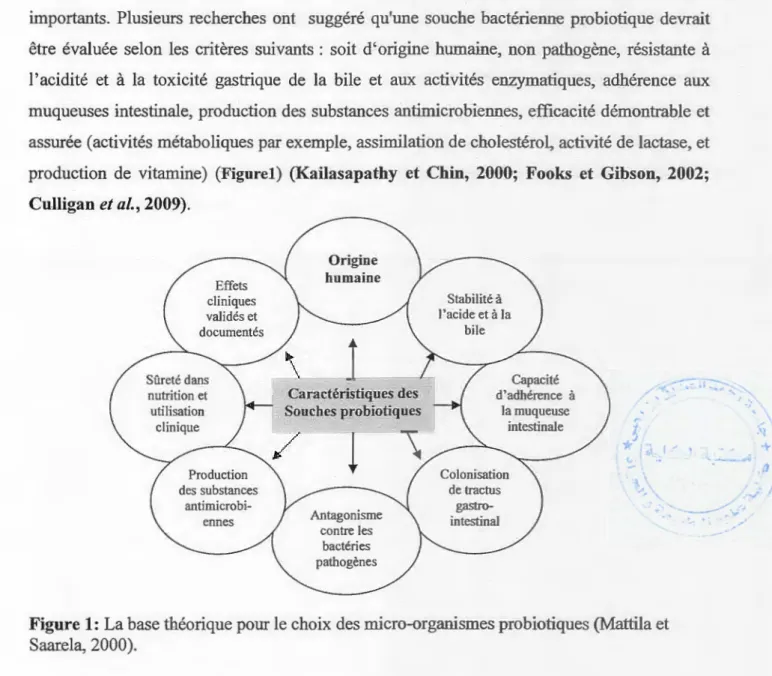
impo1iants. Plusieurs recherches ont suggéré qu'une souche bactérienne probiotique devrait
être évaluée selon les critères suivants : soit d'origine humaine, non pathogène, résistante à
l'acidité et à la toxicité gastrique de la bile et aux activités enzymatiques, adhérence aux
muqueuses intestinale, production des substances antirnicrobiennes, efficacité démontrable et assurée (activités métaboliques par exemple, assimilation de cholestérol, activité de lactase, et
production de vitamine) (Figurel) (Kailasapathy et Chin, 2000; Fooks et Gibson, 2002;
Culligan et al., 2009). Effets cliniques validés et documentés Sûreté dans nutrition et utilisation clinique Production des substances antimicrobi-ennes Origine humaine
\
î
Caractéristiques des Souches probiotiques/
l
Antagonisme contre les bactéries pathogènes\
Stabilité à l'acide et à la bile Capacité d'adhérence à la muqueuse intestinale Colonisation de tractus gastro -intestinal~-*
... J.l 1 ...Figure 1: La base théorique pour le choix des micro-organismes probiotiques (Mattila et Saar.ela, 2000).
1.4.1. Résistance à l'acidité
·'''~::-~
---"'
Plus de deux litres de jus gastrique avec un pH aussi bas que 1.5 sont sécrétés par les
cellules de l'estomac chaque jour, fournissant une barrière normale efficace et à haute teneur en acide contre l'entrée de bactéries viables dans le TGI (Kotikalapudi, 2009). En conséquence, n'importe quel microorganisme probiotique qui doit passer par l'estomac doit
tolérer aux conditions acides et aux protéases de l'estomac. Par conséquent, la tolérance à l'acidité est l'une des premières propriétés examinées pour choisir les souches probiotiques.
Des essais simples ont été employés in vitro pour évaluer la tolérance à l'acide. De tels essais ont été appliqués aux bactéries lactiques et aux souches de Bifidobacterium utilisées dans l'industrie laitière. Les résultats de ces essais peuvent prévoir la capacité des souches à survivre dans les produits acides. La validation in vivo de la survie des probiotiques à travers l'estomac humain est plus difficile à obtenir, les analyses in vih'o qui examinent
l'effet inhibiteur des acides sur la croissance des souches probiotiques sont également simples
(Tuomola et al., 200-1). La tolérance de Lactobacillus acidophilus ATCC 11975 aux conditions hostiles de l'estomac a été étudiée in vitro, les résultats ont montré qu'elle peut
survivre pendant 30 minutes à pH 2 dans le suc gastrique de l'estomac (Kotikalapudi, 2009).
1.4.2. Résistance à la bile
La bile est une solution aqueuse constituée par des acides de bile, cholestérol,
phospholipides. Environ 500-700 mL/ jour d'acides de bile sont synthétisés dans le foie à partir du cholestérol. La bile joue un rôle essentiel dans la digestion des lipides ; elles émulsifient et solubilisent les lipides et fonctionnent comme des détergents biologiques.
Avant la sécrétion dans le duodénum, les acides de bile sont conjugués avec de la glycine ou
la taurine. Dans les deux points la bile conjuguée subit de divers changements chimiques
comprenant la déconjugaison, la déshydroxylation, la déshydrogénation, et la
déglucuronidation, presque seulement par des activités microbiennes.
Les hydrolases de sels biliaires sont généralement les enzymes intracellulaires qm
catalysent l'hydrolyse des sels biliaires. L'hydrolyse des sels biliaires est atténuée par divers genres de la flore microbienne intestinale (Ratna Sudha et al., 2009).
Plusieurs bactéries probiotiques d'origine intestinale comme les bifidobactéries ont
développé des mécanismes pour résister à l'action détergente des sels biliaires et acquérir la capacité de les transformer par déconjugaison grâce à l'activité de l'enzyme « Bile Salt Hydrolase
»
ou«
BSH»
qui est aussi appelée Cholylglycine Hydrolase. Cette enzyme catalyse l'hydrolyse des sels biliaires conjugués avec la glycine ou la taurine en résidusd'acides aminés et en sels biliaires libres. La déconjugaison des sels biliaires par les bactéries
possédant une activité BSH augmente leur chance de survie dans le TGI. De plus elle contribue à la diminution des niveaux de cholestérol et à la réduction des risques de cancer de colon (Denis, 2006).
1.4.3. Capacité d'adhérence à la muqueuse intestinale
La capacité d'adhérence à la muqueuse intestinale ou aux cellules épithéliales est l'un des critères de sélection les plus importants parce qu'elle est considérée comme une condition préalable à la colonisation et la croissance (Morelli, 2000), ainsi qu'une caractéristique pour évaluer la structure extérieure des bactéries probiotiques et l'effets relatifs de la barrière intestinale. Dans plusieurs études, l'adhérence était associée à une diminution de la durée de la diarrhée, des effets immunogènes, de l'exclusion compétitive et d'autres effets sur la santé (Tuomola
et al.,
2001). La capacité des bactéries lactiques d'adhérer aux muqueuses empêche leur déplacement rapide par les contractions de l'intestin et l'écoulement péristaltique suivant la digestion (Kotikalapudi, 2009). Des résultats obtenus avec les probiotiques utilisés chez des animaux de ferme ont prouvé que quelques souches de Lactobacillus peuvent adhérer, in vitro, à de petits morceaux de tissus intestinaux d'une manière espèce-dépendante et de cela, il est possible d'observer une corrélation positive entre les résultats obtenu in vitro et le potentiel de colonisation examiné in vivo (Morelli, 2000).1.4.4. Pouvoir antagoniste
Les probiotiques pourraient supprimer la croissance et l'invasion de pathogènes supposés impliqués dans le déclenchement de l'inflammation intestinale. Ils pourraient occuper les sites d'adhésion des pathogènes sur la muqueuse intestinale, être compétitifs pour l'utilisation des substrats nécessaires à la croissance des pathogènes, secréter des substances antimicrobiennes spécifiques (acides lactique, peroxyde d'hydrogène, bactériocines) et créer un environnement local défavorable aux pathogènes (Fuller, 1991 ; Fooks et Gibson, 2002).
1.5. Mécanisme d'action des probiotiques
Les mécanismes d'action des probiotiques sont encore assez mal compris mais dans une règle générale ils incluent:
• L'adhérence et la colonisation de l'intestin. • La production de substances antirnicrobiennes. • L'amélioration des fonctions intestinales. • La stimulation du système immunitaire de l'hôte
• La suppression ou l'élimination d'entéropathogènes via la production de produits ayant une activité antimicrobienne ou par compétition pour les ressources essentielles à leur survie dans l'intestin.
• La suppression de la production de toxines en inhibant l'activité métabolique des bactéries qui les produisent, (Figure 2) (Lassard et Roy, 2004; Harish et Verghese, 2006).
Inhibe l'adhérence de Bactéries pathogènes
Produits du métabolisme (acide lactique)
Inhibe la croissance des Bactéries indésirables Bactéries patho_gènes Stimulation des mécanismes Améliore l'immunité de L'hôte
Figure 2: mécanisme d'actions possibles des bactéries probiotiques pour améliorer la résistance aux
bactéries pathogènes (Lassard et Roy, 2004)
1.5.1. Action sur les troubles intestinaux
Le tractus intestinal humain contient plus de 500 espèces microbiennes différentes. La microflore intestinale joue un rôle majeur dans la protection de l'hôte contre des microorganismes pathogènes, certaines perturbations dans cette microflore peuvent prédisposer l'hôte à plusieurs maladies (Harish et Varghese, 2006).
1.5.1.1. Maintien de l'équilibre de la barrière intestinale
Plusieurs souches probiotiques présentent tn vitro et in vivo un effet favorable sur la fonction barrière de l'intestin augmentant ainsi la résistance transépithéliale et diminuant la perméabilité intestinale (Fabia et al., 1993).
L'effet des probiotiques sur la résistance transépithéliale est généralement accompagné par un maintien de l'intégrité fonctionnelle du cytosquelette des cellules épithéliales intestinales, régulée par les jonctions serrées (Ait Belgnaoui, 2006). Les effets des pro biotiques sur l'inhibition de la croissa..'lce des bactéries pathogènes et sur la stabilisation de la barrière épithéliale sont également associés à une diminution de la translocation bactérienne, ainsi chez l'animal, le traitement par certains probiotiques tels que
Bifidobacterium longum (Suzuki et al., 1997) ou Saccharomyces boulardii (Berg et al., 1993) diminue la translocation bactérienne.
1.5.1.2. Amélioration de l'intolérance au lactose
Le lactose est un disaccharide de glucose et de galactose reliés entre eux par une
liaison
p;
sa digestion nécessite une lactase qui coupe cette liaison et autorise alorsl'absorption des sucres simples libérés. Le lactose est présent exclusivement dans le lait et
dans ses dérivés (Mnteau et Seksik, 2005).
Lorsqu'une personne est intolérante au lactose, cela signifie que les cellules de son
organisme sont incapables de produire la lactase à cause du déclin physiologique de la lactase
avec l'âge ou grâce aux maladies qui accélèrent le transit jéjunal. Les pro biotiques améliorent la digestion du lactose par le ralentissement du transit intestinal; permettant une meilleure
digestion du lactose, ou par la production de la lactase au cours de la fermentation par
plusieurs souches bactériennes comme les Lactobacillus (Exp: Lactobacillus bulgaricus) et
Streptococcus thermophilus (Harish et Varghese, 2006).
1.5.1.3. Traitement des diarrhées
Des effets protecteurs de souches probiotiques contre des infections intestinales ont été
observés sur des modèles animaux. Les mécanismes potentiellement impliqués sont multiples. Ils incluent la production d'acide lactique, de peroxyde d'hydrogène, de substances
antimicrobiennes (parfois des bactériocines), la compétition pour les nutriments ou pour les
récepteurs d'adhérence, des actions antitoxines et la stimulation du système immunitaire.
(Gill, 2003).
a. Diarrhée associée à l'utilisation des antibiotiques
Les antibiotiques entraînent fréquemment des effets indésirables digestifs,
particulièrement la diminution de la capacité fermentaire du colon et la diminution de l'effet
barrière avec émergence secondaire de microorganismes pathogènes tels que Clostridium difficile (Marteau et Seksik, 2005).
Quelques préparations probiotiques qui contiennent des mélanges de plus d'une souche
différents désordres gastro-intestinaux tels que la diarrhée associée aux antibiotiques (Rolfe et
al., 2000).
b. Diarrhée associée à C. difficile et aux Rotavirus
C. difficile est un bacille non invasif responsable d'un grand nombre de diarrhées survenant au cours d'antibiothérapies, ses caractéristiques, tout particulièrement sa cornmensalité possible et sa capacité à former des spores très résistantes explique le risque de transmission nosocomiale et la fréquence des rechutes (Marteau et Seksik, 2005). L'effet
bénéfique des probiotiques en réduisant l'incidence ou la durée de certaines maladies diarrhéiques est peut-être le plus justifié jusqu'ici. Cela vaut particulièrement pour l'utilisation de Lactobacillus rhamnosus GG; Bifidobacterium lactis BB-12 et Lactobacillus reuteri
SD2222 dans la prévention et le traitement de diarrhée à Rotavirus chez les enfants.
Les mécanismes qui ont été proposés pour cet effet protecteur incluent la compétition concurrentielle pour les sites des récepteurs (ayant pour résultat l'inhibition de l'adhérence et l'invasion de virus), le perfectionnement du système immunitaire, et la production des substances qui inactivent des particules microbiennes. Cependant, aucun de ces mécanismes n'a été démontré d'une manière concluante. Néanmoins, on le suggère maintenant qu'il y ait
d'évidence suffisante pour l'utilisation du Lactobacillus rhamnosus GG sous forme de lait ou
de capsule comme adjonction à la thérapie orale de réhydrations pour le traitement de la diarrhée à Rotavirus (Fuller, 1991; Senok et al., 2005).
d. Diarrhée du voyageur
La Diarrhée du voyageur est une situation clinique très fréquente, affectant jusqu'à 50% des touristes dans certaines régions du monde; son mécanisme est le plus souvent infectieux (Marteau et Seksik, 2005). Les probiotiques peuvent être considérés comme
moyens pour la prévention de la diarrhée du voyageur, y compris l'excrétion inhibitrice des métabolites et la compétition avec les microbes pathogènes pour les substances de croissance
et leur emplacement de colonisation (Sanders et al., 2007).
1.5.1.4. Traitement des maladies inflammatoires chroniques de l'intestin (MICI)
Les MICI regroupent la rectocolite hémorragique (RCH), et la maladie du Crohn, qui sont deux maladies séparées par des caractéristiques physiopathologiques distinctes. On peut ainsi inclure dans les MICI la porchite qui consiste en une inflammation du réservoir crée lors
la chirurgie. La RCH et la maladie de Crohn résultent à des antigènes d'origine bactérienne (Cherbut, 2008).
Le rapport entre les bactéries et l'inflanunation intestinale est complexe et ne semble
pas refléter une cause et un effet simple. En raison de l'hétérogénéité clinique et thérapeutique dans la maladie de Crohn et la colite ulcérative. Bien que les résultats préliminaires de la thérapie probiotique chez les modèles animaux et les humains atteints de la colite ulcérative et
de porchite soient encourageants, leur efficacité dans le traitement de la maladie de Crohn
reste à clarifier (Shanahan, 2000; Hoveyda et al., 2009).
Des études ont été effectuées pour bien comprendre le mécanisme par lequel les bactéries probiotiques influencent sur les MICI. L'adhésion et l'invasion de cellules épithéliales intestinales par des souches d' Escherichia coli adhérentes et invasives, isolées de
patients souffrant de la maladie de Crohn, ont été diminuées ou abolies par la co-ou pré-incubation avec la souche d'E. coli NISSLE 1817, suggérant un des mécanismes responsables de l'effet bénéfique de ce probiotique pour la maintenance de la rémission chez des patients avec une RCH. Ainsi une étude a montré que l'administration sous cutanée d'une souche de Lb. salivarus pouvait atténuer l'inflammation colique chez des souris et la production de cytokines proinflarnrnatoires.
Les probiotiques peuvent influencer la présentation antigénique, les réponses
immunitaires humorale et cellulaire et induire la production de cytokines régulatrices (IL-10,
TNF-~) tout en diminuant la production de cytokines pro inflammatoires (TNF-a, IL-8, etc.). De plus, les probiotiques peuvent influencer différents facteurs impliqués dans la fonction de barrière de l'épithélium. Certains souches de Lactobacilles ont stimulé la production de mucines par des cellules épithéliales in vitro, et ont agit sur les éléments du cytosquelette et
des jonctions serrées (Cherbut, 2008).
1.5.2. Action sur le système immunitaire
La muqueuse du tractus intestinal représente la plus importante interface entre l'hôte et
son environnement. Pour assurer la protection de l'hôte contre l'invasion d'organismes nocifs,
les propriétés fonctionnelles de la muqueuse doivent donc être optimales. L'optimisation de ces fonctions est assurée par des mécanismes de défense non spécifiques et immunitaires. Les
molécules soit par des bactéries désirables ou par l'hôte, qui contrôlent la croissance des bactéries et leur adhérence à la muqueuse intestinale. Ces mécanismes constituent une première ligne de défense. Quant aux fonctions immunitaires intestinales, elles font intervenir différents types de cellules qui interagissent ensembles pour surveiller et contrôler les agents infectieux qui n'ont pas pu être arrêtés complètement par les mécanismes non spécifiques (Lassard et Roy, 2004).
Le tissu intestinal héberge le plus grand nombre de cellules immunitaires du corps humain (Isolauri et al., 2001). Ces cellules peuvent être regroupées dans deux catégories principales, les lymphocytes T et B et le second inclut les monocytes, les macrophages, les cellules dendritiques et les neutrophiles. Une fois ces cellules du système immunitaires activées par la présence d'un agent infectieux, elles produisent plusieurs facteurs nommés cytokines. Les cytokines jouent un rôle important dans l'orchestration des mécanismes de défense qui seront activés pour combattre l'agent infectieux (Lassard et Roy, 2004).
De nombreuses études ont démontré que la colonisation bactérienne influence le développement des fonctions immunitaires intestinales et systémiques. Les bactéries commensales et pathogènes sont toutes deux capables de moduler la réponse immunitaire en affectant la production des différentes cytokines impliquées dans cette réponse (Cherbut, 2008). Les effets des probiotiques sur les mécanismes de défense immunitaire impliquent l'amélioration de la barrière immunologique de l'intestin, plus particulièrement la production d'immunoglobuline A et la diminution des réactions inflammatoires intestinales (lsolauri et al., 2001).
I.5.3. Autres applications thérapeutiques 1.5.3.1. Les maladies cardiovasculaires
Les probiotiques peuvent diminuer le risque des maladies cardiovasculaires par la diminution du niveau du cholestérol LDL et l'augmentation du niveau du cholestérol HDL. La diminution du niveau du cholestérol LDL peut être expliquée par l'activité du propionate;
produit de la fermentation des oligosaccharides dans le colon. Le propionate inhibe la HMG-COA réductase impliquée dans la synthèse du cholestérol (Trafalska et Grybowski, 2006). Une étude suggère que l'administration d'une souche probiotique d'Enteroccocusfaecium M-74 ou
Lb
.
acidophilus réduits la concentration du cholestérol sérique par 12% après 56 semaines (Hlivak et al., 2005).1.5.3.2 Cancer
Plusieurs études ont montré que certaines souches probiotiques pouvaient diminuer
l'activité des enzymes fécales de la mutagenèse et de la carcinogenèse, ainsi certains
probiotiques tels que Bifidobaterium longum peuvent produire des facteurs antitumoraux (Trafalska et Grybewski, 2006). Une autre recherche suggère que l'administration de
Lactobacillus casei (1010 UFC trois fois /jours) pendant une ar1née diminuait le risque de récidive des tumeurs superficielles de la vessie chez l'Homme. De plus, la production des agents mutagènes après l'ingestion d'un repas pourrait être réduite par la prise simultanée de probiotiques (Roos et Katan, 2000).
1.6. Pharmacologie des probiotiques
Le mode d'action des probiotiques est de mieux en mieux compris grâce à une approche
pharmacologique. Cette dernière a pour but d'identifier les principes actifs, décrire leur pharmacocinétique et démontrer les effets bénéfiques ou néfastes. Les probiotiques peuvent
être considérés comme un moyen de véhiculer des principes actifs (enzymes, composants de paroi, peptides ou nucléotides immunomodulateurs, protéines .... ) jusqu'à leur cible d'action
dans le TGI.
La plupart des études pharmacocinétiques ont décrit le devenir des probiotiques ingérés, leur survie, leur adhérence et leur colonisation dans le TGI. Des modèles in vitro peuvent aider à prédire la survie des probiotiques in vivo ou leur adhérence à l'épithélium ou au mucus intestinal, ainsi que la sensibilité des souches probiotiques au pH et aux conditions des sels
biliaires en utilisant le mucus humain ou animal (Marteau et Seksik, 2005). La majorité des études s'intéresse sur la survie des probiotiques in vivo jusque dans les selles. Deux principaux moyens utilisés pour obtenir les échantillons de chyme intestinal, la collection des selles et la perfusion intestinale. La perfusion intestinale permet la détermination non
II. LES PROBIOTIQES ENCAPSULÉS 11.L Définition et applications
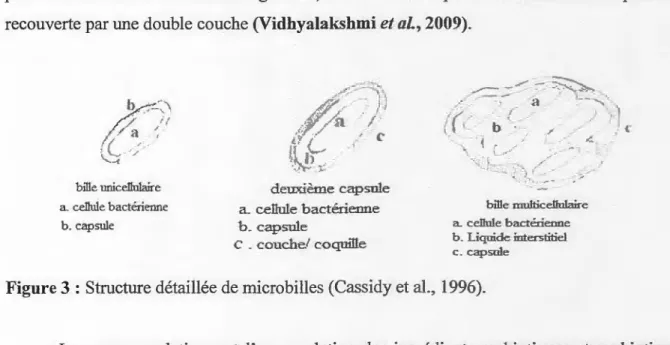
D'un point de vue micro biologique, la microencapsulation peut être définie comme un
processus d'inclusion des microorganismes dans une capsule hydrocolloïdale appropriée pour
les séparer de leur environnement, d'une certaine manière a aboutir à une libération régulée
des cellules dans le milieu intestinal (Sultana et al, 2000).
Parmi les agents qui influencent la libération des cellules on peut citer le changement
du pH, les tensions mécaniques, la température, l'activité enzymatique, la pression osmotique,
la diffusion de l 'humidîté à travers la capsule, la présence de certains composés chimiques et
la durée de stockage (Mortazavian et al., 2007).
La taille des capsules peut varier de subrnîcrons à quelques millimètres et elles
peuvent être présentes sous différentes formes (sphérique ou elliptique). Chaque rnîcrocapsule
est constituée d'une membrane (couche) semi perméable qui entoure les cellules bactériennes,
peut avoir des surfaces lisses ou rugueuses, contenir une ou plusieurs cellules et elle peut être
recouverte par une double couche (Vidhyalakshmi et al., 2009) .
k
) ::
·_,
' I <l '.: / ' ' \. r',,. "~ ,· bille unicellulaire a. cellule bactérienne b. capsule ~~:..-~ / Y / - i 'I' , . I./-'.
a
.
11" /
' 1'-'!-?
,_.
(" derncième capsule a. cellule bactérienne b_ capsule C _ coud1e/ coquille . --- ·--
..---
-
·-::::--.... ....,
... ; ,,,- - r# .a L. -· .... --:·-, 1 (\.~
b ' ,) \{ ~ , .· ..:. .. ~ -:.· ·-... t... --- /·'::...
~-\·bille multicellulaire a. cellule bactérienne b_ Liquide interstitiel
c. capsule Figure 3 : Structure détaillée de microbilles (Cassidy et al., 1996).
La co-encapsulation, est l'encapsulation des ingrédients prebiotiques et probiotiques
dans une même capsule pour influencer la croissance et la multiplication des cellules
probiotiques durant leur libération dans le TGI (Kailasapathy, 2002). La nanoencapsulation,
peut assumer une grande importance dans le futur proche pour développer des préparations
probiotiques qui peuvent être distribuées convenablement dans des régions spécifiques du
Les probiotiques encapsulés peuvent être exploités dans plusieurs domaines de l'industrie alimentaire par exemple la production de biomasse, la production des ferments starters et la production des produits fermentés. Le tableau 2 représente quelques applications de la biotechnologie de l'encapsulation des cellules dans les produits alimentaires ~Kailasapathy, 2002).
Tableau 2. Encapsulation des cellules/ Applications biotechnologiques
! Cultures
B. bifidum, B. infantis
Lb. paracasei
Enterococcus faecium B. bifidum, B. adolescentis 1 B. bifidum, B. infantis et 1 longum 1 Lb. lactis subspp. /actis ! 'i Lb. casei Lactobacil/us 1 Lactococcus 1 Lb. casei - -·-·- -Supports/Mécanismes î Alginat~·d;~alcium
Matière graisse du lait Matière graisse du lait Crème B. ' Alginate de calcium K-carraghenane Alginate Alginate de calcium Alginate de calcium K-carraghenane Produits Mayonnaise Fromage de cheddar Fromage de cheddar Fromage saumuré blanc
Fromage de Crescenzza Fromage frais
L'acide lactique
Dessert glacé Crème
Yaourt
11.2. Les différentes techniques de micrœncapsulation des probiotiques
--- -
~1-- _J
Plusieurs méthodes ont été utilisées pour encapsuler les probiotiques à savoir l'extrusion, l'émulsion et le séchage, la but principal de ces techniques est la protection des cellules bactériennes vis-à-vis des différents stress environnementaux avec un ciblage approprié des cellules vivantes vers le TGI (Hou et al., 2003; Petrovic et al., 2007).
II.2.1. L'extrusion
L'extrusion est la technique d'encapsulation la plus utilisée pour la formation des capsules hydrocolloïdales. Cette technique implique la préparation d'une solution hydrocolloïdale, inoculée par les cellules bactériennes ce qui forme ainsi une suspension bactérienne. L'extruction de la suspension aura lieu à travers l'aiguille d'une seringue d'une façon à donner des gouttelettes (l\!Iortazavian et al., 2007; Petrovic et al., 2007), d'un diamètre de 2 à 5 millimètres.
11.2.2. L'émulsion
Dans cette technique, un petit volume d'une solution aqueuse d'unbiopolymère contenant des
probiotiques (phase discontinue) est ajouté à un volume plus grand d'huiles végétales (phase
continue), cette phase est donc émulsifiée pour former une émulsion de l'eau - dans -l'huile.
Lorsque la taille des gouttelettes désirées est obtenue, la matrice est stabilisée par des liaisons,
puis la phase huileuse est enlevée et les billes peuvent être lavées par une solution qui
contient des ions stabilisants le gel (Kailasapathy, 2002; Petrovic et al., 2007).
11.2.3. Le séchage
Le séchage est une technique utilisée quand l'ingrédient actif est dissout dans des
supports d' encapsulation pour former une suspension. La solution est souvent un
hydrocolloïde comme la gélatine, les gommes végétales, l'amidon modifié et la dextrine. La
solution obtenue est séchée en donnant une barrière de protection contre l'oxygène et les
agents agressifs (Petrovic et
al.,
2007).11.3. Principaux supports de la microencapsulation des probiotiques
Pour l'encapsulation des cellules bactériennes viables, les supports utilisés devraient
être doux et non toxiques que ce soit pour les cellules encapsulées ou pour la santé du
consommateur (Kailasapathy, 2002). Plusieurs systèmes de polymères peuvent être utilisés
pour encapsuler les souches probiotiques notamment :
11.3.1. L'alginate
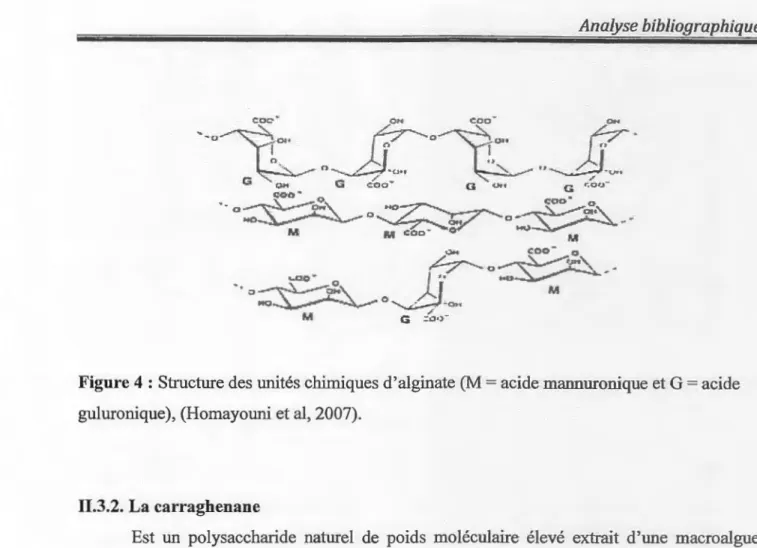
Est un hétéropolysaccharide linéaire, extrait de différents types d'algues rouges. Il est
constitué de deux unités structurales; l'acide D- manuronique et l'acide L-guluronique.
L'acide alginique est un produit intennédiaire dans la fabrication industrielle d'alginate,
l'acide alginique est transformé en alginate commercial par l'incorporation de différents ions
Co~~ CH Cco- OH ~ .,,...~'--•u -~OJ<
l
.L..~/
·o· ,.,,-~~ .!-ou 1 /~,/ .j ,-, - 1 "
"
·
.
"
)_J
Yio"
-
-
-·
"-
-~
-,,.,
'-.
---·
"---
~-
<P
·
G
~
G<:-:;o
-
G '-'" ,., ,.-;,,,-=o
·
~.. Ci -~-....-o?..~ HO----:;r---___ . C:C"'O _ _,_OO
>.o . .- o~ / ~ --~--o -~-~?""-. --- . ~"'Y ...,~-n.~ M O:oo. o ..., M ~ C:ôO o /----. ~' --.~-"" r--/ ... __ 0.- . ' -'-0.0 - J •• >-0 , • o -~_:..__--~;\. 0
)J
M )lQ~-_,.. ~-o,, M G:~.,-Figure 4: Structure des unités chimiques d'alginate (M =acide mannuronique et G =acide
guluronique ), (Homayouni et al, 2007).
11.3.2. La car_raghenane
Est un polysaccharide naturel de poids moléculaire élevé extrait d'une macroalgue marine. Il est souvent utilisé comme additif alimentaire (Anal et Singh, 2007). Sa structure
est constituée par une alternance de Galactose 4- sulfate et 3-6- anhydro D- galactose
2-sulfate. La polymérisation de la carraghenane se fait par diminution de la température en
présence des ions K+ (Leenen, 2000) utilisé souvent sous forme de KCl. Cependant, le KCl a
un effet inhibiteur sur plusieurs souches de bactéries lactiques c'est pourquoi, il est préférable de remplacer le KCl par les ions Rb+, Cs+ et
NW (Mortazavian
et al., 2007).Il.3.3. Cellulose acétate phtalate (CAP)
Ce composé contient un groupement phtalate chargé négativement. Il est soluble à un
pH supérieur à 6 et insoluble à un pH inférieur à 5. A condition de son innocuité à la consommation humaine, il est souvent utilisé dans l'encapsulation des probiotiques et les
préparations pharmaceutiques (Mortazavian et al., 2007).
11.3.4. Chitosane
Est un polysaccharide linéaire obtenu par l'acétylation de la chitine, soluble à un pH
inférieur à 6, sa polymérisation se fait par la fo1mation de liaisons en présence des anions et
des polyanions. Il est souvent utilisé pour former une deuxième couche autour des capsules
11.3.5. Gélatine
La gélatine peut être utilisée pour la microencapsulation des probiotiques, seule ou
mélangée avec d'autres gommes. C'est une gomme protéique thermoréversible, sa nature
amphotérique
lui
donne la capacité d'avoir des effets synergiques avec d'autrespolysaccharides anioniques (Anal etSingh, 2007; Mortazavian et al., 2007).
Il.3.6. Autres supports
Plusieurs d'autres composés sont utilisés dans l'encapsulation des probiotiques tels
que l'amidon, qui est utilisé souvent pour former une deuxième couche autour des capsules
d'alginate, i1 joue un rôle d'un agent protecteur dans les conditions de l'estomac et de
l'intestin (Dimantov et al., 2004; Vidhyalakshmi et al., 2009). Les protéines du lactosérum,
l'huile
de grains de soja et les biogommes (gomme arabique, gomme d'agar, et de xanthane)sont aussi utilisés dans l'encapsulation des probiotiques (Hou et al., 2003).
H.4. L'effet de différents matériels d'encapsulation sur la stabilité des bactéries pro biotiques
Plusieurs bactéries probiotiques comme Lb. rahomnsosus, Bifidobacterium longwn,
Lb. salivarus, Lb. plantarum, Lb. acidophileus, Lb. paracasei, Bifidobacterium Lactis type
B 1-04, B. Lactis type Bi-07 et Bifidobacterium bifidum, ont été encapsulés dans différents
polymères; l'alginate, la gomme gare, la gomme xanthane, la gomme de locuste. La tolérance
de ces bactéries probiotiques à l'acide et aux biles en utilisant des souches probiotiques libres
comme contrôle a été étudiée.
La tolérance des souches probiotiques à l'acide est testée dans un pH=2 pendant 2
heures d'incubation, la tolérance aux biles est testée par l'incubation des souches en présence
d'acide taurocholique pendant 8 heures. La perméabilité des capsules a aussi été étudiée en
utilisant une coloration hydrosoluble; 6- carboxyflourexine (6-CF), celle-ci a été contrôlée
par la mesure de la quantité de 6-CF libéré de la capsule pendant 2 semaines de stockage. Les
résultats ont indiqué que la survie des bactéries probiotiques encapsulées dans l'alginate, la
gomme de xanthane et le carraghenane est mieux que celle des bactéries probiotiques libres.
Tous les matériaux d'encapsulation utilisés libèrent une petite quantité de 6-CF (Ding et
Shah, 2009). Dans une autre étude des souches de Lb. acidophilus et Bifidobacterium isolées
l'encapsulation augmente la survie de Lb. acidophilus par 15,9% et de Bifidobacterium sp. par 16,7% par rapport aux cellules libres (Vidhyalakshmi, 2009).
Lee et al., 2004 ont suggèré que la microencapsulation de Lb. bulgaricus dans l'alginate et le chitosane améliore la survie de ces bactéries probiotiques dans des conditions similaires aux conditions gastriques et intestinales. Ainsi, Hou et al., (2003), ont développé une nouvelle technique qui consiste à la microencapsulation d'une souche de bactéries lactiques Lb. delbruskü spp bulgaricus dans l'huile de sésame artificielle. Les résultats obtenus démontraient une amélioration de la survie de cette souche dans des conditions similaires aux conditions TGI.
II.5. Avantages de la technologie de la microencapsulation des probiotiques
La microencapsulation des probiotiques est généralement utilisée comme la technologie de:
• Protection des souches probiotiques sensibles par l'amélioration de leur viabilité et stabilité
dans les produits alimentaires jusqu'à leur consommation finale, ainsi que dans le TGI. • La fixation et l'amélioration des propriétés organoleptiques des produits alimentaires. • Prolongation de la durée de conservation ou de stockage des produits fermentés contenant
des probiotiques.
•Protection contre la toxicité de 1'02 pour les souches anaérobies pendant le stockage. • Possibilité de leur distribution contrôlée dans le TGI.
• Distribution homogène des cellules pendant la production, cette caractéristique est
importante dans les produits polyphasés et visqueux comme la mayonnaise. (Picot et Lacroix, 2003a; Mortazavian et al., 2007; Petrovic et al., 2007).
II.6. Pharmacologie des probiotiques encapsulés
11.6.1. La survie des probiotiques encapsulés : effet in vivo
La majorité des recherches qui ont étudié l'influence de l'encapsulation sur la survie
des bactéries probiotiques sont faites in vitro par simulation des conditions du TGI. Les études
in vivo sur des animaux sont très rares. Parmi celles-ci, l'étude présentée par Kushal et al.,2006. Leur recherche évalue l'efficacité des cultures probiotiques des lactobacilles et
Bifidobactéries co-irnmobilisées, en termes de survie, et la protection contre la translocation d'un pathogène spécifique Salmonella typhimurium chez des souris modèles décontaminées par l'usage d'antibiotiques. L'augmentation du nombre de bactéries probiotiques viables dans
le TGI démontrait qu'une meilleure protection était obtenue chez l'hôte lors de l'ingestion de la co-culture encapsulée, comparée aux cultures individuelles non encapsulées.
Ces résultats réaffirment que l'administration d'un nombre élevé de la culture co-immobilisée réduit la translocation vers les organes extra intestinaux d'entéropathogènes tels que Salmonella typhimurium et réduit par la même manière l'infection chez l'hôte. Au cours de l'étude, il a été observé que le taux de survie des souris prétraitées par des co-cultures immobilisées était de 100% contre 33% pour le témoin. Une augmentation substantielle des anticorps circulant était observée après 10 jours d'ingestion de la préparation. De même les activités des enzymes lysosorniales des macrophages péritonéaux étaient, de façon générale,
plus élevées pour le groupe ayant reçu les cultures co-immobilisées par rapport au groupe témoin 2,07 et 1, 18 fois plus élevée pour la ~-glucuronidase et la galactosidase réspectivement (Kushal et al., 2006).
11.6.2. La livraison ciblée des probiotiques encapsulés dans le TGI
Le développement des systèmes de livraison des composés bioactifs va bien loin dans les applications alimentaires. L'utilisation des capsules pour protéger les composés durant leur passage à travers le TGI humain prend une importance considérable, et elle semble essentielle pour optimiser la distribution des probiotiques (Dimantove et al., 2004;
Vidhyalakshmi et al., 2009). Cette dernière aura lieu via l'utilisation de matériaux d'encapsulation entériques.
La majorité de ceux-ci réagit avec le changement de pH, et donc la libération de l'ingrédient bioactif est déterminée par le pH local dans l'intestin. A cause de l'augmentation de la solubilité de ces polymères dans des pH de 4.8 à 7.2, et puisque le pH de l'intestin grêle est de 6.2 à 8.0, les systèmes d'encapsulation basés sur ces polymères libèrent leurs contenus dans l'intestin grêle et ratent la livraison des ingrédients actifs vers le colon.
Pour atteindre le colon, un polymère à base d'amidon de maïs à haute teneur en amylose additionné de 20% d'amidon résistant a été développé (l'amidon résistant est l'amidon qui ne peut pas être dégradé par l'amylase pancréatique et par conséquent la capacité d'arriver au colon). De plus, l'amidon résistant offre une surface pour l'adhérence des probiotiques sur les granules d'amidon pendant la fabrication, le stockage et le passage à travers le TGI, cette adhérence peut être exploitée pour développer de nouvelles technologies de livraison ciblée
des probiotiques dans le TGI (Dimantove et al., 2004; Anal et Singh, 2007; Mortazavian et
al., 2007).
D'autres polymères tel que les protéines du lactosérum possèdent la propriété de résistance aux conditions gastriques ce qui offre la capacité d'encapsuler des probiotiques par ce gel pour cibler leur libération vers l'intestin (Picot et Lacroix, 2003b). Ainsi le gel de CAP est soluble dans des pH supérieurs à 6, de plus il est physiologiquement inerte quand il est administré in vivo, à cause de ces raisons, il est souvent utilisé comme matériel d'encapsulation entérique pour cibler la libération des ingrédients actifs tel que les probiotiques dans l'intestin. (Mortazavian et al., 2007).
II. Matériel et Méthodes
Notre travail a été réalisé au Laboratoire de Microbiologie de l'Université de Jijel
II. 1.Matériel
IJ.1.1. Matériel biologique II.1.1.1. Bactéries probiotiques
Deux souches de bactéries probiotiques ont été utilisées à savoir : Lactobacillus
curvatus et Lactobacillus plant arum isolées du jabot de poulet de chair de souche ISA 15 (Laboratoire de Phytopharmacologie. Université de JIJEL)
II.1.1.2. Souches utilisées
Les souches bactériennes utilisées pour le test de l'activité antibactérienne sont: Klebsiella sp. (isolée dans Laboratoire de Microbiologie de l'hôpital de Jijel).
E. coli (isolée à partir du tube digestif du lapin).
E. coli ATCC 2592l(souche standaire).
Staphylococcus aureus (isolée à partir de jabot de poulet de chaire).
II.1.1.3. Animaux de laboratoire
Les animaux utilisés au cours de cette étude sont des lapins d'origine locale d'un poids moyen d'environ 1.5 Kg.
II.1.2. Produits et réactifs
>-
Milieu MRS (ManRogosaSharpe, 1960) liquide et gélosé (Institut PASTEURd'ALGER).
>-
Géloses : Hektoène, Chapman, Mueller Hinton. (Institut PASTEUR d'ALGERIE).>-
Colorants de Gram (Violet de Gentiane, Fushine et Lugol).>-
L'alginate de sodium de grade alimentaire (Louis François)>-
HCl de IN>-
Eau physiologique>-
Sels biliaires (Institut PASTEUR d'ALGER).>-
Eau distillée>-
Acide acétique de 1 N~ Tampon phosphate 2M (K2HP04; KH2PÜ4)
~ Disques d'antibiotiques: Erythromycine15µg (Biorad); Oxacillinelµg (Biomerieux); Amoxicilline25µg (Biorad); Pénicilline G5µg (Baringstoke) et Spyramycine lOO~tg (Biorad).
II.1.3. Appareillage
../ pH mètre (Hanna)
../ Papier pH (VWR PROLABO) .
../ Bain marie- agitateur ../ Etuve (Mernmert)
../ Microscope optique (Olympus) ../ Four pasteur (Controls)
../ Seringues
../ Spectrophotomètre (UV Shimandzu) .
../ Centrifugeuse (Hettich) ../ Vortex
../ agitateur magnétique mc8 (Bensen) ../ Balance
../ Filtres millipores (0.22 µm) ../ Sonde gastrique
II.2. Méthodes
H.2.1. Préparation des souches bactériennes:
Les souches probiotiques lyophilisées de Lb. plantarum et Lb. curvatus, ont été cultivées sur un bouillon MRS et incubées à 37°C pendant 48 h. La pureté des souches a été vérifiée sur gélose MRS, les boites de Pétri contenant la gélose MRS préalablement coulée et séchée sont ensemencées par étalement de quelques gouttes de chaque souche, l'incubation est faite à
37°C pendant 24h, la souche est dite pure si on obtient des colonies homogènes de même
forme, même taille et même couleur.
II.2.2. Étude de la sensibilité des bactéries probiotiques aux antibiotiques
La gélose MRS a été ensemencée à partir des dilutions standarisés des cultures
souches à 660 rnn est 0.226 pour Lb. plantarum et 0.150 pour Lb. curvatus. Ensuite, les disques d'antibiotiques Erythromycine; Oxacilline; Amoxicilline; PenicillineG et
Spyramycine sont déposés à la surface du milieu, après incubation à 37C0 pendant 24h on détermine le diamètre des zones d'inhibition (Joffin et Leyral, 2006).
II.2.3. Évaluation de l'activité antimicrobienne des bactéries probiotiques
L'activité antimicrobienne des deux souches probiotiques contre 4 souches de bactéries a été étudiée par la technique de diffusion par disques selon Tagg et al. (1976).
Dans un premier temps, l'activité antimicrobienne de chaque culture lactique a été
évaluée. La gélose Hektoène a été ensemencée par étalement de cultures fraîches des souches
suivantes: E. coli ATCC 25921, E. coli, Klebsiella sp. et Staphylococcus aureus à l'aide d'écouvillons stériles et dont la densité optique à 625 rnn a été ajustée à 0.06. Des disques de papier filtre stérile de 5 mm de diamètre préalablement imbibés par 50 µl de la culture lactique fraîchement préparée ont été déposés sur les boites de Pétri déjà ensemencées, après
une incubation à 37 °C pendant 24 h, les diamètres des zones d'inhibition sont mesurés.
L'activité inhibitrice du surnageant natif (obtenu après centrifugation des cultures en
milieux liquides) et celui ajusté à pH 7 à été également évaluée par application de la même,
technique de diffusion par disques.
L'étude de l'effet du surnageant a été étudié comme suit (Tagg et al., 1976).
>
Préparation de cultures jeunes (âgées de 18 h) de bactéries lactiques par ensemencementdu bouillon MRS par des cultures âgées de 24 h. Après une centrifugation à froid à 7000
tr/1 Omin, les sumageants sont récupérés et filtrés sur un filtre millipore de porosité 0,22µm ;le pH de la moitié du filtrat obtenu et ajusté à pH 7 par NaOH (3N).
>
La même technique de diffusion sur disque a été appliquée et les diamètres des zonesd'inhibition sont mesurés.
II.2.4. Encapsulation des souches probiotiques dans un gel d'alginate de sodium à 1 %
Les souches lactiques; Lb. curvatus et Lb. plantarurn ont été cultivées dans le bouillon MRS à 37°C pendant 20 h puis les cellules sont recueillies par centrifugation (3000 tours
la suspension bactérienne, celle-ci a été mélangée avec 90 ml d'une solution d'alginate de
sodium à 1 %. Le mélange ainsi obtenu a été introduit dans une seringue stérile. La gélification
est faite comme suit: la suspension a été laissée couler en goutte à goutte dans la solution de
coagulation CaCb (O.OSM) préalablement refroidie, les billes formées étaient ensuite laissées
une heure sous une agitation douce afin de compléter l'échange ionique Na ++-Ca++. Toutes ces
opérations étaient réalisées aseptiquement. Les billes étaient alors lavées deux fois avec l'eau
distillée stérile afin d'éliminer l'excès de calcium (Boyaval et al, 1985).
Les billes d'alginate de sodium ont été maintenues dans du sérum physiologique dans un
réfrigérateur jusqu'à usage ultérieur.
La concentration finale en cellules était égale à 59.1011 cellules/ bille pour Lb. plantarum et
88. 1011 cellule/ bille pour Lb. curvatus Le poids d'une bille est estimé à 0.01 g.
II.2.5. Évaluation des aptitudes probiotiques des bactéries lactiques in vitro
11.2.5.1. La tolérance aux acides
La tolérance des souches encapsulées et libres à l'acidité a été réalisée selon la méthode
de Liong et Shah (2004), le pH du bouillon MRS a été ajusté à 2 par l'acide acétique, un
échantillon de chaque culture probiotique fraîchement préparé servira pour l'inoculation du
bouillon MRS dont le pH a été ajusté à 2, la culture est incubée à 3 7°C pendant 2 h, et 1 ml de
la culture est recueilli à 0 h, 1 h et 2 h. Des séries décimales de dilution sont réalisées afin
d'effectuer un dénombrement des cellules viables sur gélose MRS, les cultures sont incubées
à 3 7°C pendant 24 h.
Pour le dénombrement des cellules encapsulées, les bactéries sont libérées des capsules
par séquestration des ions calcium par le tampon phosphate: 5 billes d'alginate contenant les
cellules bactériennes ont été suspendus dans lml de tampon phosphate de 2N et pH7 après
dissolution complète du gel, 1 ml de la solution était recueilli et dilué conformément à la
technique de dénombrement citée afin de déterminer le nombre de cellules viables.
La tolérance à l'acide est déterminée par la comparaison du nombre de bactéries final après 2
h avec le nombre initial.
11.2.5.2. La tolérance aux sels biliaires
La tolérance des souches à la bile a été étudiée selon la méthode de Liong et Shah
(2004). Le bouillon MRS contenant 0,3% de sels biliaires est inoculé par un échantillon de