ANNEE: 2012
Faculté de Médecine et de Pharmacie de Rabat
UFR Doctoral : Substance naturelles : Etude chimique et biologique Spécialité: Pharmacologie, Toxicologie et Pharmacognosie
THESE DE DOCTORAT
VALORISATION PHARMACOLOGIQUE D’ALOE PERRYI BAKER ET JATROPHA UNICOSTATA BALF, PLANTES ENDEMIQUES DU YEMEN: TOXICITE,
POTENTIEL ANTI INFLAMMATOIRE ET ANALGESIQUE Equipe de Recherche de Pharmacodynamie ERP
Présentée et soutenue par
Mr. MOSA’D ALI MOSA’D AL-SOBARRYLe 28 Décembre 2012
JURY
Professeur Yahia Cherrah Président Faculté de Médecine et de Pharmacie - Rabat
Université Mohammed V- Souissi
Professeur Katim Alaoui Directeur de Thèse Faculté de Médecine et de Pharmacie -Rabat
Université Mohammed V- Souissi Professeur Amina Zellou
Faculté de Médecine et de Pharmacie - Rabat Université Mohammed V - Souissi
Professeur Abdelaziz Benjouad Faculté des Sciences - Rabat
Directeur générale de Centre National de Recherche Scientifique et Technique - Rabat Professeur Najib Gmira
Faculté des Sciences - Kénitra Université Ibn Tofail -Kénitra
Professeur Mohammed Akssira
Faculté des Sciences et Technique - Mohammedia
Université Hassan II - Mohammedia Professeur Naima Saidi
Rapporteurs
Examinateurs
ﻢﯿﺣﺮﻟا ﻦﻤﺣﺮﻟا ﷲا ﻢﺴﺑ
﴿
ﺎﻤﻠﻋ ﻲﻧﺩﺯ ﺏﺭ ﻞﻗﻭ
﴾
ﻢﻴﻈﻌﻟﺍ ﷲﺍ ﻕﺪﺻ
" ﺔﯾآ ﮫﻃ ةرﻮﺳ : 114 "
Je dédis cette thèse à
L’âme de mes honorables grands-pères.A ma mère A mon père
A ma femme et mes enfants A mes sœurs et frères A toute ma famille sans exception.
Aucun mot, aucune dédicace ne sourie exprimer mon respect, ma considération et l'amour éternel que je vous porte, veuillez trouver dans ce travail toute ma gratitude. Que dieu vous protège et vous procure santé et bonheur.
Ce travail a fait l’objet de:
I. Publications Internationales:1- Mosa’d Al-sobarry, Ahmed Alwashli, Yahia Cherrah and Katim Alaoui:« Anti-inflammatory Activities of Methanolic extract of Jatropha unicostata balf (Sibru) and Ethanolic extract of Aloe perryi baker (taife), as endemic plants in Yemen»; International Journal of Natural Product and Pharmaceutical Sciences ; 2011 Volume 2: Issue 2: 40-55.
2- Mosa’d Al- sobarry, Ahmed Alwashli, Yahia Cherrah and Katim Alaoui:« Analgesic Activity of Methanolic extract of Jatropha Unicostata Balf, as endemic plant in Yemen»; International Journal of Pharma and Bio Sciences ; 2011, Vol 2, Issue 4, PP. 375 -381.
3-Mosa’d Al-Sobarry, Ahmed Alwashli, Yahia Cherrah et Katim Alaoui : «« Toxicité aiguë et Action Analgésique d'extrait éthanolique des feuilles d'Aloe perryi Baker, plante endémique du Yémen» ; Phytothérapie ; Accepté , Avril 2012.
4- Ahmed Alwashli, Mosa’d Al-sobarry, Rachad Alnamer, Yahia Cherrah and Katim Alaoui :«Analgesic and Anti-inflammatory Activities of Boswellia elongate balf Methanolic Extracts, as endemic Plants in Yemen»; Journal of Biologically Active Products from Nature; 2012 Vol 2 (2) ; pp 90 – 98.
5- Ahmed Alwashli, Mosa’d Al-sobarry, Yahia Cherrah and Katim Alaoui: « Anti-inflammatory and Analgesic effects of Ethanol Extract of Dracaena Cinnabari Balf, as endemic plant in Yemen ; International Journal of Pharma and Bio Sciences ; 2012 ; vol3, issue 2. PP. 96-106.
6- A.Alwashli, M.AlSobarry, Y.Cherrah et K.Alaoui : «Toxicité aiguë et Activité Analgésique de l'extrait Méthanolique de Rumex nervosus Vahl» ; Phytothérapie, 2012 ; pp . 293-297.
7- Rachad Alnamer1, Katim Alaoui, Latifa Doudach, El Houcine Bouidida, Fatiha Chibani, Mosa’d AL-Sobarry, Abdelaziz Benjouad1, and Yahia Cherrah:«Investigation of Methanolic and Aqueous extract of Lavandula Officinalis for Toxicity and Antibacterial Activity» ; World Journal of Pharmaceutical Research; 2012 ; Vol. 1, Issue 5, PP. 1223- 1233.W
8- Rachad Alnamer1, Katim Alaoui, Latifa Doudach, El Houcine Bouidida, Fatiha Chibani, Mosa’d AL-Sobarry, Abdelaziz Benjouad1, and Yahia Cherrah: « In
II. Communications à des congrès Internationales:
1- Mosa’d Al- sobarry, Ahmed Alwashli, Yahia Cherrah and Katim Alaoui:« Analgesic Activity of Methanolic extract of Jatropha Unicostata Balf, as endemic plant in Yemen»; Les Journées Internationales sur Substances Naturelles et Développement Durabl. Faculté des Sciences Rabat –Agdal(Maroc) ; Les 22 – 23 Juin 2012.
2- Mosa’d Al-sobarry, Ahmed Alwashli, Yahia Cherrah and Katim Alaoui:«Anti-inflammatory Activities of Methanolic extract of Jatropha unicostata balf (Sibru) and Ethanolic extract of Aloe perryi baker (taife), as endemic plants in Yemen»; 1er International Congrès de Pharmacologie Organase par La Société Marocaine de Pharmacologie ; les 03 et 04 mai 2012.
3- Mosa’d Al-Sobarry, Ahmed Alwashli, Yahia Cherrah et Katim Alaoui : «Toxicité aiguë et Action Analgésique d'extrait éthanolique des feuilles d'Aloe perryi Baker, plante endémique du Yémen »; 1er International Congrès de Pharmacologie Organase par La Société Marocaine de Pharmacologie ; les 03 et 04 mai 2012.
4- Mosa’d Al- sobarry, Ahmed Alwashli, Yahia Cherrah and Katim Alaoui: « Analgesic Activity of Methanolic extract of Jatropha Unicostata Balf, as endemic plant in Yemen»;1er International Congrès de Pharmacologie Organase par La Société Marocaine de Pharmacologie ; les 03 et 04 mai 2012.
5- Ahmed Alwashli, Mosa’d Al-sobarry, Rachad Alnamer, Yahia Cherrah and Katim Alaoui: «Analgesic and Anti-inflammatory Activities of Boswellia elongate balf Methanolic Extracts, as endemic Plants in Yemen»; »; Les Journées Internationales sur Substances Naturelles et Développement Durabl. Faculté des Sciences Rabat – Agdal(Maroc) ; Les 22 – 23 Juin 2012.
6-A.Alwashli, M.AlSobarry, Y.Cherrah et K.Alaoui : «Toxicité aiguë et Activité Analgésique de l'extrait Méthanolique de Rumex nervosus Vahl» ; Les Journées Internationales sur Substances Naturelles et Développement Durabl. Faculté des Sciences Rabat –Agdal(Maroc) ; Les 22 – 23 Juin 2012.
Je tiens à exprimer mes vifs remerciements à:
Monsieur le Président de l'Université Mohammed V - Soussi, le Professeur Radouane MRABET, pour l'accueil chaleureux et pour ses aides précieuses et pour son extrême gentillesse.
Madame le Doyen de la Faculté des Médecine et de Pharmacie de Rabat, le professeur Najia HAJJAJ, pour les nombreuses facilités qu'elle n'a cessé d'accorder aux étudiants étrangers inscrits en Doctorat.
Madame le professeur Katim ALAOUI, responsable l'UFR: Substances naturelles et Directrice de ma thèse, pour avoir autorisé mon inscription en Doctorat : Pharmacologie et Toxicologie, pour toute l'attention et la disponibilité dont elle a fait preuve durant ces des années d'initiation à la recherche scientifique. Elle a dirigé et suivi de très près ce travail de recherche malgré ses diverses préoccupations. C'est grâce à ses suggestions, remarques et critiques que ce travail a pu être effectué. Veuillez trouver Madame dans ces mots l'expression de mes vifs remerciements et de mon profond respect.
Je remercie profondément Mr. Professeur Yahia CHARRAH, Vice Doyen de la Faculté de Médecine et de Pharmacie de Rabat, Directeur de Laboratoire de Pharmacologie et Toxicologie à la Faculté de Médecine et de Pharmacie de Rabat pour son accueil au sein de son laboratoire et sans lui ce travail ne pourra avoir lieu. Votre soutien, et votre aide précieuse et votre extrême gentillesse étaient pour moi un très grand support pour la réalisation de ce travail. Veuillez trouvez dans quelques mots l'expression de mes vifs remerciements et de mon profond respect. Aussi, je vous remercie profondément pour l'honneur que vous me faites en acceptant de présider le jury de ma thèse.
Je tiens également à remercier Monsieur le professeur Abdelaziz BENJOUAD, Professeur à la Faculté des Sciences de Rabat et Directeur du Centre National pour la Recherche Scientifique et Technique (CNRST), pour la bienveillante attention qu'il a accordé à ce travail et pour la participation à ce jury.
Je remercie profondément Mr. Professeur Najib GMIRA, Professeur à la Faculté des Sciences de Kenitra, pour la bienveillante attention qu'il a accordé à ce travail. Je le remercie profondément j’avoir bien voulu accepter de siéger dans ce jury.
Je remercie très respectueusement Mme. Naima SAIDI, Professeur à la Faculté des Sciences de Kenitra, pour la bienveillante attention qu'elle a accordée à ce travail et pour la participation à ce jury. Veuillez trouvez Mme l’expression de ma profonde reconnaissance.
Je tiens également à remercier Monsieur le professeur Mohammed AKSSIRA, Professeur à la Faculté des Sciences et Techniques de Mohammedia, pour la bienveillante attention qu'il a accordée à ce travail et pour la participation à ce jury.
Je tiens à exprimer mes sincères remerciements à tous les membres de Laboratoire de Pharmacologie et Toxicologie de notre Faculté.
Aussi, je ne saurais oublier, Mr. Rashad ALNAMER, Mr. Ahmed ALWACHALI, Doctorants en Pharmacologie et Toxicologie à la Faculté de Médicine et de Pharmacie de Rabat, pour leurs aides précieuses et pour leurs extrême gentillesse. Veuillez trouvez dans quelques mots l'expression de mes vifs remerciements et de mon profond respect.
Je remercie très sincèrement tous mes collègues, EL Houcine BOUIDIDA, Mostafa BOATIA, Maeen ALSUBARI, Alwan ALSUBARI, Rassam ALSUBARI, Walid ABDALRAB, Pour leurs extrêmes gentillesses. Veuillez trouvez dans quelques mots l'expression de mes vifs remerciements et de mon profond respect.
Ne oublier pas mes remerciements aux Madames et messieurs : Hayat AOUARI, Amane ELHACHMIA, Fatiha AGGA, Ahmed LAFROUHI et Mohammed ASRI Pour leurs extrêmes gentillesses. Veuillez trouvez dans quelques mots l'expression de mes vifs remerciements et de mon profond respect.
Je remercie très sincèrement tous mes collègues de Doctorat: De Pharmacologie et Toxicologie.
Je ne peux pas vous citer tous, Etudiants - Chercheurs, Collègues et amis; je vous dois beaucoup, je ne l'oublie pas. A toutes et à tous, du fond du cœur, Merci.
En fin, pour tous ceux qui ont contribué de prés ou de loin dans l’élaboration de ce travail, qu’ils trouvent ici l’expression de mes sentiments de reconnaissance.
Sommaire
INTRODUCTION GENERALE ... 1
PARTIE REVUE DE LA LITTERATURE I. Généralités sur les plantes aromatiques et médicinales (PAM) ...4
I. 1. Historique ...4
I. 2. Introduction ...5
I. 2.1. Définition ...6
I.3.Classification des plantes incluses dans le secteur des plantes aromatiques et médicinales (PAM) selon les domaines d’utilisation ...6
I.3.1. Plantes et extraits de plantes à intérêt médicinal ...6
I. 3.2. Plantes à intérêt aromatique ...6
I.4. Aloès ...7
I.4.1. Historique ...7
I.4.2. Aloe perryi Baker (Aloeaeceae): ...8
I.4.3. Description et habitat ...9
I.4.4. Bienfaits et utilisations traditionnelles ...9
I.4.5. Données phytochimiques ...9
I.4.6. Données Pharmacologiques ... 10
I.5. Jatropha ... 10
I.5.1. Jatropha unicostata balf ... 10
I. 5.1.1. Classification ... 10
I. 5.1.2. Description et habitat ... 11
I. 5.1.3. Utilisation traditionnelle ... 11
I. 5.1.4. Données Phytochimiques ... 11
I. 5.1.5. Données Pharmacologiques ... 12
I.6. Les principales structures chimiques des deux plantes étudiées ... 12
II. Généralités sur l’inflammation, médicament anti inflammatoires et anti inflammatoires d’origine végétale ... 18
II. 1. Inflammation... 18
II. 1.1. Définition ... 18
II.1. 2. Causes de l’inflammation... 18
II.1.2.1. Cause exogènes ... 18
II.1. 2.2. Causes endogènes ... 18
II.1.3. Les différentes phases d’inflammation ... 19
II.1.3.1. Phase vasculaire de l’inflammation ... 19
II.1.3.1.1. Congestion active... 19
II.1.3.1.2. Œdème inflammatoire ... 19
II.1.3.1.3. Diapédèse leucocytaire ... 20
II.1.3.2. Phase cellulaire ... 21
II.1.3.3. Phase de réparation... 21
II.1.3.3.1. Détersion ... 21
II.1.3.3.2. Coaptation ... 22
II.1.3.3.3. Régénération ... 22
II.1.4. Principaux médiateurs de l’inflammation ... 23
II.1.4.1. Médiateurs humoraux ... 23
II.1.4.2. Médiateurs cellulaires ... 24
II.1.4.3. Généralisation ... 24
II.2.1. Points d’impacts des thérapeutiques anti-inflammatoires... 25
II.2.1.1. Glucocorticoïdes ... 25
II.2.1.2. 1. Cytokines antagonistes ... 26
II.2.1.2 .2. Récepteurs solubles des cytokines ... 26
II.2.1.2. 3. Anticorps anti-cytokines... 26
II.2.1.3. Effets cibles sur les médiateurs lipidiques ... 26
II.2.1.4. Effets cibles sur les chémokines et les molécules d’adhérence ... 27
II.2.1.4. 1. Actions anti-chémokines ... 27
II.2.1.5. Actions ciblées sur les lymphocytes CD4+ ... 28
II.2.2 Classification des anti-inflammatoires ... 28
II.2.2.1. Principaux AINS classiques ... 28
II.2.3. Mécanismes d’actions et effets pharmacologiques ... 29
II.2.3.1. Glucocorticoïdes ... 29
II.2.3.1.1.Propriétés anti- inflammatoires et immunosuppressives ... 30
II.3.1.2. Autres propriétés ... 30
II.2.3.1.2.1. Propriétés liées à l’effet glucocorticoïde ... 31
II.2.3.1.3. Propriétés liées à l’effet minéralocorticoïde ... 31
II.2.3.2. Anti-inflammatoires non stéroïdiens ... 31
II.2.4. Indications ... 32
II.2.4.1. Indications des glucocorticoïdes ... 32
II.2.4.2. Indications des AINS: ... 33
II.2.5. Effet s indésirables des anti-inflammatoires ... 34
II.2.5.1. Effets indésirables des glucocorticoïdes ... 34
II.2.5.1.1. Effets prévisibles, liés aux propriétés pharmacologiques ... 34
II.2.5.1.2. Accidents de « sevrage » et hypocortisolisme endogène à l’arrê brutal35 II.2.5.1.3. Accidents digestifs ... 35
II.2.5.1.4. Immunosuppression ... 35
II.2.5.1.5. Effets imprévisibles plus rares ... 35
II.2.5.2. Accidents des AINS ... 35
II.2.5.2.1. Accidents liés à l’inhibition des PG ... 35
II.2.5.2.1.1. Accidents gastro-intestinaux ... 35
II.2.5.2.1.2. Asthme et bronchospasme ... 36
II.2.5.2.1.3. Accidents rénaux ... 36
II.2.5.2.1.4. Accidents indépendants des Prostaglandines ... 36
II.2.5.2.1.4.A. Réactions cutanées ... 36
II.2.5.2.1.4.B. Réactions hématologiques ... 36
II.2.5.2.1.4.C. Réactions hépatiques ... 37
II.2.5.2.1.4.D. Néphropathies monocellulaires ... 37
II.2.5.2.1.4.E. Syndrome de Reye ... 37
II.2.6. Interactions médicamenteuses ... 37
II.2.6.1. Glucocorticoïdes ... 37
II.2.6.2. Interactions médicamenteuses des AINS ... 37
II.2.7. Contre indications ... 38
II.2.7.1. Contre-indications principales des glucocorticoïdes ... 38
II.2.7.2. Contre indications des AINS... 38
II.3. Les anti-inflammatoires d’origine végétale ... 38
III. Généralités sur la douleur, Analgésiques et Analgésiques d’origine végétale ... 45
III.1. La douleur et ses principales voies de transmission: ... 45
III.1.1. Classification de la douleur... 45
III.1.2. Le message douloureux ... 46
III.2. Généralités sur l’analgésie ... 47
III.2. 2.2.1. Mécanisme d’action de la morphine ... 49
III.2. 2.2.2. Les agonistes morphiniques ... 49
III.2. 2.2.3. Pharmacodynamie ... 49
III.2. 2.2.4. Indications ... 51
III.2. 2.2.5. Effets indésirables... 52
III.2. 2.2.6. Contre-indications ... 53
III.2. 2.3. Analgésiques non morphiniques ... 53
III.2. 2.3. 1. Analgésiques antipyrétiques ... 54
III.2. 2.3.2. Analgésiques non antipyrétiques ... 56
III.3. Les Co-analgésiques ... 56
III.4. Les analgésiques d’origine végétale ... 58
PARTIE PRATIQUE : ETUDE EXPERIMENTALE I. Etude toxicologique ... 63
I. 1. Introduction ... 63
I. 2. Etude de la toxicité aiguë:... 64
I. 2.1. Détermination de la Dl50 ... 64
I.2.1.1. Différentes méthodes de détermination de la DL50 ... 65
A. Etude de la toxicité aigue selon la directive de l’OCDE code 423 ... 65
B. Méthode de Karber et Behrens. ... 65
C. Méthode de Miler et Tainter ... 66
D. Méthode de Leitchfield et Wilcoxon ... 66
I.2.1.2. Etude de la toxicité aiguë d’Aloe perryi Baker et de Jatropha unicostata Balf ... 67
A. Origine d'échantillonnage ... 67
B. Extraction ... 67
B.1. Le matériel végétal ... 67
B.2. Méthodes d’extraction ... 67
B. 3. Etude de la toxicité aiguë d’Aloe perryi Baker et de Jatropha unicostata Balf par voie orale ... 68
I.2.1.3. Résultats ... 70
I.2.1.3.1. Obtention des extraits des deux plantes étudiées ... 70
I.2.1.3.1. A. Toxicité aiguë de l’extrait d’Aloe perryi baker administré par voie orale ... 70
I.2.1.3.1. A.1. Evolution pondérale ... 72
I.2.1.3.1.B. Toxicité aiguë de Jatropha unicostata Balf administré par voie orale ... 74
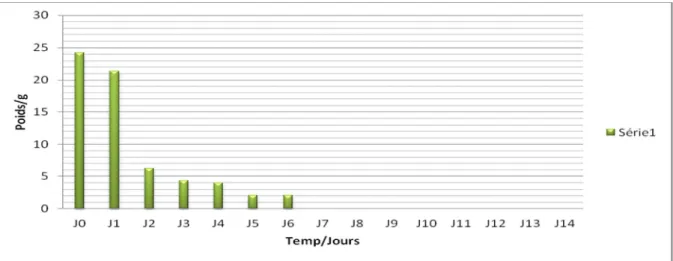
I.2.1.3.1. B. 1. Evolution pondérale ... 75
I.3. Etude Toxicologique par voie cutanée... 78
I.3.1. Etude de la toxicité aiguë et subchronique d’Aloe perryi Baker et de Jatropha unicostata Balf par voie cutanée ... 78
I.3.1.1. Préparation de la crème à base à partir de l’extrait fixe: ... 79
I.3.2. Etude de la toxicité de l’extrait par voie cutanée chez le rat ... 79
I.4. Résultats ... 81
I.4.1. Etude de la toxicité aiguë d’extrait éthanolique d’Aloe perryi Baker administré par voie cutanée chez les rats ... 81
1.4.1.1- Observations générales des effets d’extrait éthanolique d’Aloe perryi Baker chez les rats mâles. ... 82
I.4.1.2. Observations générales des effets de l’extrait éthanolique d’Aloe perryi Baker chez les rats femelles ... 84
I.4.2. Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe perryi Baker administré par voie cutanée chez les rats ... 86 I.4.3. Etude de la toxicité aiguë d’extrait méthanolique de Jatropha unicostata Balf par
voie cutanée chez les rats ... 93
I.4.3. 1. Observations générales des effets de l’ extrait méthanolique de Jatropha unicostata chez les mâles. ... 94
I.4.3.2. Observations générales des effets de Jatropha unicostata Balf chez les femelles. ... 96
I.4.4. Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats ... 98
I.4.4.1. Observations générales des effets del’extrait méthanolique de Jatropha unicostata Balf chez les mâles. ... 98
I.4.4.2. Observations générales des effets de Jatropha unicostata Balf chez les femelles. ... 101
I.4.4.3. Evolution pondérale ... 104
II. Etudes Pharmacologiques ... 107
II.1. Activités anti-inflammatoires de l'extrait méthanolique de Jatropha unicostata Balf (Sibru) et de l’extrait éthanolique d’Aloe perryi Baker (taife). ... 107
II.1.1. Introduction ... 107
II.1.2. Matériels et méthodes ... 109
II.1.2. 1. Matériel végétal ... 109
II.1.2.2. Préparation de l'extrait ... 109
II.1.2.3. Animaux ... 110
II.1.2. 1.4. Matériel ... 111
II.1.2. 1.5. Activité anti-inflammatoire ... 112
II.1.2. 1.5.1. Œdème Induit par la carragéenine ... 112
II.1.2. 1.5.2. Œdème Induit par Traumatisme expérimental ... 113
II.1.3. Résultats ... 114
II.1.3. 1. Activité anti-inflammatoire ... 114
II.1.3. 1. 1. Œdème induit par le Carragéenine... 114
II.1.3.1.2. Œdème induit par traumatisme expérimentalement ... 121
II.2. Action analgésique de l’extrait méthanolique de feuilles de Jatropha unicostata Balf et de l’extrait éthanolique des feuilles d’Aloe perryi Baker ... 128
II. 2. 1. Introduction ... 128
II. 2. 2. Matériels et méthodes ... 129
II. 2. 2.1. Matériel végétal ... 129
II. 2. 2. 2. Obtention d’extrait éthanolique ... 129
II. 2. 2. 3. Animaux ... 129
II. 2. 2. 4. Etude de l’action analgésique ... 130
II. 2. 2. 4. 1. Action analgésique périphérique ... 130
II. 2. 2. 4. 2. Action analgésique centrale ... 130
II. 2. 2. 5. Analyses statistiques ... 131
II. 2. 3. Résultats ... 131
II. 2. 3. 1. Action analgésique périphérique ... 131
II. 2. 3. 2. Action analgésique centrale ... 136
DISCUSSION ... 140
CONCLUSION GENERALE ... 145
REFERENCES BIBLIOGRAPHIQUES ... 147 ANNEXES
LISTE DES ABREVIATIONS A.M.M : autorisation de mise sur le marché AAS : acide acétylsalicylique
ACTH : hormone d’adrénocorticotrophine AINS : Anti-inflammatoire non stéroïdien APB : Aloe perryi Baker
APEE : Aloe perryi d’éxtrait éthanolique CMH : Complexe majeur d’histocompatibilité
COX : cyclo-oxygénase
CYS LT1 : Cysteinyl leucotriène 1 CYS LT2 : Cysteinyl leucotriène 2 DL0 : dose létale 0
DL50 : dose létale 50
DMM : La dose mortelle minimale FSH : follicle stimulating hormone GC : Glucocorticoïdes
HE : Huile essentielle HTA : Hypertension artérielle
IEC : inhibiteurs de l’enzyme de conversion IL : Interleukine
IL-1 : Interleukine 1 IL-10 : Interleukine 10 IL-6 : Interleukine 6 IL-8 : Interleukine 8
JUB : Jatropha unicostata Balf
JUME : Jatropha unicostata d’éxtrait méthanolique LH : hormone lutéinisante LTA4 : leucotriène A4 LTC4 : leucotriène C4 LTD4 : leucotriène D4 LTE4 : leucotriène E4 NFkB : nuclear factor-kappa B NMDA : N-Methyl-D.Aspartate
OMS : Organisation mondiale de santé PAM : plantes aromatiques et médicinales PD : patte postérieure droite
PG : patte postérieure gauche PG : Prostaglandines
PNE : Polynucléaire éosinophile PNN : Polynucléaire neutrophile
PRI : Protéine de la réaction inflammatoire SNC : système nerveux central
TGFB : Transforming growth factor B
THI : T helper
Liste des Figures
Figure. 1: Modèle pour le mécanisme d’action des glucocorticoïdes
Figure. 2: Taux de Mortalité en fonction des doses de l’extrait éthanolique d’Aloe perryi Baker administré par voie orale.
Figure. 3: Evolution du poids moyen de souris traitée à la dose 300mg/kg d’Aloe perryi administrée par voie orale en fonction du temps en jours.
Figure.4: Evolution du poids moyen des souris traitées à 500mg/kg d’Aloe perryi administrée par voie orale en fonction du temps en jours.
Figure .5: Evolution du poids moyen des souris traitées à 2000mg/kg d’Aloe perryi administrée par voie orale en fonction du temps en jours.
Figure.6: Evolution du poids moyen des souris traitées à 4000mg/kg d’Aloe perryi administrée par voie orale en fonction du temps en jours.
Figure.7: Evolution du poids moyen des souris traitées à 5000mg/kg d’Aloe perryi administrée par voie orale en fonction du temps en jours.
Figure.8: Taux de Mortalité en fonction des doses de l’extrait Méthanolique de Jatropha unicostata Balf administré par voie orale.
Figure.9: Evolution du poids moyen des souris traitées à 500mg/kg de Jatropha unicostata administré par voie orale en fonction du temps en jours.
Figure.10: Evolution du poids moyen des souris traitées à 1500mg/kg de Jatropha unicostata administré par voie orale en fonction du temps en jours.
Figure.11: Evolution du poids moyen des souris traitées à 2000mg/kg de Jatropha unicostata administré par voie orale en fonction du temps en jours.
Figure.12: Evolution du poids moyen des souris traitées à 2500mg/kg de Jatropha unicostata administré par voie orale en fonction du temps en jours.
Figure. 13: Evolution du poids moyen des traitées souris à 4000mg/kg de Jatropha Unicostata administré par voie orale en fonction du temps en jours
Figure.14 : Etude de la toxicité aiguë de l’extrait éthanolique d’Aloe perryi Baker administré par voie cutanée chez les rats mâles à J0
Figure.15 : Etude de la toxicité aiguë de l’extrait éthanolique d’Aloe perryi Baker administré par voie cutanée chez les rats mâles à J1.
Figure .16 : Etude de la toxicité aiguë de l’extrait éthanolique d’Aloe perryi Baker administré par voie cutanée chez les rats mâles à J7.
Figure.17: Etude de la toxicité aiguë de l’extrait éthanolique d’Aloe perryi Baker administré par voie cutanée chez les rats mâles à J14.
Figure.18: Etude de la toxicité aiguë d’Aloe perryi Baker administré par voie cutanée chez les rats femelles à J0.
Figure.19 : Etude de la toxicité aiguë de l’extrait éthanolique d’Aloe perryi Baker administré par voie cutanée chez les rats femelles à J1.
Figure.20: Etude de la toxicité aiguë de l’extrait éthanolique d’Aloe perryi Baker administré par voie cutanée chez les Rats femelles à J7.
Figure.21 : Etude de la toxicité aiguë de l’extrait éthanolique d’Aloe perryi Baker administrée par voie cutanée chez les Rats femelles à J14.
Figure.22 : Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats mâles à J0.
Figure. 23 : Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats mâles à J1.
Figure.24 : Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats mâles à J7.
Figure.25 : Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats mâles à J1.
Figure .26 : Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats mâles à J 21.
Figure.27: Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats mâles à J28.
Figure.28: Etude de la toxicité subchronique subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats femelles à J 0.
Figure .29 : Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats femelles à J 1.
Figure.30 : Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats femelles à J7.
Figure.31 : Etude de la toxicité subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats femelles à J14.
Figure.32 : Etude de la toxicité subchronique subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats femelles à J21
Figure.33 : Etude de la toxicité subchronique subchronique de l’extrait éthanolique d’Aloe Perryi Baker administré par voie cutanée chez les rats femelles à J28
Figure.34: Evolution du poids moyen en fonction du temps du rat témoin de l’essai de toxicité aigu de la crème sans l’extrait d’Aloe Perryi Baker
Figure .35: Evolution du poids moyen en fonction du temps du rat essai de toxicité aiguë de l’extrait éthanolique d’Aloe Perryi Baker.
Figure .36: Evolution du poids moyen en fonction du temps du rat témoin de l’essai de toxicité subchronique de la crème sans extrait d’Aloe Perryi Baker
Figure .37 : Evolution du poids moyen en fonction du temps du rat essai de toxicité subchronique d’extrait éthanolique d’extrait éthanolique d’Aloe Perryi Baker . Figure.38: Etude de la toxicité aiguë de l’extrait méthanolique de Jatropha unicostata Balf
par voie cutanée chez les rats mâles à J 0.
Figure.39 : Etude de la toxicité aiguë de l’extrait méthanolique de Jatropha unicostata Balf par voie cutanée chez les rats mâles à J 1
Figure .40 : Etude de la toxicité aiguë de l’extrait méthanolique de Jatropha unicostata Balf par voie cutanée chez les rats mâles à J 7
Figure .41 : Etude de la toxicité aiguë de l’extrait méthanolique de Jatropha unicostata Balf par voie cutanée chez les rats mâles à J 14
Figure.42 : Etude de la toxicité aiguë de l’extrait méthanolique de Jatropha unicostata Balf par voie cutanée chez les rats femelles à J 0
Figure.43 : Etude de la toxicité aiguë de l’extrait méthanolique de Jatropha unicostata Balf par voie cutanée chez les rats femelles à J 1
Figure.44: Etude de la toxicité aiguë de l’extrait méthanolique de Jatropha unicostata Balf par voie cutanée chez les rats femelles à J 7
Figure.45 : Etude de la toxicité aiguë de l’extrait méthanolique de Jatropha unicostata Balf par voie cutanée chez les rats femelles à J14
Figure.46: Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats mâles à J 0
Figure.47 : Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats mâles à J 1
Figure.48 : Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats mâles à J 7
Figure.49 : Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats à J 14
Figure.50: Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats mâles à J 21
Figure.51 : Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats mâles à J 28
Figure.52 : Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats femelles à J 0
Figure.53 : Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats femelles à J1
Figure.54: Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats femelles à J 7
Figure.55: Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats femelles à J 14
Figure. 56: Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats femelles à J 21.
Figure. 57: Etude de la toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf administré par voie cutanée chez les rats femelles à J 28
Figure .58: Evolution du poids moyen en fonction du temps du rat témoin de l’essai de toxicité aiguë de la crème sans extrait méthanolique de Jatropha unicostata Balf. Figure .59: Evolution du poids moyen en fonction du temps du rat traité de l’essai de
toxicité aiguë d’extrait méthanolique de Jatropha unicostata Balf.
Figure .60: Evolution du poids moyen en fonction du temps du rat témoin de l’essai de toxicité subchronique de la crème sans extrait méthanolique de Jatropha unicostata Balf.
Figure .61: Evolution du poids moyen en fonction du temps du rat traité de l’essai de toxicité subchronique de l’extrait méthanolique de Jatropha unicostata Balf.
Figure.62 : Influence des extraits méthanoliques de Jatropha unicostata Balf (100 et 200mg/kg, VO) sur l'œdème à la carragéenine.
Figure.63 : Influence des extraits éthanoliques d’Aloe perryi Baker (100 et 250mg/kg, VO) sur l’ l'œdème à la carragéenine.
Figure.64: Pourcentage d’inhibition de l'œdème de patte chez le rat prétraité à l’extrait méthanolique de Jatropha unicostata Balf 100 et 200 mg/kg VO, œdème à la carragéenine.
Figure.65: Pourcentage d’inhibition de l'œdème de patte chez le rat prétraité à l’extrait éthanolique d’Aloe perryi Baker 100 et 250mg/kg VO, œdème à la carragéenine. Figure.66 : Pourcentage de l’augmentation de l'œdème de patte chez le rat prétraité à l’extrait
méthanolique de Jatropha unicostata Balf 100 et 200mg/kg VO, œdème à la carragéenine.
Figure.67: Pourcentage de l’augmentation de l'œdème de patte chez le rat prétraité à l’ extrait éthanolique d Aloe perryi Baker 100 et 250mg/kg VO, œdème à la carragéenine. Figure.68: Influence des extraits méthanoliques de Jatropha unicostata Balf (100 et
200mg/kg, V.O.) sur l’ l'œdème induit par traumatisme expérimental.
Figure.69: Influence des extraits éthanoliques d’Aloe perryi Baker (100 et 250mg/kg, V.O.) sur l’ l'œdème induit par traumatisme expérimental.
Figure.70: Pourcentage d’inhibition de l'œdème de patte chez le rat prétraité aux extraits
méthanolique de Jatropha unicostata Balf (100 et 200mg/kg, V.O, œdème par traumatisme expérimental.
Figure.71: Pourcentage d’inhibition du l'œdème de patte chez le rat prétraité aux extraits
éthanoliques d’Aloe perryi Baker (100 et 250mg/kg, VO, œdème par traumatisme expérimental).
Figure.72 : Pourcentage de l’augmentation de l'œdème de patte chez le rat prétraité aux
extraits méthanoliques de Jatropha unicostata Balf (100 et 200mg/kg, V.O., œdème par traumatisme expérimental).
Figure.73 : Pourcentage de l’augmentation de l'œdème de patte chez le rat prétraité aux
extraits éthanoliques d’Aloe perryi Baker (100 et 250mg/kg, V.O., œdème par traumatisme expérimental).
Figure.74: Nombre des crampes induites par l’acide acétique chez les souris pendant 20min, sous l’extrait méthanolique (100 et 200mg/kg, v.o.) de Jatropha unicostata.
Figure.75: Nombre des crampes induites par l’acide acétique chez la souris pendant 20min, sous l’extrait éthanolique (100 et 250mg/kg, vo) d’Aloe perryi Baker (AL) administré par voie orale (v.o.) (p≤0.001).
Figure. 76: Pourcentage de protection de l’extrait méthanolique de Jatropha unicostata Balf (100 et 200mg/kg, v.o.), sur les crampes induites par l’acide acétique chez la souris.
Figure.77: Pourcentage de protection de l’extrait éthanolique d’Aloe perryi Baker100 et 250mg/kg, v.o., sur les crampes induites par l’acide acétique chez la souris.
Figure.78: Action analgésique centrale de l’extrait méthanolique de Jatropha unicostata, (100 et 200mg/kg, vo) chez le rat.
Figure.79: Action analgésique centrale de l’extrait éthanolique d’Aloe perryi Baker (100 et 250mg/kg VO) chez le rat.
Liste des Tableaux
Tableau.1: Activité anti-inflammatoire des plantes médicinales et aromatiques (données bibliographiques).
Tableau.2: Activité analgésique des plantes médicinales et aromatiques (données bibliographiques)
Tableau .3: Récapitulatif du rendement par macération à froid
Tableau .4: Protocole d’administration par voie orale d’Aloe perryi Baker
Tableau .5: Protocole d’administration par voie orale de Jatropha unicostata Balf.
Tableau .6: Taux de Mortalité en fonction des doses de l’extrait éthanolique d’Aloe perryi Baker administré par voie orale.
Tableau .7: Taux de Mortalité en fonction des doses de l’extrait Méthanolique Jatropha unicostata Balf administrée par voie orale.
Tableau .8: Caractéristiques et rôle des matières premierses utilisées
Tableau. 9: Effet anti inflammatoire de Jatropha unicostata BALF sur l’œdème induit par la carragéenine au niveau la patte arrière chez le rat.
Tableau.10: Effet anti inflammatoire d’Aloe perryi Baker sur l’œdème induit par la carragéenine au niveau la patte arrière chez le rat.
Tableau .11: Effet anti-inflammatoire de l’extrait méthanolique de Jatropha unicostata induit sur l’œdème induit par le traumatisme expérimental au niveau de la patte arrière chez le rat.
Tableau.12: Effet anti-inflammatoire de l’extrait éthanolique d’Aloe perryi sur l’œdème induit par traumatisme expérimental au niveau de la patte arrière chez le rat.
Tableau.13: Influence de l’extrait méthanolique de Jatropha unicostata Balf, de l’extrait éthanolique d’Aloe perryi Baker et de l’acide acétylsalicylique, vis-à-vis de la douleur induite par l’acide acétique chez la souris (test de Koster).
Tableau.14: Influence de l’extrait méthanolique de Jatropha unicostata Balf, de l’extrait éthanolique d’Aloe perryi Baker et de la morphine(M), vis-à-vis de la douleur induite par la chaleur chez le rat (test de Tail flick).
Liste des Photos
Photo1: Aloe perryi Baker
Photo2 : Feuilles et fleur de Jatropha unicostata Balf. Photo3. Modèle d’Animaux
INTRODUCTION GENERALE
Depuis toujours les plantes ont constitué la source majeure de médicaments grâce à la richesse de ce qu’on appelle le métabolisme secondaire, une exclusivité du monde végétal.
Ces métabolites secondaires, à structure chimique souvent complexe, sont très dispersés et très différents selon les espèces. C’est seulement à partir de la deuxième moitié du 20e siècle qu’il y a eu explosion des recherches en ce domaine grâce à l’évolution du matériel d’analyse (chromatographie, résonance magnétique nucléaire, spectrographie de masse, spectrophotométrie…). Il existe plus de 200 000 métabolites secondaires classés selon leur appartenance chimique en lipides particuliers (saturés, insaturés…), composés acétyléniques, cires et cutines, acides aminés non protéinogènes (aliphatiques, neutres, soufrés, aminoacides, basiques, hétérocycliques, aromatique), composés phénoliques (dérivés de l’acide benzoïque, de l’acide cinnamique, flavonoïdes, quinones, tannins, lignines), terpènes (hémiterpènes, monoterpènes, iridoides, sesquiterpènes, diterpenes, saponines, sapogénines, stérols, stéroïdes, glycosides cardiaques…), alcaloïdes (dérivés de la pyridine, de la pipéridine, de la quinoléine, de l’isoquinoléine, des noyaux indole, purine et tropane), mines et polyamines, etc…
Parmi les milliers de molécules produites par ce métabolisme, l’Homme sélectionne celles qui lui permettent de se défendre contre les agressions d’autres organismes vivants pathogènes (champignons, bactéries, virus…), et de corriger ses troubles métaboliques.
De nos jours, les plantes sont encore le premier réservoir de nouveaux médicaments. Les progrès de la biochimie et de l’analyse chimique et pharmacologique, ainsi que de la physiologie végétale, ont permis de commencer un tri rationnel dans la masse des actions attribuées aux plantes, détruisant certaines légendes, mais établissant solidement certains usages anciens. L’utilisation correcte des plantes dans des buts médicinaux exige une approche méthodique et rationnelle.
Malgré les progrès de la thérapeutique moderne, il est nécessaire de rechercher de nouvelles médications:
- soit parce que certaines substances actives sont assez mal tolérées, ou au contraire entrainent l’accoutumance,
L’exploration des ressources naturelles, et notamment du monde végétal, est encore capitale à l’heure actuelle, les études sont complexes et pluridisciplinaires:
- l’étude ethnopharmacologique qui consiste à recueillir des renseignements sur l’utilisation des plantes auprès des populations vivant encore prés de la nature, - l’étude chimiotaxonomique qui consiste à rechercher des catégories de molécules
dans les plantes en fonction de leur appartenance botanique. Ainsi les Apocynaceae, les Rutaceae, les Rubiaceae renferment souvent des alcaloïdes et c’est parmi ces familles que l’on recherche d’abord les alcaloïdes,
- et l’étude pharmacologique.
Dans ce sens l’étude des propriétés pharmacologiques d’une plante constituent une étape primordiale. Par ailleurs, une étude chimique pourra tenter d’isoler et de doses des substances chimiques pures ou plus vraisemblablement des groupes chimiques définis, qui devront être corrélés à l’activité pharmacologique.
Ce travail s’inscrit dans la continuité de différentes études précédemment menées sur d’autres espèces végétales, dans le domaine des antibactériens, des antifongiques, mais également dans celui des analgésiques et des anti-inflammatoires.
Ainsi, la première partie a été consacré à une famille Jatropha unicostata Balf et Aloe perryi Baker. Nommées aussi l’origan du Yémen, ces espèces ont été très peu étudiées tant au niveau de leur toxicité, qu’au niveau de diverses propriétés pharmacologiques.
Après le repositionnement succinct de ces espèces, au sein de la taxonomie générale, notre travail a été consacré à l’étude botanique de Jatropha unicostata Balf et d’Aloe perryi Baker. Les données ethnopharmacologiques comprennent les indications et usages thérapeutiques conférés à la médecine traditionnelle.
Nous avons aussi tenté de rassembler et synthétiser l’ensemble des études récentes concernant les propriétés pharmacologiques sur les deux espèces étudiées ainsi que sa composition chimique.
Bien que très communément employées en médecine traditionnelle yéménite, Jatropha unicostata Balf et Aloe perryi Baker n’ont pas fait l’objet d’étude toxicologique, pour permettre d’estimer sa tolérance. Nous avons évalué leur toxicité aiguë chez la souris.
Très souvent, une drogue est utilisée pour des affections variées, souvent fort différentes, et il est très rare de ne trouver qu’une seule indication traditionnelle. Des substances ayant un pouvoir antimicrobien peuvent également exercer des actions anti-inflammatoires, analgésiques ou autres. C’est pourquoi nous avons entrepris de rechercher l’existence de certaines propriétés pharmacologiques pour les extraits fixes de Jatropha unicostata Balf et Aloe perryi Baker.
Nous avons alors orienté notre travail vers la recherche de propriétés analgésiques et anti-inflammatoires, en raison de l’importance en médecine contemporaine des substances dotées tels effets.
Nous avons essayé de rechercher l’existence de propriétés analgésiques pour les extraits de Jatropha unicostata et Aloe perryi, propriétés par ailleurs guidés par les indications traditionnelles et pharmacologiques des autres espèces. S’est imposée également la recherche d’effets anti-inflammatoires, connus en médecine traditionnelle pour la plante et coexistant très fréquemment avec une activité analgésique.
PARTIE
I. Généralités sur les plantes aromatiques et médicinales (PAM)
I. 1. Historique
L’utilisation des plantes aromatiques dans la thérapeutique ne date pas d’aujourd’hui, car l’histoire de ces plantes se confond avec celle des civilisations, En effet, l’utilisation de certaines plantes de ce groupe remonte aussi loin que l’on puisse trouver trace de l’homme. Dans la civilisation sumérienne, akkadienne et babylonienne (4ème et 3ème siècles avant (CJ) des préparations à base de plantes aromatiques comme l’ase foetide (ferule foetida regel) ont été en usage (Bastian., 1982, paris et Moyse., 1076 – 1986, Youros et al., 1995).
Les plantes aromatiques comme la cannelle (cinnamomun zeylanicum nees), le poivre noir (piper nigrum ) et le gingembre (zingiber officinale rose) avaient leur place dans la médecine chinoise vieille de 3000 ans (Valnet et al., 1978).
Les ouvrages de Caraka Samhita et Sûrsrûta Samhîta traitant la médecine ayurvédique, pratiquée en Inde 1600 avant JC donnent des indications précises sur l’emploi de nombreuses plants aromatiques (Younis., 1993).
Dans la civilisation assyro babylonienne, les plantes aromatiques, parmi lesquelles la cardamone (Elettaria cardamomun roxb maton) étaient non seulement utiliser pour apaiser la colère des dieux mais aussi à des fins thérapeutiques (Bastian., 1982).
En Egypte, antique, la recette de l’extrait surfin du burjoin (Styrax tonkinensis
Caraib) gravée sur les parois du temple d’Edfou témoigne l’utilisation des plantes
aromatiques (Lapraz., 1979).
Aussi, le fameux papyrus d’Ebers mentionne de nombreuses plantes médicinales, parmi lesquelles les plantes aromatiques comme la myrhe (Commiphora myriha Engl) la girofle (syzigium armaticum Merril et Perry) ; les cannelles (Cinnamomum
Les grecs à partir de 380 héritiers des civilisations orientales, notamment persanes, laissèrent derrière eux des ouvrages mentionnant l’usage des plantes médicinales, parmi lesquelles des plantes aromatiques
Hippocrate fut déclaré sauveur d’Athènes pour avoir combattu une épidémie de peste par des fumigations aromatiques de thym (Thumus vulgaris L) (Bastian., 1982, Valnet et al., 1978).
Discoride (77 après JC) inventorie 959 drogues d’origines animales, minérales et végétales, dont plus de 600 d’origine végétale (Dioscoride., 1959), comprenant une centaine de plantes aromatiques. Les auteurs arabo persans comme Ibn al Baytâr (1877-1883) ont ajouté de nombreuses espèces nouvelles à cet arsenal thérapeutique.
I. 2. Introduction
Depuis des temps, la nature a été un champ de découverte et de manipulations pour l’être humain. L’histoire des peuples a montré que les plantes occupent une place importante dans les milieux de vie. En effet, ont longtemps été employés des remèdes traditionnels à base de plantes, sans que l’on sache à quoi étaient dues leurs actions bénéfiques.
Le Yémen est un pays riches et variés en végétation, des études récentes ont montré que présence d’environ 2810 espèces de plantes.
De 2810 espèces, il ya 850 espèces de plantes endémique au Yémen.
Les substances naturelles des végétaux ont des intérêts multiples mis à profit dans les industries. L’isolement des principes actifs datant du XIX° siècle en améliorant la connaissance des structures a fait progressivement se séparer et parfois s’opposer une phytothérapie traditionnelle souvent empirique avec une thérapeutique officielle incluant les principes chimiques et végétaux dont la pharmacologie était mieux connue.
De ce fait, cette thérapeutique officielle accepte parfois avec une certaine méfiance l’emploi des végétaux ou d’extraits complexes de végétaux (substances naturelles) dont l’action est confirmée par l’usage sans être attribuée de façon certains à une molécule type.
Ainsi, le développement des diverses techniques d’extractions, d’isolement et d’indentification a permis l’utilisation de ces substances naturelles dans diverses industries (pharmaceutiques, agro alimentaires, cosmétiques et parfumeries). La liste des plantes entrant précisément dans ce cadre est exhaustive et comme elles sont utilisées sous formes de tisanes, extraits ou préparations complexes, il reste difficile de définir les molécules responsables de l’action bien que certains effets pharmacologiques prouvés sur l’animal aient été attribuées à des composés tels que les alcaloïdes et ces dérivés, les terpènes, les phycocolloides et les composés poly phénoliques.
I. 2.1. Définition
Les substances naturelles sont des extraits de végétaux supérieurs obtenues par différentes méthodes, elles sont recherchées et utilisées en parfumerie et cosmétiques, ou pour leur arôme (saveur) auquel elles doivent leur emploi dans l’alimentation, d’autres enfin jouent un rôle thérapeutique important dans l’industrie pharmaceutique.
I.3.Classification des plantes incluses dans le secteur des plantes aromatiques et médicinales (PAM) selon les domaines d’utilisation
I.3.1. Plantes et extraits de plantes à intérêt médicinal
- Plantes pour la phytothérapie (plantes sèches)
- Plantes pour la médecine allopathique (extraction de substances actives pour
l’industrie pharmaceutique moderne)
- Plantes pour la préparation d’extraits utilisés comme produits de santé et de
bien -être (segment récent en plein développement).
I. 3.2. Plantes à intérêt aromatique
- Pantes pour aromatisation alimentaires - Forme sèche
- Forme surgelée
- Plantes pour l’industrie d’extraction d’HE et d’autres extraits aromatiques - HE et Extrait pour les arômes alimentaires.
- HE et extrait pour les additifs alimentaires (antioxydants, épaississants,
gélifiants,…)
- Plantes pour la parfumerie, la cosmétique et industries similaires
- Extrait de plantes pour la parfumerie industrielle, les produits d’hygiène, les
désinfectants.
- Extraits de plantes pour la cosmétique bas de gamme.
- Extraits de plantes pour les parfums haut de gamme (Benjilali et Zrira, 2005).
I.4. Aloès
I.4.1. Historique
Aloès veut dire en arabe ”goût amer”. Ce goût est du au liquide extrait des feuilles de la plante graisseuse. Selon l’histoire égyptienne la plante est utilisée depuis1500 années avant JC pour un but thérapeutique dans les brulures ou les infections bactériennes et parasitaires ; par les grecs et les arabes, selon « AL Moatamad » référence des plantes médicinales, cette plante est utilisée contre les maladies gastriques et comme soin des brulures de 2éme et 3éme degré, ainsi que dans « les maladies des yeux».
En Inde, cette plante est prescrite en cas des œdèmes, les habitants populations utilisent uniquement les feuilles de la plante réduites en poudre et diluées dans une quantité d’eau chaude.
Actuellement, il existe plus de 500 espèces de la plante Aloès dans le monde, dont 170 au Yémen, 3 types dominent dans l’île de «Socotra», elles sont endémiques comme Aloe perryi. Quelques types de plante Aloès sont toxiques, cette toxicité est due à sa composition et à son teneur en alcaloïdes qui contient à son tour de conicein identifié par Dring en 1984(Naser., 2005).
244 espèces d’Aloès répandues dans l’île Arabe et en Afrique dans le jardin botanique de Kiyou ont été étudiées ; 48 espèces d’entre elles contiennent les alcaloïdes toxiques.
Néo Finger a déclaré qu’une dose de 8 à 20g d’Aloès peut causer la mort (Naser., 2005).
En 983, le roi d’Allemagne Autou II meurt suite à l’ingestion de 16g d’Aloès, ingérés pour traiter sa constipation.
Notons aussi que la mauvaise utilisation d’Aloès a peut entrainer une perte de vue (Naser., 2005).
I.4.2. Aloe perryi Baker (Aloeaeceae):
Synonyme : Aloe forbesii Balf. f. Nom vernaculaire : Aloès Socotrin, Taife.
L’espèce Aloe perryi baker appartient à la famille Aloeaeceae; c’est une espèce endemique de l’île Socotra au Yémen (Miller et Morris., 2004).
V. V. 1. Classification : Règnè : Plantae Divission : Angiospermes Classe : Monocots Ordre : Asparagales Famille : Aloeceae Genre : Aloe Espèce : A. perryi nom binomial : Baker
I.4.3. Description et habitat
Photo1. Aloe perryi Baker
Il s’agit d’une plante se trouvant uniquement dans les iles Socotra au Yémen. Elle pousse dans les terres rocheuses et se caractérise par des feuilles épaisses et épinées, une tige courte, de couleur verte rougeâtre, et des fleurs rouges. L’extrait sec issu de la plante, connu sous le nom d’Aloe, est utilisé en médecine et exporté de l’ile depuis plusieurs centaines d’années. La partie utilisée en médecine est l’extrait des feuilles.
I.4.4. Bienfaits et utilisations traditionnelles
L’extrait d’aloès est utilisé comme produit naturel pour provoquer la diarrhée et en cas de faiblesse et anémie. Il est également utilisé pour faciliter la digestion et les sécrétions de la vésicule biliaire et dans le traitement de diverses maladies comme l’inflammation, les douleurs musculaires, la constipation, les brulures, les blessures, l’ulcère, le diabète, les maladies de la peau, la malaria et les maladies parasitaires (Al-Fatimi et al., 2005).
I.4.5. Données phytochimiques
Quelques composés chimiques ont été identifiés dans le genre Aloès incluant des huiles essentielles, alcaloïdes, stérols, saponine, acides aminés, l’acide salicylique, glycoprotéines, vitamines, minéraux, enzymes, polysaccarides, anthraquinone glycosides et résines (Yimei Jia et al., 2008 Atherton, 1997; Bazeeb., 2002 ).
I.4.6. Données Pharmacologiques
Les activités pharmacologiques étudiées confèrent à cette plante une activité antibactérienne (Mothana and Lindquist, 2005).
I.5. Jatropha
Jatropha est un genre de plantes dicotylédones de la famille des Euphorbiaceae.
Les tiges renflées (caudex) à la base de certaines espèces leur valent les noms de
plantes bouteilles et de pignons d'Inde, mais on les appelle aussi médiciniers pour
leurs utilisations thérapeutiques auxquelles le genre doit son nom (Jatropha dérive du grec jatrós, docteur et trophé, nourriture).Comme pour la plupart des Euphorbiaceae, les baies et la sève sont toxiques. On dénombre environ 160 espèces appartenant au genre Jatropha ; au Yémen, il existe trois espèces endémiques de Jatropha : Jatropha
unicostata balf, Jatropha spinosa (Forssk.)Vahl et Jatropha variegata (Forssk.)Vahl.
I.5.1. Jatropha unicostata balf
Synonyme: Jatropha bearbeiten (Balf.)
Nom vernaculaire: Jatropha frangipanier (sibru)
I. 5.1.1. Classification: Règnè : Plantae Divission : Angiospermes Classe : Eudicots Ordre : Malpighiales Famille : Euphorbiaceae Genre : Jatropha
Espèce : Jatropha unicostata nom binomial : J. U. Balf.
I. 5.1.2. Description et habitat :
Photo2. Feuilles et fleur de Jatropha unicostata Balf.
Elle appartientà la famille des euphorbiacées, et est endémique à l’île de Socotra au Yémen ; son nom en soqotri est « sibru ». Son habitat naturel est subtropical ou tropical sec des forêts. Ce petit arbre a des feuilles vert brillant et atteint jusqu'à 2m de haut.
I. 5.1.3. Utilisation traditionnelle
Cette plante est largement utilisée dans la médecine traditionnelle pour le traitement des blessures, douleur aiguë, hémorragie, inflammation, eczéma, glande tendre, infection oculaire, douleurs thoraciques et abdominales, nausées, vomissements et est utilisé comme laxatif et vermifuge (Brazinji et al., 2009; Miller und Morris., 2004; mothana et al., 2005).
I. 5.1.4. Données Phytochimiques
Après avoir évaporé le solvant, les résidus obtenus sont solubilisé dans l’eau, n-heptane, acétate d’éthyle et n-butanol ; l’extrait a été séparé par chromatographie sur colonne de gel de silice. (Katrin franke et al. 2003).
Les constituants principaux d’extrait de Jatropha unicostata Balf sont représentés par le mélange de stérol et kétostéroïdes (Katrin Frank et al, 2005) ; ces composées ont été identifiés par GC-MS : 59 mg phytostérols (Goud et Akihisa, 1997) : stérol (0,9%), campestérol(4,9%), stigmastérol(1,3%), stigma stérol(36,5%), sitostérol (56,4%) et 76 mg 3-10 stéroïdes (Simth et Brooks, 1976 ; Das par et dans Neves, 1993).
Fraxetin et Lutéoline ont été obtenus par séparation d’acétate d’éthyle (Kusâna et al. 1996, Kondo et al., 1986).
I. 5.1.5. Données Pharmacologiques
Certaines études ont rapporté que l’extrait de Jatropha unicostata présente un certain nombre d’activités pharmacologiques, tels que antimicrobiennes, anti-virales, anti-tumorales et anti-protoscolex (Brazinji et al ., 2009; Mothana et al., 2006, Mothana et al., 2007; Mothana et al., 2005).
I.6. Les principales structures chimiques des deux plantes étudiées
-Stérols
Stéroïdes
Cholésterol
Lupéol
-Flavonoïdes
Lutéoline
-Saponine Molécule de saponine -Acide Acide salicylique Acide acétylsalicylique -Anthraquinones Anthraquinone Aloïne
Émodine Anthranol ester de l'acide
-Chromons
a- evodione b- leptonol
-Sucre
Monosaccharides
Polysaccharides
glucomannans
II. Généralités sur l’inflammation, médicament anti inflammatoires et anti inflammatoires d’origine végétale
II. 1. Inflammation II. 1.1. Définition
L’inflammation désigne l’ensemble des réactions déclenchées dans un organisme vivant, par une agression qui peut être d’origine immunitaire ou non (traumatique, infectieuse, micro cristalline, chimique), quelle que soit l’origine du stimulus phlogogène. Cet ensemble de phénomènes réactionnels siégeant dans les tissus vascularisés (tissu conjonctif) a pour finalité de limiter et de réparer les effets de l’agression (Zhou et Jian., 2006 ; Kumar et al., 2005).
II.1. 2. Causes de l’inflammation
L’inflammation est une réponse de l’organisme à une agression qui peut avoir diverses origines (Revillard ., 2001).
II.1.2.1. Cause exogènes
Causes physiques: elles sont liées à un traumatisme, à la chaleur, au froid, à des radiations ionisantes, à l’électricité.
Causes chimiques: acide, base, venin, toxiques divers. Causes infectieuses: bactériennes, virales, parasitaires.
II.1. 2.2. Causes endogènes
Causes trophiques: elles sont en rapport avec un défaut de vascularisation. Conflits immunitaires: rencontrés dans les maladies inflammatoires chroniques.
II.1.3. Les différentes phases d’inflammation
L’inflammation peut avoir de nombreuses origines : traumatisme, agression physique ou chimique, infection, dérèglement immunologique. Dans tous les cas, elle concerne le tissu conjonctif et se trouve schématiquement marquée pour trois phases, qui ne sont que rarement successives mais bien plus souvent concomitantes.
II.1.3.1. Phase vasculaire de l’inflammation
En réponse à une agression, des mécanismes immédiats se mettent en route, leur but est de donner l’alerte et de recruter les cellules de l’immunité naturelle. Cette phase comporte trois modifications élémentaires qui sont la congestion active, l’œdème inflammatoire, les diapédèses leucocytaires (Gillian et Christopher., 2004).
II.1.3.1.1. Congestion active
C’est l’augmentation de la quantité de sang dans un tissu afflux exagéré de sang artériel. Elle apparaît dans les dix minutes qui suivent l’agression et atteint sont paroxysme entre 15 et 160 minutes. Sa durée est très variable, de quelques heures à quelques jours. Dans les dix minutes qui suivant l’agression, il se produit des modifications dans les territoires de la micro circulation. Cliniquement, cette congestion active s’exprime par une chaleur et par une rougeur. L’examen histologique à ce stade montre une dilatation des artérioles, des capillaires et des veinules, une turgescence des cellules endothéliales avec une lumière remplie de globules rouges (prugnolle et Thoreau., 1996). Ces phénomènes ont pour rôle l’augmentation de la quantité de sang dans les territoires lésés. Cette congestion active est déclenchée essentiellement par des facteurs humoraux: histamine, sérotonine, prostaglandine, prostascyclines (Offenstadt et al., 2001).
II.1.3.1.2. Oedème inflammatoire
Il se caractérise par l’issue hors des vaisseaux d’une substance riche en protéines infiltrant le tissu conjonctif ou s’accumulant dans les cavités naturelles (alvéoles pulmonaires, séreuses, cavités articulaires): c’est un exsudat. Cliniquement, cet œdème se traduit par un gonflement tissulaire ou tumeur. L’étude histologique montre une substance fondamentale abondante, claire et peu colorée. Parfois il s’associe à
l’œdème une extravasation d’hématies réalisant l’œdème hémorragique (Anthymle et al., 2006). Plusieurs facteurs concourent à la constitution de l’œdème :
l’augmentation de la pression hydrostatique secondaire à la congestion. l’augmentation de la perméabilité capillaire due en partie à l’élargissement
des fentes intercellulaires sous l’action de l’histamine, de la sérotonine et de la bradykinine.
L’œdème à des effets bénéfiques soit: • la dilution des produits toxiques; • l’apport local d’Immunoglobulines;
• la diffusion des substances favorisant la phagocytose;
• la précipitation de fibrine réalisant une barrière entre les territoires sains et lésés;
Il peut être néfaste en raison de son abondance comme œdème pulmonaire infectieux ou de son installation brutale comme œdème du larynx.
II.1.3.1.3. Diapédèse leucocytaire
C’est la migration de leucocytes hors des capillaires et veinules. Dans le courant sanguin, ralenti après la vasodilatation, les leucocytes se disposent en un film périphérique puis se plaquent contre les cellules endothéliales, c’est l’émargination (Cohen et Belmatoug., 2002). Grâce à des pseudopodes ces leucocytes s’insinuent entre les cellules endothéliales et franchissent la membrane basale par dépolymérisation. Ils se groupent d’abord en manchon péri capillaire puis migrent dans le tissu (Russe-Marie, et al. 1998). Il s’agit essentiellement de polynucléaires neutrophiles (PNN), de polynucléaires éosinophiles (PNE) puis des monocytes. Leur afflux local est le fait de facteurs généraux (stimulation médullaire par des substances circulantes) et de facteur locaux (chimiotactisme positif développé par de nombreuses substances), produits de dégradation du complément. Les granulocytes et les
II.1.3.2. Phase cellulaire
La vasodilatation l’augmentation de la perméabilité vasculaire par rétraction des cellules endothéliales, la production de molécules chimiotactiques sur les leucocytes, l’expression des molécules d’adhésion par les cellules endothéliales (sélective, VCAM, cadhérines, intégrines) provoquent un afflux cellulaire. Cette phase amène, sur le foyer inflammatoire, des cellules de l’immunité naturelles –PNN, PNE, macrophage) à et d’autres cellules qui permettront la mise en route de l’immunité spécifique ou acquise (monocytes, macrophages, lymphocytes) (Blétry et al., 2006).
Les polynucléaires et les monocytes vont, grâce à leur richesse en enzymes lysosomiales, agir par phagocytose et par protéolyse. Les enzymes libérées attaquent les cellules et les substances intercellulaires (collagène, élastine, membranes basales, substances cartilagineuses) ; ceci entraîne la dénaturation, la mort cellulaire ou tissulaire. D’autres enzymes activent les divers systèmes humoraux ; cette libérations e produit lorsque les lysosomes sont fragilisés par divers types d’agressions cours d’une phagocytose intenses (Chapel, et al., 2004). Certaines substances pharmacologiques utilisées comme anti-inflammatoires sont des stabilisants de membranes, en particulier lysosomiales. Les polynucléaires sont les premiers à arriver sur le site de l’inflammation, suivis des cellules mononuclées (Majno, 1982, Kumar et al., 2005).
Les lymphocytes et leurs dérivés vont agir par les processus d’immunité cellulaire (lymphokines, cellules effectrices) et d’immunité humorale (immunoglobulines). Les fibroblastes représentent une tentative très précoce de la réparation tissulaire.
II.1.3.3. Phase de réparation
La réparation tissulaire est l’ensemble des processus aboutissant à la guérison d’une lésion, avec ou sans séquelles, par régénération ou cicatrisation. Elle comporte des phénomènes qui s’intriquent et se succèdent.
II.1.3.3.1. Détersion
Elle consiste à l’élimination du matériel anormal qui encombre le foyer inflammatoire. Elle est obligatoire pour permettre la cicatrisation (Bafounta et Saiag.,