HAL Id: dumas-01220458
https://dumas.ccsd.cnrs.fr/dumas-01220458
Submitted on 26 Oct 2015
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Investigation des bactériémies nosocomiales à
Staphylococcus aureus : intérêt d’une méthode d’analyse
approfondie des causes
Romain Picot-Guéraud
To cite this version:
Romain Picot-Guéraud. Investigation des bactériémies nosocomiales à Staphylococcus aureus : intérêt d’une méthode d’analyse approfondie des causes. Sciences pharmaceutiques. 2015. �dumas-01220458�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SICD1 de Grenoble :
thesebum@ujf-grenoble.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
UNIVERSITÉ JOSEPH FOURIER FACULTÉ DE PHARMACIE DE GRENOBLE
Année : 2015 N°
INVESTIGATION DES BACTERIEMIES NOSOCOMIALES A STAPHYLOCOCCUS
AUREUS :
INTERET D’UNE METHODE D’ANALYSE APPROFONDIE DES CAUSESMEMOIRE
DU DIPLOME D’ETUDES SPECIALISEES DE
PHARMACIE HOSPITALIERE - PRATIQUE ET RECHERCHE
Conformément aux dispositions du décret N° 90-‐810 du 10 septembre 1990 tient lieu de
THESE
Présentée à la Faculté de Pharmacie de GRENOBLE Et soutenue publiquement le 21 octobre 2015 Pour obtenir le grade de DOCTEUR EN PHARMACIE Par Romain PICOT-‐GUERAUD
Né le 25/12/1987 à Bourgoin-‐Jallieu
Devant le jury composé de :
Monsieur le Professeur Benoit ALLENET – président du jury Monsieur le Docteur Jean-‐Paul BRION
Madame le Docteur Anne DOLHEANS-‐JORDEIM Madame le Docteur Caroline LANDELLE
Madame le Docteur Marie-‐Reine MALLARET – directeur de mémoire
La Faculté de Pharmacie de Grenoble n’entend donner aucune approbation ni improbation aux opinions émises dans les thèses ; ces opinions sont considérées comme propres à leurs auteurs.
REMERCIEMENTS
Au Docteur Marie-‐Reine Mallaret, qui m’a inoculé le goût de l’hygiène hospitalière et gratifié de sa confiance pendant mes stages successifs. Par ce travail, vous m’avez une nouvelle fois fait l’honneur de m’encadrer. Soyez assurée de ma profonde reconnaissance.
Au Professeur Benoit Allenet, pour la formation et le suivi de mon cursus pendant mes études de pharmacie. Je vous remercie sincèrement d’avoir accepté de présider ce jury.
A Mesdames et Monsieur les Docteurs Anne Dolehans-‐Jordeim, Caroline Landelle, et Jean-‐Paul Brion, qui m’ont fait l’honneur d’accepter de juger ce travail. Veuillez accepter le témoignage de mon profond respect.
A Philippe Saviuc et Jacqueline Shum Cheong Sing. C’est toujours un immense plaisir de travailler avec vous et je tiens à vous remercier pour votre expertise, votre disponibilité et votre enthousiasme lors de nos travaux communs.
A Sébastien Ducki, pour la liberté que tu m’as offerte afin de poursuivre ce travail dans de bonnes conditions et l’honneur que tu me fais en m’accordant ta confiance.
A Pierre Batailler. Merci pour tes conseils méthodologiques et nos collaborations passées et à venir.
A tous les pharmaciens qui m’ont encadré au cours de mes stages d’internat et d’officine. Je vous remercie pour la contribution que vous avez apportée à l’élaboration de mon cursus.
A tous les autres membres de l’équipe d’hygiène hospitalière du CHU de Grenoble, dont les compétences transmises m’ont permis de faire mes premières armes dans notre domaine commun.
A Irène, Constance et Damien, dont l’investissement dans ce travail a été total et a permis d’accomplir ce projet conséquent. Je tiens une nouvelle fois à vous en remercier.
A Yvan Caspar, pour ton expertise bactériologique et tes relectures.
A tous mes co-‐internes et amis que j’ai eu le plaisir de côtoyer pendant mon internat et en dehors, Caroline, Céline, Anne-‐Laure, Camille, Marie, Thomas, Joan, Bastien, Flore-‐ Anne, Sabine, Armance, et Joris pour ne citer qu’eux.
A mes amis de faculté et d’ailleurs, Damien, Benoit, Marion, Bastien, Christian. Merci pour les bons moments passés ensemble.
A mes amis compétiteurs et partenaires d’entrainement, dont la passion commune et le goût du dépassement ont très certainement contribué, d’une certaine façon, à cet accomplissement.
A mes très chers parents, dont le dévouement sans égal m’a permis de réaliser tous mes vœux. Je vous admire. Soyez assurés de ma reconnaissance éternelle.
A ma très chère sœur, dont la gentillesse et le soutien sont infaillibles. Je suis heureux que tu ais trouvé le bonheur auprès de Guillaume.
A ma famille et belle-‐famille, pour votre présence et votre soutien. Une pensée pour Raymond dont la contribution indirecte est certaine.
A Aurélie, merci pour ton soutien, ton implication et tes précieux avis depuis toujours, mais surtout ta joie de vivre et ta spontanéité. Sois assurée de ma reconnaissance et de mes sentiments.
TABLE DES MATIERES
Table des illustrations ... Liste des abréviations ... 1. Introduction ... 2. Revue générale de la littérature ...
2.1. Staphylococcus aureus ... 2.1.1. Caractéristiques bactériologiques ... 2.1.2. Le rôle de la colonisation ... 2.1.3. Implication en pathologie humaine ... 2.1.4. La résistance à la méticilline ... 2.2. Les bactériémies nosocomiales à S. aureus ... 2.2.1. Les bactériémies : généralités ... 2.2.2. Place du staphylocoque doré dans les bactériémies
nosocomiales ... 2.2.3. Morbidités secondaires aux bactériémies à S. aureus ... 2.2.4. Mortalité des bactériémies à S. aureus ... 2.2.5. Implication des staphylocoques dorés résistant à la méticilline 2.3. Analyse approfondie des causes et évitabilité ...
2.3.1. La gestion des risques dans la maitrise du risque infectieux ... 2.3.2. La méthode ALARM ... 2.3.3. Evitabilité des évènements indésirables associés aux soins ...
3. Matériels et méthodes ...
3.1. Construction d’une grille de recueil de données et d’analyse ... 3.2. Déploiement de la démarche ... 3.3. Définitions ... 3.4. Variables d’intérêt ... 3.5. Méthodes bactériologiques ... 3.6. Analyse statistique ... 9 11 13 16 16 16 18 20 22 23 23 24 24 25 25 26 26 28 30 32 32 33 36 37 43 43
4. Résultats ...
4.1. Description épidémiologique ... 4.1.1. Caractéristiques épidémiologiques des bactériémies à
S. aureus ... 4.1.2. Caractéristiques épidémiologiques des bactériémies
nosocomiales à S. aureus acquises au CHU de Grenoble ... 4.1.3. Incidence des bactériémies à S. aureus ... 4.2. Analyses approfondies des causes des bactériémies nosocomiales à S. aureus ...
4.2.1. Bilan des analyses approfondies des causes conduites ... 4.2.2. Bilan des facteurs favorisants observés ... 4.3. Evitabilité des bactériémies investiguées ...
5. Discussion ...
5.1. Caractéristiques épidémiologiques ... 5.2. Résultats des analyses approfondies des causes ... 5.3. Evitabilité des bactériémies nosocomiales à S. aureus ... 5.4. Intérêt de l’analyse approfondie des causes des bactériémies
nosocomiales à S. aureus ... 5.4.1. Intérêts et points forts ... 5.4.2. Limites et éléments de remise en question ...
6. Conclusion ... 7. Références ... Annexe 1 ... Annexe 2 ... Annexe 3 ... 44 44 44 48 53 55 55 59 65 67 67 72 76 78 78 83 88 90 100 109 112
TABLE DES ILLUSTRATIONS
LISTE DES TABLEAUX
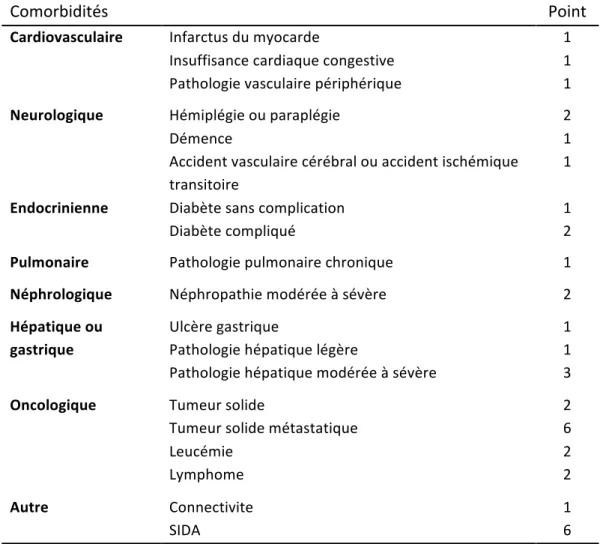
Tableau I. Pondération de l’âge dans le score de Charlson.
Tableau II. Pondération des comorbidités selon le score de Charlson.
Tableau III. Echelle des niveaux de gravité des évènements indésirables associés aux soins d’après la SHAM®.
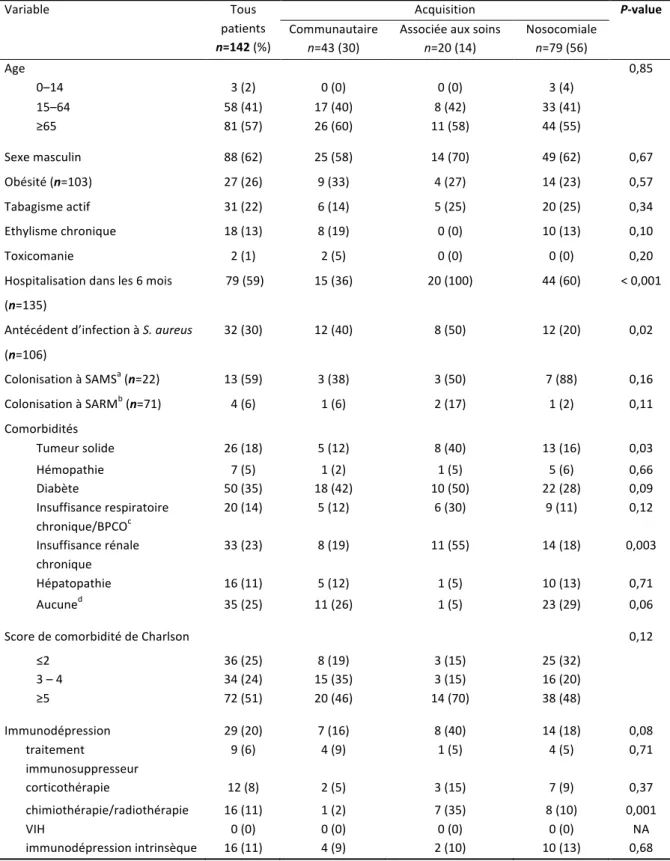
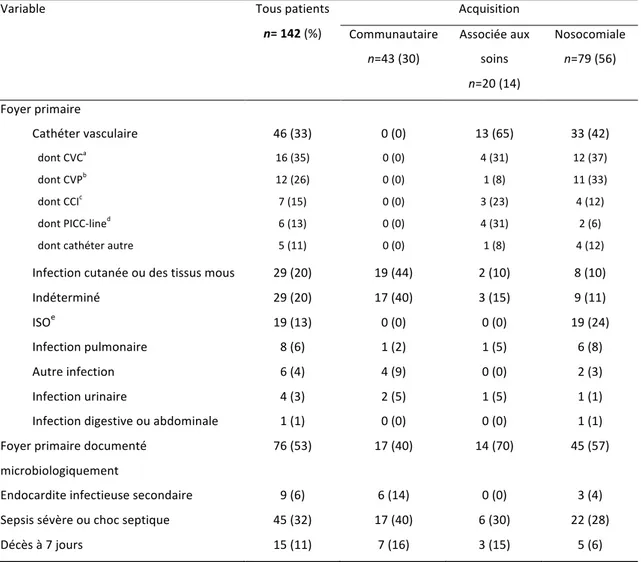
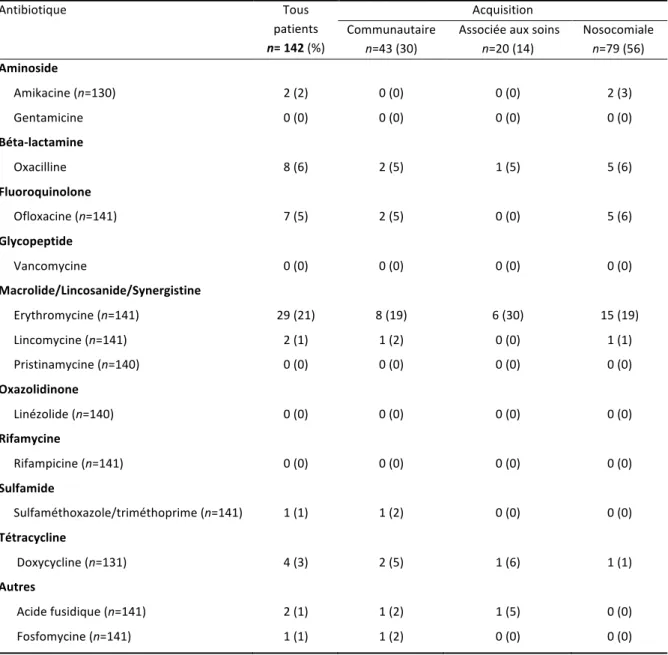
Tableau IV. Caractéristiques des patients en fonction du type d’acquisition des bactériémies à S. aureus.
Tableau V. Caractéristiques des bactériémies à S. aureus en fonction du type d’acquisition.
Tableau VI. Phénotype de résistances aux antibiotiques des souches de S. aureus en fonction du type d’acquisition.
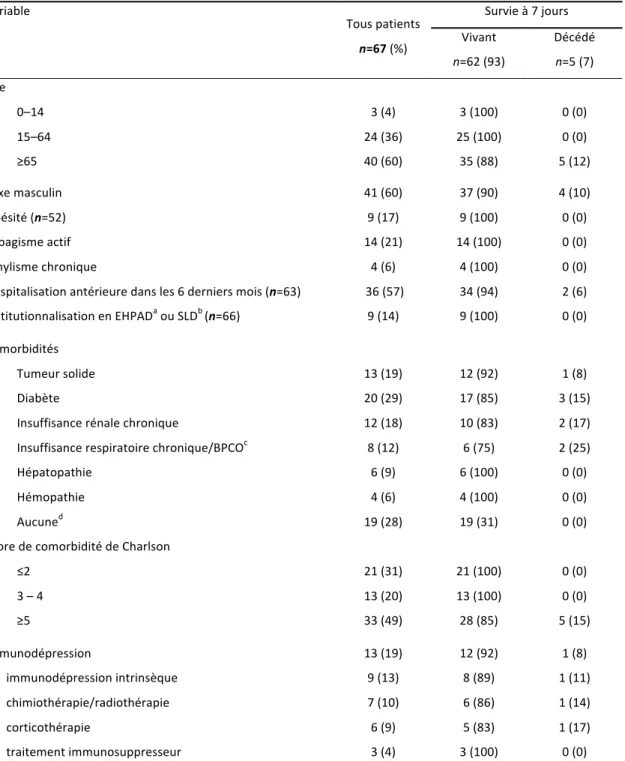
Tableau VII. Caractéristiques des patients ayant une bactériémie nosocomiale à S. aureus acquise au CHU de Grenoble en fonction de la survie à 7 jours.
Tableau VIII. Caractéristiques des bactériémies nosocomiales à Staphylococcus aureus acquises au CHU de Grenoble en fonction de la survie à 7 jours.
Tableau IX. Nombres de bactériémies avec au moins un écart mesuré en fonction des sections des analyses approfondies des causes.
Tableau X. Ecarts retrouvés dans l’investigation des BN-‐SA sur cathéters vasculaires périphériques.
Tableau XI. Ecarts retrouvés dans l’investigation des BN-‐SA sur cathéters vasculaires centraux.
Tableau XII. Ecarts retrouvés dans l’investigation des BN-‐SA sur infections de site opératoire.
Tableau XIII. Description des recommandations formulées aux services de soins. Tableau XIV. Résultats des questions préliminaires à la cotation de l’évitabilité des bactériémies à S. aureus ayant fait l’objet d’une analyse approfondie des causes. Tableau XV. Evitabilité des bactériémies à S. aureus ayant fait l’objet d’une analyse approfondie des causes.
Tableau XVI. Comparaison des écarts rapportés par les AAC de BN-‐SA et les résultats des visites de risques relatifs aux abords vasculaires pour quelques services de soins.
LISTE DES FIGURES
Figure 1. Nombre annuel de bactériémies à S. aureus pour la période 2010 à 2014 au CHU de Grenoble d’après les données du laboratoire de bactériologie.
Figure 2. Schéma des facteurs contributifs au développement d’une infection.
Figure 3. Logigramme du protocole de surveillance et d’analyse approfondie des causes de bactériémies nosocomiales à S. aureus.
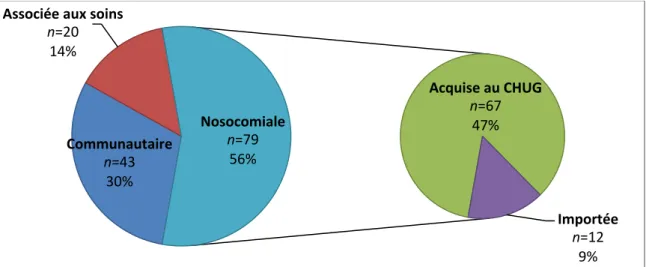
Figure 4. Origine des bactériémies à S. aureus détectées au CHU de Grenoble entre le 1er décembre 2014 et le 31 juillet 2015.
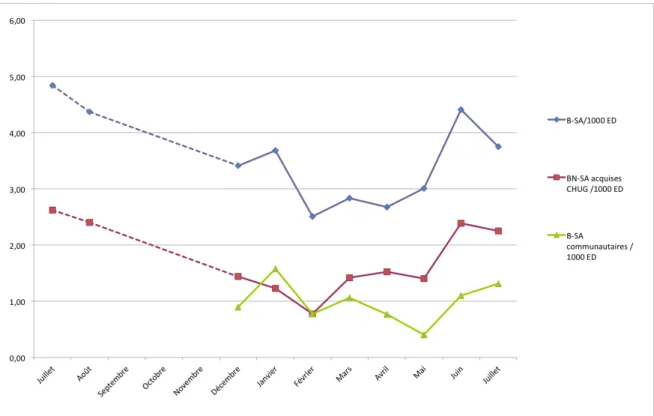
Figure 5. Incidence des bactériémies nosocomiales à S. aureus acquises au CHU de Grenoble pour 1000 journées d’hospitalisation complètes entre le 1er juillet 2014 et le 31 juillet 2015.
Figure 6. Incidence des bactériémies à S. aureus tous types d’acquisition confondus, des bactériémies communautaires à S. aureus et des bactériémies nosocomiales à S. aureus acquises au CHU de Grenoble pour 1000 entrées directes en hospitalisation complètes entre le 1er juillet 2014 et le 31 juillet 2015.
Figure 7. Origine des bactériémies à S. aureus ayant fait l’objet d’une analyse approfondie des causes.
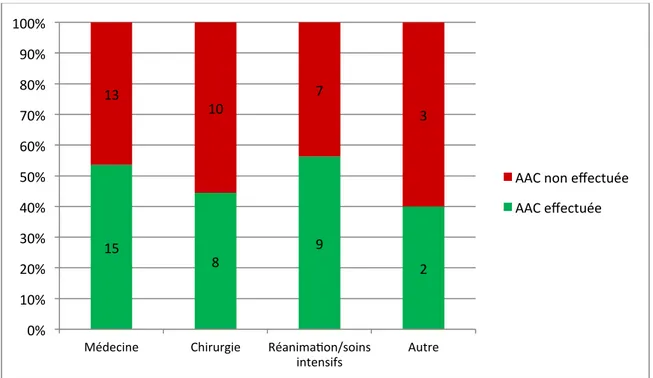
Figure 8. Taux de réalisation d’analyses approfondies des causes de bactériémies nosocomiales à S. aureus acquises au CHU de Grenoble en fonction du type de service. Figure 9. Taux de réalisation d’analyses approfondies des causes de bactériémies nosocomiales à S. aureus acquises au CHU de Grenoble en fonction du foyer primitif suspecté.
Figure 10. Typologie des écarts mesurés lors des investigations de bactériémies nosocomiales à S. aureus.
LISTE DES ABREVIATIONS
AAC : Analyse Approfondie des Causes
ALARM : Association of Litigation And Risk Management
AMDEC : Analyse des Modes de Défaillance de leurs Effets et de leurs Criticités BN : Bactériémie nosocomiale
B-‐SA : Bactériémie à Staphylococcus aureus
BN-‐SA : Bactériémie nosocomiale à Staphylococcus aureus BPCO : Broncho-‐Pneumopathie Chronique Obstructive
CA-‐SFM : Comité de l’Antibiogramme de la Société Française de Microbiologie CCLIN : Centre de Coordination de la Lutte contre les Infections Nosocomiales CHU : Centre Hospitalier Universitaire
CHUG : Centre Hospitalier Universitaire de Grenoble CLIN : Comité de Lutte contre les Infections Nosocomiales CMI : Concentration Minimale Inhibitrice
CTINILS : Comité Technique des Infections Nosocomiales et des Infections Liées aux Soins CVC : Cathéter Veineux Central
CVP : Cathéter Veineux Périphérique
DGCS : Direction Générale de la Cohésion Sociale DGOS : Direction Générale de l’Offre de Soins DGS : Direction Générale de la Santé
EIAS : Evènement Indésirable Associée aux Soins
EHPAD : Etablissement d’Hébergement pour Personnes Agées Dépendantes EOH : Equipe Opérationnelle d’Hygiène
ENEIS : Enquête Nationale sur les Evènements Indésirables lies aux Soins
ENP : Enquête Nationale de Prévalence des infections nosocomiales et des traitements
anti-‐infectieux
EPP : Evaluation des Pratiques Professionnelles G/L : Giga par Litre
HAS : Haute Autorité de Santé IAS : Infection Associée aux Soins
ICALIN : Indicateur Composite des Activités de Lutte contre les Infections Nosocomiales ISO : Infection de Site Opératoire
PICC : Cathéter central à insertion périphérique PLP : Protéine Liant les Pénicillines
PROPIAS : Programme national d'actions de Prévention des Infections Associées aux Soins Q1 : Premier quartile
Q3 : Troisième quartile
REMED : Revue des Erreurs liées aux Médicaments Et Dispositifs médicaux associés REX : Retour d’Expérience
RIPIN : Réseau Inter-‐hospitalier de Prévention des Infections Nosocomiales RMM : Revue de Morbi-‐Mortalité
SAMS : Staphylococcus aureus sensible à la méticilline SARM : Staphylococcus aureus résistant à la méticilline SLD : Service de Soins de Longue Durée
SCTS : Syndrome de Choc Toxique Staphylococcique
1. INTRODUCTION
La prévention des infections associées aux soins constitue un des défis majeurs de la qualité des soins et de la sécurité des patients. Lors de l’Enquête Nationale de Prévalence des infections nosocomiales et des traitements anti-‐infectieux (ENP) conduite en 2012, leur prévalence a été évaluée à 5,1 % dans les établissements de soins français, soit près de un patient sur 20 concerné un jour donné (1). Les estimations européennes font état de 1,9 à 5,3 millions de patients victimes d’une infection associée aux soins sur la période 2011-‐2012 dans les services de court séjour, soit une prévalence de 5,7 % (2).
En France, parmi ces infections nosocomiales, 10,1 % étaient des bactériémies, représentant ainsi la quatrième cause après les infections urinaires (29,9 %), les pneumonies (16,7 %) et les Infections de Sites Opératoires (ISO) (13,5 %) (1). Déjà en 2011, Raoult D. et Richet H. alertaient sur l’impact non négligeable des bactériémies nosocomiales en terme de mortalité, puisque estimé autour de 10 morts pour 100 000 habitants et par an (3).
Parmi les micro-‐organismes impliqués dans la survenue de bactériémies nosocomiales documentées, Staphylococcus aureus occupe la première place en France, avec une part relative de 18,4 % (1). Dans une étude de grande ampleur conduite aux Etats-‐Unis, S. aureus était la seconde étiologie à l’origine de bactériémies nosocomiales avec 20,2 % des cas, et le taux de mortalité associé s’élevait à 25,4 % (4).
Depuis 2014, les bactériémies nosocomiales à staphylocoque doré résistant à la méticilline (SARM) font l’objet d’une surveillance renforcée. Ainsi, une démarche d’analyse approfondie des causes (AAC) pour ces bactériémies est demandée dans le cadre des indicateurs figurant au tableau de bord des infections nosocomiales (5). Ceci s’inscrit dans une politique d’impulsion à la mise en œuvre de la gestion des risques dans les établissements de santé, afin de déterminer et traiter la part évitable de ces évènements indésirables.
Parallèlement, une recrudescence importante des bactériémies à S. aureus méticillino-‐sensible (SAMS) a été mise en évidence rétrospectivement dès l’année 2013 au sein du Centre Hospitalier Universitaire (CHU) de Grenoble. Le nombre de bactériémies à SAMS a augmenté de près de 45 % entre 2012 et 2013, et avec une tendance confirmée pour l’année 2014 (Figure 1). Au cours de la période 2010 – 2014, les bactériémies à SAMS se sont révélées être huit fois plus nombreuses que les bactériémies à SARM. Une tendance similaire à l’augmentation des bactériémies à SAMS, se profile dans plusieurs réseaux de surveillance en France et à l’étranger (6,7). A titre d’exemple, cette augmentation a été estimée à 16,9 % entre 2011 et 2015 en Angleterre, pour atteindre une incidence de 18,93 bactériémies à SAMS pour 100 000 habitants au premier trimestre 2015 (7). Toutefois aucune hypothèse n’a pu être formulée pour expliquer ce phénomène.
Figure 1. Nombre annuel de bactériémies à S. aureus pour la période 2010 à 2014 au CHU de Grenoble d’après les données du laboratoire de bactériologie.
25# 19# 16# 10# 24# 130# 123# 138# 200# 173# 155# 142# 154# 210# 197# 0# 50# 100# 150# 200# 250# 2010# 2011# 2012# 2013# 2014# Effe c-f# Année#
Les bactériémies nosocomiales à SAMS ayant elles aussi une évitabilité potentielle, cette étiologie ne doit pas être négligée face aux souches résistantes à la méticilline. Cette thèse est d’ailleurs soutenue par les résultats de travaux relatifs à la prévention des bactériémies à S. aureus, et menés en Australie, où au moins un facteur évitable a été identifié dans 33 % des bactériémies à SAMS associées aux soins (8). Une réflexion autour de la mise en œuvre d’une démarche d’AAC élargit à l’ensemble des bactériémies nosocomiales à staphylocoque doré a ainsi été engagée dans notre établissement.
L’objectif principal de ce travail est d’évaluer l’intérêt et la faisabilité d’une démarche d’AAC étendues à tous les cas de bactériémies nosocomiales à Staphylococcus aureus (BN-‐SA).
Les objectifs secondaires sont :
- décrire l’épidémiologie des bactériémies à S. aureus (B-‐SA) et plus particulièrement des BN-‐SA acquises au CHU de Grenoble ;
- développer la prévention autour de ce risque infectieux dans le cadre de l’amélioration continue de la qualité en s’appuyant sur ces investigations ;
- déterminer l’évitabilité des BN-‐SA selon une méthode standardisée.
Les retombés attendus de ce travail sont une meilleure prise en considération des mesures de prévention du risque infectieux et une diminution de l’incidence des BN-‐SA
2. REVUE GENERALE DE LA LITTERATURE
2.1. Staphylococcus aureus 2.1.1. Caractéristiques bactériologiquesStaphylococcus aureus est une bactérie ubiquitaire, retrouvée sous toutes les latitudes du globe terrestre. De la famille des Micrococcaceae, les staphylocoques dorés se présentent sous l’aspect de cocci à Gram positif. D’environ 1 µm de diamètre, les coques forment des amas dit en « grappe de raisin ». Son nom vient de la pigmentation dorée de ses colonies, liée à la présence de caroténoïdes. Contrairement aux autres espèces de staphylocoques, S. aureus sécrète une coagulase.
De nombreux facteurs de virulence ont déjà été mis en évidence chez S. aureus (9): - facteurs de colonisation, d’adhésion, d’invasion et de diffusion :
o protéine A (ou Spa) : est un facteur de colonisation de par son affinité au facteur Willebrand ;
o protéine de liaison au collagène Cna : son rôle dans les infections ostéo-‐ articulaires semble être important ;
o protéines de liaison à la fibronectine FnbpA et FnbpB : à l’origine de l’adhérence de S. aureus aux caillots sanguins et aux dispositifs invasifs en contact avec le compartiment sanguin ;
o protéines de liaison au fibrinogène ClfA et ClfB : aussi dénommé Clumping factor, ce récepteur permet l’agrégation bactérienne en présence de plasma constituant ainsi un facteur de virulence en cas de plaies ou de dispositifs invasifs ;
o coagulase : active la thrombine et est ainsi à l’origine de la production de fibrine. Sa présence est également un des éléments de l’identification bactériologique du staphylocoque doré ;
o staphylokinase : impliqué dans le mécanisme de diffusion hématogène à porte d’entrée thrombophlébitique par son activité fibrinolytique fragmentant les caillots ;
o mais aussi des récepteurs à diverses protéines tel que le plasminogène, la thromboplastine, l’élastine ou la laminine, des sidérophores, ou le Fatty Acid Modifying Enzyme (FAME) ;
- facteurs de résistance à la phagocytose :
o la protéine A est également un facteur de résistance à la phagocytose en se liant aux fragments Fc des anticorps anti-‐staphylocoques ;
o capsule polysaccharidique : présente chez la majorité des souches de S. aureus, certains sérotypes capsulaires sont associés à des capsules épaissies (macrocapsules) et à des souches plus virulentes ;
- toxines :
o α-‐toxine : sa polymérisation forme des pores sur les surfaces membranaires de nombreux types cellulaires entrainant leur lyse ;
o β-‐toxine : son activité de sphyngomyélinase provoque la dégradation des membranes cellulaires ;
o δ-‐toxine : le mécanisme de cette hémolysine est inconnu ;
o γ-‐toxine : forme des pores membranaires laissant libre passage aux cations divalents, elle est douée de propriétés hémolytique et leucotoxique ; o leucocidine de Panton-‐Valentine : ses propriétés leucotoxique et
dermonécrotique sont également la conséquence de la formation de pores membranaires ;
o entérotoxines : thermostables, de nombreuses entérotoxines ont déjà été identifiées. L’entérotoxine A est la plus souvent impliquée dans les toxi-‐ infections alimentaires. Ces toxines sont dotées d’une activité super-‐ antigénique, qui est un mécanisme de liaison simultanée aux récepteurs des lymphocytes T et à une molécule de classe II du complexe majeur d’histocompatibilité des cellules présentatrices d’antigènes. Ceci va être à l’origine d’une stimulation polyclonale des lymphocytes T sans spécificité antigénique, et ainsi d’une libération massive de cytokines à une dose toxique.
o toxine du choc toxique staphylococcique (TSST1) : également dotée de propriétés super-‐antigèniques ;
o exfoliatines : ce sont des toxines responsables de lésions épidermiques bulleuses superficielles par une activité de type protéase à sérine agissant au niveau des desmosomes.
L’expression de ses facteurs de virulence est régulée par un système de quorum sensing (systèmes agr et sar), permettant une optimisation des propriétés de chacun en fonction du stade de l’invasion bactérienne.
2.1.2. Le rôle de la colonisation
L’homme constitue le principal réservoir écologique de S. aureus, germe commensal de la flore muqueuse et cutanée. Les fosses nasales antérieures constituent le site de colonisation préférentiel du staphylocoque doré. Deux grands types de portage peuvent être distingués :
- le portage intermittent, concernerait 30 à 60 % de la population (10,11) ;
- le portage permanent, touchant 20 % de la population (10,11).
Ainsi, seulement 20 à 50 % des humains sont considérés non porteurs de staphylocoque doré.
Certains facteurs sont associés à une colonisation nasale à S. aureus plus fréquente dont entre autres le diabète, la dépendance à l’hémodialyse ou certaines atteintes dermatologiques (eczéma, psoriasis) (10). Les mains constituent le principal vecteur d’inoculation du S. aureus vers le nez, souvent à partir des surfaces (12).
Les patients colonisés par cette bactérie présentent un risque plus élevé de contracter une infection nosocomiale (10). Ainsi, le risque de développer une BN-‐SA est trois fois plus élevé chez ces patients par rapport à des patients non colonisés selon une étude portant sur 14 000 patients (1,2 % versus 0,4 % ; IC95% = 2,0 – 4,7) (13). Cependant, il a également été démontré dans cette même étude que le taux de mortalité secondaire aux
BN-‐SA était plus faible chez les patients colonisés (8 % versus 32 % ; p=0,006). Ce phénomène semble être expliqué par le développement d’une réponse immunitaire spécifique de la souche colonisatrice chez les patients porteurs de staphylocoque doré (14). Notons également que dans 80 % des cas la même souche est isolée sur le site infectieux et le site de colonisation, laissant ainsi supposer une origine endogène à l’infection, et que 10 % des patients colonisés sont porteurs d’au moins deux souches différentes de S. aureus. Ainsi, l’immunité humorale spécifique de la souche colonisatrice pourrait contribuer à améliorer le pronostic de survie en cas de bactériémie par rapport aux patients non colonisés. Dans la population des patients hémodialysés chroniques, l’occurrence d’une bactériémie à S. aureus s’est également révélée être trois fois plus fréquente en cas de colonisation nasale, ce chiffre étant même porté à près de 26 si le site d’insertion du cathéter est lui aussi colonisé par ce germe de manière concomitante avec le nez (10). Enfin, parmi les infections nosocomiales plus fréquemment rencontrées chez les patients colonisés à S. aureus, les infections de site opératoire constituent une part notable (15,16). Une distinction peut également être introduite entre la population des colonisés permanents et des colonisés intermittents puisque l’inoculum ainsi que le risque de développer une infection à S. aureus apparaissent plus élevés chez les individus ayant un portage nasal permanent (10).
A un moindre degré, ce germe colonise également de nombreux autres sites anatomiques tels que les aisselles, le pharynx, le périnée ou le tractus gastro-‐intestinal notamment (10). Le taux de portage de S. aureus sur ces différents sites anatomiques est plus élevé chez les individus colonisés au niveau nasal que les individus non-‐colonisés : 60 % versus 22 % au niveau du périnée, ou bien 19 % versus 8 % au niveau axillaire par exemple (10). Le pharynx est également un site de colonisation fréquemment mis en évidence, qui permettrait d’objectiver une colonisation à S. aureus chez 13 à 20 % des individus en l’absence d’une colonisation nasale concomitante (17,18).
La méthode de décolonisation repose généralement sur l’application intra-‐nasale de pommade à base de mupirocine associée à une douche quotidienne avec un savon antiseptique à base de chlorhexidine (19–21). Ce type de stratégie s’est avérée efficace sur le taux d’infections de site opératoire, après une stratégie de dépistage rapide
préopératoire, et notamment en cas de chirurgie cardiaque et de certaines chirurgies orthopédiques avec pose de matériel prothétique (19,20). L’impact d’une stratégie de décolonisation nasal s’est avéré également positif chez les patients hémodialysés chronique (22,23).
2.1.3. Implication en pathologie humaine
L’association entre une forte prévalence dans la population et de nombreux facteurs de virulence font du staphylocoque doré un pathogène majeur (24). S. aureus est un des principaux germes impliqués en pathologie humaine. Il est à l’origine de deux grands types de syndromes :
- les infections suppuratives, pouvant toucher tous types d’organes :
o infections de la peau et des tissus mous : folliculite, furoncle, orgelet, périonyxis, panaris, anthrax, impétigo, phlegmon, etc ;
o infections du tractus respiratoire : angine, sinusite, pneumopathie, etc ; o infections du système nerveux central : méningite, épidurite, empyème
sous dural, etc ;
o infections urinaires : cystite, pyélonéphrite, prostatite ;
o infections endovasculaires et valvulaires cardiaques : endocardite infectieuse, bactériémie, etc ;
o infections musculaires et osseuses : ostéomyélite, arthrite septique, pyomyosite, spondylodiscite, etc.
- les toxémies staphylococciques, parmi lesquelles figurent:
o le Syndrome de Choc Toxique Staphylococcique (SCTS) : initialement décrit chez des femmes et lié à l’utilisation de tampons menstruels super-‐ absorbants laissés en place de manière prolongée, cette entité nosologique se manifeste cliniquement par l’association d’un syndrome de choc avec atteinte viscérale et d’une érythrodermie généralisée non systématiquement desquamative. La toxine TSST1 est directement responsable du SCTS ;
o le syndrome d’exfoliation généralisée : également nommé syndrome de la peau ébouillantée, il se caractérise par une érythrodermie péri-‐orbitaire et péri-‐buccale à la phase initiale avant de se généraliser rapidement. S’en suit alors un décollement bulleux intra-‐épidermique. Les exfoliatines sont impliquées dans ce syndrome ;
o la pneumonie staphylococcique nécrosante : cette infection redoutable, associant une pneumonie aiguë avec insuffisance respiratoire, un syndrome de choc et une leucopénie, survient fréquemment dans les suites d’un syndrome pseudo-‐grippal. Les souches de staphylocoque doré impliquées sont productrices de la leucocidine de Panton-‐Valentine ; o les toxi-‐infections alimentaires : d’incubation très rapide, ce sont les
entéroxines staphylococciques souvent présentes dans des préparations pâtissières à base de crème qui en portent la responsabilité. Les manifestations cliniques les plus courantes associent diarrhée, douleurs abdominales et vomissements.
Les infections suppuratives sont largement prépondérantes au regard des syndromes toxémiques d’un point de vue quantitatif.
Ces infections sont largement communautaires mais représentent aussi une part très importante des infections associées aux soins. En France, lors de la dernière ENP, S. aureus représentait, parmi les infections nosocomiales documentées, la deuxième cause de pneumonies (14,7 %), la deuxième cause d’infections de la peau et des tissus mous (11,8 %) et la première cause d’ISO (29,2 %) et de bactériémie (18,4 %) (1). Dans une étude américaine de grande ampleur, il a été observé que S. aureus était la deuxième cause d’infections associées aux soins avec une part relative s’élevant à 10,7 %, et était notamment impliqué dans 16,4 % des pneumonies et 15,5 % des ISO (25). Ces résultats démontrent l’importance que revêt ce germe dans l’épidémiologie des infections associées aux soins.
S. aureus est également un germe responsable d’épidémies. De nombreux cas touchant divers services de soins sont décrits dans la littérature (26–28). La dissémination du
S. aureus en milieu de soins repose le plus souvent sur une transmission de type contact direct, via les mains du personnel soignant (26,29). Une transmission par contact indirect à partir des surfaces contaminées est un autre mode dissémination incriminé en milieu hospitalier (30). La capacité de survie prolongée de cette bactérie dans l’environnement, jusqu’à sept mois (31), contribue à cette transmissibilité.
2.1.4. La résistance à la méticilline
Le S. aureus résistant à la méticilline, ou SARM, fait partie des problématiques notables de santé publique à travers le monde. Ces souches sont résistantes à la plupart des antibiotiques de la famille des béta-‐lactamines. Le mécanisme de ce phénomène est la présence d’une cible pharmacologique modifiée, la PLP2a (Protéine Liant les Pénicillines), provoquant une diminution de l’affinité de ces antibiotiques (32). La résistance à la méticilline était jusqu’à présent essentiellement codée par le gène mecA, cependant un nouveau gène de résistance, mecC, a été récemment découvert (33).
Malgré une baisse de l’incidence des infections nosocomiales à SARM ces dernières années en France (34), les souches résistantes représentent encore près de 20 % des souches de S. aureus isolées chez l’homme à l’heure actuelle dans notre pays (35,36).
Longtemps supposé cantonnée au milieu de soins, la présence de SARM au niveau communautaire est désormais avérée, avec des caractéristiques néanmoins différentes telles qu’une proportion de souches productrices de la leucocidine de Panton-‐Valentine plus élevée (37,38). A l’instar des souches hospitalières de SARM, les souches communautaires présentent également un antibiotype souvent différent puisque sensible à la plupart des antibiotiques, exceptées les béta-‐lactamines.
Enfin, signalons que la résistance aux antibiotiques de la famille des glycopeptides chez le S. aureus est un phénomène dont l’émergence suscite des inquiétudes (39), bien que l’incidence en France soit très limitée à l’heure actuelle.
2.2. Les bactériémies nosocomiales à S. aureus
2.2.1. Les bactériémies : généralités
Les bactériémies correspondent à un état septique au cours duquel des bactéries sont retrouvées dans le sang, compartiment physiologiquement stérile. La mise en évidence de ces bactéries est réalisée sur des flacons d’hémocultures. Le passage de ces germes dans le système vasculaire se fait à partir d’un foyer primaire tel qu’une brèche cutanée ou une infection pulmonaire par exemple, on parle alors de bactériémie secondaire. Dans le cas où aucun foyer primitif n’est retrouvé, la bactériémie sera qualifiée de primaire. Les bactériémies peuvent se manifester cliniquement sous divers aspects, pouvant aller jusqu’au choc septique et conduire au décès du patient (40).
La proportion de bactériémies acquises en établissement de soins s’élève à près de 50 % (41,42). Friedman et al. distinguent dans une étude sur 504 bactériémies une origine communautaire pour 28 % des cas, associée aux soins acquise en dehors d’un établissement hospitalier pour 37 % et nosocomiale pour 35 % des cas (43).
Dans l’ENP de 2012, il a été constaté que les bactériémies nosocomiales touchaient 0,5 % des patients hospitalisés en France, représentant ainsi 10,1 % des infections nosocomiales totales. Ces chiffres s’élevaient respectivement à 0,7 % et 10,6 % à l’échelle européenne (2). En terme d’incidence, les bactériémies concerneraient près de 60 patients pour 10 000 admissions en hospitalisation aux Etats-‐Unis (4), soit 250 000 épisodes bactériémiques par an (44).
Le taux de mortalité associée aux bactériémies nosocomiales atteint 10 à 50 % selon les études (24,44).
2.2.2. Place du staphylocoque doré dans les bactériémies nosocomiales
D’un point de vu épidémiologique, la place de S. aureus est majeure puisque il est le premier micro-‐organisme en cause dans les bactériémies nosocomiales en France avec une part relative de 18,4 % (1), et le deuxième (20,2 %) derrière les staphylocoques à coagulase négative (31,3 %) aux Etats-‐Unis (4). D’après l’enquête européenne de prévalence des infections associées aux soins conduite en 2011-‐2012, S. aureus représentait également la seconde cause de bactériémie avec 15,9 % des cas après les staphylocoques à coagulase négative (18,5 %) (2).
L’occurrence des bactériémies à staphylocoque doré est associée à différents facteurs de risque. Ainsi, les âges extrêmes (45), la présence d’une colonisation préalable, la présence de dispositifs médicaux invasifs (46,47) et les états d’immunodépression (48) sont des éléments favorisants.
2.2.3. Morbidités secondaires aux bactériémies à S. aureus
Les bactériémies à staphylocoque doré peuvent être à l’origine de disséminations secondaires. Des métastases septiques sont fréquemment retrouvées puisque environ 20 à 30 % des patients seraient concernés (49). Parmi ces dernières, les endocardites infectieuses concerneraient 6 à 32 % des patients (50), sachant que les endocardites infectieuses compliqueraient davantage les bactériémies communautaires que les bactériémies nosocomiales (51). Les autres localisations infectieuses métastatiques pouvant être retrouvées sont des abcès, notamment localisés au niveau du psoas, des ostéomyélites, des arthrites septiques, des méningites ou des spondylodiscites (49,52).
Les bactériémies à S. aureus présentent également un risque de rechute important. A 12 semaines, 12,7 % de ces épisodes infectieux avaient rechuté dans une étude américaine (49), la présence d’un foyer infectieux secondaire favorisant particulièrement ce phénomène (53).
2.2.4. Mortalité des bactériémies à S. aureus
En l’absence de traitement antibiotique adapté, le taux de mortalité des patients atteints de bactériémies à S. aureus s’élèverait à plus de 80 % selon une étude conduite dans les années 1940 (54). Aujourd’hui, la mortalité suite à une BN-‐SA reste encore importante. Le taux de mortalité tous types de services confondus a été évalué à 25,4%, dont 34,4% en service de réanimation et 18,9 % hors réanimation, sur une cohorte de 24 000 cas (4). Dans une étude danoise, les auteurs ont estimé que la mortalité secondaire aux BN-‐SA avait significativement diminué entre les années 1980 et 2000 (36,2 % versus 20,7 % ; p<0,0001) (55).
Le taux de mortalité s’avère plus élevé en cas de comorbidités, d’infection à SARM ou de délai de positivité des hémocultures inférieur ou égal à 12 heures (56–58). Le foyer primaire de la bactériémie à S. aureus influence également le pronostic de survie, ce dernier étant plus réservé en cas de foyer primitif pulmonaire notamment, et plus favorable en cas de foyer primitif à partir d’un cathéter veineux périphérique ou central (59).
2.2.5. Implication des staphylocoques dorés résistant à la méticilline
La méticillino-‐résistance concernait 40% des souches de S. aureus isolées lors d’épisodes de bactériémie nosocomiale en France en 2002 (42) et 35 % en 2012 (1). Ainsi, les souches résistantes à la méticilline seraient proportionnellement plus fréquentes en cas de BN-‐SA par rapport aux infections nosocomiales toutes étiologies confondues.
Certains éléments apparaissent être des facteurs de risque de bactériémie à SARM : - traitement antibiotique préalable (60–63) ;
- bactériémie acquise en hospitalisation ou associée aux soins (60,63) ; - présence de comorbidités (60,61) ;
- institutionnalisation (62) ; - coexistence d’escarres (63).
L’influence de la résistance à la méticilline au cours des bactériémies est un élément péjoratif pour la survie du patient. Plusieurs méta-‐analyses ont démontré que la présence de SARM engendrait un sur-‐risque de mortalité d’un facteur proche de deux (64)(65). Cette surmortalité serait en partie la conséquence d’un retard à la mise en place d’un traitement antibiotique approprié (66).
2.3. Analyse approfondie des causes et évitabilité
2.3.1. La gestion des risques dans la maitrise du risque infectieux
Initialement développé dans le domaine de l’aéronautique, la gestion des risques est un concept d’application relativement récente dans le domaine de la santé. La finalité de cette démarche est la maitrise des évènements indésirables associés aux soins (EIAS). Ces EIAS présentant un caractère souvent évitable, estimé à près de 40 % des cas (67), la gestion des risques et la sécurité des patients ont été déclarées priorités de santé publique dans le programme national pour la sécurité des patients 2013-‐2017 écrit conjointement par le Direction Générale de l’Offre de Soins (DGOS), la Direction Générale de la Santé (DGS) et la Haute Autorité de Santé (HAS) (68).
La démarche de gestion des risques est un processus comprenant plusieurs étapes : - identification d’un événement indésirable potentiel ou avéré ;
- analyse de cet événement grâce à des outils spécifiques ; - mise en place de mesures barrières ;
- évaluation et suivi de l’efficacité de ces mesures.
Il peut être distingué deux types de démarche de gestion des risques en fonction de leur chronologie de mise en application par rapport à la survenue d’un événement indésirable : les méthodes a priori (ou proactives) et les méthodes a posteriori (ou
réactives). Néanmoins ces deux approches présentent des aspects complémentaires. Parmi les outils de gestion des risques a priori, nous pouvons citer le chemin clinique, la cartographie des risques, l’AMDEC (Analyse des Modes de Défaillance de leurs Effets et de leurs Criticités) ou les évaluations de pratiques professionnelles (EPP). Les outils utilisés a posteriori regroupent notamment des méthodes d’analyse systémique telles que les méthodes ORION©, REMED (Revue des Erreurs liées aux Médicaments Et Dispositifs médicaux associés), ALARM (Association of Litigation And Risk Management) ou bien les arbres des causes (diagramme d’Ishikawa).
Depuis l’instruction n° DGOS/PF2/2014/66 du 4 mars 2014, relative au bilan des activités de lutte contre les infections nosocomiales dans les établissements de santé pour l’année 2013, les bactériémies nosocomiales à SARM figurent au tableau de bord des infections nosocomiales (5). Cet indicateur, « BN-‐SARM », prend en compte deux éléments : le nombre de BN-‐SARM acquises dans l’établissement et la proportion de celles ayant fait l’objet d’une AAC. De plus, il est précisé dans cette instruction que la méthodologie d’AAC employée devra être reconnue. Cet indicateur reflète ainsi la politique de gestion des risques a posteriori de l’établissement de santé, et focalisée sur un événement indésirable grave et emblématique. Enfin, l’existence d’une démarche d’AAC en cas de survenu d’un évènement infectieux grave rentre aussi en compte dans l’indicateur ICALIN.2 du tableau de bord des infections nosocomiales incitant une fois encore à l’usage de ce type de méthode (5).
Concernant la pratique de l’hygiène hospitalière, le guide pratique La gestion du risque infectieux dans un établissement de santé, une démarche collective au service du patient, et rédigé par le CCLIN Ouest (Centre de Coordination de la Lutte contre les Infections Nosocomiales) en 2014, expose les outils de gestion des risques applicables à la maitrise du risque infectieux (69). Ainsi d’après ce guide, la méthode ALARM et l’arbre des causes sont des outils de choix en cas de démarche a posteriori appliquée à ce domaine.
La finalité de ce type de démarche est l’élaboration d’action d’amélioration, et en conséquence la prévention de la survenue de l’événement en question.