Étude des performances du procédé d’ultrafiltration lors
de la concentration d’un lait traité par hautes pressions
hydrostatiques
Mémoire
Mathilde Leu
Maîtrise en sciences des aliments
Maître ès science (M. Sc.)
Québec, Canada
ii
Étude des performances du procédé d’ultrafiltration lors
de la concentration d’un lait traité par hautes pressions
hydrostatiques
Mémoire
Mathilde Leu
Sous la direction de :
Alain Doyen, directeur de recherche
Laurent Bazinet, codirecteur de recherche
iii
RESUME
L’ultrafiltration (UF) est utilisée en industrie laitière pour la production de concentrés protéiques laitiers. Récemment, des études ont démontré que l’utilisation des hautes pressions hydrostatiques (HPH) permet d’améliorer la durée de vie du lait mais a un effet important sur les protéines (diminution de la taille des micelles de caséine, dénaturation/agrégation des protéines sériques). Ces effets peuvent ainsi altérer les performances du procédé d’UF. Cette étude avait donc pour but de déterminer l’impact d’un prétraitement du lait par HPH (300 et 600 MPa, 5 min) sur les performances du procédé d’UF. L’effet des HPH a d’abord été étudié sur les différentes fractions protéiques du lait. Ensuite, l’UF a été réalisée en mode recirculation totale afin de déterminer les paramètres de filtration optimaux et l’effet des HPH sur les valeurs de flux critiques et limites. Des filtrations en mode concentration ont également été réalisées afin d’évaluer l’effet des HPH sur les flux de perméation et le colmatage. Il a été observé que la taille des micelles de caséine diminue de 32% et 38% et le taux de dénaturation de la bêta-lactoglobuline (β-LG) atteint 30% et 70% après une pressurisation respective à 300 et 600 MPa durant 5 min. En mode recirculation totale, et comparativement au lait témoin, les flux de perméation ont diminué de 25% suite à la filtration des laits pressurisés. En mode concentration, les flux initiaux étaient 30% plus faibles pour les deux traitements HPH comparativement au lait témoin. Le calcul des résistances membranaires a montré un colmatage irréversible plus important à 600 MPa. Finalement, une caractérisation de la couche de colmatage a permis de confirmer que la caséine et la β-LG étaient responsables des baisses de flux. Les résultats démontrent ainsi qu’un traitement HPH altère drastiquement les performances d’UF et modifie la composition de la couche colmatante.
iv
ABSTRACT
In dairy industry, ultrafiltration (UF) is largely used to produce milk protein concentrates. Recently, it was demonstrated that high hydrostatic pressure (HHP) extended shelf-life of milk but decreased the casein micelle size and induced denaturation and aggregation of whey proteins. Therefore, these modifications could negatively impact UF performances. Consequently, this study aims to determine the impact of skim milk pre-treatment by HHP (300 and 600 MPa, 5 min) on UF performances. Firstly, impact of HHP was studied on proteins which composed the colloidal and serum phases. Afterwards, UF was performed in full recycle mode to determine optimal parameters for the concentration mode and to characterize the impact of pressurization on critical and limiting fluxes. Then, pressure-treated milks were ultrafiltrated in concentration mode to evaluate permeate flux decline and fouling phenomenon. It was observed that casein micelle size decreased by 32% and 38% while β-LG denaturation reached 30% and 70% at 300 and 600 MPa during 5 min, respectively. During pressure-treated milk concentration by UF, initial fluxes were 30% lower at 300 and 600 MPa compared to control. Moreover, hydraulic resistance of membrane indicate a significant irreversible deposition for milk treated at 600 MPa. Finally, the characterization of the fouling layer confirmed that casein and β-LG proteins represented major fouling species at membrane surface after UF of pressure-treated milks, especially at 600 MPa. Consequently, our results demonstrated that HPP treatment of skim milk had major negative impact on UF performance and modified the composition of membrane fouling layer.
v
TABLE DES MATIERES
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations ... x
Remerciements ... xii
Avant-propos ... xiii
Introduction ... 1
Chapitre 1. Revue de littérature ... 4
1. Les protéines laitières ... 5
1.1. Généralités ... 5
1.2. Les fractions protéiques du lait ... 6
1.2.1. Les protéines sériques ... 6
1.2.1.1. La bêta-lactoglobuline ... 6
1.2.1.2. L’α-lactalbumine ... 8
1.2.1.3. Les protéines mineures du lactosérum ... 9
1.2.2. Les caséines ... 11
1.2.2.1. Les types de caséines... 11
1.2.2.2. Structure et propriétés de la micelle ... 13
2. Les hautes pressions hydrostatiques ... 17
2.1. Principes et applications dans le domaine laitier ... 18
2.1.1. Principe ... 18
2.1.2. Applications ... 19
2.1.3. Utilisation dans le domaine laitier ... 20
2.2. Effet des HPH sur les différents composants d’un système biologique ... 20
2.3. Effet des HPH sur les protéines du lait ... 21
2.3.1. Généralité ... 21
2.3.2. Impact sur la micelle de caséine ... 22
2.3.3. Impact sur les protéines sériques ... 24
2.3.3.1. Effet sur la β-lactoglobuline ... 24
2.3.3.2. Effet sur l’α-lactalbumine ... 25
2.3.3.3. Effet sur les protéines mineures du lactosérum ... 26
2.3.4. Interactions protéiques générées ... 26
3. Le procédé d’ultrafiltration ... 28
3.1. Principe et utilisation de l’ultrafiltration en industrie laitière ... 29
3.2. Les paramètres de filtration ... 29
3.2.1. Paramètres liés au système de filtration ... 30
3.2.1.1. Mode opératoire ... 30
vi
3.2.1.3. Les différents types de module... 32
3.2.2. Les conditions opératoires ... 35
3.2.2.1. Facteur de concentration volumique ... 35
3.2.2.2. Pression transmembranaire ... 35
3.2.2.3. Flux de perméation ... 35
3.2.2.4. Température ... 35
3.3. Le colmatage membranaire : principale limite des procédés de filtration ... 36
3.3.1. Définition et principe ... 36
3.3.2. Composition de la couche colmatante ... 40
3.3.3. Stratégies de prévention et de traitement ... 41
Chapitre 2. Hypothèse et objectifs de recherche ... 43
1. Hypothèse de recherche ... 44
2. Objectifs ... 44
Chapitre 3. Impact of high hydrostatic pressure-treated skim milk on permeate flux and fouling during ultrafiltration ... 45
1. Résumé ... 47
2. Abstract ... 48
3. Introduction ... 49
4. Materials and methods ... 51
4.1. Milk supply ... 51
4.2. High hydrostatic pressure treatment ... 51
4.3. Ultrafiltration system... 52
4.4. Operational modes... 52
4.4.1. Total recycle mode ... 52
4.4.2. Concentration mode ... 53
4.4.3. Rejection coefficient ... 53
4.5. Membrane fouling evaluation ... 54
4.5.1. Membrane fouling characterization ... 54
4.5.2. Membrane fouling analysis ... 54
4.6. Analyses ... 55
4.6.1. Particles size analysis ... 55
4.6.2. Separation of the soluble and the micellar phase of milk ... 55
4.6.3. Protein profile analysis by SDS-PAGE ... 55
4.6.4. Protein profile analysis by HPLC analysis ... 56
4.7. Statistical analysis ... 56
5. Results ... 57
5.1. Modification of casein micellar diameter by high hydrostatic pressure ... 57
5.2. Impact of pressurization on whey proteins ... 57
5.3. Ultrafiltration ... 58
5.3.1. Total recycle mode ... 58
5.3.2. Concentration mode ... 60
5.3.3. Fouling ... 63
6. Discussion ... 64
6.1. Effect of HHP on milk protein ... 64
vii
6.3. Time evolution of permeate flux during skim milk concentration... 67
6.4. Membrane fouling evaluation ... 67
7. Conclusion ... 68
8. Acknowledgements ... 69
Chapitre 4. Discussion et conclusion générale ... 70
1. Discussion générale ... 71
2. Conclusion générale ... 75
viii
LISTE DES TABLEAUX
Tableau 1 - Propriétés des différentes caséines 22 ... 11 Tableau 2 - Effet des HPH sur les interactions chimiques 51... 22 Tableau 3 - Principaux avantages et inconvénients des modules membranaires 19... 32 Tableau 4 - Concentration of α-LA and β-LG in the supernatant of control and pressurized
skim milk samples ... 58 Tableau 5 - Evolution of critical and limiting fluxes during total recirculation of control and
pressure-treated milk samples. ... 60 Tableau 6 - Protein content of retentates and permeates, rejection coefficients and
concentration factors obtained after UF concentration of control and pressure-treated skim milk at 300 and 600 MPa... 62 Tableau 7 - Hydraulic resistance of the UF membrane ... 63
ix
LISTE DES FIGURES
Figure 1 - Pourcentage des différentes protéines du lait 21 ... 5
Figure 2 - Séquence d'acides aminés de la β-lactoglobuline pour la variante génétique B du lait de vache 25 ... 6
Figure 3 - Structure tridimensionnelle de la bêta-lactoglobuline 12... 7
Figure 4 - Structure et site fonctionnel de l'α-LA 26 ... 8
Figure 5 - Structure tridimensionnelle de la ASB 29 ... 9
Figure 6 - Structure schématique d'une Immunoglobuline 23 ... 10
Figure 7 - Structure 3D de la Lactoferrine 34 ... 10
Figure 8 - Modèle de caséine présenté par Waugh en 1958 43 ... 14
Figure 9 - Représentation schématique du modèle submicellaire de Schmidt, revu en 2005 41 ... 15
Figure 10 - Modèle de micelle de caséines selon Walstra en 1999 43 ... 15
Figure 11 - Représentation du modèle micellaire proposé par Holt 43 ... 16
Figure 12 - Illustration de la formation du réseau selon le modèle de Holt 41 ... 16
Figure 13 - Micrographe par transmission d'électron d'une micelle de caséine 42 ... 17
Figure 14 - Schéma de principe du traitement par HPH 46 ... 18
Figure 15 - Diagramme de l'eau sous pression 62 ... 21
Figure 16 - schéma synthétique des effets des HPH sur les micelles de caséines 67 ... 24
Figure 17 - Model de dénaturation de la β-lg sous pression 12 ... 25
Figure 18 - Les différents systèmes de filtration membranaire 18 ... 28
Figure 19 - Représentation schématique d'une filtration frontale (a) et d’une filtration tangentielle (b) 74 ... 30
Figure 20 - Configurations membranaire en fonction de leur structure 74 ... 32
Figure 21 - Configuration Plate-and-frame 76... 33
Figure 22 - Configuration d'un module spiralÉ 76 ... 33
Figure 23 - Module d'une membrane tubulaire 76 ... 34
Figure 24 - Schémas des différents mécanismes de colmatage : (a) adsorption (b) blocage des pores (c) formation d'un gâteau 77 ... 37
Figure 25 - représentation schématique du colmatage protéique 83... 38
Figure 26 - Apparition du flux limite et du flux CRITIQUE SUR le graphique Flux-PTM (adapté de 87) ... 39
Figure 27 - diagramme des facteurs influençant le nettoyage 97 ... 42
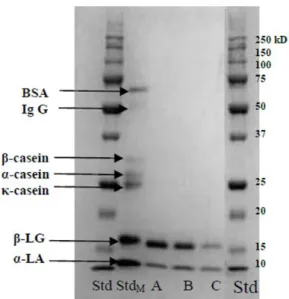
Figure 28 - SDS-PAGE pattern of surpernatant for (A) non-pressurized milk, (B) milk pressurized at 300 MPa and (C) 600 MPa. Std, standard, StdM, standard composed of the different milk proteins ... 58
Figure 29 – Flux-transmembrane pressure relationship for non-treated milk (•) and pressured-treated milk at 300 MPa (○) and 600 MPa (▼) ... 59
Figure 30 - Evolution of permeate flux for unpressurized milk (•) and milk treated at 300 MPa (○) and 600 MPa (▼) ... 61
Figure 31 - SDS-PAGE pattern of fouling layer recovered after UF for non-pressurized milk (A), milk pressurized at 300 MPa (B) and 600 MPa (C) ... 64
x
LISTE DES ABREVIATIONS
α-LA : alpha-lactalbumineArg : arginine
β-LG : bêta-lactoglobuline Ca : calcium
CN : caséine
FCV : facteur de concentration volumique Lf : lactoferrine
Gln : glutamine HΦ : hydrophobicité HP : haute pression
HPH : haute pression hydrostatique Ig : immunoglobuline
J : flux de perméation (L/h.m2 ou L/h.m2. Pa) Jcrit : flux critique (L/h.m2 ou L/h.m2. Pa) Jlim : flux limite (L/h.m2 ou L/h.m2. Pa) K : potassium MF : microfiltration Mn : magnésium Na : sodium NF : nanofiltration OI : osmose inverse
PCM : phosphate de calcium micellaire PTM : pression transmembranaire RREV : Résistance réversible (m-1) RIR : Résistance irréversible (m-1) RM : Résistance de la membrane (m-1) RT : Résistance totale (m-1)
ASB : l’albumine de sérum bovin Tb : terbium
UF : ultrafiltration Zn : zinc
xi
xii
REMERCIEMENTS
Tout d’abord, j’aimerais remercier mon directeur de recherche : Alain Doyen. Il a su être présent quand les choses n’allaient pas (et même quand tout se passait bien) pour m’aider dans la réflexion scientifique. Il a toujours été disponible pour parler de mon projet. Son approche d’un problème et son sens critique m’ont permis de développer le mien et sa confiance en moi m’a également permis de développer mon autonomie. Il est toujours très à l’écoute de ces étudiants ce qui lui apporte leur confiance et le rend plus disponible. De plus, son humour m’a toujours apporté le sourire et permis de garder le moral. Alors un grand merci pour m’avoir soutenu tout au long de ma maitrise.
En second lieu, je souhaiterais remercier mon co-directeur Laurent Bazinet ainsi que le professeur Yves Pouliot pour leur aide à solutionner certains problèmes rencontrés. De plus, leurs avis scientifiques et leurs conseils m’ont aussi permis de m’améliorer sur le plan scientifique. Merci de m’avoir invité à toutes vos réunions d’équipe. J’ai pu y acquérir de nombreuses connaissances scientifiques à travers la présentation du projet de recherche des autres étudiants. Par la même occasion, j’aimerais remercier toutes les équipes de recherche que j’ai pu côtoyer au cours de ma maitrise. Tout le monde a été très accueillant et disponible pour de l’entre-aide.
Je tiens également à mentionner la présence de Diane Gagnon que je remercie énormément. Son expertise m’a grandement aidé en laboratoire pour résoudre les problèmes d’ordre analytique. Elle a toujours répondu présente en cas de problèmes et ce avec bonne humeur. De même, je souhaiterais remercier les personnes du laboratoire pilote pour leur soutien technique lors de la phase expérimentale de mon projet : Mélanie Martineau, Pascal Lavoie et Pierre Côté. De plus, je voudrais remercier les personnes du Centre de Développement Bioalimentaire du Québec (CDBQ) qui m’ont aidé à réaliser les manipulations de pressurisation.
Pour finir, j’aimerais remercier les organismes subventionnaires : le ministère de l’Agriculture, des Pêches et de l’Alimentation du Québec (MAPAQ) ainsi que la fromagerie Bergeron sans qui ce projet n’aurait pu avoir lieu.
xiii
AVANT-PROPOS
Les travaux de recherche présentés dans ce mémoire ont été réalisés dans le cadre de ma maîtrise en Sciences et Technologie des Aliments au sein du Département des Sciences des Aliments de la Faculté des Sciences de l’Agriculture et de l’Alimentation de l’Université Laval. Les recherches réalisées traitent de « l’étude des performances du procédé d’ultrafiltration lors de la concentration d’un lait traité par hautes pressions hydrostatiques ».
Ce mémoire est divisé en quatre chapitres :
- Le Chapitre 1 est un état de l’art des connaissances sur le sujet traité. Cette revue bibliographique est organisée de façon à présenter les protéines laitières et leur structure, suivie par une introduction sur le procédé à hautes pressions hydrostatiques et son impact sur les protéines laitières. Pour finir une dernière partie présente le système d’ultrafiltration ainsi que le colmatage, problème majeur associé à cette technologie. - Le Chapitre 2 présente l’hypothèse de recherche et les objectifs associés.
- Le Chapitre 3 correspond à l’article scientifique qui a été rédigé au cours de cette maîtrise et présente les principaux résultats obtenus. Cet article est intitulé « Impact of high hydrostatic pressure-treated skim milk on permeate flux and fouling during ultrafiltration » et a été soumis au périodique « Journal of Dairy Science » au début de l’année 2017. Madame Mathilde Leu est la première auteure de l’article, et a réalisé l’ensemble des expérimentations reliées à celui-ci. Les autres auteurs sont Julien Chamberland, Alice Marciniak, Laurent Bazinet, Yves Pouliot et Alain Doyen qui ont participé à la planification des expériences ainsi qu’à la révision de l’article.
- Le Chapitre 4 comporte une discussion générale sur les résultats obtenus, un retour sur l’hypothèse, des perspectives pour la continuité du projet ainsi qu’une conclusion générale. Enfin, la bibliographie présentant tous les travaux cités se retrouve à la fin de ce mémoire.
1
INTRODUCTION
Le lait et les produits laitiers sont des composantes majeures de l’alimentation humaine du fait de bénéfices nutritionnels, sensoriels et organoleptiques majeurs. En 2015, la production mondiale de lait et de produits laitiers s’élevait à 800 millions de tonnes dont 15% sont attribuables au secteur nord-américain 1. Au Canada, le secteur du lait et des produits laitiers représentait 16% de l’industrie alimentaire, avec un chiffre d’affaire de 17,0 milliards de dollars. Environ 36,3% de la recette monétaire de la production laitière est attribuable au Québec, soit environ 6,17 milliards de dollars, ce qui en fait l’un des principaux acteurs de ce secteur 2.
Le lait est une solution vraie qui peut être défini comme un système complexe composé de globules de gras en émulsion, d’une fraction protéique colloïdale (caséines) et soluble (protéines du lactosérum)3. Le lait contient une quantité significative de minéraux. De manière générale, les sels minéraux du lait peuvent se regrouper en deux catégories : les ions monovalents (sodium, chlorure, potassium) retrouvés dans la phase soluble et les ions à valence multiple tel que le calcium, le magnésium, le phosphate et le citrate qui peuvent être liés aux protéines 4. Finalement, le lactose représente le principal glucide de la matrice laitière. De par sa composition propice aux contaminations microbiennes, plusieurs procédés de conservation ont été développés afin de réduire drastiquement le niveau de contamination du lait. Ces technologies sont majoritairement basées sur une élévation de l’énergie thermique telles que la pasteurisation et la stérilisation à ultra-haute température. Depuis quelques décennies et en remplacement des procédés de conservation thermiques conventionnels, plusieurs études ont été réalisées sur l’impact des hautes pressions hydrostatiques (HPH) sur les matrices laitières et plus globalement alimentaires dans une optique d’augmenter leur durée de vie et d’améliorer leurs propriétés fonctionnelles et nutritionnelles 5,6,7.
Le procédé à HPH, également appelé pressurisation isostatique ou pascalisation, a été étudié dès le début des années 1900 mais n’est disponible à l’échelle industrielle que depuis les années 1980. Ce procédé est basé sur une élévation de pression pouvant aller jusqu’à 1000 MPa et fait intervenir deux principes de base : le principe de Le Chatelier et le principe isostatique 7. Globalement, la majorité des travaux en lien avec
2
ce procédé ont montré que les HPH ont peu d’effet sur les qualités visuelles et organoleptiques des matrices alimentaires. Au niveau nutritionnel, les HPH permettent de préserver certains composés bioactifs telles que les vitamines et les composés phénoliques, cependant, et selon la matrice alimentaire étudiée, les HPH peuvent engendrer des modifications drastiques de la structure des protéines 6–8.
Dans le cas du lait, un traitement de HPH compris entre 400 et 600 MPa permet l’obtention d’un lait microbiologiquement semblable à un lait pasteurisé (72°C, 15 sec)8. Cependant, divers paramètres opératoires tels que le niveau de pression appliquée, la durée de maintien à la pression cible, la température et le pH engendrent des taux de dénaturation et d’agrégation d’importance variable sur les fractions protéiques colloïdale et soluble du lait. Sur la fraction colloïdale, un traitement de HPH inférieur à 200 MPa engendre peu d’effet sur la micelle alors qu’à une pression de 250 MPa pendant 15 min, une augmentation de la taille micellaire est observée. À des pressions comprises entre 300 MPa et 600 MPa, une diminution de la taille des micells est observée 9. Selon les paramètres de pressurisation, cette diminution de taille peut atteindre jusqu’à 50% et est plus ou moins réversible 7. Concernant les protéines sériques, l’α-lactalbumine (α-LA) en mélange pur ne subit aucune modification structurale pour des pressions inférieures à 400 MPa de par sa structure tridimensionnelle compacte. Un taux de dénaturation de 70% est cependant atteint à 800 MPa pendant 30 min 6,7. Contrairement à l’α-LA, la dénaturation de la bêta-lactoglobuline (β-LG) débute à partir de 100 MPa pour atteindre 90% de dénaturation à 400 MPa. Une fois dénaturée, la β-LG va s’associer avec elle-même, les micelles de caséines ou d’autres protéines sériques pour former des agrégats alors que l’α-LA reste soluble dans le sérum 10–12. Ainsi, bien que les HPH soient intéressantes pour l’amélioration de la qualité sanitaire du lait, les modifications de structure protéiques et les interactions formées suite aux traitements de pressurisations pourraient avoir un impact majeur sur la performance des procédés utilisés en industrie de transformation du lait, plus particulièrement sur les procédés baromembranaires.
Depuis leur introduction dans les années 1960, les technologies baromembranaires (osmose inverse (OI), nanofiltration (NF), l’ultrafiltration (UF) et la microfiltration (MF)) ont été à l’origine de nombreuses innovations et applications au sein de l’industrie laitière. Dans le cas de l’UF plus spécifiquement, ce procédé permet de
3
retenir les protéines dans le rétentat alors que le lactose et les sels minéraux peuvent passer à travers la membrane de filtration et être récupérés dans le perméat 13. Ainsi, l’UF est généralement utilisée pour des étapes de concentration de l’ensemble des protéines du lait ou des protéines sériques dans le but de produire des concentrés protéiques de lait ou de lactosérum pour la standardisation du lait destiné à la production fromagère 14–17. Toutefois et malgré une utilisation en perpétuelle croissance, la problématique majeure associée à l’utilisation des procédés baromembranaires est l’apparition d’un colmatage en cours de procédé.
Le colmatage fait référence à la détérioration des performances de la membrane de filtration et se traduit par une diminution du flux de perméation dû à l’augmentation de la résistance de la membrane ainsi qu’à un changement dans les propriétés du rétentat. Plusieurs altérations peuvent se produire au cours d’une filtration notamment l’apparition du phénomène de polarisation de la concentration suivi par la formation d’un gel protéique ainsi que l’adsorption de particules à la surface ou à l’intérieur de la membrane engendrant la formation d’une nouvelle couche filtrante de type gâteau et le blocage des pores 18,19. Les principaux agents colmatant lors de la filtration du lait sont les protéines et notamment la β-lactoglobuline et les caséines. Les caséines vont intervenir lors de la formation du gâteau conduisant au développement d’un colmatage irréversible. Les protéines sériques participent principalement au colmatage irréversible. La présence d’ion calcium dans le sérum va aussi augmenter le colmatage, principalement au niveau des interactions avec la membrane20.
Plusieurs études portent sur l’UF d’un lait pasteurisé thermiquement mais aucune étude ne s’est intéressée à la concentration d’un lait pressurisé. Dans ce contexte, le but de cette étude est de déterminer l’impact de la pressurisation d’un lait écrémé sur les performances d’UF. Ainsi, les objectifs spécifiques seront d’étudier les effets des HPH sur la structure des protéines laitières et d’évaluer l’impact des paramètres hydrodynamiques sur les performances du procédé en termes de flux de perméation et de colmatage.
4
5
1. Les protéines laitières
1.1. Généralités
Les protéines représentent environ 3,2% de la composition totale du lait. En lien avec leurs structures et leurs propriétés physicochimiques, les protéines laitières sont séparées en deux classes distinctes : les caséines (fraction colloïdale) et les protéines sériques (fraction soluble). La figure 1 présente les proportions des différentes protéines laitières au sein de la matrice laitière. Les protéines du sérum (environ 20% du pourcentage total de protéine dans le lait) ont la particularité d’être solubles dans l’eau. Parmi celles-ci, la β-lactoglobuline et l’α-lactalbumine sont considérées comme étant les deux principales et sont présentes à hauteur de 55 et 22%, respectivement. Les immunoglobulines (Ig) (13%), l’albumine de sérum bovin (ASB) (7%) et la lactoferrine (Lf) (4%) font pour leur part partie des protéines mineures du lactosérum. Les caséines (80% du pourcentage totale de protéine dans le lait) sont présentes majoritairement sous forme d’une suspension colloïdale 21.
FIGURE 1-POURCENTAGE DES DIFFERENTES PROTEINES DU LAIT 21
Une connaissance approfondie des composés du lait garanti une meilleure maitrise des procédés de transformation. Dans les sections à venir, les principaux constituants du lait, et plus particulièrement les protéines, seront davantage détaillés 22.
6
1.2. Les fractions protéiques du lait
1.2.1. Les protéines sériques
1.2.1.1. La bêta-lactoglobuline
La β-LG est une protéine globulaire de la famille des protéines lipocalines se retrouvant dans la majorité des laits de mammifères excepté dans le lait maternel humain où elle est absente. Dans le lait bovin, sa concentration varie entre 2 et 4 g.L-1 et représente donc une part importante des protéines sériques (55% des protéines sériques). Son point isoélectrique est de 5,1 11,12,21,22.
La structure primaire de la β-LG consiste en un enchaînement de 162 acides aminés représentant un poids moléculaire de 18,3 kDa 11,12,21,22. Cette protéine possède également deux ponts disulfures ainsi qu’une fonction thiol libre sur le résidu d’acide aminé cystyle (Figure 2). Actuellement 10 variants génétiques de la β-LG ont été identifiés parmi lesquelles les variantes A et B sont les plus fréquents (respectivement 46-50% et 50-54% dans le lait de vache) 23. Selon le variant, la cystéine peut se situer en position 106, 119 ou 121 12,22,24,25.
FIGURE 2- SEQUENCE D'ACIDES AMINES DE LA Β-LACTOGLOBULINE POUR LE VARIANT GENETIQUE B DU LAIT DE VACHE 25
7
La β-LG possède un fort degré de structuration. En effet, selon les données, la stabilité de la structure secondaire repose sur 8% d’hélices alpha, 45% de feuillet bêta 12,22. Sous forme de monomère, la β-LG est composé de 9 brins antiparallèles β et d’une hélice α. Les 9 brins sont liés de façon à former deux feuillets. Le premier feuillet est composé des brin B, C, D et d’une partie du A (A1) alors que le deuxième feuillet compte les brins E, F, G, H, A2 et I (Figure 3) 11,12.
FIGURE 3-STRUCTURE TRIDIMENSIONNELLE DE LA BETA-LACTOGLOBULINE 12
Les deux feuillets β sont positionnés perpendiculairement. De plus, ces derniers possèdent chacun une face hydrophobe orientée en vis-à-vis de façon à former un calice (structure tertiaire). Au niveau de ce calice, un ligand peut venir se positionner 12,24,25. Plusieurs études ont démontré que la β-LG interagissait fortement avec les acides gras ainsi que le rétinol. De par ces propriétés, la β-LG joue un rôle dans le transport de petites molécules hydrophobes. Toutefois, même si on sait que la β-LG est capable de fixer un grand nombre de ligands différents, son rôle reste encore mal défini 24,25. Dans le lait, la β-LG se retrouve sous forme de dimère (structure quaternaire) constitué du même variant (dimère A-A ou B-B). Toutefois, elle existe aussi sous d’autres formes oligomériques selon les différents paramètres du milieu (pH, température, force ionique, etc.) 24.
La dénaturation de la β-LG a été largement étudiée notamment suite à un traitement thermique. Dans un premier temps, avec l’augmentation de la température, les dimères de β-LG se séparent en monomères. Puis la protéine va se dénaturer irréversiblement ce qui va permettre l’exposition de son groupement thiol libre. Les monomères dénaturés vont alors s’agréger via des ponts disulfure inter-protéine 24.
8
1.2.1.2. L’α-lactalbumine
L’α-LA, deuxième protéine majeure du lait, est une métalloprotéine ayant comme ligand principal, le calcium 24. Cette protéine, de faible poids moléculaire (14,2 kDa), possède un point isoélectrique de 4,8 21,24. La structure primaire de l’α-LA est composée de 123 acides aminés stabilisés par 4 ponts disulfures et un cation. Il existe deux variants (A et B) de l’α-LA présentant une différence au niveau du résidu d’acide aminé 10 (Arg et Gln pour respectivement les variants B et A). Toutefois, le variant B est le plus retrouvé dans le lait 22. L’α-LA présente un degré d’organisation secondaire plus faible que celui de la β-LG. En effet, 26% des acides aminées vont former 4 hélices α et 15% de la structure se retrouve sous forme d’un feuillet β (Figure 4). De plus, la structure tertiaire montre la présence d’une « poche » hydrophobe 24.
Il est important de remarquer que l’ion Ca2+ joue un rôle structurant important. En effet, une étude portant sur les différences de structure entre la forme holo- (forme native dont un ion Ca2+ est lié à la protéine par un lien de coordination) et apo- (non lié) de l’α-LA a permis de mettre en avant des différences majeures au niveau de la structure tertiaire de la protéine. Ainsi les auteurs ont conclu que la présence de calcium stabilise la protéine 24,26,27.
9
L’α-LA possède également la capacité de se lier à d’autres cations polyvalents tels que Mn2+, Zn2+ et Tb3+ ainsi qu’avec des cations monovalents Na+ et K+. Toutefois, la présence (ou non) du zinc dans la protéine n’impacte pas la structure de celle-ci ce qui indique que les sites de fixation du calcium et du zinc sont différents 22,24.
1.2.1.3. Les protéines mineures du lactosérum
➢ L’albumine de sérum bovin
L’ASB se retrouve dans le lait mais aussi dans le sang de nombreux mammifères. Cette protéine est composée de 582 acides aminés et a un poids moléculaire de 66,43 kDa. Sa structure contient 17 ponts disulfures ainsi qu’un groupement sulfhydrile. Les ponts disulfures se positionnent de manière rapprochée sur la chaîne peptidique ce qui permet la formation de courtes hélices regroupées en trois domaines (I à III), eux-mêmes divisés en deux (A et B) (Figure 5) 28,29,30.
FIGURE 5-STRUCTURE TRIDIMENSIONNELLE DE L’ASB29
➢ Immunoglobulines
Les Ig sont des protéines complexes regroupées en 5 familles. La plus présente dans le lait bovin est l’IgG et plus particulièrement IgG1. Sa structure est composée de deux longues chaînes (chaînes lourdes) ainsi que de deux courtes chaînes polypeptidiques (chaînes légères) liées entre elles par des ponts disulfures. Ces deux chaînes présentent en grande majorité des feuillets β 23,28 (Figure 6).
10
FIGURE 6-STRUCTURE SCHEMATIQUE D'UNE IMMUNOGLOBULINE 23
➢ Lactoferrine
La Lf est une protéine monomérique, globulaire, d’une masse moléculaire de 80 kDa et composée d’environ 690 acides aminés. La présence d’une hélice α dans sa structure permet la formation de deux « lobes » similaires possédant chacun un site de fixation au fer (Figure 7). Cette glycoprotéine possède deux sites distincts glycosylés 32–35.
11
1.2.2. Les caséines
Selon l’American Dairy Science Association Committee sur la nomenclature, la classification et la méthodologie des protéines laitières, les caséines d’origine bovine sont définies comme étant les phosphoprotéines du lait cru qui précipitent à pH 4,6 à 20°C 36. Dans le lait, 6 à 10 % de la fraction caséique est présente sous forme de monomères 37. Cette caractéristique dépend de nombreux facteurs physico-chimiques. Les autres caséines sont présentes sous formes de larges agrégats, aussi appelés micelles de caséines 36. Quatre caséines ont été identifiées : la caséine αS1 (αS1-CN), la caséine αS2 (αS2-CN), la caséine β (β-CN) et la caséine κ (κ-CN), respectivement présentes dans les proportions suivantes 3 :0,8 :3 :1 36,37. Cependant, l’hydrolyse de la β-CN par la plasmine permet de générer des caséines γ (γ-CN) dont les quantités restent marginales.
Les principales caractéristiques des différentes caséines sont regroupées dans le tableau ci-dessous (Tableau 1). Toutefois, dans la suite de ce chapitre nous aborderons plus en détail leurs structures et les propriétés associées.
TABLEAU 1-PROPRIETES DES DIFFERENTES CASEINES 22
Protéine Concentration moyenne (%)
Masse moléculaire (kDa) Résidus pH isoélectrique Acides
aminés Phosphosérine Cystéine
αS1-CN 1,1 23,61 199 7 – 9 0 4,5
αS2- CN 0,3 25,23 207 10 – 13 2 5,0
β- CN 0,9 23,98 209 5 0 4,8
κ- CN 0,3 19,02 169 1 2 5,6
1.2.2.1. Les types de caséines
Avant d’exposer les différentes caractéristiques inhérentes à chaque caséine. Il est important de prendre en compte certaines particularités communes, notamment le degré de phosphorylation qui a un impact sur les propriétés des caséines. En effet, les caséines sont d’autant plus sensibles à la précipitation par les ions Ca2+ qu’elles sont phosphorylées. Ainsi, on peut classer les caséines selon leur sensibilité au calcium 38 :
αS2-CN > αS1-CN > β-CN > κ-CN
Toutefois, la κ-CN, seule caséine à être glycosylée, va jouer un rôle chaperon pour les autres caséines contre la précipitation par les ions Ca2+. En effet, la κ-CN ne
12
précipite pas en présence de calcium. Les résidus phosphosérines ont, de plus, tendance à se regrouper pour former des « clusters ». Ces sites permettent la liaison avec des cations et le phosphate de calcium micellaire 38.
➢ Caséine αS2
La αS2-CN représente 10% des caséines. Elle présente un fort degré de phosphorylation. La présence de deux groupements cystéine lui permet de se lier via des ponts disulfures, soit en formant des dimères de αS2-CN, soit par des liaisons intramoléculaires 39. Les différents résidus phosphorylés sont regroupés en trois « clusters » répartis tout au long de la chaîne peptidique.
Cette protéine est la plus hydrophile, comparativement aux autres caséines. Son hydrophobicité s’élève à 4,64 kJ/résidu. De plus, la αS2-CN possède une structure dipolaire avec une concentration des groupements anioniques dans la partie N-terminale qui est donc chargée négativement et une concentration des groupements cationiques dans la partie C-terminale (chargée positivement) 22,36,37.
➢ Caséine αS1
La αS1-CN est la plus abondante et représente à elle seule 40% des caséines. Elle est composée de 199 résidus d’acides aminés dont 7 à 9 des 16 résidus sérines sont phosphorylés. Il existe 5 variants de cette caséine mais le phénotype B est le plus abondant. Cette protéine est riche en résidus hydrophobes (HΦ = 4,89 kJ/résidu) et est chargée négativement : 25 acides aminés sont chargés positivement et 40 négativement. La répartition des charges montre une forte concentration des charges négatives entre les résidus 30 et 80. De plus, c’est aussi dans cette zone que se situent les deux « clusters » de phosphorylation. Concernant l’hydrophobicité le long de sa chaîne polypeptidique, deux zones hydrophobes sont détectées au niveau des résidus 20-35 et 160-175 22,36.
➢ Caséine β
La β-CN, présente à 35% dans le lait, est la plus hydrophobe des caséines (HΦ = 5,58 kJ/résidu), principalement au niveau de la région C-terminal qui est apolaire. A l’inverse, la partie N-terminale possède une faible hydrophobicité, ce qui confère à cette protéine un caractère amphiphile. C’est également dans cette partie que se concentrent les groupements phosphorylés.
13
La présence de deux sites distincts, l’un polaire et l’autre hydrophobe, rend la β-CN sensible aux changements de températures. Pour une température de l’ordre de 0 à 4°C, la β-CN se présente principalement sous forme de monomère. A ces températures, un transfert de la β-CN de la micelle de caséine à la phase soluble se produit, dû à un affaiblissement des interactions hydrophobes 4. Avec une augmentation de température, les protéines vont s’associer entre elles pour former de larges polymères 22,36,37.
➢ Caséine κ
Après la β-CN, la κ-CN est la plus hydrophobe des caséines (HΦ = 5,12 kJ/résidu) et sa charge nette n’est que très faiblement négative. Le glycomacropeptide (106-169), issu de l’hydrolyse de la κ-CN par la chymosine, est très hydrophile ce qui confère à la κ-CN une nature amphiphile puisque la partie N-terminale est, quant-à-elle, hydrophobe. De plus, la présence de résidus cystéine lui permet de former des dimères ou des oligomères via des ponts disulfures.
La κ-CN est la seule caséine à être glycosylée et contient un résidu carbohydrate dans sa structure. Les cibles de la glycosylation sont les résidus thréonine (principalement en position 131, 133, 135 et 136). Quarante pourcents des κ-CN sont non-glycolysées. Son faible degré de phosphorylation la rend peu sensible aux ions Ca2+, contrairement aux autres caséines. De plus, sa capacité à rester soluble dans le sérum lui permet de stabiliser les autres caséines 22,37.
1.2.2.2. Structure et propriétés de la micelle
La majeure partie des caséines s’agrègent pour former des micelles de caséines composées de centaines de particules. Le diamètre des micelles de caséine varie entre 50 et 300 nm, le diamètre moyen étant de 180 nm avec un poids moléculaire pouvant varier de 107 à 109 Da. Les micelles sont composées approximativement de 94% de caséines et 6% de minéraux 37.
Le mécanisme d’assemblage est sujet à de nombreuses spéculations. Plusieurs modèles ont ainsi été développés au cours du temps. En effet, la structure et les propriétés des différentes caséines permettent d’anticiper leur assemblage en micelles 40. Certaines caractéristiques sont communes aux différents modèles. Notamment la présence des κ-CN en surface ainsi que le rôle majeur du phosphate de calcium dans le
14
maintien de l’intégrité de la structure de la micelle. Le premier modèle a été proposé par Waugh à la fin des années 50: le « core-coat » 41.
➢ Le modèle « core-coat »
Ce modèle consiste en un cœur sphérique composé de β-CN et αS-CN, et recouvert par un « manteau » de κ-CN (Figure 8) 41.
Par la suite, plusieurs variantes de ce modèle ont été proposées. Ces dernières ont conduit à l’élaboration d’un modèle composé de sous-unités : le modèle submicellaire (Schmidt, 1980 et plus tard Walstra dans les années 90).
FIGURE 8-MODELE DE CASEINE PRESENTE PAR
WAUGH EN 195842
➢ Le modèle submicellaire
Selon ce modèle, les caséines vont s’agréger entre elles via des liaisons hydrophobes pour former des sous-unités de 15 à 20 particules. L’organisation se fait de telle manière que la concentration en κ-CN varie selon les sous-micelles. Ainsi, certaines sous-unités seront pauvres voire totalement dépourvues en κ-CN alors que d’autres en seront riches. Ensuite, les sous-micelles vont se lier ensemble grâce au phosphate de calcium micellaire de façon à positionner les unités enrichies en κ-CN à la surface de la micelle (Figure 9).
15
FIGURE 9-REPRESENTATION SCHEMATIQUE DU MODELE SUBMICELLAIRE DE SCHMIDT, REVU EN
200540
Ce modèle présente toutefois quelques lacunes. Notamment, le fait que certaines sous-unités présentent de la κ-CN alors que d’autres en sont dépourvues. De plus, l’entrée tardive du phosphate de calcium dans la micelle est un autre point critiquable. En effet, le phosphate de même que le calcium jouent un rôle dans la phosphorylation de la chaîne protéique, étape qui se déroule avant la formation de la micelle. Ainsi il est donc fort probable que le phosphate de calcium agit plus tôt dans l’association des micelles. Basé sur le modèle de Schmidt, Walstra a présenté un modèle similaire incluant le phosphate de calcium dans les sous-unités de la micelle (Figure 10) 41.
FIGURE 10-MODELE DE MICELLE DE CASEINES SELON WALSTRA EN 199942
Phosphate de Calcium Sous-micelle riche en κ Sous-micelle pauvre en κ Sous-micelle Phosphate de Calcium Chaîne peptidique proéminente
16
Un autre type de modèle a été développé par Holt dans les années 90 : le modèle des « nanoclusters ». Alors que le modèle submicellaire met l’emphase sur les interactions hydrophobes qui engendre les sous-unités, le modèle de Holt se base sur les interactions entre les caséines et le phosphate de calcium pour assurer l’intégrité de la micelle 40.
➢ Le modèle « nanoclusters » (Figure 11)
Selon ce modèle, le phosphate de calcium forme des nanoclusters qui vont interagir avec les groupements phosphosérines des caséines (Figure 12). Tel que mentionné dans la partie 1.2.2.1., les phosphosérines se regroupent sur la chaîne polypeptidique pour former des « clusters ». C’est au niveau de ces sites que la liaison avec le phosphate de calcium se fait. Holt suggère que les nanoclusters de phosphate de calcium puissent se lier jusqu’avec 49 groupements phosphosérines. De plus, les αS1-CN et αS2-CN qui possèdent plusieurs « clusters » dans leur structure, permettent d’obtenir un réseau tridimensionnel plus développé 40.
FIGURE 12-ILLUSTRATION DE LA FORMATION DU RESEAU SELON LE MODELE DE HOLT 40
FIGURE 11 - REPRESENTATION DU MODELE MICELLAIRE PROPOSE PAR
17
Ce modèle prend aussi en compte le fait que les parties des caséines qui ne sont pas liées aux nanoclusters vont se lier entre elles via des liaisons faibles, c’est-à-dire des interactions hydrophobes, des ponts d’hydrogène et des interactions électrostatiques 42. De plus, la présence en surface de κ-CN, qui ne possède qu’une phosphosérine, jouerait le rôle de limitant dans l’association des caséines ce qui permettrait de réguler la taille et stabiliser la micelle 40,42.
McMahon et al. (2013) ont étudié la structure de la micelle de caséine via l’utilisation du microscope électronique. Le nombre important de caséines présentes dans une micelle rend difficile l’observation de celle-ci (Figure 13). Toutefois, la structure semble homogène. Une étude de la périphérie de la micelle permet donc d’avoir une vue d’ensemble de la structure. Les conclusions effectuées supportent le modèle de nanoclusters et a tendance à réfuter l’hypothèse du modèle submicellaire.
FIGURE 13 - MICROGRAPHE PAR TRANSMISSION D'ELECTRON D'UNE MICELLE DE CASEINE 41
Dans le lait, la stabilité de la micelle est assurée par la présence de charges négatives à la surface qui grâce aux répulsions électrostatiques empêchent les micelles de s’associer. De plus, les micelles ont une affinité avec l’eau. En effet, elles sont très hydratées et peuvent fixer 4 g d’eau/g de protéine 43.
Pour résumer, les protéines laitières ainsi que l’ensemble des autres constituants (sels minéraux, lactose, etc.) forment un système très complexe en équilibre. Une modification de ce système par divers facteurs physico-chimiques telles que les hautes pressions hydrostatiques va obligatoirement modifier cet équilibre. Ces effets sont développés dans la prochaine section.
18
2. Les hautes pressions hydrostatiques
2.1. Principes et applications dans le domaine laitier
2.1.1. Principe
Depuis les premières études datant de la fin du 19ème siècle et jusqu’à récemment, les HPH étaient peu étudiées et ce par manque d’outils technologiques de contrôle et d’automatisation. Il a fallu attendre les années 1990 pour observer un intérêt plus marqué concernant les applications liées à l’utilisation des HPH. En parallèle, des demandes grandissantes des consommateurs pour des produits naturels, de qualité nutritionnelle supérieure avec un minimum de transformation ont poussé les chercheurs à développer de nouvelles technologies pour répondre à ces besoins 44.
FIGURE 14-SCHEMA DE PRINCIPE DU TRAITEMENT PAR HPH45
Les HPH, appelées également pascalisation ou technologie à hautes pressions isostatiques, sont basées sur une élévation de pression comprise entre 100 et 1000 MPa (Figure 14) 46. Ce procédé est gouverné par deux principes : le principe isostatique et le principe de Le Chatelier 7. Le terme isostatique ou hydrostatique fait référence à l’état d’équilibre atteint par un système sous l’action d’une force ou d’une pression. Sous pression, un fluide a la capacité de transmettre cette force sans friction. Le principe isostatique considère donc que la force transportée à la surface d’un fluide est instantanée et uniforme peu importe la forme ou la taille du produit traité. Ceci permet donc de diminuer considérablement les déformations du produit 11. Le principe de Le
19
Chatelier, quant à lui, stipule que si un stress est appliqué sur un système en équilibre, ce dernier va réagir pour contrebalancer les effets induits et se déplacer vers un nouvel équilibre 7,11.
2.1.2. Applications
Les premières utilisations des HPH ont été réalisées dans le but d’inhiber les contaminants microbiologiques afin d’augmenter la conservation et la durée de vie des aliments. Les HPH présentent l’avantage de ne dépendre ni de la chaleur, de produits chimiques, de modifications de l’activité de l’eau ou encore des basses températures pour contrôler le développement microbien 11.
Plusieurs études ont démontré que la résistance des micro-organismes aux HPH dépend de plusieurs facteurs tels que les conditions de traitement, la composition de la matrice alimentaire, l’activité de l’eau, l’état des micro-organismes (végétatif ou sporulé), leur nature (Gram+, Gram-, etc.), leur morphologie, etc. 6–8,11,47–51. Les effets des HPH sur les micro-organismes sont nombreux. En effet la pressurisation induit une inactivation des cellules végétatives suite à l’endommagement de la structure subcellulaire (membrane cellulaire, nucléotides, ribosomes et enzymes). Les HPH engendrent également une dénaturation de divers composés biochimiques (protéines de transport, canaux ioniques) et du matériel génétique (ADN). Généralement, les premières cibles des mécanismes d’inactivation sont la membrane cellulaire et les enzymes liées à la membrane tel que l’ATPase 47,50.
A ce jour, il est possible de retrouver sur le marché des produits pressurisés tels que des jus de fruits, des viandes ou encore des fruits de mer. Les HPH ont donc trouvé de nombreuses applications en industrie notamment pour l’amélioration de la qualité des produits : augmentation de la tendreté des viandes et des rendements fromagers, faciliter l’ouverture des mollusques bivalves, etc 11. Les HPH permettent aussi d’améliorer l’extraction des composés bioactifs 52. De plus, il a été démontré qu’un traitement par les HPH présentait l’avantage de conserver les composés bioactifs comparativement à un traitement thermique. Plusieurs études ont été réalisée dans ce sens sur des produits tel que le soja, des smoothies aux fruits ou encore les fraises 53–55. Toutefois, la principale utilisation reste dans un but d’innocuité microbiologique.
20
2.1.3. Utilisation dans le domaine laitier
Les premières recherches sur l’application des HPH dans le domaine laitier datent de 1899 quand Hite a démontré que la durée de vie du lait cru pouvait être augmentée via une augmentation de la pression 7. Depuis, plusieurs études ont démontré qu’un traitement à 400-600 MPa pendant 10-60 min permettait de produire un lait microbiologiquement semblable à un lait pasteurisé (72°C pendant 15 sec.) 8,51.
Au niveau des produits laitiers, de nombreuses études ont été réalisées concernant la production fromagère. En effet, l’utilisation d’un lait pressurisé a un impact sur le temps de coagulation enzymatique et par conséquent modifie la qualité finale du fromage ainsi que son rendement 12,44,56–59. D’autres études visent l’inactivation microbiologique pendant la phase d’affinage des fromages par l’application des HPH. Toutefois, les propriétés physicochimiques, rhéologiques et sensorielles du fromage sont alors modifiées 48. L’utilisation des HPH a aussi été testée dans la fabrication de yogourt et de crème glacée pour améliorer les propriétés rhéologiques 7,8,44,60.
Les HPH sont donc un compromis permettant la réduction des pathogènes sans compromettre les propriétés organoleptiques et nutritionnelles du produit 11. Toutefois, des modifications surviennent au niveau des différents constituants du lait et notamment au niveau des protéines.
2.2. Effet des HPH sur les différents composants d’un système
biologique
Pour comprendre les effets des HPH sur les différents composants du lait, il est important de comprendre les effets de la pression sur l’équilibre chimique et physique. En effet, comme mentionné ci-dessus, un système sous pression suit la loi de Le Chatelier et va chercher à contrebalancer une réduction de volume en modifiant son équilibre. Pour un système aqueux, un changement de volume impactera en premier l’organisation des molécules d’eau 7. La phase solide de l’eau présente différentes formes polymorphiques. A pression atmosphérique, l’eau congèle à 0°C et prend une
21
forme hexagonale I. Sous pression, le point de congélation va diminuer pour atteindre -22°C à 207MPa. Au-delà, le point de congélation va ré-augmenter mais la forme polymorphique va changer (Figure 15) 61. Toutefois, ces effets sont réversibles pendant la décompression. L’abaissement du point de congélation permet malgré tout de produire des aliments sous 0°C sans formation de cristaux mais avec un contrôle de l’activité microbiologique. La décongélation est aussi facilitée 11,49. De plus, la compression est accompagnée d’une augmentation de la température (2 à 3°C par palier de 100MPa) et d’une diminution du pH (une unité pour 1000MPa). Les réactions de ionisation sont aussi favorisées sous pressions, ce qui est dû à une organisation plus compacte des molécules d’eau autour des ions chargés 7.
FIGURE 15-DIAGRAMME DE L'EAU SOUS PRESSION 61
2.3. Effet des HPH sur les protéines du lait
2.3.1. Généralités
La structure primaire des protéines est une chaîne polypeptidique, composé d’acides aminés, liés de manière covalente grâce à des liens peptidiques. La structure secondaire et quaternaire est assurée par des liaisons non-covalentes : interactions électrostatiques, ponts d’hydrogènes, interactions hydrophobes et forces de Van Der Waals. Des liaisons semi-covalentes (ponts disulfures) vont stabiliser la structure tertiaire des protéines 62.
22
Le volume des protéines prend en compte le volume des atomes de la structure primaire, le volume des cavités présentes dans la conformation de la protéine et le volume d’hydratation, c’est-à-dire du solvant lié à la protéine. Sous pression, le volume des protéines va diminuer ; ce qui se traduit par un ΔV négatif. Les principaux changements vont se dérouler au niveau des cavités qui vont diminuer voire disparaitre ainsi qu’au niveau de l’hydratation de la protéine. Les liaisons misent en jeu lors de la solvatation des protéines vont être rompues ou modifiées engendrant ainsi une forte diminution du volume global de la protéine 62.
La structure primaire des protéines va être conservée du fait que les liaisons covalentes ne sont peu ou pas affectées par les HPH. En effet, afin de dissocier des liaisons covalentes, le ΔV doit être positif (Tableau 2) (ex : congélation). A l’inverse, les structures secondaire, tertiaire et quaternaire vont être altérées 7,50,62,63.
TABLEAU 2-EFFET DES HPH SUR LES INTERACTIONS CHIMIQUES 50
Type d’interaction ΔV dissociation (ml.mol-1) Effet de la pression
Covalente + 10 Stabilisation
Ionique - 10 Déstabilisation
Hydrogène +3 à -1 Stabilisation ou faible déstabilisation
Hydrophobe ‹ 0 (de -10 à -20) Déstabilisation
2.3.2. Impact sur la micelle de caséine
Visuellement, la turbidité du lait diminue suite à l’application de HPH provoquant ainsi un changement de couleur. En effet, la luminosité (L*) diminue et les paramètres a* et b* se modifient pour tendre vers le vert (-a*) et le jaune (+b*). Le lait apparaît alors plus « jaunâtre » 58,8. Ce phénomène est engendré par une déstabilisation de la micelle de caséine suite au traitement de pressurisation. Pour une pression variant de 100 à 200 MPa, les micelles de caséines ne sont que très peu affectées 44,7. Un traitement compris entre 250 et 300 MPa (> 15 min) induit une augmentation de la taille des micelles 44,64. Ce phénomène est partiellement réversible lors du stockage du lait 7. A des pressions supérieures, allant de 300 à 800 MPa, la taille des micelles de caséines va diminuer comparativement à un lait non traité. Toutefois, une baisse maximale semble être atteinte à partir de 400 MPa. Selon la pression appliquée, cette diminution peut atteindre jusque 50% et est plus ou moins irréversible 7.
23
Les effets induits sur la micelle dépendent essentiellement du niveau de pression appliquée. Toutefois, plusieurs études ont montré que la température et le pH avaient également un impact majeur sur la déstabilisation de la micelle 7. En effet, alors qu’un traitement de 250 MPa, à 20°C, n’avait pas ou peu d’impact sur la micelle de caséine, l’application d’un même niveau de pression à 40°C provoque une augmentation de la taille. Au contraire, un traitement à 4°C va induire une diminution 63. Une diminution de pH va aussi favoriser la déstructuration des micelles de caséine 7.
Ces effets peuvent être expliqués par deux mécanismes : une solubilisation du phosphate de calcium micellaire (PCM) et une agrégation des caséines. En effet, la destruction des micelles est induite par la solubilisation des PCM et par la déstabilisation des interactions intra-micellaire. La solubilisation du phosphate de calcium dans le sérum augmente linéairement en fonction de la pression appliquée Ainsi, selon le niveau de pression appliquée, la déstabilisation des micelles est plus ou moins importante, des formes totalement monomériques peuvent être détectées à partir de 400 MPa, lorsque l’ensemble PCM est solubilisé. Lors de la décompression, les caséines vont se réassembler pour reformer des micelles de tailles différentes selon la pression. La formation de micelles de plus grande taille entre 250 et 300 MPa serait due à la présence de fragments de micelle non-dissocié qui n’apparaîtrait pas à des pressions plus élevées. Ces fragments de micelle proviendraient de la solubilisation incomplète du PCM. L’augmentation de la pression provoquerait donc une solubilisation intégrale du PCM ce qui préviendrait l’agrégation des caséines. La taille des micelles serait alors plus petite (figure 16) 7,10,64,65.
24
FIGURE 16- SCHEMA SYNTHETIQUE DES EFFETS DES HPH SUR LES MICELLES DE CASEINES 66
De façon générale, la charge négative de la micelle de caséine augmente, ce qui induit une solvatation plus importante 51. Les HPH vont également engendrer une solubilisation des caséines dans le sérum, augmentant ainsi le nombre de caséines non micellaires. La dissociation des caséines suit l’ordre suivant : κ > β > αs1 > αs2. Cela semble correspondre à leur composition en groupement phosphorylé indiquant que plus une caséine est liée au phosphate de calcium micellaire, plus sa dissociation sera difficile 49. Toutefois, ce nombre peut varier en fonction du pH. En effet, pour un lait dont le pH est inférieur à 6, le niveau de caséine soluble augmente. Les mêmes effets peuvent être observés lors d’une alcalinisation. Cela serait dû à une déstructuration de la structure colloïdale ou à l’augmentation des répulsions électrostatiques 51.
2.3.3. Impact sur les protéines sériques
2.3.3.1. Effet sur la β-lactoglobuline
Plusieurs études ont démontré que le taux d’azote non-caséique du lactosérum diminue avec l’augmentation de la pression laissant à suggérer que les protéines sériques vont s’insolubiliser et précipiter lors d’une acidification à 4,6 63. Une dénaturation partielle de la β-LG est engendrée à partir de 50 MPa ce qui provoque
25
l’exposition des sites hydrophobes de la protéine. Toutefois, la protéine retrouve sa forme initiale au moment de la décompression. A partir de 200 MPa, la dénaturation devient irréversible et le taux de protéines dénaturées augmente avec la pression pour atteindre 90% à 400 MPa. De 400 à 800 MPa, le taux de dénaturation de la β-lg se stabilise démontrant ainsi qu’une dénaturation optimale intervient à 400 MPa 11,12. Plusieurs modèles ont été mis en place afin d’expliquer la configuration de la β-lg selon la pression appliquée.
Considine et al. (2007) ont proposé un modèle en trois étapes qui explique la dénaturation de la β-lg en solution modèle (Figure 17). A l’étape I P (0,1 – 150 MPa), la β-LG se retrouve sous forme de monomère natif stable. Au cours de l’étape II P (200 – 450 MPa), les monomères natifs peuvent interagir avec des monomères non-natifs pour former des dimères via des ponts disulfures. Finalement, à l’étape III P (450 – 800 MPa), la β-lg complétement dénaturée va former des agrégats 12.
FIGURE 17-MODEL DE DENATURATION DE LA Β-LG SOUS PRESSION 12 2.3.3.2. Effet sur l’α-lactalbumine
Contrairement à la β-LG, l’α-LA est beaucoup plus stable à la pressurisation due à sa structure moléculaire plus compacte. En effet, cette protéine est composée d’un nombre de ponts disulfures intramoléculaires plus important (4 pour l’α-la et 2 pour la β-lg) et ne possède pas de groupement thiol libre dans sa structure 51,9. L’α-la est ainsi dénaturée à partir de 400 MPa, le taux de dénaturation atteignant 70% après 30 min à 800 MPa 7,59. La pressurisation d’une solution d’α-la pure n’a montré aucune formation
26
d’agrégats, l’α-la reste donc sous forme de monomères même si elle est dénaturée par la pression 12.
2.3.3.3. Effet sur les protéines mineures du lactosérum
Comparativement aux protéines sériques majeures, peu d’étude traitent de l’impact des HP sur l’ASB, les Ig, la Lf et les protéoses peptones. Toutefois, il a été rapporté que l’ASB n’était pas affectée par les HP. La stabilité de cette protéine est probablement due à sa structure moléculaire, composée de 17 ponts disulfures, qui lui confèrent une forte rigidité 12. Plus récemment, l’équipe de Bravo et al. (2015) s’est intéressée à l’impact des HPH sur les protéines mineures du lactosérum. Il a été démontré que la dénaturation de l’IgA débute à une pression comprise entre 250 et 450 MPa et se poursuivait jusque 700 MPa. Une augmentation de la température améliorerait grandement le taux de dénaturation de l’IgA 10. La Lf, quant-à-elle, commence à se dénaturer à partir de 250 MPa mais est en partie protégée par les micelles de caséine. En effet, même si la Lf fait partie des protéines du lactosérum, elle présente la particularité de se lier avec les micelles de caséines via des interactions électrostatiques 67. C’est cette particularité qui confère à la Lf une protection face à la dénaturation 10,68. En effet, les micelles de caséines vont jouer un rôle chaperon.
2.3.4. Interactions protéiques générées
Une fois dénaturée par les HPH, la β-lg va être retrouvée dans des agrégats de différentes compositions. Dans la majorité des cas, la β-lg va s’associer avec les micelles de caséines : principalement avec la κ-caséine par liaisons disulfures mais aussi possiblement avec la caséine-αs2 (> 400 MPa) par liaisons disulfure 58,69. Toutefois, elle peut aussi interagir avec les membranes des globules de gras ou former des agrégats β-lg/α-la ou β-lg/β-lg 7. Une petite partie de la β-lg va rester non-sédimentable lorsqu’elle se présente sous forme d’agrégats de protéines sériques lors de son agrégation avec des caséines de très petites tailles 51.
Un mécanisme pour les interactions entre les protéines a été proposé : sous pression, la β-lg se déplie dû à l’entrée de l’eau dans la molécule ainsi qu’à l’inhibition
27
des liaison faibles 70,71. Ceci permet l’exposition de son groupement thiol libre présent dans la zone hydrophobe de la molécule. Le groupement sulfhydrile est alors accessible pour former des ponts disulfures via des réactions d’inter-échange sulfhydrile/disulfure 70,71. La présence de calcium faciliterait ces réactions. Lors de la décompression, les protéines qui ne sont pas agrégées vont se replier pour récupérer un état proche de celui natif 58,69.
➢ Interaction β-LG/ caséine
Plusieurs études ont montré la baisse du taux de β-lg dans le sérum suite à une acidification à pH 4,6 du lait résultant d’une perte de solubilité à ce pH. Ce phénomène se traduit par l’association de la β-lg avec des caséines. La β-lg va majoritairement s’associer avec la κ-caséine grâce au mécanisme présenté ci-dessus 72. En effet, la présence de deux cystéines sur la κ-caséine et sa position à la surface de la micelle rend cette protéine rapidement accessible pour la formation d’agrégats 12.
Toutefois, la β-lg peut aussi se complexer avec la caséine αS par liaisons disulfures pour former des agrégats solubles dans le sérum et ainsi prévenir la formation d’agrégats insolubles. L’αS-CN montre donc une activité chaperonne 70.
Finalement, l’association de la β-lg dénaturée avec des caséines s’accompagnent d’une augmentation de l’hydratation de ces dernières 51.
➢ Interaction β-LG/ β-LG
Sous pression, l’ouverture de la β-LG expose son groupement sulfhydrile qui pourra se lier à ce même groupement provenant d’une autre β-LG via des réactions d’inter-échange sulfhydrile/disulfure 12,69,73.
➢ Interaction β-LG/ α-LA
Dans le cas d’une solution modèle composée de β-LG et α-LA, des agrégats hétérogènes ont été observés. En effet, la présence de β-LG peut induire la formation d’oligomères avec l’α-LA. Toutefois, dans le cas du lait, peu d’agrégats β-LG/ α-LA se retrouvent dans le sérum. Ceci est dû à la différence de stabilité aux hautes pressions de ces deux protéines. En effet, la β-lg sera déjà fortement dénaturée lorsque les premiers effets sur l’α-LA seront observés. Ainsi la β-lg s’agrégera préférentiellement avec des caséines puisque celles-ci se dénaturent dans une même gamme de pression 12. De plus, un autre point critique est la disponibilité physique des ponts disulfures de
l’α-28
LA à créer de possibles interactions avec la β-LG. En effet, ces interactions sont de type hydrophobe et peu de ces environnements se retrouvent sous pression 12.
En conclusion, l’utilisation des HPH sur le lait va modifier son équilibre et conduire à des changements majeurs au niveau protéique. Ces modifications peuvent avoir un impact sur la suite du procédé de transformation et plus particulièrement durant la filtration du lait.
3. Le procédé d’ultrafiltration
Les procédés baromembranaires sont très largement utilisés en industrie alimentaire pour la concentration et le fractionnement sélectif de matrices complexes dans le but de générer des ingrédients à plus forte valeur ajoutée. Comparativement aux procédés de séparation traditionnels (décantation, centrifugation, etc.), les procédés membranaires présentent plusieurs avantages notamment au niveau qualitatif (séparation optimale), économique et écologique 15. Il existe 4 procédés de filtration par membranes qui permettent de concentrer plus ou moins sélectivement les différents constituants d’un système en fonction de la taille de pores utilisée : OI, NF, UF et MF 74,4 (Figure 18). La séparation des constituants d’un système complexe repose sur la différence de pression appliquée entre l’entrée et la sortie de la membrane et la taille de pores du matériau membranaire.
Du fait que le projet de recherche s’intéresse spécifiquement à l’effet de la pressurisation du lait sur les performances du procédé d’ultrafiltration, seul ce dernier sera détaillé dans les sections suivantes.