Université de Montréal
Apport du gène TCF7L2 au diabète induit par les statines
par Thuy Anne Nguyen
Faculté de Médecine
Programme de sciences biomédicales
Mémoire présenté
en vue de l’obtention du grade de Maître ès Sciences (M.Sc.) en Sciences Biomédicales
option Recherche Clinique
Août 2017
ii
Résumé
L’usage de statines augmente le risque de développer le diabète de 11% comparativement à un placébo[1]. Dans la présente étude, nous avons utilisé une approche génomique visant l’étude du gène TCF7L2, fortement lié au diabète, afin de caractériser son apport au risque de diabète induit par les statines. Nous avons utilisé des données issues de deux études cliniques de Phase 4 avec statines : TNT (Treating to New Targets) et IDEAL (Incremental Decrease in End Points Through Aggressive Lipid Lowering). Ces études font la comparaison entre une haute dose d’atorvastatine et une dose modérée d’atorvastatine ou de simvastatine. L’étude génomique a été effectuée à l’aide de la puce MEGA (Illumina). Les résultats statistiques des deux études ont été combinés par méta-analyse. Nos résultats supportent l’observation d’une augmentation du risque de nouvelle apparition de diabète, à hauteur de 16% (p=0.022) chez les utilisateurs de forte dose de statine comparé à une dose modérée. Nous démontrons que, bien que l’allèle T du variant rs7903146 au gène TCF7L2 soit associé à une augmentation du risque d’apparition de diabète de 29% (p=1.98E-13) comparativement à l’allèle C toutes doses confondues, aucun variant du gène TCF7L2 n’était associé à l’apparition du diabète induit par une forte dose de statines comparativement à une faible dose. De plus, le variant rs7903146 n’est pas significativement associé à l’aggravation du diabète chez les personnes étant déjà diabétiques avant l’étude (p=0.266). Ces résultats contribuent à l’avancement des connaissances sur le rôle du gène TCF7L2 et le risque de diabète de type 2 chez les utilisateurs de statines.
Mots-clés : diabète de type 2, statines, Transcription factor 7-like 2 gene TCF7L2, Treating New Targets (TNT), Incremental Decrease in End Points Through Aggressive Lipid Lowering (IDEAL), épidémiologie génétique, pharmecogénomique, méta-analyse, atorvastatine, simvastatine.
Abstract
Statins usage increases the risk of diabetes apparition by 11% compared to a placebo [1]. In the present study, we used a genomic approach focused on the TCF7L2 gene, strongly linked to diabetes, to show the relationship with statin-induced diabetes. We used data from two Phase 4 randomized clinical trial studies where statins where used: TNT (Treating to New Targets) and IDEAL (Incremental Decrease in End Points Through Aggressive Lipid Lowering). Both studies compare a high atorvastatin dosage (80 mg) to either a moderate dose or a lower dose simvastatin. The genomic study was performed using the MEGA genotyping chip (Illumina). Statistical results of both studies were combined by meta-analysis. Our results show a 16% increase in risk of new onset of diabetes (p=0.022) in high dosage users, compared to lower dosage users confirming our observations. We show that the T allele of the rs7903146 variant of the TCF7L2 gene has a 29% increase in risk of diabetes at baseline or any time during the study (p=1.98E-13) compared to the C allele in any dosage. No genetic variant in or near the
TCF7L2 gene was associated to the new onset diabetes in both high and low statins dosage.
Furthermore, the rs7903146 variant was not significantly associated with diabetes aggravation in subjects who had diabetes at study baseline (p=0.266). These results contribute to a better understanding of the role of the TCF7L2 gene and the risk of new onset of type 2 diabetes in statins users.
Keywords: Type 2 diabetes, statins, Transcription factor 7-like 2 gene TCF7L2, Treating New Targets (TNT), Incremental Decrease in End Points Through Aggressive Lipid Lowering (IDEAL), Genetic epidemiology, pharmecogenomics, meta-analysis, atorvastatin, simvastatin.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières... iv
Liste des tableaux ... vii
Liste des figures ... viii
Liste des sigles et des abréviations ... ix
Remerciements ... xi
Introduction ... 1
Section 1 : Diabète ... 1
1.1. Définition et symptômes du diabète ... 1
1.2 Épidémiologie du diabète ... 3
1.3. Facteurs de risque relatifs au diabète de type 2 ... 7
Section 2 : Les statines ... 8
2.1. Mécanisme d’action et indication des statines ... 8
2.2. Épidémiologie des statines ... 12
2.3. Quels sont les liens entre les statines et le diabète? ... 15
2.4. Mécanismes proposés expliquant la diabétogénicité par les statines ... 17
Section 3: TCF7L2 - Transcription factor 7-like 2 gene ... 28
3.1. La découverte de TCF7L2 dans une population islandaise ... 28
3.2. Observations de GWAS ... 29
3.3. Un variant particulier de TCF7L2 : rs7903146 ... 30
3.4. Études épigénomiques ... 31
3.5. Corrélation de rs7903146 avec la réponse médicamenteuse ... 32
Section 4 : Études cliniques TNT et IDEAL ... 35
v
4.2. Objectifs des études ... 38
4.3. Devis des études ... 39
4.4. Variables d’intérêt ... 42
4.5. Critères d’éligibilité ... 44
4.7. Résultats des études ... 45
4.7. Sous étude pharmacogénomique des études TNT et IDEAL ... 46
Objectifs ... 47
Matériels et méthodes ... 48
1. Méthode de génotypage et nettoyage des données de TNT ... 48
Génotypage ... 48
Nettoyage des données ... 48
Extraction des SNPs du gène TCF7L2 ... 50
2. Méthode de génotypage et nettoyage des données d’IDEAL ... 50
Génotypage ... 50
Nettoyage des données ... 51
Extraction des SNPs du gène TCF7L2 ... 52
3. Définition du diabète et issues d’intérêt... 52
4. Logiciels utilisés pour les analyses et l’interprétation des résultats ... 53
5. Analyses statistiques des résultats p60 ... 54
Analyses préparatoire pour tester l’hypothèse d’un mécanisme commun entre le gène TCF7L2 et les statines dans le risque de diabète attribuable aux statines (analyses 1 à 3) 54 Objectif 1- Risque de diabète pour la haute dose de statine (méta-analyse 4) ... 56
Objectif 2 - Effet de TCF7L2 sur le risque de diabète (méta-analyses 5 et 6) ... 56
Objectif 3 - Effet d’interaction du gène TCF7L2 et de la dose de statine sur le diabète (méta-analyses 7 et 8) ... 58
vi
Résultats ... 60
Caractéristiques des patients génotypés et des études ... 60
Comparaison des variables de diabètes ... 65
Comparaison du diabète entre les patients génotypés et non-génotypés ... 67
Comparaison du diabète entre les patients génotypés des deux études ... 68
Analyses univariées de l’étude TNT ... 69
Objectif 1 - Risque de diabète pour la haute dose de statine ... 72
Objectif 2 - Effet de TCF7L2 sur le risque de diabète ... 74
SNP associé au diabète dépendamment de la dose de statine ... 74
Déséquilibres de liaison entre les SNP associés au risque de diabète ... 75
Le risque de diabète selon les génotypes de rs7903146 ... 79
Objectif 3 - Effet d’interaction du gène TCF7L2 et de la dose de statine sur le diabète ... 81
SNP associé au diabète dépendamment de la dose de statine ... 81
Discussion ... 83
Conclusion ... 95
Bibliographie... 96
Liste des tableaux
TABLEAU I.DIAGNOSTIC DU DIABÈTE DE TYPE 2 ... 1
TABLEAU II.PRÉVALENCE ET COÛT ESTIMÉ AU CANADA ... 4
TABLEAU III. PROFIL DE CHOLESTÉROLÉMIE IDÉAL POUR LES PERSONNES QUI ONT UN RISQUE ÉLEVÉ DE DÉVELOPPER DES PROBLÈMES CARDIAQUES ... 9
TABLEAU IV. PRÉVALENCE DU RISQUE DE MALADIE CARDIOVASCULAIRE, SELON LE SEXE, L’ÂGE ET LES FACTEURS DE RISQUE CARDIOVASCULAIRE, POPULATION À DOMICILE DE 20 À 79 ANS,CANADA,2007 À 2011. ... 13
TABLEAU V. TRAITEMENT AVEC LES STATINES AU CANADA SUR 1199 INDIVIDUS DE 20 À 79 ANS ... 14
TABLEAU VI.PLAN D'ÉTUDE DES ÉTUDES IDEAL ET TNT ... 35
TABLEAU VII.CARACTÉRISTIQUES ENTRE LES ÉTUDES TNT ET IDEAL ... 37
TABLEAU VIII.INFORMATIONS RÉCAPITULATIVES SUR LES PROCÉDURES DE NETTOYAGE DES DONNÉES GÉNÉTIQUES EFFECTUÉES AVANT L'ANALYSE STATISTIQUE DE L’ÉTUDE TNT ... 49
TABLEAU IX. INFORMATIONS RÉCAPITULATIVES SUR LES PROCÉDURES DE NETTOYAGE DES DONNÉES GÉNÉTIQUES EFFECTUÉES AVANT L'ANALYSE STATISTIQUE DE L’ÉTUDE IDEAL ... 52
TABLEAU X. DESCRIPTION DES PATIENTS DE L'ÉTUDE TNT TOTALE ET DES PATIENTS GÉNOTYPÉS AU RECRUTEMENT ... 61
TABLEAU XI. DESCRIPTION DES PATIENTS DE L'ÉTUDE IDEAL TOTALE ET DES PATIENTS GÉNOTYPÉS AU RECRUTEMENT ... 63
TABLEAU XII.DESCRIPTION DU DIABÈTE ENTRE LES PATIENTS GÉNOTYPÉS ET LES PATIENTS NON-GÉNOTYPÉS POUR LES ÉTUDES TNT ET IDEAL ... 67
TABLEAU XIII. COMPARAISON DU DIABÈTE ENTRE LES ÉTUDES DES PARTICIPANTS PHARMACOGÉNOMIQUE ... 68
TABLEAU XIV. ANALYSES DE RÉGRESSION LOGISTIQUE UNIVARIÉE AVEC NAD ET L’AGGRAVATION DU DIABÈTE DE TYPE 2 ... 70
TABLEAU XV. ASSOCIATION ENTRE LE RISQUE DE DIABÈTE ET LA HAUTE VS DOSE MODÉRÉE DE STATINE ... 72
TABLEAU XVI.MÉTA-ANALYSES DU GÈNE TCF7L2 AVEC LE RISQUE DE DIABÈTE ... 74
TABLEAU XVII.MÉTA-ANALYSES DES SNP SIGNIFICATIFS AVEC LE DIABÈTE TOTAL AJUSTÉ POUR RS7903146 .. 77
TABLEAU XVIII.RISQUES DE DIABÈTE DES GÉNOTYPES DU SNP RS7903146 À RISQUE C/T ET T/T EN FONCTION DU GÉNOTYPE C/C ... 79
TABLEAU XIX. MÉTA-ANALYSE DU RISQUE D’INTERACTION TRAITEMENT*SNP ... 81
Liste des figures
FIGURE 1.MORTALITÉ PROPORTIONNELLE EN 2007 AU CANADA:% DES DÉCÈS, TOUS ÂGES CONFONDUS ... 4
FIGURE 2.INHIBITION DE LA SYNTHÈSE DE CHOLESTÉROL PAR LES STATINES ... 11
FIGURE 3. LES SITES POTENTIELS D'ACTION DES STATINES SUR LA FONCTION DES CELLULES Β ONT ÉTÉ IDENTIFIÉS À PARTIR D'ÉTUDES IN VITRO ... 19
FIGURE 4. LES SITES POTENTIELS D'ACTION DES STATINES SUR L'ACTION DE L'INSULINE ... 23
FIGURE 5. DISPOSITION DES PATIENTS TNT ... 40
FIGURE 6.DISPOSITION DES PATIENTS IDEAL ... 42
FIGURE 7.PROTOCOLE DE L'ÉTUDE IDEAL ... 43
FIGURE 8.VARIABLE D’INTÉRÊT DU DIABÈTE DE L’ÉTUDE TNT ... 66
FIGURE 9.VARIABLE D’INTÉRÊT DU DIABÈTE DE L’ÉTUDE IDEAL ... 66
FIGURE 10. GRAPHIQUE DE LA RÉGION DU GÈNE TCF7L2 AVEC COMME RÉFÉRENCE RS7903146 PRÉSENTANT LE RISQUE DE DIABÈTE TOTAL POUR CHAQUE SNP(MÉTA-ANALYSE 5) ... 76
Liste des sigles et des abréviations
Aggrav. : Aggravation du diabète AVC : Accident vasculaire cérébral E-04 : 10-4
Etc. : Et ceteta
FAM : Fréquence allélique mineur
GWAS : Étude d'association pangénomique (genome-wide association study) HbA1c : Hémoglobine glyquée
HDL-C : Lipoprotéines à haute densité en Cholestérol (High Density Lipoproteins-Cholesterol)
HR : Hasard ratio
I : I2 indice d'hétérogénéité (0-100) (% de variance attribuable à l'hétérogénéité de l'étude) IC95% : Intervalle de confiance à 95%
IDEAL : Incremental Decrease in End Points Through Aggressive Lipid Lowering IMC : Indice de Masse Corporelle
LDL-C : Lipoprotéines à faible densité en Cholestérol (Low Density Lipoproteins-Cholesterol)
NAD : Nouvelle apparition de diabète P : Numéro de page
P (valeur p) : Valeur de probabilité de risque Q : Valeur P pour la statistique Q de Cochran
x RC : Rapport de cote
SNP : Variant nucléotidique
TCF7L2 : Transcription factor 7-like 2
Tmt : Traitement
TNT : Treating New Targets Vs : Versus
Remerciements
La réalisation de ce projet de maîtrise de deux ans a été possible grâce à plusieurs personnes à qui je voudrais témoigner toute ma reconnaissance.
Je voudrais tout d’abord remercier ma Directrice de maîtrise, Dre Marie-Pierre Dubé, pour m’avoir permis d’effectuer le présent projet de maîtrise sous sa supervision. Je tiens entre autres à la remercier pour sa patience et son enseignement, autant aux cours d’épidémiologie génétique qu’au laboratoire. La confiance qu’elle m’a accordée pour mener ce projet à bien m’a poussé à prendre conscience de mes capacités scientifiques et d’apprécier pleinement mon projet ainsi que la recherche clinique et l’épidémiologie génétique. Ses aptitudes à affectionner la recherche et à gérer son équipe m’ont beaucoup inspiré.
Ce projet n’aurait pu se concrétiser sans l’aide de l’équipe Statgen et l’équipe de pharmacogénomique. Merci à Sylvie Provost, Amina Barhdadi, Géraldine Asselin et Yassamin Feroz Zada de m’avoir préparé les données, mais aussi pour vos conseils, vos disponibilités, et votre aide scientifique tout le long de mes analyses. Merci également à Payman Shahabi de m’avoir guidé au début de mon projet, notamment par ses compétences médicales et ses encouragements inépuisables. Enfin je voudrais remercier Marc-André Legault, Louis-Philippe Lemieux Perreault, Johanna Sandoval et Rene Fouodjio pour leur renfort en statistique et bio-informatique. Merci à Simon Dedenus de m’avoir épaulé lors de mes présentations orales et d’avoir fait partie de mon comité de parrainage.
J’aimerais aussi remercier mes parents pour m’avoir soutenue dans mes études et m'avoir encouragé à étudier à Montréal.
Enfin, je voudrais exprimer ma reconnaissance envers Imène Tabti, Louis Arrou-Vignod et Céline Haché pour leur support inconditionnel, moral et intellectuel, leur soutien dans mes projets et leur aide pour la correction de mon mémoire et enfin d’être toujours présents pour moi.
Introduction
Section 1 : Diabète
1.1. Définition et symptômes du diabète
Diagnostic
Le diabète est une maladie d’état permanent caractérisé par une augmentation de la quantité de glucose circulant dans le sang, au-delà des valeurs normales (0.7 à 1.4 g/L en tout temps, voir tableau 1). Le taux de glucose normal à jeun est de 0.7 g/L à 0.9 g/L, mais chez un diabétique, elle dépasse 1.26 g/L (7.0 mmol/L)[2]. Après un repas, le taux de glucose ne dépasse pas 1.4 g/L chez une personne normale, et le dépasse toujours chez une personne diabétique. Il s’agit d’une maladie chronique qui ne se guérit pas, mais que l’on peut traiter et contrôler[2]. Elle est causée par une défaillance de régulation du glucose par un manque ou un défaut de la fonction de l’insuline. Le glucose n’arrive plus à servir de sources d’énergie aux cellules. La présence d’un taux de sucre élevé dans le sang étant toxique à la longue, des lésions graves des vaisseaux sanguins et des organes surviennent, notamment au niveau oculaire, rénal, nerveux et cardiaque [3].
Tableau I. Diagnostic du diabète de type 2
Les valeurs de référence proposées par les lignes directrices de pratique clinique 2013 pour la prévention et le traitement du diabète [2]
Dosage de laboratoire Diabète de type 2
Glycémie à jeun 1.26 g/L ou 7,0 mmol/L et plus
Hémoglobine glyquée (HbA1c) 6,5 % et plus
Glycémie hyperglycémie provoquée par voie orale 2g/L ou 11,1 mmol/L et plus
Glycémie à tout moment de la journée 2g/L ou 11,1 mmol/L et plus, avec les symptômes classiques
2
Le dosage de l’hémoglobine glyquée (HbA1c) (tableau 1) est essentiel, car il reflète la moyenne de la glycémie des deux mois précédents[2]. C’est donc un meilleur moyen de diagnostiquer le diabète qu’une mesure de glycémie qui donne une indication instantanée. Une HbA1c à 6% signifie une moyenne de 1.26 g/L durant ces deux derniers mois. Ce chiffre est le seuil que les diabétiques de type 2 cherchent à atteindre par le contrôle de leur hygiène de vie et par la prise de médicaments[2].
Symptôme et complications
Le diabète de type 2 entraîne peu de symptômes et peut passer inaperçu durant plusieurs années. Certaines personnes peuvent toutefois présenter des symptômes causés par l’hyperglycémie telle que l’envie fréquente d’uriner, une augmentation de la faim et de la soif, une somnolence excessive surtout après les repas, des infections bactériennes ou fongiques plus fréquentes, une perte de poids, une irritabilité, des troubles de la vision, un ralentissement de la cicatrisation et des paresthésies des extrémités[4].
Les artères sont des cibles privilégiées du diabète de type 2 et leur altération a des conséquences dévastatrices car ils permettent l’accès en oxygène et en nutriments à la totalité de nos organes[5]. Les parois des artères participent au développement de l’athérosclérose et de l’hypertension. Au niveau cardiaque, le diabète de type 2 peut conduire à un infarctus du myocarde[5]. Quant à l’altération des vaisseaux rétiniens, on observe l’apparition de rétinite avec une baisse voire même avec une perte de vision (cécité) en l’absence de traitement. La cécité est 25 fois plus élevée chez les diabétiques que les non-diabétiques. Après 15 ans d’évolution, 10% des diabétiques souffrent de malvoyance et 2% perdent la vue[5]. Sur le plan rénal, on observe très fréquemment après des années une évolution du diabète à une néphropathie, qui réduit les capacités de filtration du rein et augmente les déchets moléculaires toxiques pour l’organisme. Les patients peuvent alors nécessiter d’une dialyse rénale. La néphropathie se développe pour 25% à 30% des diabétiques de type 2[5]. De plus, les diabétiques de type 2 développent pratiquement tous une neuropathie pouvant se traduire cliniquement par des crampes, des douleurs et une diminution de la sensibilité des membres inférieurs. La conjugaison de l’altération des vaisseaux et de la neuropathie augmente les risques de pied diabétique par la répétition d’appui pathologiques, la négligence d’une plaie, la
3
surinfection pouvant parfois conduire à l’amputation du membre. L’ulcération touche 15 % à 25 % des personnes atteintes de diabète. 1/3 des amputations réalisées en 2011-2012 ont été pratiquées sur des personnes atteintes d’une plaie de pied diabétique[5].
1.2 Épidémiologie du diabète
Dans le monde
À l’échelle mondiale, en 2016, 1 personne sur 11 souffre du diabète. Le chiffre rendu public par l'Organisation Mondiale de la Santé représente très exactement 442 millions de personnes à travers le monde, comparé à 108 millions en 1980[6]
.
La prévalence mondiale (standardisée selon l’âge) du diabète a presque doublé depuis 1980, passant de 4.7% à 8.5% chez la population adulte. Ces chiffres indiquent une augmentation des facteurs de risque associés tels que le surpoids ou l’obésité, mais ils s’expliquent aussi par la présence d’une population vieillissante. En 2016, le diabète était à l’origine de 1.5 million de décès. Un taux de glycémie plus élevé que le niveau optimal a provoqué 2.2 millions de décès supplémentaires en augmentant les risques de maladies cardiovasculaires et d’autres affections. Sur ces 3.7 millions de décès, 43% surviennent avant l’âge de 70 ans[6].Au Canada
Bien qu'en 2007, seulement 3.1 % des décès au Canada étaient attribuables au diabète, plus du quart (29.9 %) des personnes décédées étaient atteintes de diabète en 2008/09. Le diabète en soi n'est généralement pas la cause directe du décès, mais les complications qui y sont associées le sont (figure 1 p4)[6]
4
Valeur de référence [6]
Figure 1. Mortalité proportionnelle en 2007 au Canada: % des décès, tous âges confondus Au Canada, en 2015, il y a 3.4 millions de personnes diabétiques et 5.7 millions de pré-diabétiques, soit près de 10% et 22% de la population (tableau II). Selon des données basées sur des tests sanguins, environ 20 % des cas de diabète n'étaient pas diagnostiqués. Le coût que représente la maladie est de 14 milliards de dollars et devrait s’élever à 17.4 milliards de dollars en 2025 (tableau II). Cela correspond à une augmentation de 44% du diabète et 25% des coûts liés à celui-ci[7]. Avec plus de 60 000 nouveaux cas par an au Canada, le diabète de type 2 est une des maladies où l'incidence croît le plus rapidement[3]. Un tiers des Canadiens ne savent pas qu'ils sont atteints de cette maladie. Le diabète est la septième cause de décès au Canada[3]. Tableau II. Prévalence et coût estimé au Canada
Principales données statistiques 2015 2025
Prévalence estimée du diabète au Canada – nbr (%) 3.4 millions (9.3) 5 millions (12.1) Coût estimé du diabète au Canada ($) 14 milliards 17.4 milliards Augmentation estimée de la prévalence du diabète
de type 2 (%)
Augmentation de 44 % entre 2015 et 2025 Augmentation estimée des coûts liés au diabète (%) Augmentation de 25 %
entre 2015 et 2025 Référence [7] 30% 30% 19% 5% 6% 3% 7% Maladies cardiovasculaires Cancers
Autres maladies non transmissibles
Affections transmissibles, maternelles, périnatales et nutrionnelles
5
De 1998/99 à 2008/09, la prévalence du diabète diagnostiqué chez les Canadiens et Canadiennes a augmenté de 70%. La plus forte hausse relative de la prévalence a été observée au sein des groupes d'âge des 35 à 39 ans et des 40 à 44 ans, où la proportion a doublé. Cette hausse chez les groupes d'âge plus jeunes s'explique, du moins en partie, par la hausse des taux d'embonpoint et d'obésité. Près de la moitié des nouveaux cas de diabète ont été diagnostiqués chez des personnes âgées de 45 à 64 ans. Selon les données d'enquêtes, dans ce groupe d'âge, 47.5% des personnes atteintes de diabète étaient obèses par rapport à 19.1% des personnes sans diabète, ce qui laisse aussi entendre que l'obésité était un facteur important contribuant au diabète dans ce groupe d'âge. Globalement, la prévalence chez les hommes (7.2%) était plus élevée que chez les femmes (6.4%). Ces prévalences devraient atteindre 12% et 23% en 2025. Terre-Neuve-et-Labrador, la Nouvelle-Écosse et l'Ontario affichaient les taux de prévalence de diabète diagnostiqué (standardisés selon l'âge) les plus élevés au Canada; le Nunavut, l'Alberta et le Québec affichaient les taux les plus bas.
Concernant les conséquences du diabète à la population générale canadienne, les personnes diabétiques risquent au moins 3 fois plus d’être hospitalisées en raison d’une maladie cardiovasculaire, 12 fois plus pour une maladie rénale au stade terminal et 20 fois plus à cause d’une amputation non traumatique d’un membre inférieur[7]. Selon des données basées sur des tests sanguins, environ 20% des cas de diabète n'étaient pas diagnostiqués. Dans la population atteinte de diabète, les coûts annuels en soins de santé par habitant ont été estimés de trois à quatre fois supérieurs à ceux de la population sans diabète. Les complications du diabète sont associées à un décès prématuré. Selon les données disponibles, il est estimé que plus du dixième des décès chez les adultes canadiens pourrait être évité si les taux de diabète étaient ramenés à zéro[7]. Dans tous les groupes d'âge, les personnes atteintes de diabète avaient des taux de mortalité au moins deux fois plus élevés que les personnes n'en étant pas atteintes. Cela entraîne une diminution notable de l'espérance de vie ainsi que de l'espérance de vie en bonne santé[7]. Près de 40% des adultes canadiens qui ont déclaré être atteints de diabète estimaient d’ailleurs que leur état de santé était « passable » ou « mauvais » par rapport à un dixième de la population adulte sans diabète (10.3%)[7]. Comme le diabète et d'autres maladies chroniques partagent plusieurs facteurs de risque, 36.5% des adultes canadiens atteints de diabète ont affirmé être atteints d'au moins deux autres maladies chroniques graves (hypertension artérielle, maladies du
6
cœur, maladie pulmonaire obstructive chronique, troubles de l'humeur ou arthrose) en plus du diabète et 12.5 % ont affirmé en avoir au moins trois[7]. Les Canadiens diabétiques sont 57% à signaler qu’ils ne sont pas en mesure de suivre le traitement qui leur a été prescrit en raison des coûts élevés à leur charge pour acheter les médicaments, appareils et fournitures nécessaires[7]. En moyenne, le coût de ces soutiens représente en moyenne plus de 3% de leur revenu annuel, ou plus de 1 500 dollars[7]. De plus, de peur de la stigmatisation, 37% des Canadiens ayant un diabète de type 2 qui ont été interrogés par l’Association canadienne du diabète indiquent qu’ils hésitent à divulguer leur maladie[7].
Au Québec
Au Québec, 830 000 personnes vivent avec le diabète, soit 10% de la population, parmi lesquelles 250 000 l’ignorent[2]. La prévalence est de 6.9% en 2013-2014 pour les personnes de plus de 12 ans, ce qui place le Québec au cinquième rang par rapport aux autres provinces. Pour la mortalité en 2012, pour tous âges, il est classé au premier rang avec un taux ajusté de 11 sur 100 000[8]. En 2012, 1 300 décès étaient attribuables au diabète comme cause initiale. C’est la première cause de cécité chez les adultes de moins de 65 ans. C’est un facteur économique estimé à 3 milliards de dollars par année. Il est responsable de 40% des insuffisantes rénales et de 50% des amputations[2].
À Montréal
En 2011-2012, 138 000 personnes âgées de 20 ans et plus vivent avec le diabète, soit une augmentation de 70% depuis 2000-2001[9].La prévalence du diabète est plus élevée à Montréal que dans le reste du Québec, probablement en partie à cause de la surreprésentation des populations vulnérables sur le territoire[9]. L'incidence du diabète est stable dans le temps. C'est un peu plus de 10 000 nouveaux cas qui sont identifiés à Montréal chaque année. En 2011-2012, le taux de mortalité est deux fois plus élevé chez les personnes diabétiques que chez les non-diabétiques[9]. On observe à Montréal d'importantes disparités territoriales, tant par rapport à la prévalence du diabète qu'à son évolution dans le temps. Entre 2000-2001 et 2011-2012, les écarts se creusent sur l'île[9]. La maladie progresse plus rapidement dans l'est de Montréal et dans les quartiers qui longent le nord de l'île alors que la situation est plus stable dans les quartiers centraux[9]. Les personnes diabétiques vivant à Montréal consultent plus souvent les
7
spécialistes que la population diabétique du reste du Québec, notamment les ophtalmologistes, les endocrinologues et les cardiologues[9]. La proportion de personnes diabétiques hospitalisées ou ayant recours à l'urgence est à la baisse[9].
1.3. Facteurs de risque relatifs au diabète de type 2
Le diabète de type 2 n'est pas associé à une seule cause. C’est une maladie complexe qui est attribuée à des facteurs génétiques (voir section 3 p28-34) et environnementaux. Les facteurs qui en augmentent le risque sont l'âge (40 ans ou plus), le surplus de poids (en particulier l'obésité abdominale), un membre de la famille atteint de diabète, l’antécédent de diabète gestationnel, avoir donné naissance à un bébé pesant plus de 4 kg (9 lb) à la naissance, l'hypertension artérielle, l'hypercholestérolémie ou autres hyper-lipémies et l’origine de groupe ethnique à risque[3]. Par exemple, les Autochtones ont de trois à cinq fois plus de risques d'être atteints d'un diabète de type 2 que les autres Canadiens. Le diabète de type 2 est actuellement diagnostiqué même chez des enfants autochtones alors que cette maladie apparaît généralement chez des personnes plus âgées. Les personnes d'ascendance hispanique, asiatique, sud-asiatique ou africaine sont également plus à risque d'être atteintes du diabète de type 2[3]. Certains médicaments comme les statines sont aussi des facteurs de risque de diabète de type 2, ceci sera développé à la section 2 (p8-27) suivante.
8
Section 2 : Les statines
2.1. Mécanisme d’action et indication des statines
Utilité
Les statines sont des médicaments hypocholestérolémiants prescrits pour traiter l’hypercholestérolémie (concentration anormale de cholestérol dans le sang)[10]. Les statines participent à la réduction de risque d’évènements cardiovasculaires et à la survie des individus souffrant de maladie cardiovasculaire comme l’athérosclérose, coronaropathies et les accidents vasculaires cérébraux[10]. Les statines réduisent la progression de l’obstruction des artères, réduisent l’athérosclérose et prolongent la durée de vie en bonne santé. Une réduction de 1 mmol/L du cholestérol sanguin LDL se traduit par une réduction de 20% à 25% des événements cardiovasculaires[10]. La prise des statines est indiquée dans le traitement de l’hypercholestérolémie, mais aussi à des fins préventives chez les patients à risque de maladie cardiovasculaire[11].
Effets secondaires
Les statines ne sont toutefois pas sans risque d’évènements indésirables, notamment les myalgies qui peuvent réduire la qualité de vie et la mobilité, voire dans de rares cas causer des rhabdomyolyses généralisées (dégradation rapide du tissu musculaire)[10]. Les statines peuvent aussi favoriser le diabète, des céphalées, des troubles digestifs en plus des douleurs et une faiblesse musculaire. Certains facteurs prédisposent à présenter ces effets musculaires comme l’âge avancé, une petite ossature, une fonction rénale altérée, une infection, une interaction avec d’autres médicaments et un abus d’alcool, et d’être de sexe féminin[10]. Pour les individus intolérants aux statines, on propose d’autres médicaments hypoglycémiants tels que ceux dans la famille des inhibiteurs de PCSK9[12].
Facteurs de risque de maladie cardiovasculaire
Les taux optimaux de cholestérolémie sont déterminés selon les facteurs de risque de maladie cardiovasculaire, comme le diabète ou l’usage du tabac[13]. Les faibles taux de HDL sont associés à une augmentation du risque de maladie du cœur. Le taux optimal de HDL est
9
supérieur à 1.3 mmol/L, mais de très hauts taux de HDL n’offrent pas de protection additionnelle. Pour cette raison, le ratio cholestérol total sur cholestérol HDL n’est plus utilisé pour évaluer le risque[13]. Les taux sanguins de cholestérol et de triglycérides sont déterminés en partie par des facteurs héréditaires (génétiques). De plus, les taux de LDL augmentent naturellement avec l’âge[13].
Tableau III. Profil de cholestérolémie idéal pour les personnes qui ont un risque élevé de développer des problèmes cardiaques
Lipide Profil idéal
Cholestérol total < 4.0 mmol/L
Triglycérides < 1.8 mmol/L
C-LDL < 2.0 mmol/L
Cholestérol non-HDL
(rapport CT/cholestérol HDL) < 2.6 mmol/L
HDL-C > 1.0 mmol/L (homme); > 1.3 mmol/L (femme)
Référence [13]
Un taux élevé de triglycérides est souvent associé à un faible taux de HDL et constitue un autre facteur de risque de maladie du cœur. Un taux très élevé de triglycérides sanguins peut être responsable d’une pancréatite[13].
La lipoprotéine a ou Lp(a) est une particule de transport du cholestérol. Des taux de Lp(a) supérieurs à 25 mg/dL (>250 mg/l) sont associés à une nette augmentation du risque de maladie du cœur et d’accident vasculaire cérébral, risque qui augmente proportionnellement aux taux sanguins de Lp(a). La mesure des Lp(a) peut aider à déterminer s’il faut recourir à un hypocholestérolémiant[13].
La protéine C-réactive est un marqueur de l’inflammation. Cette protéine est utilisée pour faciliter l’évaluation du risque de maladies cardiovasculaires chez des individus d’apparence en bonne santé n’ayant pas de symptôme. Le taux d’accidents coronariens augmente considérablement en présence de taux élevés de la protéine C-réactive. Les patients qui présentent des taux élevés de protéine C-réactive tirent profit d’un traitement aux statines. Le
10
taux optimal de protéine C-réactive est inférieur à 1 mg/L et les taux supérieurs à 3 mg/L signalent un risque accru de maladie du cœur et d’accident vasculaire cérébral[13].
Les diabétiques sont de trois à cinq fois plus à risque d’être atteints d’une maladie du cœur que les non-diabétiques. Le diabète de type 2 se traite notamment par l’activité physique, par la perte de poids et des médicaments pour réduire à la normale la glycémie (voir section 1 p1-7). Comme le risque de maladie cardiovasculaire est élevé, la plupart des diabétiques ont aussi besoin de statines pour abaisser leur taux de LDL sous la barre des 2 mmol/L[13].
Pour calculer les niveaux de facteur de risque d’évènements cardiovasculaires il faut compter l’hypertension artérielle permanente traitée ou non; la cholestérolémie HDL-cholestérol < 0.40 g/L (1.0 mmol/L) et soustraire si le taux de HDL-cholestérol > 0.60 g/L (1.5 mmol/L); le diabète de type 2 traité ou non; l’âge (50 ans ou plus chez les hommes, 60 ans ou plus chez les femmes); des antécédents familiaux de maladie coronarienne précoce (infarctus du myocarde ou mort subite avant 55 ans chez le père ou chez un parent du premier degré de sexe masculin, avant 65 ans chez la mère ou chez un parent du premier degré de sexe féminin[14]. Selon les niveaux de risques, le taux de LDL-C et l’objectif visé, le choix de la dose et du type de statine sera choisi[14].
Mécanismes d’action des statines
HMG-CoA (3-hydroxy-3-methylglutaryl-coenzyme A) réductase, ou HMGR catalyse l'étape engagée dans la biosynthèse du cholestérol (figure 2 p11)[15]. Les statines sont des inhibiteurs compétitifs hépatiques de HMG-CoA réductase dont le substrat habituel est HMG-CoA. Toutes les statines réduisent la biosynthèse du cholestérol en inhibant l'étape engagée dans la biosynthèse des isoprénoïdes et stérols. Il est catalysé par une réaction HMGR qui se déroule comme suit[15] :
11 Référence[15]
12
2.2. Épidémiologie des statines
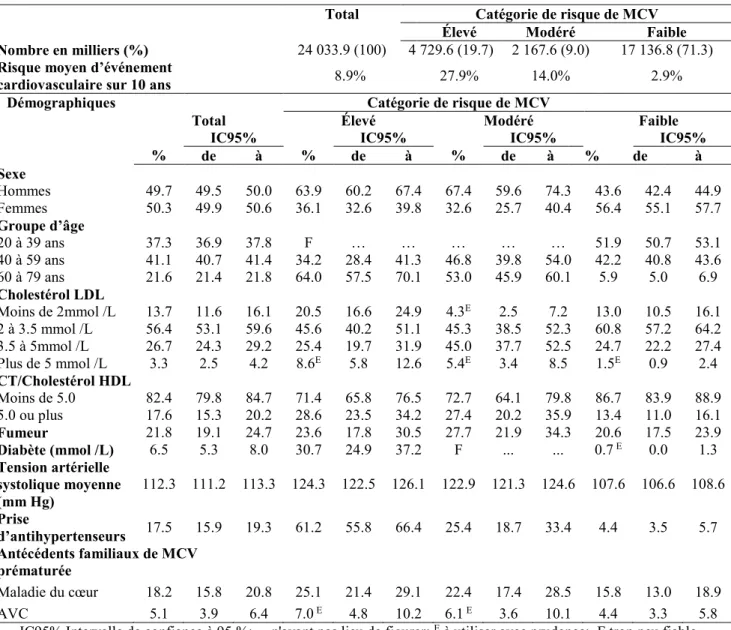
Les statines sont l’une des classes de médicaments les plus souvent prescrites au Canada et coûtent plus cher aux régimes provinciaux d’assurance-médicaments que tout autre médicament, menant à des coûts directs de presque 2 milliards de dollars annuels[16]. Entre 2007 et 2011, une étude de l’Enquête canadienne sur l’incidence du traitement aux statines sur la population canadienne regroupant 11 999 individus a été réalisée par Statistique Canada (tableaux IV p13). L’étude compare les tendances actuelles en matière de traitement aux recommandations de traitement selon les lignes directrices de la Société canadienne de cardiologie. C’est l’étude far présentant le mieux le traitement des statines au Canada.
Le tableau IV (p13) présente le risque de maladie cardiovasculaire chez les canadiens adultes, selon le sexe, le groupe d’âge et les facteurs de risque cardiovasculaire [16]. Ces facteurs de risque comprennent le taux de cholestérol-LDL; le rapport cholestérol total/cholestérol HDL; l’usage de tabac (les individus déclarés comme fumeurs s’ils fumaient tous les jours ou à l’occasion); le diabète (≥ 7 mmol/L ou consommation vérifiée d’hypoglycémiants ou déclaré avoir reçu un diagnostic de diabète); tension artérielle systolique; la prise en compte de prise de médicaments antihypertenseurs (bêta-bloquant); les médicaments agissant sur le système rénine-angiotensine; les diurétiques thiazidiques; les inhibiteurs de canaux calciques et les hypertenseurs, mais aussi les antécédents familiaux de maladie cardio-vasculaire prématurée; et les accidents vasculaires cérébraux (AVC). Le risque de base de maladie cardiovasculaire a été calculé à partir du score de risque de Framingham (SRF) pour la coronaropathie récurrente. Pour les besoins de la stratification du risque, on a défini les personnes présentant un risque élevé comme faisant de l’hypertension à hauts risques, c’est-à-dire qu’elles montraient au moins trois des facteurs de risque suivants : sexe masculin, plus de 55 ans, fumeur, rapport cholestérol total/HDL-C supérieur à 6, posséder des antécédents familiaux de maladie cardiovasculaire prématurée et de maladie rénale chronique. Dans le cas des participants qui n’entraient pas automatiquement dans la catégorie de risque élevé, le risque de base de maladie cardiovasculaire a été calculé à partir du SRF pour le total des événements cardiovasculaires sur 10 ans (lignes directrices de 2012 de la Société Canadienne de Cardiologie ou SCC)[17].
13
Tableau IV. Prévalence du risque de maladie cardiovasculaire, selon le sexe, l’âge et les facteurs de risque cardiovasculaire, population à domicile de 20 à 79 ans, Canada, 2007 à 2011.
Total Catégorie de risque de MCV
Élevé Modéré Faible
Nombre en milliers (%) 24 033.9 (100) 4 729.6 (19.7) 2 167.6 (9.0) 17 136.8 (71.3) Risque moyen d’événement
cardiovasculaire sur 10 ans 8.9% 27.9% 14.0% 2.9%
Démographiques Catégorie de risque de MCV
Total Élevé Modéré Faible
% IC95% % IC95% % IC95% IC95% de à de à de à % de à Sexe Hommes 49.7 49.5 50.0 63.9 60.2 67.4 67.4 59.6 74.3 43.6 42.4 44.9 Femmes 50.3 49.9 50.6 36.1 32.6 39.8 32.6 25.7 40.4 56.4 55.1 57.7 Groupe d’âge 20 à 39 ans 37.3 36.9 37.8 F … … … 51.9 50.7 53.1 40 à 59 ans 41.1 40.7 41.4 34.2 28.4 41.3 46.8 39.8 54.0 42.2 40.8 43.6 60 à 79 ans 21.6 21.4 21.8 64.0 57.5 70.1 53.0 45.9 60.1 5.9 5.0 6.9 Cholestérol LDL Moins de 2mmol /L 13.7 11.6 16.1 20.5 16.6 24.9 4.3E 2.5 7.2 13.0 10.5 16.1 2 à 3.5 mmol /L 56.4 53.1 59.6 45.6 40.2 51.1 45.3 38.5 52.3 60.8 57.2 64.2 3.5 à 5mmol /L 26.7 24.3 29.2 25.4 19.7 31.9 45.0 37.7 52.5 24.7 22.2 27.4 Plus de 5 mmol /L 3.3 2.5 4.2 8.6E 5.8 12.6 5.4E 3.4 8.5 1.5E 0.9 2.4 CT/Cholestérol HDL Moins de 5.0 82.4 79.8 84.7 71.4 65.8 76.5 72.7 64.1 79.8 86.7 83.9 88.9 5.0 ou plus 17.6 15.3 20.2 28.6 23.5 34.2 27.4 20.2 35.9 13.4 11.0 16.1 Fumeur 21.8 19.1 24.7 23.6 17.8 30.5 27.7 21.9 34.3 20.6 17.5 23.9 Diabète (mmol /L) 6.5 5.3 8.0 30.7 24.9 37.2 F ... ... 0.7 E 0.0 1.3 Tension artérielle systolique moyenne (mm Hg) 112.3 111.2 113.3 124.3 122.5 126.1 122.9 121.3 124.6 107.6 106.6 108.6 Prise d’antihypertenseurs 17.5 15.9 19.3 61.2 55.8 66.4 25.4 18.7 33.4 4.4 3.5 5.7 Antécédents familiaux de MCV prématurée Maladie du cœur 18.2 15.8 20.8 25.1 21.4 29.1 22.4 17.4 28.5 15.8 13.0 18.9 AVC 5.1 3.9 6.4 7.0 E 4.8 10.2 6.1 E 3.6 10.1 4.4 3.3 5.8
IC95% Intervalle de confiance à 95 %; ... n'ayant pas lieu de figurer; E à utiliser avec prudence; F trop peu fiable pour être publié; † taux rajustés aux valeurs d'avant traitement pour les personnes prenant des statines;
Cholestérol LDL = cholestérol à lipoprotéines de faible densité; CT/Cholestérol HDL = cholestérol total/cholestérol à lipoprotéines de haute densité; Source : Enquête canadienne sur les mesures de la santé. données combinées pour 2007 à 2009 et 2009 à 2011 [16]
14
La part la plus importante (90%) du bénéfice réel de l’utilisation des statines au niveau de la population dépend des personnes à risque élevé. Chez ce groupe, le traitement est plus de deux fois plus efficace que chez celui à risque modéré, et quatre fois plus efficace que chez celui à faible risque.
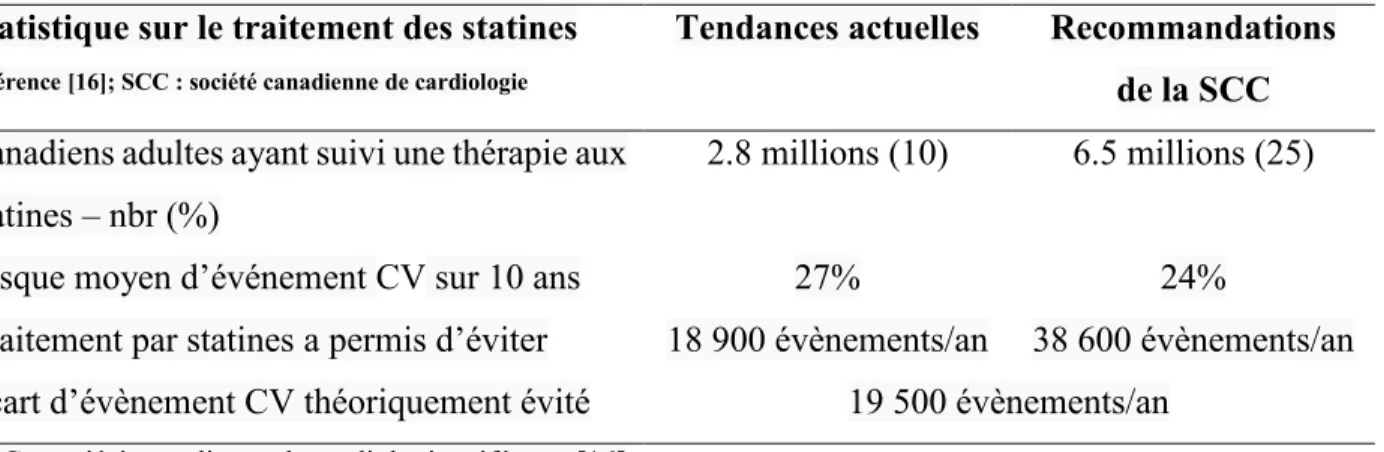
Chez la population âgée de 20 à 79 ans, le risque d’événement cardiovasculaire sur 10 ans s’établissait à 8.9 %, ce qui représente environ 2.1 millions d’événements sur 10 ans (environ 210 000 par année)[16]. L’étude estime que 2.8 millions de Canadiens adultes (environ un sur dix) ont suivi une thérapie aux statines alors que 6.5 millions de Canadiens adultes (une personne sur quatre) se sont vu proposer une thérapie aux statines, comme on peut voir dans le tableau V. Le risque moyen d’événement cardiovasculaire sur 10 ans chez des personnes sous statines s’établissait à 27 % contre 24 % pour les personnes qui se sont vu recommander les statines[16]. En supposant une observance thérapeutique optimale, l’étude estime que le traitement par statines a permis d’éviter quelques 18 900 événements cardiovasculaires par année, mais qu’il aurait pu éviter 38 600 événements cardiovasculaires chaque année si tous les individus qui présentaient l’indication à un traitement le suivaient, ce qui fait un écart de 19 500 évènements cardiovasculaires par années (tableau V)[16].
Tableau V. Traitement avec les statines au Canada sur 1199 individus de 20 à 79 ans Statistique sur le traitement des statines
référence [16]; SCC : société canadienne de cardiologie
Tendances actuelles Recommandations de la SCC Canadiens adultes ayant suivi une thérapie aux
statines – nbr (%)
2.8 millions (10) 6.5 millions (25)
Risque moyen d’événement CV sur 10 ans 27% 24%
Traitement par statines a permis d’éviter 18 900 évènements/an 38 600 évènements/an Écart d’évènement CV théoriquement évité 19 500 évènements/an
15
2.3. Quels sont les liens entre les statines et le diabète?
Mise en contexte
Le glucose et les lipides sont tous deux des composantes importantes du métabolisme énergétique. Il n'est donc pas surprenant que le métabolisme du glucose et le métabolisme lipidique soient étroitement liés. Les patients diabétiques sont caractérisés par une dyslipidémie typique qui est étroitement liée à la maladie cardiovasculaire chez ces patients. Cependant, l'hypertriglycéridémie et le faible HDL-C peuvent également induire des troubles du métabolisme du glucose et peuvent donc être source et conséquence de l’hyperglycémie. Étonnamment, la thérapie par statine est associée à une augmentation faible, mais significative de la fréquence de nouvelle apparition de diabète, mais le bénéfice du traitement par statine l'emporte sur le risque dans presque toutes les situations cliniques[18]. Les statines sont les médicaments phares contre la prévention des évènements cardiovasculaires leur permettant de réduire la morbidité et la mortalité. L’impact sur les maladies cardiovasculaires est attribuable principalement à l’abaissement du cholestérol. En plus de réduire le risque cardiovasculaire, les statines exercent plusieurs effets bénéfiques sur l'inflammation et le stress oxydatif[19].
Diabétogénicité des statines
La première étude à rapporter le risque de diabète de type 2 a été chez des hommes, West of Scotland Coronary Prevention Study (WOSCOPS; n=5974). Cette étude a suggéré contre placébo que la prévastatine est associée à 30% de risque relatif de réduction (p=0.042) après 5 ans [20]. Par la suite, l’étude Justification for the Use of Statin in Primary Prevention : An Intervention Trial Evaluating Rosuvastatin (JUPITER; n=17 802), avec 20 mg/jour de rosuvastatine pendant 1.9 années a conclu à un risque relatif significatif de 25% de développer du diabète chez des hommes et femmes avec des niveaux de LDL normaux (une moyenne de 108 mg/dL) par rapport au placebo (p=0.01). Cette augmentation s'est accompagnée d'une légère augmentation de HbA1c (0.3%).
16
Une enquête a été réalisée par Sattar et al. sur la totalité des résultats des essais pertinents, afin de réaliser une méta-analyse de 13 essais sur les statines (dont JUPITER et WOSCOP) en incluant 91 140 patients sans diabète de type 2[20]. Dans l’ensemble, la dose standard de statine (atorvastatine 10 mg, pravastatine 40 mg, simvastatine 40 mg et rosuvastatine 20 mg) a été associée avec 9% d’augmentation de risque de diabète en 4 ans (OR=1.09; IC95% [1.02-1.07]) avec une hétérogénéité de I2=11% entre les essais. Plus tard, une analyse d’essai post-hoc Stroke
Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL; n = 3803) montre 8.71% de nouveau diabète chez patients sous 80 mg d’atorvastatine par jour contre 6.06% dans le groupe placebo (HR=1.37; 95%CI [1.08-1.75]; p=0.011).
Une autre méta-analyse par Preiss et al., en 2011 confirme la diabétogénicité des statines et conclut que cet effet est dose-dépendant avec 12% d’augmentation du risque avec une dose intensive comparée à une dose modérée [21]. Cette méta-analyse inclut cinq essais avec 32 752 participants sans diabète au recrutement et sans hétérogénéité entre les essais (I2=0%)[19]. Par
la suite, une foule de données des méta-analyses supplémentaires et des études rétrospectives ont montré que les statines à fortes doses sont plus susceptibles d’augmenter le risque de diabète par rapport à une dose faible[22]. Néanmoins, il convient de souligner que certains des essais inclus dans ces analyses étaient de courte durée et qu'aucune donnée sur le diabète induite par les statines n'est disponible pour une durée supérieure à 10 ans[23].
Groupes à risque
Les groupes à risque de développer du diabète au cours d’une thérapie par statine sont les groupes de facteurs de risque classiques associés avec le diabète de type 2 : les personnes âgées (>70 ans), les femmes et les individus d’origine asiatique[20, 24, 25]. L'effet diabétogène lié à la dose des statines est plus apparent pour les individus avec des facteurs de risque préexistants, tels que les composants du syndrome métabolique[22]. Une récente analyse post-hoc de Waters et al. des essais Treating to New Target (TNT) (n=7595) et IDEAL Incremental Decrease in End Points Through Aggressive Lipid Lowering (n=7461) (fig. 4) a montré que le développement du diabète de type 2 par les statines est associé à des taux élevés de glucose à jeun (> 100 mg/dL) et par la présence de composants du syndrome métabolique, y compris des taux élevés de triglycéride à jeun (> 150 mg/dL), l'indice de masse corporel IMC> 30 kg/m2 et de
17
l’hypertension [26, 27]. Parmi les patients possédant entre 0 et 1 facteur de risque de diabète de type 2 au départ, le risque de développer un diabète de type 2 pendant un suivi moyen de 5 ans était, pour les patients traités avec des doses élevées de statines (atorvastatine 80 mg ou simvastatine 40 mg) et des statines à doses modérées (atorvastatine 10 mg ou 20 mg de simvastatine), sont de 3.22% contre 3.35% respectivement (HR=0.97; IC95% [0.77-1.22]). Parmi les patients possédant entre 2 et 4 facteurs de risque, le diabète de type 2 s'est développé dans 14,3% des groupes à dose élevée et dans 11,9% des groupes à faible dose (HR=1.24; IC95% [1.08-1.42]; p=0.0027). Cela suggère que l’effet diabétogène lié à la dose des statines est principalement apparent pour les personnes ayant des facteurs de risque préexistants[20]. Dans les deux essais, une dose élevée de statine a nettement réduit le nombre d'événements cardiovasculaires majeurs[28].
Une analyse post hoc de l'essai SPARCL a montré que les individus avec quatre facteurs de risque de diabète de type 2 ayant reçu de l'atorvastatine à une dose de 80 mg par jour ont montré une augmentation de 37% du risque relatif de développer une nouvelle apparition de diabète[28]. De même, une analyse récente de l'étude JUPITER a montré que la prise de rosuvastatine contre placébo chez des sujets avec un facteur de risque accru pour le diabète de type 2 (syndrome métabolique, glucose à jeun altérée, IMC> 30 kg m2, ou HbA1c> 6%) augmentait le risque de
28% de développer un diabète de type 2 (HR=1.28; IC95% [1.07-1.54]; p=0.01), alors que le risque chez les patients sans aucun facteur de risque avait une augmentation du risque négligeable[20]. Néanmoins, il convient de souligner que les bénéfices cardiovasculaires et de prévention de mortalité attribuables aux statines dans l’essai JUPITER ont dépassé le risque d’apparition de diabète, même pour les participants à haut risque de développer du diabète[29, 30]. D'autres études sont nécessaires pour examiner si les statines sont directement responsables de l’apparition de diabète de type 2 ou si simplement accélèrent la progression vers le diabète de type 2 chez les personnes ayant une prédisposition pour la maladie[20].
2.4. Mécanismes proposés expliquant la diabétogénicité par les statines
Les statines peuvent interférer avec la fonction pancréatique et la sensibilité à l'insuline tissulaire. Certaines différences entre statines lipophiles et hydrophiles peuvent aider à expliquer leur diabétométrie variable.
18 Facteurs génétiques
Une association entre la diabétogenèse liée à la statine et son effet inhibiteur de la HMG-CoA réductase a été mise en évidence par une récente étude d'observation comprenant 233 463 individus participant à 43 études génétiques[31]. Cette analyse de randomisation mendélienne a évalué deux polymorphismes de nucléotide unique dans le gène HMG-CoA réductase (HMGCR) comme intermédiaires de l'inhibition de l'enzyme par les statines. Les SNP dans le gène codant pour cette enzyme ont été choisis selon leurs associations génétiques significatives avec le LDL-C; à savoir rs17238484-G pour l'analyse principale et rs12916 comme analyse supplémentaire.
La présence de tout allèle additionnel rs17238484 ou rs12916 a été associée à un taux de LDL-C moyen inférieur à 2.3 mg/dl (0.06 mmol /L). LDL-Cependant, elle a également été associée à une augmentation significative, du poids corporel de 0.30 kg, de la circonférence de la taille de 0.32 cm ainsi que des niveaux de glucose plasmatique de 0.23% et d'insuline de 1.62%. La présence de l'un de ces allèles liés à une augmentation de l'expression de HMGCR était associée à une augmentation significative du risque de diabète de type 2 de 2 à 6%: 1.02 (IC95%: 1.00-1.05) pour rs17238484-G et 1.06 (IC95%: 1.03 à 1.09) pour l'allèle rs12916[23, 31]. L’effet a été lié à une augmentation du poids corporel, un facteur contributif connu pour le développement du diabète sucré. Cependant, il est peu probable que ce changement explique pleinement le risque accru observé[23]. Cette association suggère que le risque de NAD est lié au degré d’inhibition de l'activité de HMG-CoA réductase et, par conséquent, à la puissance de la statine[23]. Les statines pourraient augmenter potentiellement les taux de glucose et de nouvelle apparition de diabète par l'augmentation de l'insuline ou une fonction des cellules β détériorée ou une combinaison de ces deux procédés.
19
Les cellules bêta du pancréas et la sécrétion de l’insuline
Le glucose est transporté par le transporteur de glucose GLUT2 dans les cellules bêta pancréatiques. Par la suite, le glucose est acheminé vers sa voie métabolique après phosphorylation du glucose en glucose-6-phosphate par la glucokinase (première réaction de la glycolyse). La cascade métabolique qui s’ensuit (glucolyse et phosphorylation oxydative) mène à une production d’ATP qui entraine l’inactivation des canaux K+/ATP, bloquant ainsi la sortie
de potassium qui, en s’accumulant, dépolarise la membrane cellulaire et ouvre les canaux Ca2+
voltage-dépendants. À cela s’ensuit l'influx Ca2+. Il en résulte la sécrétion d'insuline par
l'exocytose des granules sécrétoires contenant de l'insuline[23].
Figure 3. Les sites potentiels d'action des statines sur la fonction des cellules β ont été
20
La figure 3 résume les sites potentiels d’action des statines sur les fonctions des cellules β [32]. 1. Les statines réduisent l'expression de l'ARNm et des protéines du GLUT2, ce qui limite l'absorption du glucose. 2. Les statines régulent à la hausse les récepteurs des LDL et l'absorption du cholestérol. Le chargement du cholestérol nuit à la fonction des cellules ß, leur prolifération et leur survie. 3. Les statines réduisent les niveaux de Coenzyme Q10 (CoQ10) secondaires à l'inhibition de la voie du mévalonate, ce qui nuit au transport des électrons mitochondriaux et à la production d'ATP. L'ATP est un régulateur essentiel de la sécrétion d'insuline par les effets sur les canaux K+/ATP, la dépolarisation membranaire et l'ouverture subséquente des canaux
calciques. 4. Les statines inhibent les canaux calciques de type L et l'élévation du taux de calcium cytosolique nécessaire à la sécrétion d'insuline. 5. Les statines réduisent la synthèse de l'isoprène compromettant la modification post-traductionnelle de petites protéines G, qui sont importantes dans l'exocytose des granules contenant de l'insuline[32]. Ces mécanismes sont développés dans les paragraphes suivant.
Comme mentionné au premier paragraphe sur la sécrétion de l’insuline, les cellules β pancréatiques sont électriquement excitables via GLUT 2 et la fermeture de canal K+/ATP joue
un rôle clé dans ces cellules en couplant l'énergie à l'activité électrique (figure 3, mécanisme 1). Lorsque le canal s'ouvre, les cellules β pancréatiques s’hyperpolarisent et la sécrétion d'insuline est supprimée[33]. Dans ce contexte, la suractivité de K+/ATP semble être diabétogène.
L'activation de mutations sur la sous-unité Kir6.2 de K+/ATP peut être associée au
développement du diabète[33]. Des concentrations élevées de simvastatine ont réduit la sécrétion d'insuline dans une lignée de cellules β pancréatiques[34]. Cet effet est associé à une réduction de l’ARNm, des protéines de GLUT2 et des canaux calciques, avec l’augmentation de l’expression de Kir6.2 du canal potassique[34]. La simvastatine affecte donc la sécrétion d'insuline indirectement en réduisant le glucose via GLUT2 et directement par inhibition de la dépolarisation de la membrane et influe de calcium[23].
L'appauvrissement du cholestérol endogène est compensé par une absorption augmentée du LDL-C plasmatique[19, 35], qui pourrait dépendre de l'activité des récepteurs LDL[36] (figure 3, mécanisme 2). Le LDL-C absorbé inhibe la glucokinase, enzyme limitant de la vitesse de la glycolyse, réduisant ainsi la sécrétion d'insuline dépendant du Ca2+[35]. Les statines
21
d'insuline médiée par le glucose[35, 37]. L'oxydation des LDL-C intracellulaires peut déclencher diverses voies inflammatoires, qui nuisent à l'intégrité structurelle et fonctionnelle des cellules β pancréatiques, affectant ainsi leur capacité sécrétoire[35, 37]. Des données in vitro suggèrent que la croissance et la viabilité des cellules β sont altérées par une incubation prolongée avec des statines lipophiles en concentrations élevées[19, 26]. Cet effet peut être associé à une augmentation initiale de l'insuline basale libérée par les granules contenant de l'insuline. Cependant, la sécrétion d'insuline en réponse à une concentration élevée en glucose peut être perturbée[19, 36]. Cet effet peut ne pas être pertinent pour les statines hydrophiles[26, 38]. Dans ce contexte, il a été montré que la rosuvastatine empêchait le dérangement induit par les acides gras des cellules des îlots pancréatiques[19, 38].
La coenzyme Q10 (ubiquinone) est un produit du mévalonate (voir figure 2 p11), qui contribue à la fonction sécrétoire des cellules b pancréatiques via la régulation du système d'émission d'électrons mitochondriaux dans la chaîne respiratoire[19, 39] (figure 3, mécanisme 3). Cette molécule facilite la génération d'énergie sous forme d'ATP[40]. Dans ce contexte, l'inhibition de la synthèse de la coenzyme Q10 liée à la statine peut entraîner une diminution de la sécrétion d'insuline pancréatique[41]. Ces effets ont été observés dans des échantillons de biopsie de muscle squelettique prélevé chez des personnes traitées par la simvastatine, mais une situation similaire se produisant dans les cellules β reste à déterminer.
La concentration de calcium cytosolique dans les cellules ß du pancréas semble dépendre de la teneur en cholestérol intracellulaire[26, 42] (figure 3, mécanisme 4). Ce dernier médiatise l'influx de Ca2+ dans ces cellules en activant les canaux Ca2+ de type L. L'inhibition de la
biosynthèse du cholestérol endogène par les statines peut bloquer l'afflux de Ca2+ médié par le
type L, réduisant ainsi sa concentration cytosolique de calcium[26, 42]. Il est à noter que les canaux Ca2+ de type L pourraient aussi jouer un rôle dans la sécrétion d'insuline stimulée par la
L-arginine et le KCl en ouvrant les canaux calciques. Ces deux fonctions ont été inhibées par la simvastatine lipophile in vitro[42] et expliqueraient la perturbation de la sécrétion de l’insuline, plus particulièrement pour les statines lipophiles (c'est-à-dire l'atorvastatine, la simvastatine) plutôt que les statines hydrophiles (c'est-à-dire la pravastatine)[26, 42]. En effet, contrairement aux statines hydrophiles, les lipophiles ont une forte affinité pour la membrane cellulaire, ce qui permet un accès facile à l'espace intracellulaire[39]. En d'autres termes, la simvastatine et
22
l'atorvastatine lipophiles inhibent en fonction de la dose et du temps le glucose médié par la sécrétion d'insuline in vitro[26, 34, 42]. Cet effet n'était pas aussi prononcé avec la simvastatine qui est moins lipophile, alors qu'il n'était pas significatif pour la pravastatine hydrophile[42]. De même, la rosuvastatine n'a pas eu d'effet significatif sur la libération d'insuline basale et stimulée par le glucose dans les cultures cellulaires d'îlots humains[38]. Outre son rôle dans la sécrétion d'insuline dépendant du Ca2+,le cholestérol endogène semble être abondant dans les membranes
de granules sécrétoires d'insuline. La statine lipophile lovastatine, en inhibant la synthèse de mévalonate, a réduit le taux de cholestérol membranaire et la teneur en insuline de granules sécrétoires dans les cellules β pancréatiques[43].
Les petites protéines de liaison au GTP (Rab4 et de RhoA) jouent un rôle clé dans la signalisation de la sécrétion d'insuline par les cellules β du pancréas en réponse au glucose et au Ca2+[39, 44]
(figure 3, mécanisme 5). Ces protéines nécessitent l'isoprénylation pour leur association (modification post-traductionnelle) avec les membranes cellulaires. Ce processus est médié par des produits du mévalonate, y compris le pyrophosphate de géranygeranyle et le pyrophosphate de farsényle (voir figure 2 p11[45]). Les statines bloquent la signalisation de la sécrétion d'insuline induite par le glucose et le KCl via l'inhibition de la synthèse de mévalonate[39, 44]. Les statines peuvent également perturber plusieurs autres événements précoces de la signalisation de l'insuline. Ceux-ci incluent la phosphorylation de la tyrosine de la sous-unité β du récepteur de l'insuline et de la protéine kinase activée par le mitogène[19]. De plus, l'association de la sous-unité p85 de la phosphoinositide-3-kinase avec le substrat 1 du récepteur de l'insuline (IRS)-1 et l'activation de la protéine kinase activée par le mitogène peuvent être inhibées par les statines[45-47].
23 Résistance et sensibilité de l’insuline
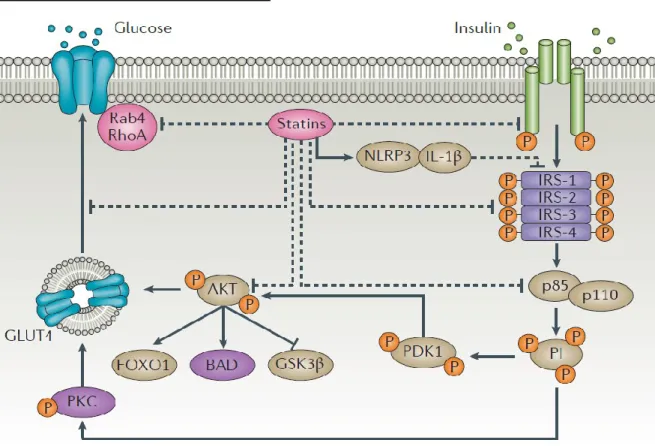
Figure 4. Les sites potentiels d'action des statines sur l'action de l'insuline
La figure 4 résume les sites potentiels d’action des statines sur l’action de l’insuline [32]. Ces sites sont identifiés à partir d'études in vitro. La tyrosine kinase du récepteur de l'insuline est activée par l'insuline, ce qui conduit à la phosphorylation de la tyrosine du substrat 1 du récepteur de l'insuline (IRS-1). La sérine-thréonine kinase AKT est ensuite activée, ce qui facilite le déplacement des vésicules de stockage contenant le transporteur de glucose type 4 (GLUT4) vers la membrane cellulaire. La protéine transmembranaire GLUT4 permet au glucose de pénétrer dans la cellule. L'IRS-1 phosphorylée par la tyrosine possède des sites de liaison pour des protéines de signalisation clés, comprenant les sous-unités p85 et p110 de phosphatidylinositol 3-kinase, qui par l'activation des cascades AKT et protéine kinase 3 (PKC) joues un rôle majeur dans la fonction insuline. L'AKT activé induit la synthèse du glycogène par inhibition du glycogène synthase kinase 3β (GSK3β), la synthèse protéique et la survie cellulaire en inhibant le promoteur de la mort associée à Bcl-2 (BAD, un facteur proapoptotique), la protéine FOXO1 (un facteur de transcription) et GSK3ß. P sur la figure 4 est groupe phosphate; PI un phosphatidylinositol. Reproduit de Banach, M. et al.[23].
24
Il est bien établi par les études cliniques que les statines augmentent la résistance à l'insuline[39]. Cette résistance est liée à une réduction des taux de cholestérol membranaire et une augmentation de cholestérol qui s'accumule avec les triglycérides dans les cellules[23]. L’appauvrissement de la membrane en cholestérol est, associé avec l’activation de SREBP2 et de ses gènes cibles, impliqués dans l'homéostasie du cholestérol[23].
Le tissu adipeux est l'un des principaux tissus exprimant le GLUT4. GLUT4 est un transporteur stimulé par l'insuline pour permettre l'absorption de glucose[39]. Lorsque l’insuline arrive dans les adipocytes, il se lie au récepteur qui mène à une voie signalisation intracellulaire. La voie de signalisation provoque la sortie de GLUT4 à la membrane des adipocytes pour faire rentrer le glucose. Cette signalisation implique IRS-1 (récepteur de l’insuline) et plusieurs kinases, y compris la phosphoinositide-3 et l'Akt[39, 48, 49]. Les petites protéines de liaison au GTP sont également des acteurs clés[39, 50].
Comme mentionné ci-dessus, de petites protéines de liaison au GTP Rab4 et RhoA nécessitent l’isoprénylation par les produits du mévalonate pour leur association avec les membranes cellulaires (voir figure 2 p11[51, 52]). Les statines altèrent l'expression du GLUT4 dans les cellules adipeuses en inhibant la synthèse des intermédiaires d'isoprénoïde tels que le farnesyl et le géranylgeranyle pyrophosphates[46, 51, 53]. En effet, l’incubation par la lovastatine a diminué l’expression de GLUT4 et a inhibé le transport de glucose stimulé par l'insuline dans les adipocytes 3T3-L162[51, 52]. Ces effets ont été inversés par l'addition de mévalonate[51, 52]. Par conséquent, ils augmentent la résistance à l'insuline avec leur capacité inhibitrice de la synthèse de mévalonate[39].
Différentes statines lipophiles ont été associées à des réducteurs des analogues du glucose dans différents types cellulaires, y compris des adipocytes viscéraux, des myocytes squelettiques et des cellules hépatiques différenciés[54]. Cet effet a été associé à une réduction de l’effet induit par la statine du taux de cholestérol dans les membranes plasmiques. Ce dernier peut jouer un rôle clé dans la fonction de protéines transmembranaires impliquées dans l'homéostasie du glucose, y compris GLUT1[54].
De plus, plusieurs autres processus impliqués dans la voie de signalisation GLUT4 peuvent être inhibés par les statines. Ceux-ci incluent l'IRS-1, la sous-unité β du récepteur de l'insuline et la
25
phosphorisation d’Akt[50, 52]. En effet, cette réduction de cholestérol membranaire a entraîné une réduction marquée de la phosphorylation de la tyrosine du récepteur de l’insuline (IRS-1) en réponse à l'insuline[55]. Une hypothèse est que la membrane caveolae (petit radeau lipide spécialisé dans la transduction du signal et l'endocytose), où les récepteurs insuliniques sont situés, est perturbée par la chute de cholestérol membranaire[31].
Sans surprise, toutes ces actions semblent dépendre de la dose et sont réversibles lors de la présence de mévalonate ou ses produits[50, 52, 56]. Par conséquent, les statines les plus puissantes dans la réduction de la biosynthèse de cholestérol exercent ces effets dans une plus grande mesure[50, 51, 56]. En outre, il a été suggéré que ces effets sont pertinents seulement pour les statines lipophiles (par exemple l'atorvastatine et la simvastatine), mais pas pour les statines hydrophiles (par exemple, la pravastatine)[50, 52]. La capacité des statines lipophiles à pénétrer dans les adipocytes par diffusion passive peut aider à expliquer cette différence, car les composés hydrophiles ne peuvent pénétrer dans les cellules que par l'intermédiaire de transporteurs transmembranaires.
L'atorvastatine peut inhiber la différenciation et la maturation des adipocytes par une expression réduite des facteurs de transcription comme C/EPBα et PPARγ[50]. En revanche, la pitavastatine n’a aucun effet sur la différenciation et la maturation des adipocytes, mais prévient l'accumulation excessive de triglycérides, ce qui entraîne une augmentation de la résistance à l'insuline[57]. Cet effet peut au moins expliquer en partie l'absence de diabétogenèse de cette statine[55].
De la même manière que pour la fonction des cellules β, des résidus d'isoprène sont nécessaires pour la synthèse de Coenzyme Q10 (CoQ10), une molécule dans laquelle 10 unités d’isoprène sont attachées au groupe quinone. CoQ10 a un rôle central dans la phosphorylation oxydative mitochondriale et la génération de l'ATP. La co-administration de CoQ10 empêche l'expression réduite de GLUT4 par la simvastatine dans les cellules 3T3-L1[58, 59].
Les récepteurs toll-like et les récepteurs de type nucleotide-binding oligomerization domain-like sont de plus en plus reconnus pour leurs liens entre la fonction immunitaire et le métabolisme[60]. Une famille de récepteurs de type domaine d'oligomérisation de liaison de nucléotide, inflammasome NOD-like receptor family, pyrin domain containing 3 (NLRP3) peut
26
être impliquée dans le diabète de type 2. Cet inflammasome par médiation de l'inflammation a été associé à la résistance à l'insuline dans le tissu adipeux in vivo[61, 62]. Il a également été trouvé activé dans les macrophages de patients obèses, diabètiques de type 2, ou atteints de syndromes métaboliques[62-64]. L'activation de NLRP3 a été associée à une augmentation de la sécrétion d'interleukine-1β (IL-1β) par les macrophages. IL-1β provoque une résistance à l'insuline dans les adipocytes par régulation négative de l'expression de l'IRS-1[23, 65, 66]. Il a été suggéré que les statines comme la lovastatine, la simvastatine, l'atorvastatine et la fluvastatine augmentent l'expression d'interleukine-1β indépendamment de leur puissance et de leur lipophilie[67]. La fluvastatine inhibait l'élimination de glucose stimulée par l'insuline dans un modèle animal obèse. Cet effet a été associé à une activation dose-dépendante de NLRP3 et par conséquent à une augmentation de l'expression de IL-1β[62]. L’incubation avec le pyrophosphate de géranylgeranyle a bloqué l'effet des statines[23]. Ces résultats suggèrent que les statines provoquent une résistance à l'insuline en activant NLRP3. Cependant, les effets sur l’espèce humaine restent à confirmer[10]. Phosphatase and tension homolog (PTEN) est un autre régulateur négatif de la signalisation de l'insuline phosphoinositide-3 kinase[68]. Il a été montré que la rosuvastatine augmentait la résistance à l'insuline en régulant à la hausse PTEN
in vivo[69].
Il est établi que plusieurs adipokines affectent la sensibilité de l'insuline dans plusieurs tissus. Parmi ceux-ci, l'adiponectine semble exercer des effets bénéfiques clés sur le métabolisme des glucides. En résumé, elle réduit la glycémie surtout en améliorant la sensibilité à l'insuline (en particulier le foie et les muscles), en réduisant l'inflammation des tissus adipeux, et en améliorant la fonction cellulaire et la viabilité[70]. Son lien avec le risque de diabète a été mis en évidence par une méta-analyse comprenant 13 études prospectives avec un total de 14 598 participants et 2 623 cas incidents de diabète de type 2[71]. Dans cette analyse, le risque relatif de diabète de type 2 a été réduit de 28% par log-1 μg/mL d'augmentation des taux d'adiponectine. Cette association était pertinente pour tous les groupes ethniques[71]. À ce jour, les données cliniques sur l'effet de la plupart des statines (simvastatine, la pravastatine, l'atorvastatine, la rosuvastatine, la fluvastatine) sur les taux d'adiponectine sont controversées[53, 70]. Par exemple, 10 des 23 études de simvastatine ont montré une diminution des taux d'adiponectine, 11 n'ont trouvé aucun changement et deux ont déclaré une augmentation[23]. En revanche, dans




![Diagramme reproduit à partir de la publication LaRosa et al. [144]](https://thumb-eu.123doks.com/thumbv2/123doknet/2043305.4888/51.918.64.856.77.883/diagramme-reproduit-partir-publication-larosa-al.webp)
![Diagramme reproduit à partir de la publication de Peterson et al. Référence [141]](https://thumb-eu.123doks.com/thumbv2/123doknet/2043305.4888/53.918.152.766.113.601/diagramme-reproduit-partir-publication-peterson-al-reference.webp)