T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par : l’Université : Toulouse III –Paul Sabatier Discipline ou spécialité : Ecologie, biodiversité et évolution
JURY
Ecole doctorale : SEVAB
Unité de recherche : LABORATOIRE D’EVOLUTION ET DIVERSITE BIOLOGIQUE Présentée et soutenue par : Mailyn Adriana Gonzalez Herrera
Le: 28 septembre 2009
Etude de la diversité spécifique et phylogénétique
de communautés de plantes ligneuses en forêt tropicale :
Apport des séquences ADN dans l’identification des espèces et l’étude des communautésAlain Franc Finn Kjellberg Daniel Sabatier Guillaume Besnard Jérôme Chave Directeur de recherche, CNRS Directeur de recherche, INRA
Directeur de recherche, CNRS Christophe Thébaud
Chargé de recherche, IRD
Chercheur, Imperial College, UK
Professeur, Université Toulouse III
Rapporteur Rapporteur Examinateur Examinateur Directeur de thèse Président
Caminante, son tus huellas el camino, y nada más ; caminante, no hay camino, se hace camino al andar. Al andar se hace camino, y al volver la vista atrás se ve la senda que nunca se ha de volver a pisar. Caminante, no hay camino, sino estelas en la mar.
réalité !
Cette thèse est la preuve que l’union fait la force. C’est le résultat d’un travail en équipe, enrichi des apports des nombreuses personnes dans l’obtention et le traitement des données, mais surtout dans le soutien moral nécessaire pour garder les pieds sur terre et pour ne pas oublier que Oui c’est possible…
Jérôme, Merci ! Avec toi j’ai découvert la forêt tropicale Guyanaise, un milieu qui m’émerveille. Tu m’as introduit au monde de l’écologie des communautés, une discipline fascinante où comprendre les mécanismes de coexistence des espèces est devenue pour moi un défi passionnant. Merci de m’avoir donné les outils pour aller loin dans ma recherche. Je retiendrais qu’il faut toujours garder la perspective, optimiser, ne pas perdre de vu les questions, l’importance des méthodes, aller au-delà de la forme pour ne retenir que le fond…entre autres. Ce travail aura privilégié d’un grand investissement de ta part, notamment dans l’accomplissement de ce premier article qui a été à la base de jours très difficiles, mais qui aura généré de moments de grand enthousiasme. Nouragues, Paracou, le Mexique, le Suriname, que des bons souvenirs. Nous avons réussi à avancer dans une collaboration étroite qui porte ses fruits et dont je m’en réjouis.
Christophe, ta participation au développement des questions et à l’interprétation des résultas aura toujours été encourageante, pleine de perspective et pertinence. J’admire ta patience, et ta vision de la nature. Merci, parce que chaque un des nos échanges et discussions m’auront rempli d’enthousiasme.
Un grand merci aux membres de mon équipe, Natalia, Franck, Elodie, Claire, Kyle, avec qui les échanges auront été riches et les collaborations fructueuses. En me réjouissant de collaborations futures avec vous : Natalia, tu m’auras beaucoup appris dans la rédaction des papiers, patiemment corrigeant mes versions, l’une après l’autre. Franck, tu m’a écouté avec patience et attention, et auras répondu à toutes mes questions. Nos discussions m’ont éclairé et motivé. Elo, les discussions avec toi ont été riches en idées, le projet plantules a grandement bénéficié de ta participation, merci pour ton investissement. Claire toujours souriante et pleine d’énergie tu m’as ‘boosté’ à chaque échange. Kyle, depuis les quelques mois que tu es parmi nous, on aura collaboré d’une façon étroite, encourageante et positive… thanks.
Un chaleureux et profond merci aux étudiants de master que j’ai eu l’opportunité de co-encadrer : Aurélien, Julien, Marie. Travailler avec vous a été un réel plaisir. Votre travail, d’excellente qualité, toujours dans la bonne humeur, a largement enrichi cette thèse. Je vous témoigne toute mon amitié.
Egalement un sincère merci à Céline qui avec professionnalisme et patience m’a permis de mettre en place l’énorme travail de laboratoire. Ton expertise a été cruciale à la vite réussite de l’aspect moléculaire dans ma thèse.
Aux membres « outgroup » qui tout au long de ma thèse m’ont permis de retrouver la direction des mes réflexions. PA, ta vision critique, toujours pertinente et enrobé
avec R. Erwan tu m’as fourni ton expertise particulièrement dans l’article de variation géographique, je suis très contente de ces échanges.
En amont des discussions sur les résultats il y a eu bien sur la découverte de la forêt tropicale et les séjours en Guyane, dont je tiens à remercier : Bernad Riéra, avec qui j’aurais fais mes premiers pas dans la botanique tropicale, des moments qui ont été riches en émotions. C’est avec toi que j’aurais reniflé les troncs des arbres pour la première fois et que j’aurais découvert les fleures de Duguetia cadaverica, une petite merveille. Phillipe Gaucher, toujours à la recherche d’une grenouille dans les endroits les plus insolites. Ton énergie, et ta bonne humeur m’ont fait passer des moments de grande joie. Pierre Charles-Dominique qui avec ces histoires d’aventure en forêt m’a fait rêver et dont la connaissance de la nature m’inspire un profond respect. Mireille Charles-Dominique qui m’a accueilli avec tant d’affection, tu m’as fait découvrir Joe le glacier, le marché,…les moments à Cayenne en ta compagnie ont été un grand plaisir.
Pour la collecte des échantillons la liste est longue. Merci à tous les participants du projet BRIDGE qui ont rendu disponibles un jeu de données sans précédant. C’est lors des missions du projet BRIDGE que j’aurais le plus appris en botanique grâce à l’expertise de Pascal Pétronnelli, Bernard Riéra, Julien Engel, Christopher Baraloto, Tim Paine, Eric Nicolini…Un grand merci aux grimpeurs qui ont bravé les fourmis, les guêpes, la hauteur, la fatigue. Grâce à vous nous avons des échantillons uniques, et personnellement grâce à vous j’ai pu enfin associer une forme à ma longue liste des noms d’espèces: Nathy, Salim, Jean Yves, Damien travailler avec vous a été souuperrr !!. Mes missions de terrain avec BRIDGE resteront un super souvenir grâce aussi au travail en équipe avec Lilian Blanc et Jean-Yves Goret.
Merci à Patricio, aux Nouragues, qui m’a aidé à mettre en place les parcelles de plantules et grâce à qui mes missions aux Nouragues ont été une pure partie de plaisir. Gracias papacito ! Pour le travail moléculaire, un grand merci à Caroline Scotti-Saintagne qui m’aura formé au traitement des échantillons de cambium, dès la collecte à la séquence. A Ivan Scotti qui m’a accueilli au sein de son équipe lors de cette expérience et avec qui j’ai eu des discussions très intéressantes sur la génétique des plantes.
Mais au cours de ces années ce qui m’a permis de tenir bon, de croire, de continuer, de ne pas lâcher (bref vous avez compris…) c’est l’Amitié, les encouragements, de tant d’entre vous que je garde auprès de moi. Merci de m’avoir fait confiance : Borja, Cat, Ema, Elo, Erwan, Franck, Lucie bb, Jean, Joelito, Juliancito ( ;)), Marie, Natalia, PA, Pascal, Sarah, Susanita………Vous savoir auprès de moi est ma plus grande réussite.
Enfin merci à tout les membres du laboratoire EDB qui on rendu mon quotidien plus agréable. En particulier merci à Marie-Martine et Dominique Galy qui avec beaucoup de compétence est toujours un sourire, m’ont aidé dans tous les aspects administratifs. Merci à Sophie qui aura rendu mes journées au labo très agréables et à Monique Burrus pour les conseils de manip. Philippe Heeb qui m’a mis en contacte avec Jérôme et qui m’auras toujours apporté ce petit souffle de la Colombie.
Pipe y Françoise, merci de m’avoir accueilli dans mes premiers jours à Toulouse. Merci pour votre générosité.
Paco, gracias, el tigre pintado ya no me da miedo !
Myriam Chave qui m’a manifesté son amitié et m’a encouragé à chaque rencontre.
Finalmente el agradecimiento mas profundo va a mi familia: A mi papá, mi mamá, y mis hermanos Camilo, Daniel y Javier. Gracias a ustedes por el apoyo moral (y financiero) que me ha permitido llegar tan lejos. Gracias por todo el amor, la amistad, las risas, las peleas. Cada dia los recuerdo, cada dia me acompañan. El apoyo constante y la confianza que me otorgan me hacen cada dia mas fuerte. En todos los momentos dificiles lo mas reconfortante es saber y sentir que cuento con ustedes. Gracias por creer en mi y demostrarmelo. Bueno antes de que se burlen...paro aqui.
Gracias a toda la familia Gonzalez y Herrera, mis tios, tias, primos, primas, por tantos momentos de felicidad. Porque fue en compañia de ustedes que aprendi a trabajar y vivir en equipo!. Ademas ustedes me enseñaron que hay que ser coriaz, tenaz, perseverar, este trabajo reune esos valores. Un especial saludo a Silvia siempre atenta y pendiente que mi moral estuviera en lo mas alto. Gracias Melvin por tus palabras que me llenaron de confianza!. A mis amigos de siempre, que me acompañan cada dia, cuyo recuerdo me llena de fuerza y alegria: pollo, motas, santa, lucho, diana maria, diana marcela, droopy, margarita, lucha, huevo. Gracias amigos, su amistad me hace fuerte.
Les derniers moments de la rédaction ont été très encourageants grâce à toutes les démonstrations d’amitié, de solidarité, d’affection ! Malgré des km qui sépare une partie d’entre vous de la ville rose, vous avez réussi à être présents, à parcourir cette piste comme si on était côte à côte. A tous mes collègues qui ont consacré une partie précieuse de leur temps, pour corriger la grammaire, voir la cohérence de frases, la biblio, etc..Ainsi qu’à tous ceux qui ont été en veille jusqu’à la dernière minute pour vous assurer que tout allait bien. Je vous suis profondément reconnaissante : Aurélie, Chloé, Elo, Ema, Joelito, Juliancito, Julieta, Julien, Kyle, Marie, Manu, PA, Susanita… (ah bien sur, vu qu’aucun d’entre vous n’aura lu mes remerciements avant la publication, ils ont probablement remplis d’erreurs grammaticaux, mais peu importe, tout ce qui compte
c’est que c’est FINI ! )
A tous ceux que j’aurais oublié, je me rattraperai pour la vraie version finale….
Je finis ce manuscrit avec le sentiment d’être énormément chanceuse d’avoir rencontré de gens aussi incroyables qui ont fait de ma thèse une merveilleuse aventure.
A vous tous, Merci ! A todos ustedes, Gracias !
knowledge about species distributions and ecological mechanisms governing species coexistence in this system remains scarce. This is partly due to the difficulty of accurately identifying species. This dissertation is anchored in the global need for understanding mechanisms underlying diversity, as well as the need to develop technical tools that allow one to study diversity. The studies included in this dissertation were conducted at two sites in Neotropical rainforest in French Guiana (Nouragues & Paracou).
One of the goals was to test the reliability of DNA barcoding as a tool in tropical plant species identification. DNA barcoding performance was tested for seven plastid markers and one nuclear marker over more than 250 angiosperm species. DNA markers correctly delimit species in about 70% of cases. Despite this imperfect success, DNA barcoding was useful to identify juveniles stages, provided an aid to identification at the herbarium, and reveal potential cryptic species. However, success of the DNA barcoding approach in tropical rainforest may be hampered by geographic genetic structure. Indeed, I found that 50% of species (out of 38 analyzed) showed a pattern of isolation by distance in their plastid genome. This result highlights the need to include samples covering the entire geographic range of a species distribution in DNA reference databases. In the near future, DNA barcoding will be able to facilitate large-scale inventories in the tropics and will offer new possibilities for ecological studies by helping to free them of the difficulty of identifying species.
This dissertation also confirms the usefulness of recently developed molecular tools (DNA barcoding, phylodiversity indices) into community ecological studies. One major goal of this dissertation was to examine ecological mechanisms that drive species assembly beyond the regeneration phase, integrating for this purpose molecular information. This was done by comparing phylogenetic and species diversity patterns of saplings and trees. I found no changes in species or phylogenetic richness across sapling and tree assemblages. However, rare species were favored across these size classes, increasing species evenness at the tree layer. These results, indicates that negative density-dependence is driving species sorting from sapling to tree assemblages. Elucidation of this mechanism highlights the importance of ecological processes beyond the regeneration phase in the maintenance of biodiversity in tropical tree communities.
We assist a revolution time where DNA sequencing technologies offer amazing possibilities for ecological research. Species identification and integration of evolutionary history in community ecology studies refines our knowledge of processes that facilitate species coexistence and maintain biodiversity.
Key-words : Species coexistence, biodiversity, community ecology, DNA barcoding, phylogenetic diversity, species diversity, density-dependence, French Guiana
Bien que la forêt tropicale humide représente le plus grand réservoir mondial de biodiversité végétale, notre connaissance de la distribution des espèces ainsi que des mécanismes qui permettent leur coexistence est limitée par la difficulté que constitue l’identification taxinomique des espèces. Ma thèse s’inscrit dans ce besoin global de comprendre l’organisation de la diversité et d’apporter des outils pratiques à son étude. Les travaux présentés dans cette thèse ont été réalisés sur deux sites de la forêt Néotropicale de Guyane Française (Nouragues & Paracou).
Un des objectifs de cette thèse a été de tester la fiabilité des séquences de code-barres ADN pour l’identification des espèces en milieu tropical. Cette étape a nécessité l’utilisation de sept marqueurs chloroplastiques et un nucléaire sur plus de 250 espèces d’angiospermes. Dans près de 70% des cas, cet outil moléculaire permet d’assigner correctement une séquence ADN à une espèce décrite. Malgré ce succès imparfait, le code-barres ADN a facilité l’identification d’individus juvéniles, l’identification en herbier et a également permis de révéler l’existence d’espèces cryptiques potentielles. Le succès de code-barres ADN peut être nuancé par l’existence d’une structuration géographique du génome chloroplastique, un phénomène qui semble fréquent dans les forêts tropicales. On a trouvé que près de 50% d’espèces d’arbres (sur 38 analysés) présentent un patron d’isolement par la distance dans leur génome plastidial. Il apparaît donc crucial d'inclure dans les banques de données de référence des échantillons couvrant l’aire de répartition de chaque espèce.
Dans un avenir proche, la méthode code-barres ADN facilitera les inventaires à large échelle dans les tropiques et offrira de nouvelles possibilités pour les études écologiques en les affranchissant de certaines difficultés liées à l'identification spécifique.
Les outils moléculaires développés récemment (code-barres ADN, indice de diversité phylogénétique,etc…) permettent une avancée considérable dans les études d’écologie des communautés. Un objectif majeur de cette thèse a été d’étudier les mécanismes écologiques qui régissent l’assemblage des communautés d’arbres tropicaux au-delà de l’étape de régénération, en se servant de l’information moléculaire. Ceci a été fait en comparant les patrons de diversité phylogénétique et spécifique des communautés de plantules établies à ceux des arbres de canopée. Dans les communautés étudiées, les richesses spécifique et phylogénétique ne présentent pas de variation au cours de l’ontogénie. Par contre, les espèces rares sont favorisées lors du passage de l’état plantule à l’état arbre et les abondances spécifiques ont tendance à s’équilibrer chez les adultes. Ceci indique que la densité-dépendance négative est un des processus écologiques majeurs régissant l’assemblage des communautés d’arbres de Guyane Française. La mise en lumière de ce mécanisme souligne l’importance des processus écologiques au-delà de la phase de régénération, dans le maintien de la biodiversité dans les communautés de forêts tropicales humides
Nous assistons à une révolution technique des outils de séquençage qui offrent des possibilités considérables pour les recherches en écologie tropicale. L’identification des espèces ainsi que l’intégration de l’histoire évolutive dans l’étude de l’écologie de communautés sont un premier pas pour affiner notre connaissance des facteurs qui facilitent la coexistence des espèces et permettent le maintien de la biodiversité.
dans le contexte scientifique et sociologique actuel. Ensuite je présente
l’ensemble des méthodes d’obtention des données (sites d’étude, techniques
d’échantillonnage et techniques de laboratoire).
Le corps de mon travail est compilé dans 3 articles rédigés en anglais. L’article
1 va être soumis prochainement à Plos One. L’article 2 est en finalisation de
rédaction. L’article 3 a été accepté avec corrections à Journal of Ecology.
INTRODUCTION GENERALE :
Biodiversité, écologie des communautés et outils génétiques . . . 1
I. Biodiversité : enjeux, problèmes globaux et tropicaux . . . 2
I.1. Pourquoi s’intéresser à la biodiversité ? . . . 2
I.2. Changements globaux : constats, prévisions et directives internationales . . . 4
I.3. Défis actuels dans l’inventaire de la biodiversité . . . 8
Encadré 1 : Les indices de biodiversité . . . 9
I.4. Les défis dans la mesure de la diversité floristique dans les forêts tropicales humides . . . 13
I.5. Problématique abordée dans la thèse . . . 21
II. Assemblage des communautés et processus de coexistence . . . 24
II.1. Concepts théoriques de niche et neutralité : évidence à partir des patrons d’abondance . . . 25
Filtrage environnemental . . . 25
Interactions biotiques . . . 27
Le mécanisme de densité dépendance . . . 28
La difficulté de mesurer la niche des espèces et le rôle des mécanismes stochastiques . . . 30
Complémentarité des processus neutres et déterministes . . . 32
II. 2. Intégration de traits fonctionnels dans l’étude de l’assemblage des communautés . . . 35
Prédictions des mécanismes d’assemblage à partir des traits . . . 36
Avantages de l’approche . . . 38
II. 3. Intégration de l’information phylogénétique dans l’étude de l’assemblage des communautés . . . 39
Prédictions des mécanismes d’assemblage à partir de l’histoire évolutive au sein des communautés . . . 40
Cas d’étude . . . 41
Densité dépendance phylogénétique . . . 45
Progrès attendus dans l’approche intégrant l’histoire évolutive dans l’étude d’assemblages de communautés locales . . . 46
II.4. Structuration des communautés végétales au cours du développement ontogénétique . . . 47
III. Evaluation de la biodiversité avec les codes barre ADN . . . 53
Encadré 2. Démarche théorique dans l’application des codes barres ADN . . . 57
III. 1. Le choix du marqueur . . . 58
III.1.1. Choix du marqueur chez les animaux . . . 58
III.1.2. Prospection d’un marqueur chez les végétaux . . . 59
III.1.3. Performance de marqueurs testés comme code-barres ADN chez les végétaux . . . 64
Tests encore nécessaires pour la validation de la méthode code-barres ADN . . . 69
III. 2. Assignation d’une séquence code-barres à une espèce . . . 69
III. 3. Manque de congruence entre les informations génétiques et morphologiques . . 73
III. 4. Applications des code-barres ADN dans l’étude de la biodiversité . . . 76
METHODES : Sites d’étude, technique d’échantillonnage et techniques de laboratoire . . . 79
I. Le site d’étude . . . 80
II. Parcelles échantillonnées . . . 82
II.1. La station scientifique des Nouragues . . . 82
III. Protocole d’échantillonnage . . . 86
III.1. Arbres : collecte de tissus pour les extractions ADN et mesure de trais fonctionnels . . . 86
Procédure suite à la collecte de l’échantillon de feuilles : . . . 87
III.2. Etats juvéniles : Marquage, cartographie et collecte de tissu de plantules . . . . 88
IV. Obtention des séquences ADN . . . 90
Broyage des échantillons . . . 91
Extraction d’ADN . . . 91
Choix de marqueurs ADN . . . 92
Amplification de séquences . . . 92
Purification . . . 93
Réaction de séquence . . . 95
Lecture des séquences . . . 95
RESULTATS . . . 96
Article 1 : Identification of Amazonian trees with DNA barcodes . . . 97
Article 2 : Geographical structure of plant DNA barcodes in tropical trees . . . 127
Article 3: Shifts in species and phylogenetic diversity between sapling and tree communities indicates negative density-dependence in a Neotropical forest . . . 155
DISCUSSION GENERALE, PERSPECTIVES & CONCLUSION . . . 195
I. Organisation de la diversité spécifique et phylogénétique au sein de communautés végétales . . . 196
I.1 Processus écologiques sous-jacents à l’assemblage des communautés . . . 196
I.2 Avantages et inconvénients de l’approche choisie pour l’étude de l’assemblage de communautés végétales . . . 199
I.3 Futurs tests pour affiner la connaissance de la structure des communautés étudiées . 200 II. Utilisation des code-barres ADN dans l’étude de la biodiversité végétale tropicale . . . 203
II.1. Performances et avantages de l’approche code barre ADN . . . 203
II.2 Mises en garde dans l’application de l’approche code-barres ADN dans l’étude de la biodiversité tropicale . . . 208
II.3. Applications futures de l’approche code-barres ADN dans les forêts tropicales . . 211
II.4. Choix de marqueurs pour un code-barres ADN chez les végétaux . . . 212
III. Conclusion . . . 214
REFERENCES BIBLIOGRAPHIQUES . . . 215
ANNEXES . . . . . . 231
I. Caractéristiques floristiques de huit familles d’Angiospermes très abondantes dans la forêt Néotropicale étudiée . . . 232
INTRODUCTION GENERALE
Biodiversité, écologie des communautés et outils
génétiques
I. Biodiversité : enjeux, problèmes globaux et tropicaux
I.1. Pourquoi s’intéresser à la biodiversité ?
La biodiversité, terme avancé dans la communauté scientifique lors du premier Forum National sur la Diversité Biologique (Washington, 1986), fait référence au nombre et à la variété de formes des organismes vivants, ainsi qu’à leurs attributs écologiques et leur contenu génétique. Elle constitue un enjeu social, politique, économique, scientifique et éthique.
Dans la conjoncture actuelle d’une société humaine qui se développe au détriment de l’environnement, l’un des défis majeurs est de parvenir à déterminer la place et l’importance de la biodiversité afin qu’elle devienne un critère de décision dans l’organisation des sociétés humaines. Une des façons d’estimer la valeur de la biodiversité est de quantifier son apport à la nutrition, à la médecine et au développement économique de sociétés. Pas moins de 7000 espèces de plantes entrent dans notre régime alimentaire direct (GPPC 2009). Par ailleurs, autour de 25000 espèces de plantes seraient utilisées comme source médicinale (Dirzo & Raven 2003) et il est estimé que 25% des composants de médicaments proviennent de végétaux (Frankham et al. 2002). Mis à part ces bénéfices tangibles, la biodiversité est partie intégrante du maintien, du fonctionnement et de la stabilité des écosystèmes. Ces derniers fournissent des« services » qui possèdent une valeur écologique et économique globale (Myers 1995, Loreau et al. 2001). Dans un effort pour estimer la valeur économique de 16 services fournis par les écosystèmes, parmi lesquels le contrôle de l’eau, des sols et la production de nourriture, Constanza et al. (1997) sont arrivés à une estimation moyenne annuelle de 33000 milliards de US$. Plus particulièrement, des services tels que la pollinisation naturelle de céréales permettrait un gain annuel de 30 milliards de US$ aux seuls Etats-Unis (Myers 1995). La nature revêt également une valeur touristique et peut donc
l’écotourisme. A titre d’exemple, cette activité représente un gain annuel de 100 millions de US$ dans les îles Galapagos (FAO, 2009). Enfin, la biodiversité constitue un réservoir de ressources qui renferme un potentiel d’amélioration de la productivité et la qualité de vie. La plante Euchalaena mexicana (Poaceae) constitue un bon exemple. Cette herbe que l’on trouve exclusivement dans les prairies de l’état de Jalisco au Mexique, est utilisée pour produire un antiviral chez le maïs, et la conservation de la zone où elle se trouve a fourni un gain estimé entre 230 et 330 millions de US$ (Chapin et al. 2000). Balmford et al. (2002) ont fait une révision des coûts et des bénéfices dérivés de la conversion de zones sauvages en terres agricoles. Ils ont montré que le bénéfice produit par la protection de ces zones était 100 fois plus important que le bénéfice de leur conversion pour l’exploitation.
Nous assistons actuellement à une perte de biodiversité, liée aux activités humaines et comparable à celles que la Terre a connues au cours des cinq extinctions majeures du Phanérozoïque (Leakey & Levin 1995). Pimm et al. (1995) ont estimé que le taux actuel d’extinction des espèces était 100 à 1000 fois plus important que par le passé ; un rythme tel que deux tiers des espèces de plantes et d’animaux pourraient disparaître en l’espace de 50 ans. De fait, Pitman & Jorgensen (2002) ont estimé qu’entre 22 et 47% des Angiospermes pouvaient être considérées en risque d’extinction selon les critères de l’UICN (Union Internationale pour la Conservation de la Nature) qui prennent en compte l’aire de répartition et le nombre d’individus. De même, environ 10% des espèces de mammifères et d’oiseaux sont actuellement exposés à un risque critique d’extinction (probabilité d’extinction de 50% dans un intervalle de 10 ans ; Frankham et al. 2002).
En se fondant sur le taux de richesse spécifique, le taux d’endémisme (espèces avec une répartition restreinte) et le danger de disparition, Myers et al. (2000) ont mis en évidence 25 zones qu’ils considèrent comme des zones prioritaires pour la conservation, connues comme les « points chauds de la diversité ». Ces dernières correspondent à seulement 1,4%
de la surface émergée, principalement dans les zones tropicales, mais ils regroupent environ 35% des espèces de vertébrées et 44% des plantes vasculaires (Myers et al. 2000, Brooks et
al. 2006). Ces régions sont non seulement les plus riches en espèces mais aussi celles qui
subissent une surexploitation accrue par la croissance rapide de la population humaine et qui disposent de moins de ressources économiques pour les programmes de conservation (Brooks
et al. 2006). Il est ainsi estimé que sur les 6 milliards de US$ accordés annuellement à des fins
de conservation de la biodiversité, plus de 90% proviennent et sont dépensés dans les pays développés (James et al. 1999).
I.2. Changements globaux : constats, prévisions et directives internationales
Les facteurs les plus importants impliqués dans la perte actuelle de la biodiversité sont principalement les transformations des habitats, suivi par les changements climatiques, la pollution atmosphérique (dépôt d’azote et de carbone) et les espèces envahissantes (Sala et al. 2000). L’impact relatif de ces facteurs varie selon les régions. Ainsi, les tropiques semblent être plus affectées par la transformation de l’habitat alors que les changements climatiques ont le plus d’impact dans les zones tempérées (Sala et al. 2000).
La déforestation, provoquée par l’urbanisation, l’industrie du bois et la conversion de forêts en terrains agricoles et de pâturage, constitue l’agent le plus important de la
transformation de l’habitat. Il est estimé que 45% du couvert forestier a disparu au cours
des 8000 dernières années (CDB : www.cbd.int/forest/problem). Alors que six millions d’hectares de forêt tropicale ont disparu chaque année entre 1990 et 1997 (Achard et al. 2002), la perte nette du couvert forestier global entre 2000 et 2005 a été estimée à 7,3 millions d’hectares par an selon la FAO (Food and Agriculture Organization of the United Nations, 2005). Si le taux de déforestation actuel se maintient, 55% de la forêt Amazonienne disparaîtrait d’ici à 2030 (Soares-Filho et al. 2006, Malhi et al. 2008). La perte du couvert
forestier et sa fragmentation s’accompagnent de la disparition des organismes qu’il abrite. Ainsi, lors d’une étude sur le déclin des espèces d’oiseaux à l’échelle mondiale, Butchart et
al. (2004) ont montré que ce déclin était particulièrement important dans la région
Indo-Malaysienne, à cause de l’intense déforestation qui touche cette région.
La déforestation a également un impact sur les changements climatiques. En effet les forêts tropicales contiennent près de 40% du carbone global (Phillips et al. 1998) et la déforestation est responsable de 20% des rejets de gaz à effet de serre dans l’atmosphère (Tollefson 2008). Par ailleurs, la déforestation conduirait à une diminution du régime des pluies en diminuant le taux d’évapotranspiration (GIEC 2007). Pour l’Amazonie, il est prédit que la perte du couvert forestier engendrera une diminution des précipitations lors de la saison sèche, surtout dans les régions de l’Est et du Sud-est (Oyama & Nobre 2003, Malhi et al. 2008). Cette diminution du régime de pluies pourrait aboutir à la conversion de la forêt Amazonienne en de grandes étendues de savanes (Malhi et al. 2008). Enfin, une augmentation de la sécheresse dans les régions tropicales conduirait à une augmentation du rejet de CO2 dans l’atmosphère, résultant d’une mortalité accrue des arbres. Ces prévisions sont fondées sur des études expérimentales et des suivis temporels de biomasse (Nepstad et al. 2007, Phillips et al. 2009).
L’augmentation des températures s’accompagne de façon globale d’un accroissement de l’intensité des perturbations climatiques telles que les cyclones, les inondations et les feux (GIEC 2007). Ces changements climatiques vont de pair avec une redistribution géographique des espèces dont les conséquences sont incertaines. On estime que ces modifications des régimes climatiques pourraient conduire à la disparition de 60% des espèces de montagne européenne d’ici 2080 (GIEC 2007). Les changements climatiques peuvent également entraîner la perte de diversité en altérant les interactions entre espèces; par exemple en
découplant les périodes de floraison et la disponibilité des pollinisateurs (Harrington et al. 1999).
Une source importante de la perte de la biodiversité résulte de l’impact des espèces
envahissantessur les espèces natives. Cette perturbation serait responsable de 40% du déclin
actuel de la biodiversité selon le CDB (Convention pour la Diversité Biologique). Les espèces envahissantes ont conduit à l’extinction locale des espèces natives, comme dans le cas de la perche du Nil (Lates niloticus) introduite dans le lac Victoria en 1954 et qui a conduit à la perte de plus de 200 espèces piscicoles endémiques (Meyer 1993). De même, Miconia
calvescens (Melastomataceae) introduite à Tahiti dans les années 1930 recouvre actuellement
plus de la moitié du territoire de l’île (Lowe et al. 2000). Par ailleurs, les espèces envahissantes peuvent conduire à une altération du fonctionnement de l’écosystème en modifiant par exemple le régime des feux (D'Antonio & Vitousek 1992, Levine et al. 2003). C’est le cas de l’herbe Bromus tectorum (Poaceae) qui a envahit l’ouest de l’Amérique du Nord et a augmenté la fréquence des feux de telle façon que les plantes natives ne peuvent plus se réinstaller (Brooks et al. 2004). Dans cette même étude, les auteurs montrent que ces changements de structure des communautés végétales ont des répercussions sur la faune : L’écureuil (Spermophilus mollis) devenant plus vulnérable à la prédation par le faucon (Falco
mexicanus) et l’aigle (Aquila chrysaetos). Parmi les changements importants des
écosystèmes, la jacinthe d’eau (Eichhornia crassipes, Pontederiaceae), native du Bassin Amazonien et présente aujourd’hui dans plus de 50 pays, conduit à l’eutrophisation des eaux de surface (Lowe et al. 2000). De même, deux espèces de Mimosa (Fabaceae), M. fubicaulis et M. diplotricha, posent un problème majeur dans le Parc National Kaziranga (Inde) où elles éliminent les herbes couramment consommées par la plus grande population de rhinocéros unicornes (Rhinoceros unicornis) (GISP, 2007). Il est donc prioritaire de comprendre quelles
forces structurent les communautés pour prévoir et atténuer l’impact des espèces introduites dans les écosystèmes.
Face à ces problèmes d’ordre global, des directives internationales ont été mises en place pour faire face à la crise de la diversité. La Conférence des Nations Unies sur l’Environnement et le Développement à Rio de Janeiro (1992) est l’une des premières manifestations de l’intérêt général porté à la gestion de la biodiversité. Dès lors, l’impact des activités anthropiques dépasse le seul domaine scientifique et devient un axe de politique gouvernementale. Cette volonté d’agir pour endiguer la perte de diversité a été ratifiée en 2002 lors du Sommet du Développement Durable à Johannesburg. A cette occasion, 190 pays ont affiché comme objectif général d’aboutir à une réduction de la perte de la diversité pour 2010 (Balmford et al. 2005).
La CDB a adopté en 2002 une stratégie qui concerne particulièrement la conservation des plantes. Il s’agit de la GSPC (Global Strategy for Plant Conservation) qui fixe 16 objectifs pour aboutir en 2010 à une meilleure connaissance des espèces et des dangers qu’elles encourent afin de proposer des solutions de conservation. Parmi ces objectifs figure la création d’une liste des espèces connues, une estimation de leur état de menace et une élimination du commerce illégal de la flore sauvage vulnérable (CDB, 2009). Par ailleurs, un des programmes proposés lors du sommet de Johannesburg (2002) touche particulièrement la compréhension et le maintien de la diversité forestière (www.cbd.int/forest/problem). Ce programme comporte trois volets : (1) Conservation, utilisation durable, partage des bénéfices, (2) Habilitation des institutions, étude socio-économique, (3) Connaissance, estimation et suivi.
Atteindre les objectifs fixés par ce type de programmes implique pour les scientifiques de faire l’état des connaissances quant aux composantes de la diversité, à sa distribution, à son maintien et à son fonctionnement. De même, à la lumière des informations disponibles, le
développement d’outils et l’amélioration des connaissances apparaissent aujourd’hui indispensables à la gestion de cette crise de la biodiversité. Ceci semble d’autant plus urgent dans les régions tropicales, où la distribution même de la diversité est encore mal connue.
I.3. Défis actuels dans l’inventaire de la biodiversité
La biodiversité peut être mesurée à différents niveaux d’organisation biologique (génome, population, communauté, paysage). Elle est souvent quantifiée à partir de trois critères complémentaires : le nombre d’entités distinctes, leur fréquence relative et la différence entre les entités. Au niveau de la communauté, mesurer la diversité revient à quantifier la richesse spécifique, la fréquence relative des espèces, et la richesse de l'histoire évolutive ou fonctionnelle représentée par les lignées présentes (voir Encadré 1 pour quelques-uns des indices employés). La quantification de la diversité est souvent partitionnée en trois échelles spatiales: l’échelle locale (Į), l’échelle régionale (Ȗ), et une échelle intermédiaire (ȕ) qui représente la comparaison entre diversité régionale et diversité locale (Whittaker 1975, Blondel 1995).
Encadré 1 : Les indices de biodiversité.
Les indices de diversité servent à quantifier les entités distinctes telles que les espèces, les lignées évolutives ou les groupes fonctionnels. Les mesures de diversité peuvent tenir compte ou non de l’abondance de ces entités. Ici ne sont présentés que quelques-uns des indices parmi les nombreux disponibles (Magurran 2004, Jost 2006). Diversité spécifique :
A l’échelle locale (Į) la diversité peut être mesurée en tant que richesse spécifique, soit le nombre d’espèces présentes dans un endroit, généralement corrigé par le nombre d’individus échantillonnés. Parmi les indices couramment utilisés, l’indice alpha de Fisher calcule la richesse en estimant le paramètre D d’une distribution logarithmique des abondances (la plupart des espèces sont représentées par de faibles effectifs). Cet indice semble être indépendant de la taille de l’échantillon au-delà de 1000 individus (Magurran 2004). Lorsque l’abondance est incluse dans le calcul de diversité, l’indice de Simpson est souvent employé. Il calcule la probabilité que deux individus pris au hasard dans une communauté appartiennent à des espèces différentes et est
défini comme H=1-pi2 où pi représente la fréquence de l’espèce i (Magurran 2004). Cette mesure peut être
convertie en un nombre d’espèces « efficaces », soit le nombre d’espèces à fréquence égale dans l’échantillon, en calculant 1/H (Jost 2006).
La diversité entre localités (ȕ) peut être mesurée en termes de complémentarité et de similarité, soit des mesures qui prennent en compte les changements de composition. Si l’on mesure la similarité entre deux sites et que l’on considère a comme le nombre total d’espèces partagées par les deux sites et b et c comme le nombre d’espèces uniques à chaque site, on peut utiliser l’indice de Jaccard – Cj= a/( a+b +c) – ou l’ indice de Chao (2005) qui représente une mesure de similarité tenant compte des abondances relatives et corrigeant les différences observées dans le changement de composition par les espèces rares non rencontrées lors de l’échantillonnage. Diversité Phylogénétique :
Elle est souvent mesurée avec l’indice « PD » de Faith (1992) qui correspond à la somme des longueurs de branches qui relient les espèces présentes dans une communauté à partir d’une hypothèse phylogénétique qui sous-tend ces espèces. Pour le même nombre d’espèces présentes dans deux communautés celle dont les membres sont les plus éloignés dans la phylogénie correspond à une histoire évolutive plus grande. Cette approche ne tient pas compte de l’abondance des espèces. Pour inclure l’abondance, l’entropie quadratique de
Rao peut être utilisée. Ceci représente une extension de la formulation de la diversité spécifique mesurée par
l’indice de Simpson (DI) en incluant la distance phylogénétique de chaque paire d’espèces. Ceci se traduit par la
formule suivante : Dp=
ijį ij fi fj où fi et fj représentent les fréquences des espèces i et j et į ij est la longueur de
branches qui sépare ces deux espèces (distance à l’ancêtre commun le plus récent). Hardy & Senterre (2007) et Chave et al. (2007) ont proposé un partitionnement géographique de la diversité phylogénétique en diversité Į et diversité ȕ qui tienne compte des abondances.
(1) DT=ijį ij fi fj (2) DK=ijį ij fik fjk
où l’équation (1) définit la diversité totale Ȗ dans le cas où fi fjcorrespondent aux fréquences régionales des
espèces i et j et l’équation (2) définit la diversité Į de la localité K cas lorsque fik fjkcorrespondent aux fréquences
espèces i et j dans la localité K. A partir de ceci, on peut définir Ds comme étant la moyenne de toutes les
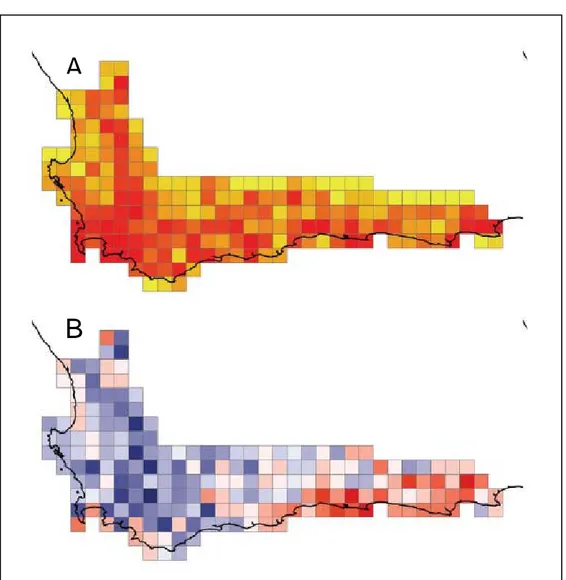
Les différents composants de la diversité constituent des indicateurs complémentaires pour la définition des zones prioritaires à la conservation. Au niveau de la population, la priorité devrait concerner les zones à grande diversité génétique. Par exemple, l’étude de Gallo et al. (2009) a mis en évidence la zone où la diversité génétique de Nothofagus nervosa (Nothofagaceae) était la plus importante en Argentine, ce qui a conduit à la protection de cette zone auparavant soumise à l’abattage forestier. Au niveau des communautés, la diversité spécifique et phylogénétique apparaissent découplées ce qui sous-entend l’importance de prendre en compte ces deux types de diversités pour définir le statut de conservation d’une région (Forest et al. 2007, Chave et al. 2007). Ainsi, dans la flore du Cap en Afrique du Sud, Forest et al. (2007) ont trouvé que la richesse spécifique était plus grande à l’ouest, alors que la diversité phylogénétique était plus importante à l’est (Figure 1). Cette information phylogénétique a été mise en corrélation avec la valeur en ressources exploitables potentielles (médicaments, ressources alimentaires, etc) et il en ressort que la protection des lignées évolutivement distinctes constituerait une meilleure stratégie pour la préservation des ressources « utiles ». En outre, conserver l’histoire évolutive n’a pas qu’une valeur utilitaire ; elle représente aussi un moyen de préserver le potentiel évolutif de réponse face aux changements globaux.
Figure 1. Complémentarité des informations apportées par la diversité taxinomique et
phylogénétique dans la flore du Cap (Afrique du Sud). (A) La richesse taxinomique (au niveau du genre) indique une forte diversité à l’ouest de la région (illustrée par l’intensité du rouge). (B) Résidus d’une régression de la diversité phylogénétique en fonction de la richesse spécifique. Les cases bleues représentent les valeurs négatives et les rouges des valeurs positives. L’information apportée par la diversité phylogénétique indique une forte diversité à l’est du Cap. Tiré de Forest et al. (2007)
B
A
Bien que l’intérêt de combiner les différentes composantes de la diversité dans la prise de décisions ait été démontré, la caractérisation de la biodiversité continue à être principalement fondée sur des critères comme le nombre d’espèces et leur aire de distribution (Meyers et al. 2000). A noter toutefois, que nos connaissances actuelles de ces deux paramètres restent extrêmement limitées. Ainsi, les estimations du nombre d’espèces actuelles varient entre 5 et 15 millions quand on considère les eucaryotes et montent jusqu’à 100 millions avec les procaryotes (May 1988). Ces chiffres restent des estimations basées sur une connaissance plus ou moins bonne des organismes considérés et met en lumière la nécessité de comprendre et connaître la diversité pour être à même de la protéger. Une illustration de l’écart entre le nombre d’espèces connues et estimées se trouve chez les Arthropodes où environ 1 million d’espèces ont été décrites alors que leur nombre réel se situerait entre 4 et 6 millions selon les estimations récentes (Novotny et al. 2002). De même, chez les Angiospermes, un groupe considéré comme l’un des mieux connus (Lughadha et al. 2005), les estimations du nombre d’espèces varient entre 300 000 (Prance et al. 2000) et 422 000 (Govaerts 2001) alors que 250 000 espèces ont été décrites.
La limitation de nos connaissances touche aussi les données concernant la distribution des espèces connues. Bien que nous soyons en mesure de tracer les patrons globaux de la répartition de la diversité, sa caractérisation à une échelle fine reste un défi dans la plupart des cas. Par exemple de nombreuses espèces d’Angiospermes ne sont connues que grâce à un unique spécimen d’herbier (Lughadha et al. 2005). Pourtant, la connaissance des patrons de distribution des espèces est un des défis majeurs pour la préservation de la diversité biologique. Tout d’abord, cette information est essentielle pour faire de meilleures estimations du nombre réel d’espèces menacées. Ainsi, parmi l’ensemble des espèces eucaryotes décrites, environ 3% seulement ont fait l’objet d’études permettant d’estimer leur degré de menace selon les critères de l’UICN (www.iucn.org). Plus particulièrement, alors que près de la
moitié des espèces d’Angiospermes semblent être en danger d’extinction, environ 4% seulement (9598 espèces) sont présentes sur les listes de l’UICN (Pitman & Jorgensen 2002, Lughadha et al. 2005). Cet écart constaté dans les listes de l’UICN, non seulement pour les plantes vasculaires mais également dans le cas de nombreux autres organismes, résulte en partie de l’absence de données permettant la validation des critères de menace, comme par exemple une éventuelle restriction de l’étendue de l’aire de répartition.
Une des caractéristiques majeures de la distribution de la diversité biologique est le fait que la diversité s’accroît lorsqu’on s’approche de l’Equateur (Stevens 1989, Dirzo & Raven 2003) et décroît lorsque l’altitude augmente (Rahbek 1995). Ce gradient latitudinal
de la diversité semble généralisable à tous les groupes d’organismes (Hillebrand 2004, Willig
et al. 2003) à l’exception des guêpes, des salamandres, des pingouins et probablement
d’autres taxa dont la distribution reste mal documentée (Dirzo & Raven 2003). En ce qui concerne les taxa terrestres, ce sont les forêts tropicales humides qui abritent le plus grand nombre d’espèces (Bermingham et al. 2005). Il est donc critique de mesurer la diversité dans ces systèmes et d’être à même de comprendre son organisation pour mettre en évidence les sites qui devraient être considérés comme des priorités de conservation (Brooks et al. 2006).
I.4. Les défis dans la mesure de la diversité floristique dans les forêts tropicales humides
Les forêts tropicales humides s’étendent entre l’équateur et 23,5° de latitude. Elles sont caractérisées par des précipitations supérieures à 1800 mm/an, une photopériode constante et des températures peu variables tout au long de l’année fluctuant entre 18°C et 28°C (Richards 1996, Morley 2000, Burnham & Johnson 2004). Ces forêts sont aujourd’hui dominées par les Angiospermes qui représentent jusqu’à 90% des espèces de plantes (Burnham & Johnson 2004). On estime que parmi les 250 000 espèces connues
d’Angiospermes, la flore Néotropicale (Amérique Centrale, une partie de l’Amérique du Sud et les îles des Caraïbes) comprend environ 90 000 espèces dont 30 000 en forêt Amazonienne, tandis que 35 000 espèces se trouvent en Afrique (principalement dans le bassin du Congo) et 40 000 dans la région Indo-Malaysienne (Thomas 1999, Morley 2000, Smith 2007).
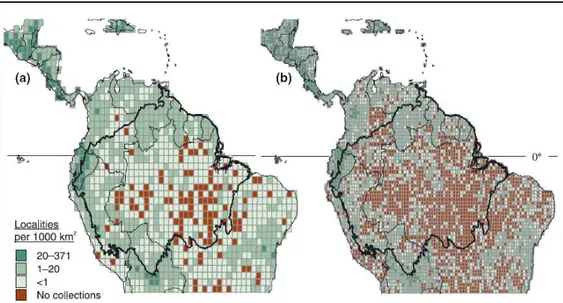
Si la forte diversité floristique des forêts tropicales est donc bien connue, celles-ci sont encore, cependant, considérées comme sous-échantillonnées (Prance et al. 2000). Par exemple, en 1995, 3 nouveaux genres et 85 espèces de palmiers ont été découverts à Madagascar. Parallèlement, dans la Reserva Florestal Adolpho Ducke (100 km2, Manaus, Brésil) 1350 espèces de plantes ont été inventoriées en l’espace de 5 ans (1993-1998), s’ajoutant aux 825 décrites auparavant et comprenant 50 nouvelles espèces. Plus récemment, Schulman et al. (2007) ont estimé que 43% des régions de 0.5° x 0.5° (soit environ 50x50 km) n’avaient fait l’objet d’aucune collection botanique en Amazonie (Figure 2). Ces estimations sont fondées sur des données de collection disponibles dans les herbiers de New York et du Missouri Botanical Garden avec un modèle d’information géographique spatiale. Leurs résultats montrent aussi que les sites collectés ne sont pas uniformément distribués (Figure 2). Ils rejoignent en cela les observations faites auparavant par Nelson et al. (1990) qui ont discuté les limitations des estimations des zones d’endémisme en Amazonie à partir de données biaisées par l’effort d’échantillonnage.
Figure 2. Intensité de collecte botanique en Amazonie : nombre de localités échantillonnées
par 1000 Km2. (a) correspond à une grille de 1°et (b) à une grille de 0.5°. Les cases ou aucune collecte n’est enregistrée sont indiquées en rouge ; le degré de vert représente l’intensité de collecte. Tiré de Schulman et al. (2007).
Les estimations actuelles de la diversité végétale aux tropiques reposent principalement sur des modèles d’interpolation numérique fortement dépendants de l’agrégation des données disponibles. Il est difficile d’évaluer l’étendue du réseau de parcelles qui servent ou ont servi aux tropiques dans l’inventaire et le suivi de la diversité végétale. Néanmoins, d’après les données fournies par des programmes tels que la CTFS1, l’ATDN2, RAINFOR3 et SALVIAS4, la plupart des parcelles ont une superficie de l’ordre de 0.1 ha à 1 ha et n’ont subi des inventaires de diversité qu’une seule fois (Phillips et al. 2003). Dans la région Néotropicale, il existe trois parcelles de 25 ha (Amacayacu et La Planada en Colombie et Manaus au Brésil) et deux de 50 ha (Yasuni en Equateur et Barro Colorado Island à Panama) gérées par le CTFS. Les lacunes dans l’étendue de l’échantillonnage ont des répercutions sur la précision de nos connaissances quant à la répartition de la diversité et
1 Center For Tropical Forest Science (www.ctfs.si.edu)
2 Amazon Tree Diversity Network (www.bio.uu.nl/~herba/Guyana/ATDN)
limitent notre capacité à faire des tests d’hypothèses écologiques à différentes échelles spatiales.
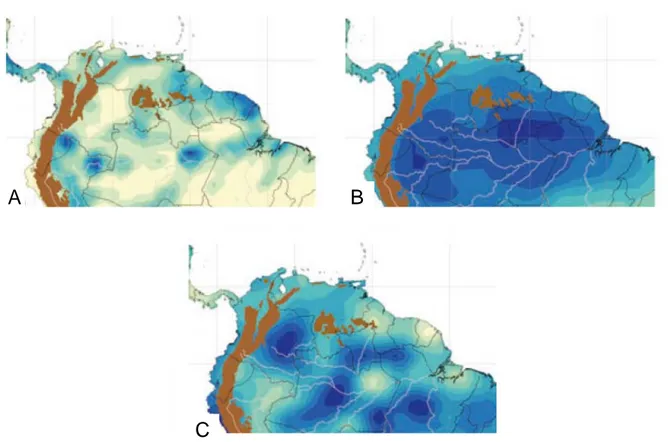
L’étude de ter Steege et al. (2003) illustre la répartition de la diversité spécifique Į à partir de 275 parcelles réparties dans toute l’Amazonie. L’interpolation de ces informations à toute la zone d’étude a mis en évidence un pic de diversité près d’Iquitos et Manaus avec un déclin de diversité vers l’est (Figure 3). Cependant, les zones de richesse locale prédites par cette étude diffèrent des prédictions récentes faites par Hopkins (2007) qui a trouvé un pic de richesse à l’est de l’Amazonie, avec toutefois un gradient de richesse régulièrement distribué d’est en ouest (Figure 4). Hopkins (2007) a fondé ses prédictions sur les données de richesse et répartitions disponibles pour 1584 espèces répertoriées dans des monographies. Bien que ces deux études diffèrent dans leurs données de base et leur modèle d’interpolation, elles se rejoignent en indiquant que de larges zones manquent d’inventaire et appuient le fait que la diversité Amazonienne reste probablement largement sous-estimée.
Il faut souligner que la plupart des patrons de diversité entre localités, sont estimés à partir des inventaires qui considèrent les arbres dont le diamètre à hauteur de poitrine (dbh) est supérieur à 10 cm. La sous-estimation de la biodiversité pourrait donc être encore plus importante que l’on ne l’estime, du fait de la mauvaise représentation des différentes classes d’âges dans les inventaires.
En forêt tropicale, les inventaires floristiques tout comme les projets de recherche en écologie, sont affectés par l’étendue des inventaires mais aussi par le manque de résolution taxinomique. La majorité des études portant sur les changements de composition floristique à travers de grandes échelles géographiques en forêt Amazonienne ont été réalisées à l’échelle de la famille (Terborgh & Andresen 1998, ter Steege et al. 2000) ou du genre (ter Steege et al. 2006). Cependant, la pertinence de l’utilisation des hauts rangs taxinomiques comme indicateurs de la diversité d’une région est encore débattue. Gaston & Williams (1993) ont
suggéré que les patrons de diversité établis à partir des hauts rangs taxinomiques (genre, famille) seraient de bons indicateurs de la richesse spécifique. Cependant, Prance (1994) a montré que ce type d’indicateurs était biaisé et ne reflétait pas les zones d’endémisme. En soutien de cette affirmation, il a signalé que pour trois des régions tropicales –Afrique, Malaisie, Néotropiques - le nombre de familles ou de genres n’était pas très différent alors qu’en terme de nombre d’espèces, les forêts Néotropicales comprenaient au moins autant d’espèces que les deux autres régions réunies (Tableau 1). Prance (1994) a aussi mis en lumière le fait que la distribution restreinte d’un grand nombre d’espèces, facteur clé pour définir les zones de haute endémicité, n’était pas prise en compte par les rangs taxinomiques au dessus de l’espèce. En appui de cet argument, la flore du Pérou est représentée par 2% des genres endémiques, mais si l’on considère les espèces l’endémicité augmente à 31%. Dans le but de définir les zones prioritaires à la conservation il parait important de disposer d’indicateurs de diversité fiables et l’identification spécifique apparaît comme la meilleure solution.
Tableau 1. Comparaison de la diversité taxinomique de plantes de trois grandes régions
tropicales. Tiré de Prance (1994)
Rang taxinomique Afrique Malaisie Néotropiques
Familles 271 310 292
Genres 3750 3250 4200
Figure 3. Carte de distribution de la diversité Į (indice de Fisher voir Encadré 1) en Amazonie et sur le plateau des Guyanes à partir de 275 parcelles. La taille des points indique la valeur maximale observée de la diversité Į présente dans une grille de 1°. Le gradient de couleur représente la richesse spécifique interpolée à toute la zone. Tirée de ter Steege et al. (2003).
Figure 4. Cartes de distribution de la diversité floristique en Amazonie estimées à partir de
1584 espèces référenciées dans des monographies. (A) Distribution des connaissances quant à la distribution des espèces utilisées dans l’étude. Les zones en bleu représentent les endroits où les listes des espèces sont les plus complètes, en blanc les zones manquant d’informations. (B) Distribution de la richesse spécifique à partir d’un modèle d’interpolation spatiale, le degré de bleu est indicateur du degré de richesse. (C) Illustration des zones pour lesquelles une haute richesse spécifique est prédite, mais qui sont sous-échantillonnées. Tiré de Hopkins (2007).
La difficulté de disposer des identifications à l’espèce en forêt tropicale est en partie expliquée par la richesse spécifique de ces régions et par les moyens techniques qui doivent être mis en place pour sa caractérisation. Ainsi, dans un hectare de forêt il est possible de trouver près de 300 espèces dont le diamètre à hauteur de poitrine (dbh) est supérieur à 10 cm (Valencia et al. 1994). De plus, à cette classe de taille, les traits foliaires sont le plus souvent inaccessibles. Les premières observations portent donc généralement sur les caractéristiques du tronc : la couleur, la présence de lenticelles, l’odeur ou la présence de latex font partie des
A
B
critères d’identification (ONF 2004). La collecte des traits foliaires des arbres de canopée requiert souvent la mise en place de moyens techniques tels que l’utilisation de griffes (de Castilho et al. 2006) ou le recourt à des grimpeurs professionnels. Néanmoins, même lorsqu’il est possible d’accéder à la couronne des arbres, les échantillons sont souvent stériles. Suite au travail de collecte, le travail taxinomique en herbier est long et il dépend de la qualité des herbiers de référence. Mis à part le fait que les espèces rares risquent de ne pas être représentées dans les collections d’herbier, Hopkins (2007) estimait que près de 40% des échantillons d’herbier des tropiques sont mal identifiés.
En absence d’une identification spécifique, une solution est la définition de morphotypes qui peuvent ou pas être associés à des rangs taxinomiques tels que la famille ou le genre. Cependant, le manque de résolution taxinomique limite les estimations de diversité puisqu’un nombre important de données doivent être exclues des estimations (Pitman et al. 1999, 2008). Rukolainen et al. (2002) ont estimé que 20% à 30% des individus étaient classés en morphotypes dans les inventaires permanents d’arbres réalisés en Amazonie. Ils ont suggéré que ces individus dont l’identification est difficile pourraient correspondre à des espèces à distribution restreinte (donc potentiellement endémiques), ce qui expliquerait en partie l’absence d’informations disponibles pour leur reconnaissance.
L’identification des espèces de plantes peut s’avérer encore plus difficile aux états juvéniles. Entre juvéniles et adultes, certains traits comme la taille ou la forme des feuilles peuvent varier (Thomas & Ickes 1995). Par ailleurs la prédation à laquelle sont soumises beaucoup d’espèces tropicales aux stades juvéniles rend encore plus difficile leur assignation à une espèce (Boege & Marquis 2005). Cette difficulté de l’identification aux stades juvéniles est illustrée par l’étude de Norden (2007) sur la dynamique de régénération dans la forêt des Nouragues ; lors d’un suivi sur 9423 plantules, 38% ont été identifiées à l’espèce, 15% ont été classées en morphotypes, alors que 37% n’ont pas pu être identifiées. Pour faire face à ces
limitations, certains chercheurs ont procédé dans leur zone d’étude à la culture de graines bien identifiées pour caractériser morphologiquement les juvéniles après la germination (Kobe & Vriesendor 2009, Paine & Harms 2009). Cette pratique, bien que très informative, nécessite un temps de mise en place et de suivi considérable.
A la lumière des problématiques exposées au cours de cette section, il est clair que nous avons besoin de caractériser la diversité et de mieux comprendre son organisation dans le but de la préserver. En particulier, les études présentées dans cette section soulignent la nécessité d’améliorer les inventaires de biodiversité en termes de nombre de sites, de leur emplacement, de l’échelle spatiale utilisée, de la résolution taxinomique et de l’inclusion de mesures telles que la diversité phylogénétique. Le manque d’information taxinomique auquel nous sommes confrontés dans les milieux tropicaux limite non seulement les études de biodiversité, mais aussi toutes les études d’écologie des communautés où l’on cherche à comprendre les forces qui ont participé à l’assemblage et la structuration de la communauté. .
I.5. Problématique abordée dans la thèse
Il est important d’être en mesure de décrire et de cataloguer la biodiversité. Cependant, il semble actuellement encore plus urgent de mettre en évidence la façon dont elle s’organise et les forces sous-jacentes qui permettent son maintien. En effet, connaître le fonctionnement et l’organisation de la biodiversité est un défi et constitue un besoin essentiel pour prévoir les changements à venir et définir les meilleures stratégies de protection sur le long terme. Au cours de ma thèse, j’ai cherché à comprendre quels mécanismes écologiques influencent la structure des communautés et parviennent à maintenir de forts niveaux de diversité locale. Cette forte diversité locale conditionne pour une large part les hauts niveaux de diversité régionale dans les tropiques.
La plupart des études qui abordent la problématique de la coexistence des espèces et de l’organisation de la diversité se focalisent sur un stade de vie donnée. Cependant, la diversité de la forêt tropicale est façonnée tout au long de classes d’âge et il est donc nécessaire de mettre en évidence les processus d’assemblage d’une façon intégrative au cours du temps. Dans ce but j’ai étudié les mécanismes qui structurent la communauté lors du passage de l’état de plantules établies aux arbres de canopée. J’ai abordé cette problématique sous un angle intégrant les relations évolutives des individus qui coexistent. L’intérêt d’inclure l’information évolutive au niveau de la communauté est double. D’une part, cela constitue en soi une mesure de diversité phylogénétique, complémentaire à la diversité spécifique. D’autre part, la structure phylogénétique d’une communauté porte la signature des processus écologiques qui ont pris place au cours de l’assemblage.
Au cours des dernières années, la disponibilité croissante des séquences ADN a permis d’aborder la structure phylogénétique des communautés d’une façon plus précise que les estimations fondées sur des ratios entre rangs taxinomiques. Cependant, la résolution actuelle des phylogénies utilisées dans ce type d’études reste à améliorer. Dans ma thèse, je me suis servi des séquences ADN obtenues à partir des individus en coexistence, ce qui m’a permis de comparer l’impact du degré de résolution des hypothèses phylogénétiques sur les interprétations écologiques.
Ma thèse a été conduite dans la forêt Néotropicale de la Guyane Française (voir méthodes). Cet endroit est caractérisé par une forte diversité spécifique à l’avantage d’être parmi les forêts primaires qui ont subi le moins de pressions anthropiques.
Entre des localités, différents mécanismes écologiques peuvent régir la structure de communautés influencés en partie par l’histoires évolutives de chaque région. Ainsi, la position de la forêt Néotropicale de la Guyane Française à l’est de l’Amazonie confère aux études de biodiversité un intérêt particulier, car les conditions édaphiques ainsi que l’histoire
biogéographique de ces endroits se distinguent de celles des forêts d’Amazonie ouest où de nombreux rapports sur la structure de communautés ont été conduits.
A début de ma thèse, à la station de recherche des Nouragues où j’ai principalement conduit mes recherches, je ne disposais pas d’informations exhaustives et précises concernant les identifications des arbres et des juvéniles. Ainsi, avant d’être en mesure d’aborder la problématique écologique dans ces communautés, j’ai testé la performance des séquences ADN comme moyen d’identification en forêt tropicale. L’utilisation des séquences ADN en tant qu’outil d’identification est un moyen employé depuis des décennies notamment dans les études au niveau de la population. Au cours des dernières années cependant, grâce à la disponibilité croissante d’informations génétiques, les séquences ADN ont été présentées comme un outil prometteur permettant aux non taxonomistes d’accéder à l’identité des espèces de façon fiable, objective et rapide. J’ai donc testé cette approche sur les espèces ligneuses tropicales. Ce travail moléculaire s’inscrit dans ma thèse dans la perspective d’études d’écologie des communautés, néanmoins il constitue à ce jour le premier travail de ce type conduit en forêt tropicale. Dès lors, les tests de cette approche moléculaire ont une portée potentielle sur les études d’inventaires de la biodiversité végétale aux tropiques.
II. Assemblage des communautés et processus de
coexistence.
Dans cette section j’expose les théories en écologie qui permettent d’aborder la problématique de l’organisation de la biodiversité. La compréhension des mécanismes qui régissent l’assemblage d’une communauté est nécessaire pour améliorer les modèles prédictifs sur les changements futurs des communautés face à la transformation de l’habitat (Purves & Pacala 2008, Hubbell et al. 2008). Etre en capacité de prédire le changement des communautés face au changement climatique requiert que l’on comprenne quelle est la part des événements déterministes et des événements stochastiques dans le façonnement des communautés.
Depuis Darwin, la théorie de la compétition entre espèces a permis d’interpréter des phénomènes observés dans la nature. Mais, si la compétition est un processus fondamental gouvernant les interactions entre les espèces comment expliquer qu’environ 40 espèces d’herbes coexistent sur 1m2 dans les prairies anglaises et qu’environ 300 espèces d’arbres coexistent dans la canopée sur un hectare de forêt tropicale (Silvertown 2004, Valencia et al. 1994) ? La coexistence des nombreuses espèces semble paradoxale si l’on part du principe d’exclusion compétitive qui prédit que deux espèces qui sont en concurrence pour les mêmes ressources ne peuvent pas coexister de façon fiable (Gause 1934). De même, comment expliquer que certaines paires d’espèces s’excluent alors que d’autres coexistent (Christian 2001) ? L’ensemble de ces observations a conduit à la recherche des processus qui permettent d’expliquer comment l’interaction entre certaines espèces aboutit à l’exclusion alors qu’entre d’autres la coexistence est possible. Les mécanismes proposés jusqu’à présent sont nombreux et leur étude sur le terrain est difficile.
II.1. Concepts théoriques de niche et neutralité : évidence à partir des patrons d’abondance
La recherche d’une explication à la coexistence des espèces et à leur patron de distribution s’est fondée historiquement sur le principe de compétition comme interaction fondamentale entre les espèces qui exploitent les mêmes ressources. D’après Hutchinson (1959), l’exclusion compétitive peut être évitée à condition que chaque espèce possède un ensemble de propriétés écologiques, « la niche », qui lui permettent d’être la plus compétitive dans un milieu déterminé. Suivant ceci, la coexistence est possible dans un milieu hétérogène où chacune des espèces présentes sera la plus compétitive dans un point sur l’axe du partitionnement de ressources (biotiques et abiotiques) (Hutchinson 1961). D’après ce principe, les processus prenant place lors de l’assemblage de la communauté sont régis par le
filtrage environnemental et les interactions biotiques (Diamond 1975, Weiher & Keddy
1995). Ces mécanismes conduisent à une composition des communautés prévisible et stable, ce qui suppose que dans des conditions environnementales semblables on s’attend à trouver une composition taxinomique ou du moins fonctionnelle comparable.
Filtrage environnemental
Ce mécanisme fait référence à la spécialisation des espèces aux conditions environnementales. La validation de l’approche des niches comme fondement de la coexistence a consisté, en partie, à mettre en évidence la spécialisation des espèces aux axes environnementaux de leur aire de distribution. Ainsi, Silvertown et al. (1999) ont montré dans un réseau de prairies que la distribution de 87 espèces était ségrégée le long d’un axe de sécheresse et de porosité du sol (Figure 5a). D’autres études en zone tempérée ont mis en évidence une ségrégation des stratégies écologiques par rapport à la profondeur des racines,
ainsi qu’une distribution des espèces le long des gradients de salinité et de nutriments comme l’azote (Silvertown 2004). L’association entre la distribution des espèces est les conditions environnementales a aussi été mise en évidence dans les tropiques et cette association a souvent concerné les variables édaphiques. Par exemple, Engelbrecht et al. (2007) ont trouvé une association de 48 espèces d’arbres aux conditions de sécheresse du sol dans l’axe Atlantique-Pacifique à Panama (Figure 5b). De même, Paoli et al. (2006) ont trouvé une association entre la distribution de 18 espèces (sur 22) de Dipterocarpaceae et les nutriments du sol (P, Ca, Mg).
De façon générale les études caractérisant les espèces selon leur tolérance et leur performance écologique à l’échelle des communautés restent rares. Elles sont limitées en partie par le manque d’information quant à la distribution des taxons, particulièrement dans les systèmes tropicaux. Par ailleurs, bien qu’un ensemble d’études ait dévoilé le partitionnement de ressources principalement édaphiques dans les communautés végétales, la distribution des espèces associées à des variables environnementales ne concerne souvent qu’une partie des espèces suivies. Ainsi lors de l’étude de l’association entre les arbres et les variables topographiques et édaphiques à Bornéo, Webb & Peart (1999) ont trouvé une association pour 17 espèces sur 49 suivies, alors que Comita et al. (2007) ont reporté une association pour seulement 18 espèces d’arbres sur les 80 suivies dans une forêt du centre de Panama. Ce faible taux apparent d’association avec un axe environnemental pourrait être expliqué par la complexité de mesurer empiriquement la niche, car celle-ci regroupe toutes les propriétés écologiques d’une espèce. Par exemple, l’axe de différenciation peut se faire sur d’autres variables telles que la vulnérabilité à la pression par les herbivores.