Régulation de la voie MAPK et de l'expression du
facteur de transcription induit en hypoxie HIF-1a par
l'arginine méthyltransférase PRMT1 via la méthylation
de DOCK6
Mémoire
Catherine Turgeon
Maîtrise en biologie cellulaire et moléculaire - avec mémoire
Maître ès sciences (M. Sc.)
Régulation de la voie MAPK et de l’expression du
facteur de transcription induit en hypoxie HIF-1α
par l’arginine méthyltransférase PRMT1 via la
méthylation de DOCK6
Mémoire
Catherine Turgeon
Sous la direction de :
Résumé
L’hypoxie est un processus physiopathologique impliqué dans l’embryogenèse et le développement de maladies cardiovasculaires, mais également dans la tumorigenèse et la progression tumorale. Au niveau cellulaire, la réponse hypoxique est médiée par une activité transcriptionnelle adaptative hautement régulée via le facteur de transcription induit en hypoxie, HIF-1 (Hypoxia inducible factor-1). L’activité de ce facteur de transcription est dépendante de la stabilisation de sa sous-unité HIF-1α en fonction des niveaux d’oxygène. Dans des travaux récents, nous avons identifié un nouveau répresseur de l’expression de HIF-1α, soit la protéine arginine méthyltransférase 1 (PRMT1). En inhibant l’activité des facteurs de transcription Sp1 et Sp3 (Sp1/3) au promoteur de HIF-1α, PRMT1 module la disponibilité de la sous-unité HIF-1α et l’activité du facteur de transcription HIF-1. Dans ces mêmes travaux, nous avons montré que PRMT1 inhibe l’activité de Sp1/3 en empêchant leur phosphorylation via la répression de la voie de signalisation mitogénique MAPK (mitogen-activated protein kinases) composée entre autres des kinases ERK1/2 (extracellular signal-regulated kinases) et de la kinase MEK (MAPK/ERK kinase) qui peut elle-même être activée par la kinase PAK1 (p21-activated kinase). Nous avons également identifié le facteur d’échange de nucléotides guanyliques DOCK6 comme partenaire de PRMT1 et comme intermédiaire dans la régulation de la voie MAPK. Le but de cette étude est donc de mieux caractériser le rôle de DOCK6 dans le contrôle de l’expression de HIF-1α et dans la régulation de la voie MAPK modulés par PRMT1.
Nos résultats montrent que la méthylation de DOCK6 par PRMT1 inhibe son activité GEF (guanine exchange factor) ce qui résulte en l’inactivation de la signalisation PAK1/MEK/ERK1/2 en aval. De manière intéressante, nos résultats montrent également que l’expression protéique de DOCK6 est modulée en hypoxie de manière HIF-1 dépendante. Enfin, nous montrons que HIF-1α est nécessaire pour l’activation de la voie MAPK en hypoxie.
Ces travaux permettent de mieux comprendre le mécanisme de rétrocontrôle régulant les protéines HIF-1, PRMT1, DOCK6 et la voie MAPK. Ce projet souligne ainsi l’importance et la complexité de la régulation du facteur de transcription HIF-1 lors de
Abstract
Conditions of low oxygen, or hypoxia, are involved in various pathophysiological situations including cancer and cardiovascular diseases. Hypoxic responses are mediated through a highly regulated transcriptional response in which hypoxia-inducible factor-1 (HIF-1) plays an important role. HIF-1 transcriptional activity relies on hypoxia-dependent stabilization of HIF-1α, an essential HIF-1 subunit. In previous work, we identified protein-arginine methyltransferase 1 (PRMT1) as a novel repressor of HIF-1α expression. By inhibiting the activity of specificity proteins 1 and 3 (Sp1, Sp3; Sp1/3) transcription factors, PRMT1 regulates HIF-1α subunit availability and HIF-1 activity. PRMT1 blocks Sp1/3 activity by preventing phosphorylation through the inhibition of the mitogen-activated protein kinases (MAPK) pathway. MAPK pathway is composed of ERK1/2 (extracellular
signal-regulated kinases) and MEK (MAPK/ERK kinase), which can itself be activated by
PAK1 (p21-activated kinases). In addition, we identified the guanine nucleotide exchange factor (GEF) DOCK6 as a novel PRMT1 binding partner and as an intermediate for the regulation of MAPK pathway. Therefore, the aim of this study is to better characterize the role of DOCK6 in HIF-1α expression and MAPK regulation.
Our results show that DOCK6 is directly methylated by PRMT1. PRMT1 methylation of DOCK6 alters its GEF activity and results in the inactivation of downstream PAK1/MEK/ERK1/2 signaling. Interestingly, our results indicate that DOCK6 levels are increased by hypoxia in a HIF-1 dependent manner. Finally, we show that HIF-1α is required for MAPK pathway activation in hypoxic conditions.
These studies demonstrate the intricate feedback mechanism that can regulate HIF-1, highlight the complexity of HIF-1 regulation under hypoxic conditions and identify novel targets for potential intervention.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Listes des figures ... vii
Listes des tableaux ... viii
Listes des abréviations ... ix
Remerciements ... xii
Introduction ... 1
La révolution de l’oxygène ... 1
L’oxygène et le corps humain ... 3
Généralités ... 3
Dans la cellule ... 4
L’hypoxie ... 6
L’hypoxie en situations physiologiques ... 8
Développement embryonnaire ... 8
Sport ... 9
Altitude ... 9
L’hypoxie en situations pathologiques ... 12
Troubles pulmonaires ... 12
Maladies cardiovasculaires ... 13
Cancer ... 14
HIF, les facteurs de transcription induits en hypoxie ... 17
Généralités ... 17
Les domaines fonctionnels ... 17
Différences entre les HIF ... 18
Régulation dépendante de l’oxygène (ubiquitination) ... 19
Régulation par la méthylation ... 21
Régulation via la voie MAPK ... 23
Objectifs ... 25
Chapitre 1 : Matériel et méthodes ... 29
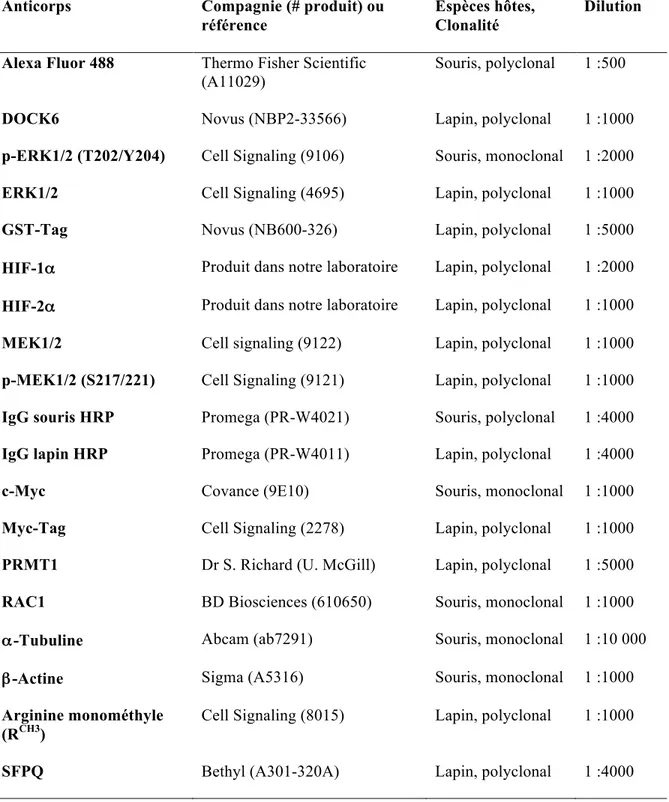
1.1 Matériel et anticorps ... 29
1.2 Culture cellulaire ... 31
1.3 Immunobuvardage de type Western ... 31
1.4 Transfections, interférence à l’ARN et vecteurs ... 32
1.5 Purification des protéines liées à la GST ... 33
1.9 Immunoprécipitation ... 35
1.10Étude de l’expression génique par RT-qPCR (reverse transcription – quantitave polymerase chain reaction) ... 35
1.11Essai de liaison de proximité PLA (Proximity Ligation Assay) ... 36
1.12Analyses statistiques ... 37
Chapitre 2 : Résultats ... 38
2.1 La protéine DOCK6 est méthylée par PRMT1 ... 38
2.2 La méthylation de DOCK6 inhibe son activité GEF ... 44
2.3 DOCK6 active la voie de signalisation MAPK ... 46
2.4 DOCK6 régule l’expression de HIF-1α via la voie de signalisation MAPK ... 50
2.5 La méthylation de DOCK6 par PRMT1 réprime l’activité transcriptionnelle de HIF-1 ... 52
2.6 L’expression de DOCK6 augmente en hypoxie de manière HIF-1 dépendante ... 54
2.7 HIF-1α est nécessaire pour l’activation de la voie MAPK en hypoxie ... 58
Chapitre 3 : Discussion ... 60
3.1 DOCK6 : nouvelle cible de PRMT1 et protéine activatrice de la voie de signalisation MAPK ... 60
3.2 Régulation de HIF-1α par la voie MAPK ... 62
3.3 Régulation d’expression de DOCK6 en hypoxie par HIF-1 ... 64
3.4 Régulation de la voie MAPK en hypoxie ... 66
Chapitre 4 : Perspectives ... 69
4.1 Confirmer la régulation directe de DOCK6 par HIF-1 ... 69
4.2 Préciser la relation entre PRMT1, DOCK6, la voie MAPK et le facteur de transcription HIF-2 ... 69
4.3 Étudier le rôle de Sp1 dans la régulation de DOCK6 ... 70
4.4 Étudier le rôle de la protéine DOCK7 dans l’activation de la voie MAPK et dans la régulation d’expression de HIF-1α ... 71
4.5 Déterminer l’implication de HIF-1 dans le SAO ... 71
Conclusion ... 73
Listes des figures
Introduction
Figure 1 : Respiration cellulaire ... 5
Figure 2 : Réponses physiologiques à l’hypoxie ... 7
Figure 3 : Implication des HIF dans plusieurs caractéristiques du cancer ... 16
Figure 4 : Domaines fonctionnels des HIF ... 18
Figure 5 : Régulation des sous-unités alpha dépendante de l’oxygène ... 20
Figure 6 : Méthylation d’arginines par les PRMT ... 22
Figure 7 : Régulation du niveau de SAM en hypoxie ... 22
Figure 8 : Répression de l’expression de HIF-1α par PRMT1 ... 25
Figure 9 : Répression de l’activité transcriptionnelle de Sp1 et Sp3 par PRMT1 ... 26
Figure 10 : Facteur d’échange de nucléotides guanyliques DOCK6 ... 27
Chapitre 2 : Résultats Figure 11 : Démonstration de l’interaction entre PRMT1 et DOCK6 par un essai PLA ... 39
Figure 12 : DOCK6 est méthylée par PRMT1 ... 41
Figure 13 : La forme mutée de DOCK6 sur les arginines 865 et 869 n’est pas méthylée par PRMT1 ... 43
Figure 14 : La méthylation de DOCK6 par PRMT1 bloque son activité GEF ... 45
Figure 15 : DOCK6 augmente l’activation de la voie MAPK ... 47
Figure 16 : PRMT1 inhibe l’augmentation de la phosphorylation de ERK par DOCK6 ... 49
Figure 17 : DOCK6 augmente l’expression protéique de HIF-1α ... 51
Figure 18 : DOCK6 augmente l’activité transcriptionnelle de HIF-1 ... 53
Figure 19 : Régulation de DOCK6 en hypoxie ... 55
Figure 20 : Régulation de gènes HIF-dépendants en hypoxie ... 57
Figure 21 : L’activation de la voie MAPK en hypoxie est dépendante de HIF-1α ... 59
Chapitre 3 : Discussion Figure 22 : Boucle de rétroaction positive régulant l’activation de HIF-1 et de la voie MAPK ... 68
Conclusion Figure 23 : Modèle représentant la dynamique entre la régulation d’expression de HIF-1α par PRMT1 via la voie MAPK et DOCK6 ... 74
Listes des tableaux
Chapitre 1 : Matériel et méthodes
Tableau 1 : Anticorps utilisés ... 29 Tableau 2 : Séquences d’oligonucléotides utilisés pour les expériences de RT-qPCR ... 35
Listes des abréviations
A549 Lignée cellulaire de carcinome pulmonaire
ADOX Adénosine dialdéhyde
AMI de l’anglais : Arginine methyltransferase inhibitor
ARN Acide ribonucléique
ATII de l’anglais : Alveolar type II cells
ATP Adénosine triphosphate
BNIP3 de l’anglais : BCL2/adenovirus E1B 19 kDa protein-interacting protein 3
BSA de l’anglais : Bovine serum albumin
CaPO4 Calcium phosphate
CBP de l’anglais : CEBP-binding protein
CDC42 ChIP
de l’anglais : Cell division control protein 42 homolog de l’anglais : Chromatin immunoprecipitation
CEBP de l’anglais : CCAAT-enhancer binding protein
CH3 Groupement méthyle
CO2 Dioxyde de carbone
CpG Dinucléotide cytosine-phosphate-guanine
CRIB de l’anglais : Cdc42- and Rac-interactive binding domain
CRM1 de l’anglais : Chromosomal maintenance 1
CTL Contrôle
DHR de l’anglais : Dock Homology Region
DMEM de l’anglais : Dulbecco’s modified Eagle’s medium
DMSO Diméthyloxaloylglycine
DNA de l’anglais : Deoxyribonucleic acid
DOCK de l’anglais : Dedicator of cytokinesis
DSP de l’anglais : Dithiobis (succinimidyl propionate)
ECL de l’anglais : Enhanced chemiluminescence
ECT2 de l’anglais : Epithelial cells transforming 2
EDTA de l’anglais : Ethylenediaminetetraacetic acid
EGF de l’anglais : Epidermal growth factor
EGFR de l’anglais : Epidermal growth factor receptor
ERK de l’anglais : Extracellular signal-regulated kinase
FADH2 Forme réduite de la flavine adénine dinucléotide (FAD)
FBS de l’anglais : Fetal bovine serum
Fe2+ Ion ferreux
FIH de l’anglais : Factor inhibiting HIF
FT Facteur de transcription
GDP Guanosine diphosphate
GEF de l’anglais : Guanine nucleotide exchange factors
GLUT1 de l’anglais : Glucose transporter 1
GRB2 de l’anglais : Growth factor receptor-bound protein 2
GST Glutathione S-transférase
GTP Guanosine triphosphate
HEK de l’anglais : Human embryonic kidney cells
HIC Hypoxie intermittente chronique
HIF de l’anglais : Hypoxia-inducible factor
HIG2 de l’anglais : Hypoxia-inducible gene 2
bHLH de l’anglais : Basic helix-loop-helix
H2O Eau
H2O2 Peroxyde d’hydrogène
HPRT de l’anglais : Hypoxanthine-guanine phosphoribosyltransferase
HRE de l’anglais : Hypoxia response element
HRP de l’anglais : Horseradish peroxidase
IP Immunoprécipitation
IPA-3 de l’anglais : group 1 PAK1 inhibitor
LZIP de l’anglais : leucine zipper
MAPK de l’anglais : Mitogen-activated protein kinase
MAT Méthionine adénosyltransférase
MEC Matrice extracellulaire
MEF de l’anglais : Mouse embryonic fibroblast
MEK de l’anglais : MAPK/ERK kinase
MeMo de l’anglais : Methylation Modification Prediction Server
MgCl2 Chlorure de magnésium
MMA de l’anglais : ω-NG-monomethylarginine
mmHg Millimètre de mercure
MPOC Maladie pulmonaire obstructive chronique
NaCl Chlorure de sodium
NAD Nicotinamide adénine dinucléotide
NLS de l’anglais : Nuclear localisation signal
O2 Dioxygène
ppO2 Pression partielle d’oxygène
ODDD de l’anglais : Oxygen-dependent degradation domain
2-OG 2-oxoglutarate
OH Hydroxyde
4-OHT 4-hydroxytamoxifène
PAK1 de l’anglais : p21-activated kinase 1
PCR de l’anglais : Polymerase chain reaction PEI PFK Polyéthylènimine Phosphofructokinase PFKFB4 6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 4
PHD de l’anglais : Prolyl hydroxylase domain-containing protein
PLA de l’anglais : Proximity ligation assay
PP2A Protéine phosphatase 2
PREX1 de l’anglais : Phosphatidylinositol 3,4,5-trisphosphate-dependent RAC
echanger 1 protein
PRMT Protéine arginine méthyltransférase
PV Pervanadate
PVDF de l’anglais : Polyvinylidene difluoride membrane
RCH3 Arginine monométhyle
RNA de l’anglais : Ribonucleic acid
ROS de l’anglais : Reactive oxygen species
RTK Récepteur à activité tyrosine kinase
RT-qPCR de l’anglais : Reverse transcription quantitative polymerase chain reaction
SAH S-adénosyl-homocystéine
SAHH S-adénosyl-homocystéine hydrolase
SAM S-adénosyl-méthionine
SAO Syndrome Adams-Oliver
SAOS Syndrome de l’apnée obstructive du sommeil
SEM de l’anglais : Standard error of the mean
SFPQ de l’anglais : Splicing factor, proline- and glutamine-rich
SH2 de l’anglais : Src Homology 2
SILAC de l’anglais : Stable-isotope labeling by amino acids in cell culture
SOS de l’anglais : Son of sevenless
Sp de l’anglais : Specific protein
TAD de l’anglais : Transactivation domain
TBS de l’anglais : Tris-buffered saline
UCSC de l’anglais : University of California, Santa Cruz
VEGF de l’anglais : Vascular endothelial growth factor
pVHL de l’anglais : von Hipplel-Lindau tumor suppressor protein
°C Degré Celsius
Remerciements
Les années à la maîtrise ont été pour moi une période riche en apprentissages, autant du point de vue professionnel que personnel. En effet, mon cheminement au deuxième cycle m’a permis non seulement d’approfondir mes compétences scientifiques, mais également d’en apprendre un peu plus sur moi-même. Les nombreux défis que j’ai eu à réaliser ont permis de révéler quelques traits de caractère et de façonner ma personnalité. Mes années à la maîtrise m’ont appris les joies et les peines de la recherche, à persévérer lors de moments difficiles et à apprécier humblement les moments de succès.
J’ai eu la chance de faire partie d’une équipe talentueuse aux projets variés et exaltants. J’ai toutefois vécu un contexte de recherche particulier caractérisé par le départ graduel de mes collègues. Cette expérience m’a néanmoins permis d’apprendre plusieurs tâches connexes dans le laboratoire en plus de me permettre de développer mon sens d’autonomie. Malgré les défis supplémentaires que cette situation m’a apportés, je considère que ma formation n’en a été que plus complète.
Les derniers mois de mon parcours ont été les plus épanouissants. Mon projet débouchait tranquillement sur une histoire intéressante et je voyais se profiler la fin de ma maîtrise avec un sentiment de fierté et d’accomplissement. J’ai également eu la chance de présenter mon projet de recherche dans le cadre d’un congrès à Oxford au Royaume-Uni. Je n’oublierai jamais cette belle expérience qui m’a permis de voyager, d’approfondir mes connaissances et de sortir de ma zone de confort.
Ce parcours, parsemé de quelques embuches mais également de bons coups et de moments de fierté, n’aurait pas été possible sans l’aide et le soutien précieux de plusieurs personnes. J’aimerais prendre ici le temps de les remercier comme il se doit.
Je veux d’abord remercier mon directeur de recherche Darren E. Richard pour m’avoir accueillie dans son équipe et pour m’avoir fait confiance dès mes premiers stages dans le laboratoire. Darren a invariablement fait preuve d’un bon caractère et d’une écoute
bon directeur se doit de l’être, mais il m’a également laissé beaucoup de liberté et d’autonomie pour réaliser mon projet de recherche. Je garderai un bon souvenir de nos discussions scientifiques, mais également de nos conversations anodines sur la famille, les voyages et la vie de tous les jours. Merci pour tout l’apprentissage et pour toutes les belles opportunités.
Merci à Laurent Lamalice qui a été une ressource précieuse dans le laboratoire. Malgré sa rigueur professionnelle, son enthousiasme contagieux apportait une belle ambiance dans notre milieu de travail. Étant érudit de nature, Laurent nous a permis d’avoir de belles conversations variées sur la musique, le sport et la science. Je le remercie pour la bonne formation en laboratoire qu’il m’a prodiguée et pour les nombreuses connaissances qu’il m’a transmises.
Merci à mes collègues Maroua Jalouli et Sophie Mokas. Malgré notre bref côtoiement dans le laboratoire, elles étaient présentes lors de mon tout premier stage et ont participé à ma formation ainsi qu’à la réussite de mon cheminement. J’ai également eu la chance de participer avec elles à la réalisation d’un article scientifique. Je les en remercie pour cette belle opportunité.
Je veux remercier particulièrement ma collègue Véronique Lafleur. Nous avons cheminé ensemble pendant un moment au sein du laboratoire et j’ai eu la chance de travailler avec elle sur son projet de doctorat. J’ai également eu l’opportunité de poursuivre et de complémenter son projet de recherche au cours de ma maîtrise. Je la remercie de m’avoir fait confiance dans mes débuts et de m’avoir impliquée dans ses travaux de recherche. Je garderai de bons souvenirs de ma visite à Oxford pendant laquelle nous avons eu l’occasion de nous côtoyer dans un contexte autre que celui du laboratoire ce qui nous a permis d’apprendre à mieux nous connaitre et de passer de bons moments ensemble.
Merci à Noémie Lavoie, ma partenaire dans cette aventure qu’a été la maîtrise. Nous avons vécu ensemble plusieurs moments importants de cette étape académique. Bien
compter l’une sur l’autre dans les moments plus difficiles tout comme pour célébrer nos réussites. Dès notre première rencontre dans le fameux cours de génome, nous avons développé une belle complicité qui a rapidement évolué en une amitié précieuse. Je la remercie pour sa belle énergie et pour cette amitié qui perdurera au-delà de notre passage au centre de recherche.
Enfin, ce parcours aurait sans doute été beaucoup plus ardu sans le soutien précieux de ma famille. Merci à ma mère Chantal, mon père Sylvain, mes frères Philippe et Mathieu, mon amour Alexis. Même de manière inconsciente, les membres de ma famille m’ont continuellement encouragée à repousser mes limites ainsi qu’à relever les nombreux défis qu’implique la maîtrise. Leur présence réconfortante et leur soutien ont toujours été des piliers solides dans ma vie et ont été d’une aide précieuse pendant mon cheminement à la maîtrise. Je suis fière de l’unité familiale que nous formons, remplie d’écoute, d’entraide, de belle complicité et d’amour.
Introduction
La révolution de l’oxygène
L’oxygène, principalement retrouvé sous la forme de dioxygène (O2), est un
élément essentiel à la diversité de la vie terrestre. L’atmosphère de notre ère est composée d’environ 78% d’azote, 21% d’O2 et 1% d’un mélange d’autres gaz. Par contre, au début de
la vie de notre planète, la situation était toute autre. Il y environ 4 milliards d’années (Ga,
giga-annum), alors que la terre naissante était géologiquement instable et ravagée par les
pluies de météorites, l’atmosphère terrestre s’est composée peu à peu à partir de gaz provenant d’éruptions volcaniques, soit principalement le dioxyde de carbone (CO2) et le
méthane, mais très peu d'O2 (1).
Il faut faire un bond dans le temps de plusieurs millions d’années avant de percevoir l’augmentation du niveau d’O2 à la surface terrestre. L’émergence de l’O2 dans notre
atmosphère est presque exclusivement due à l’apparition d’organismes photosynthétiques nommés cyanobactéries il y a environ 2.7 Ga (2). Ces microorganismes utilisent l’énergie du soleil pour convertir le CO2 et l’eau en nutriments et en O2 (3). Ils sont devenus si
omniprésents sur la planète que l’O2 qu’ils produisaient s’est rapidement accumulé dans
l’atmosphère. Cette époque, caractérisée par la constitution de la couche d’ozone, est nommée par les historiens l’Évènement de Grande Oxydation (Great Oxygenation Event, ~ 2.5 Ga). Sur le plan géologique, cette transformation rapide de la composition de l’atmosphère terrestre s’est déroulée sur environ 200 millions d’années, la concentration d’O2 passant de moins de 1% à plus de 15% (4).
Avant cette période, les microorganismes qui peuplaient la terre étaient anaérobiques. Les organismes anaérobiques sont classifiés selon trois catégories. Les anaérobies obligatoires meurent lorsqu’exposés à l’O2, tandis que les aérotolérants
survivent en sa présence sans pouvoir l’utiliser. Les anaérobies facultatifs, quant à eux, peuvent croître sans dioxygène, mais peuvent également l’utiliser lorsqu’il est présent. L’augmentation croissante de la concentration d’O2 dans l’atmosphère a causé une pression
sélectif d’une lignée d’organismes aérobiques, les eucaryotes (5,6). En fait, des évidences de plus en plus nombreuses suggèrent que les eucaryotes aérobiques auraient évolué à partir de l’endosymbiose d’un protomitochondrion, une protéobactérie anaérobique facultative qui deviendra la mitochondrie, par un ancêtre proto-eucaryote (7,8). Les organismes anaérobiques facultatifs produisent l’ATP par respiration aérobique lorsque l’O2 est
présent, mais ont également la capacité d’effectuer la respiration anaérobique ou la fermentation en absence d’O2 (9). Ce serait grâce au protomitochondrion que les eucaryotes
primitifs auraient réussi à survivre et à évoluer dans un environnement nouvellement riche en O2 (6,9-11).
À travers le temps, plusieurs autres perturbations vinrent modifier la composition de l’atmosphère. Les périodes glaciaires entrainèrent la diminution de la concentration de dioxygène dans l’air, tandis que la fonte des glaciers augmenta substantiellement le niveau d’O2 (12). Il y a environ 350 millions d’années, pendant la période chaude du Carbonifère,
le taux d’O2 passa d’environ 20% à 35% en l’espace de 50 millions d’années, entrainant le
gigantisme de certains insectes et amphibiens dont la taille était limitée par leur capacité de distribution d’O2 (13,14). Ces variations d’O2 et les nombreux changements climatiques
associés influencèrent l’évolution de la vie terrestre en guidant tout autant les périodes prolifératives que celles de grandes extinctions.
L’oxygène et le corps humain
Généralités
À partir de l’apparition des premiers eucaryotes, il faut faire un bond dans le temps de plus de 1.5 Ga avant l’évolution des hommes modernes, Homo sapiens, il y a environ 300 000 ans (15). Depuis, le corps humain n’a cessé d’évoluer, s’adaptant aux variations climatiques et aux divers habitats colonisés (16,17). L’évolution entre premiers eucaryotes et hommes modernes n’aurait pas été possible sans l’O2 qui a permis le développement
d’organismes multicellulaires complexes.
L’homme, comme tout organisme aérobique, utilise le dioxygène pour la respiration. L’O2 accède aux poumons lors de l’inspiration et se dirige jusque dans les
alvéoles pulmonaires où se produit l’échange entre le CO2 et l’O2 (18). Les alvéoles sont
composés d’une seule couche de cellules épithéliales et sont enrobés dans un réseau de capillaires assurant un contact étroit avec la circulation sanguine et permettant les échanges gazeux (19,20).
L’O2 est ensuite transporté dans la circulation sanguine par les érythrocytes qui
contiennent l’hémoglobine, une métalloprotéine contenant un atome de fer qui permet de lier l’O2 (21). Le sang oxygéné provenant des poumons circule par les veines pulmonaires
jusqu’au ventricule gauche du cœur qui le pompe dans tout le reste du corps par les artères. Dans les organes et les tissus, le système circulatoire se fractionne en conduits de plus en plus petits, passant des artères aux artérioles et aux capillaires qui constituent la jonction entre la circulation artérielle et la circulation veineuse. Comme les alvéoles pulmonaires, les capillaires sanguins sont composés d’une seule couche de cellules endothéliales ce qui permet l’échange de gaz. L’O2 provenant de la circulation artérielle est transmis au tissu et
le CO2 produit par les cellules est transporté par le système veineux jusqu’aux poumons où
Dans la cellule
Au niveau cellulaire, la respiration aérobique fait intervenir le glucose et l’O2 pour
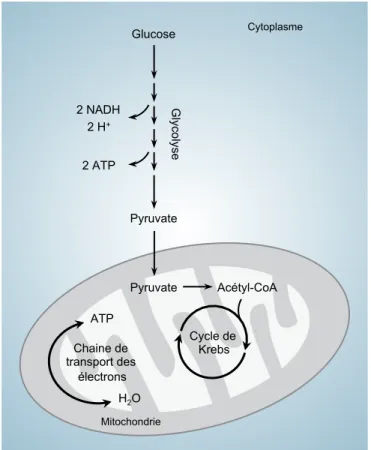
la production d’énergie sous forme d’adénosine triphosphate (ATP). Ce processus permet de produire une trentaine de molécules d’ATP à partir d’un seul glucose (Figure 1). Le glucose est d’abord transformé en pyruvate par la glycolyse dans le cytoplasme. Le pyruvate est ensuite transporté dans la mitochondrie et entre dans le cycle de Krebs qui produit une quantité importante de transporteurs d’électrons de haute énergie comme le NADH et le FADH2. Les électrons fournis par ces deux donneurs sont ensuite transportés à
travers les quatre complexes protéiques de la chaine de transport d’électrons située à la membrane interne de la mitochondrie. L’énergie fournie par le transport d’électrons est utilisée pour pomper des protons H+ de la matrice mitochondriale jusque dans l’espace intermembranaire. Le gradient électrochimique qui en résulte est finalement utilisé par l’ATP synthase, une enzyme qui permet la production d’ATP via la phosphorylation oxydative (23,24).
L’utilisation d’O2 dans la cellule se fait principalement au niveau de la chaine de
transport d’électrons; cette molécule est l’accepteur final d’électrons ce qui résulte en la production d’eau. La réduction de l’O2 en H2O entraine la production de radicaux libres soit
l’anion superoxyde O2-, le radical hydroxyle HO- et le peroxyde d’hydrogène H2O2. Ces
dérivés réactifs de l’oxygène peuvent altérer le fonctionnement enzymatique et endommager les acides nucléiques (9,25). Pour limiter le dommage causé par ces radicaux libres, certaines enzymes, comme la cytochrome c oxydase, contiennent des ions métalliques à leur site actif ce qui évite la production de ces intermédiaires. D’autres enzymes, comme la superoxyde dismutase, catalysent la transformation de l’anion superoxyde en O2 et H2O2, tandis que la catalase et la glutathion peroxydase favorisent la
réduction du peroxyde d’hydrogène en eau. Au cours de l’évolution, ces enzymes ont constitué le premier moyen de défense des cellules au stress oxydatif (26). En fait, des évidences suggèrent que ces enzymes sont apparues avant même l’augmentation des niveaux d’O2 et la respiration aérobique. Sans la présence de ces mécanismes de protection,
l’émergence de l’O2 dans l’atmosphère aurait eu des effets délétères sur les premiers
En absence d’O2, la chaine de transport d’électrons est bloquée. Le pyruvate produit
lors de la glycolyse n’est pas métabolisé pour la respiration cellulaire aérobique mais subit plutôt un processus de fermentation. Dans ce cas, l’enzyme lactate déshydrogénase catalyse la transformation du pyruvate en lactate. Le lactate peut alors être reconverti en pyruvate ou transformé en glucose via la gluconéogenèse. Ce processus, nommé glycolyse anaérobique, se produit notamment au niveau des cellules musculaires où les réserves d’O2 s’épuisent
rapidement lors d’un exercice intense (28). La fermentation du pyruvate ne produit pas d’ATP; les deux seules molécules d’ATP résultant de ce processus sont produites lors de la glycolyse. La phosphorylation oxydative via la respiration aérobique est donc énergiquement beaucoup plus avantageuse que la glycolyse anaérobique (29,30).
Figure 1. Respiration cellulaire
Le glucose est d’abord transformé en pyruvate lors de la glycolyse. Le pyruvate est ainsi importé dans la mitochondrie où il entre dans le cycle de Krebs, processus cellulaire qui permet la production de plusieurs transporteurs d’électrons. Ceux-ci fournissent l’énergie nécessaire pour la production d’ATP dans la chaine de transport d’électrons où l’O2 est finalement réduit en H2O.
Illustration adaptée avec permission de V.N. Lafleur (31)
Glucose G lyco lyse Pyruvate Pyruvate Acétyl-CoA Cycle de Krebs Chaine de transport des électrons ATP H2O 2 ATP 2 H+ 2 NADH Cytoplasme Mitochondrie
L’hypoxie
L’hypoxie est définie comme un apport insuffisant en dioxygène. Dans le sang, les tissus et les organes, la quantité d’O2 est déterminée sous forme de pression partielle d’O2
(ppO2) exprimée en pourcentage (%) ou en millimètres de mercure (mmHg). La pression
partielle d’un gaz se définit comme la pression de ce gaz dans un mélange gazeux. Elle peut également déterminer la pression d’un gaz dissout dans le sang. Par exemple, la ppO2 varie
de 100 mmHg dans le sang artériel jusqu’à moins de 20 mmHg dans certains tissus (32). Les organes riches en sang artériel comme les poumons, le cœur, le foie et les reins sont exposés à un niveau plus élevé d’O2 que les organes moins vascularisés comme l’œil et la
moelle épinière. L’état d’hypoxie varie donc selon le tissu (33).
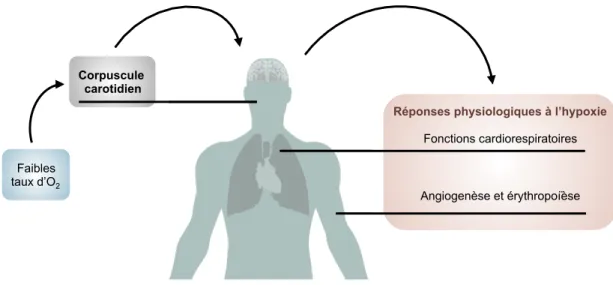
L’organisme peut détecter les variations d’O2 dans le sang artériel via le corpuscule
carotidien (Figure 2). Cette structure située au niveau de la bifurcation de la carotide contient des cellules glomiques qui agissent comme chimiorécepteurs et perçoivent les variations de la ppO2. Ces cellules libèrent des neurotransmetteurs qui régulent le
fonctionnement du système respiratoire; la première réponse à l’hypoxie est l’hyperventilation (34,35). En cas d’exposition prolongée à l’hypoxie, l’érythropoïétine sécrétée par les reins favorise la production d’érythrocytes en stimulant la différenciation et la maturation de précurseurs présents au niveau de la moelle osseuse, processus nommé érythropoïèse (36). L’augmentation du nombre d’érythrocytes permet d’améliorer la capacité du sang à transporter et distribuer l’O2. L’hypoxie prolongée favorise également
l’angiogenèse, soit le développement de nouveaux vaisseaux sanguins à partir de la vascularisation existante (37). Tous ces processus sont mis en branle afin de maintenir l’oxygénation adéquate des tissus.
Figure 2. Réponses physiologiques à l'hypoxie
Le faible taux d’oxygénation est perçu par le corpuscule carotidien qui permet de réguler et d’ajuster les fonctions respiratoires. En réponse à l’hypoxie prolongée, d’autres processus physiologiques comme l’angiogenèse et l’érythropoïèse sont activés afin de maintenir l’oxygénation des tissus. Illustration adaptée avec permission de V.N Lafleur (31)
L’hypoxie est une condition qui peut subvenir dans plusieurs processus physiologiques et pathologiques. Ces situations hypoxiques seront abordées dans les prochaines sections.
En réponse à l’hypoxie, des mécanismes cellulaires et moléculaires sont activés afin de maintenir les fonctions vitales des cellules. Ces mécanismes d’adaptation font intervenir une réponse transcriptionnelle hautement contrôlée qui est principalement régulée par les facteurs de transcription induits en hypoxie (HIF). Les HIF seront également abordés plus loin.
Figure 1.1: Les réponses adaptatives cellulaires et physiologiques à l’hypoxie.
Le corpuscule carotidien et les facteurs de transcription HIF agissent en tant que senseurs et médiateurs des différentes réponses biologiques au stress hypoxique. Voir le texte pour plus de détails.
Illustration par V.N. Lafleur.
L’implication des protéines HIF dans la régulation des fonctions de cet organe sensoriel fut soulevée. En effet, une déficience en HIF-1 atténue les fonctions de détection d’O2 du corpuscule
carotidien, tandis qu’une carence en HIF-2 les augmente [36]. Il en résulte dans les deux cas des perturbations néfastes dans l’homéostasie cardiorespiratoire en réponse à l’hypoxie. Un antagonisme réciproque entre HIF-1 et HIF-2 a été démontré dans ce contexte, soulignant l’importance d’un équilibre entre les niveaux respectifs de ces facteurs pour la sensibilité adéquate du corpuscule carotidien envers l’O2 [37].
Le corpuscule carotidien n’est pas requis seulement pour la réponse rapide à l’hypoxie, il l’est également pour l’acclimatation à long terme à l’hypoxémie [38]. Le maintien de l’hyperventilation lors d’hypoxie chronique est permis par le développement d’une hypersensibilité des chémorécepteurs [39]. De plus, des conditions d’hypoxie chronique mènent à une augmentation
Réponses physiologiques à l’hypoxie
Fonctions cardiorespiratoires Angiogenèse et érythropoïèse Faibles taux d’O2 Corpuscule carotidien
L’hypoxie en situations physiologiques
Développement embryonnaire
Pendant le premier trimestre de la grossesse, des cellules trophoblastiques d’origine fœtale migrent et s’accumulent dans les artères spiralées de l’endomètre qui relient la circulation maternelle au placenta. Ce bouchon de cellules isole le fœtus de la circulation maternelle et provoque un gradient d’O2 entre la mère et le fœtus. Les cellules
trophoblastiques bloquent les artères spiralées jusqu’à la 12e semaine de grossesse, moment où le sang maternel commence à irriguer le placenta (38). Les premières semaines de développement se font donc dans un environnement hypoxique. Ce mécanisme de blocage des artères protège l’embryon des dommages oxydatifs puisque les enzymes antioxydantes comme la superoxyde dismutase ne sont exprimées qu’à partir de la 8e semaine (39,40).
Dans ce premier trimestre, la ppO2 dans le placenta est d’environ 17,9 mmHg en
comparaison avec l’endomètre à proximité où la ppO2 atteint 39,6 mmHg (41). En plus de
protéger l’embryon des dommages oxydatifs, des évidences de la littérature suggèrent également que cet état hypoxique favorise une meilleure différenciation des cellules souches embryonnaires (42). De plus, l’environnement hypoxique dans lequel se développe le fœtus stimule la vasculogenèse, soit la formation des premiers vaisseaux sanguins, ainsi que la formation et la maturation du cœur (43,44). Le développement du système vasculaire stimulé par l’hypoxie est régulé via l’expression de facteurs proangiogéniques par les HIF.
Le système vasculaire, formé pendant le développement fœtal, sera remodelé tout au long de la vie selon la demande en O2 et en nutriments des tissus (ex. croissance, blessure).
Ce remodelage vasculaire se fait via le processus d’angiogenèse. Les nouveaux vaisseaux sont formés grâce aux cellules endothéliales qui migrent à partir de vaisseaux préexistants pour former de nouveaux bourgeons vasculaires. La matrice extracellulaire (MEC) doit aussi être remodelée par des métalloprotéases matricielles qui dégradent la MEC pour permettre la migration des cellules. Ces processus sont régulés par plusieurs facteurs proangiogéniques, entre autres par le Vascular Endothelial Growth Factor, VEGF (45). Les cellules endothéliales sont normalement quiescentes mais ont le potentiel de migrer et de former de nouveaux vaisseaux en condition de stress hypoxique. En effet, le niveau d’O
constitue le régulateur principal de l’angiogenèse via les HIF qui favorisent l’expression de VEGF (46). Les HIF sont donc à la base de la cascade de signalisation qui régule le bourgeonnement de nouveaux vaisseaux afin d’assurer aux tissus une vascularisation adéquate et un apport en O2 suffisant (47).
Sport
Lors d’un exercice physique intense, la demande musculaire en O2 devient plus
grande que ce que le système respiratoire peut fournir, créant ainsi un stress hypoxique au sein des cellules musculaires (48,49). En effet, la ppO2 dans le muscle lors d’un exercice
peut atteindre un niveau aussi bas que 3 mmHg (50). L’état d’hypoxie locale causée par un effort musculaire de haute intensité induit une réponse transcriptionnelle par les HIF. Cette réponse permet de moduler la plasticité du muscle en induisant, par exemple, la formation de nouveaux capillaires sanguins via le VEGF ce qui contribue à améliorer la distribution d’O2 au niveau du muscle (51). L’activation des HIF dans cet environnement hypoxique
induit également l’expression de gènes impliqués dans la glycolyse pour répondre à la demande énergétique des cellules musculaires (52).
Puisque l’apport en O2 est insuffisant lors d’un effort intense, la chaine de transport
d’électrons et la phosphorylation oxydative sont bloquées. Les cellules musculaires ont donc plutôt recours à la glycolyse anaérobique pour la production d’énergie. Comme mentionné plus tôt, le pyruvate produit lors de la glycolyse est converti en lactate par l’enzyme lactate déshydrogénase. La réaction totale implique également du NADH qui est reconverti en NAD+. En effet, le but ultime de cette réaction est de régénéré du NAD+ qui est nécessaire pour maintenir active la glycolyse (53). Ce procédé métabolique permet de subvenir aux besoins énergétiques du muscle lors d’un effort prolongé.
Altitude
Comme mentionné plus tôt, l’atmosphère est composée à 21% d’O2, 78% d’azote et
1% d’un mélange d’autres gaz. Ces concentrations gazeuses sont constantes et indépendantes de l’altitude. C’est plutôt la pression atmosphérique qui diminue en haute
molécules d’O2 disponibles (54). Au niveau de la mer, la ppO2 est de 760 mmHg. À 5500m,
hauteur équivalente au camp de base de l’Everest, la ppO2 est diminuée de 50% tandis
qu’elle est réduite de 70% à 8900m, hauteur équivalente au sommet de l’Everest (55). Une acclimatation progressive à l’altitude est essentielle chez les grimpeurs qui escaladent de hauts sommets puisque le stress hypoxique induit par la diminution de la ppO2 peut provoquer le mal de l’altitude dont les symptômes comprennent des maux de
tête, des étourdissements, de l’insomnie et des nausées. Dans des cas plus graves, le mal de l’altitude peut également provoquer des œdèmes pulmonaires et cérébraux (55).
Les peuples qui vivent en altitude ont subi au fil du temps des adaptations physiologiques qui leur permettent de survivre dans ces endroits inadéquats. De manière intéressante, ces différents peuples ont subi des adaptations génétiques variées. Par exemple, les habitants des Andes qui vivent à plus de 1500m au-dessus du niveau de la mer ont naturellement un plus grand nombre d’érythrocytes et une concentration plus élevée d’hémoglobine qui varient en corrélation avec le niveau d’altitude (56). Ceci a pour avantage un meilleur transport sanguin de l’O2 malgré une diminution du nombre de
molécules disponibles. Étonnamment, d’autres études ont quant à elles montré que les Tibétains vivant jusqu’à 4000m d’altitude n’ont pas une concentration d’hémoglobine plus élevée que les valeurs de référence au niveau de la mer (57). Les mêmes données physiologiques ont été observées chez les peuples éthiopiens vivant dans les hauts plateaux est-africains (58). Ces différentes études ont donc montré que l’adaptation physiologique à l’altitude diffère selon les populations et qu’une concentration plus élevée d’hémoglobine n’est pas la réponse universelle (59).
La saturation en oxygène, soit le pourcentage d’hémoglobines qui transportent des molécules d’O2, est une mesure également utilisée pour étudier l’adaptation des différents
peuples à l’hypoxie en altitude. Par exemple, les Andins ont une plus grande saturation en oxygène que les Tibétains à la même altitude, suggérant une meilleure adaptation à l’hypoxie (60).
Des études relatant les différences d’adaptation à l’altitude chez les Andins et les Tibétains ont montré que ces variations physiologiques sont régulées via une expression différentielle de certains gènes chez les différents peuples vivant en altitude. Ces études ont également mis en évidence des polymorphismes nucléotidiques situés dans des gènes impliqués dans les voies de réponse à l’hypoxie régulées par les HIF (61-63). Plusieurs gènes ont donc été identifiés comme exerçant une sélection positive en réponse à l’hypoxie chez les peuples vivant en altitude.
L’hypoxie en situations pathologiques
Troubles pulmonaires
Certaines pathologies pulmonaires peuvent entrainer l’hypoxie physiologique. C’est entre autres le cas de la maladie pulmonaire obstructive chronique (MPOC) ainsi que du syndrome d’apnée obstructive du sommeil (SAOS). L’hypoxie est alors provoquée par une entrée insuffisante d’O2 dans la circulation sanguine qui peut être causée par différents
facteurs comme l’obstruction des voies respiratoires, de l’œdème, de l’inflammation, de la fibrose ou des dommages aux capillaires sanguins (64).
L’hypoxie provoquée par ces troubles pulmonaires peut causer de l’hypoxémie, soit le manque d’O2 aux organes et tissus, ce qui peut entrainer des complications systémiques
comme de l’inflammation, une dysfonction des muscles squelettiques et de la polyglobulie (augmentation anormale du pourcentage d’érythrocytes par rapport au volume sanguin) (65). Ces symptômes augmentent le risque de complications cardiovasculaires et la morbidité de la maladie.
Dans le cas de la MPOC, causée principalement par l’inhalation de la fumée de cigarette et par l’exposition à des polluants, l’hypoxie est provoquée par une destruction des capillaires alvéolaires. De manière intéressante, une étude a également montré que la fumée de cigarette altère l’expression des HIF ce qui affecte le processus d’angiogenèse et aggrave les symptômes d’hypoxie chez les patients atteints de la MPOC (66). Le principal traitement pour la MPOC est un apport supplémentaire en O2.
L’hypoxie est également un élément physiopathologique important du SAOS. Ce syndrome est causé par l’obstruction partielle ou complète des voies respiratoires supérieures ce qui entraine de l’hypoxie intermittente chronique (HIC). Dans ce cas, l’obstruction des voies respiratoires est généralement provoquée par une diminution du tonus vasculaire qui peut être due à plusieurs facteurs dont l’âge avancé et l’obésité. L’HIC et l’interruption fréquente du sommeil sont considérées comme des causes importantes de complications cérébrales et cardiovasculaires chez les patients atteints du SAOS. Ces
complications comprennent entre autres des thromboses vasculaires ainsi qu’un risque accru de subir un accident vasculaire cérébral ou de développer des maladies du cœur (67).
Qu’elle soit provoquée par l’altitude ou par un trouble pulmonaire, l’hypoxie systémique peut engendrer de l’hypertension pulmonaire provoquée par un épaississement des parois vasculaires. Dans des cas d’hypertension pulmonaire sévère, un remodelage vasculaire et de l’angiogenèse peuvent être observés au niveau des poumons (68). Ces processus régulés par les HIF sont mis en œuvre afin de diminuer la résistance de perfusion et de limiter l’hypertension au sein de la vascularisation pulmonaire (69).
Maladies cardiovasculaires
Les maladies cardiovasculaires constituent la deuxième principale cause de décès au Canada (70). Une des maladies cardiovasculaires majeures est l’infarctus du myocarde provoqué par le blocage d’artères coronariennes. Ce blocage est majoritairement dû à une accumulation de plaque d’athérosclérose contenant des facteurs thrombogènes et inflammatoires. La rupture de ces plaques stimule l’agrégation plaquettaire au site de lésion et l’activation du système de coagulation (71). Le thrombus qui en résulte et les débris d’athérosclérose peuvent bloquer l’apport sanguin au muscle cardiaque entrainant l’infarctus du myocarde (72). L’hypoxie locale provoquée par le blocage de la circulation sanguine est la principale cause de la nécrose des myocytes cardiaques, caractéristique de l’infarctus (73).
Par ailleurs, il est intéressant de constater que l’hypoxie n’est pas seulement une conséquence d’un arrêt cardiaque, mais peut également entrainer le développement de maladies cardiovasculaires. Par exemple, des études ont montré que l’HIC provoquée par le SAOS augmente l’expression de facteurs pro-inflammatoires via les HIF. De plus, ces études ont montré que l’HIC provoque l’expression de facteurs pro-apoptotiques chez les cellules endothéliales, altérant ainsi l’intégrité de l’endothélium vasculaire (74,75). Ensemble, l’inflammation et la dysfonction endothéliale sont des facteurs de risques importants pour le développement d’athérosclérose et de maladies coronariennes.
Cancer
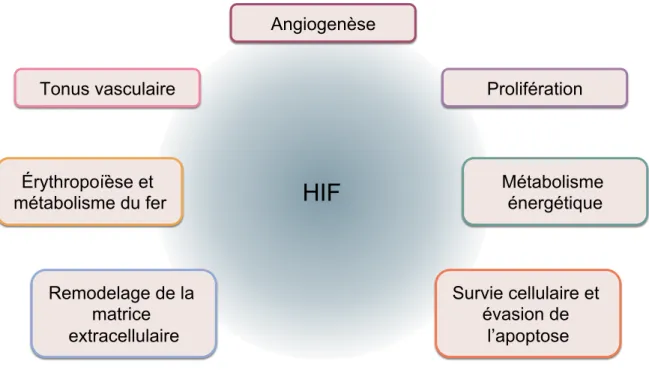
L’hypoxie est une particularité importante des tumeurs solides et joue un rôle majeur dans plusieurs caractéristiques principales du cancer (Figure 3) (76,77). L’hypoxie intratumorale se produit lorsque les cellules cancéreuses sont trop éloignées d’un vaisseau sanguin fonctionnel pour être adéquatement alimentées en O2 et nutriments. Afin de
survivre et de proliférer dans cet environnement défavorable, les cellules tumorales ont la capacité d’adapter leur métabolisme à l’hypoxie de plusieurs manières. Entre autres, elles effectuent la glycolyse anaérobique plutôt que la phosphorylation oxydative afin de répondre à leur besoin énergétique, la glycolyse anaérobique ne nécessitant pas d’O2 (78).
Il a d’ailleurs été montré dans la littérature que les HIF forcent la glycolyse anaérobique en inhibant la pyruvate déshydrogénase, bloquant ainsi la transformation du pyruvate en acétyl-CoA et son entrée dans le cycle de Krebs (79). Le pyruvate produit lors de la glycolyse est alors transformé en lactate qui s’accumule hors des cellules ce qui provoque une acidification du microenvironnement tumoral (80). De plus, les HIF jouent un rôle majeur dans la glycolyse en régulant l’expression de plusieurs enzymes glycolytiques. L’hypoxie et les HIF sont donc des régulateurs importants du métabolisme énergétique des cellules cancéreuses (81).
L’hypoxie joue également un rôle clé dans la vascularisation tumorale via l’angiogenèse. En effet, les cellules cancéreuses qui constituent une tumeur solide ont la particularité d’être éloignées des vaisseaux sanguins et donc d’être en environnement hypoxique. En réponse à cet état défavorable, les cellules tumorales ont la capacité de remodeler leur microenvironnement en stimulant la production de nouveaux vaisseaux sanguins. Ce processus d’angiogenèse est régulé grâce à l’expression de facteur pro-angiogéniques comme le VEGF via les HIF (82). De plus, les HIF activés en hypoxie ont également la capacité de limiter l’activité de facteurs anti-angiogéniques comme les thrombospondines afin de promouvoir la progression vasculaire et la perfusion tumorale (83,84). Par contre, malgré l’angiogenèse, les nouveaux vaisseaux formés au sein de la tumeur sont souvent anormaux, composés d’endothéliums fragiles et perforés (85). Cette vascularisation anarchique contribue à l’état hypoxique de la tumeur ainsi qu’au maintien de l’activité des HIF et de leur implication dans plusieurs processus tumoraux.
L’hypoxie est aussi impliquée dans l’invasion tissulaire et la formation de métastases, caractéristique tumorale qui constitue la principale cause de morbidité et de mortalité associées au cancer (86). La carence en O2 au sein d’une tumeur influence la
formation de métastase de plusieurs manières. D’abord, la formation de vaisseaux sanguins intratumoraux régulée par l’hypoxie permet aux cellules malignes de s’échapper de la tumeur primaire via la circulation sanguine et d’envahir d’autres tissus. Ensuite, l’adaptation des cellules cancéreuses à l’hypoxie, qui est maintenue via la vascularisation tumorale anarchique, leur procure un avantage prolifératif et augmente leur capacité d’invasion. En effet, les cellules tumorales hypoxiques sont davantage agressives, en plus de présenter une résistance aux agents thérapeutiques, ce qui leur procure un pouvoir métastatique important (87,88). Il a également été montré que l’hypoxie et les HIF promeuvent la transition épithélio-mésenchymateuse essentielle à l’intravasation, soit l’entrée des cellules tumorales dans la circulation sanguine (89,90).
Enfin, des études suggèrent également que l’hypoxie et les HIF jouent un rôle dans les autres caractéristiques du cancer dont la résistance aux signaux antiprolifératifs, l’autosuffisance en facteurs de croissance, la résistance à l’apoptose et l’évasion du système immunitaire, la capacité de réplication illimitée ainsi que l’instabilité génomique (91-94).
Figure 3. Implication des HIF dans plusieurs caractéristiques du cancer
Par leur activité transcriptionnelle, les HIF modulent la réponse hypoxique et procurent aux cellules tumorales plusieurs caractéristiques nécessaires à leur survie. Illustration adaptée avec permission de V.N. Lafleur (31) Angiogenèse Tonus vasculaire Érythropoïèse et métabolisme du fer Remodelage de la matrice extracellulaire Métabolisme énergétique Survie cellulaire et évasion de l’apoptose Prolifération
HIF
HIF, les facteurs de transcription induits en hypoxie
Généralités
Les HIF sont impliqués de manière non négligeable dans la réponse cellulaire adaptative à l’hypoxie. Ils constituent les régulateurs principaux de la réponse transcriptionnelle activée lors d’une carence en O2. En réponse à l’hypoxie, les voies de
signalisation et mécanismes régulés par les HIF ont des effets moléculaires et cellulaires mais également tissulaires et systémiques. Ces facteurs de transcription jouent donc un rôle majeur dans le maintien de l’homéostasie de l’oxygène.
La famille des HIF comprend trois membres; HIF-1, HIF-2 et HIF-3. Ces protéines font partie de la famille des facteurs de transcription bHLH-PAS (basic
helix-loop-helix-PER-ARNT-SIM) (95). Ces facteurs de transcription ont la particularité de former des
hétérodimères et sont capables de détecter et de répondre à des signaux environnementaux (96). Les HIF sont composés d’une sous-unité alpha (HIF-1α, HIF-2α, HIF-3α) qui leur est propre et d’une sous-unité bêta (HIF-1β) commune aux trois facteurs et qui est exprimée constitutivement. Les sous-unités alpha sont quant à elles finement régulées par les niveaux d’O2 (97).
Les domaines fonctionnels
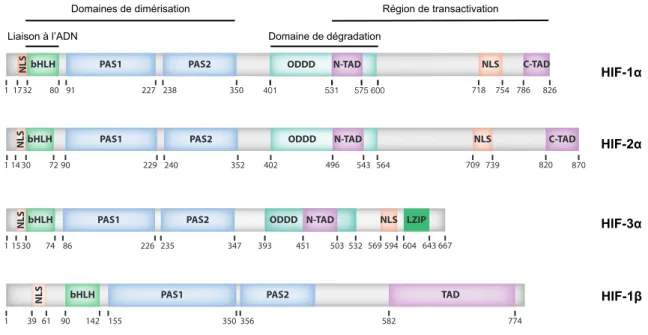
Les sous-unités HIF-α sont composées de plusieurs domaines fonctionnels (Figure
4). Elles possèdent entre autres des séquences de localisation nucléaire (NLS) afin d’être
transportées au noyau et effectuer la transcription (98). Leur domaine bHLH assure la liaison à l’ADN tandis que leurs régions PAS permettent l’hétérodimérisation des sous-unités alpha et bêta (99,100). L’activité transcriptionnelle des HIF est dépendante de leurs domaines de transactivation (TAD) situés en N-terminal (N-TAD) et en C-terminal (C-TAD). Ces deux domaines de transactivation sont séparés par un domaine inhibiteur qui réprime leur activité transcriptionnelle en condition normale d’oxygénation (101). Enfin, les HIF ont la particularité d’avoir un domaine de dégradation dépendant de l’oxygène (ODDD) (102). Ce domaine régule la stabilité de la sous-unité alpha selon les niveaux d’O2
Figure 4. Domaines fonctionnels des HIF
Représentation des sous-unités HIF-1α, HIF-2α, HIF-3α et HIF-1β. Illustration adaptée avec permission de V.N. Lafleur (31)
Différences entre les HIF
HIF-1α constitue le régulateur principal de la réponse cellulaire à l’hypoxie et la protéine la plus étudiée parmi cette famille de facteurs de transcription. Il y a également un grand intérêt de recherche pour HIF-2α qui est très semblable à HIF-1α dans sa structure et dans sa réponse à l’hypoxie (105). Les deux protéines régulent l’expression de gènes cibles communs, mais elles ont également chacune leur particularité pour certains gènes. Par exemple, 1α régule l’expression de gènes impliqués dans la glycolyse, tandis que HIF-2α est plutôt impliquée dans la production d’érythropoïétine (106). Une autre différence réside dans leur expression différentielle selon les tissus (107). Enfin leur différente sensibilité aux variations d’O2 constitue leur principale disparité. Il a été montré que
HIF-2α peut être stabilisée à des niveaux plus élevés d’O2 et que sa réponse est plus prolongée
dans le temps que celle de HIF-1α (108). La réponse de HIF-1α est donc associée à des périodes plus courtes d’hypoxie. La protéine HIF-3α, quant à elle, se distingue de HIF-1α et HIF-2α dans sa structure. En effet, HIF-3α est tronquée dans son domaine de transactivation en C-terminal ce qui lui procure un rôle d’inhibiteur pour les autres protéines HIF en agissant comme compétiteur pour les sites de liaison à l’ADN (109). Des
1
bHLH PAS1 PAS2 TAD
39 61 90 142 155 350 356 582 774
NLS
1
ODDD
bHLH PAS1 PAS2 N-TAD
15 74 86 226 235 347 393 451 532 667 NLS 30 569594 NLS 503 LZIP 643 604 1 ODDD
bHLH PAS1 PAS2 N-TAD C-TAD
14 72 90 229 240 352 402 543 564 820 870 NLS 30 709 739 NLS 496 1 ODDD
bHLH PAS1 PAS2 N-TAD C-TAD
17 80 91 227 238 350 401 531 575 600 786 826 NLS 32 718 754 NLS ODDD N-TAD 401! 531! 575! 600! HIF-1β HIF-3α HIF-1α HIF-2α Domaines de dimérisation
Liaison à l’ADN Domaine de dégradation
études récentes ont également montré que HIF-3α peut aussi réguler positivement l’expression transcriptionnelle de certains gènes (110,111). Les rôles de HIF-3α semblent donc variés, mais les études sur cette protéine sont encore restreintes.
Bien que la régulation de HIF-2α et de HIF-3α nous intéresse également, la majorité de nos travaux porte sur HIF-1α. Cette décision s’explique par le fait que HIF-1α est le régulateur principal de la réponse à l’hypoxie et que nous disposons de tous les outils nécessaires pour l’étude de cette protéine.
Régulation dépendante de l’oxygène (ubiquitination)
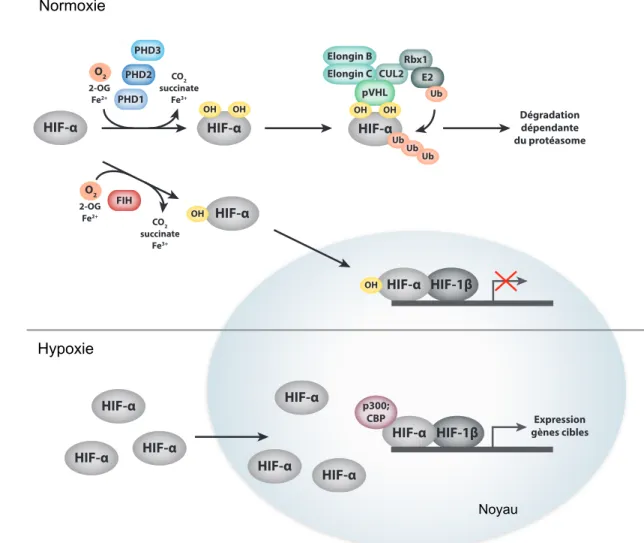
Les HIF sont régulés principalement de manière post-traductionnelle via les niveaux d’O2. Ce mécanisme de régulation fait intervenir deux types de protéines, les enzymes à
domaine prolyl-hydroxylase (PHD; prolyl-hydroxylase domain) et le facteur d’inhibition de HIF (FIH; factor inhibiting HIF) (112,113). Ces enzymes sont des dioxygénases dépendantes du fer (Fe2+) et du 2-oxoglutarate (2-OG). Elles régulent respectivement la stabilité et l’activité transcriptionnelle des sous-unités alpha via l’hydroxylation de résidus spécifiques (114).
Le premier niveau de régulation dépendante de l’oxygène est effectué par les PHD. En présence d’O2, les sous-unités alpha sont hydroxylées par les PHD sur des résidus
prolines spécifiques dans leur domaine ODDD (115,116). La modification post-traductionnelle de ces résidus prolines constitue un site d’ancrage pour la protéine von Hipple-Lindau (pVHL) qui permet par la suite le recrutement du complexe d’ubiquitine ligase E3 (117). La poly-ubiquitination des sous-unités alpha par le complexe E3 mène finalement à leur dégradation par le protéasome (118). Au contraire, en absence d’O2,
l’activité des PHD est inhibée entrainant la stabilisation des sous-unités alpha. Le complexe HIF-α/HIF-1β peut alors s’assembler et se lier au gène cible sur la séquence régulatrice HRE (hypoxia response element) afin d’induire la réponse transcriptionnelle (119).
une plus grande affinité pour l’O2 et pour ses cofacteurs comparativement aux PHD (120).
FIH régule donc l’activité des HIF même en faibles conditions d’oxygénation. FIH catalyse l’hydroxylation d’un résidu asparagine dans le domaine de transactivation au niveau de l’extrémité C-terminale des HIF-α (121). L’hydroxylation de ce résidu asparagine bloque l’interaction entre HIF-α et ses coactivateurs transcriptionnels p300 et CBP (CEBP binding
protein), inhibant par le fait même son activité transcriptionnelle (122).
Figure 5. Régulation des sous-unités alpha dépendante de l’oxygène
L’hydroxylation des HIF-α en normoxie par les PHD et le FIH régulent respectivement la stabilisation des sous-unités alpha et leur activité transcriptionnelle. En condition hypoxique, les HIF-α stabilisées s’assemblent avec HIF-1β afin d’induire la transcription de gènes cibles. Illustration par V.N. Lafleur (31)
oxygénées HIF-α HIF-α PHD1 OH OH PHD2 PHD3 CO2 succinate Fe3+ 2-OG Fe2+ CUL2 Elongin C pVHL Rbx1 E2 HIF-α OH OH Ub Ub Ub Ub Dégradation dépendante du protéasome Elongin B O2 FIH HIF-α OH CO2 succinate Fe3+ 2-OG Fe2+ HIF-1β HIF-α OH O2 HIF-1β HIF-α HIF-α HIF-α HIF-α p300; CBP Expression gènes cibles HIF-α HIF-α HIF-α Conditions hypoxiques Normoxie Hypoxie Noyau
Régulation par la méthylation
En plus de leur régulation par l’hydroxylation, la stabilisation et la fonction des HIF-α peuvent également être régulées par d’autres modifications post-traductionnelles, entre autres via la méthylation. La méthylation de protéines est effectuée par des enzymes méthyltransférases qui utilisent la molécule S-adénosyl-méthionine (SAM) pour transférer un groupement méthyle sur un résidu lysine ou arginine (123,124). Il a d’ailleurs été montré que la méthylation de résidus lysines dans le domaine de transactivation de la sous-unité HIF-1α inhibe son activité transcriptionnelle (125). De plus, la méthylation de lysines au niveau du domaine bHLH des HIF-α réprime la transcription de gènes cibles en limitant la capacité de liaison au promoteur HRE (126). Enfin, une étude a également montré que la méthylation de lysines spécifiques augmente l’ubiquitination et la dégradation protéasomale de HIF-1α. La méthylation constitue donc une autre modification post-traductionnelle capable de réguler la stabilisation des sous-unités alpha indépendamment du niveau d’oxygène et de l’hydroxylation (127).
La méthylation d’arginine peut également moduler la fonction et la stabilité des HIF. Cette modification post-traductionnelle est majoritairement associée au contrôle de l’expression des gènes via la modulation des histones mais elle peut également réguler d’autres protéines (128). Elle est d’ailleurs impliquée dans plusieurs fonctions cellulaires soit la transcription, la réparation de l’ADN et la signalisation cellulaire (129). La méthylation d’arginine est effectuée par les enzymes PRMT (Protein Arginine
Methyltransferases), une famille protéique qui contient neuf membres et dont l’enzyme
principale est PRMT1 (Figure 6) (130,131). PRMT1 est particulièrement impliquée dans la transcription et la signalisation cellulaire, suggérant son rôle dans la réponse à l’hypoxie (132). En effet, plusieurs études ont montré que les enzymes PRMT ont la capacité de moduler la réponse hypoxique en régulant la traduction et la stabilisation de HIF-1α (133-135).
Figure 6. Méthylation d’arginines par les PRMT
Les PRMT peuvent diméthyler les résidus arginines de façon symétrique ou asymétrique en passant par un intermédiaire monométhylé. Illustration par V.N. Lafleur (31)
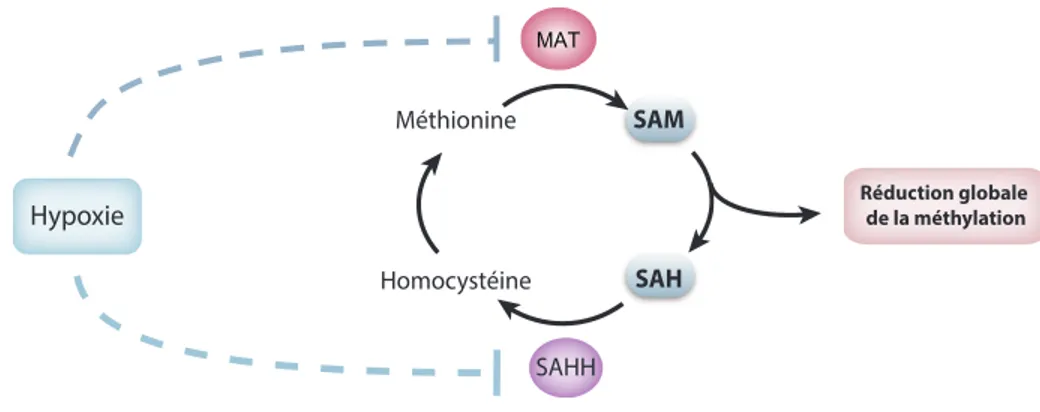
Par ailleurs, il est connu dans la littérature que le niveau protéique du donneur de méthyle SAM est réduit en hypoxie (Figure 7). Dans la cellule, SAM est produit par l’enzyme méthionine adénosyltransférase (MAT) dont l’expression est régulée par l’hypoxie. En effet, des études ont montré que l’hypoxie limite la transcription de MAT ce qui a pour conséquence de diminuer la production de SAM et de réduire l’activité des PRMT (136-138). Il existe donc une dynamique intéressante entre la méthylation par les PRMT et la réponse hypoxique régulée par les facteurs de transcription HIF.
Figure 7. Régulation du niveau de SAM en hypoxie
La SAM est produite dans la cellule par l’enzyme MAT. En situation hypoxique, cette enzyme est inhibée, diminuant par le fait même la quantité de SAM dans la cellule et la réaction globale de méthylation. Illustration adaptée avec permission de V.N. Lafleur (31)
H2N NH2 NH + H2N NH NH + CH3 HN NH NH + CH3 SAM SAH CH3 Arginine MMA SDMA Arginine Arginine PRMT Type I, II, III
SAM SAH PRMT type I SAH SA M PRM T typ e II Type I: PRMT 1, 2, 3, 4, 6, 8 Type II: PRMT 5, 9 Type III: PRMT 7 Méthionine Homocystéine MAT SAHH H2N N NH + CH3 CH3 ADMA Arginine SAM SAM SAM Méthionine Homocystéine SAHH MAT1A MAT2A SAM SAH Hypoxie HIF-1 Réduction globale de la méthylation MAT
Régulation via la voie MAPK
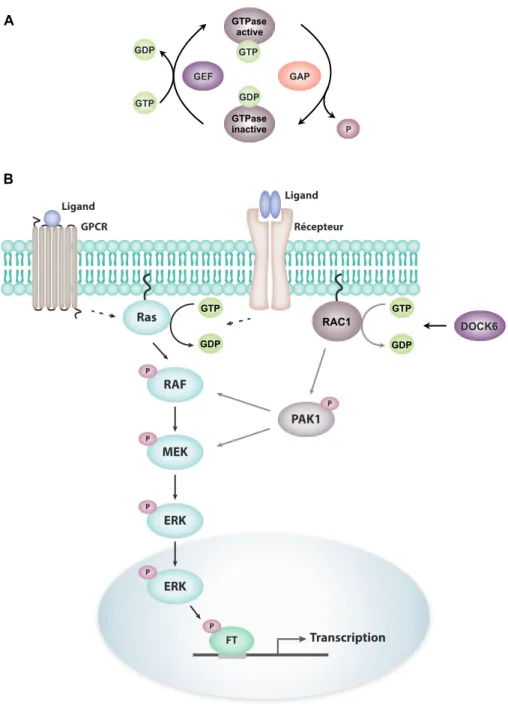
La voie des kinases mitogéniques MAPK (mitogen-activated protein kinases) est un regroupement de protéines sérine/thréonine kinases qui interagissent afin de convertir différents stimuli extracellulaires en une variété de réponses cellulaires. Elle est impliquée dans la régulation de plusieurs processus cellulaires, notamment la prolifération, la migration, la différentiation, la réponse au stress et la progression du cycle cellulaire (139). La voie MAPK est généralement composée de trois kinases qui permettent la transduction de signaux via la phosphorylation de protéines en aval, soient une MAPK, une MAPK kinase (MAPKK) et une MAPKK kinase (MAPKKK). Une des principales cascades protéiques MAPK est entre autres composée des kinases RAF (MAPKKK), MEK (MAPK/ERK kinase; MAPKK) et ERK1/2 (extracellular signal-regulated kinases; MAPK) (140).
La transduction de signal s’effectue à partir de récepteurs de type tyrosine kinase (RTK; receptor tyrosine kinases) ou de récepteurs couplés aux protéines G (GPCR;
G-protein-coupled receptors) présents à la membrane qui sont activés par différents stimuli
extracellulaires, dont des facteurs de croissance, des cytokines et des hormones (141). La liaison d’un RTK avec son ligand permet l’activation du récepteur via son autophosphorylation sur des résidus tyrosines. La phosphorylation de ces résidus tyrosines permet l’interaction du récepteur avec une protéine adaptatrice contenant un domaine SH2 (Src Homology 2) capable de lier les tyrosines phosphorylées. La protéine adaptatrice forme alors un complexe avec un facteur d’échange de nucléotides guanyliques (GEF;
guanine nucleotide exchange factors) qui active la GTPase RAS via l’échange GDP/GTP.
L’activation de RAS lui permet d’interagir avec ses cibles effectrices, dont RAF qui est une des kinases initiatrices de la voie MAPK (142,143). Dans le cas des GPCR, la liaison d’un ligand induit un changement de conformation du récepteur ce qui lui permet d’agir en tant que facteur d’échange de nucléotides guanyliques. L’échange GDP/GTP induit ensuite l’activation d’une protéine G qui peut à son tour activer RAF via la phosphorylation (144,145).