Production de substituts du LCA de seconde génération
par génie tissulaire
Thèse
Jadson Moreira Pereira
Doctorat en biologie cellulaire et moléculaire
Philosophiæ doctor (Ph. D.)
Production de substituts du LCA de seconde génération
par génie tissulaire
Thèse
Jádson Moreira-Pereira, m.d., M.Sc.
Sous la direction de:
Sylvain G. Bourgoin, directeur de recherche
Résumé
Ce projet de recherche porte sur la reconstruction du ligament croisé antérieur du genou (LCA) par génie tissulaire. Fréquente chez les sportifs et les personnes actives, la rupture du LCA compromet la stabilité fonctionnelle du genou. Notre équipe de recherche a développé un ligament reconstruit par génie tissulaire qui pourrait éventuellement servir d’option de remplacement, suite à une rupture du LCA. Notre modèle expérimental étant la chèvre, les expériences de greffe sur des périodes variant entre 1 et 13 mois, ont démontré une revascularisation, une innervation, un renouvellement de la matrice, la formation de cartilage structuré aux insertions osseuses, ainsi qu’un gain de force et de rigidité. Dans le but d’optimiser la procédure de production et d’implantation en prévision d’éventuels essais cliniques, des tests ont été effectués in vitro pour préparer une prochaine série de greffes d’un substitut du LCA de 2e
génération. Ce nouveau substitut ligamentaire n’est pas ancré par des blocs osseux, alors sa fixation à l’articulation du genou sera effectuée en utilisant des endoboutons, une pratique devenue courante en chirurgie de reconstruction du LCA (Chapitre 1). L’adaptation de la technologie aux méthodes d’implantation privilégiées en clinique constitue une étape essentielle pour évaluer son potentiel chez l’humain. La conception et la production de substituts du LCA par génie tissulaire présentent un potentiel très intéressant et prometteur au plan clinique.
Table des matières
Résumé ... iii
LISTE DES FIGURES ... vi
LISTE DES TABLEAUX ... vii
Liste des abréviations ... viii
Message personnel ... ix
Dédicace spéciale ... x
Remerciements ... xi
Avant-propos ... xiii
INTRODUCTION: RUPTURE DU LCA: ÉTAT DE LA QUESTION ... 1
PROBLÉMATIQUE CLINIQUE ... 1
OPTIONS DE REMPLACEMENT DU LCA RUPTURÉ ... 1
L'articulation du genou: composantes anatomiques et fonctions ... 2
Le LCA: éléments matriciels et fonctionnels ... 3
Formation et assemblage du réseau de fibres de collagène ... 4
Structures nerveuses du LCA... 5
Structures vasculaires du LCA ... 7
Problèmes cliniques liés au remplacement d’un LCA rupturé ... 8
Fonction du LCA dans l'articulation du genou ... 9
Cicatrisation compromise du LCA blessé ... 9
Impact du LCA déchiré sur la force, la stabilité et l'arthrose du genou ... 11
Approches chirurgicales actuelles pour rétablir la fonction du genou après une lésion du LCA ... 12
Tendon autologue pour remplacement du LCA déchiré ... 13
Implantation d’allogreffe de cadavre. ... 13
Expérimentation animale ... 14
Le lapin ... 14
La chèvre... 15
Le chien ... 16
Cellules ensemencées (cellules souches, sources de cellules autologues) ou substituts du LCA acellulaires? ... 16
Biomatériaux: synthétiques, natifs ou les deux?... 18
Rôle de la stimulation biomécanique en génie tissulaire ... 19
Différents substituts du LCA issus du génie tissulaire ... 20
Modélisation du substitut du LCA in vitro ... 20
Implantation du substitut dans le modèle animal caprin. ... 24
Objectifs et hypothèses de travail ... 27
Objectif général ... 27
Objectifs spécifiques : ... 27
Hypothèses de travail : ... 28
Chapitre 1 : Manuscrit scientifiqueSubstitut ligamentaire produit par génie tissulaire pour remplacer le LCA rupturé: adaptations pour des applications cliniques. ... 29
Substitut ligamentaire produit par génie tissulaire pour remplacer le LCA rupturé: adaptations pour des applications cliniques. ... 30
RÉSUMÉ ... 31
ABSTRACT ... 33
INTRODUCTION ... 34
MATERIALS AND METHODS ... 37
Preparation of acellular graftable bACLs ... 37
Surgical procedures for implantation of acellular bACLs into 3 goats. ... 38
Histological analysis of bACLs before and after implantation, ex-vivo. ... 38
Mechanical analyses. ... 38
Goat dermal fibroblasts. ... 39
Preparation of a second generation of graftable bACLs. ... 39
Surgical testing. ... 40
Mechanical characterization of the braided thread scaffold. ... 41
Histological analyses of the scaffold. ... 41
RESULTS ... 42
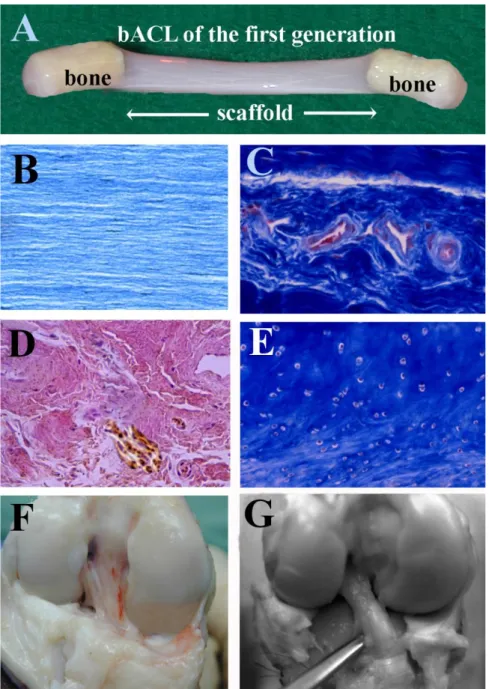
Successful grafting of the first generation of acellular bACLs. ... 42
Endobutton fixations of bACLs. ... 44
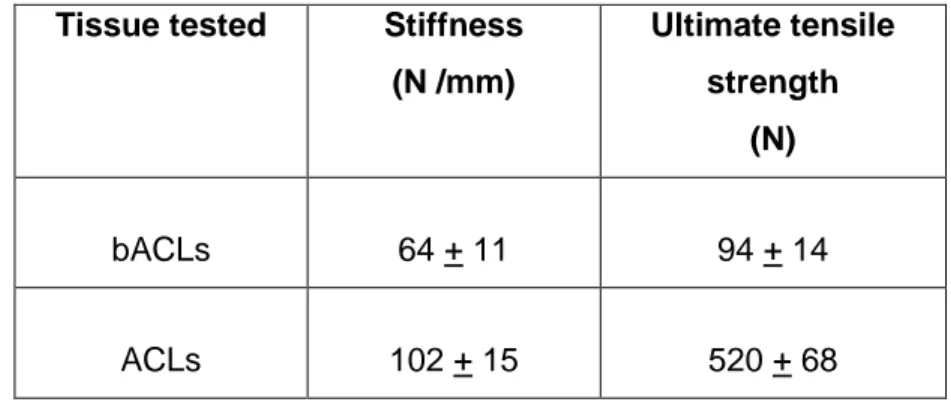
Strength of the braided thread. ... 46
Discussion ... 49
Acknowledgements: ... 51
CONCLUSION ... 53
Substituts du LCA de première génération ... 53
Nouvelle réalité clinique ... 54
Mise à niveau technologique ... 55
Substitut du LCA de seconde génération. ... 56
Perspectives ... 59
BIBLIOGRAPHIE ... 64
Annexe 1: Production of tissue-engineered human 3D bronchi in vitro ... 73
Annexe 2: Role of seaweed laminaran from S. longicruris on matrix deposition during dermal tissue-engineered production. ... 93
LISTE DES FIGURES
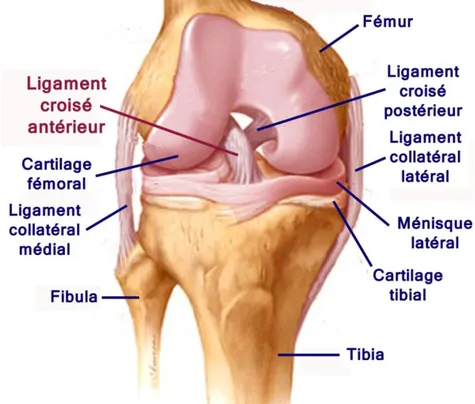
Figure 1 : Structures anatomiques de l’articulation du genou ... 2
Figure 2 : Greffe chez la chèvre d’un substitut du LCA produit par génie tissulaire. ... 15
Figure 3 : Deux chèvres greffées depuis 1 semaine. ... 16
Figure 4 : Montage de culture d’un substitut du LCA sous tension statique. ... 22
Figure 5 :.Coupe histologiques colorées au Thrichrome de Masson ... 24
Figure 6 : Étapes de la production d’un substitut du LCA par génie tissulaire ... 26
Figure 7 : Biocompatibilité d’un fil chirurgical résorbable in vitro ... 26
Figure 8 : Substitut du LCA cultivé in vitro, ancré par deux blocs osseux ... 25
Figure 9 : Implantation d’un substitut du LCA. ... 25
Figure 10 : Coupe histologique d’un bACL greffé 6 mois…. ... 25
LISTE DES TABLEAUX
Tableau 1 : Valeurs moyennes de résistance des greffons in vitro (n = 6), sans le
fil de suture qui relie les deux ancrages osseux. ... 23
Table I : Mechanical features of acellular bACLs grafted for 6 months… ... 44
Table II : Mechanical features of the Vicryl braided thread.. ... 47
Liste des abréviations
LCA – ligament croisé antérieur du genou BSA – sérum de l’albumine bovine
bACL – bioengineered ACL
DME – milieu d’Eagle modifié par Dulbelcco NGF – facteur de croissance nerveux
Entre a flor e a raiz existe o tempo
Dédicace spéciale
À toi minha mainha’… J’ai cherché parmi nos chansons préférées quelque chose qui pourrait mieux représenter nos escapades en voiture à Bahia, Sao Paulo et à Rio, qu’ont a tant aimées. Ces moments nous appartiennent juste à nous… Mais, en cherchant les chansons – et pleurant aussi, tu le sais! – j’ai réussi à trouver cette exhortation dans une des chansons de Maria Bethânia, notre chanteuse préférée. Et voilà les mots que tu m’avais souvent dits lorsqu’on traversait des moments difficiles. Tu m’apportais toujours une tasse de café frais et me rappelais que nous étions forts derrière nos larmes!
Extrait du DVD, Cartas de Amor (Maria Bethânia) Je ne marche pas seul
La peur ne peut pas m'atteindre Dans le désert je me retrouve
Mes pieds reçoivent des pommades, onguents doux des mains de Marie Sœur de Marthe et Lazare, dans l'oasis de Béthanie
Tu crois que je marche seul? Regarde mieux le temps:
Ça ne commence pas, ça ne finit pas Est jamais, est toujours…
Il est temps de noter la balance fait en cuivre noble que Dieu équilibre Détruit l'injuste, laisse la justice nue…
Je suis comme une ligne fine que la moindre brise peut plier Mais qu'aucune épée ne coupe.
Remerciements
Premièrement et avant tout je remercie à Dieu qui m’a permis d’arriver jusqu’ici avec la résilience nécessaire pour franchir des barrières, faire face aux obstacles les plus sombres avec ma dignité et ma volonté de vivre.
Je suis très reconnaissant à mon directeur de recherche, le Dr Sylvain Bourgoin, ainsi qu’à la Dre Francine Goulet, co-directrice, de m’avoir permis de travailler sur ce projet de recherche. Je remercie également les évaluateurs de ma thèse: le Dr Pedro Campos-Lima, évaluateur externe, le Dr Stéphane Bolduc et le Dr Robert Faure, évaluateurs internes, qui ont accepté de consacrer temps et énergie à l’analyse de mes travaux de recherche. Je dis aussi un grand merci au Dr Jean Charron, directeur du programme de Biologie cellulaire et moléculaire et également directeur de mon comité de thèse. Depuis son arrivée, il s’est toujours révélé disponible et efficace pour la gestion des différents aspects associés à la rédaction et au dépôt de ma thèse de doctorat.
Je désire exprimer toute ma reconnaissance et mon admiration au Dr. Stéphane Chabaud, qui pendant mes études m’a beaucoup enrichi à travers nos discussions très prolifiques et des idées toujours sensées. Un grand merci aussi à M. Franck Simon pour son expertise et ses conseils ainsi que pour son empathie lors de mes périodes intenses de maladie. Merci à tout le personnel du Laboratoire d’Organogénèse Expérimentale / LOEX qui m’a soutenu pendant ma période de formation, spécialement M. Sébastien Larochelle, Mmes Caroline Simard-Bisson et Syrine Arif, ainsi que Loraine Andrée-Parent, qui est devenue une très bonne amie au fil du temps et que je garde en très haute estime.
Également, je remercie le Conseil National de la Recherche du Brésil (CNPq) et l’Université Laval (FMED, BBAF, etc.) pour leur soutien financier pendant mes études. Ma reconnaissance va aussi au Dr. Serge Rivest et au Dr. Stéphane
Bolduc pour l’octroi des aides financières qui m’ont permis de reprendre mes études après mon congé médical. Merci de votre sensibilité/humanité envers moi. Dans le même sens, je ne peux pas oublier l’aide et le soutien sincère de la Dre. Josée Lavoie lors des moments extrêmement difficiles. Sans votre esprit conciliateur je pense que je n’y serais jamais arrivé.
Merci à mes amis des familles Légaré et Lachance qui m’on accueilli avec chaleur. Un merci spécial également à Richard Légaré qui m’avait pris en charge à mon arrivé et qui m’a beaucoup aidé pendant une bonne période de temps. Un incommensurable merci à ma compatriote Josy Naud, présence constante dans mes moments les plus dramatiques.
Finalement, ma plus profonde reconnaissance envers deux personnes qui sont les responsables majeures de l’aboutissement de cette thèse et qui ont marqué positivement ma vie pour toujours: ma co-directrice la Dre Francine Goulet et mon frère et meilleur ami, le Dr. Sérgio Paulo Jozely Sousa. J’ai une dette immatérielle envers vous deux. À la Dre. Goulet je dis merci pour tous les mots d’encouragement et pour sa présence constante lors des périodes les plus difficiles et handicapantes de ma maladie. Vous avez fait une telle preuve d’humanité, bienveillance et générosité envers moi, que seulement Dieu pourrait vous récompenser. À Sérgio, je remercie Dieu pour la chance de t’avoir dans ma vie et aucun mot que je pose sur ce texte ne sera jamais à l’hauteur de votre bonté et générosité. Pendant tous mes moments de douleur, de désespoir, d’incompréhension et même quand j’ai frôlé la mort, vous étiez toujours à mon appui et à mon chevet.
Avant-propos
Mes travaux au doctorat s’inscrivent dans le domaine de la reconstruction de tissus humains au Centre Multidisciplinaire de développement du génie tissulaire (CMDGT). Ils m’ont permis d’élargir mes connaissances en génie tissulaire, une science qui se développe en faisant appel à différentes notions en médecine, en biologie cellulaire et moléculaire, en histopathologie, en immunologie, et en génie mécanique. J’ai travaillé sur la culture de peau, mais la reconstruction ligamentaire aura été mon principal intérêt de recherche.
Pour qu’une équipe de recherche en génie tissulaire atteigne ses objectifs fondamentaux et cliniques, il lui faut regrouper des personnes qui travaillent en synergie et dont les expertises sont complémentaires. Les professionnels de la santé qui s’impliquent en ce domaine de recherche apportent un point de vue clinique fort utile pour cibler les besoins pertinents et réels en santé. Les discussions interdisciplinaires stimulent la créativité et l’audace, ajoutent des ressources et génèrent des solutions bénéfiques pour la population. C’est dans cette optique que j’ai participé à l’évolution de ce projet.
Le grand objectif de ce projet demeure la création d’un substitut du LCA qui soit accessible à toute personne ayant besoin de remplacer un LCA rupturé. Du grand athlète au jeune joueur de soccer ou de football, chacun devrait pouvoir bénéficier d’un nouveau ligament, sans devoir sacrifier un tendon sain de son genou. C’était le souhait de l’orthopédiste qui avait initialement suggéré ce projet, le Dr Albert Normand, décédé d’un cancer à l’Hôpital du St-Sacrement. Ce projet s’est développé en collaboration avec deux de ses collègues chirurgiens-orthopédistes et des ingénieurs mécaniciens. Les résultats obtenus sont extrêmement impressionnants et prometteurs.
Un article est issu de mes travaux. Il sera soumis à un journal spécialisé en orthopédie tel Journal of Bone and Joint Surgery, dès que tous les auteurs auront
lu, révisé et approuvé son contenu. Ma contribution dans ce travail a été 1) de procéder aux analyses histologiques par la coloration de Holmes, pour mettre en évidence les terminaisons nerveuses libres dans les greffons acellulaires implantés pendant 6 mois, 2) de participer au design de la 2e génération de substituts du LCA et 3) à la rédaction et au montage des figures de l’article.
Lors de mes études doctorales, j’ai également développé des collaborations fructueuses avec des collègues qui m’ont permis de participer à l’écriture du chapitre intitulé «Production of Tissue-Engineered Human 3D Bronchi In Vitro», du livre «Cells and Biomaterials in Regenerative Medicine» (INTECH), au cours de l’année 2014. À nouveau, en 2015 et à titre de collaborateur, j’ai contribué à la rédaction et a la publication de l’article scientifique intitulé: «Role of seaweed laminaran from S. longicruris on matrix deposition during dermal tissue-engineered production», publié dans «International Journal of Biological Macromolecules».
Je me considère privilégié d’être aujourd’hui suffisamment en santé pour rédiger ma thèse de doctorat et de pouvoir la défendre. Ayant frôlé la mort au cours des dernières années, je suis très heureux d’avoir l’opportunité de terminer mes études au doctorat. Je m’accroche à cette phrase souvent citée au Québec: «Dans la vie, ce qui ne nous tue pas nous rend plus fort!»
INTRODUCTION:
RUPTURE DU LCA: ÉTAT DE LA QUESTION
PROBLÉMATIQUE CLINIQUE
OPTIONS DE REMPLACEMENT DU LCA RUPTURÉ
En 2019, la population est incitée à bouger, à faire de l’activité physique afin de combattre la sédentarité souvent associée à un travail de bureau. Cependant, la pratique d’activités sportives comporte certains risques. La rupture du ligament croisé antérieur (LCA) du genou est une blessure assez fréquente chez les sportifs de niveau professionnel, mais aussi chez les personnes qui pratiquent des activités de tous les niveaux d’intensité. Plus de 120 000 ruptures complètes du LCA par année sont rapportées aux États-Unis (Langer and Vacanti, 1993), dont au-delà de 50 000 nécessiteront une reconstruction complète (Frank and Jackson, 1997). La rupture complète de ce ligament intra-articulaire compromet la stabilité du genou. Il existe des alternatives chirurgicales de remplacement du LCA suite à une rupture complète. L’option la plus souvent appliquée est soit l’utilisation du tiers central du tendon patellaire du patient, ou de l’un de ses tendons de la patte d’oie, dont le tendon semi-tendineux, le gracile ou le sartorius. Ceci implique la perte partielle ou totale d’un tendon autologue. Le génie tissulaire permet de reconstruire un ligament en laboratoire qui évite la morbidité associée à la perte de tissus sains. En plus d’être biocompatible, le greffon produit par génie tissulaire pourra être utilisé comme modèle d’étude, in vitro et in vivo, de différenciation cellulaire, de réparation du LCA et de régénération de la matrice. En effet, cette thèse aborde le domaine de la régénération de LCAs produits par génie tissulaire, utilisant la chèvre comme modèle expérimental. Le degré d’intégration de substituts ligamentaires greffés dans le genou caprin sera documenté et discuté, incluant la revascularisation, la réinnervation, le remodelage matriciel combiné à la néoformation de fibres de Sharpey associée à un gain de force. L’adaptation des procédures de production et d’implantation du substitut ligamentaire est à l’étude, de façon à rendre éventuellement l’option accessible partout et pour tous les patients susceptibles d’en bénéficier.
L’articulation du genou: composantes anatomiques et fonctions
L'articulation du genou est de type trochléenne uniaxiale qui permet les mouvements de flexion, d'extension ainsi qu’une légère rotation en position fléchie. Les quatre os qui la composent sont le tibia (plateau tibial), la fibula et les deux condyles du fémur, entre lesquels se situe la trochlée fémorale, qui s'articule avec la rotule qui recouvre l’articulation sur la face antérieur du genou. Il s’agit d’une articulation synoviale, où les os se joignent au niveau d'une cavité qui contient le liquide synovial. Ce liquide est une source d’oxygène et de nutriments pour le cartilage. En effet, le tibia et les condyles fémoraux sont recouverts de cartilage hyalin, riche en acide hyaluronique et en glycoaminoglycanes (GAG), qui protège et en lubrifie la surface. Les composantes anatomiques du genou sont nombreuses (figure 1). La capsule articulaire comprend une couche externe fibreuse attachée au périoste des os adjacents, ainsi qu’une couche interne, la membrane synoviale, formée de tissu conjonctif lâche. Elle contribue à la stabilisation de l'articulation et à la proprioception. (Tortora & Anagnostakos, 1981).Figure 1 : Structures anatomiques de l’articulation du genou gauche.
Les ligaments relient et stabilisent les os donc jouent un rôle indispensable dans le maintien de la stabilité articulaire. Contribuant à la proprioception, ils participent à l'orientation du mouvement et limitent les déplacements osseux d’amplitude excessive. Les ligaments croisés sont intra-articulaires, recouverts par la membrane synoviale. Les ligaments collatéraux stabilisent le genou en étant placés hors de la cavité articulaire, reliant au fémur avec le tibia du côté externe de l’articulation et avec la fibula du côté interne. Les ménisques situés en appui sur le plateau tibial agissent comme des coussins qui absorbent les chocs transmis à l'articulation du genou. Ils sont donc exposés et souvent fissurés par les traumatismes articulaires violents.
Le LCA: éléments matriciels et fonctionnels
La principale composante de la matrice des ligaments, comme celle des tendons, est le collagène. En fait, 90 % du collagène d’un vertébré est de type I. Comme dans la peau, on y retrouve les collagènes de types I et III, (Van der Rest et Garrone, 1991. Le LCA est aussi composé à 88% de collagène de type I. Lorsque utilisé comme matrice pour des reconstructions, le collagène est biocompatible, très peu antigénique et chémotactique pour les fibroblastes et autres types cellulaires (Dunn et coll., 1992). Les éléments de la matrice des ligaments sont sécrétés par les cellules, notamment les fibroblastes, également responsables du type de collagène produit (Amiel et coll., 1984). L’acide ascorbique, ou vitamine C, est un inducteur de synthèse du collagène, (Kipp et Schwarz, 1990). Cette propriété de l’ascorbate est cohérente avec son usage pour traiter le scorbut, maladie dégénérative du tissu conjonctif dû à une carence en vitamine C (Chambial et coll., 2013). Dans le LCA, les faisceaux de collagène sont organisés selon un patron matriciel ondulé, qui rappelle un peu la structure d’un accordéon. Avec les protéoglycanes, l’acide hyaluronique et l’élastine, le collagène confère la résistance requise aux forces de tension, au cisaillement et aux stress multiaxiaux auxquels le LCA est exposé in vivo (Strocchi et coll., 1992).
Formation et assemblage du réseau de fibres de collagène
Les fibres de collagène sont produites par les cellules qui colonisent un tissu. Par contre, ce ne sont pas les cellules qui sont responsables de l’alignement des fibres de collagène. Avec ou sans cellule, les fibres s’alignent dans la direction de la tension à laquelle elles sont soumises. Mais comment ces fibres se forment-elles?
La structure de la molécule de collagène, riche en glycine et en proline, se compose de trois chaînes de pro-collagène, aussi appelées chaînes (1, 2 ou
3), organisées en torsade. Leur séquence en acides aminés suit souvent la configuration Gly-Pro-x ou Gly-X-Hyp, où X peut être n'importe lequel de divers autres résidus d'acide aminé. Les chaînes sont stabilisées par des liaisons hydrogène entre l'hydroxylysine et l'hydroxyproline et des liaisons covalentes, (Berg et Prockop, 1973). La glycine est un petit acide aminé. Sa chaîne latérale n’est constituée que par un atome d’hydrogène. La proline est un acide aminé dont la chaîne latérale se replie pour rejoindre son groupement aminé. La chaîne latérale de la proline dépasse l’axe principal de la chaîne polypeptidique comme l’anse d’une tasse. La rigidité associée à cette conformation particulière empêche la proline de participer à la formation d’une hélice . Une fibre de collagène peut être hétérogène (chaînes
différentes) ou homogène (chaînes
identiques) selon le type de collagène synthétisé. La structure du collagène de type I est hétérogène, comprenant 2 chaines
1et une chaîne
2. Le collagène de type III, molécule homogène, est composé de trois chaines identiques
1, reliées par des liaisons hydrogène (Van der Rest et Garrone, 1991). Après la traduction de l’ARMm qui code pour la molécule de collagène, la proline est hydroxylée par l’enzyme prolyl hydroxylase, pour former l’hydroxyproline. Les cofacteurs de cette réaction incluent le dioxygène, le fer, l’acide ascorbique et l’-cétoglutarate. Certaines lysines sont également hydroxylées et serviront à stabiliser les microfibrilles de collagène. Chacune des trois chaînes, de façon concomitante à satraduction, est transférée dans le lumen du réticulum endoplasmique, où certaines modifications sont effectuées comme l’hydroxylation et la glycosylation. La formation de ponts disulfure se forment sur les propeptides C-terminaux pour permettre l’alignement de 3 chaînes. Une fois sa base alignée, la triple hélice s’enroule par elle-même en direction de la partie N-terminale. Ensuite, la triple hélice passe à l’appareil de Golgi pour ensuite être exocytée dans l’espace extracellulaire. Des procollagène peptidases coupent les propeptides N- et C-terminaux, libérant une triple hélice mature de tropocollagène, de 300 nm de longueur. À leur tour, les molécules de tropocollagène s’assemblent côte à côte mais avec un décalage de 67 nm. L’enzyme Lysyl oxidase crée des liaisons covalentes entre les lysines de la portion N-terminale d’une molécule de tropocollagène et d’autres lysines de la partie C-terminale d’une molécule voisine. Une fibrille de 50 nm de diamètre est ainsi formée. Les fibrilles s’agrègent progressivement pour former ultimement une fibre de collagène de 1-10 m de diamètre (Lodish et coll., 2002; Uzawa et coll, 1999; Amiel et Nimni, 1993). Ces structures sont formées et maintenues par les cellules qui avaient préalablement sécrété le collagène (Jackson et coll., 1996). Elles regroupent les fibres grâce aux extensions membranaires qui agissent comme un étau. Afin que ces fibres soient regroupées, elles doivent être dans la même orientation. Cette orientation parallèle des fibres (Abe et coll., 1993), tout comme l'arrangement en fascicules ont été discuté abondamment dans la littérature (Haus J. et Refior, 1987; Jackson et coll., 1996). Le fascicule de collagène est la plus grosse unité structurale du LCA. Son diamètre moyen atteint 20-400 m. Chaque fascicule de collagène comprends plusieurs sous-fascicules ou faisceaux de fibres de 1-20 m et de fibrilles de 25-150 nm (Dunn et coll., 1993). Cette ultrastructure confère au LCA sa résistance à l’étirement, qui dépend de l'arrangement et du diamètre de ses fibres.
Structures nerveuses du LCA
L'innervation du LCA provient d'arborisation du nerf articulaire postérieur, qui dérive du nerf tibial postérieur (Halata et coll., 1999). Les axones qui entrent dans
la partie sous-synoviale doivent être attirés ou guidés. Cette assistance à la migration ou attraction neuronale est nécessaire aux axones en élongation afin qu'ils atteignent leur destination. Une simple adhésion du cône de croissance à un substrat comme la laminine ou la fibronectine est suffisante pour qu'il y ait conduction axonale (Yu et Bargmann, 2001). La migration axonale peut être également aiguillée par des gradients de facteurs de croissance, tel le facteur de croissance des fibres nerveuses, le Nerve Growth Factor (NGF, Yu et Bargmann, 2001). Le facteur de croissance NGF est un régulateur clé du développement et de la différenciation des cellules neuronales et non neuronales. Par exemple, la libération ciblée de NGF dans des coupes de dents humaines en culture a induit une croissance axonale importante et la migration de cellules de Schwann vers le site d'administration du NGF (Mitsiadis et coll., 2017). Lors de la migration sur de
longues distances, comme c'est le cas suite à une reconstruction ligamentaire, c'est via des gradients de facteurs attractifs et répulsifs que le cône de croissance s'oriente (Yu et Bargmann, 2001).
Le rôle majeur des neurones qui innervent l'articulation du genou, plus spécifiquement dans le LCA, en est un de proprioception. La proprioception est la perception, le plus souvent inconsciente, que l'on a de la position statique et dynamique de notre corps dans l'espace. Il s’agit d’une fonction importante du système locomoteur, qui nous informe sur notre mobilité corporelle, en assure l'équilibre et le contrôle dynamique de la vitesse et de la direction du mouvement. Les mécanorécepteurs du LCA convertissent les stimuli mécaniques en impulsions nerveuses, lesquelles seront transmises et interprétées par système nerveux central. L'ensemble de ces structures nerveuses a donc la capacité de signaler la vitesse, l'accélération, la direction et la position du genou dans certains axes. Le système nerveux central induit une réponse musculaire qui stabilise la position du corps en mouvement, de façon à le maintenir en équilibre. L’anticipation, la réaction, l’adaptation à l’environnement sont associées de près à la proprioception.
On observe trois types de structures neuronales distinctes au niveau du LCA, soient les corpuscules de Pacini, de Ruffini, les terminaisons nerveuses libres. Ces
structures nerveuses représenteraient environ 1% du volume du LCA, (Raunest et coll., 1998). Les corpuscules de Ruffini réagissent au changement de pression à l’intérieur de l’articulation et détectent les tensions statiques et dynamiques. Les corpuscules de Pacini sont des récepteurs de l’accélération qui sont activés seulement pendant le mouvement. Les terminaisons nerveuses libres, estimées à une centaine par LCA, sont localisées en majorité au niveau proximal ou portion fémorale. Les fibres nerveuses menant aux mécanorécepteurs semblent entrer dans le ligament via des faisceaux neuro-vasculaires dans la partie sous-jacente de la membrane synoviale (Halata et coll., 1999; Raunest et coll., 1998; Fromm et coll., 1996; Zimny et coll., 1986) et également au niveau de sa partie inter-fasciculaire (Buma et coll., 2000). On observe généralement les corpuscules de Pacini et de Ruffini au niveau sous-synovial plutôt qu’à l'intérieur du LCA. Les afférences des terminaisons nerveuses libres myélinisées ont un diamètre de 2 à 5
m, tandis que le diamètre moyen des fibres non-myélinisées est inférieur à 2 m (Zimny, 1988). D'après Zimny (1988), la concentration des mécanorécepteurs est plus grande dans la portion tibiale étant donné que la plupart des muscles du genou s'attachent au tibia. La partie médiane du LCA est plus pauvre en mécanorécepteurs. De plus, la quantité de corpuscules de Ruffini (environ 20) est plus élevée que celles des Pacini (de 5 à 15) dans le LCA (Halata et coll., 1999). Les structures nerveuses du genou, notamment du LCA, jouent donc un rôle important lors de nos déplacements et mouvements de la vie quotidienne.
Structures vasculaires du LCA
La vascularisation du LCA se retrouve au niveau de la membrane synoviale (Haus et Refior, 1987). Cette membrane est irriguée par des vaisseaux provenant des parties antérieure et postérieure de l’articulation. Antérieurement, il y a un groupe de vaisseaux qui alimente le panicule adipeux sous-patellaire ainsi que le ligament patellaire et contribue par ses arborisations, à la vascularisation de la membrane synoviale. Les vaisseaux de la synoviale postérieure provenant de l’artère poplitée donnent naissance à de nombreuses ramifications qui alimentent aussi la
membrane synoviale (Arnoczky et coll., 1979; Clancy et coll., 1981; Corsetti et Jackson, 1996). Ces vaisseaux ont comme principale fonction la nutrition de toutes les cellules du LCA (Arnoczky et coll., 1979; Haus et Refior, 1987). Cependant dans le processus d’intégration d’un substitut ligamentaire utilisé pour la reconstruction du LCA, le liquide synovial peut remplir ce rôle nutritif avant la revascularisation (Amiel et coll., 1986; Arnoczky et coll., 1979).
Les vaisseaux retrouvés dans la membrane synoviale recouvrant le LCA forment un fin réseau vasculaire périligamentaire. Ce réseau provient du panicule adipeux et de la membrane synoviale postérieure. Ces vaisseaux pénètrent le LCA grâce aux insertions de la membrane synoviale et se ramifient entre les fibres de collagène, formant ainsi un réseau endoligamentaire parcourant le LCA sur sa longueur en proximal et distal. Ces vaisseaux endoligamentaires s’anastomosent avec des vaisseaux de l’endoste en proximal et distal. La plus grande densité des vaisseaux sanguins est au niveau des insertions tibiale et fémorale (Fromm et coll., 1996). Une zone hypovasculaire est observée dans la partie centrale du LCA (Arnoczky et coll., 1979; Clancy et coll., 1981).
Problèmes cliniques liés au remplacement d’un LCA rupturé
Des descriptions anatomiques du ligament croisé antérieur (LCA) peuvent être trouvées dans des rouleaux de papyrus égyptiens datant de 3000 ans avant Hippocrates (ou 460-370 avant Jésus-Christ) a décrit une subluxation du genou avec lésion du LCA. Même aujourd'hui, le LCA de l'articulation du genou reste la cible fréquente des traumatismes, en particulier chez les jeunes et les actifs (Murray, 2009). La rupture du LCA du genou affecte plus de 175 000 patients par an dans le monde (Myer et coll., 2004). Une telle blessure résulte souvent d'une torsion ou d'une rotation du genou lors de l'atterrissage, d'un stress valgus (position coup de genou) ou d'une hyperextension directement liée au contact ou à la collision. (Wu et coll., 2010). Pour des raisons inconnues, ce stabilisateur majeur de l'articulation du genou ne guérit pas après la réparation d'une fissure (Murray et coll., 2007). Souvent, d'autres structures du genou sont directement affectées
lorsque des lésions partielles ou complètes du LCA surviennent, altérant la fonction du genou. Le tibia et le fémur sont plus susceptibles de frotter l'un contre l'autre, entraînant des défauts du cartilage et de l'arthrose. Divers protocoles de rééducation ont été évalués, mais la rééducation n’assure pas le maintien à long terme de la fonction du genou. La décision clinique de remplacer un LCA déchiré est fonction de l’ampleur des dommages causés par la blessure et le fonctionnement ultérieur du genou. La chirurgie du LCA est pratiquée plusieurs semaines après la lésion afin de permettre la diminution du gonflement articulaire et de l'inflammation. Après la chirurgie, une rééducation physique est nécessaire pour renforcer les muscles, stabiliser l’articulation du genou et rétablir l’amplitude des mouvements.
Fonction du LCA dans l'articulation du genou.
Le LCA a une fonction proprioceptive et mécanique. C'est la première contrainte à la traduction antérieure du tibia. La charge de traction et la rigidité ultimes du complexe fémur humain-LCA-tibia sont de 2160 + 157 N et 242 + 28 N / mm, respectivement (Dargel et coll., 2007; Woo, 2006). Les forces appliquées sur le LCA pendant la marche normale sont de 303 N ou moins (Peterson et Zantop, 2007). Les charges et les efforts les plus importants exercés sur le LCA au cours de la journée sont une extension du genou avec un quadriceps, qui le fait passer d’environ 40 degrés de flexion à une extension complète. Ceci explique pourquoi les exercices à chaîne cinétique ouverte (exercices avec le pied libre) sont évités pendant les premières phases de la rééducation. Le renforcement du quadriceps est important et il peut se faire avec le pied stabilisé, ce qu’on appelle en chaîne fermée (Wilk et coll., 2012). Deuxièmement, le LCA oblige le tibia à effectuer une rotation interne lors de la translation tibiale antérieure, indiquant que le LCA restreint principalement les moments de rotation internes lors de la traduction antéropostérieure (Fukubayashi et coll., 1982).
Cicatrisation compromise du LCA blessé
Contrairement aux ligaments extra-articulaires du genou (par exemple, les ligaments collatéraux), la cicatrisation du LCA intra-articulaire est mal comprise. Une déchirure complète du LCA (substance intermédiaire ou à l'insertion) ne laisserait pas de structure résiduelle sur laquelle former une cicatrice. Cependant, une déchirure partielle doit laisser au moins un modèle partiel pour former une cicatrice. Il est intéressant de noter que même si des saignements se produisent après une lésion du LCA, aucun bouchon plaquettaire de fibrine ne se forme à l'intérieur de l'articulation, même au site de la blessure. Une explication possible de cette observation est que la plasmine intra-articulaire en circulation détruit le bouchon de fibrine aussi vite qu'il peut se former (Murray, 2009). Des travaux ont montré qu'après traumatisme articulaire, la production de plasmine est régulée positivement par la sécrétion accrue d'activateur du plasminogène de l'urokinase (Rosc et coll., 2002). Avec la plasmine en circulation supplémentaire, le réseau de fibrine est rapidement déstabilisé dans l’environnement articulaire et aucune forme de bouchon fibrine-plaquettes ne se forme. Cette perte prématurée du bouchon fibrine-plaquettes serait bénéfique en prévenant la cicatrisation et la raideur associée à la fibrose articulaire qui limite la mobilité après une lésion. Comme la formation d'un bouchon fibrine-plaquettes est une première étape essentielle pour la cicatrisation des tissus musculo-squelettiques à l'extérieur de l'articulation, la perte de ce bouchon plaquette-fibrine à l'intérieur de l'articulation peut être le principal mécanisme responsable de l'incapacité de guérison des tissus intra-articulaires (Murray, 2009). L'échec de la guérison (non union) et la laxité observés dans le LCA après la réparation de la suture ont également été attribués à différentes causes physiologiques potentielles. On peut soupçonner l'influence néfaste du liquide synovial (Murray et coll., 2009; Woo et coll., 2000), des altérations du métabolisme après une blessure (Amiel et coll., 1989) et également des carences cellulaires intrinsèques (Kobayashi et coll., 2000). La capacité supérieure du ligament collatéral médial (LCM) à augmenter son apport sanguin par l'angiogenèse et un débit accru est essentielle à la guérison des ligaments et peut constituer la principale différence de potentiel de guérison entre le LCA et le
LCM (Kobayashi et coll, 2000). Plusieurs facteurs de croissance ont été étudiés dans les tendons en post-opératoire. L'expression des ARNm d'Aggrecan, Versican, Biglycan, Lumican, Decorin, TGF-β et β-FGF a été suivie in vivo à l'aide d'un modèle de lésion du tendon fléchisseur chez le lapin (Berglund et coll., 2006). Le rôle et le mode d'interaction entre ces différents facteurs ainsi que la modulation séquentielle post-traumatique de leur expression restent à définir.
Impact du LCA déchiré sur la force, la stabilité et l'arthrose du genou
Une lésion du ligament croisé antérieur (LCA) est considérée comme essentielle à la cinématique physiologique de l'articulation fémoro-tibiale, sa rupture entraînant éventuellement une altération fonctionnelle à long terme. Tant le traumatisme initial que le type de mouvement pathologique du genou blessé peuvent entraîner des lésions dégénératives primaires des stabilisateurs secondaires du genou, chacune étant associée au début précoce de l'arthrose (Von Porat et coll., 2004). Par conséquent, il existe un large consensus sur le fait que les patients jeunes et actifs peuvent bénéficier de la reconstruction du LCA. Plusieurs facteurs ont été identifiés comme influençant de manière significative les caractéristiques biomécaniques et le résultat fonctionnel d'une articulation du genou reconstruite par le LCA. Ces facteurs sont les suivants: (1) choix individuel du matériau de greffe autologue en utilisant soit une greffe os-tendon patellaire, soit une greffe de tendon ischio-jambier quadruplée, soit un autre type de substitut du LCA, (2) la perforation des tunnels osseux d’implantation sur les sites naturels de fixation du LCA natif, (3) une tension de substitution adéquate après le préconditionnement cyclique du greffon, et (4) une fixation de la greffe proche de l'articulation avec des matériaux de fixation de greffe biodégradables offrant une force de fixation initiale supérieure aux charges normalement attendues lors de la rééducation. En respectant ces facteurs, la littérature fait état des résultats cliniques et fonctionnels à moyen et à long termes après la reconstruction du LCA (Dargel et coll., 2007). Au suivi fémoro-patellaire, l'arthrose est associée à un niveau d'activité plus élevé,
à une lésion méniscale, à un déficit d'extension et de flexion et à une reconstruction du LCA. Bien que les facteurs de risque d'arthrose post-traumatique soient multifactoriels, le principal facteur de risque ressort d'une étude de Neuman et coll. (2009), était de savoir si une méniscectomie avait été réalisée. La modification précoce de l'activité et la rééducation neuromusculaire du genou pourraient également être liées à la faible prévalence de l'arthrose du genou par radiographie. Chez les patients présentant une lésion du LCA qui sont disposés à limiter leur niveau d'activité pour éviter une nouvelle lésion, un traitement initial sans reconstruction du LCA peut être envisagé. (Neuman et coll., 2009). Fait intéressant, l'incidence de l'arthrose après une déchirure du LCA semble être similaire, que le LCA ait été reconstruit ou non (Lohmander et coll., 2007), probablement en raison de lésions concomitantes d'autres structures articulaires au moment de la déchirure du LCA. Cependant, la reconstruction améliore la qualité de vie et la stabilité du genou, en particulier chez les patients actifs plus jeunes.
Approches chirurgicales actuelles pour rétablir la fonction du genou après une lésion du LCA
De nouvelles options de remplacement du LCA sont en cours d'élaboration et certaines études cliniques progressent (Altman et coll., 2008; Murray, 2009, Khatri et coll., 2018). Par définition, le génie tissulaire implique une combinaison de connaissances et de compétences en biologie et en biomécanique. Cette science multidisciplinaire a ouvert la porte à la conception et à la fabrication de nouveaux matériaux biocompatibles pour la reconstruction du LCA (Woo, 2009, Ong et coll., 2015). Cependant, indépendamment du type de substitut du LCA choisi, la reconstruction réussie du LCA dépend de la mise en place anatomique du substitut du ligament lors de la greffe (Cole et coll., 2000). La force a été et reste une considération majeure dans le choix des greffes (Frank & Jackson, 1997). La mise en place précise des tunnels minimise l'excursion du greffon et l'empiètement sur
le toit de l'entaille intercondylienne. Cela se traduira par une stabilité et une mobilité maximales du genou (Fineberg et coll., 2000; Steiner et coll., 2008).
Tendon autologue pour remplacement du LCA déchiré
La reconstruction orthopédique du ligament par autogreffe utilise souvent une technique os-os pour une réparation optimale (Frank & Jackson, 1997; Paxton et coll., 2009). La partie centrale du tendon rotulien, y compris les fragments d'os du tibia et du fémur, ou les tendons du jarret est souvent utilisée comme substitut déchiré du LCA. Les autogreffes os-tendon rotulien (BPTB) ont été proclamées «l'étalon-or» de la reconstruction du LCA (Woo et coll., 2006). Sur le plan biomécanique, une greffe de BPTB d'une largeur de 10 mm présente des valeurs de rigidité et de charge maximale respectives de 210 ± 65 N / mm et 1784 ± 580 N (Wilson et coll., 1999), qui se comparent bien à celles du complexe fémur-LCA-tibia (242 ± 28 N / mm et 2160 ± 157 N, respectivement), (Woo et coll., 2006). Cela montre également l'avantage d'avoir des blocs osseux disponibles pour la fixation de la greffe dans les tunnels osseux, ce qui permet une meilleure stabilité du genou. Malheureusement, la traduction ou la laxité des ligaments est observée après l'intervention chirurgicale, ce qui ajoute à la morbidité associée à la perte partielle d'un tendon en bonne santé, à une douleur chronique au genou, à une perte de mouvement, à une instabilité du genou, faiblesse du quadriceps et rupture de la rotule. Ainsi, les chirurgiens orthopédistes concluent qu’il est hautement justifié sur le plan clinique d’explorer d’autres stratégies de remplacement du LCA.
Implantation d’allogreffe de cadavre.
L'utilisation de substituts d'allogreffe (LCA provenant de cadavres) supprime le besoin de tissus autologues, évitant ainsi la morbidité du site donneur. Cependant, cette approche présente des lacunes compte tenu des risques de transmission de
la maladie, de rejet de greffe, d'intégration physiologique retardée et d'inflammation (Murray, 2009). Les allogreffes sont relativement coûteuses et leur disponibilité pourrait être limitée. Néanmoins, les tendons rotuliens prélevés sur des cadavres sont encore utilisés pour le remplacement du LCA déchiré, en fonction des besoins à court et à long terme de chaque patient traité. Les allogreffes de cadavres sont facilement résistantes et sont progressivement remodelées par les cellules de l'hôte après la greffe. Elles comportent toutefois des risques de rejet, même décellularisées.
Expérimentation animale
Au cours des dernières années, les substituts du LCA produits par génie tissulaire ont suscité l'intérêt des chirurgiens orthopédistes pour des raisons évidentes. Le concept de production de ligament in vitro résout le problème de la morbidité associée aux greffes de tendon autologues. En fonction de l'approche technologique développée pour reconstruire un LCA in vitro, la disponibilité de produits du génie tissulaire élargit le spectre des options chirurgicales et fournit une solution à moyen et à long terme pour prévenir l'instabilité de l'articulation du genou. Cependant, les caractéristiques d'un LCA modifié par un tissu dépendent du type de biomatériaux qui composent son échafaudage. Le potentiel et la fonctionnalité de tout ligament reconstruit doivent être évalués sur des modèles animaux. Il s'agit de l'étape cruciale pour évaluer la faisabilité, la viabilité et les facteurs d'échec associés à toutes les nouvelles stratégies de remplacement du LCA en cours de développement.
Le lapin
Des modèles de lapin et de chèvre ont été utilisés pour évaluer les stratégies de remplacement du LCA déchirées (Xerogeanes et coll, 1998). L'avantage du lapin reste le large choix d'anticorps et de biomarqueurs disponibles dans le commerce pour analyser les divers constituants des substituts du LCA après la greffe et ex
vivo. La principale limite de ce modèle est sa taille et le fait qu’il ne se compare pas à l’articulation du genou humain.
La chèvre
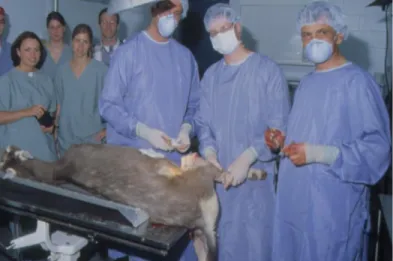
La chèvre est plus grande et la taille de son genou est proche des structures humaines. Cela facilite l'élaboration d'un protocole préclinique pour l'implantation d'un nouveau type de remplacement du LCA (figures 2 et 3). Cependant, des différences sont observées entre l'ampleur de la force subie par le LCA de chèvre et ses faisceaux antéro-médian et postérolatéral par rapport au LCA humain correspondant. Néanmoins, le modèle animal caprin est largement utilisé pour la caractérisation du LCA in vitro et in vivo (Tischer et coll., 2009).
Figure 2 : Greffe chez la chèvre d’un substitut du LCA produit par génie tissulaire
Figure 3 : Deux chèvres greffées avec un substitut du LCA depuis 1 semaine.
Le chien
Le modèle animal le plus difficile à étudier pour la réparation du LCA est certainement l’articulation du genou du chien. Comme chez l'homme, des lésions du LCA sont fréquemment observées dans les grosses articulations du genou du chien. Le ménisque interne est généralement endommagé avec le LCA. Le modèle canin implique plusieurs problèmes, notamment le développement précoce de l'arthrose après une lésion du LCA déchirée (Murray et coll., 2006). Pour cette raison, un substitut du LCA testé avec succès dans l'articulation du genou canin indiquerait certainement un potentiel sérieux d'utilisation dans le genou humain.
Cellules ensemencées (cellules souches, sources de cellules autologues) ou substituts du LCA acellulaires?
Il existe deux groupes de substituts de LCA ensemencés de cellules: les tissus peuplés de cellules vivantes (par exemple, des greffons os-tendon patellaire-os ou LCA autologues semi -tendineux) et les greffons contenant des cellules mortes (par exemple des allogreffes de cadavres). Outre les risques de réaction immunitaire et / ou inflammatoire, les cellules mortes autologues ou allogènes doivent être éliminées après l'implantation. Les débris cellulaires présents dans un substitut du LCA ensemencé de cellules peuvent ralentir ou retarder sa colonisation et entraver la croissance des cellules hôtes, migrant dans les greffons à partir des sites d'insertion osseuse vers le centre du ligament. La vascularisation
du greffon après implantation peut également être retardée par la présence de microstructures soumises à un processus de nécrose dans l'implant. Les substituts du LCA déjà peuplés de cellules autologues vivantes, qui ne seront pas rejetées par l’hôte, ont le potentiel de se régénérer plus rapidement in situ, à la suite de la migration de cellules endothéliales qui ont reconstruit les structures vasculaires pour rétablir l’approvisionnement en sang. Le choix de la source de cellules reste pour sa part, controversé. L'utilisation de cellules souches est une option attrayante car ces cellules ont une longue durée de vie et ne sont pas complètement différenciées, ce qui suggère qu'elles pourraient être tolérées d'un individu à l'autre. L'utilisation de sérum humain au lieu de sérum d'origine animale semble avoir un effet direct et positif sur le phénotype des cellules souches mésenchymateuses dérivées de la synovie humaine (Tateishi et coll., 2008). En effet, les résultats de l’étude de Tateishi et coll. (2008), indiquent que le sérum humain est supérieur pour la culture de cellules souches mésenchymateuses humaines par rapport au sérum de veau fétal en termes d'extensibilité cellulaire, sans perte de capacité de différenciation chondrogénique ou ostéogénique. Une population de cellules mésenchymateuses humaines bien caractérisées pourrait s’avérer être une option intéressante, en éliminant le prélèvement cutané chez le patient traité et la période de culture de ses cellules. L'utilisation d'une population de cellules humaines «universelle» pour la production à grande échelle de substituts du LCA serait idéale pour des raisons techniques et économiques évidentes (Hart et coll., 2005). Cependant, cette approche comporte des risques car la différenciation de ces cellules in situ n’est pas totalement prévisible et comporte certains risques de développement de phénotypes autres que celui souhaité.
Les cellules autologues présentent l'avantage d'être non immunogènes, mais leur amplification in vitro pourrait également impliquer certains risques de changements phénotypiques. L'utilisation de fibroblastes isolés de la peau au lieu de biopsies du LCA pour cellulariser le substitut du LCA a conduit à des résultats comparables dans l'articulation du genou de la chèvre (Tremblay et coll., 2011). Les fibroblastes
isolés des deux sources sécrètent les mêmes types de collagène (I et III), mais une microbiopsie cutanée est beaucoup plus facile à prélever qu'un échantillon de LCA déchiré, prélevé sous arthroscopie, dans une articulation du genou blessée. En fin de compte, les substituts du LCA acellulaires, composés de biomatériaux biodégradables et biocompatibles, restent l’option la plus sûre. Cependant, ces substituts devront être colonisés par les cellules de l’hôte après leur implantation. Par conséquent, les substituts acellulaires de LCA, issus du génie tissulaire, impliquent un remodelage retardé de la greffe comparativement à ceux contenant des cellules (Robayo et coll., 2011), ce qui peut nuire à sa stabilité in situ à long terme. Les cellules semblent jouer un rôle essentiel dans le développement de tels tissus in vitro. Cependant, pour conserver le meilleur des deux options, il serait important de procéder en deux étapes pour obtenir un substitut viable et efficace du LCA. La première phase serait basée sur l'utilisation de cellules pour structurer et renforcer l'échafaudage du ligament en culture. Lorsqu'il est suffisamment puissant pour supporter le stress biomécanique de l'articulation, le ligament peut être lyophilisé avant l'implantation afin de tuer les cellules initialement présentes dans l'implant et de permettre la colonisation cellulaire par l'hôte, en étant certain que la structure de l'échafaudage jouera son rôle et ainsi améliorer l'intégration.
Biomatériaux: synthétiques, natifs ou les deux?
Pour faciliter la migration, la croissance, la colonisation et le remodelage des cellules hôtes des substituts du LCA après l'implantation, le support du greffon doit être poreux et entièrement biocompatible. La greffe doit être biodégradable et les produits générés par cette dégradation doivent également être facilement éliminés par des mécanismes physiologiques. Le collagène I est le composant majeur et naturel de la matrice native du LCA. Par conséquent, cette protéine convient parfaitement, seule ou en combinaison avec d'autres constituants biocompatibles, pour construire l'échafaudage d'un substitut du LCA (Tremblay et coll., 2011). Par exemple, un échafaudage de pontage au plasma riche en plaquettes et en collagène (collagène-PRP), ajouté à un site de plaie du LCA, peut stimuler sa
guérison histologique et biomécanique (Murray et coll., 2006; Spindler et coll., 2009). D'autres types de matrices composées de biomatériaux issus du génie tissulaire ont été décrits pour leur potentiel en tant que substituts du LCA, tant qu'ils peuvent être implantés et maintenir le stress biomécanique auquel ils sont soumis in vivo (Altman et coll., 2008; Sandmann et Tischer, 2010). Plus récemment, le concept de reconstruction anatomique du LCA à double faisceau a été développé pour remplacer les faisceaux antéro-médiaux et postéro-latéraux du LCA. Cette approche vise à améliorer la fonctionnalité biomécanique des greffes (Woo et coll., 2006).
Rôle de la stimulation biomécanique en génie tissulaire
Le principal avantage d'inclure des cellules vivantes dans tout substitut de LCA est la possibilité de stimuler la synthèse et le remodelage précoces de la matrice in vitro. L'étirement cyclique est un exemple de stimuli biomécanique qui augmente la synthèse de collagène par les cellules du tissu, renforçant ainsi son échafaudage constitué de faisceaux de fibres alignées (Goulet et coll., 2000, Kaneko et coll., 2009). Ainsi, le substitut du LCA a déjà franchi une première étape dans la synthèse de la matrice et le processus peut continuer à progresser en réponse aux différents types de cellules qui migreront dans le greffon in vivo (Goulet et coll., 2004; Tremblay et coll., 2011).
La mise en place anatomique d'un substitut du ligament du LCA est cruciale pour sa bonne intégration et l’acquisition de son comportement fonctionnel (Cole et coll., 2000). Tel que mentionné précédemment, une mise en place précise du greffon doit être effectuée par rapport aux sites d'insertion d'origine du LCA rupturé, afin de limiter l'excursion du greffon et son empiètement sur le toit de l'entaille intercondylienne (Fineberg et coll., 2000; Steiner et coll., 2008). Le substitut du LCA doit pouvoir résister à une tension initiale du greffon allant de 44 à 88 N (Woo et coll., 2006). Une étude in vivo sur des chèvres n'a révélé aucune différence significative dans la cinématique du genou et les forces in situ entre une tension
initiale élevée (35 N) et faible (5 N), 6 semaines après la chirurgie (Abramowitch et coll., 2003). Des études viscoélastiques ont révélé que la tension dans la greffe pouvait diminuer de 50% en peu de temps après la fixation, en raison de son comportement de relaxation des contraintes. La variation des résultats chez l’humain peut également être influencée par d'autres variables associées à l'individu, telles que l'âge, le sexe, la génétique, l'obésité, la force musculaire, l'activité et les blessures récurrentes. Par conséquent, l'objectif principal de la gestion clinique d’une lésion du LCA est le retour à la stabilité et à l'état fonctionnel de l'articulation. Un substitut du LCA obtenu par génie tissulaire, qui pourrait stabiliser l'articulation et maintenir son état fonctionnel après la greffe, est certainement nécessaire.
Différents substituts du LCA issus du génie tissulaire
Plusieurs substituts de LCA produits par génie tissulaire sont proposés dans la littérature (Lubowitz, 2015). Fibres de collagène bovin réticulées, hydrogels à base d'hyaluronane et de chitosane (Dang et coll, 2016), hydrogels à base de chitosane et d'alginate (Baysal et coll., 2013), échafaudages d'acide polyglycolique, matrice de soie (Yilgor et coll., 2012; Teuschl et coll., 2019) et autres échafaudages biodégradables ensemencés ou non de cellules (Altman et coll., 2008). Jusqu'à présent, seuls les dispositifs d'augmentation du ligament ont fait l'objet d'essais cliniques. Cependant, de nombreux substituts du LCA biosynthétiques et biologiques sont en cours d'expérimentation animale (Yilgor et coll., 2012). C'est le cas du substitut du LCA qui a été développé à l'aide de blocs osseux, de collagène de type I et de cellules autologues (Goulet et coll., 2004; Tremblay et coll., 2011).
Modélisation du substitut du LCA in vitro
L’échafaudage du substitut du LCA est constitué de collagène de type I bovin, qui est ensemencé avec des fibroblastes autologues isolés du LCA ou d’une biopsie cutanée de la chèvre à greffer. Ce ligament est entièrement produit in vitro. Le
substitut du LCA est maintenu sous tension statique en culture (figure 4). La tension est appliquée en exerçant une traction sur l'un des blocs osseux. Cette tension induit l'alignement des fibres de collagène dans le sens de la longueur du ligament.
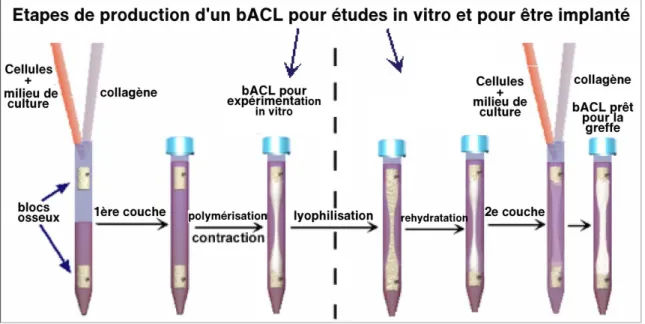
La tension appliquée permet aux fibres de collagène de s’aligner dans le sens de la tension, entre les deux pôles osseux. La figure 5 illustre les fibres de la matrice qui sont alignées selon un patron ondulé (A), comme pour le ligament natif (C). Après avoir été greffé, la synthèse de collagène est s’intensifie (B) et se compare aux ligaments controlatéraux après 5-8 semaines. La figure 6 représente l’ensemble des étapes de production d’un substitut ligamentaire.
Figure 4. Montage de culture du substitut du LCA sous tension statique. Ici le
substitut a été fixé dans du formol pour servir de modèle à moyen et long termes.
Figure 5. Coupes histologiques colorées au Trichrome de Masson d’un substitut
du LCA produit par génie tissulaire immédiatement avant son implantation (A), après 6 mois de greffe (B), comparativement à un LCA natif (C). (X60).
Figure 6: Étapes de la production d’un substitut du LCA par génie tissulaire.
Une solution de collagène de type I (1 mg / ml) est versée avec des fibroblastes autologues (0,5 x 106 cellules ml) dans un tube à essai contenant deux bouchons osseux fixés à l'aide d'une goupille en haut et en bas. Le collagène polymérise et est contracté par les cellules, pour obtenir un ligament pouvant servir de modèle in vitro. Pour produire un ligament à implanter dans une articulation du genou, un fil chirurgical est placé entre les os (non représenté). Une étape de lyophilisation est ajoutée pour obtenir un échafaudage plus résistant. Une fois réhydraté, une deuxième couche de collagène comprenant des cellules est ajoutée (figure 6). Le collagène polymérise et le substitut du LCA est prêt à être greffé dans une articulation du genou.
Avant de les greffer, les chirurgiens orthopédiques doivent connaître la force et la rigidité des substituts construits in vitro. Des essais de rupture ont été réalisés pour évaluer les propriétés mécaniques des ligaments avant implantation (Tableau I). Tout gel de collagène naturel non renforcé à l'aide d'un fil ou d'un autre type de support ne résistera pas à une tension supérieure à 0,5 N. Une fois lyophilisé, l'échafaudage en collagène présente une résistance maximale de 2 N, tandis que l'ajout d'un fil de suture biorésorbable permettra à la structure de résister à une traction de 60 N et plus.
Tableau 1 : Valeurs moyennes de résistance des greffons in vitro (n = 6), sans le fil de suture qui relie les deux ancrages osseux.
Structure de la matrice Force de rupture (N) Site de rupture 1 couche de collagène (gel) 0.2-0.5 (+ 0,02) Interface os-ligament
+ 1 couche de collagène (gel),
lyophilisée et réhydratée
2 (+ 0,1) Centre du ligament
Aire de surface transversale moyenne: 100 mm2 (+ 5 mm) N= Newton
En culture, une tension minimale est appliquée sur le canevas de fils tressés, entouré du collagène. Les fils de suture sont biocompatibles par définition, mais il est bon de le vérifier. La viabilité des cellules en est un excellent indicateur. Sur la figure 7, on observe une coupe histologique montrant l’alignement des fibres de collagène en tension, accolées au fil de suture. Les cellules présentes dans le gel étaient toujours vivantes après 20 jours de culture. Cela fut vérifié en digérant la matrice avec de la collagénase pour en extraire les fibroblastes, pour ensuite les mettre en culture monocouche.
Figure 7 : Biocompatibilité du fil chirurgical résorbable in vitro. Coupe histologique
d’une microsection du fil résorbable Vicryl Polyglactin 910 no 3, CCS-1(au-dessus du trait pointillé), autour duquel un gel de collagène contenant des fibroblastes de LCA a été conservé en culture pendant 20 jours (sous le trait pointillé). (x40)
La figure 8 présente une vue macroscopique d'un substitut du LCA obtenu par génie tissulaire, maintenu en culture pendant deux mois sous tension statique, ancré avec deux blocs osseux spongieux. Notez la partie centrale du tissu qui a été contractée par les cellules vivantes qui peuplent son échafaudage de collagène de type I. Un fil chirurgical, résorbé en un mois in vivo, renforce les liens entre les os (pas visible).
Figure 8 : Substitut du LCA cultivé in vitro, ancré par deux blocs osseux.
Implantation du substitut dans le modèle animal caprin.
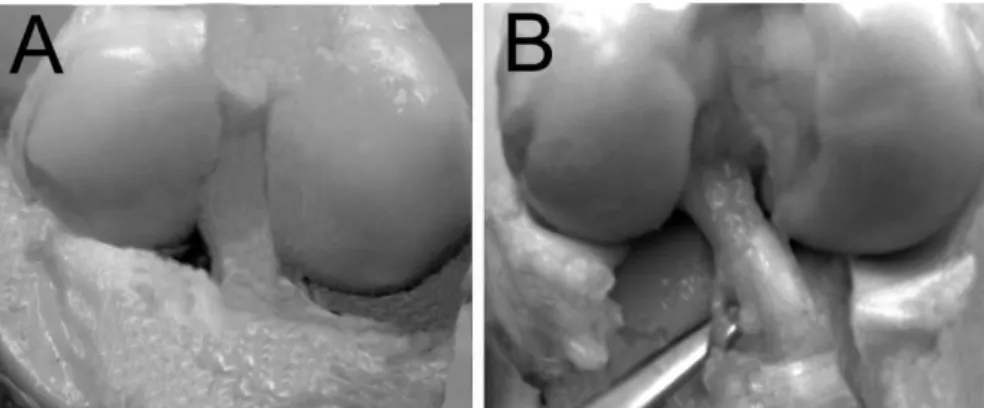
Un tel implant est vascularisé dans le mois qui suit la greffe. Son aspect macroscopique aprèes seulement 6 mois d’implantation dans un genou caprin nous permet d’affirmer que notre approche est fort prometteuse (figure 9).
Figure 9: Implantation d’un substitut du LCA. Vue macroscopique d'un substitut du
LCA produit par génie tissulaire après six mois d’implantation (A), comparativement à un LCA natif de chèvre (B).
Des terminaisons nerveuses, des fibres de Sharpey (figure 10) et un fibrocartilage (figure 11) ont été observés dans tous les greffons âgés de 6 mois (n = 5; Tremblay et coll., 2011). Des analyses en microscopie électronique ont montré que le diamètre des fibres de collagène synthétisées par les cellules in vivo était comparable à celui des fibres de LCA natives (Goulet et coll., 2004). L'un des problèmes qui pourrait entraver l'utilisation potentielle de ce substitut du LCA à des fins d'application clinique serait la difficulté de récolter une biopsie du LCA déchiré pour isoler les cellules requises. Des expériences menées avec des LCAs ensemencés avec des fibroblastes cutanés autologues et greffées dans les articulations du genou de la chèvre pendant six mois ont conduit aux mêmes observations que celles effectuées avec des cellules du LCA. Ainsi, l'expérimentation animale utilisant des fibroblastes cutanés a montré des signes prometteurs d'intégration dans l'articulation du genou de la chèvre (Tremblay et coll., 2011).
Figure 10 : Coupe histologique colorée au bleu de Stevenel, d’un substitut du LCA
greffé 6 mois dans un genou de chèvre, qui montre les fibres de Sharpey (flèches) (X 300). Ces fibres sont essentielles à la liaison permanente et solide de l’implant avec l’os.
Figure 11 : Néoformation de cartilage. Insertion osseuse d’un substitut du LCA
greffé 6 mois (reproduite avec la permission de Cell Transplantation, Tremblay et coll., 2011). La coupe histologique a été colorée au bleu de Stevenel. Notez la qualité du fibrocartilage qui débute au niveau de la substance ligamentaire (L) vers la zone non décalcifiée (UF), puis vers la zone calcifiée (CF), pour atteindre l’os (B). (x60).
Objectifs et hypothèses de travail
Objectif général
L’objectif général de mon travail de recherche visait à optimiser les procédés de
production de substituts ligamentaires produits par génie tissulaire, à des fins de recherche fondamentale mais également pour développer une option qui soit applicable partout en clinique.
Objectifs spécifiques:
a) Participer à la préparation et à l’analyse des résultats de l’expérience de greffe d’un substitut acellulaire du LCA dans le genou de chèvre in vivo;
b) Développer un substitut ligamentaire sans ancrages osseux, en collaboration avec les chirurgiens orthopédistes;
c) Améliorer la résistance de la matrice du substitut ligamentaire aux crêtes osseuses des parois des tunnels fémoral et tibial;
d) Évaluer la faisabilité des solutions proposées pour améliorer davantage le substitut ligamentaire, en étroite collaboration avec les chirurgiens orthopédistes.
Hypothèses de travail:
a) L’hypothèse de travail était que le substitut ligamentaire acellulaire s’intégrerait aussi bien dans le genou caprin que le substitut cellularisé (migration, organisation et différenciation de fibroblastes, de cellules endothéliales, de fibres nerveuses et de chondrocytes avec synthèse de fibres de Sharpey, renforcement et remodelage matriciel);
b) L’hypothèse était qu’un substitut ligamentaire de seconde génération sans ancrages osseux pourrait être construit avec ou sans cellules, en modifiant son mode de fixation grâce à un endobouton;
c) L’hypothèse était que l’utilisation d’une membrane protectrice augmenterait la résistance de la matrice, lors du passage du substitut ligamentaire dans les tunnels fémoral et tibial;
d) L’hypothèse était qu’un implant ligamentaire, produit sans ancrages osseux et muni une protection qui augmente la résistance de sa matrice aux cisaillements dans les tunnels osseux, serait démontré comme étant suffisamment solide pour être implanté chez l’animal, lors de tests d’implantation effectués ex vivo par des orthopédistes.
Substitut ligamentaire produit par génie tissulaire pour remplacer
le LCA rupturé: adaptations pour des applications cliniques.
Simon F.1*, Moreira Pereira J.1*, Lamontagne J.1, Cloutier R.1, Goulet F.2 and Chabaud S.1Institutions: 1CMDGT, Centre de Recherche du CHU de Québec-Université-Laval, Hôpital de l’Enfant-Jésus, 1401 18e
rue, Quebec, QC, Canada, G1J 1Z4. 1
Département de chirurgie and 2Département de réadaptation, Université Laval, Québec, QC, Canada, G1K 7P4.
Auteur de correspondance: Stéphane Chabaud, Ph.D. courriel: stefchabo@hotmail.com
*: Simon F. et Moreira Pereira J. doivent être considérés tous les deux premiers
auteurs sur cette publication.