HAL Id: dumas-01906206
https://dumas.ccsd.cnrs.fr/dumas-01906206
Submitted on 26 Oct 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Chirurgie robotisée en stimulation cérébrale profonde :
étude de précision et expérience clinique
Lannie Liu
To cite this version:
Lannie Liu. Chirurgie robotisée en stimulation cérébrale profonde : étude de précision et expérience clinique. Médecine humaine et pathologie. 2018. �dumas-01906206�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteurUNIVERSITÉ GRENOBLE ALPES UFR DE MÉDECINE DE GRENOBLE Année 2018
CHIRURGIE ROBOTISÉE EN STIMULATION CÉRÉBRALE PROFONDE : ÉTUDE DE PRÉCISION ET EXPÉRIENCE CLINIQUE
THÈSE
PRÉSENTÉE POUR L’OBTENTION DU TITRE DE DOCTEUR EN MÉDECINE DIPLÔME D’ÉTAT
LANNIE LIU
THÈSE SOUTENUE PUBLIQUEMENT À LA FACULTÉ DE MÉDECINE DE GRENOBLE
Le 15 octobre 2018
DEVANT LE JURY COMPOSÉ DE Président du jury :
Monsieur le Professeur Emmanuel GAY Directeur de thèse :
Monsieur le Professeur Stéphan CHABARDÈS Membres :
Madame le Docteur Anna CASTRIOTO Monsieur le Docteur Michel LEFRANC Monsieur le Docteur Éric SEIGNEURET
L’UFR de Médecine de Grenoble n’entend donner aucune approbation ni improbation aux opinions émises dans les thèses ; ces opinions sont considérées comme propres à leurs auteurs.
Doyen de la Faculté : Pr. Patrice MORAND
Année 2017-2018
REMERCIEMENTS
En plus de mes plus humbles remerciements, j’ai glissé quelques précieuses maximes de certains d’entre vous qui ont profondément marqué mon esprit pendant ces six années d’internat.
• Aux Membres du jury pour l’honneur qu’ils me font de juger mon travail
Monsieur le Professeur Stéphan CHABARDÈS
Il y a des gens que l’on rencontre et qui changent radicalement le cours de votre vie, c’est une occasion très rare que peu de gens ont la chance de connaître. Moi j’ai eu cette chance, grâce à vous. Merci d’être mon mentor, merci pour tout.
« On ne va pas réinventer tous les jours la Neurochirurgie ». Monsieur le Professeur Emmanuel GAY
Vous me faîtes l’honneur de présider le jury de ma thèse. Grâce à votre excellence, votre rigueur et votre humanisme, merci de me former pour être chaque jour un meilleur médecin, une meilleure chirurgienne mais surtout une meilleure personne.
« Comme dit Jean-Guy, y’a mieux mais c’est plus cher ». Madame le Docteur Anna CASTRIOTO
Merci d’avoir accepté de juger mon travail. Je vais en plus avoir la chance de continuer de travailler avec toi et de continuer cette étroite collaboration entre neurologues et neurochirurgiens fonctionnels, basée sur l’amitié et le profond respect que je te porte.
Monsieur le Docteur Michel LEFRANC
Vous me faîtes l’honneur de juger mon travail. Nous avons eu l’occasion de se rencontrer en congrès nationaux et j’espère que nous aurons encore d’autres occasions dans le futur.
Monsieur le Docteur Éric SEIGNEURET
J’espère que cette thèse aura été à la hauteur de vos espérances. Merci pour votre gentillesse et votre bienveillance au quotidien mais surtout les nombreuses maximes que vous m’avez transmises. Le choix a été cornélien mais ma préférée reste :
7 • À mes Maîtres de Neurochirurgie pour leur excellence chirurgicale, leurs
enseignements et l’esprit de compagnonnage qu’ils m’ont inculqué
Aux Neurochirurgiens Grenoblois
Monsieur le Docteur Dominique Hoffmann
Vous êtes ce savant mélange entre intelligence inouïe et empathie humaine. Je ne sais pas si c’est parce que j’ai le même âge que vos aînés mais vous êtes comme un second père. Merci pour votre soutien sans faille, merci pour tout.
« Alors c’est l’histoire de… »
Monsieur le Docteur Ahmad Ashraf
Vous avez survécu à tout et malgré tout, vous aimez encore la vie mais surtout vous aimez profondément les gens. Merci de me permettre de rester dans le droit chemin.
« On ne va pas transformer un mort médical en mort chirurgical ». Monsieur le Professeur Olivier Palombi
Merci de me rappeler que l’on peut être un excellent neurochirurgien tout en gardant son équilibre familial, et surtout son humour en toute circonstance.
« Je suis chirurgien, mes doigts sont mon cerveau ». Monsieur le Docteur Jean-Jacques Favre
Je suis ravie d’avoir rencontré un autre membre de cette famille Grenobloise.
Aux grand patrons, Messieurs les Professeurs Jean-Guy Passagia, Jean-Paul Chirossel et Alim-Louis Benabid, pour leur immense héritage.
Aux plus jeunes, Madame et Messieurs les Docteurs Benjamin Nicot, Stéphanie Isnard, Emmanuel De Schlichting et bien sûr Laurent Selek.
Aux Neurochirurgiens Annéciens, Messieurs les Docteurs Vivien Mendès Martins, Renaud Montessuy et Claudiu Popa, vous m’avez beaucoup appris des aventures d’un jeune
neurochirurgien, et surtout ce qui ne se trouve pas dans les livres.
Aux Neurochirurgiens de la Société Française de Neurochirurgie, pour leur grande sympathie
et leurs enseignements aux travers des différents DU, DIU et masters.
Aux Neurochirurgiens Québécois, et en particulier Monsieur le Docteur Michel Bojanowski,
• À mes Maîtres d’internat des autres spécialités pour leurs précieux enseignements venus enrichir ma formation
Madame le Docteur Valérie Fraix à qui j’aurais souhaité demander de faire partie de mon jury
de thèse si j’avais pu avoir une place de plus car je ne peux concevoir la neurologie des troubles du mouvement sans vous, merci de tout ce que vous m’avez appris et ce dont vous allez encore m’inculquer dans les prochaines années.
Aux Neuroradiologues, Messieurs les Docteurs Arnaud Attye, Kamel Boubagra, Alexis Gailloux, Olivier Heck, Adrien Kastler et Monsieur le Professeur Alexandre Krainik. Aux Neurologues, Mesdames et Messieurs les Docteurs Philippe Kahane, Sara Meoni et Madame le Professeur Elena Moro.
Aux Urologues, Messieurs les Professeurs Jean-Luc Descotes, Jean-Jacques Rambeaud et Jean-Alexandre Long, Mesdames et Messieurs les Docteurs Bernard Boillot, Caroline Thuillier, Gaelle Fiard, Nicolas Terrier et Valentin Arnoux.
Mais surtout aux femmes dans ce métier qui m’inspirent quotidiennement et qui tracent la route devant moi, les Doctoresses Florence Tahon et Sylvie Grand en neuroradiologie, Lorella
Minotti, Anne-Sophie Job-Chapron et Isabelle Favre-Wiki en neurologie.
• À tout le personnel soignant : infirmières de service, de bloc opératoire et d’anesthésie, aides-soignants, ASH, brancardiers, secrétaires, cadres, manipulateurs radio, kinésithérapeutes, que j’ai la chance de côtoyer tous les jours.
Dans le service de Neurochirurgie et au bloc opératoire de Neurochirurgie
Vous m’avez tout appris, vous m’avez nourri et soutenu, vous m’avez vu grandir.
Au bloc opératoire des Urgences
J’ai passé plus de la moitié de mon internat avec vous, puisque c’est bien connu, je suis un chat noir, mais heureusement grâce à vous, le sourire et les rires sont toujours là, même à pas d’heure.
Dans les services de Neurologie, de Neuroradiologie et d’Urologie
• Aux chercheurs et au personnel du Grenoble Institut des Neurosciences que j’ai eu la chance de côtoyer durant mon année recherche.
Madame le Docteur Brigitte Piallat
Déjà d’avoir son mentor dans sa spécialité médicale est une chance, mais d’avoir son mentor en sciences, c’est comme gagner au loto : merci d’être une source perpétuelle d’inspiration, merci d’être là, merci pour tout.
Aux filles de la plateforme Primate
Plus que du travail, maintenant nous sommes cette petite bande de copines plus soudées que dans une série télévisée ou dans un magazine de mode. Mention spéciale pour mon binôme.
9 • Au Laboratoire d’Anatomie des Alpes Françaises et son personnel toujours très
sympathique et accueillant, et toujours en musique !
• Aux étudiants en médecine, tous ces piou-pious devenus grands et qui me rappellent tous mes cours et conseils qu’ils ont a-do-rés.
• À tous mes collègues et amis que j’ai rencontré au cours de mon internat
À mes anciens et actuels co-internes de Neurochirurgie à Grenoble et à Annecy
Les United Colors of Benetton : cette petite famille internationale.
« Yâ pâ d’undicâsson neuwochiwuwgicâle »
À mes co-internes de Neurochirurgie dans toute la France
Avec en moyenne un interne par ville et par an, ça en crée des liens de tenir tous dans un amphi, merci les JNE.
À mes co-Jean-internes d’Urologie
Avec qui j’ai beaucoup rigolé. « Quand c’est bouché derrière c’est bouché devant ».
À mes collègues et amis orthopédistes
Que j’ai finalement beaucoup plus côtoyés que mes propres co-internes de DES, merci les gars de me faire autant rire. « Ça s’auto-gère ».
À mes collègues et amis des autres spécialités chirurgicales, anesthésistes-réanimateurs, radiologues et urgentistes, ça en crée des liens de passer toutes ces nuits à l’hosto.
À mes copines d’internat Sushi
Depuis Annecy jusqu’à maintenant, et pour encore toutes nos belles années ensemble devant nous. • À ma bande de potes de toujours et maintenant de Grenoble
De banlieue : les gars, on n’a pas pris une ride, on ressemble toujours à un mélange des lascars
avec le Jamel Comedy Club.
De Paris : le trio infernal, c’est la fin de 12 ans de carte étudiante !
De Montréal (et compagnie, et maintenant de Paris) : déjà qu’on était nombreux, on ne fait que
de s’agrandir sans se perdre de vue, si-si la famille.
De Grenoble : déjà 6 ans et ça ne fait que commencer…Vous me rappelez chaque jour que venir
à Grenoble reste une des plus belles choses qui me soit arrivée. • À ma famille
La famille LIU : une grosse bande de rebelles, amoureux des sciences et aucun sens de la
diplomatie depuis des générations et des générations… Merci d’être là, merci pour tout.
À toi
Merci à tout ce petit beau monde qui constitue mon entourage, aucune chance sans vous de continuer ce métier aussi fou !
SOMMAIRE
TRAVAUX LIÉS À LA THÈSE 11
ABRÉVIATIONS 13
INTRODUCTION GÉNÉRALE 14
PARTIE I : ARTICLE ORIGINAL 27
FRAMELESS ROSA® ROBOT-ASSISTED LEAD IMPLANTATION FOR DEEP BRAIN STIMULATION :
TECHNIQUE AND ACCURACY
PARTIE II : ARTICLE ORIGINAL 46
FRAMELESS ROSA® ROBOT-ASSISTED LEAD IMPLANTATION FOR DEEP BRAIN STIMULATION
FOR ADVANCED PARKINSON’S DISEASE : CLINICAL OUTCOMES AT 1-YEAR FOLLOW-UP
DISCUSSION GÉNÉRALE 70 RÉFÉRENCES BIBLIOGRAPHIQUES 75 ANNEXES 84 CONCLUSION GÉNÉRALE 135 RÉSUMÉ 137 SERMENT D’HIPPOCRATE 139
11
TRAVAUX LIÉS À LA THÈSE
• Articles soumis
Frameless ROSA® robot-assisted lead implantation for Deep Brain Stimulation : technique and accuracy
L. Liu, SG. Mariani, E. De Schlichting, S. Grand, M. Lefranc, E. Seigneuret, S. Chabardès
Soumis dans Neurosurgery le 10 septembre 2018
• Communications nationales
Stimulation cérébrale profonde assistée par le robot ROSA® :
Implantation d’électrodes de stimulation cérébrale profonde assistée par bras robotisé ROSA® : précision in vivo selon deux types d’imagerie peropératoire
L. Liu, SG. Mariani, A. Krainik, E. Seigneuret, E. Gay, S. Chabardès
Congrès annuel de la Société Française de Neurochirurgie, Grenoble – 2018
Accuracy of DBS leads placement using the ROSA robotic arm assisted frameless technique
L. Liu, E. Seigneuret, V. Fraix, A. Catriotto, A. Krainik, S. Chabardès
Congrès annuel de la Société Française de Neurochirurgie, Nantes - 2015
Stéréo-électro-encéphalographie assistée par le robot ROSA® :
SEEG : apport du robot et de l’angiographie
S. Chabardès, L. Minotti, D. Hoffmann, E. Seigneuret, O. David, AL. Benabid, P. Kahane
• Communications internationales
Stimulation cérébrale profonde assistée par le robot ROSA® :
Robot guided surgery for DBS
S. Chabardès, L. Liu, SY. Pan, E. Seigneuret
American Society for Stereotactic and Functional Neurosurgery (ASSFN) Biennial Meeting, Denver, CO, USA – 2018
Robotic guided surgery for DBS
S. Chabardès, L. Liu, E. Seigneuret
V Congreso de la Sociedad Española de Neurocirugía Funcional y Estereotáctica, Palma de Mallorca, España - 2017
Robotic in Functional Neurosurgery
S. Chabardès
The joint scientific meeting of the Dutch and Belgian Neurosurgical societies, Den Bosch, The Netherlands – 2017
DBS in PD : will robotic guided surgery improve STN-DBS?
S. Chabardès
World Society for Stereotactic and Functional Neurosurgery (WSSFN) 17th quadrennial meeting
: emerging techniques and indications, Berlin, Germany – 2017 Robotic frameless DBS surgery using the ROSA robot
S. Chabardès, E. Seigneuret, L. Liu
Asian-Australasian Society for Stereotactic and Functional Neurosurgery (AASSFN) 9th meeting, Shanghai, China – 2014
Stéréo-électro-encéphalographie assistée par le robot ROSA® :
SEEG implantation technique for perisylvian seizures
D. Hoffmann, S. Chabardès, A.S Job, L. Liu, L. Minotti, P. Kahane
The 3rd International Conference on SEEG and Brain Mapping for Epilepsy, Shanghai, China -
2018
SEEG and epilepsy surgery
S. Chabardès, L. Minotti, D. Hoffmann, E. Seigneuret, O. David, AL. Benabid, P. Kahane
IRCAD, Strasbourg - 2017
13
ABRÉVIATIONS
AC, anterior commissure
ANT, anterior nucleus of the thalamus
CAPSIT-PD, Core Assessment Program for Surgical Interventional Therapies in Parkinson’s
Disease
CG25, subgenual cingulate cortex CT, computed tomography CSF, cerebrospinal fluid DBS, deep brain stimulation Dys, dystonia
ET, essential tremor
GPi, globus pallidus internus
LEDD, levodopa equivalent daily dose MRI, magnetic resonance imaging OCD, obsessive-compulsive disorders PC, posterior commissure
PD, Parkinson’s disease
PPN, pedunculopontine nucleus RE, radial error
EPI, refractory epilepsy
SEEG, stereo-electro-encephalography SMA, supplementary motor area STN, subthalamic nucleus
TRD, treatment-resistant depression TS, Tourette syndrome
UPDRS, Unified Parkinson’s Disease Rating Scale Vim, ventralis intermedius
INTRODUCTION GÉNÉRALE
1. Stimulation cérébrale profonde
La stimulation cérébrale profonde (SCP) est une technique de neuromodulation qui consiste à placer une ou deux électrode(s) au sein d’une cible anatomique précise, reliée(s) à une pile électronique 1. Le tout permet une stimulation électrique chronique généralement à haute
fréquence de cette cible, le plus souvent au sein des ganglions de la base, afin de rétablir un circuit neuronal fonctionnel 2 (Figure 1). Elle permet de traiter de manière symptomatique, non
lésionnelle et réversible à l’arrêt de la stimulation, des pathologies neurologiques pharmacorésistantes comme la maladie de Parkinson idiopathique, indication phare et historique de la SCP 3–9. Actuellement, plus de 100 000 patients parkinsoniens sont traités par SCP à travers
le monde 10. Grâce au succès thérapeutique franc mais surtout grâce à sa réversibilité, la SCP a
connu un élargissement rapide de ses indications à d’autres pathologiques neurologiques comme le tremblement essentiel 11, les dystonies 12 ou l’épilepsie réfractaire 13, mais aussi à des pathologies
neuropsychiatriques comme les troubles obsessionnels compulsifs 14, la dépression sévère 15 ou
encore récemment le syndrome de Gilles de la Tourette 16.
Figure 1 : Stimulation cérébrale profonde (SCP)
Ce système électrique reliant une ou deux électrode(s) intracérébrale(s) à une pile électronique permet une stimulation électrique chronique mais réversible à l’arrêt de celle-ci (Pasieka/Science photo library).
15 2. Techniques chirurgicales
2.1. La stéréotaxie
L’implantation des électrodes de SCP se réalise par voie stéréotaxique 17. La stéréotaxie est une
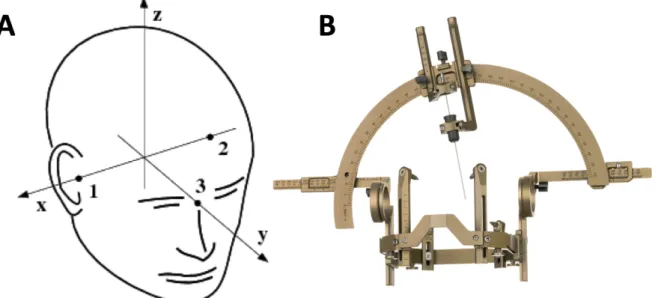
technique neurochirurgicale permettant de définir de façon très précise la position d’une structure cérébrale sans avoir à « ouvrir » le crâne, grâce à sa mise en correspondance dans les 3 plans de l’espace et définie par ses coordonnées stéréotaxiques dans les axes x, y et z. L’environnement stéréotaxique requière traditionnellement l’utilisation d’un cadre de stéréotaxie (Figure 2).
Figure 2 : Stéréotaxie
2.A : Coordonnées stéréotaxiques (axe x : latéralité ; axe y : antéro-postériorité ; axe z : profondeur) ; 2.B : Cadre de stéréotaxie Leksell G (Elekta, Stockholm, Suède).
2.2. Diversification des techniques
Depuis les premières chirurgies de SCP pour la maladie de Parkinson datant des années fin 1980 - début 1990 3,4, la technique traditionnelle utilisant un cadre est restée maîtresse de son art.
Toutefois, l’inconfort du patient et la courbe d’apprentissage fastidieuse de la technique chirurgicale avec cadre ont incité de nombreuses équipes neurochirurgicales à développer des alternatives techniques solides et en particulier grâce à l’amélioration significative des modalités d’imagerie neuroradiologique, avec la tomodensitométrie (TDM) et l’imagerie par résonnance magnétique (IRM). En effet, l’apparition de techniques sans utilisation de cadre stéréotaxique 18
avait pour but notamment d’une part d’améliorer le confort du patient durant cette intervention à visée purement fonctionnelle, et d’autre part de simplifier la procédure chirurgicale dont l’environnement stéréotaxique qu’elle requière nécessite de valider de nombreuses étapes chirurgicales, pouvant être une grande source d’erreurs accumulées 19.
2.3. Évaluation des nouvelles techniques
La précision de la technique d’implantation des électrodes de SCP est garante de l’efficacité clinique de la stimulation 20–24. Ainsi toute nouvelle technique chirurgicale doit donc en premier
lieu être validée par des études de précision in vivo avant de pouvoir être évaluée pour son efficacité clinique à long terme. Elle se définit de plusieurs manières : par l’erreur vectorielle en 3 dimensions (axes x, y et z) ou par l’erreur radiale en 2 dimensions (axes x et y, pour une position z donnée). Elle représente la distance la plus courte entre le centre de l’artéfact de l’électrode et la cible anatomique visée sur différentes imageries de contrôle intraopératoire et/ou postopératoire 25
17 Figure 3 : Étude de la précision de la technique chirurgicale
L’erreur vectorielle (Euclidean error -d-) se mesure en 3 dimensions (coordonnées x, y et z) et l’erreur radiale (Radial error -r-) se mesure en 2 dimensions (coordonnées x et y, pour une coordonnée z donnée), au niveau du contact de l’électrode (Electrode Contact -EC-) au sein de la cible anatomique (Planned target) entre la trajectoire planifiée (Planned trajctory) et l’électrode de SCP implantée (Implanted DBS lead), d’après Li et collègues 25.
Les techniques sans cadre offrent une précision similaire aux techniques plus traditionnelles avec cadre, de l’ordre de 1 à 3 millimètres en moyenne, et ce, malgré l’utilisation de l’imagerie de contrôle intraopératoire par des téléradiographies ou des scanners 18. Seules les techniques utilisant
l’IRM intraopératoire a permis de réduire l’imprécision en dessous du millimètre, mais leur principal inconvénient réside dans l’accès à ce type d’imagerie très spécifique en pratique routinière 26.
3. Les robots stéréotaxiques 3.1. Historique
Les premières utilisations des robots chirurgicaux en neurochirurgie stéréotaxique datent des années 1980 27,28. Le premier robot fut le PUMA 200 (Staubli International AG, Pfaffikon, Suisse)
venant directement de l’industrie automobile 29 . Il s’agissait d’un bras robotisé porte-instrument
qui permettait de réaliser des biopsies après avoir planifié la trajectoire sur l’imagerie préopératoire mais n’intégrait pas d’imagerie intraopératoire pour limiter le « brain shift ». Ceci fut chose faite avec le robot MINERVA® (Université de Lausanne, Lausanne, Suisse) mais ce dernier ne possédait qu’un seul axe de mobilité 30. Puis différents bras robotisés stéréotaxiques incluant de
nombreux degrés de mobilité et de l’imagerie intraopératoire furent développés au cours des années 2000 afin de pouvoir les utiliser en pratique courante : le Neuromate® (Renishaw, Wotton-under-Edge, Royaume-Uni) 31, le Zeiss MKM (Carl Zeiss AG, Oberkochen, Allemagne) 32, le
NeuroMaster (Robotic Institute of Beihang University, Beijing, Chine) 33, le Surgiscope® (ISIS
SAS, Saint-Ismier, France) 34, le PathFinder Robot (Prosurgics, Wycombe, Royaume-Uni) 35, le
ROSA® (Zimmer Biomet, Warsaw, États-Unis) 36, le Renaissance® (Mazor Robotics, Caesarea,
Israël) 37 et enfin le iSYS1® (Medizintechnik GmbH, Kitzbühel, Autriche) 38.
3.2. Avantages
Ces robots stéréotaxiques, comme le robot ROSA® avec ses 6 degrés de mobilité et sa plateforme de planification chirurgicale avec le logiciel ROSANA® (Zimmer Biomet, Warsaw, États-Unis), permettent à la fois de planifier et de réaliser l’implantation des électrodes de SCP en conditions stéréotaxiques grâce au bras robotisé qui sert de porte-instrument, tout en intégrant différentes modalités d’imagerie de contrôle intraopératoire 39–41. Leur premier objectif était d’améliorer la
précision mais surtout la répétabilité d’implanter toujours l’électrode de manière très précise et sécurisée au sein de sa cible, en éliminant le facteur humain 42,43 (Figure 4). Mais leur principal
intérêt réside en leur capacité, lorsqu’ils sont couplés avec un contrôle d’imagerie intraopératoire de qualité, de corriger de manière simple et immédiate la position du bras robotisé si une erreur de précision entre la planification et la position des instruments est objectivée à l’imagerie durant la chirurgie. Les autres avantages des robots sont notamment une grande rigidité mécanique garante d’une certaine précision et fiabilité, une flexibilité du bras robotisé avec de nombreux degrés de mobilité permettant d’établir de nombreuses trajectoires pour atteindre diverses cibles anatomiques durant une seule et même intervention, permettant de réaliser des procédures d’implantation multiples ou bilatérales sans avoir à calculer des cordonnées stéréotaxiques 41.
19 Figure 4 : Amélioration de la précision chirurgicale par le robot stéréotaxique
3.A : Concepts de précision et de répétabilité chirurgicales d’après Bot et collègues 42 : le robot
permet d’améliorer la précision (accurate) en améliorant la répétabilité (precise) en évitant les situations inverses (innacurate ; imprecise) ; 3.B : Le robot ROSA® avec ses 6 degrés de mobilité et sa plateforme de planification chirurgicale avec le logiciel ROSANA® (Zimmer Biomet, Warsaw, États-Unis).
3.3. Utilisations actuelles
De nombreux centres ont déjà adoptés les techniques robotisées pour les biopsies stéréotaxiques 44 ou encore pour les stéréo-électro-encéphalo-graphies (SEEG) pour le bilan des
épilepsies pharmacorésistantes 45,46. Ces techniques sont aussi adaptées à la population pédiatrique 47,48. Concernant la SCP, les premiers résultats ont été prometteurs, en particulier quant à la
précision in vivo, en atteignant une précision infra-millimétrique dans des séries de patients assez larges mais ces dernières techniques ont utilisé un cadre stéréotaxique en plus du bras robotisé
36,49,50. D’autres équipes ont développé des techniques robotisées sans cadre mais les patients
étaient peu nombreux et donc la précision mesurée restait de l’ordre du millimètre 51,52. Depuis
plusieurs années, nous avons développé en pratique routinière une technique robotisée d’implantation d’électrodes de SCP utilisant le robot ROSA® en s’affranchissant du cadre stéréotaxique par l’utilisation de fiduciaires osseux.
4. Objectifs du travail
Les objectifs de ce travail étaient d’évaluer par une étude monocentrique dans un premier temps la précision de notre technique chirurgicale robotisée pour l’implantation d’électrodes de SCP utilisant le robot ROSA® et en l’absence de cadre, puis d’évaluer dans un second temps son efficacité à un an appliquée à la stimulation subthalamique bilatérale pour la maladie de Parkinson.
5. Présentation du travail
Après cette introduction générale, ce travail s’articule en deux parties. La première partie de ce travail concernant la précision de notre technique chirurgicale assistée par le bras robotisé ROSA®, se présente sous la forme d’un article original en anglais, actuellement soumis dans la revue Neurosurgery. La seconde partie de ce travail concernant l’évaluation de cette technique au regard de l’efficacité clinique à un an chez des patients Parkinsoniens opérés pour stimulation bilatérale du noyau subthalamique, se présente sous la forme d’un article original en anglais, qui sera bientôt soumis dans cette même revue une fois que nous aurons résolu les différentes problématiques que soulèvent ce second travail. En effet, dans la discussion générale résumant les conclusions tirées de ces deux articles, nous avancerons plusieurs hypothèses afin de répondre aux différentes problématiques que soulèvent cette thèse, notamment dans sa seconde partie. Nous terminerons ce travail par une conclusion générale.
21 RÉFÉRENCES
1. Brocker DT, Grill WM. Principles of Electrical Stimulation of Neural Tissue. Vol 116. 1st ed. Elsevier B.V.; 2013. doi:10.1016/B978-0-444-53497-2.00001-2.
2. Agnesi F, Johnson MD, Vitek JL. Deep Brain Stimulation. How Does It Work? Vol 116. 1st ed. Elsevier B.V.; 2013. doi:10.1016/B978-0-444-53497-2.00004-8.
3. Benabid AL, Pollack P, Loveau A, Henry S, de Rougemont J. Combined (Thalamototmy and Stimulation) Stereotactic Surgery of the VM Thalamic Nucleus for Bilateral Parkinson Disease. Stereotact Funct Neurosurg. 1987;50(1-6):344-346. doi:10.1159/000100803. 4. Benabid AL, Pollak P, Seigneuret E, Hoffmann D, Gay E, Perret J. Chronic VIM thalamic
stimulation in Parkinson’s disease, essential tremor and extra-pyramidal dyskinesias. Acta
Neurochir Suppl (Wien). 1993;58:39-44. http://www.ncbi.nlm.nih.gov/pubmed/8109299.
Accessed September 10, 2018.
5. Limousin P, Pollak P, Benazzouz A, et al. Effect of parkinsonian signs and symptoms of bilateral subthalamic nucleus stimulation. Lancet. 1995;345(0140-6736 (Print)):91-95. doi:10.1016/S0140-6736(95)90062-4.
6. Limousin P, Krack P, Pollak P, et al. Electrical stimulation of the subthalamic nucleus in
advanced PD. N Engl J Med. 1998;339(16):1105-1111.
doi:10.1056/NEJM199810153391603.
7. Krack P, Limousin P, Benabid AL, Pollak P. Chronic stimulation of subthalamic nucleus improves levodopa-induced dyskinesias in Parkinson’s disease. Lancet (London, England). 1997;350(9092):1676. doi:10.1016/S0140-6736(05)64273-0.
8. Benabid AL, Pollak P, Gao D, et al. Chronic electrical stimulation of the ventralis intermedius nucleus of the thalamus as a treatment of movement disorders. J Neurosurg. 1996;84(2):203-214. doi:10.3171/jns.1996.84.2.0203.
9. Benabid AL, Chabardes S, Mitrofanis J, Pollak P. Deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson’s disease. Lancet Neurol. 2009;8(1):67-81. doi:10.1016/S1474-4422(08)70291-6.
10. Strauss I, Kalia SK, Lozano AM. Where are we with surgical therapies for Parkinson’s disease? Park Relat Disord. 2014;20(SUPPL.1):S187-S191. doi:10.1016/S1353-8020(13)70044-0.
11. Nazzaro JM, Lyons KE, Pahwa R. Deep Brain Stimulation for Essential Tremor. Vol 116. 1st ed. Elsevier B.V.; 2013. doi:10.1016/B978-0-444-53497-2.00013-9.
12. Vidailhet M, Jutras MF, Roze E, Grabli D. Deep Brain Stimulation for Dystonia. Vol 116. 1st ed. Elsevier B.V.; 2013. doi:10.1016/B978-0-444-53497-2.00014-0.
13. Fisher RS. Deep Brain Stimulation for Epilepsy. Vol 116. 1st ed. Elsevier B.V.; 2013. doi:10.1016/B978-0-444-53497-2.00017-6.
14. Laxton AW, Lipsman N, Lozano AM. Deep Brain Stimulation for Cognitive Disorders. Vol 116. 1st ed. Elsevier B.V.; 2013. doi:10.1016/B978-0-444-53497-2.00025-5.
15. Schlaepfer TE, Bewernick BH. Deep Brain Stimulation for Major Depression. Vol 116. 1st ed. Elsevier B.V.; 2013. doi:10.1016/B978-0-444-53497-2.00018-8.
16. Visser-Vandewalle V, Kuhn J. Deep Brain Stimulation for Tourette Syndrome. Vol 116. 1st ed. Elsevier B.V.; 2013. doi:10.1016/B978-0-444-53497-2.00020-6.
17. Khan FR, Henderson JM. Deep Brain Stimulation Surgical Techniques. Vol 116. 1st ed. Elsevier B.V.; 2013. doi:10.1016/B978-0-444-53497-2.00003-6.
18. Palys V, Holloway KL. Frameless Functional Stereotactic Approaches. Prog Neurol Surg. 2018;33:168-186. doi:10.1159/000481102.
19. Zrinzo L. Pitfalls in precision stereotactic surgery. Surg Neurol Int. 2012;3(2):53. doi:10.4103/2152-7806.91612.
20. Papavassiliou E, Rau G, Heath S, et al. Thalamic Deep Brain Stimulation for Essential Tremor: Relation of Lead Location to Outcome. Neurosurgery. 2004;54(5):1120-1130. doi:10.1227/01.NEU.0000119329.66931.9E.
21. McClelland S, Ford B, Senatus PB, et al. Subthalamic stimulation for Parkinson disease: determination of electrode location necessary for clinical efficacy. Neurosurg Focus. 2005;19(5):E12. doi:10.3171/foc.2005.19.5.13.
22. Anheim M, Batir A, Seigneuret E, Krack P, Benabid A, Pollak P. Improvement in Parkinson Disease by Subthalamic Nucleus Stimulation Based on Electrode Placement. Arch Neurol. 2008;65(5):612-616.
23. Ellis TM, Foote KD, Fernandez HH, et al. Reoperation for suboptimal outcomes after deep
brain stimulation surgery. Neurosurgery. 2008;63(4):754-760.
doi:10.1227/01.NEU.0000325492.58799.35.
24. Richardson RM, Ostrem JL, Starr PA. Surgical repositioning of misplaced subthalamic electrodes in Parkinson’s disease: Location of effective and ineffective leads. Stereotact
Funct Neurosurg. 2009;87(5):297-303. doi:10.1159/000230692.
25. Li Z, Zhang JG, Ye Y, Li X. Review on Factors Affecting Targeting Accuracy of Deep Brain Stimulation Electrode Implantation between 2001 and 2015. Stereotact Funct
Neurosurg. 2017;94(6):351-362. doi:10.1159/000449206.
26. Chabardes S, Isnard S, Castrioto A, et al. Surgical implantation of STN-DBS leads using intraoperative MRI guidance: technique, accuracy, and clinical benefit at 1-year follow-up.
23
Acta Neurochir (Wien). 2015;157(4):729-737. doi:10.1007/s00701-015-2361-4.
27. Young RF. Application of robotics to stereotactic neurosurgery. Neurol Res. 1987;9(2):123-128. doi:10.1080/01616412.1987.11739782.
28. Benabid A, Cinquin P, Lavallee S, Le Bas J, Demongeot J, de Rougemont J. Computer-Driven Robot for Stereotactic Surgery Connected to CT Scan and Magnetic Resonance Imaging. Meet Am Soc Stereotact Funct Neurosurg. 1987:153-154. doi:10.1159/000100701.
29. Kwoh YS, Hou J, Jonckheere EA, Hayati S. A Robot with Improved Absolute Positioning Accuracy for CT Guided Stereotactic Brain Surgery. IEEE Trans Biomed Eng. 1988. doi:10.1109/10.1354.
30. Glauser D, Fankhauser H, Epitaux M, Hefti JL, Jaccottet A. Neurosurgical robot minerva: First results and Current developments. Comput Aided Surg. 1995. doi:10.3109/10929089509106332.
31. Li QH, Zamorano L, Pandya A, Perez R, Gong J, Diaz F. The application accuracy of the NeuroMate robot - A quantitative comparison with frameless and frame-based surgical localization systems. Comput Aided Surg. 2002. doi:10.1002/igs.10035.
32. Willems PWA, Noordmans HJ, Ramos LMP, et al. Clinical evaluation of stereotactic brain biopsies with an MKM-mounted instrument holder. Acta Neurochir (Wien). 2003. doi:10.1007/s00701-003-0112-4.
33. Junchuan L, Yuru Z, Zhen L. The application accuracy of NeuroMaster: A robot system for stereotactic neurosurgery. Proc 2nd IEEE/ASME Int Conf Mechatron Embed Syst Appl
MESA 2006. 2007;(37). doi:10.1109/MESA.2006.296994.
34. Zhao JZ, Wang S, Wang DJ, et al. Application of frameless stereotaxy in craniotomy procedures: Clinical evaluation. Neurosurg Q. 2003. doi:10.1097/00013414-200303000-00005.
35. Eljamel MS. Robotic application in epilepsy surgery. Int J Med Robot Comput Assist Surg. 2006. doi:10.1002/rcs.97.
36. Lefranc M, Capel C, Pruvot AS, et al. The impact of the reference imaging modality, registration method and intraoperative flat-panel computed tomography on the accuracy of the ROSA® stereotactic robot. Stereotact Funct Neurosurg. 2014;92(4):242-250. doi:10.1159/000362936.
37. Grimm F, Naros G, Gutenberg A, Keric N, Giese A, Gharabaghi A. Blurring the boundaries between frame-based and frameless stereotaxy: feasibility study for brain biopsies performed with the use of a head-mounted robot. J Neurosurg. 2015.
doi:10.3171/2014.12.JNS141781.
38. Dorfer C, Minchev G, Czech T, et al. A novel miniature robotic device for frameless implantation of depth electrodes in refractory epilepsy. J Neurosurg. 2017. doi:10.3171/2016.5.JNS16388.
39. Doulgeris JJ, Gonzalez-Blohm SA, Filis AK, Shea TM, Aghayev K, Vrionis FD. Robotics in Neurosurgery: Evolution, Current Challenges, and Compromises. Cancer Control. 2015;22(3):352-359. doi:10.1177/107327481502200314.
40. Smith JA, Jivraj J, Wong R, Yang V. 30 Years of Neurosurgical Robots: Review and Trends for Manipulators and Associated Navigational Systems. Ann Biomed Eng. 2016;44(4):836-846. doi:10.1007/s10439-015-1475-4.
41. Fomenko A, Serletis D. Robotic Stereotaxy in Cranial Neurosurgery: A Qualitative Systematic Review. Neurosurgery. 2017;0(0):1-9. doi:10.1093/neuros/nyx576.
42. Bot M, Van Den Munckhof P, Bakay R, Sierens D, Stebbins G, Verhagen Metman L. Analysis of Stereotactic Accuracy in Patients Undergoing Deep Brain Stimulation Using Nexframe and the Leksell Frame. Stereotact Funct Neurosurg. 2015;93(5):316-325. doi:10.1159/000375178.
43. Mazzone P, Arena P, Cantelli L, et al. Experimental new automatic tools for robotic stereotactic neurosurgery: towards “no hands” procedure of leads implantation into a brain target. J Neural Transm. 2016;123(7):737-750. doi:10.1007/s00702-016-1575-9.
44. Bekelis K, Radwan TA, Desai A, Roberts DW. Frameless robotically targeted stereotactic brain biopsy: feasibility, diagnostic yield, and safety. J Neurosurg. 2012;116(5):1002-1006. doi:10.3171/2012.1.JNS111746.
45. Cardinale F, Cossu M, Castana L, et al. Stereoelectroencephalography: Surgical methodology, safety, and stereotactic application accuracy in 500 procedures.
Neurosurgery. 2013;72(3):353-366. doi:10.1227/NEU.0b013e31827d1161.
46. González-Martínez J, Bulacio J, Thompson S, et al. Technique, results, and complications related to robot-assisted stereoelectroencephalography. Neurosurgery. 2016;78(2):169-179. doi:10.1227/NEU.0000000000001034.
47. De Benedictis A, Trezza A, Carai A, et al. Robot-assisted procedures in pediatric neurosurgery. Neurosurg Focus. 2017;42(5):E7. doi:10.3171/2017.2.FOCUS16579. 48. Abel TJ, Varela Osorio R, Amorim-Leite R, et al. Frameless robot-assisted
stereoelectroencephalography in children: technical aspects and comparison with Talairach frame technique. J Neurosurg Pediatr. 2018:1-10. doi:10.3171/2018.1.PEDS17435. 49. Von Langsdorff D, Paquis P, Fontaine D. In vivo measurement of the frame-based
25 application accuracy of the Neuromate neurosurgical robot. J Neurosurg. 2015;122(1):191-194. doi:10.3171/2014.9.JNS14256.
50. Lefranc M, Zouitina Y, Tir M, et al. Asleep Robot-Assisted Surgery for the Implantation of Subthalamic Electrodes Provides the Same Clinical Improvement and Therapeutic Window as Awake Surgery. World Neurosurg. 2017;106:602-608. doi:10.1016/j.wneu.2017.07.047. 51. Varma TRK, Eldridge PR, Forster A, et al. Use of the NeuroMate stereotactic robot in a frameless mode for movement disorder surgery. Stereotact Funct Neurosurg. 2003;80(1-4):132-135. doi:10.1159/000075173.
52. Vadera S, Chan A, Lo T, et al. Frameless Stereotactic Robot-Assisted Subthalamic Nucleus Deep Brain Stimulation: Case Report. World Neurosurg. 2015;97:762.e11-762.e14. doi:10.1016/j.wneu.2015.11.009.
53. Hariz MI. Complications of deep brain stimulation surgery. Mov Disord. 2002;17(SUPPL. 3):162-166. doi:10.1002/mds.10159.
54. Deuschl G, Agid Y. Subthalamic neurostimulation for Parkinson’s disease with early fluctuations: Balancing the risks and benefits. Lancet Neurol. 2013;12(10):1025-1034. doi:10.1016/S1474-4422(13)70151-0.
55. Deuschl G. A Randomized Trial of Deep-Brain Stimulation for Parkinson. N Engl J Med. 2006;355:896-908. doi:10.1056/NEJMoa060281.
56. Follett KA, Weaver FM, Stern M, et al. Pallidal versus Subthalamic Deep-Brain Stimulation for Parkinson’s Disease. N Engl J Med. 2010;362(22):2077-2091. doi:10.1056/NEJMoa0907083.
57. Odekerken VJJ, van Laar T, Staal MJ, et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson’s disease (NSTAPS study): A randomised controlled trial. Lancet Neurol. 2013;12(1):37-44. doi:10.1016/S1474-4422(12)70264-8.
58. Okun MS, Gallo B V., Mandybur G, et al. Subthalamic deep brain stimulation with a constant-current device in Parkinson’s disease: An open-label randomised controlled trial.
Lancet Neurol. 2012;11(2):140-149. doi:10.1016/S1474-4422(11)70308-8.
59. Schuepbach WMM, Rau J, Knudsen K, et al. Neurostimulation for Parkinson’s Disease with Early Motor Complications. N Engl J Med. 2013;368(7):610-622. doi:10.1056/NEJMoa1205158.
60. Williams A, Gill S, Varma T, et al. Deep brain stimulation plus best medical therapy versus best medical therapy alone for advanced Parkinson’s disease (PD SURG trial): a randomised, open-label trial. Lancet Neurol. 2010;9(6):581-591.
doi:10.1016/S1474-4422(10)70093-4.
61. The Deep-Brain Stimulation For Parkinson’s Disease Study Group. Deep-Brain Stimulation of the Subthalamic Nucleus or the Pars Interna of the Globus Pallidus in Parkinson’s Disease. N Engl J Med. 2001. doi:10.1056/NEJMoa000827.
62. Krack P, Batir A, Van Blercom N, et al. Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson’s disease. N Engl J Med. 2003;349(20):1925-1934. doi:10.1056/NEJMoa035275.
63. Krack P, Fraix V, Mendes A, Benabid A-L, Pollak P. Postoperative management of subthalamic nucleus stimulation for Parkinson’s disease. Mov Disord. 2002. doi:10.1002/mds.10163.
64. Thobois S, Ardouin C, Lhommée E, et al. Non-motor dopamine withdrawal syndrome after surgery for Parkinson’s disease: Predictors and underlying mesolimbic denervation. Brain. 2010. doi:10.1093/brain/awq032.
65. Castrioto A, Volkmann J, Krack P. Postoperative Management of Deep Brain Stimulation
in Parkinson’s Disease. Vol 116. 1st ed. Elsevier B.V.; 2013.
doi:10.1016/B978-0-444-53497-2.00011-5.
66. Defer G, Widner H, Marie R. Core Assessment Program for Surgical Interventional Therapies in Parkinson ’ s Disease ( CAPSIT-PD ). 1999;14(4):572-584.
27
PARTIE I : ARTICLE ORIGINAL
TITLE
Frameless ROSA® robot-assisted lead implantation for Deep Brain Stimulation : technique and accuracy
SHORT TITLE Robotic guided DBS AUTHORS
Lannie Liu, MD*, Sarah Giulia Mariani, MD‡, Emmanuel De Schlichting, MD*, Sylvie
Grand, MD¶, Michel Lefranc, MD, PHD§, Eric Seigneuret, MD*, Stéphan Chabardès, MD*†#.
*Department of Neurosurgery, Grenoble-Alpes University Hospital, La Tronche, France ‡Department of Neurosurgery, Marseille La Timone University Hospital, Marseille, France ¶Department of Neuroradiology, Grenoble-Alpes University Hospital, La Tronche, France §Department of Neurosurgery, Amiens-Picardie University Hospital, Amiens, France †INSERM U1216, Grenoble Institute of Neurosciences, La Tronche, France
#Clinatec, CEA-Minatec, Grenoble, France.
Correspondence :
Stéphan Chabardès, MD,
Department of Neurosurgery, Grenoble-Alpes University Hospital, La Tronche, France Boulevard de la Chantourne, 38700 La Tronche, France
E-mail : schabardes@chu-grenoble.fr
Conflict of Interest :
Dr. Chabardès declares to be a consultant for Zimmer Biomet (Warsaw, USA)
Disclosure of Funding :
ABSTRACT
BACKGROUND : Frameless robotic-assisted surgery is an innovative technique for Deep Brain
Stimulation (DBS) that has not been assessed in a large cohort of patients yet.
OBJECTIVE : To evaluate accuracy of DBS lead placement using the ROSA® robot and a
frameless registration.
METHODS : An open label single-center study was conducted on all patients undergoing DBS
surgery prospectively including them between 2012 and 2016. Accuracy was evaluated by the radial error (RE) of the first stylet implanted and RE of the final lead position at the target level, and was measured on intraoperative telemetric X-Rays (Group 1) ; on intraoperative O-Arm® CT scans (Group 2) and on postoperative CT scans or MRI.
RESULTS : Regarding a total of 119 out of 144 consecutive patients (123 DBS ; 186 stylets ; 192
leads), the mean RE was 0.57±0.02 mm for intraoperative stylet ; 0.72±0.03 mm for intraoperative lead and 0.88±0.04 mm for postoperative lead on CT scans in Group 1 (76 patients). The mean RE was 0.68±0.05 mm for intraoperative stylet ; 0.75±0.04 mm for intraoperative lead ; 0.86±0.05 mm and 1.10±0.08 mm for postoperative lead on CT scans and on MRI respectively in Group 2 (43 patients). No statistical difference was found between accuracy measurements on the different intraoperative imaging modalities and postoperative CT scans but a significant difference was found on postoperative MRI.
CONCLUSION : Frameless ROSA® robot-assisted technique for DBS reached sub-millimeter
accuracy. Intraoperative CT scans appeared to be reliable and sufficient to control final lead position.
KEY WORDS : Accuracy, Deep Brain Stimulation, Robotic, Frameless technique, Intraoperative
imaging, Functional and Stereotactic Neurosurgery
ABBREVIATIONS : ANT, anterior nucleus of the thalamus ; CG25, subgenual cingulate cortex
; Dys, dystonia ; ET, essential tremor ; GPi, globus pallidus internus ; OCD, obsessive-compulsive disorders ; PD, Parkinson’s disease ; PPN, pedunculopontine nucleus ; EPI, refractory epilepsy ;
STN, subthalamic nucleus ; TRD, treatment-resistant depression ; TS, Tourette syndrome ; Vim,
29
INTRODUCTION
Accurate placement of the lead in the appropriate target is the main goal to achieve best clinical outcomes after Deep Brain Stimulation (DBS) 1–5. Thus, all surgical techniques developed over
the years for DBS routine practice had to be evaluated for the accuracy, defined as the vector error (VE) in the 3D plane (x, y and z axes) or as the radial error (RE) in the 2D plane (x and y axes). High accuracy can be obtained with traditional frame-based or frameless techniques showing a range of 1 to 3 millimeters in average, and more recently, with intraoperative CT scans or MRI guided-techniques showing a range of 0.6 to 2 millimeters in average 6,7. However, many technical
factors related to the stereotactic frame can contribute to inaccuracy such as mismatch position of the frame during image acquisition and surgery, magnetic resonance imaging (MRI) distortions that can be aggravated by the presence of the frame itself (especially with high field MRI), lack of calibration and possible deformation of the frame itself 8. Frameless techniques have been
developed to reduce MRI distortions related to the frame in addition to improve comfort of the patient during surgery, but have achieved similar accuracy compared to frame-based techniques despite the recent use of intraoperative CT scan control 9,10. On the other hand, intraoperative
MRI-guided techniques allowed minimizing errors by avoiding frame-based co-registration and image fusion while permitting intraoperative checking of final lead position, reducing in most of the cases the imprecision under the millimeter 11–13. But its routine application on a daily basis can meet
some technical or cost-effective limitations. Therefore, robotic-assisted techniques have emerged to improve the accuracy but also the precision, which refers to the reproducibility of placing the lead into the target 14. Very few centers had reported experience with such techniques for DBS 15– 18, and preliminary results are promising as it had reached submillimeter accuracy using a
frame-based registration 16,17. But robotic-assisted techniques with a frameless approach had not been
reported in large case series yet. The present study aimed at evaluating in vivo accuracy of our innovative technique for DBS lead implantation, using frameless registration with bone fiducials, the ROSA® robot (Zimmer Biomet, Warsaw, USA) and 2 types of intraoperative imaging control.
METHODS
1. Population
We conducted an open label single-center study by prospectively including all patients undergoing DBS surgery at our center from May 2012 to April 2016 and involving different targets for different diseases. All bilateral or unilateral implantations or re-implantations were included. Surgeries were performed by two senior neurosurgeons under local or general anesthesia. Patients were separated into 2 groups according to intraoperative imaging control : Group 1 included the
first consecutive patients operated on using 2D telemetric X-Rays ; Group 2 included the last consecutive patients operated on using 3D CT scans performed with the O-Arm® Surgical Imaging System (Medtronic, Minneapolis, USA). All patients provided written informed consent before surgery and study entry.
2. Surgical procedure 2.1. DBS planification
Targeting and trajectories planning was established on the dedicated ROSANA® planning software (Zimmer Biomet, Warsaw, USA), apart from the robotic platform, allowing automatic image fusion between preoperative 3D contrast MRI and CT scan images. Preoperative images included 3D T1 with Gadolinium injection (voxel size 1x1x1mm, field of view 256x256mm, matrix 256), 3D T2 TSE (voxel size 0.98x1.22x1mm, field of view 250x199mm, matrix 156) and FGATIR (voxel size 0.9x0.89x1mm, field of view 240x211mm, matrix 268x236) sequences for MRI performed on a 3 Tesla magnet (Philips Achieva, Amsterdam, Netherlands) ; 3D CT scan images with iodine contrast agent injection (matrix 512x512; 0.8 mm thickness slices). The ROSANA® planning software provided easy checking for quality of image fusion by direct visualization of the main veins, arteries, ventricles and sulci, allowing fine and quick adjustments in the 3 plans whenever needed.
2.2. Frameless stereotactic registration
Stereotactic environment was provided by rigidly maintaining patient’s head with 4 transcranial fixations into a head holder (Dixi, Besançon, France) fixed to the floor of the operating room and the ROSA® robot rigidly fixed to the floor too. Five titanium bone fiducials (Dixi or Alcis, Besançon, France) were implanted under local anesthesia the day before surgery in order to be visualized on preoperative images and to allow frameless registration. The latter was achieved by a mechanical contact between the probe of the robot and the fiducials (Figure 1).
31 Figure 1 : Frameless registration
1.A : Bone fiducial ; 1.B : Manual registration of the bone fiducial using the probe of the robot ; 1.C : Visualization of bone fiducial on preoperative CT scan.
2.3. Intraoperative imaging control
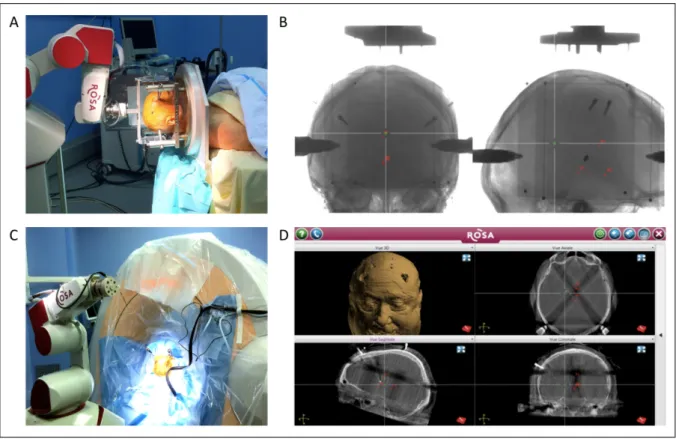
For Group 1, 2D telemetric X-Rays were performed by a generator linked to 2 flat panel detectors allowing antero-posterior (AP) and lateral views (0.2 x 0.2 mm screen definition). For Group 2, 3D CT scans were performed with the O-Arm® Surgical Imaging System (0.8 mm thickness slices ; irradiation dose 0.68 mSv -standard protocol- or 0.33 mSv -low dose protocol- per scan). For both groups, intraoperative images were automatically merged with preoperative images by the ROSANA® planning software into the same stereotactic space. Co-registration for image fusion was performed using a localizer box fixed to the robotic arm for Group 1 ; using bone fiducials visualization to check fusion accuracy for Group 2 (Figure 2). Intraoperative images were executed at each surgical step (implantation of first stylet, implantation of microelectrodes for recording and implantation of final lead), to control final lead position at the end of surgery and whenever needed.
Figure 2 : Surgical work flow with intraoperative imaging control
2.A : ROSA® robot localizer box for X-rays co-registration ; 2.B :X-rays co-registration (face and profile) ; 2.C : The ROSA® robot and the O-Arm® system installation ; 2.D :O-Arm® CT scans co-registration.
2.4. Lead implantation and postoperative control
For each side, the exact position of trajectory entry point (and of the burrhole) was showed by the laser probe of the robot. The robotic arm was then deployed and a microdriver for micro-electrode recording (MER) supporting the Ben Gun was attached on it (Alpha Omega, Nazareth, Israël). After introducing a first rigid stylet through a guide tube into the tract of the Ben Gun in order to
cross the dura (without opening it) to avoid cerebrospinal fluid leakage, the stylet was replaced by
a microelectrode for MER (Alpha Omega, Nazareth, Israël). MER and clinical testing were performed with 3 microelectrodes in average. The final lead was then implanted (Medtronic 3389, Minneapolis, USA or Boston Scientific, Valencia, USA) and anchored with suture and bone cement to the cranium as already described 19. Postoperative MRI and/or CT scan were performed
33 3. Accuracy measurements
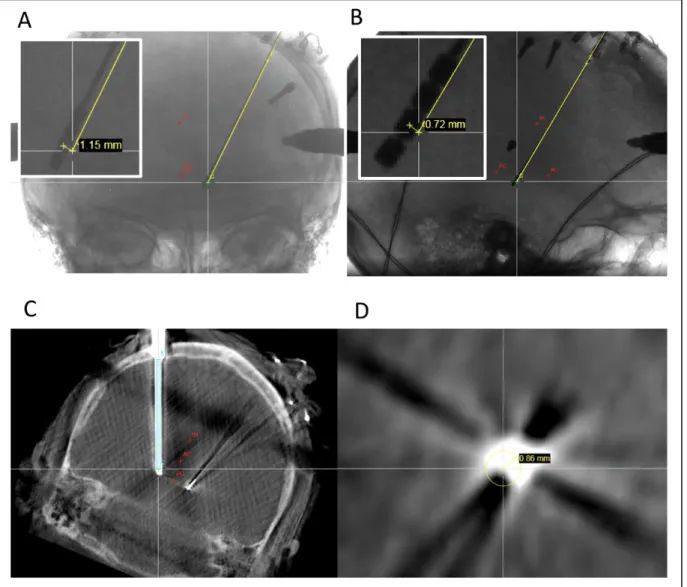
In Group 1, accuracy was evaluated by the radial error (RE) of the tip of the first stylet and of the final lead measured in x and y axes at the level of the target (for a z axis given position) and was calculated as : RE = √(#$+ &$). In Group 2, RE was represented by the shortest orthogonal distance between the planned trajectory and the tip of the first stylet or the middle of the final lead at the level of the target measured on intra- and postoperative orthogonal views, using the ROSANA® planning software. The final position of the lead was also checked on postoperative CT scans and, for Group 2, on postoperative MRI (Figure 3).
Figure 3 : Accuracy measurements on the different imaging modalities
3.A and B : On 2D telemetric X-rays (face and profile) ; 3.C and D : On 3D O-Arm® CT scans (coronal and axial planes) ; 3.E and F : On postoperative CT scans (coronal and axial planes) ; 3.G and H : On postoperative MRI (coronal and axial planes).
4. Statistical analysis
Left-side and right-side measurements were pooled and only leads implanted into the central tract of the Ben Gun were selected for final analysis. All statistical analyses were performed with the software Prism® (GraphPad, La Jolla, USA). Kruskal-Wallis test and Dunn’s post-test were used. Results were expressed as mean±SEM with p-value<0.05 for significance.
35
RESULTS
1. Population data
For final central lead analysis, we studied a total of 119 (out of 144) consecutive patients corresponding to 123 DBS, 186 stylets and 192 central leads ; 76 patients for Group 1 (80 DBS ; 126 stylets and 131 central leads represented 71% of all leads) ; 43 patients for Group 2 (43 DBS ; 60 stylets and 61 central leads represented 60% of all leads). One lead in Group 2 was excluded from analysis due to image fusion errors. Difference between the number of stylets and leads implanted was due to some re-implantations in Group 1 without the use of the stylet because of the presence of a previous lead implanted. Table 1 shows all population data and repartition between the 2 groups according to the type of implantations, type of anesthesia, age, gender, operative indications, targets, number of leads analyzed on postoperative CT scan and MRI controls.
Table 1 : Population data
Group 1 (X-Ray) Group 2 (O-Arm®) All leads Patients (n=144) 91 53 DBS (n=150) 97 53 Stylets (n=281) 179 102 Leads (n=286) 185 101‡ Central leads¥ Patients (n=119¥) 76 43 DBS (n=123¥) 80 43 Stylets (n=186) 126 60 Leads (n=192) 131 61 Bilateral/Unilateral implantations (n) 73/7 43/0 Re-implantations (n) 4£ 0 Local/General anesthesia (n) 59/21 28/15
Age at surgery (mean ± SD ; years) 53±13 55±12
Female/Male (n) 32/44 15/28 Operative indications (n) PD 57 36 Dys 8 6 ET 3 - OCD 3 - Epi 2 - TS 2 1 TRD 1 - Targets (n) STN 60 35 GPi 9 7 Vim 7 - CG25 1 - ANT 3 - PPN - 1
Postoperative central leads on CT scan (n) 83 52
Postoperative central leads on MRI (n) - 51
‡One lead excluded due to image fusion errors ; ¥ One central lead was at least implanted ; £ Re-implantations : hardware complications (2) and lead mispositions (2).
37 2. Accuracy measurements
Table 2 resumes all results.
Table 2 : Radial errors (mean ± SEM mm)
Group 1 (X-Ray) Group 2 (O-Arm®) p-value
Intraoperative stylet 0.57±0.02 0.68±0.05 NS
Intraoperative lead 0.72±0.03 0.75±0.04 NS
Postoperative lead on CT scan 0.88±0.04 0.86±0.05 NS
Postoperative lead on MRI - 1.10±0.08 -
2.1. Group 1 (X-Ray)
Mean±SEM RE was 0.57±0.02 mm for intraoperative stylet ; 0.72±0.03 mm for intraoperative lead and 0.88±0.04 mm for postoperative lead on CT scan. 94.4 % of stylets and 79.4 % of leads were deviated ≤1 mm from the target on intraoperative X-Rays while 66.3 % of leads were deviated ≤1mm from the target on postoperative CT scans. Deviation of the stylet from the target was significantly smaller than deviation of the lead from the target on intraoperative X-Rays (p<0.005) and on postoperative CT scans (p<0.001). However, no statistical difference was found between deviation of the lead from the target either on intraoperative X-Rays or on postoperative CT scans (Figure 4).
Figure 4 : Group 1 (X-Ray) accuracy measurements
Accuracy evaluated by the radial error (RE) was expressed as mean±SEM (mm) for intraoperative stylet (stylet X-Ray) ; intraoperative lead (lead X-Ray) and postoperative lead on CT scans (lead postop CT-scan). The mean RE of intraoperative stylet was significantly smaller than the mean RE of intraoperative lead (p<0.05) and of postoperative lead on CT scans (p<0.001).
2.2. Group 2 (O-Arm®)
Mean±SEM RE was 0.68±0.05 mm for intraoperative stylet ; 0.75±0.04 mm for intraoperative lead ; 0.86±0.05 mm and 1.10±0.08 mm for postoperative lead on CT scan and on MRI respectively. 83.3 % of stylets and 78.7 % of leads were deviated ≤1 mm from the target on O-Arm® CT scans ; 69.2% of leads were deviated ≤1mm from the target on postoperative CT scans and 51.0 % of leads were deviated ≤1mm from the target on postoperative MRI. Only deviation of the stylet from the target on intraoperative O-Arm® CT scans was significantly smaller than deviation of the lead from the target on postoperative MRI (p<0.001). Otherwise no statistical difference between the deviation of the lead from the target was found either on intraoperative O-Arm® CT scans or on postoperative CT scans (Figure 5).
39 Figure 5 : Group 2 (O-Arm®) accuracy measurements
Accuracy evaluated by the radial error (RE) was expressed as mean±SEM (mm) for intraoperative stylet (stylet O-Arm®) ; intraoperative lead (lead O-Arm®) ; postoperative lead on CT scans (lead postop CT-scan) and postoperative lead on MRI (lead postop MRI). The mean RE of intraoperative stylet was significantly smaller than the mean RE of postoperative lead on MRI (p<0.001).
2.3 Comparison between the 2 groups
No statistical difference was found between the 2 groups regarding the accuracy measurements either for the stylet or for the lead on intraoperative images or on postoperative CT scans.
DISCUSSION
1. Accuracy of the frameless robotic-assisted technique
This study demonstrates high accuracy reached by frameless robotic-assisted DBS surgery in the largest series reported at our best knowledge. Compared to the literature, our results are better than those obtained with conventional frame-based techniques 14,20–25 or frameless techniques 14,22,25–30
or intraoperative CT scans-guided techniques 9,10,31–35. Our results seem comparable to those
obtained with intraoperative MRI-guided techniques using ClearPoint® (MRI interventions, Irvine, USA) 11,13. Our own experience using this latest device was convincing but the difficulty
to access a MRI facility on a daily basis was the reason to look for alternative techniques 36. Also,
we have reached at least similar or even better accuracy than those obtained by other centers using robotic-assisted DBS techniques 15–18 (Table 3).
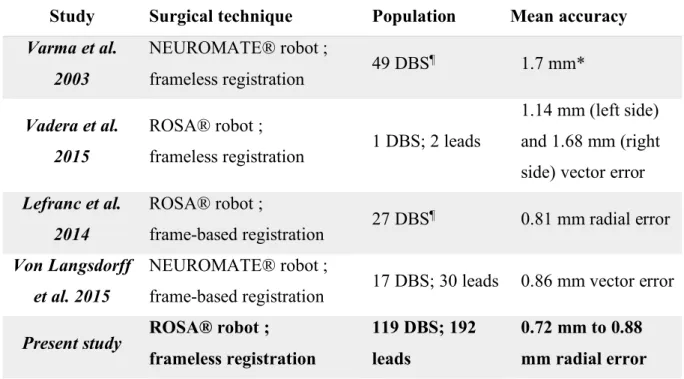
Table 3 : Clinical studies reporting accuracy of robotic-assisted techniques for DBS
Study Surgical technique Population Mean accuracy
Varma et al. 2003 NEUROMATE® robot ; frameless registration 49 DBS ¶ 1.7 mm* Vadera et al. 2015 ROSA® robot ;
frameless registration 1 DBS; 2 leads
1.14 mm (left side) and 1.68 mm (right side) vector error Lefranc et al. 2014 ROSA® robot ; frame-based registration 27 DBS ¶ 0.81 mm radial error Von Langsdorff et al. 2015 NEUROMATE® robot ;
frame-based registration 17 DBS; 30 leads 0.86 mm vector error Present study ROSA® robot ;
frameless registration
119 DBS; 192 leads
0.72 mm to 0.88 mm radial error *Accuracy calculation was not specified ; ¶Number of leads was not specified ; the
NEUROMATE® robot (Renishaw, Wotton-under-Edge, UK) ; the ROSA® robot (Zimmer Biomet, Warsaw, USA).
2. Interests of intraoperative imaging modality
No statistical difference was found for measurements of the lead on intraoperative images and on postoperative CT scans in both groups, regardless the intraoperative imaging modality. This finding suggests that intraoperative CT scans can accurately predict the final position of a lead, better than postoperative MRI, and seem to be sufficient to check for the final position of the leads, as already reported 9,10,31–35.
3. Benefits of the robotic-assisted technique
Innovative frameless robotic-assisted technique for DBS is expected to offer many features and advantages over the traditional frame-based techniques : reproducibility of the position of the arm on a given trajectory, mechanical rigidity, flexibility to allow different trajectories on different targets during a same session, facilitating bilateral and multiple procedures, avoiding the need for setting up stereotactic coordinates, reducing image distortions related to frame position, and allowing easy intraoperative adjustments inferior to 2 mm (up to 0.5 mm) in multidimensional planes if necessary. Associated with X-Rays or CT scans for intraoperative control, it may help to minimize the ratio of lead misplacements that can be responsible for almost half of the lead revision that seems to occur in 15.2% to 34.0% 37.
41 4. Limitations
Firstly, accuracy measurements did not include z axis deviation. This was on purpose, as we decided to measure the deviation of the stylet and of the lead on a perpendicular plane that was set at the level of the target. The definition of the z axis depends not only of the position of the robotic arm, but also on the setting of the microdriver that varies among patients. This axis was not considered as a major issue, as it was reported that lead deviation occurred more often in x and y planes 38. Secondly, small differences for intraoperative measurements were found between the
deviation of the lead that was higher than that of the stylet in both groups, most likely because of a greater lead flexibility compared to stylet rigidity, with the consequence that a slight displacement is still possible from the stylet position. The robotic arm itself cannot be responsible for these differences due to its fixed position during the whole procedure. It is very unlikely that a brain shift might have occurred and might be responsible for some additional deviation of the lead, as we do not open the dura in order to prevent any cerebrospinal fluid leakage. A less likely possibility is the movement of patient head relative to the robotic arm position which is prevented by a rigid fixation of patient head during surgery. In Group 2, a significant difference was found only between the stylet and the lead on postoperative MRI, likely due to the error induced by a bigger diameter of the lead artifact on MRI with the center of the artifact not always corresponding to the center of the lead, as already reported 9.
5. Conclusion
This present study has demonstrated the ability to achieve sub-millimetric accuracy with high precision using innovative frameless ROSA® robot-assisted technique for DBS lead implantation. In addition to provide a straight forward workflow, the ROSA® robotic arm is a very reliable surgical instrument that can be used in routine practice for DBS.
DISCLOSURE
Dr. Chabardès declares to be a consultant for Zimmer Biomet (Warsaw, USA). The other authors declare no conflict of interest in any of the materials or devices described in this article.
REFERENCES
1. Anheim M, Batir A, Seigneuret E, Krack P, Benabid A, Pollak P. Improvement in Parkinson Disease by Subthalamic Nucleus Stimulation Based on Electrode Placement. Arch Neurol. 2008;65(5):612-616.
2. Ellis TM, Foote KD, Fernandez HH, et al. Reoperation for suboptimal outcomes after deep
brain stimulation surgery. Neurosurgery. 2008;63(4):754-760.
doi:10.1227/01.NEU.0000325492.58799.35.
3. McClelland S, Ford B, Senatus PB, et al. Subthalamic stimulation for Parkinson disease: determination of electrode location necessary for clinical efficacy. Neurosurg Focus. 2005;19(5):E12. doi:10.3171/foc.2005.19.5.13.
4. Papavassiliou E, Rau G, Heath S, et al. Thalamic Deep Brain Stimulation for Essential Tremor: Relation of Lead Location to Outcome. Neurosurgery. 2004;54(5):1120-1130. doi:10.1227/01.NEU.0000119329.66931.9E.
5. Richardson RM, Ostrem JL, Starr PA. Surgical repositioning of misplaced subthalamic electrodes in Parkinson’s disease: Location of effective and ineffective leads. Stereotact
Funct Neurosurg. 2009;87(5):297-303. doi:10.1159/000230692.
6. Li Z, Zhang JG, Ye Y, Li X. Review on Factors Affecting Targeting Accuracy of Deep Brain Stimulation Electrode Implantation between 2001 and 2015. Stereotact Funct
Neurosurg. 2017;94(6):351-362. doi:10.1159/000449206.
7. Palys V, Holloway KL. Frameless Functional Stereotactic Approaches. Prog Neurol Surg. 2018;33:168-186. doi:10.1159/000481102.
8. Zrinzo L. Pitfalls in precision stereotactic surgery. Surg Neurol Int. 2012;3(2):53. doi:10.4103/2152-7806.91612.
9. Holloway K, Docef A. A quantitative assessment of the accuracy and reliability of O-arm images for deep brain stimulation surgery. Neurosurgery. 2013;72(March):47-57. doi:10.1227/NEU.0b013e318273a090.
10. Bot M, Van Den Munckhof P, Bakay R, Stebbins G, Verhagen Metman L. Accuracy of intraoperative computed tomography during deep brain stimulation procedures: Comparison with postoperative magnetic resonance imaging. Stereotact Funct Neurosurg. 2017;95(3):183-188. doi:10.1159/000475672.
11. Starr PA, Markun LC, Larson PS, Volz M, Martin AJ, Ostrem JL. Interventional MRI– guided deep brain stimulation in pediatric dystonia: first experience with the ClearPoint system. J Neurosurg Pediatr. 2014;14(October):400-408.