Le cholestérol comme agent cryoprotecteur pour la
congélation des semences animales
Thèse
Mahutin Vianney Salmon
Doctorat en sciences animales
Philosophiae Doctor (Ph.D.)
Québec, Canada
iii
Résumé
Parce que le cholestérol spermatique influence la résistance des spermatozoïdes à la congélation, nous avons émis l’hypothèse que les spermatozoïdes supplémentés en cholestérol exogène subiraient moins de dommages pendant la cryoconservation améliorant leur pouvoir fécondant après décongélation. Etant insoluble, le cholestérol est incorporé dans la méthyl β-cyclodextrin formant un complexe hydrosoluble, cholestérol lié à la cyclodextrine (CLC). Cette étude à montré que le traitement CLC, dans un dilueur de lait écrémé, améliore la cryorésistance de la semence de bouc en augmentant le niveau de cholestérol spermatique, responsable de la résistance des spermatozoïdes au choc au froid et au stress osmotique, sans affecter la capacitation induite in vitro après décongélation. Par insémination artificielle, les semences ayant subient une augmentation de cholestérol exogène ont montré un meilleur taux de fertilité et de prolificité in vivo par rapport à la semence non traitée. Ces observations suggèrent que le traitement CLC pourrait être utilisé pour améliorer la fertilité des troupeaux et mérite des explorations chez d’autres espèces. Evaluer l’efficacité du CLC sur la cryorésistance de la semence de bélier nous a permis de montrer que le traitement CLC est plus efficace dans un dilueur de lait écrémé par rapport à un dilueur de jaune d’œuf commercial. Toutefois, cette amélioration de la qualité spermatique post-dégel n’est pas suffisante pour induire une augmentation de la fertilité in vivo, suggérant la nécessité d’optimiser le protocole de congélation ou une adaptation du protocole d’insémination. Cependant, combiner le traitement CLC au tréhalose (un cryoprotecteur externe) n’a pas montré d’effet synergique sur l’amélioration de la qualité spermatique post-dégel. Finalement, pour amorcer un transfert technologique nous avons montré que le traitement CLC permet de conserver la qualité spermatique de la semence de bouc en présence de plasma séminal, dont le retrait était recommandé en raison de son effet délétère. De plus, le traitement CLC permet le maintain de la qualité de la semence bouc conservée en frais pendant 24 h à 5°C avant congélation facilitant son transport de la ferme vers le laboratoire. Ces résultats démontrent que le cholestérol joue un rôle crucial et essentiel dans la cryoprotection des semences animales.
v
Abstract
Because sperm cholesterol content contributes to their resistance to freezing, we hypothesized that exogenous cholesterol incorporated in sperm reduces cryodamage and thus improves the fertilizing capacity of thawed sperm. Being a lipid, cholesterol is insoluble in aqueous media, rendering difficult to deliver to cells in vitro. Methyl β-cyclodextrin is a carrier molecule that couples to cholesterol to form a water-soluble compound, “cholesterol-loaded cyclodextrin” (CLC) that can transfer the cholesterol into cell membranes. The research within this thesis shows that CLC treatment of goat semen enhances fresh sperm resistance to cold shock and osmotic stress due to the increased cholesterol, involving in sperm cryoresistance in a skim milk-based extender without affecting sperm in vitro capacitation after thawing. A pilot field trial in goats demonstrated that artificial insemination with sperm that underwent increased exogenous cholesterol yielded higher fertility and prolificacy rates in vivo compared to untreated semen. These observations suggest that CLC treatment could be used to improve frozen sperm quality and fertility rate of other species. Using ram sperm, our study demonstrated that CLC treatment was more efficient in a skim milk-based extender compared totraditional egg yolk-based extender. However, in vivo fertility of the ram semen that was cryopreserved in the skim milk-based extender with CLC did not differ from semen that was cryopreserved in egg yolk-based extender without CLC. Further research is warranted to combine CLC with other cryoprotection strategies or to modify the insemination protocol to adequately permit capacitation in vivo. However, using CLC treatment with trehalose, a cell impermeable cryoprotectant, did not demonstrate any synergic effect of the cryoprotectants on thawed sperm quality. Finally, in an effort to develop a protocol for semen cryopreservation that can be accessible to the emerging goat industry in Quebec, a pilot test trial demonstrated that goat sperm treated with CLC are more resistant to exposure to seminal plasma than CLC-free sperm in skim milk-based extender. Additionally, CLC treatment markedly improves the post-thaw quality of the sperm after temporary storage for 24 h prior to processing. Together, these results demonstrated that cholesterol has a fundamental and innovative role in animal semen cryoprotection.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations ... xv
Remerciements ... xvii
Avant-Propos ... xxi
Chapitre 1 : La conservation de la semence ... 1
1.1. Préambule ... 2
1.2. Les techniques de conservation de la semence ... 5
1.2.1. Collecte et conservation de la semence en frais ... 5
1.2.1.1. La collecte de semence ... 5
1.2.1.2. La conservation de la semence en frais ... 6
1.2.2. La cryoconservation de la semence ... 7
1.2.2.1. Principe ... 7
1.2.2.2. Les agents cryoprotecteurs ... 8
1.2.2.3. Le tréhalose ... 9
1.2.3. La vitrification ... 10
1.3. Les dilueurs de semences ... 12
1.3.1. L’effet bénéfique du jaune d’œuf... 12
1.3.2. L’effet bénéfique du lait ... 13
1.3.3. Les dilueurs synthétiques ... 14
1.3.4. Conclusion ... 15
1.4. Le plasma séminal dans la fonction spermatique ... 16
1.4.1. Le plasma séminal et son effet bénéfique pour la fonction spermatique ... 16
1.4.1.1. Le plasma séminal et la motilité spermatique ... 16
1.4.1.2. Le plasma séminal et la stabilisation des membranes spermatiques ... 17
1.4.1.4. Le plasma séminal et le déclenchement de l’ovulation ... 18
1.4.2. L’effet délétère du plasma séminal pendant la conservation de la semence ... 19
1.4.2.1. Le plasma séminal et la capacitation précoce ... 19
1.4.2.2. Le plasma séminal et les dilueurs de semences ... 20
1.4.3. Conclusion ... 21
1.5. Le réservoir spermatique dans l’oviducte ... 23
1.6. L’hyperactivation ... 25
1.7. La capacitation ... 27
1.7.1. L’induction de la capacitation ... 27
1.7.2. L’efflux de cholestérol responsable du changement de la fluidité membranaire ... 27
1.7.3. La phosphorylation sur résidus tyrosine ... 29
1.8. La réaction acrosomale ... 31
1.8.1. Le renversement du dogme autour de la réaction acrosomique ... 31
1.8.2. Mécanisme de la réaction acrosomique ... 33
1.8.2.1. La variation du pH intra-spermatique ... 33
1.8.2.2. L’augmentation de la concentration en calcium intra-spermatique ... 34
1.8.2.3. La fusion membranaire ... 34
1.8.3. Conclusion ... 35
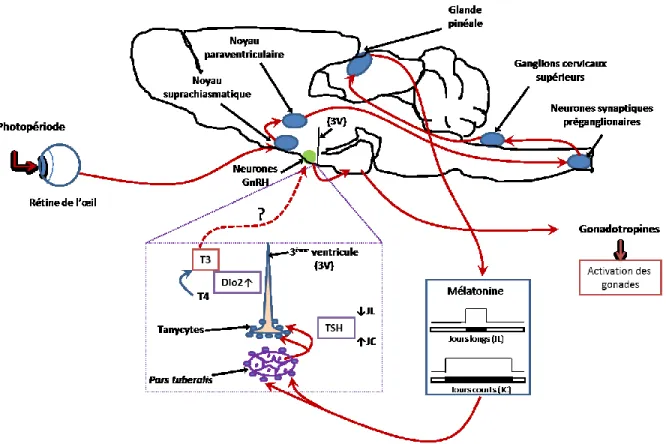
1.9. La saisonnalité ... 36
1.9.1. Les fonctions saisonnées ... 36
1.9.2. La reproduction saisonnée ... 37
1.9.3. La mélatonine et la régulation de la reproduction saisonnée ... 38
1.9.4. Kisspeptine et le contrôle de la reproduction... 39
1.9.5. Le système TSH/tanycyte/T3 : chaînon manquant entre la mélatonine et l’activation des neurones GnRH ... 40
1.9.6. Contrôle des fonctions de reproduction ... 43
1.10. Mise en situation du projet de recherche ... 44
1.10.1. Pourquoi le cholestérol ? ... 44
1.10.2. Comment incorporer du cholestérol dans des spermatozoïdes ? ... 47
1.10.3. Le traitement de la semence avec la cyclodextrine liée au cholestérol (CLC) ... 47
ix
1.10.3.2. Les concentrations de CLC testées ... 48
1.10.4. L’effet du traitement CLC sur la qualité spermatique post-dégel ... 50
1.10.5. L’effet du traitement CLC sur la fonction spermatique ... 50
1.10.5.1. L’effet du CLC sur la fluidité et la perméabilité membranaire ... 50
1.10.5.2. L’effet du CLC sur la capacitation spermatique ... 51
1.10.5.3. L’effet du traitement CLC sur le pouvoir fécondant de la semence ... 52
1.10.6. Conclusion ... 52
1.11. Hypothèse et objectifs de thèse ... 54
Bibliographie ... 57
Chapitre 2 : l’utilisation du cholestérol pour améliorer la cryoconservation de la semence de bouc .. 85
2.1. Résumé ... 87
2.2. Abstract ... 88
2.3. Introduction ... 89
2.4. Materials and methods ... 93
2.5. Results ... 99
2.6. Discussion ... 102
2.7. Conclusion ... 107
2.8. References ... 120
Chapitre 3 : Du cholestérol pour améliorer la cryoconservation de la semence de bélier ... 127
3.1. Résumé ... 129
3.2. Abstract ... 130
3.3. Introduction ... 131
3.4. Materials and methods ... 133
3.5. Results ... 139
3.6. Discussion ... 141
3.7. Conclusion ... 144
3.8. References ... 153
Chapitre 4 : Le tréhalose comme agent cryoprotecteur additionel au traitement CLC ... 159
4.1. Résumé ... 161
4.2. Introduction ... 162
4.4. Results ... 168
4.5. Discussion ... 169
References ... 173
Chapitre 5 : Optimisation des techniques de congélation de la semence de bouc ... 177
5.1. Résumé ... 179
5.2. Abstract ... 180
5.3. Introduction ... 181
5.4. Materials and methods ... 183
5.5. Results ... 186
5.6. Discussion ... 187
5.7. Conclusion ... 189
5.8. References ... 193
Chapitre 6 : Discussion et perspectives ... 197
6.1. Supplémenter les spermatozoïdes en cholestérol est-ce, une véritable solution pour l’amélioration de la cryoresistance des semences, ou une impasse ? ... 198
6.1.1. Est-ce que le traitement à base de CLC est efficace ? ... 198
6.1.2. Pourquoi le traitement CLC améliore-t-il la qualité spermatique post-dégel mais pas le taux de fertilité ? ... 199
6.2. Transfert technologique ... 201
6.2.1. Premier dans le domaine ... 201
6.2.2. Qu’est-ce que ce projet a permis de concrétiser ? ... 202
6.2.3. Quelles sont les faiblesses et perspectives du projet ? ... 203
6.2.3.1. La disponibilité d’un petit nombre d’animaux pour les IA... 203
6.2.3.2. La fécondation in vitro (FIV) ... 204
6.2.3.3. Le suivi du cholestérol exogène incorporé dans les spermatozoïdes via la cyclodextrin ... 205
Conclusion générale ... 207
xi
Liste des tableaux
Tableau 1.1 Comparaison entre les techniques d'insémination artificielle chirurgicales et
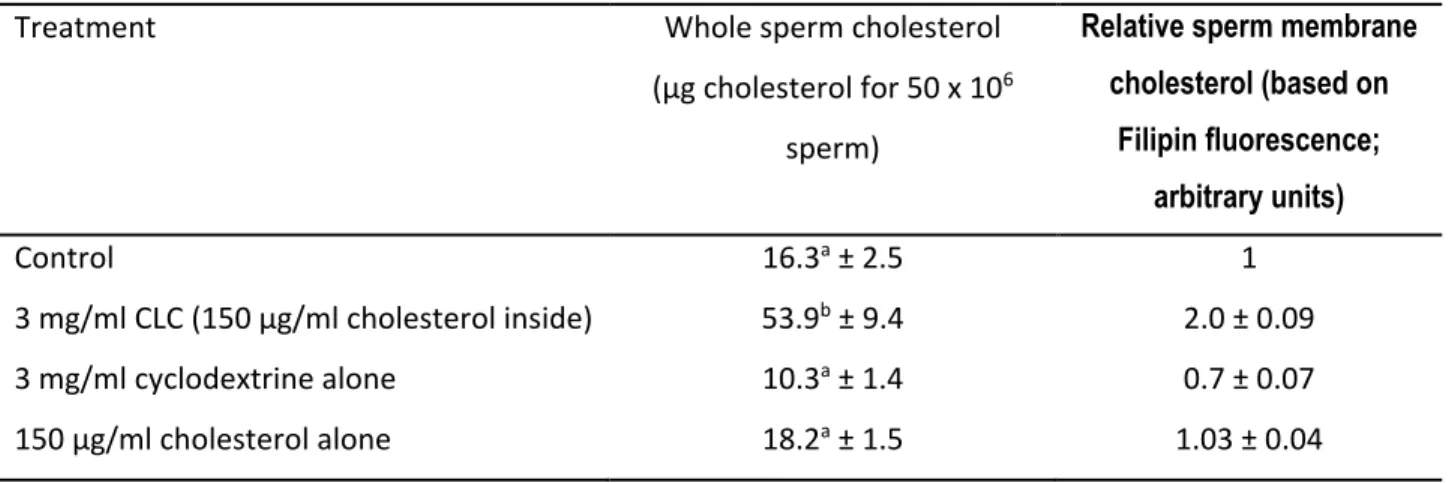
non-chirurgicales avec de la semence cryoconservée ... 4 Tableau 1.2 Récapitulatif des fonctions du plasma séminal ... 22 Tableau 1.3 Différences morphologique et lipidique entre les spermatozoïdes de plusieurs espèces46 Tableau 1.4 Variation des concentrations optimales de CLC en fonction du type d'espèce étudiée . 49 Tableau 2.1 Cholesterol content in fresh sperm and plasma membranes in the presence or absence
of CLC, cyclodextrin alone or cholesterol alone ... 108 Tableau 2.2 Kidding and prolificacy rates following AI with semen ± 3 mg/ml CLC cryopreserved in
skim milk-based extender and corresponding sperm cholesterol content and
physiological status according to the CTC fluorescence assay ... 109 Tableau 3.1 Cholesterol content in fresh sperm and plasma membranes ± CLC, methyl
β-cyclodextrin alone and cholesterol alone (added to 120 x 106 sperm) ... 145 Tableau 3.2 Pregnancy rates following laparoscopic insemination of ewes ... 146
xiii
Liste des figures
Figure 1.1 Mécanisme de contrôle de la reproduction saisonnée chez le hamster ... 42
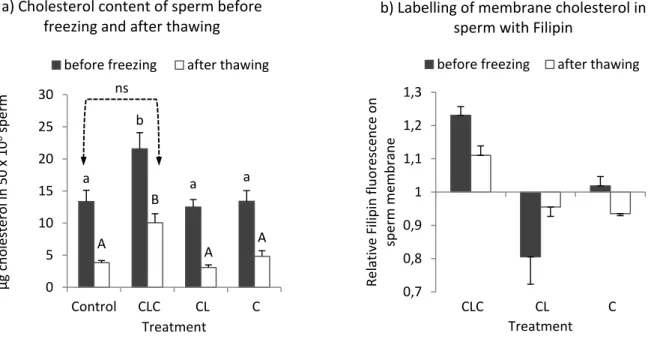
Figure 2.1 Cholesterol content of sperm in skim milk-based extender ... 110
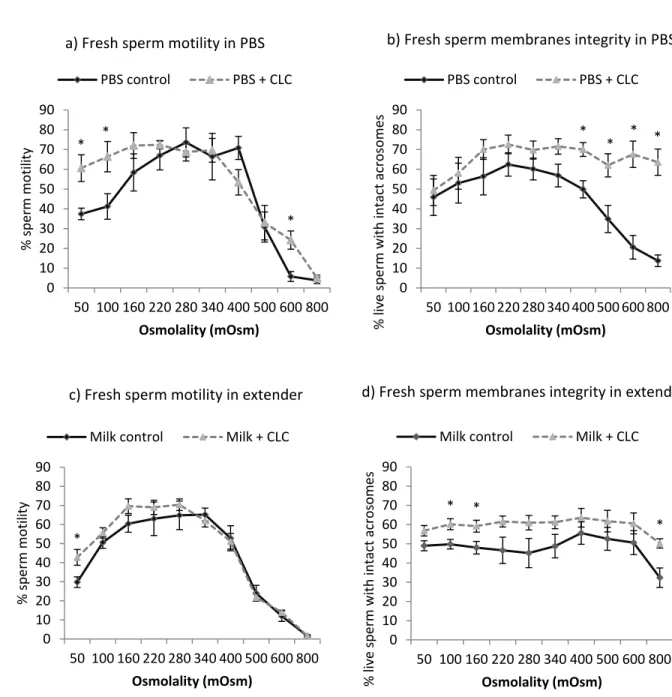
Figure 2.2 Impact of CLC supplementation on the resistance of sperm to cold shock ... 111
Figure 2.3 Impact of CLC supplementation on the osmotic resistance of sperm ... 112
Figure 2.4 CLC improves sperm quality after cryopreservation in skim milk-based extender. ... 113
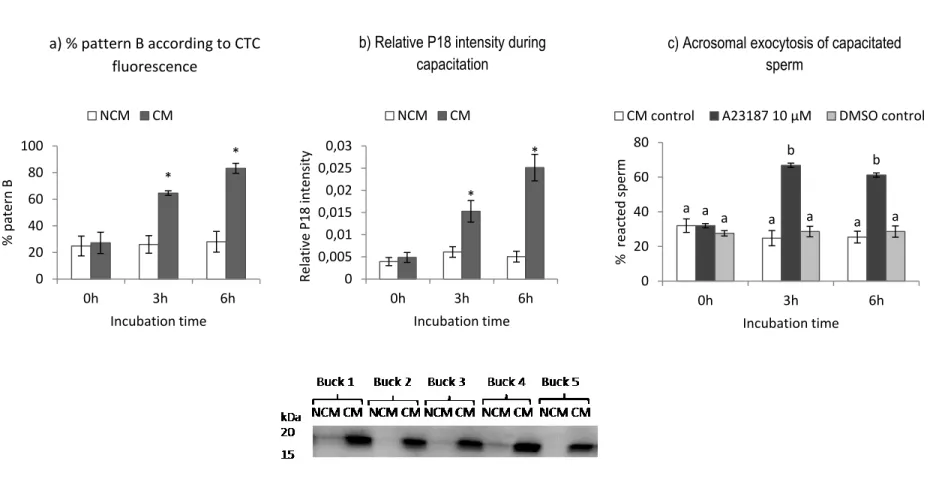
Figure 2.5 A23187 induces acrosomal exocytosis of sperm capacitated by CM ... 114
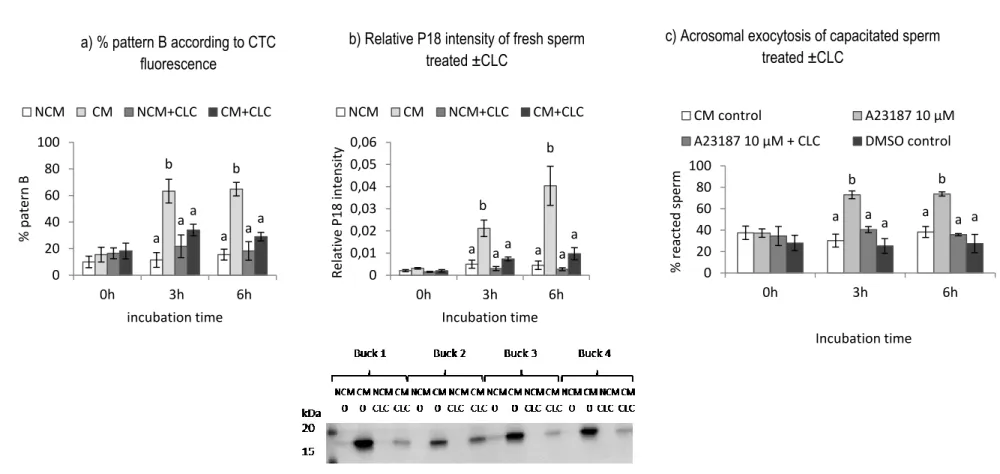
Figure 2.6 The effect of CLC on the ability of fresh sperm incubated in NCM or CM to undergo capacitation and acrosomal exocytosis ... 116
Figure 2.7 Effect of CLC on ability of sperm before and after freezing in skim milk-based extender to undergo capacitation and acrosomal exocytosis ... 118
Figure 2.8 In vivo fertility of cryopreserved sperm ... 119
Figure 3.1 Cold shock resistance of fresh ram sperm in PBS supplemented with CLC ... 147
Figure 3.2 Impact of CLC supplementation on the osmotic resistance of sperm ... 149
Figure 3.3 Filipin fluorescent labeling of cholesterol on fresh ram sperm in PBS ... 150
Figure 3.4 CLC effects on ram sperm quality in extenders after thawing ... 151
Figure 4.1 Supplémentation de la semence de bouc en tréhalose avec ou sans ajustement de l’osmolarité ... 171
Figure 4.2 Effet synergique du tréhalose (T) et du CLC sur la qualité spermatique post-dégel ... 172
Figure 5.1 Seminal plasma effect on sperm treated ±CLC ... 190
xv
Liste des abréviations
BSP: Binder of SPerm
BUSgp60: N-glycosyl-protein of bulbourethral gland secretion
CLC: cholestérol lié à la cyclodextrine / cholesterol-loaded cyclodextrin Dio2: enzyme déiosdinase 2
EYCE: egg yolk coagulating enzyme
FAO: Food and Agriculture Organization of the United Nations HDL: high-density lipoprotein
IA: insémination artificielle IGF-I: insulin-like growth factor I JC : jours courts
JL: jours longs
LDL: low-density lipoprotein
OIF: facteurs inducteurs d’ovulation
PDC-109: protein with N-terminus aspartic acid, D, and carboxy terminus cystine, having 109 amino acids
PKA: protein kinase A sAC: adenylyl cyclase T 3 : triiodothyronine T4 : thyroxine
xvii
Remerciements
Parce qu’arriver au bout d’un doctorat c’est avant tout être entouré de personnes passionnées, intelligentes et patientes, j’adresse mes sincères remerciements à tous ceux qui m’ont formé, guidé, aidé, soutenu et motivé. Je remercie tout d’abord le Dr Janice L. Bailey pour m’avoir formé et supervisé pendant ses trois années passées dans son équipe. Former des étudiants c’est savoir les féliciter quand les expériences fonctionnent mais surtout avoir les mots pour les encourager et les motiver à persévérer dans la bonne direction lorsque tout part de travers. Janice, tu as su mener ton rôle de mentor à merveille. Grâce à toi j’ai appris à repousser mes limites et surtout donner le meilleur de moi. Je remercie également mon co-directeur, Dr Pierre Leclerc qui a su voir la portée de chaque résultat et comment les interpréter pour en ressortir leur quintessence. Je remercie Dr Robert Sullivan, « monsieur épididyme », qui a été un modèle en matière de connaissance et de passion pour ses domaines de recherche. Je remercie Dr François Castonguay pour avoir répondu présent avec enthousiasme quand j’avais besoin de son aide et de son expertise. Je remercie aussi Dr Carl Lessard qui m’a fait profiter de son expérience avec les producteurs et qui m’a énormément poussé à garder à l’esprit l’intérêt de mon travail pour les producteurs et pour l’industrie québécoise.
Merci à Christian Lessard pour ses explications rapides mais précises, à Christelle Brèque pour sa gentillesse, sa disponibilité et son aide au laboratoire et à Isabelle Laflamme qui a toujours su répondre à mes besoins au laboratoire.
Merci à tous mes stagiaires qui ont été de séjour au laboratoire, Céline Chesseron, Rania Zaïène, Anaïs Granito, Stéphanie Tremblay, Martina Rocco, Emilie Normand, Véronique Jean et Lucas Kessler. Vous former a été très enrichissant pour moi et j’ai beaucoup appris des erreurs de certains. J’adresse tout ma reconnaissance aux employés du CRSAD, Hélène Lavallée, Paul Montambault, Véronique Trottier, Yan Martel-Kennes, Annie Dumas, Daniel Gignac et Gilbert Genest, pour leur aide à l’entrainement des boucs, à la récolte de semences et au contrôle des gestations. Mention spéciale pour le bouc 50 toujours prêt à fournir sa semence peu importe les conditions.Je remercie également tous les employés du CEPOQ qui ont contribué à la réussite du projet, en particulier Marie-Claude Litalien, François Dionne et Gaston Rioux.
Un grand merci à mes parents Laure et Olivier Salmon, mes frères Irénée et Maximilien et ma sœur Émeline. Bien qu’arrivé seul au Québec, j’ai toujours ressenti leur soutien et leurs encouragements.
Merci également à ma belle-famille Charlène et Alexandre Archambault qui m’ont accueilli à bras ouverts.
Je remercie finalement ma femme Imelda Houssou pour sa patience, son soutien, ses prières et pour n’avoir jamais cessé de croire en moi et de m’encourager.
xix A ceux qui ont contribué à ma réussite
xxi
Avant-Propos
Cette thèse est présentée avec insertion d’articles et comporte six chapitres. Le premier chapitre introduit les concepts d’insémination artificielle, de conservation de semence et de fonction spermatique de manière à comprendre le contexte et les objectifs du projet de recherche.
Le second chapitre a été accepté avec corrections mineures dans la revue Biology of Reproduction. Cette étude présente pour la première fois le mécanisme par lequel la supplémentation en cholestérol des semences de bouc améliore leur cryorésistance. J’ai effectué les expériences menant aux résultats publiés, l’interprétation des données et la rédaction du manuscrit. Dr Janice L. Bailey responsable et concepteur du projet a contribué à l’élaboration du plan expérimental ainsi qu’à la révision du manuscrit avec Dr Pierre Leclerc, mon co-directeur.
Le troisième chapitre de cette thèse a été soumis dans la revue Reproduction. Cette étude consistait à vérifier si les excellents résultats obtenus dans le chapitre 2 sont transposables à l’espèce ovine dont la cryoconservation des semences est très délicate. J’ai réalisé les expériences et rédigé le manuscrit. Les Drs Janice L. Bailey, Pierre Leclerc, François Castonguay et Vincent Demers-Caron ont contribué à la mise en place du dispositif expérimental et à la révision du manuscrit.
Le quatrième chapitre de cette thèse n’a pas fait l’objet de publication. L’étude a été conçue pour le développement d’une nouvelle approche de congélation de semence caprine à base de cholestérol et de tréhalose. J’ai réalisé les expériences avec l’aide de Stéphanie Tremblay, étudiante stagiaire d’été. Le manuscrit que j’ai rédigé a été révisé par Dr Janice L. Bailey.
Le cinquième chapitre de cette thèse sera soumis à la revue Theriogenology. Cette étude a été élaborée pour raffiner les techniques de manipulation de semence caprine pour la congélation dans le but de faciliter le transfert technologique. J’ai réalisé les expériences et rédigé le manuscrit. Dr Janice L. Bailey a participé à la mise en place du plan expérimental et a révisé le manuscrit.
1
1.1. Préambule
L’augmentation de la population, la prospérité croissante et l’urbanisation engendrent une demande accrue de produits animaux, en particulier dans les pays en développement. La Food and Agriculture
Organization of the United Nations (FAO) estime que la demande mondiale devrait augmenter de
70% pour nourrir une population qui atteindra selon les estimations 9.6 milliards d’habitants en 2050 (Gerber et al., 2013). Ces données interpellent sur la nécessité d’optimiser les techniques de reproduction animale actuellement dans le but de s’adapter à une demande sans cesse croissante de produits animaux. La technique la plus connue et la plus efficace pour promouvoir l’expansion et l’amélioration génétique d’un troupeau est celle de l’insémination artificielle (IA).
L’insémination artificielle se définie comme l’introduction de semence dans le tractus génital femelle par l’intermédiaire d’instruments adaptés (Faigl et al., 2012). L’insémination artificielle se pratique couramment de façon chirurgicale chez la brebis avec de la semence congelée (laparoscopie) (Anel et al., 2006) et non chirurgicale (vaginale et cervicale) chez la plupart des espèces domestiques (Baril et al., 1993; Evans, 1998; Palacin et al., 2012). L’insémination artificielle pour la reproduction animale était appliquée pour des raisons sanitaires dans le but de réduire les transmissions de pathogènes suite aux saillies répétées (Faigl et al., 2012). Très rapidement les producteurs se sont aperçus que l’IA pouvait devenir une méthode très pratique pour l’introduction rapide d’une génétique d’intérêt afin d’accroître les traits de production. Avec la cryoconservation de semence rendue possible, les avantages économiques qu’apporteraient l’augmentation du taux de fertilité et l’accélération de l’amélioration génétique sont devenus clairement évidents. De plus, le nombre d’inséminations et l’expansion de la génétique des reproducteurs d’intérêt se sont considérablement améliorés en réduisant la quantité de spermatozoïdes des doses d’insémination. Aujourd’hui, le renouvellement des cheptels dans l’industrie de la vache laitière se fait majoritairement par IA en Amérique du Nord et en Europe. En 1980, un total de 130 millions de doses de semence ont été produites dans l’industrie bovine à travers le monde. Ce chiffre est passé à 200 millions en 1995 et plus de 260 millions en 1998 (95% réalisées avec de la semence congelée) (Vishwanath & Shannon, 2000; Thibier & Wagner, 2002). De nos jours, la production de dose de semence pour l’industrie bovine n’est plus un facteur limitant. Les efforts sont maintenant concentrés sur l’amélioration de la qualité des semences cryoconservées pour maximiser le taux de fertilité des semences d’IA (Faigl et al., 2012).
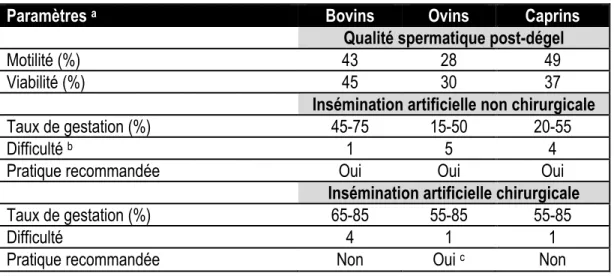
3 Quelle soit chirurgical ou non, l’IA présente un taux de gestation encore très variable suivant les espèces (tableau 1.1). L’IA chirurgicale procure de meilleurs taux de gestation avec de la semence cryoconservée en raison du dépôt de la semence directement dans les cornes utérines, réduisant le parcours des spermatozoïdes jusqu’au cite de fécondation (Anel et al., 2006). Toutefois elle nécessite une formation complexe de l’inséminateur (le plus souvent un vétérinaire), du matériel onéreux et un risque potentiellement vital pour la femelle à inséminer. En revanche, l’IA non chirurgicale à l’avantage d’être facile à apprendre, peu onéreuse et nécessite très peu de contention pour la femelle. La difficulté de l’IA non chirurgicale réside dans l’accès à l’utérus qui est plus ou moins difficile suivant les espèces. Chez la vache, l’IA est facilité par un cervix peu contorsionné et l’anatomie de la femelle permet à l’inséminateur de guider la pipette d’insémination grâce à son bras introduit par voie rectale (Shannon, 1978). De plus, les chaleurs évidentes chez la vache permettent de déterminer facilement la période d’ovulation contribuant grandement aux bons taux de succès de l’IA chez cette espèce (tableau 1.1) (De Kruif, 1978). Chez la truie, le cervix est torsadé et les pipettes d’insémination sont munies d’une mousse en forme de vis permettant de traverser le cervix pour déposer la semence à l’entrée de l’utérus (Roca et al., 2006). Chez la brebis et la chèvre, le cervix est très contorsionné et l’accès direct à l’utérus est quasi impossible faute de blesser l’animal (Salamon & Maxwell, 1995).
Certains auteurs ont testés l’efficacité de la relaxine et de l’ocytocine, avec plus ou moins de succès, pour faciliter le passage du cervix. Chez la brebis, la relaxine injectée 12h avant l’insémination n’a pas montré d’effet relaxant du cervix ni d’amélioration de la pénétration de la pipette d’insémination (Salamon & Lightfoot, 1970). L’ocytocine quant à elle a montré chez la brebis une augmentation des contractions cervicales et utérines in vivo et in vitro (Edqvist et al., 1975), une dilatation du cervix (Khalifa et al., 1992) et une amélioration du transport spermatique après un accouplement naturel (Thibault & Winterberger-Torres, 1967; Lang & Oh, 1970), mais pas après une insémination avec de la semence congelée (Lightfoot & Salamon, 1970). Toutefois, l’utilisation d’ocytocine n’améliore pas le taux de gestation des brebis lors d’une IA avec de la semence fraiche (Jones, 1968; Jones et al., 1969), et selon certains auteurs, elle réduit leur taux de gestation lorsque de la semence congelée est utilisée pour les IA (Salamon & Lightfoot, 1970). Faute d’efficacité, l’utilisation d’injection d’hormone pour faciliter le passage du cervix a été moins étudiée pour laisser place aux recherches sur l’amélioration de la qualité de la semence inséminée.
Tableau 1.1 Comparaison entre les techniques d'insémination artificielle chirurgicales et
non-chirurgicales avec de la semence cryoconservée
Paramètres a Bovins Ovins Caprins
Qualité spermatique post-dégel
Motilité (%) 43 28 49
Viabilité (%) 45 30 37
Insémination artificielle non chirurgicale
Taux de gestation (%) 45-75 15-50 20-55
Difficulté b 1 5 4
Pratique recommandée Oui Oui Oui
Insémination artificielle chirurgicale
Taux de gestation (%) 65-85 55-85 55-85
Difficulté 4 1 1
Pratique recommandée Non Oui c Non
Références : Purdy & Graham, 2004b; Purdy et al., 2005; Moce & Graham, 2006; Amorim et al., 2009; Moce et al., 2010b; Moraes et al., 2010; Purdy et al., 2010; FAO, 2012; Konyali et al., 2013; Motamedi-Mojdehi et al., 2014.
a La variation dépend de l’expertise de l’inséminateur, de la race et du conditionnement des animaux.
b Difficulté de la réalisation de l’insémination, avec le niveau 1 pour facile au niveau 5 pour très difficile à réaliser. c En prenant compte de l’équipe d’intervention est suffisamment formée pour réaliser la procédure.
5
1.2. Les techniques de conservation de la semence
La réussite de l’IA dépend principalement de la qualité de la semence. Les inséminations artificielles réalisées avec de la semence fraiche ont un taux de succès très satisfaisant suivant les espèces et les techniques d’insémination (Cseh et al., 2012). En générale, la semence fraiche de bélier et de bouc doit être inséminée dans les 8h suivant sa collecte afin d’obtenir le taux de gestation optimal (Maxwell & Watson, 1996; Salamon & Maxwell, 2000). La semence cryoconservée présente des taux de succès plus variables, principalement dues aux dommages subis par les spermatozoïdes durant le processus de congélation (Hammerstedt et al., 1990; Bailey et al., 2000). Selon plusieurs études les techniques de congélation de semence induisent des dommages aux spermatozoïdes affectant l’intégrité des membranes et des fonctions spermatiques (Mazur, 1968; Critser et al., 1987; Hammerstedt et al., 1990; Bailey et al., 2000; Bailey et al., 2003). Quel que soit le type de dilueur ou la technique de congélation, une grande majorité des spermatozoïdes présente une baisse de motilité et d’intégrité membranaire réduisant leurs chances de fécondation (Salamon & Maxwell, 1995; Gillan et al., 2004; Menchaca & Rubianes, 2004; Barbas & Mascarenhas, 2009).
1.2.1. Collecte et conservation de la semence en frais 1.2.1.1. La collecte de semence
Deux techniques sont couramment utilisées pour la collecte de semence de bouc, bélier, taureau, verrat et étalon. La première consiste à utiliser un vagin artificiel (nécessite un entrainement préalable sur mâle), et la seconde l’électroéjaculation (Mattner & Voglmayr, 1962; Curry, 2007; Marco-Jimenez et al., 2008). Cette dernière permet de collecter de la semence sur n’importe quel mâle adulte grâce à une sonde rectale qui provoque l’excitation de différents nerfs (en particulier le nerf sciatique), ce qui entraîne des contractions musculaires involontaires de l’animal (Dziuk et al., 1954; Curry, 2007). Elle est parfois légèrement controversée puisqu’elle peut induire un stress à l’animal. Selon certains auteurs, les stimulations induites par l’électroéjaculation changent les fonctions sécrétrices d’une ou de plusieurs glandes annexes affectant la quantité du fluide produit (Dziuk et al., 1954; Mattner & Voglmayr, 1962) et souvent une contamination de la semence par l’urine chez le bélier (Pineda & Dooley, 1991). D’autre part, certaines études plus récentes menées chez le bélier démontrent que la technique de collecte n’affecte pas la qualité de la semence de bélier (Marco-Jimenez et al., 2005; Marco-Jimenez et al., 2008). Marco-Jimerez et al., (2008) ont
démontré que seule la concentration spermatique était plus basse et la concentration en Na+ du plasma séminal plus haute lorsque la semence de bélier était collectée par électroéjaculation par rapport au vagin artificielle; ces deux différences n’étant pas suffisantes pour induire une baisse de qualité spermatique. De manière générale, la collecte par vagin artificiel reste la plus recommandée pour obtenir un éjaculat de qualité et l’électroéjaculation est une alternative pour la collecte de mâles non entraînés.
1.2.1.2. La conservation de la semence en frais
Une manière de conserver la semence de taureau, bouc, bélier ou cheval en frais est de descendre progressivement sa température à 5°C après sa dilution (Katila, 1997; Leboeuf et al., 1998; Verberckmoes et al., 2005; O'Hara et al., 2010). Cette descente en température a pour but de réduire les dépenses métaboliques et de prolonger la durée de vie des spermatozoïdes (Gadea, 2003). Le dilueur Glucose-citrate-jaune d’œuf est l’un des premiers à avoir été testé avec succès sur de la semence de bélier depuis 1960 (Salamon & Maxwell, 2000). Plus récemment, les dilueurs de conservation de semence en frais sont à base de Tris : Tris-glucose-jaune d’œuf et le Tris-citrate-fructose-jaune d’œuf (Salamon & Maxwell, 2000). Le dilueur à base de lait est également utilisé pour la conservation de la semence fraiche chez le bélier et de taureau (Vishwanath & Shannon, 2000; O'Hara et al., 2010). En revanche, le lait doit être préalablement chauffé afin d’éliminer la lacténine, une protéine du lait capable de diminuer la qualité spermatique (Vishwanath & Shannon, 2000). De manière générale, il est recommandé d’utiliser la semence pour les IA durant les 8h qui suivent la collecte. Chez le bélier, les semences inséminées plus de 24h après la collecte montrent une baisse de fertilité de 10-35% par jour de stockage (Maxwell & Watson, 1996; Salamon & Maxwell, 2000). Plus récemment, O’Hara et al. (2010) ont montré que la motilité et la viabilité spermatique de la semence de bélier pouvaient être maintenues pendant 72h à 5°C dans les dilueurs commerciaux actuelles tels que : OviPro® (à base de jaune d’œuf), INRA 96® (majoritairement à base de caséine du lait) et AndroMed® (à base de lécithine de soya). Les auteurs montrent toutefois un meilleur taux de fertilité en IA avec de la semence conservée à 5°C pendant les 24h après collecte, en raison d’une baisse de fertilité de 30% observée pour les semences conservées à 5°C pendant 48h et 20% de plus pour celles conservée jusqu’à 72h (O'Hara et al., 2010).
7 Les dilueurs optimisés pour la conservation de semence de taureau en frais, comme le Triladyl® et Caprogen® (les deux à base de jaune d’œuf), peuvent permettre un maintien de la qualité spermatique pendant 6 jours à 5°C et l’obtention d’un taux de fertilité en fécondation in vitro de 25 et 66% lorsque les semences sont diluées dans du Triladyl® et du Caprogen®, respectivement (Verberckmoes et al., 2005). Il reste encore à démontrer l’efficacité de la conservation à long-terme de la semence de taureau via ces dilueurs en IA chez la vache. Cependant dans l’industrie bovine actuelle, l’utilisation de semence congelée pour l’IA est déjà très efficace avec un suivi technique et très souvent une garantie sur le taux de fertilité. On comprend bien que la conception de dilueurs de conservation de semence bovine en frais a de moins en moins d’intérêt à la fois pour la communauté scientifique ainsi que pour l’industrie.
Quant à la semence de verrat, elle est très sensible au choc au froid qui affecte considérablement la viabilité spermatique (Pursel et al., 1973). Cette sensibilité serait due principalement à une réduction des mouvements latéraux des phospholipides membranaires à basse température, corrélée avec une altération irréversible des protéines membranaires (White, 1993). De ce fait, il est recommandé de conserver la semence de verrat entre 15 et 20°C (Paulenz et al., 2000). Il existe bon nombre de dilueurs commerciaux pour la conservation de semence de verrat dont le BTS (Beltsville thawing solution) permettant leur conservation pendant 3 à 5 jours avec d’excellents taux de fertilité en IA (Gadea, 2003).
1.2.2. La cryoconservation de la semence 1.2.2.1. Principe
La cryoconservation se définie comme l’utilisation de très basses températures pour conserver à long terme des cellules ou tissus, tout en maintenant intact leur structure et leurs fonctions (Mazur, 1984). Cette dernière partie de la définition est la plus difficile à maîtriser puisque les cellules et tissus ne sont pas naturellement programmés pour résister à la congélation et la majorité des cellules non protégées subissent d’importants dommages à basse température. De plus, les cellules spermatiques ne possédant aucun système de réparation subissent des dommages irréversibles rendant la semence non fonctionnelle. Il devient donc indispensable de maîtriser les modifications biologiques, physiologiques et physiques s’exerçant sur les cellules et leur environnement au
moment de la cryoconservation afin d’apporter aux spermatozoïdes des composants pouvant leurs permettre de résister à ces modifications délétères.
L’eau est non seulement indispensable à la vie de toute cellule mais elle est également le principal agent responsable des cryodommages au moment de la congélation. Pendant sa congélation, l’eau va subir une transition de phase passant d’un état liquide à un état cristalline (Mazur, 1968). De ceci résulte la formation de cristaux de glace et l’augmentation de la concentration en solutés présents dans le milieu. Les cristaux de glace, au cours de leur formation, transpercent les membranes des cellules tandis que l’augmentation de la concentration en solutés crée un changement de l’osmolarité du milieu, entrainant des pressions mécaniques importantes sur les membranes cellulaires (Mazur, 1968). Les agents cryoprotecteurs augmentent la concentration de tous les solutés du système permettant la réduction des cristaux de glace. Pour être biologiquement acceptable par les cellules, les agents cryoprotecteurs doivent avoir un faible taux de toxicité, qu’il soit pénétrant ou non (Fahy et al., 1984).
1.2.2.2. Les agents cryoprotecteurs
La congélation entraine une modification biologique de l’eau qui, en changeant de phase, va former des cristaux de glace et précipiter les solutés présents dans le milieu. En 1949, il a été démontré pour la première fois que l’ajout de glycérol à de la semence de coq permettait d’augmenter le taux de survie des spermatozoïdes après décongélation (Polge et al., 1949). Le glycérol, réduirait la formation des cristaux de glace délétères pour les membranes cellulaires en augmentant la concentration totale en soluté.
Quelques années plus tard, des études ont démontré que le changement d’osmolarité au moment de la congélation était la principale cause de dommage cellulaire, plus que la formation de cristaux de glace (Lovelock, 1953a; Lovelock, 1953b). Le glycérol réduirait les cryodommages en équilibrant la variation de concentration en soluté de part et d’autres des membranes cellulaires. De ces études ont été déduites les propriétés des agents cryoprotecteurs : (1) le cryoprotecteur doit être soluble dans l’eau et le rester à basse température afin d’abaisser la température de congélation ; (2) il doit avoir un faible taux de toxicité afin d’être utilisé à sa concentration d’efficacité optimale ; (3) il doit être toléré par le tractus génital femelle.
9 Le glycérol reste de loin le cryoprotecteur le plus couramment utilisé pour la congélation de semences de mammifères (Di Santo et al., 2012). Toutefois il a été démontré chez l’humain que l’utilisation de glycérol pour la congélation de semence induit des ondulations de la membrane plasmique, une altération de la membrane acrosomale interne ainsi qu’une désorganisation des crêtes mitochondriales (Sherman, 1990). De ces observations, plusieurs autres agents cryoprotecteurs ont été proposés pour la congélation de semences, comme le méthanol chez le poisson (Lahnsteiner et al., 2000; Yang et al., 2010), du diméthylacétamide chez le coq (Blanco et al., 2010; Wishart, 2007) et du DMSO chez l’amphibien (Mansour et al., 2010).
En 1963, Peter Mazur démontrait que le changement de température contrôle le transport d’eau à travers la membrane cellulaire (Mazur, 1963). En effet, la vitesse de congélation contrôle la vitesse de transition de phase de l’eau (et donc de formation de cristaux de glace) qui influe sur le contrôle de la concentration en soluté autour de la cellule. Ainsi, en contrôlant l’osmolarité autour de la cellule, le changement de température influence le transport d’eau en dehors de la cellule pendant la congélation et, l’entrée d’eau dans la cellule pendant la décongélation. Les cryoprotecteurs vont réduire de la formation des cristaux de glace ainsi que les transferts d’eau au travers des membranes cellulaires en abaissant la température de congélation (Mazur, 1963).
1.2.2.3. Le tréhalose
Le tréhalose est un disaccharide composé de deux molécules de glucose, qui a particularité d’être remarquablement thermostable >99% (120°C/90min) et possède un seuil de congélation très élevé (température de congélation -197°C dans 100mg/mL dans de l’eau) (Jain & Roy, 2009). Le tréhalose est naturellement synthétisé par certaines bactéries, plantes et levures pour s’adapter à un stress environnemental comme l’augmentation de chaleur, l’oxydation, la dessiccation ou le refroidissement (Crowe et al., 2001; Jain & Roy, 2009). Lors d’un stress, ces sujets produisent du tréhalose en quantité massive qui forme des liaisons hydrogènes (réversibles) avec les protéines et lipides membranaires afin d’empêcher leur dénaturation (Jain & Roy, 2009). Lors d’une baisse de température importante, le tréhalose à la faculté de remplacer la molécule de d’eau à l’intérieur des cellules réduisant ainsi la formation de cristaux intracellulaires (Carpenter et al., 1993).
Les cellules de mammifères en revanche ne produisent pas de tréhalose. Toutefois, le tréhalose est décrit comme le plus efficace des sucres pour la protection des spermatozoïdes lors
cryoconservation (Najafi et al., 2013). De nombreuses études montrent un effet bénéfique du tréhalose pour la cryoconservation de semence de plusieurs espèces comme le bélier (Aisen et al., 2002; Jafaroghli et al., 2011), le bouc (Aboagla & Terada, 2003; Aboagla & Terada, 2004), le taureau (Chen et al., 1993; Woelders et al., 1997), le porc (Hu et al., 2009) et la souris (Sztein et al., 2001). D’autres études révèlent cependant un effet non significatif de l’action du tréhalose sur l’amélioration de la cryoconservation des semences de cheval (Squires et al., 2004), de cerf (Fernandez-Santos et al., 2007), de lièvre (Kozdrowski, 2009), de coq (Madeddu et al., 2010) et d’émeu (Sood et al., 2012). Il serait possible de spéculer que cette différence d’efficacité serait due au faite que le tréhalose aurait une affinité préférentielle pour les protéines spermatiques au détriment des phospholipides membranaires qui sont très sensibles lors de la congélation (Jain & Roy, 2009). Cette hypothèse reste encore à démontrer.
1.2.3. La vitrification
La vitrification est une technique plus récente de conservation d’éléments biologiques, élaborée pour la première fois en 1984 (Fahy et al., 1984), qui a pour avantage de ne pas former de cristaux de glace (Guyadet-Joly, 1998). Pour ce faire, la vitrification nécessite l’utilisation d’agent cryoprotecteurs à de très haute concentration (diméthyl sulfoxide, propanediol, éthyl glycol et glycérol), entrainant une augmentation de la viscosité du milieu (Ko et al., 2008; Wani et al., 2004; Yamada et al., 2007). L’eau pure à l’état vitreux ne s’obtient qu’à des températures très basse (-140°C) (Franks, 1982). Pour éviter la formation des cristaux de glace il est impératif d’atteindre cette température immédiatement, ce qui nécessite une vitesse de refroidissement d’au moins 20 000°C/s (Baudot et al., 1998). Le principal inconvénient de la vitrification est qu’il est impossible d’obtenir de manière homogène, dans un tissu, une vitesse de refroidissement de l’ordre de 20 000°C/s (Guyadet-Joly, 1998).
Différentes stratégies permettent la vitrification à cinétique réalisable. La première est l’utilisation de cryoprotecteurs à très hautes concentration dans le but d’augmenter la viscosité du milieu, de stabiliser l’état vitreux et de freiner ainsi la vitesse de croissance des cristaux de glace (Guyadet-Joly, 1998; Baudot et al., 1998). L’utilisation de cryoprotecteurs très concentrés est toutefois toxique pour la cellule (Fahy et al., 1984; Baudot et al., 1998). La deuxième stratégie, encore expérimentale, est la congélation à pression atmosphérique élevée. Des études récentes ont montré qu’en congelant à
11 des pressions atmosphériques élevées (1000 atm), la cristallisation était nettement ralentie. Cependant, des pressions supérieures à 500 atm sont délétères pour la cellule (Guyadet-Joly, 1998). L’association de ce procédé avec des cryoprotecteurs en concentration suffisante représente peut-être l’avenir de la vitrification d’éléments biologiques.
1.3. Les dilueurs de semences
Les dilueurs de semences sont des solutions aqueuses servant à augmenter le volume d’un éjaculat pour l’amener à la concentration de conservation souhaitée. Afin d’être efficace, le dilueur doit apporter les nutriments nécessaires au maintien métabolique des spermatozoïdes (glucose ou fructose), conserver un pH (Tris, Hepes) et une osmolarité physiologique (NaCl, KCl), empêcher la prolifération bactérienne (antibiotiques) et faciliter l’ajout d’agent cryoprotecteur le cas échéant (Gadea, 2003). Depuis les 50 dernières années, les dilueurs à base de jaune d’œuf et de lait de vache sont les plus répandus pour la conservation des semences d’animaux d’élevage en frais ou en congeler (Iritani & Nishikawa, 1961; O'Shea & Wales, 1966). Cependant, le mécanisme par lequel le jaune d’œuf et le lait protègent les spermatozoïdes pendant la conservation en frais ou contre le cryodommage reste très peu connu.
1.3.1. L’effet bénéfique du jaune d’œuf
Le dilueur à base de jaune d’œuf est le dilueur le plus commercialement utilisé, puisqu’il a été le premier à être testé avec succès pour la congélation de semence bovine, qui représente un intérêt économique sans précédent (Holt, 2000a). Le jaune d’œuf est généralement très concentré dans le dilueur (20% v/v) ce qui a poussé plusieurs études à identifier son composant le plus actif qui serait responsable de l’effet protecteur (Foulkes, 1977; Watson, 1981). Il en est ressortit que la lipoprotéine de basse densité (low-density lipoprotein « LDL ») était le composant du jaune d’œuf montrant le meilleur effet protecteur de semence (Pace & Graham, 1974; Watson, 1981). De plus, certaines études ont également montré que le LDL seul était largement responsable de la résistance des spermatozoïdes bovins au choc au froid ainsi que de l’amélioration de la motilité spermatique post-dégel (Moussa et al., 2002; Amirat et al., 2004). Plus récemment, des tests de fertilité sur des vaches laitières ont montré que le dilueur à base LDL seul permettait de maintenir une qualité spermatique post-dégel comparable à celle du dilueur à base de jaune d’œuf sans toutefois réussir à augmenter le taux de fertilité par insémination artificielle (59% pour le dilueur à base de LDL contre 65% pour le dilueur à base de jaune d’œuf) (Amirat-Briand et al., 2010). En revanche, son mécanisme de protection n’est pas encore élucidé. Une hypothèse est que la portion phospholipidique du LDL serait
13 spermatique (Quinn et al., 1980) ou en remplaçant les phospholipides membranaires perdus ou endommagés pendant la cryoconservation (Foulkes et al., 1980; Graham & Foote, 1987). Chez le taureau, le LDL peut également se lier aux protéines BSP afin de protéger l’intégrité membranaire. Les protéines BSP « Binder of SPerm » sont des protéines du plasma séminal qui dans un premier temps participent au maintien de la membrane plasmique des spermatozoïdes au moment de l’éjaculation ainsi que dans le tractus génital femelle (fonction décapacitante) et dans un second temps à l’induction de la capacitation (fonction capacitante) via l’efflux de lipides membranaires (Manjunath et al., 2002; Manjunath & Therien, 2002). Cette dernière fonction confère aux protéines BSP un effet néfaste pour les spermatozoïdes dans un contexte de conservation à long terme. En effet, les protéines BSP se fixent spécifiquement au cholestérol et aux phosphatidylcholines membranaires au moment de l’éjaculation, puis entrainent leur efflux de la membrane plasmique dans l’oviducte ou suite à une incubation prolongée avec la semence (Bergeron et al., 2004). Les protéines BSP ont en revanche une plus grande affinité pour le LDL que pour les lipides de la membrane plasmique protégeant ainsi le spermatozoïde d’une capacitation précoce (Manjunath et al., 2002; Bergeron et al., 2004).
1.3.2. L’effet bénéfique du lait
Le lait entier ou le lait écrémé sont couramment utilisés comme base de dilueur pour la conservation de semence à 4°C ou pour la congélation de semence lorsqu’ils sont supplémentés en glycérol (Kakar & Ganguli, 1978). Le lait entier est constitué d’eau (87,5 %), de protéines (3.2 %), de sucres (4,6 %), et lipides (3,7 %) et de minéraux (0.8 %). Le lait écrémé à la même composition à la différence qu’il n’a que < 0.1 % de lipides (Lusignan et al., 2011). La majorité des protéines du lait sont des caséines organisées en micelles (80 %) qui seraient responsables de l’effet protecteur de semence. Selon certains auteurs, les micelles de caséines extraites du lait permettent de conserver à 4°C la semence d’étalon (Batellier et al., 1997), de bouc (Leboeuf et al., 2003), de bélier (O'Shea & Wales, 1966) ainsi que la semence de taureau en frais (O'Shea & Wales, 1966) et en congelée en présence de glycérol (Choong & Wales, 1963). Les micelles de caséines ont également une grande affinité pour les protéines BSP, ce qui justifierait, comme dans le cas du jaune d’œuf, leur effet protecteur de semence (Lusignan et al., 2011).
1.3.3. Les dilueurs synthétiques
L’utilisation de produits d’origine animale dans la compositions des dilueurs, comme le jaune d’œuf, présente parfois un risque d’introduction de maladies animales non-contrôlée sanitaire pour la semence mais également pour les femelles inséminées (Akhter et al., 2011; Bousseau et al., 1998). De plus, les produits d’origine animale sont soumis à des variations de qualité suivent l’origine et le traitement des animaux dont ils sont issus (Bousseau et al., 1998). Pour pallier à cela, certains auteurs se concentrent sur la conception de dilueurs synthétiques exempts de produit d’origine animale. Les dilueurs synthétiques sont le plus souvent à base de produit d’origine végétale comme la lécithine de soya (BioXCell ®). Cette lécithine est composée en grande partie de phosphatidylcholine, phosphatidylinositol et phosphatidyléthanolamine, qui sont des phospholipides également retrouvés au niveau de la membrane spermatique (Lenzi et al., 1996; Martinez & Morros, 1996). La phosphatidylcholine est un des phospholipides essentiels du spermatozoïde qui intervient dans le maintien de la structure et de la forme du spermatozoïde (Aires et al., 2003). La lécithine a un effet émulsifiant et permet de maintenir un niveau de toxicité bas pour les cellules (LeBlanc et al., 2003). Il a été démontré que grâce à son apport en phospholipides, la lécithine de soya était aussi efficace que le jaune d’œuf pour préserver les semences de chien contre le choc au froid induit pendant la cryoconservation (Beccaglia et al., 2009).
Au début des années 2000, les dilueurs synthétiques étaient perçus comme une alternative aux dilueurs à base de jaune d’œuf, sans toutefois présenter une amélioration de la qualité spermatique post-dégel (van Wagtendonk-de Leeuw et al., 2000; Gil et al., 2003). Plus récemment, de plus en plus d’études postulent pour une meilleure efficacité du dilueur à base de lécithine de soya par rapport à celui à base de jaune d’œuf. Chez le bélier, il est décrit que 1% de lécithine de soya combinée à du glycérol était aussi efficace que 20% de jaune d’œuf comme base de dilueurs de cryoconservation (Forouzanfar et al., 2010). D’autres auteurs ont également montré une meilleure efficacité de cryoconservation de semence de chat avec un dilueur à base de lécithine de soya par rapport au dilueur à base de jaune d’œuf usuel (Vick et al., 2012). Chez le bélier, un dilueur à base de lécithine de soya est meilleur que le dilueur à base de jaune d’œuf commercial pour la préservation de la chromatine et de la motilité spermatique (Khalifa & Lymberopoulos, 2013).
15 1.3.4. Conclusion
La cryoconservation des semences permet une conservation indéfinie des génétiques animales et facilite la pratique des IA à travers le monde. La connaissance des dilueurs et de leurs cryoprotecteurs a considérablement évoluée réduisant l’écart de qualité spermatique entre la semence fraiche et congelée, dans le but de préserver le plus possible toutes les fonctions spermatiques pour optimiser la fertilité. D’importants progrès restent encore à réaliser notamment pour protéger toutes les fonctions spermatozoïdes afin de maximiser les chances de fécondation en IA.
1.4. Le plasma séminal dans la fonction spermatique
La semence est constituée de spermatozoïdes suspendus dans un fluide appelé plasma séminal. Le plasma séminal est un fluide complexe qui contrôle la fonction chimique de l’éjaculat. L’une des raisons de sa complexité est due à la grande diversité des composants biochimiques du plasma séminal qui proviennent des sécrétions du rete testis, de l’épididyme, des vésicules séminales, de la prostate et des glandes bulbo-urétrales (Mann, 1978; Mann & Lutwak-Mann, 1981). De façon conventionnelle, le plasma séminal est un milieu de survie servant au transport des spermatozoïdes. L’évolution des technologies en reproduction a permis de montrer que le plasma séminal tient un rôle beaucoup plus important dans la fonction spermatique notamment pour la préparation des spermatozoïdes à la fécondation.
1.4.1. Le plasma séminal et son effet bénéfique pour la fonction spermatique La composition biochimique et les fonctions du plasma séminal varient selon l’espèce, entre les mâles d’une même espèce et même entre éjaculats d’un même mâle (Aurich et al., 1996; Killian et al., 1993). Ceci dû au fait que la concentration des composants du plasma séminal est sensible au régime alimentaire et à la taille des glandes annexes (Metafora et al., 1989). Le volume d’un éjaculat peut varier en moyenne de 1 mL chez le bélier, 3,7 mL chez l’homme et jusqu’à 500 mL chez le verrat (Cooper et al., 2010). Le plasma séminal est majoritairement composé de peptides et de protéines (25 – 55 g/L chez l’homme et 30 – 60 g/L chez le verrat), qui vont jouer ses fonctions essentiels (Rodriguez-Martinez et al., 2011).
1.4.1.1. Le plasma séminal et la motilité spermatique
Il a été décrit chez le taureau que la protéine PDC-109, l’isomère non glycosylé de BSP1 est en mesure d’augmenter la motilité spermatique (Sanchez-Luengo et al., 2004). La protéine PDC-109 se fixe sur la pièce intermédiaire des spermatozoïdes lors de leur passage dans le vas déférent et induit l’activation irréversible des pompes ioniques Ca2+-ATPases de la membrane plasmique. Une telle observation est également applicable sur les spermatozoïdes de rat (Sanchez-Luengo et al., 2004).
17 De façon plus surprenante, IGF-I « insulin-like growth factor I » intervient également dans le maintien de la motilité spermatique in vitro chez le taureau. Chez de nombreuses espèces, IGF-I est connu pour son rôle dans la différentiation et la fonction des cellules de Leydig (Lin, 1995; Baker et al., 1996; Lejeune et al., 1996) ainsi que dans la régulation des fonctions testiculaires (Hansson et al., 1989; Zhou & Bondy, 1993; Lejeune et al., 1996). Henricks et al., (1998) ont démontré pour la première fois que IGF-I intervient dans le maintien de la motilité spermatique en augmentant la vélocité des spermatozoïdes , un paramètre de motilité dont la corrélation avec la fertilité a déjà été démontrée (Leidl et al., 1993; Wainer et al., 1996). Aussi, de par le rôle d’IGF-I dans l’augmentation de l’incorporation du glucose, la production de lactate et l’activité de la pyruvate déshydrogénase (Stewart & Rotwein, 1996), ces mêmes auteurs émettent l’hypothèse que IGF-I permettrait le maintien de la motilité spermatique en régulant le métabolisme énergétique des spermatozoïdes (Henricks et al., 1998).
1.4.1.2. Le plasma séminal et la stabilisation des membranes spermatiques
Souvent reliées à l’induction de la capacitation (Therien et al., 1998; Manjunath & Therien, 2002; Manjunath et al., 2007), certaines protéines BSP interviennent également dans la stabilisation de la membrane plasmique après l’éjaculation. Certains auteurs ont démontré que des protéines de la famille BSP sont en mesure de se fixer aux groupements cholines des phospholipides membranaires de spermatozoïdes de bouc et de cheval, empêchant leur départ spontané de la membrane plasmique, de l’éjaculation jusqu’à la capacitation (Menard et al., 2003; Villemure et al., 2003). De même, dans un dilueur à base de jaune d’œuf, les protéines BSP forment des complexes stables avec les LDF « low-density lipoprotein fraction » afin de renforcer la stabilisation de la membrane plasmique, réduisant la perte spontanée de lipides membranaires après l’éjaculation (Manjunath et al., 2002; Bergeron et al., 2004). Toutefois, les protéines BSP intervenant dans la stabilisation de la membrane plasmique n’ont pas encore été caractérisées.
Parce que les protéines BSP interviennent dans la stabilisation de la membrane plasmique, elles pourraient également augmenter la résistance des spermatozoïdes au choc au froid. Cette hypothèse a été vérifiée par Barrios et al., (2000), qui ont montré qu’un extrait de protéines du plasma séminal de bélier augmente la résistance des spermatozoïdes au choc au froid. Cette observation a été ensuite confirmée par d’autres auteurs, toujours chez la même espèce (Perez-Pe
et al., 2002). Les RSVP14 et RSVP20 ont été caractérisées comme protéines de la famille des BSPs intervenant dans l’augmentation de la résistance des spermatozoïdes de bélier au choc au froid (Barrios et al., 2005).
1.4.1.3. Le plasma séminal et l’interaction spermatozoïde-ovocyte
Une autre protéine du plasma séminal, l’ostéopontine (OPN), interviendrait dans l’interaction du spermatozoïde avec la zone pellucide. L’OPN est connue pour sa présence dans le plasma séminal bovin (Killian et al., 1993; Moura et al., 2006) et son rôle dans l’adhésion et la migration cellulaire (Mazzali et al., 2002; Rangaswami et al., 2006). De par son rôle d’adhésion cellulaire, l’OPN a été proposée comme protéine du plasma séminal intervenant dans l’interaction spermatozoïde-ovocyte (Moura, 2005). Par fécondation in vitro, certains auteurs ont montré que l’OPN est un excellent candidat intervenant dans l’augmentation du taux des spermatozoïdes liés à l’ovocyte chez le bovin (Goncalves et al., 2007) et la réduction de la polyspermie chez le porcin (Hao et al., 2006). Le mécanisme proposé est que l’OPN se fixe aux spermatozoïdes pendant l’éjaculation, probablement via l’intégrine ou les récepteurs CD44. Cette liaison est stable jusqu’à l’approche de l’ovocyte où l’OPN favorise l’interaction du spermatozoïde avec la zone pellucide, puis dans l’espace périvitellin avec la membrane de l’ovocyte (Souza et al., 2008). Une question intéressant reste toutefois à élucider : comment en fécondation in vitro porcine, l’OPN intervient dans la réduction de la polyspermie alors que chez le bovin il prône l’augmentation de la liaison des spermatozoïdes à l’ovocyte?
1.4.1.4. Le plasma séminal et le déclenchement de l’ovulation
Plus récemment, certaines protéines du plasma séminal ont été décrites pour leur intervention dans le déclenchement de l’ovulation (Adams & Ratto, 2013). Il s’agit de facteurs inducteurs d’ovulation (OIF) découverts par des équipes chinoises qui ont montré qu’une administration intravaginal (Chen et al., 1985; Xu et al., 1985) ou intramusculaire (Pan et al., 1992) de plasma séminal de chameau de Bactriane induisait une ovulation spontanée chez la chamelle. C’est seulement 20 ans plus tard que le rôle des OIF dans le déclenchement de l’ovulation a été confirmé par des études menées chez l’alpaga et le lama (Adams et al., 2005). En effet, l’injection intramusculaire de plasma séminal de lama induit une augmentation rapide de LH plasmatique, responsable du déclenchement de
19 l’ovulation (Adams et al., 2005). Cette augmentation de LH est comparable à celle induite par un traitement GnRH, à la différence que l’injection intramusculaire de plasma séminal induit une production de LH deux fois plus longue (8h pour le traitement plasma séminal par rapport à 4h pour le traitement GnRH). Les auteurs précisent également que le corps jaune résultant de l’ovulation induite par le traitement du plasma séminal tend à être plus large et à régresser moins vite que celui induit par un traitement GnRH, et produit deux fois plus de progestérone (Adams et al., 2005). Une étude plus récente, visant à identifier les protéines OIF, a démontré qu’une protéine de 14kDa, purifiée par chromatographie en phase liquide à partir du plasma séminal de lama, était responsable de l’augmentation de LH déclencheur de l’ovulation (Ratto et al., 2011). De par sa taille les auteurs spéculent une action au niveau l’hypothalamus (libération de GnRH) ou sur la glande pituitaire (production d’hormones gonadotropes). Les protéines OIF méritent un grand intérêt scientifique, notamment à savoir si leur utilisation peut être efficace pour d’induction de l’ovulation chez d’autres espèces. Il serait également intéressant d’évaluer la qualité des ovocytes produits suite à l’administration du traitement plasma séminal par rapport à une ovulation naturelle.
1.4.2. L’effet délétère du plasma séminal pendant la conservation de la semence Dans les conditions naturelles le plasma séminal s’impose comme un acteur important pour promouvoir le conditionnement et le pouvoir fécondant des spermatozoïdes (Juyena & Stelletta, 2012). Cependant, dans un contexte de conservation de semence, le plasma séminal peut devenir délétère pour les spermatozoïdes.
1.4.2.1. Le plasma séminal et la capacitation précoce
Les protéines BSP du plasma séminal sont connues pour leur fonction de protection de l’intégrité des membranes spermatiques après l’éjaculation, comme présenté précédemment, mais elles sont surtout connues pour leur habilité à promouvoir la capacitation des spermatozoïdes de bovin et de porc (Therien et al., 1998; Lane et al., 1999; Therien et al., 2005; Lusignan et al., 2007). Les protéines BSP ont été identifiées chez plusieurs espèces comme le bélier, le bouc, l’étalon, le verrat, le bison et le taureau représentant respectivement 30%, 20%, 20%, 1,1%, 25% et 65% des protéines totales (Manjunath et al., 2002). Pendant le mélange de la semence et du plasma séminal au
moment de l’éjaculation, les protéines BSP induisent un premier départ rapide de cholestérol de la membrane spermatique (5 à 8% de cholestérol), avant de se fixer aux phospholipides membranaires pour promouvoir la stabilisation de la membrane des spermatozoïdes caprins (Villemure et al., 2003). Cette stabilisation de la membrane spermatique via les BSPs est maintenue tout le long du tractus génital femelle jusqu’à l’oviducte. Les lipoprotéines à faible densité (LDL) présents dans l’oviducte interagissent avec les protéines BSP entrainent un second efflux de cholestérol médiateur de la capacitation chez l’espèce bovine (Therien et al., 2001; Manjunath et al., 2007). Cependant, l’exposition à long terme de la semence avec les protéines BSP entraine un efflux spontané de cholestérol et de phospholipides de la membrane plasmique, rendant les spermatozoïdes très sensibles à la conservation en frais ou en congelé (Manjunath et al., 2007).
1.4.2.2. Le plasma séminal et les dilueurs de semences
Chez le bouc, BUSgp60, une glycoprotéine lipase secrétée par les glandes bulbo-urétrales (Sias et al., 2005), est capable d’hydrolyser les triglycérides du lait en acide oléique, qui inhibe la motilité des spermatozoïdes et entrainent des dommages membranaires (Pellicer-Rubio & Combarnous, 1998). L’effet catalytique de BUSgp60 est augmenté par l’interaction de cette lipase avec la caséine et la lactoglobuline (Leboeuf et al., 2000). Toujours dans le plasma séminal de bouc, l’enzyme de coagulation du jaune d’œuf, EYCE « egg yolk coagulating enzyme », est une phospholipase qui hydrolyse la lécithine du jaune d’œuf en acides gras et en lysolécithine (Iritani & Nishikawa, 1961; Iritani & Nishikawa, 1963), ce dernier étant toxique pour les spermatozoïdes de bouc (Leboeuf et al., 2000). Les auteurs précisent que l’activité d’EYCE peut être réduite par chauffage du dilueur à 60°C pendant 2 à 5 min avant l’incorporation de la semence.
Ces effets délétères du plasma séminal sur la qualité de la semence dans un contexte de conservation ont amené certains auteurs à recommander un lavage systématique de la semence par centrifugation chez le bouc, le bélier et le cheval (Gil et al., 2000; Salvador et al., 2007; Bliss et al., 2011). Ceci a permis de montrer que le plasma séminal n’était pas nécessaire pour la conservation des spermatozoïdes ainsi que pour leur fertilité (Garcia et al., 2010). D’autres auteurs restent toutefois persuadés que le plasma séminal est important pour l’acquisition du pouvoir fécondant des spermatozoïdes et ils vont jusqu’à montrer que son retrait entraine une baisse de la qualité
21 spermatique chez le bouc (Azeredo et al., 2001) ainsi qu’une baisse du taux de fertilité (Tummaruk et al., 2000).
1.4.3. Conclusion
Dans les conditions naturelles, l’importance du plasma séminal dans la protection et l’activation du pouvoir fécondant des spermatozoïdes est plus qu’évidente (tableau 1.2). La conservation de semence apparaît comme un processus physiologiquement imprévu, faisant en sorte que le plasma séminal, de par sa fonction capacitante via les BSPs entre autre, devient délétère pour les spermatozoïdes. Son retrait ou non reste controversé pour la communauté scientifique tant sa complexité et sa variabilité suivant les espèces est grande. Une alternative serait de renforcer les membranes spermatiques afin de les protéger des agents du plasma séminal qui deviennent délétères lors de la conservation des semences.
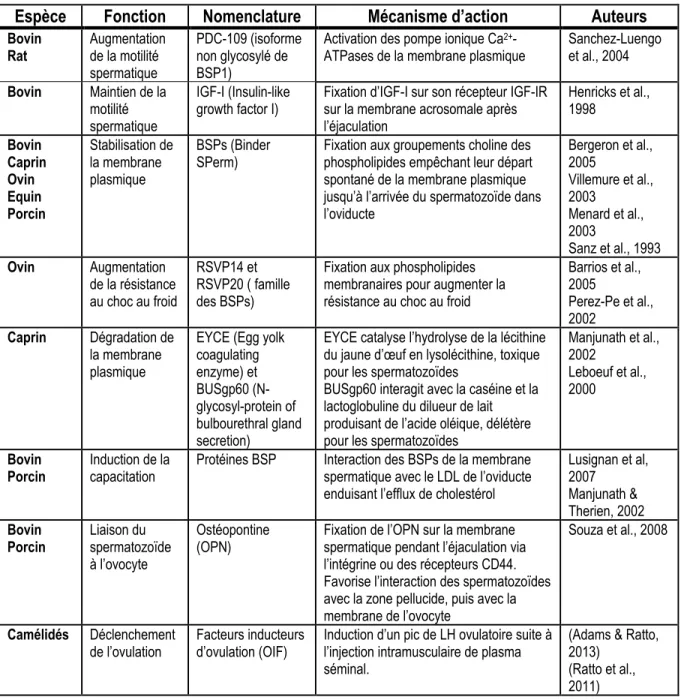
Tableau 1.2 Récapitulatif des fonctions du plasma séminal
Espèce Fonction Nomenclature Mécanisme d’action Auteurs
Bovin Rat Augmentation de la motilité spermatique PDC-109 (isoforme non glycosylé de BSP1)
Activation des pompe ionique Ca2+
-ATPases de la membrane plasmique
Sanchez-Luengo et al., 2004 Bovin Maintien de la motilité spermatique IGF-I (Insulin-like
growth factor I) Fixation d’IGF-I sur son récepteur IGF-IR sur la membrane acrosomale après l’éjaculation Henricks et al., 1998 Bovin Caprin Ovin Equin Porcin Stabilisation de la membrane plasmique BSPs (Binder
SPerm) Fixation aux groupements choline des phospholipides empêchant leur départ spontané de la membrane plasmique jusqu’à l’arrivée du spermatozoïde dans l’oviducte Bergeron et al., 2005 Villemure et al., 2003 Menard et al., 2003 Sanz et al., 1993 Ovin Augmentation de la résistance au choc au froid RSVP14 et RSVP20 ( famille des BSPs)
Fixation aux phospholipides membranaires pour augmenter la résistance au choc au froid
Barrios et al., 2005 Perez-Pe et al., 2002 Caprin Dégradation de la membrane plasmique
EYCE (Egg yolk coagulating enzyme) et BUSgp60 (N-glycosyl-protein of bulbourethral gland secretion)
EYCE catalyse l’hydrolyse de la lécithine du jaune d’œuf en lysolécithine, toxique pour les spermatozoïdes
BUSgp60 interagit avec la caséine et la lactoglobuline du dilueur de lait produisant de l’acide oléique, délétère pour les spermatozoïdes
Manjunath et al., 2002
Leboeuf et al., 2000
Bovin
Porcin Induction de la capacitation Protéines BSP Interaction des BSPs de la membrane spermatique avec le LDL de l’oviducte
enduisant l’efflux de cholestérol
Lusignan et al, 2007 Manjunath & Therien, 2002 Bovin Porcin Liaison du spermatozoïde à l’ovocyte Ostéopontine (OPN)
Fixation de l’OPN sur la membrane spermatique pendant l’éjaculation via l’intégrine ou des récepteurs CD44. Favorise l’interaction des spermatozoïdes avec la zone pellucide, puis avec la membrane de l’ovocyte Souza et al., 2008 Camélidés Déclenchement de l’ovulation Facteurs inducteurs d’ovulation (OIF)
Induction d’un pic de LH ovulatoire suite à l’injection intramusculaire de plasma séminal.
(Adams & Ratto, 2013)
(Ratto et al., 2011)