CÉLINE CAMPAGNA
IMPACT D’UNE MIXTURE ENVIRONNEMENTALE
D’ORGANOCHLORÉS SUR L'OVOCYTE, LE
SPERMATOZOÏDE ET L'EMBRYON PORCIN IN
VITRO
Thèse présentée
à la Faculté des études supérieures de l’Université Laval dans le cadre du programme de doctorat en sciences animales
pour l’obtention du grade de Philosophiæ Doctor (Ph.D.)
DÉPARTEMENT DES SCIENCES ANIMALES
FACULTÉ DES SCIENCES DE L’AGRICULTURE ET DE L’ALIMENTATION UNIVERSITÉ LAVAL
QUÉBEC
2008
Résumé
Les êtres humains et les animaux, principalement ceux habitant le Cercle Arctique, sont constamment exposés à un large éventail de composés chimiques présents dans leur environnement et leur nourriture. Parmi ces polluants, les composés organochlorés sont montrés du doigt depuis quelques décennies comme étant des composés toxiques qui perturbent plusieurs systèmes physiologiques, y compris le système reproducteur. Ces composés se présentent rarement individuellement dans le biote, on les retrouve plutôt sous forme de mixtures complexes, où chaque composé influence les systèmes physiologiques à sa façon, indépendamment ou conjointement avec d’autres composés. Les organochlorés sont présents dans le sang, le lait maternel, le tissu adipeux, les liquides amniotique et séminal, ainsi que dans les fluides ovarien et utérin. C’est dans cette optique que nous avons testé l’hypothèse qu’une mixture d’organochlorés, reconstituée pour imiter celle présente dans la graisse de phoque de l’Arctique que mangent les Inuits du Nunavik, nuit à la compétence à la maturation des gamètes, à la fécondation et au développement in vitro des embryons préimplantatoires, en utilisant l’espèce porcine comme modèle toxicologique pour l’humain. La mixture d’organochlorés a effectivement réduit la compétence à la maturation, fécondation et au développement des ovocytes exposés, ainsi que le développement préimplantatoire des embryons exposés. La fécondation et le développement subséquent ont diminué lors de l’exposition conjointe des gamètes à la mixture. Nous avons aussi utilisé un extrait métabolisé de cette mixture, provenant du sérum de truies préalablement exposées à la mixture originale d’organochlorés, pour vérifier ces mêmes paramètres. L’extrait métabolisé n’a pas eu d’effet sur la maturation des ovocytes, leur compétence à la fécondation et au développement, ou même sur le développement préimplantatoire des embryons exposés. L’extrait métabolisé a par contre réduit l’apoptose des cellules du cumulus. En conclusion, la mixture d’organochlorés, similaire à celle retrouvée dans l’environnement, perturbe les fonctions essentielles des gamètes et des embryons, dommages qui se répercutent sur leurs compétences à la fécondation et au développement.
ii
Abstract
Human beings and animals, especially those living in the Arctic Circle, are constantly exposed to a wide range of chemical compounds that are present in their environment and food. Among these pollutants, organochlorine compounds are considered as a major group of toxicants that disrupt numerous physiological systems, including the reproductive system. These compounds are rarely present one at a time in the biota; they are mainly present as complex mixtures of different organochlorines, where each compound influences physiological systems in its own way, independently or in concert with other compounds. Organochlorines are present in blood, breast milk, fat tissues, as well as in amniotic, seminal, uterine and ovarian fluids. Therefore, we tested the hypothesis that an organochlorine mixture, reconstituted to mimic that present in the Arctic seal blubber and ingested by the Inuits in Nunavik, disrupts the competence to in vitro maturation, fertilization and development of gametes and embryos, using the pig as a toxicological model for humans. The organochlorine mixture reduced maturation, fertilization and developmental competence of exposed oocytes. It also reduced fertilization and subsequent development of gametes exposed during fertilization, as well as preimplantory development of exposed embryos. We also used a metabolized extract of the same mixture, originating from the serum of sows preexposed to the original organochlorine mixture, to verify the same parameters. The metabolized extract did not reduce oocyte maturation or their competence to fertilization and development; neither did it alter preimplantory development of exposed embryos. Nevertheless, the metabolized extract reduced apoptosis in cumulus cells. In conclusion, the environmentally-relevant organochlorine mixture damages essential functions of gametes and embryos, therefore altering their fertilizing and developmental competence.
Avant-propos
J’aimerais tout d’abord remercier de tout cœur ma directrice, Dr. Janice L. Bailey, de m’avoir offert ce projet enthousiasmant à une époque où je cherchais désespérément un projet de recherche qui était en accord avec mes valeurs environnementales, mais qui incluait quand même les techniques de laboratoire pour lesquelles j’avais été formée. Au cours de mon doctorat, j’ai eu la chance de pouvoir être dirigée par cette femme inspirante qui croyait en moi et mon potentiel, et avec qui j’ai pu avoir de grandes discussions professionnelles aussi bien que personnelles. Durant ces années, nous avons tissé une amitié qui, je l’espère, perdurera au-delà de ce doctorat. Je la remercie aussi pour ses bons conseils, sa détermination pour me pousser vers une carrière en recherche, pour les millions d’encouragements, de tapes dans le dos et de poussées un peu plus fortes pour me motiver à continuer et à me surpasser, ainsi que pour tous les congrès auxquels j’ai assisté et pour les deux stages au Danemark auxquels j’ai participé.
Je tiens aussi à remercier mes codirecteurs. Merci à Dr. Marc-André Sirard, pour m’avoir permis de m’insérer à travers ses étudiants dans son laboratoire, et pour tous ses conseils et ses idées. Merci d’avoir eu confiance en moi et en mes possibilités. Je le remercie aussi pour m’avoir donnée la chance d’aller une première fois dans le laboratoire du Dr. Hyttel au Danemark, projet qui m’a valu une publication supplémentaire et une très belle expérience de vie. Merci à Dr. Pierre Ayotte d’avoir été mon mentor en toxicologie, pour ses commentaires pertinents relativement à ma recherche et à mes manuscrits et pour son intégrité.
Je veux aussi remercier les autres membres de mon jury : Dr. François Richard, Dr. Daria Pereg et Dr. Ana M. Soto.
Je voudrais aussi profiter de ce moment pour exprimer tout le bonheur que j’ai eu à travailler avec une équipe formidable qui formait (à l’époque) le laboratoire MAS-JLB-FJR : Charlotte, Christine, Mario, Mariève Bureau et Christian Savard, pour leur amitié et comme formateur en fécondation in vitro, ainsi que pour avoir été d’aussi bons
iv compagnons de travail. Merci aussi à tous les autres membres du laboratoire avec qui j’ai partagé de très bons moments, sans oublier Dr. François Pothier, pour toutes nos belles conversations.
Je m’en voudrais de passer sous silence tous ceux et celles qui m’ont aidé indirectement à terminer ce doctorat. Tout d’abord, je remercie du plus profond de mon cœur ma mère qui était déterminée à me « voler » mes filles pour des périodes indéterminées qui s’éternisaient toujours, histoire que je finisse d’écrire cette thèse. Merci à elle et à ma sœur, pour toute leur aide matérielle, financière, leurs encouragements et leur fierté. Merci aussi aux autres membres de ma famille d’être présent pour moi et de m’aider. Je tiens encore à remercier Janice dans cette perspective, pour tous les prêts et les dons qu’elle m’a offerts au cours de mes maternités et de ma vie familiale ainsi que pour sa compréhension de la vie familiale. Je remercie finalement mon conjoint Guillaume et nos enfants, pour tout l’amour inconditionnel qu’ils me donnent et leur patience face aux sacrifices que je leur ai imposés. Je vous aime.
Je tiens aussi à remercier tous les entités et organismes subventionnaires d’avoir cru en mon potentiel et de m’avoir permis d’effectuer ce doctorat : Bourse d’excellence à l’admission Alex Couture, Bourse de doctorat Germain Brisson en Sciences animales, Bourse de doctorat du Conseil de recherche en sciences naturelles et en génie du Canada (CRSNG).
À tous les enfants : pour qu’un jour il soit possible que vous viviez sur une terre où l’avancement de la technologie et du mode de vie puisse coexister avec la santé des êtres vivants et la biodiversité…
Table des matières
Résumé...i
Abstract... ii
Avant-propos ... iii
Table des matières ...vi
Liste des tableaux... xiii
Liste des figures ...xiv
Liste des abréviations...xvi
Introduction générale ...18
Chapitre 1 Les polluants organochlorés et le système reproducteur : revue de la littérature. ...20
1.1 Le système reproducteur porcin...20
1.1.1 Folliculogenèse porcine ...20
1.1.1.1 Puberté et recrutement ...20
1.1.1.2 Dominance ...21
1.1.1.3 Ovulation ...22
1.1.2 Maturation de l’ovocyte porcin...22
1.1.2.1 Croissance de l’ovocyte ...22
1.1.2.2 Reprise de la méiose ...23
1.1.2.3 Maturation cytoplasmique finale ...23
1.1.2.4 La maturation ovocytaire in vitro ...24
1.1.3 Interactions entre l’ovocyte et les cellules folliculaires porcines ...25
1.1.3.1 Les cellules de la granulosa et de la thèque ...25
1.1.3.2 Les cellules du cumulus...26
1.1.4 La fécondation chez le porc ...27
1.1.4.1 Le spermatozoïde porcin...27
1.1.4.2 Interactions entre le spermatozoïde et l’ovule ...27
1.1.4.3 Activation de l’ovule et formation des pronoyaux ...29
1.1.4.4 Blocage à la polyspermie...30
1.1.5 L’embryon préimplantatoire porcin...31
1.1.6 Utilisation du modèle porcin en reproduction et en toxicologie...33
1.2 Les polluants organochlorés ...35
1.2.1 Contexte et description ...35
1.2.1.1 Production, utilisation et accumulation ...35
1.2.1.2 L’Arctique contaminé ...36
1.2.2 L’utilisation de mixtures dans les études toxicologiques ...41
1.2.3 Les métabolites d’organochlorés ...42
1.2.3.1 Voies métaboliques impliquées ...42
1.2.3.2 Avantage à étudier les métabolites sous forme de mixture ...43
1.3 Les organochlorés et le système reproducteur...43
1.3.1 Contexte ...44
1.3.2 Les organochlorés : perturbateurs endocriniens ?...48
1.3.3 Effets sur la fertilité suite à l’exposition environnementale ...55
1.3.3.2 Exposition environnementale, industrielle ou accidentelle des humains
Études épidémiologiques ...55
1.3.4 Effets des organochlorés sur le système reproducteur mâle en laboratoire...60
1.3.4.1 Perturbation endocrinienne in vivo des mâles par les organochlorés ...60
1.3.4.2 Perturbations au niveau du système reproducteur in vivo par les organochlorés...62
1.3.4.3 Perturbations des cellules testiculaires in vitro par les organochlorés...65
1.3.4.4 Perturbations des spermatozoïdes par les organochlorés...65
1.3.5 Effets des organochlorés sur le système reproducteur femelle en laboratoire...66
1.3.5.1 Perturbation du comportement sexuel des femelles exposées aux organochlorés...67
1.3.5.2 Perturbation de la stéroïdogénèse des femelles in vivo par les organochlorés ...67
1.3.5.3 Perturbations de la gestation in vivo par les organochlorés ...67
1.3.5.4 Perturbations au niveau des ovaires in vivo par les organochlorés...71
1.3.5.5 Perturbation des cellules folliculaires in vitro par les organochlorés ...71
1.3.5.6 Perturbation de l’ovocyte par les organochlorés in vitro...74
1.3.5.7 Perturbation de l’embryon préimplantatoire in vitro ...76
1.4 Justification du projet de recherche ...78
1.5 Objectifs et hypothèses généraux ...80
1.5.1 Objectif ...80
1.5.2 Hypothèses...80
1.6 Aperçu de la thèse...81
Chapitre 2 Perturbation de la maturation, fécondation et du développement embryonnaire d’ovocytes porcins suite à l’exposition à une mixture d’organochlorés similaire à celle retrouvée dans l’environnement...83
2.1 Avant-propos ...84
2.2 Article ...86
2.2.1 Abstract...87
2.2.2 Introduction...87
2.2.3 Materials and methods ...89
2.2.3.1 Organochlorine mixture...89
2.2.3.2 Media ...89
2.2.3.3 Oocyte preparation...90
2.2.3.4 In vitro maturation assay...90
2.2.3.5 In vitro fertilization...91
2.2.3.6 In vitro development and evaluation of sperm penetration and oocyte nuclear maturation ...91
2.2.3.7 Cumulus viability assay ...92
2.2.3.8 Statistical analyses ...92
2.2.4 Results...92
2.2.4.1 Effets of organochlorines on cumulus cells in vitro ...92
2.2.4.2 Effects of organochlorines on nuclear maturation in vitro ...93
2.2.4.3 Effects on IVF...93
2.2.4.4 Effects on embryo development ...94
2.2.5 Discussion...94
viii
2.2.5.2 Exposure to organochlorines affects oocyte maturation...96
2.2.5.3 Polyspermy, but not penetration, is decreased after organochlorine exposure ...96
2.2.5.4 Oocyte developmental competence is reduced following organochlorine exposure ...97
2.2.6 Acknowledgments ...98
2.2.7 References...98
Chapitre 3 Une mixture d’organochlorés similaire à celle retrouvée dans l’environnement perturbe les fonctions spermatiques et le développement embryonnaire chez le modèle porcin. ...106 3.1 Avant-propos ...107 3.2 Résumé français...108 3.3 Article ...109 3.4 Abstract...110 3.5 Introduction...111
3.6 Materials and methods ...112
3.6.1 Organochlorine mixture...112
3.6.2 Media ...112
3.6.3 Cumulus-oocyte complexe preparation ...113
3.6.4 In vitro maturation ...113
3.6.5 Experiment 1: Inclusion of the organochlorine mixture during IVF ...113
3.6.6 In vitro development and evaluation of sperm penetration ...114
3.6.7 Experiment 2: Exposure to organochlorines during oocyte maturation and fertilization...115
3.6.8 Experiment 3: Effect of the organochlorine mixture on sperm motility, viability, and the acrosome reaction...115
3.6.9 Statistical analyses ...116
3.7 Results...117
3.7.1 Overall DMSO effect...117
3.7.2 Experiment 1: Inclusion of the organochlorine mixture during IVF ...117
3.7.3 Experiment 2: Exposure to organochlorines during oocyte maturation and fertilization...118
3.7.4 Experiment 3: Effect of the organochlorine mixture on sperm motility, viability, and the acrosome reaction...118
3.8 Discussion...119
3.8.1 Disruption of fertilization by organochlorine mixture...119
3.8.2 Does organochlorine exposure during IVF perturb subsequent development?.120 3.8.3 Fertilization in the presence of organochlorines following pre-treatment during IVM...121
3.8.4 Organochlorines affect sperm motility and viability ...122
3.9 Acknowledgments ...124
3.10 References...125
3.11 Table ...129
Chapitre 4 Une mixture d’organochlorés similaire à celle retrouvée dans l’environnement, ainsi que son véhicule DMSO, induisent des altérations à l’ultrastructure des ovocytes porcins...133
4.2 Résumé français...135
4.3 Article ...136
4.4 Abstract...137
4.5 Introduction...138
4.6 Materials and Methods...139
4.6.1 Organochlorine mixture...139
4.6.2 Media ...139
4.6.3 Cumulus-oocyte complex preparation ...139
4.6.4 In vitro culture ...140
4.6.5 Processing for TEM ...140
4.7 Results...141
4.7.1 Control Immature COCs...141
4.7.2 Control 18h Cultured COCs ...142
4.7.3 DMSO-Control Cultured COCs...142
4.7.4 Organochlorine-Treated Cultured COCs ...143
4.8 Discussion...144
4.8.1 Effects on gap junctions...144
4.8.2 Effects on cortical granules...145
4.8.3 Effect on mitochondria ...145
4.8.4 Effects on the endosomal apparatus...146
4.8.5 Unexpected DMSO modifications...148
4.9 Conclusions...148
4.10 Acknowledgements...149
4.11 References...149
4.12 Tables...153
Chapitre 5 Effets d’une mixture de métabolites d’organochlorés similaire à celle retrouvée dans l’environnement et dérivée de fluides physiologiques sur les complexes ovocyte-cumulus porcins. ...158 5.1 Avant-propos ...159 5.2 Résumé français...160 5.3 Article ...161 5.4 Abstract...162 5.5 Introduction...163
5.6 Materials and Methods...164
5.6.1 Extraction of plasma samples containing organochlorines and their metabolites ...164
5.6.2 Media ...165
5.6.3 Treatments ...165
5.6.4 Preparation of cumulus-oocyte complexes ...166
5.6.5 In vitro maturation ...167
5.6.6 Cryopreservation of boar semen ...167
5.6.7 In vitro fertilization...168
5.6.8 In vitro development and evaluation of nuclear status ...168
5.6.9 Cumulus viability assay ...169
5.6.10 Statistical analyses ...169
5.7 Results...170
x
5.7.2 Organochlorine metabolites and IVM ...170
5.7.3 Organochlorine metabolites and IVF and embryo development ...171
5.8 Discussion...171
5.9 Acknowledgements...175
5.10 References...175
5.11 Table ...180
5.12 Figures ...182
Chapitre 6 Une mixture d’organochlorés, similaire à celle retrouvée dans l’environnement, ses métabolites et ses effets sur le développement préimplantatoire des embryons porcins. ...185 6.1 Avant-propos ...186 6.2 Résumé français...187 6.3 Article ...188 6.4 Abstract...189 6.5 Introduction...190
6.6 Materials and methods ...192
6.6.1 Organochlorine mixture and metabolised extract...192
6.6.2 Media ...192
6.6.3 In vitro maturation ...193
6.6.4 In vitro fertilization...193
6.6.5 In vitro development...194
6.6.6 TUNEL assay...194
6.6.7 Experiment 1: Exposing embryos to an organochlorine mixture ...195
6.6.8 Experiment 2: Exposing embryos to the metabolised extract...195
6.6.9 Statistical analyses ...196
6.7 Results...197
6.7.1 Experiment 1: original organochlorine mixture...197
6.7.2 Experiment 2: metabolised organochlorine extract ...197
6.8 Discussion...198
6.8.1 The organochlorine mixture induces embryotoxicity...198
6.8.2 Low concentrations of metabolised extract do not affect embryonic development ...199
6.8.3 Are embryos more resistant to contaminants than oocytes?...200
6.8.4 Summary and conclusion...201
6.8.5 Acknowledgements...201
6.9 References...202
6.10 Tables...205
6.11 Figures ...207
Chapitre 7 Discussion générale...210
7.1 Les organochlorés nuisent à la maturation de l’ovocyte...210
7.1.1 Au niveau de la maturation...210
7.1.2 Implication des cellules de cumulus ...211
7.1.3 Au niveau de la fécondation subséquente...212
7.1.4 Au niveau du développement subséquent...213
7.2 Les spermatozoïdes sont affectés par les organochlorés ...214
7.2.1 Pendant la fécondation...214
7.3 Les organochlorés perturbent le développement embryonnaire préimplantatoire....215
7.4 L’extrait métabolisé d’organochlorés ...216
7.5 Perspectives de recherche futures ...217
Conclusion ...219
Bibliographie ...220
Annexe 1. Description des organochlorés choisis. ...246
A.1.1 Les biphényles polychlorés...246
A.1.1.1 Structure, caractéristique, production, biodisponibilité ...246
A.1.1.2 Principales activités toxiques...247
A.1.2 Le dichlorodiphényltrichloroéthane (DDT) et ses analogues ...249
A.1.2.1 Structure, caractéristique, production, biodisponibilité ...249
A.1.2.2 Principales activités toxiques...250
A.1.3 Le Chlordane...251
A.1.3.1 Structure, caractéristique, production, biodisponibilité ...251
A.1.3.2 Principales activités toxiques...252
A.1.4 L’aldrine et la dieldrine...252
A.1.4.1 Structure, caractéristique, production, biodisponibilité ...252
A.1.4.2 Principales activités toxiques...253
A.1.5 Le toxaphène...253
A.1.5.1 Structure, caractéristique...254
A.1.5.2 Principales activités toxiques...254
A.1.6 L’hexachlorocyclohexane (HCH)...255
A.1.6.1 Structure, caractéristique, production, biodisponibilité ...255
A.1.6.2 Principales activités toxiques...256
A.1.7 L’hexachlorobenzène...256
A.1.7.1 Structure, caractéristique, production, biodisponibilité ...256
A.1.7.2 Principales activités toxiques...257
A.1.8 Le mirex ...258
A.1.8.1 Structure, caractéristique, production, biodisponibilité ...258
A.1.8.2 Principales activités toxiques...258
Annexe 2. Tableau de l’identité chimique des congénères de BPCs et de leurs homologues. ...261
Annexe 3. Graphiques de la composition de différentes mixture d’Aroclor (1016, 1242, 1248, 1254 et 1260). ...267
Annexe 4. Effet d’une mixture environnementale d’organochlorés et de son extrait métabolisé, dérivé de truies pré-exposées, sur les paramètres spermatiques porcins in vitro. ...272 Avant-propos ...273 Résumé français...274 Article ...275 Abstract...276 Introduction...277
Materials and methods ...278
Chemicals...278
Sperm preparation...278
Experiment 1: Exposing sperm to the original organochlorine mixture...279
xii
Analysis of motility and progressive motility...280
Measurement of sperm viability ...280
Measurement of sperm functional state ...280
Evaluation of sperm cytosolic calcium levels...280
Statistical analyses ...281
Results...282
Experiment 1: Exposing sperm to an environmentally-relevant organochlorine mixture ...282
Experiment 2: Exposing sperm to a metabolized extract of the organochlorine mixture ...282
Discussion...283
The organochlorine mixture harms sperm function...283
No apparent effect of the metabolised extract on sperm ...284
Summary and conclusion...285
Acknowledgements...285
References...286
Liste des tableaux
Tableau 1-1. Composition de la mixture d’organochlorés conçue pour imiter celle
retrouvée dans la graisse de phoque de l’Arctique. ...38
Tableau 1-2. Concentrations relatives en organochlorés de différents tissus et fluides provenant de différentes populations humaines et animales. ...45
Tableau 1-3. Activités endocriniennes d’organochlorés ou de leurs métabolites...52
Table 2-1. Composition of the organochlorine mixture used in the present study...102
Table 3-1. Composition of the organochlorine mixture used in the present study...129
Table 4-1. Concentration of compounds present in the IVM medium of COCs treated to the organochlorine mixture...153
Table 4-2. Summary of morphological modifications following IVM in presence or absence of 0.1 % DMSO and the organochlorine mixture. ...154
Table 5-1. Concentrations (µg/l) of organochlorines and their metabolites in stock plasma extracts in DMSO from control sows and sows orally exposed to the organochlorine mixture (OC-treated sows)...180
Table 6-1. Composition of the organochlorine mixture used in Experiment 1 [18]...205
Table 6-2. Concentrations (µg/l) of the major organochlorines and their metabolites in plasma extract from sows orally exposed to the organochlorine mixture used in Experiment 2 [19]. ...206
Liste des figures
Figure 1-1. Structure générale des BPCs (ATSDR 2000). ...39 Figure 1-2. A : Biphényles polychlorés non coplanaires. Structures bi- (a, c) et
tridimensionnelles (b, d) de BPC 128 (a, b) et de PCB 153 (c, d) ; B : Biphényles polychlorés coplanaires (« dioxin-like »). Structure bi- (e, g) et tridimensionnelles (f, h) de BPC 118 (e, f) et de PCB 77 (g, h) (NLM 2005)...39 Figure 1-3. Structure du p,p’-DDT (a), du p,p’-DDE (b) et du p,p’-DDD (c) (NLM 2005).
...39 Figure 1-4. Structure moléculaire du chlordane (a), de l'aldrine (b) et de la dieldrine (c)
(NLM 2005)...40 Figure 1-5. Structure générale du toxaphène. Le nombre d’atomes de chlore, ainsi que leur
position, peuvent varier (UNEP 2005a)...40 Figure 1-6. Structure du HCH (a), de l’hexachlorobenzène (b) et du Mirex (c) (NLM
2005). ...40 Figure 2-1. Effects of the organochlorine mixture added to the maturation medium on the
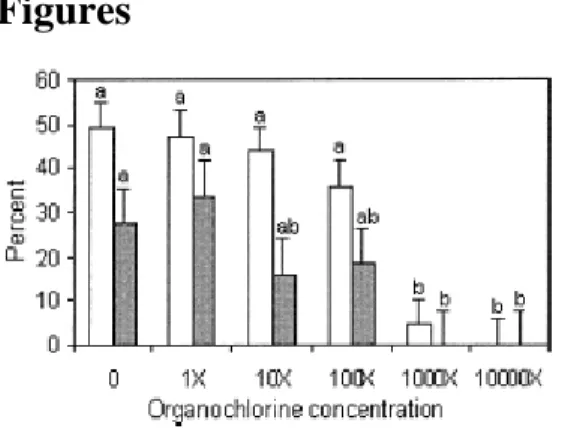
quality of the cumulus expansion of porcine oocytes...103 Figure 2-2. Effects of the organochlorine mixture added to the maturation medium on the
viability parameters of the cumulus cells of porcine oocytes...103 Figure 2-3. Effects of the organochlorine mixture added to the maturation medium on the
maturation parameters of porcine oocytes in vitro ...104 Figure 2-4. Effects of the organochlorine mixture added to the maturation medium on the
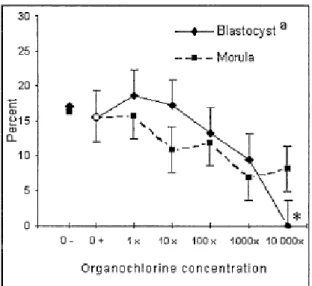
fertilization parameters of porcine oocytes...104 Figure 2-5. Effects of the organochlorine mixture added to the maturation medium of
porcine oocytes on the rate of morula and blastocyst formation ...105 Figure 2-6. Effects of the organochlorine mixture added to the maturation medium on
mean cell numbers in IVM-IVF-derived expanded blastocysts ...105 Figure 3-1. Effects of the organochlorine mixture added to the IVF medium of sperm and
oocytes on their subsequent fertilization parameters...130 Figure 3-2. Effects of the organochlorine mixture added to the IVF medium of sperm and
oocytes on the proportion of multicell embryos (open bars) and blastocysts (closed bars) subsequently formed, expressed as a percentage of penetrated oocytes...130 Figure 3-3. Effects of the organochlorine mixture added to the IVF medium of sperm and
oocytes on the mean cell numbers of the derived expanded blastocysts ...131 Figure 3-4. Effects of the organochlorine mixture added to the IVF medium of both sperm
and oocytes pre-exposed during in vitro maturation on their subsequent fertilization parameters...131 Figure 3-5. Effect of various concentrations of an organochlorine mixture on motility (A),
progressive motility (B), viability (C), and induced (plain bars) and spontaneous (dotted bars) acrosome reaction (D) at 0, 2, or 4 h of frozen-thawed sperm incubated in the fertilization medium...132 Figure 4-1. Light micrographs of porcine oocytes: (a) Immature. (b) Control cultured.
(c) DMSO control. (d) Organochlorine-treated ...155 Figure 4-2. Transmission electron micrographs of the cortex of porcine oocytes: (a)
Figure 4-3. Transmission electron micrographs of the center of porcine oocytes: (a)
Immature. (b) Control cultured. (c) DMSO control. (d) Organochlorine-treated....157 Figure 5-1. Cumulus expansion of COCs exposed to the metabolised organochlorine
mixture. ...182 Figure 5-2. Viability parameters of the cumulus cells of COCs exposed to the metabolised
organochlorine mixture...182 Figure 5-3. Maturation and degeneracy rates of COCs exposed to the metabolised
organochlorine mixture...183 Figure 5-4. Fertilization and polyspermic penetration rates of COCs exposed to the
metabolised organochlorine mixture ...183 Figure 5-5. Rate of blastocyst formation of fertilized COCs exposed to the metabolised
organochlorine mixture during maturation. ...184 Figure 5-6. Mean blastomere number of expanded blastocysts derived from fertilized COCs
exposed to the metabolised organochlorine mixture during maturation...184 Figure 6-1. Rate of development to blastocyst stage of fertilized oocytes during IVC in the
presence of an environmentally-relevant organochlorine mixture ...207 Figure 6-2. Mean blastomere number per expanded blastocyst developed by IVC in the
presence of an environmentally-relevant organochlorine mixture.. ...208 Figure 6-3. Mean rate of blastomere apoptosis (TUNEL assay) in expanded blastocysts
developed by IVC in the presence of an environmentally-relevant organochlorine mixture ...208 Figure 6-4. Rate of development to blastocyst stage of fertilized oocytes during IVC in the
presence of the metabolised organochlorine mixture ...209 Figure 6-5. Mean blastomere number per expanded blastocyst developed by IVC in the
Liste des abréviations
AAH Agents actifs de façon hormonale (« Hormonally Active Agents ») ADN Acide désoxyribonucléique
AhR Récepteur des hydrocarbures aromatiques
AMAP Programme d’évaluation et de surveillance pour l’Arctique (« Arctic Monitoring and Assessment Programme »)
ARN Acide ribonucléique
BPC Biphényle polychloré
CYP Cytochrome P450
COC Complexe ovocyte-cumulus
DDD Dichlorodiphényldichloroéthane DDE Dichlorodiphényldichloroéthylène DDT Dichlorodiphényltrichloroéthane DHT Dihydrotestostérone
F0, F1 et F2 Génération de : parents, 1re génération et 2e génération
FIV Fécondation in vitro
FSH Hormone folliculostimulante (« Follicle Stimulating Hormone ») GSH Glutathion
GVBD Rupture de la vésicule germinative (« Germinal Vesicle BreakDown ») HCB Hexachlorobenzène
HCH Hexachlorocyclohexane kg Kilogrammes
LDL Lipoprotéine de faible densité (« Low Density Lipoprotein ») LH Hormone lutéinisante (« Luteinizing Hormone »)
MIV Maturation in vitro
NADPH Nicotinamide adénine dinucléotide phosphate hydrogéné
NCP Programme de lutte contre les contaminants dans le Nord (« Northern Contaminants Program »)
OH-BPC Biphényle polychloré hydroxylé p.c. Postcoitum
PCDFs Furanes polychlorés (« Polychlorinated dibenzofurans ») POPs Polluants organiques persistants
T3 Triiodothyronine T4 Thyroxine
TCB Tétrachlorobiphényle
TCDD Dioxine (tétrachloro-2,3,7,8-dibenzo-p-dioxine) TSH Thyréostimuline (« Thyroid Stimulating Hormone »)
UNEP Programme des Nations unies pour l’environnement (« United Nations Environment Programme »)
Introduction générale
Depuis le début de l’ère industrielle, la production et le développement de produits chimiques ne cessent de s’accroître. Nombre de ces produits chimiques ont été développés pour servir de pesticides (herbicide, insecticide, fongicide), qui ont permis, entre autres, de développer l’agriculture industrielle moderne et d’améliorer les rendements des récoltes. D’autres produits, tels que les BPCs, ont été développés et utilisés dans les secteurs industriels grâce à leurs propriétés thermostables et ignifuges. Avec le temps, plusieurs de ces composés se sont révélés très stables, mais leur stabilité et leur résistance à la dégradation environnementale leur valent maintenant le statut de polluants environnementaux.
Ces polluants environnementaux s’introduisent dans la chaîne alimentaire humaine et animale et peuvent affecter, selon le degré d’exposition, plusieurs systèmes du corps. Parmi ces nombreux composés qui persistent dans l’environnement, ceux qui nous intéressent font partie de la famille chimique des organochlorés. En effet, les organochlorés persistent dans l’environnement et se bioaccumulent tout au long de la chaîne alimentaire. De fortes concentrations d’organochlorés, parfois jusqu’à cent fois supérieures à celles retrouvées dans le sang des habitants de la ville de Québec, ont été détectées dans le sang des Inuits du Nunavik, dans le Nord du Québec, ainsi que dans leurs sources de nourriture traditionnelle, soit le poisson, le phoque, la baleine et l’ours polaire (Ayotte et coll. 1997; Dewailly et coll. 1993; Dewailly et coll. 1996; Muckle et coll. 2001).
Notre équipe de recherche s’intéresse à l’influence de ces polluants organochlorés sur la santé reproductrice. Plus précisément, nos recherches s’effectuent à partir d’une mixture d’organochlorés préparée synthétiquement pour imiter, toutes proportions gardées, le mélange d’organochlorés retrouvé dans la graisse de phoque de l’Arctique (Muir 1995), principale source de contamination des Inuits.
Dans le cadre de cette thématique de recherche, cette thèse présente les effets potentiels de cette mixture d’organochlorés sur l’ovocyte, le spermatozoïde et l’embryon préimplantatoire en utilisant les techniques de reproduction in vitro. En effet, des concentrations non négligeables de sources environnementales se retrouvent dans les fluides utérins, folliculaires et séminaux des êtres humains et de certains animaux (Charlier et Foidart 2005; De Felip et coll. 2004; Kamarianos et coll. 2003a; Kamarianos et coll. 2003b; Saxena et coll. 1980; Stachel et coll. 1989; Younglai et coll. 2002).
Les travaux inclus dans cette thèse porteront sur les effets potentiels de la mixture sur les gamètes aux étapes de la maturation in vitro de l’ovocyte, de la fécondation in vitro de l’ovocyte par le spermatozoïde et du développement in vitro de l’embryon préimplantatoire. Parmi les modèles animaux disponibles pour effectuer une telle recherche dans ce contexte in vitro, le modèle porcin (Sus scrofa domestica) a été retenu puisque c’est un mammifère supérieur comme l’humain, et que plusieurs de ses systèmes, dont le système reproducteur et par conséquent ses gamètes, présentent certaines similitudes à ceux de l’humain. De plus, les organes reproducteurs du porc sont facilement accessibles et à peu de coûts (abattoir local), et les techniques de reproduction in vitro chez le porc sont bien connues et maitrisées au sein de notre centre de recherche.
La revue de littérature qui suit (Chapitre 1 ) tente d’effectuer un survol précis, mais concis, de la toxicologie de la reproduction, avec une spécificité pour l’ovaire. Mais d’abord, il est nécessaire de bien comprendre le système reproducteur porcin en se concentrant principalement sur l’ovaire et l’ovule, et d’approfondir les connaissances sur les polluants organochlorés inclus dans la mixture à l’étude. Le chapitre 1a donc été divisé en 3 grandes sections, toutes axées sur les mammifères : les systèmes reproducteurs, les gamètes et les embryons porcins; les organochlorés; et finalement la toxicologie de la reproduction.
Chapitre 1 Les polluants organochlorés et le système
reproducteur : revue de la littérature.
Tel qu’abordé dans l’introduction générale, cette revue de littérature est divisée en trois grandes sections, soit le système reproducteur porcin, les polluants organochlorés et la toxicologie de la reproduction en rapport avec les organochlorés. La section 1.2 sur les composés organochlorés discute principalement de la problématique de la contamination des régions du Grand Nord, ainsi que les potentiels perturbateurs sur les systèmes reproductifs et endocriniens des principaux composés organochlorés à l’étude dans cette thèse. Finalement, la dernière section (1.3 ), la toxicologie des organochlorés sur les systèmes reproducteurs, concerne principalement les effets des organochlorés sur la reproduction des mammifères incluant l’homme. L’effet des organochlorés sur les gamètes in vitro y est aussi abordé.
Pour en connaître davantage sur l’origine et la toxicité générale des principaux organochlorés à l’étude dans cette thèse, l’Annexe 1 peut être consultée.
1.1 Le système reproducteur porcin
Ce survol du système reproducteur concerne presque exclusivement le modèle porcin, puisque c’est le modèle à l’étude dans cette thèse. Nous verrons tout d’abord les étapes de la formation et de la croissance des ovules et ovaires, puis la maturation des follicules et de l’ovocyte. Le rôle des cellules folliculaires et la communication entre ces dernières et l’ovocyte sont aussi abordés. Un résumé de la formation des spermatozoïdes précède la section sur la fécondation. Le développement embryonnaire préimplantatoire y est aussi abordé. Cette section concernant le système reproducteur se termine sur l’explication du choix du modèle porcin pour des études en toxicologie de la reproduction.
1.1.1 Folliculogenèse porcine
1.1.1.1 Puberté et recrutement
Chez la cochette, la puberté débute autour de 4 à 9 mois d’âge (moyenne de 6 à 7 mois) (Aiello 2003; Hughes et coll. 1997). Dans le follicule secondaire, les cellules de granulosa
continuent de proliférer, entrainant la formation de la thèque. La zone pellucide apparaît, cette dernière étant sécrétée à la fois par l’ovocyte et la granulosa chez le porc (Parillo et coll. 2003; Thibault and Levasseur 2001). Dans le follicule tertiaire (environ 2 mm), les cellules de granulosa expriment le récepteur de la FSH et les cellules de la thèque, celui de la LH, ce qui rend le follicule apte à répondre à une stimulation gonadotrope provenant de l’hypophyse, principalement par la FSH (Christenson et coll. 1985). Cette étape constitue la phase de recrutement, initialisée autour du jour 14-16 d’un cycle œstral de 16 à 24 jours (moyenne de 21 jours) (Aiello 2003; Foxcroft and Hunter 1985).
Ces follicules tertiaires (une cohorte d’environ 50) augmentent en diamètre grâce à la prolifération cellulaire de la thèque (interne et externe) et de la granulosa, et à l’accumulation du fluide folliculaire dans l’antre nouvellement formé (Foxcroft and Hunter 1985). À ce stade, le follicule tertiaire est aussi antral et atteint un diamètre de 2 à 6 mm chez le porc où l’ovocyte est entouré d’un amas de cellules granulosa différenciées appelées les cellules du cumulus (Grant et coll. 1989). Le recrutement coïncide aussi avec l’apparition d’une activité aromatase dans la granulosa porcine (Foxcroft and Hunter 1985).
1.1.1.2 Dominance
Parmi ces follicules en recrutement, seulement 15 à 20 continuent leur croissance en follicules préovulatoires. Dans ces follicules dits dominants, de plus de 5 mm, les cellules de la granulosa ont une forte activité aromatase qui permet la synthèse d’œstradiol et expriment le récepteur de la LH dont l’induction serait influencée par les niveaux croissants d’œstradiol dans le fluide folliculaire (Foxcroft and Hunter 1985). À ce stade, les cellules de la thèque produisent aussi de l’œstradiol par une activité aromatase (Evans et coll. 1981; Haney and Schomberg 1981). Entre les jours 16 et 20 du cycle de la truie, le taux d’œstrogène dans le fluide folliculaire décuple, la testostérone triple et l’affinité pour la LH dans les cellules de la granulosa et de la thèque augmente encore plus (Grant et coll. 1989). Les niveaux de FSH sanguins sont abaissés par l’œstradiol et l’inhibine produite par les follicules en formation; les follicules dominants sont donc soutenus presque exclusivement par la LH (Thibault and Levasseur 2001). Les autres follicules termineront leur destinée en subissant une atrésie par apoptose jusqu’à la disparition complète du follicule dans le stroma ovarien (Foxcroft and Hunter 1985).
22
1.1.1.3 Ovulation
L’accumulation croissante d’œstradiol sécrété par les follicules en fin de croissance stimule l’hypophyse à larguer une décharge de LH entre le jour 20 et 21 du cycle œstral, communément appelé le « pic de LH »; cette étape constitue le début de l’œstrus, d’une durée de deux à trois jours (Aiello 2003; Foxcroft and Hunter 1985; Grant et coll. 1989). Cette décharge diminue la production d’œstradiol en inhibant l’activité aromatase de la granulosa, permettant une augmentation de la production de progestérone (Grant et coll. 1989). Ce pic de LH provoque un remaniement cellulaire important dans le follicule : augmentation de la taille folliculaire jusqu’à plus de 8 mm, accroissement de la vascularisation, angiogenèse, fermeture des jonctions ouvertes entre les cellules de la granulosa et perte de la lame basale (Grant et coll. 1989; Thibault and Levasseur 2001). Environ 36 à 40 heures après la décharge de LH, le follicule se rompt et l’ovule est expulsé (Aiello 2003; Thibault and Levasseur 2001). Le follicule débarrassé de son ovocyte se transforme en corpus luteum et produit davantage de progestérone, mais aussi de l’œstradiol et de l’inhibine, inhibant ainsi la libération de FSH et empêchant la reprise de croissance d’un nouveau groupe de follicules (Thibault and Levasseur 2001).
1.1.2 Maturation de l’ovocyte porcin
1.1.2.1 Croissance de l’ovocyte
La croissance de l'ovocyte suit de près la folliculogenèse. Bien que la maturation nucléaire de l’ovocyte soit bloquée au stade de vésicule germinative, sa maturation cytoplasmique est très active (Thibault and Levasseur 2001). Cette maturation cytoplasmique est essentielle pour que l’ovule acquière la compétence à reprendre la méiose, à être fécondé et à entreprendre le développement embryonnaire. Cette phase intense de croissance de l’ovocyte porcin se termine lorsque le follicule a atteint un diamètre d’environ 2,2 mm, soit 200 fois son diamètre initial (Moor et coll. 1990; Motlik et coll. 1984a).
La maturation ovocytaire coïncide aussi avec une synthèse intense d’ARN ribosomial et messager ainsi que de multiples protéines; en effet, l’ovocyte du follicule antral incorpore quatre fois plus d’acide aminé que celui du follicule primordial (Moor et coll. 1990; Motlik et coll. 1984 b). La fin de cette période de transcription et traduction active coïncidera avec l’approche de la taille ovocytaire optimale (> 100 µm; 80 % de la taille finale), et avec le
début de la reprise de la méiose (Moor et coll. 1990). Les glycoprotéines de la zone pellucide comptent pour près de 10 % des protéines formées dans l’ovocyte : ZPA (90 kDa), ZPB (55 kDa) et ZPC (55 kDa) (Hedrick and Wardrip 1987; Rath et coll. 2005; Thibault and Levasseur 2001; Yurewicz et coll. 1987). L’appareil de Golgi est très actif pendant cette période et participe, entre autres fonctions, à la sécrétion des protéines de la zone pellucide et des granules corticaux, essentiels à la fécondation (Thibault and Levasseur 2001; Zamboni 1970).
1.1.2.2 Reprise de la méiose
L’approche de la taille finale de l’ovocyte (120 µm) et la décharge de LH coïncident avec l’apparition du MPF (« Maturation Promoting Factor »; constitué des 2 sous-unités protéiques cdc2 et cycline B) (Fulka et coll. 1985). En effet, lors du pic de LH, les jonctions perméables entre les cellules du cumulus et l’ovocyte se ferment et les niveaux d’AMPc dans l’ovocyte augmentent rapidement, permettant ainsi la reprise de la méiose (Granot and Dekel 1994; Mattioli et coll. 1994).
L’ovocyte reprend donc sa méiose par l’ondulation puis la rupture de la vésicule germinative (GVBD), suivi par la condensation de la chromatine, environ 20 heures après la décharge de LH (Cran 1985). S’en suivent par la suite la formation du fuseau méiotique et l’alignement des chromosomes en métaphase I, environ 30 heures post-LH (Cran 1985). Rapidement, l’ovocyte entreprend l’anaphase et la télophase, suivie de l’expulsion du 1er globule polaire. La transition de la métaphase I à la métaphase II coïncide avec la croissance à la taille optimale de l’ovocyte, la capacité de synthétiser les protéines de l’étape métaphase et la terminaison de l’activité transcriptionnelle nucléaire (Moor et coll. 1990). Les chromosomes de l’ovocyte se répartissent rapidement sur le second fuseau méiotique, environ 40 à 50 heures post-LH (Cran 1985). C’est la métaphase II, et l’ovocyte y demeura bloqué jusqu’à la fécondation.
1.1.2.3 Maturation cytoplasmique finale
La reprise de la méiose permet le début de la phase finale de la maturation cytoplasmique impliquant le transfert des organites dans l’ovocyte. Les mitochondries, initialement distribuées à travers l’ovoplasme, se rassemblent autour du noyau lors de la GVBD sous l’influence des microtubules; leur nombre diminue d’un tiers, mais leur volume augmente
24 de 300 % (Cran 1985; Moor et coll. 1990). Les granules corticaux, sécrétés par l’appareil de Golgi et initialement situés dans l’espace sous-cortical, se multiplient et migrent à quelques nanomètres sous la membrane plasmique (Cran 1985). L’appareil de Golgi disparaît presque complètement après la reprise de la méiose, mais les granules corticaux continuent d’être produits près de la membrane plasmique par ce qui semble être une forme spécialisée de réticulum endoplasmique rugueux (Cran 1985). Les microvillosités disparaissent à la surface de la membrane plasmique et le réseau de filaments d’actine corticaux s’épaissit (Thibault and Levasseur 2001). Les gouttelettes lipidiques, très importantes chez l’ovocyte porcin, augmentent en nombre, mais diminuent en volume (Cran 1985; McEvoy et coll. 2000). L’espace périvitellin apparaît pendant cette période, et est composé d’une matrice complexe de chaines d’acide hyaluronique et de protéoglycanes sécrétées à la fois par l’ovocyte et par les cellules de la corona radiata (Cran 1985; Fléchon et coll. 2003).
Pendant cette période, la concentration de glutathion (GSH) dans l’ovocyte augmente pour atteindre un maximum en métaphase II; ce dernier provient à la fois de l’ovocyte et du cumulus et est relié à une meilleure compétence à la fécondation et au développement (de Matos et coll. 1997; Mori et coll. 2000a; Tatemoto et coll. 2000). La zone pellucide subit aussi des changements biochimiques et fonctionnels qui permettront une meilleure induction de la réaction acrosomiale (Rath et coll. 2005). Par contre, la consommation en oxygène, indice du métabolisme, demeure faible et stable pendant la maturation finale (Sturmey and Leese 2003). C’est aussi à ce moment que l’ovocyte acquiert la compétence pour expulser les granules corticaux (Ducibella and Buetow 1994).
1.1.2.4 La maturation ovocytaire in vitro
La maturation in vitro des ovocytes ne permet pas d’atteindre les rendements embryonnaires tels qu’observés in vivo (Moor et coll. 1990). Privé de ses facteurs inhibiteurs de la reprise de la méiose provenant des cellules de la granulosa et de la thèque, l’ovocyte porcin isolé de son follicule (avec antre; 3-6 mm) est capable de reprendre sa méiose (Pincus and Enzmann 1935; Tsafriri et coll. 1976). Par contre, sa capacité au développement en est compromise (diminution du taux de développement), ce qui confirme l’importance de la maturation cytoplasmique finale (Funahashi and Day 1997).
Contrairement à la situation in vivo, la reprise de la méiose n’est pas reliée à la rupture des jonctions ouvertes entre l’ovocyte et les cellules du cumulus, mais plutôt à la rupture des jonctions entre les cellules du cumulus même (Isobe et coll. 1998). L’ajout d’AMPc au milieu de culture permet de maintenir l’ovocyte en arrêt méiotique au stade de VG pendant une vingtaine d’heures avant la reprise de la méiose pour permettre une synchronisation de la maturation cytoplasmique finale des ovocytes, ce qui améliore leur compétence au développement (Funahashi et coll. 1997). Pendant cette période, l’ovocyte continue de traduire de nombreuses protéines (Tomek et coll. 2002). La maturation in vitro de l’ovocyte semble aussi affecter la maturation finale de la zone pellucide, puisqu’elle est plus mince et que sa surface ne correspond pas à celle des ovocytes maturés in vivo (Funahashi et coll. 2001; Funahashi et coll. 2000).
1.1.3 Interactions entre l’ovocyte et les cellules folliculaires porcines
1.1.3.1 Les cellules de la granulosa et de la thèque
Dans le follicule porcin en développement, les cellules de la thèque interne et de la granulosa participent à la production de stéroïdes. Ces deux types cellulaires sont séparés par la lame basale, isolant ainsi l’ovocyte de la circulation sanguine directe, mais ces cellules folliculaires communiquent entre elles par diffusion et par les jonctions ouvertes qui permettent le passage d’ions et de petites molécules de < 1 kDa, tels que l’AMPc, le GSH et le calcium (Webb et coll. 2002). Les cellules de la granulosa sont le type cellulaire prédominant pour la production de progestérone sous l’influence de la FSH et de la LH, mais le récepteur de la LH s’exprime seulement à l’étape de dominance (Evans et coll. 1981). Les cellules de la thèque transforment la prégnènolone (le précurseur de la progestérone) en androstènedione par la 17 α-hydroxylase (P450C17), puisque la granulosa en est déficiente, puis l’exporte vers les cellules de la granulosa qui la convertiront en testostérone puis en œstradiol par l’aromatase, cette dernière étant exprimée à partir de l’étape du recrutement (Evans et coll. 1981). Le porc est particulier en comparaison avec d’autres espèces puisque les cellules de la thèque interne porcine produisent aussi de l’œstradiol (Evans et coll. 1981; Haney et Schomberg 1981). Cet œstradiol stimule, dans les cellules de la granulosa, la prolifération cellulaire, la formation de l’antre, la formation
26 de jonctions ouvertes et de récepteurs à l’œstrogène, ainsi que la réponse aux gonadotrophines (LH et FSH) (Ainsworth et coll. 1990).
L’ovocyte joue aussi un rôle important dans le développement du follicule. Il régule, via un facteur de cellule souche (« Stem Cell Factor »), les interactions entre thèque et granulosa en stimulant la production d’œstrogène, la prolifération et viabilité cellulaire, et en inhibant la production de progestérone et d’androstènedione (Brankin et coll. 2003). L’ovocyte joue aussi un rôle dans la prolifération cellulaire, la formation du follicule, l’expansion du cumulus et dans l’ovulation (Eppig 2001). Il serait, selon toute vraisemblance, apte à influencer le développement folliculaire dans l’ovaire immature (Matzuk et coll. 2002).
1.1.3.2 Les cellules du cumulus
Dès la formation de l’antre dans le follicule, quelques couches de cellules de la granulosa entourant l’ovocyte se détachent du reste de la granulosa en contact avec la thèque, formant ainsi un complexe ovocyte-cumulus. La couche de cellules en étroit contact avec l’ovocyte par des jonctions ouvertes et dont les projections traversent la zone pellucide s’appelle la corona radiata. Comparativement aux cellules de la granulosa, les cellules du cumulus expriment peu ou pas de récepteurs à la LH (Eppig 2001). En fait, il semble que des facteurs sécrétés par l’ovocyte (dont GDF-9; facteur de différentiation de la croissance) réduiraient, dans les cellules de cumulus, l’expression de plusieurs gènes caractéristiques aux cellules de la granulosa, tels que LHCGR (« luteinizing hormone/chorionic gonadotropin receptor »; gène du récepteur de la LH et des gonadotrophines chorioniques) et Kitl (« Kit ligant »; agglutinant de Kit; stimule la croissance ovocytaire) (Eppig 2001). La communication intercellulaire par les jonctions ouvertes entre les cellules de cumulus et l’ovocyte est très importante au stade de VG et ne décline qu’après l’anaphase I dans les follicules in vivo (environ 32 heures post-LH), tandis qu’in vitro, l’arrêt complet de la communication est progressif et se termine entre 24 et 36 heures de maturation, entre la métaphase I et la métaphase II (Moor et coll. 1990; Motlik et coll. 1986; Suzuki et coll. 2000).
Au cours de la maturation, les cellules du cumulus produisent de l’acide hyaluronique sous l’influence de la FSH et de l’AMPc, ce qui permet un accroissement de l’espace
intercellulaire et mène à l’expansion du cumulus (Eppig 1979; Salustri et coll. 1989). Cette matrice d’acide hyaluronique permet de maintenir l’intégrité du cumulus même après la fermeture des jonctions ouvertes. L’ovocyte stimule cette production d’acide hyaluronique par, entre autres facteurs, le CEEF (« Cumulus expansion-enabling factor ») (Nagyova et coll. 2000). Les cellules du cumulus sécrètent aussi des facteurs (hyaluronan synthases et CD44) régulant la perte des jonctions ouvertes et l’expansion du cumulus (Isobe et Terada 2001; Kimura et coll. 2002).
Chez le porc, la masse de cumulus persiste pour quelques heures après l’ovulation dans les animaux non accouplés, mais se disperse rapidement (< 6 h) chez les animaux qui ont été accouplés avant l’ovulation (Szollosi et Hunter 1973). In vitro, les spermatozoïdes se chargent de briser les liens de la matrice d’acide hyaluronique, facilitant ainsi le dépouillement des ovules de leurs cellules de cumulus.
1.1.4 La fécondation chez le porc
1.1.4.1 Le spermatozoïde porcin
Le spermatozoïde est produit dans les testicules et doit passer par l’épididyme pour acquérir sa compétence à la fécondation. L’étape finale de la maturation du spermatozoïde est la capacitation et s’effectue, in vivo, dans le tractus génital femelle. Elle est provoquée, dans la plupart des cas, par l’enlèvement du plasma séminal, l’interaction avec les cellules des voies utérine et de l'oviducte et un changement de pH (le pH utérin est plus bas que celui du plasma séminal) (Hunter 1990). La capacitation découle d’une cascade d’évènements : enlèvement des protéines de revêtement et du cholestérol, influx de calcium dans le spermatozoïde, augmentation de la fluidité de la membrane plasmique et de la mobilité des protéines membranaires, et modification des chaînes d’oligosaccharides (Bailey et coll. 2005; Visconti et coll. 1998). Ces évènements rendent disponibles les récepteurs pour des composantes de la zone pellucide à la surface de la membrane plasmique du spermatozoïde et induisent une hyperactivation de la motilité du spermatozoïde.
1.1.4.2 Interactions entre le spermatozoïde et l’ovule
Après avoir traversé le tractus génital, le spermatozoïde arrive dans l’oviducte et peut y séjourner de quelques minutes à quelques jours. Cette association des gamètes mâles avec
28 les cellules de l’oviducte permettrait de réduire la polyspermie et d’améliorer la compétence à la fécondation, sans doute en induisant une maturation finale de la membrane spermatique (Bureau et coll. 2000; Dubuc et Sirard 1995). Chez la truie, l’ovule arrive au site de fécondation (à la jonction de l’ampoule et de l’isthme) environ 30 à 45 min après l’ovulation (Hunter 1990). Le spermatozoïde, arrivé au site de fécondation, doit traverser les cellules de cumulus pour atteindre la zone pellucide de l’ovule. Cette étape nécessite une hypermotilité du spermatozoïde, induite par la capacitation, pour se tailler mécaniquement un chemin vers et à travers l’acide hyaluronique entre les cellules du cumulus (Suarez 2007).
In vivo, la réaction acrosomiale est induite lors du contact des spermatozoïdes avec les cellules de la corona radiata ou la zone pellucide (Szollosi et Hunter 1978). La réaction acrosomiale implique de nombreuses molécules, telles que la lactadhérine, la galactosyl-transférase et les protéines d’adhésion à la zone pellucide, et induit une vésiculation de la membrane externe de l’acrosome, une perte des composés acrosomials et l’enlèvement de vésicules membranaires de la tête du spermatozoïde (Rath et coll. 2005; Szollosi et Hunter 1978). S’en suit une cascade d’évènements biochimiques tels qu’une augmentation du pH intracellulaire et de l’AMPc, un influx massif d’ions calciques dans la cellule, et une activation de protéines kinases (Mori et coll. 2000 b). L'hyaluronidase porcine libérée de l’acrosome permet de briser les liens entre les molécules d’acide hyaluronique de la matrice extracellulaire, facilitant ainsi le passage du spermatozoïde à travers la corona radiata jusqu’à la zone pellucide (Dudkiewicz 1984).
La réaction acrosomiale permet d’exposer les molécules de liaison à la zone pellucide, situés sur la membrane interne de l’acrosome et la membrane plasmique (Mori et coll. 2000 b). La proacrosine (précurseur de l’acrosine, qui rompt les ponts entre les glycoprotéines de la zone pellucide) et l'hyaluronidase participent à la forte liaison secondaire avec les composantes de la zone pellucide, surtout la ZPA, ce qui permet au spermatozoïde de migrer vers la membrane plasmique de l’ovule (Rath et coll. 2005). Une autre molécule du spermatozoïde porcin, la sp38, se lie spécifiquement à la ZPA (Mori et coll. 1993). Les vésicules membranaires libérées lors de la réaction acrosomiale se lient
fortement au complexe ZPB-ZPC, mais le rôle exact de cette liaison lors de la fécondation demeure indéterminé (Yurewicz et coll. 1998).
Une fois la zone pellucide traversée, la membrane plasmique de la région postacrosomiale du spermatozoïde se fixe et fusionne avec la membrane plasmique de l’ovule. Les protéines qui interviennent lors de ce processus sont la fertiline et la 62 kDa de la région équatoriale, la SP10 de la membrane acrosomiale interne, ainsi que des molécules reliées à l’immunologie telles que le complexe majeur d’histocompatibilité de classe II et les CD4 (Evans et Florman 2002; Mori et coll. 2000 b). La pénétration de l’ovule par le spermatozoïde arrive trois heures après l’accouplement (ou 1 à 2 heures après l’ovulation) et, environ 5 à 6 h plus tard, le développement synchronisé des pronoyaux mâle et femelle commence (Hunter 1972; Hunter 1990).
1.1.4.3 Activation de l’ovule et formation des pronoyaux
À la suite de la fusion des membranes plasmiques, le corps du spermatozoïde est entraîné dans le cortex de l’ovule par le cytosquelette et la membrane du noyau spermatique est digérée. Les chromosomes mâles se décondensent, les protamines sont remplacées par des histones de l’ovule et une nouvelle enveloppe nucléaire se forme : c’est le pronoyau mâle (Thibault et Levasseur 2001).
Dès le début de la fusion, l’ovule reprend sa méiose bloquée en métaphase II et expulse son deuxième globule polaire. L’ADN chromosomique de l’ovule migre vers le centre de l’ovule et se décondense. Une nouvelle enveloppe nucléaire est aussi formée autour de l’ADN décondensé : c’est le pronoyau femelle (Thibault et Levasseur 2001).
In vitro, la formation du pronoyau mâle est intimement liée à la qualité de la maturation cytoplasmique de l’ovule, surtout à la présence du facteur MPGF (« male pronucléus growth factor ») et de la concentration intracellulaire en GSH (Moor et coll. 1990; Sawai et coll. 1997). Le détachement de la tête spermatique et le gonflement initial du noyau débutent environ 4 heures après l’insémination et sont synchronisés avec l’anaphase II de l’ovule (Moor et coll. 1990). Vers 6 heures postinsémination, les membranes nucléaires apparaissent et, vers 7 heures, les pronoyaux mâle et femelle sont observés (Moor et coll. 1990).
30 Les deux pronoyaux ne fusionnent pas. Plutôt, les pronoyaux entrent en phase S du premier cycle cellulaire mitotique et dupliquent leur matériel génétique (Thibault et Levasseur 2001). Suite à la pénétration, un petit aster (les centrioles du centrosome provenant à la fois du spermatozoïde et de l’ovule) est associé à la tête du spermatozoïde et grossit pendant la décondensation des pronoyaux (Kim et coll. 1996; Navara et coll. 1995). Les pronoyaux se recondensent partiellement et s’alignent de part et d’autre du spermaster grâce aux microtubules nouvellement formés (Kim et coll. 1997). Les membranes nucléaires disparaissent et la première métaphase de l’embryon a lieu. À cette étape, un fuseau mitotique bipolaire est observé, dont un des pôles est associé à la queue du spermatozoïde (Navara et coll. 1995).
1.1.4.4 Blocage à la polyspermie
À la suite de la pénétration du spermatozoïde dans l’ovule, la concentration de calcium intracellulaire augmente, impliquant les réserves intracellulaires de calcium du réticulum endoplasmique et la voie de la phospholipase C (Machaty et coll. 1997; Sun 2003). Le contenu des granules corticaux est expulsé dans l’espace périvitellin pour induire le durcissement de la zone pellucide (Wang et coll. 1998 b; Wang et coll. 1997). Le durcissement de la zone pellucide est induit par une protéase des granules corticaux qui séparerait la ZPA en deux fragments et par la formation de liaisons disulfures entre ces nouvelles composantes (Iwamoto et coll. 1999; Tatemoto et Terada 1999). L’exocytose des granules corticaux induit aussi la formation d’une matrice dans l’espace périvitellin, pouvant atteindre la même épaisseur que celle de la zone pellucide (Talbot et Dandekar 2003). Simultanément, la membrane plasmique de l’ovule subit un changement structurel suite à l’incorporation de la membrane spermatique (Rath et coll. 2005). In vivo, la fécondation induit aussi un épaississement de la zone pellucide (Funahashi et coll. 2001). Tous ces changements constituent un aspect du blocage à la polyspermie (fécondation par de multiples spermatozoïdes).
Chez les mammifères, la polyspermie est considérée comme une pathologie. Chez le porc, la fréquence de polyspermie in vivo est élevée, pouvant atteindre 20-30 % lorsque le nombre de spermatozoïdes compétents atteignant l’ovule est anormalement élevé ou
lorsque les conditions physiologiques perturbent la maturation finale de l’ovocyte, telle qu’une dose élevée de progestérone (Hunter 1990).
La polyspermie est aussi un problème en fécondation in vitro chez le porc. Les ovocytes ne peuvent assurer un durcissement adéquat de la zone pellucide, sans doute en réponse à une maturation cytoplasmique inadéquate (Rath et coll. 2005). Ce mauvais durcissement serait causé par un retard dans la réaction de la zone pellucide plutôt que par un retard d’expulsion ou de non-expulsion des granules corticaux (Wang et coll. 1998a). Chez la souris, la polyspermie in vitro a aussi été associée à des ovules âgés, et serait induite par une déficience du cytosquelette et une mauvaise réceptivité de la membrane ovocytaire à fusionner avec la membrane spermatique (Wortzman et Evans 2005).
1.1.5 L’embryon préimplantatoire porcin
Chez la truie, l’embryon est transporté vers la jonction de l’isthme et de l’ampoule quelques heures après la fécondation et y demeure pour environ 36 heures (Dziuk 1985). Le premier clivage du zygote est observé environ 20 à 24 heures après l’ovulation in vivo, soit 15 heures après la fécondation (Hunter 1974). Le cycle de deux cellules continue environ 6 à 8 heures et celui de quatre cellules de 20 à 24 heures (Hunter 1974). L’embryon entre dans l’utérus environ 48 heures après l’ovulation, au stade de 4 cellules (Dziuk 1985; Hunter 1974). Cette migration semble être facilitée par la progestérone et inhibée par l’œstradiol (Dziuk 1985). In vitro, le premier clivage est observé 12 heures après la fécondation, puis l’embryon demeure au stade de deux cellules pendant 14 heures et au stade de quatre cellules pendant 50 heures (Prather 1993; Schoenbeck et coll. 1992).
Pendant le stade de zygote et de deux cellules, les embryons porcins dépendent du groupe d’ARN messagers maternels pour diriger leur développement (Prather 1993). Le stade de 4 cellules est un stade critique de l’activation du génome embryonnaire et le commencement de la synthèse d’ARN messagers embryonnaires (Prather 1993; Stroband and Van der Lende 1990). Les nucléoles sont retrouvés à partir du stade de 8 cellules, et leur développement est accompagné d’une augmentation du nombre de ribosomes (Stroband et Van der Lende 1990).
32 Le stade de morula (8 à 16 cellules) est atteint après 4 jours in vivo, et c’est à ce moment que les premiers signes de compaction sont observés (Hunter 1974). La blastulation, c'est-à-dire la différenciation des cellules internes et externes de l’embryon, est observée à partir du stade de 12 à 16 cellules (Stroband et Van der Lende 1990). Les cellules internes deviendront la masse cellulaire interne du blastocyste, tandis que les cellules externes deviendront le trophectoderme. Les cellules externes forment alors une couche de cellules polarisées étroitement en contact, puis des jonctions cellulaires (desmosomes et jonctions serrées) apparaissent entre cellules voisines et dans le trophectoderme (Stroband et Van der Lende 1990). Le transport d’ions de sodium et d’eau à travers le trophectoderme permet la formation du blastocœle (Stroband et Van der Lende 1990). À partir de ce moment, l’embryon est appelé blastocyste : ce stade est atteint au jour 5 ou 6, et le nombre de cellules au moment de la formation du blastocœle est en moyenne de 16 à 32 (Papaioannou et Ebert 1988).
Juste avant l’éclosion hors de la zone pellucide, le blastocyste continue son expansion et remplit complètement l’espace périvitellin. La majorité des blastocystes porcins contiennent alors de 65 à 120 cellules, mais certains blastocystes en expansion in vivo de 17 à 32 cellules ont aussi été observés (Papaioannou et Ebert 1988). La proportion de cellules de la masse interne atteint un maximum de 25 % à ce stade (Papaioannou et Ebert 1988). In vivo, l’éclosion hors de la zone pellucide est observée au jour 6 ou 7 pour des blastocystes ayant de 80 à 135 cellules (Papaioannou et Ebert 1988).
Pendant les premières étapes du clivage, les organites cytoplasmiques des embryons porcins sont peu nombreux et concentrés principalement autour des noyaux, tandis que les gouttelettes lipidiques remplissent la périphérie du cytoplasme des cellules embryonnaires (Stroband et Van der Lende 1990). Les mitochondries, qui sont globulaires aux premières étapes de clivage, deviennent allongées au stade de morula, suggérant une augmentation de l’activité métabolique (Stroband et Van der Lende 1990). Au stade de blastocyste, les cellules du trophectoderme contiennent de nombreuses mitochondries et quelques bandes de réticulum endoplasmique et de citernes de Golgi, tandis que les cellules de la masse interne n’ont pratiquement pas d’organites (Stroband et Van der Lende 1990). Ces deux
types cellulaires contiennent par contre un grand nombre de gouttelettes lipidiques et de vésicules (Stroband et Van der Lende 1990).
Les embryons porcins sont sensibles aux stéroïdes, tels que l’œstrogène, dès le jour 4 (8 cellules) et ce dernier pourrait être impliqué dans la formation du blastocœle (Niemann et Elsaesser 1986). Les ARN messagers du récepteur de l’estrogène (RE) sont détectés au stade d’une, de deux et de quatre cellules, ainsi qu’au stade de blastocyste; par ailleurs, la présence de la protéine du RE est seulement détectée au stade d’une et de quatre cellules (stades situés avant l’activation du génome embryonnaire) (Ying et coll. 2000). L’embryon porcin produit une quantité croissante d’œstradiol à partir du jour 10 à 12 in vivo (Pope et coll. 1990). Ces sécrétions d’œstradiol seraient essentielles à la réceptivité de l’utérus pour l’implantation, mais dommageables pour les embryons moins avancés (< 10 jours) (Pope et coll. 1990). Il est donc possible que cette sensibilité à l’estrogène de l’utérus et des embryons puisse affecter les jeunes embryons et les étapes de l’implantation et de la reconnaissance foeto-maternelle en les rendant plus susceptibles aux perturbateurs endocriniens provenant de l’environnement.
1.1.6 Utilisation du modèle porcin en reproduction et en toxicologie
Dans les études toxicologiques ou celles étudiant le système reproducteur, les rongeurs (rat, souris, cochon d'Inde et hamster) sont souvent les modèles les plus prisés depuis les débuts de la recherche sur les animaux de laboratoire, sans doute grâce à leur petite taille (ce qui confère une facilité de manipulation) et de la rapidité de leur reproduction. Pourtant, d’un point de vue évolutif, la différence entre les humains et plusieurs modèles animaux (tels que les rongeurs) a souvent ralenti l’application des découvertes vers les thérapies humaines (Vodicka et coll. 2005). Il existe donc un manque de modèle animal idéal pour examiner les effets potentiellement néfastes des contaminants environnementaux sur le système reproducteur humain.
Le porc constitue un modèle de choix, contrairement au modèle rongeur, puisque la physiologie de ses organes et de ses systèmes est remarquablement similaire à ceux de l’humain (Petters 1994; Prather et coll. 2003). De ce fait, le porc offre de nombreux avantages. Il représente une espèce évolutionnaire assez distincte des primates et des
34 rongeurs pour augmenter la compréhension de la complexité génétique par rapport aux maladies et à la diversité génotypique (Vodicka et coll. 2005). De plus, le porc offre l’avantage d’un temps de gestation relativement court, d’une maturité sexuelle assez rapide et d’une production de portées importantes comparativement à d’autres mammifères supérieurs en taille, tels que le bovin et les primates (Prather et coll. 2003).
Les porcs et les porcs miniatures jouent déjà un rôle significatif comme modèle animal dans les champs de recherche en physiologie, pharmacologie, toxicologie, radiologie, chirurgie et transplantation d’organes, traumatologie, pathologie, embryologie, gastroentérologie et pédiatrie (Rand 2002). Au cours des dernières années, le modèle porcin a gagné massivement en importance dans les secteurs suivants de la recherche biomédicale : (a) la physiologie de la reproduction; (b) la génération d’organes compétents pour la xénotransplantation; (c) la physiologie de la peau et le traitement des problèmes de peau; et (d) la neurotransplantation (Prather et coll. 2003; Vodicka et coll. 2005).
Les organes des systèmes reproducteurs du verrat et de la truie ont été utilisés pour le développement de techniques microchirurgicales pour les désordres du tractus génito-urinaire humain (Rand 2002). De plus, les ovaires et ovocytes provenant de cochettes ou de jeunes truies pubères peuvent facilement être comparés avec la morphologie et la biochimie de ceux provenant de truies plus âgées, permettant ainsi d’utiliser le modèle porcin pour étudier les pathologies de plus en plus fréquentes associées avec la maternité tardive chez l’humain (Vodicka et coll. 2005). Les ovocytes porcins ressemblent beaucoup à ceux des humains, considérant leur morphologie et la durée de leur maturation méiotique. En effet, les ovocytes porcins et humains requièrent environ 20 heures pour reprendre leur méiose et arrivent à la métaphase II après 40 heures, comparativement à la souris chez qui la méiose reprend après 2 à 5 heures et la métaphase est aperçue après 7 à 8 heures (Vodicka et coll. 2005).
La source abondante, accessible et relativement peu coûteuse d’ovaires et d’ovocytes provenant de cochettes (par les abattoirs locaux) permet d’effectuer des recherches intensives dans le secteur de la recherche fondamentale de l’ovocyte et celui de la toxicologie de la reproduction des polluants environnementaux et des perturbateurs endocriniens.