HAL Id: dumas-01785854
https://dumas.ccsd.cnrs.fr/dumas-01785854
Submitted on 4 May 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Étude de 26 cas d’allo-immunisations et d’hémolyses
post-transfusionnelles survenus chez les enfants
drépanocytaires suivis à l’Unité Transversale de la
Drépanocytose
Edima Augusty
To cite this version:
Edima Augusty. Étude de 26 cas d’allo-immunisations et d’hémolyses post-transfusionnelles survenus chez les enfants drépanocytaires suivis à l’Unité Transversale de la Drépanocytose. Médecine humaine et pathologie. 2017. �dumas-01785854�
UNIVERSITE DES ANTILLES 2017 FACULTE DE MEDECINE HYACINTHE BASTARAUD N° 2017ANTI0199
TITRE DE LA THESE
Etude de 26 cas d’allo-immunisations et d’hémolyses post-transfusionnelles
survenus chez les enfants drépanocytaires suivis à l’Unité Transversale de la
Drépanocytose.
THESE
Présentée et soutenue publiquement à la Faculté de Médecine Hyacinthe BASTARAUD des Antilles
Et examinée par les Enseignants de la dite Faculté
Le
29 Septembre 2017
Pour obtenir le grade de
DOCTEUR EN MEDECINE
Par
AUGUSTY EDIMA
Examinateurs de la thèse :
M JANKY EUSTASE Professeur - Président du jury
M NACHER MATHIEU Professeur
M UZEL MAX Professeur
2
REMERCIEMENTS
Je remercie le Docteur ETIENNE-JULAN Maryse, chef de service de l’Unité Transversale de la Drépanocytose (UTD), pour m’avoir permis de réaliser un stage au sein de son service, ainsi que les Docteurs Lydia DIVIALLE-DOUMDO et Marie PETRAS, médecins référents du secteur pédiatrique de l’UTD, pour leurs encadrements tout au long de cette formation.
Je remercie madame ARJOUNIN Jeanne, responsable de la bibliothèque hospitalière universitaire, pour la mise à disposition des articles scientifiques, les Docteurs Isabelle NOYON et Paul BROUSSE de la cellule d’hémovigilance pour la transmission des fiches d’évènements indésirables, le Docteur Anne-Lise MARACHET du laboratoire d’immuno-hématologie de l’EFS de Guadeloupe-Guyane pour la transmission des fiches transfusionnelles, madame TARER Vanessa, attaché de recherche clinique pour l’aide à l’analyse statistique.
Je remercie le Professeur JANKY Eustase, pour avoir accepté d’être le président du jury. Veuillez trouver ici l’expression de ma profonde reconnaissance pour m’avoir permis de soutenir ce travail et pour la disponibilité que vous avez montré.
Au Professeur HELENE-PELAGE Jeannie, veuillez trouver ici l’expression de ma reconnaissance pour la lecture et la correction de ce travail.
Au Professeur DUFLO Suzy, veuillez trouver ici l’expression de ma reconnaissance pour avoir accepté d’être membre de ce jury de thèse.
Au Professeur NACHER Mathieu, veuillez trouver ici l’expression de ma reconnaissance pour avoir accepté d’être membre de ce jury de thèse.
Au Professeur UZEL Max, veuillez trouver ici l’expression de ma reconnaissance pour avoir accepté d’être membre de ce jury de thèse.
Au Docteur DOUMDO-DIVIALLE Lydia, veuillez trouver ici l’expression de ma reconnaissance pour avoir dirigé ce travail et pour la disponibilité que vous avez montré.
TABLE DES MATIERES
REMERCIEMENTS ...2
RESUME ...5
ABSTRACT...6
LISTE DES ABREVIATIONS ...7
I - GENERALITES ...8
Epidémiologie ...8
Enjeu médical ...8
Contexte transfusionnel dans la drépanocytose ...9
L’allo-immunisation ...12
L’hémolyse post-transfusionnelle ...13
Règles de transfusion chez le drépanocytaire ...15
Encadrement du geste transfusionnel chez le drépanocytaire ...16
Indications du geste transfusionnel chez le drépanocytaire ...16
II - ETUDE ...19 1. INTRODUCTION ...19 2. PATIENTS ET METHODES ...19 2.1 PATIENTS ...19 2.2 METHODES ...19 Critères d’inclusion ...19
Recueil des données ...20
Traitement et analyse des données ...20
3. RESULTATS ...21
3.1 LES ALLO-IMMUNISATIONS ...21
Caractéristiques du patient ...21
Caractéristiques des épisodes d’allo-immunisation ...21
Complications ayant justifié l’acte transfusionnel ...21
Historique transfusionnel ...22
Caractéristiques immunohématologiques ...23
Nombre d’épisodes d’allo-immunisations par patient Nombre de culots globulaires reçus Concordance des phénotypes érythrocytaires Caractéristiques des expositions antigéniques Production d’anticorps 3.2 LES HEMOLYSES POST-TRANSFUSIONNELLES ...28
Caractéristiques du patient ...28
Complications ayant justifié l’acte transfusionnel ...29
Historique transfusionnel ...29
Caractéristiques immunohématologiques ...30
Nombre d’épisodes d’hémolyses par patient Nombre de culots globulaires reçus Concordance des phénotypes érythrocytaires Caractéristiques des expositions antigéniques Production d’anticorps 4. DISCUSSION ...34
4
ANNEXES. ...43
Tableau 1. Caractéristiques des patients et allo-immunisations Tableau 2. Caractéristiques des patients et hémolyses post-transfusionnelles Figure 1. Transfusion simple Figure 2. Echange érythrocytaire sur séparateur de cellules REFERENCES ...47
SERMENT D’HIPPOCRATE ...50
IMPRIMATUR ...51
TABLE DES TABLEAUX
I - GENERALITES ...12Tableau 1. Différences inter-ethniques d’expression des antigènes ...12
II - ETUDE ...23
Tableau 1. Description des patients ayant développé une allo-immunisation ...23
Tableau 2. Caractéristiques des allo-immunisations par patient ...26
Tableau 3. Caractéristiques des patients ayant développé une hémolyse post-transfusionnelle ...29
Tableau 4. Présentation des marqueurs biologiques des patients avant la transfusion source de l’hémolyse post-transfusionnelle ...30
Tableau 5. Caractéristiques des hémolyses post-transfusionnelles par patient ...32
TABLE DES FIGURES
Figure 1. Répartition des indications ayant justifié l’acte transfusionnel ...22Figure 2. Répartition du nombre d’épisodes d’allo-immunisations par patient ...24
Figure 3. Caractéristiques des expositions antigéniques au sein des allo-immunisations ...25
Figure 4. Représentation des anticorps produits après la transfusion ...26
Figure 5. Répartition des allo-immunisations étudiées ...28
Figure 6. Caractéristiques des expositions antigéniques au sein des hémolyses post-transfusionnelles ...31
RESUME
CONTEXTE – Développer une allo-immunisation ou une hémolyse post-transfusionnelle à la suite d’une transfusion restreint les possibilités de trouver ultérieurement des culots globulaires compatibles. Les chances de guérisons et de survie des patients s’en trouvent diminuées. En effet, la transfusion est un élément majeur pour la prise en charge des complications de la drépanocytose ; le recours à cette thérapeutique est fréquent et elle constitue l’ultime rempart en cas de pronostic vital engagé.
OBJET – Le but de cette étude a été de décrire les accidents transfusionnels immunologiques survenus chez des patients de notre cohorte et d’identifier leurs facteurs de risques.
MATERIEL ET METHODES – Les données immuno-hématologiques de 18 patients drépanocytaires en âge pédiatrique, signalés par les professionnels de santé comme posant problème pour la prise en charge transfusionnelle ultérieure, et les caractéristiques des culots globulaires rouges qui leur ont été délivrés ont été recueillies à partir des dossiers médicaux et des fiches transfusionnelles de chaque patient puis comparées. RESULTAT – 26 accidents transfusionnels dont 16 allo-immunisations et 10 hé-molyses post-transfusionnelles, survenus chez 18 enfants drépanocytaires suivis à l’Unité Transversale de la Drépanocytose, sur la période de septembre 1996 à juin 2016 ont été analysés.
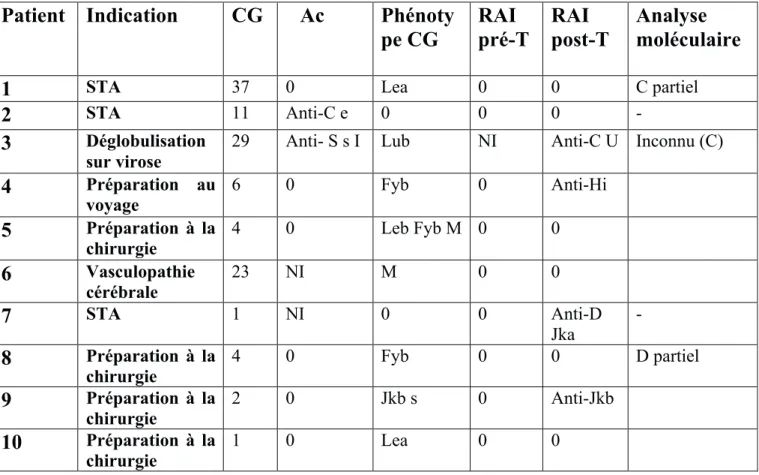
L’analyse des phénotypes étendus des culots globulaires et celui du patient ont montré que les antigènes présents à la surface des globules rouges ont été différents entre le patient et le donneur. On retrouve une exposition antigénique dans 10/16 cas d’allo-immunisations. Parmi ces 10 cas, 7 des antigènes identifiés faisaient partie des systèmes Duffy, Kidd, MNS et 3 du système RH. 4 des cas ont développé l’anti-corps contre l’antigène auquel ils ont été exposés (anti-C, anti-Fya, anti-U), dans 1 cas on a retrouvé une exposition prédisposante dans l’historique transfusionnel (anti-FY3); dans 2 autres cas les anticorps retrouvés ont été liés à l’existence de variants antigéniques.
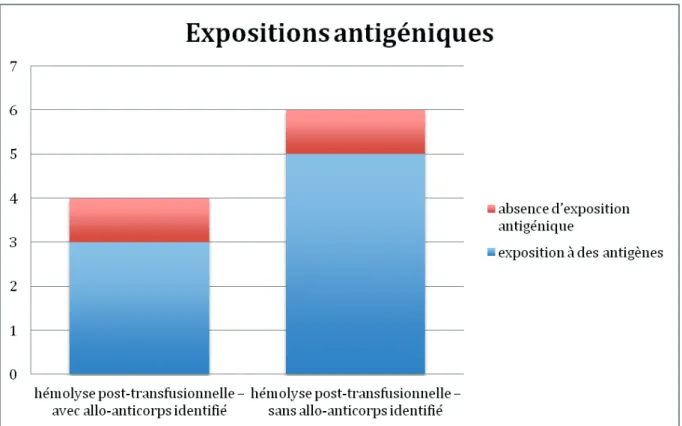
Dans 8/10 des cas d’hémolyses post-transfusionnelles nous avons retrouvé une exposition antigénique. Parmi ces 8 cas, 2 des antigènes identifiés faisaient partie du système Duffy, 1 du système Kidd, 2 du système MNS, 2 du système LE, 1 du système LU et dans1 cas le patient avait été exposé à une association d’antigènes appartenant aux systèmes Duffy, MNS et LE. Sur ces 8 cas, 4 cas ont développé un anticorps. 1 des cas a développé l’anticorps contre l’antigène auquel il a été exposé (anti-Jkb), dans 1 cas on a retrouvé une exposition prédisposante dans l’historique transfusionnel (an-ti-U).
CONCLUSION – Des expositions à des antigènes et l’existence de variants antigéniques ont été retrouvées chez la plupart des enfants ayant présenté un accident transfusionnel. La concordance des phénotypes érythrocytaires des culots globulaires rouges avec ceux des patients est un aspect important de la prévention de l’allo-immunisation. L’identification des variants aide également à la diminution de ce risque. Le manque de donneurs locaux, oblige les banques de sang à avoir recours à des culots globulaires issus de la métropole ce qui expose ces patients au polymorphisme génétique des groupes sanguins. Ainsi la promotion du don du sang dans notre région est une piste pour permettre la diminution des accidents transfusionnels.
6
ABSTRACT
CONTEXT - Developing post-transfusion alloimmunization or haemolysis following transfusion restricts the possibilities of later finding compatible globular pellets. The chances of cure and survival of patients are reduced. In fact, transfusion is a major factor in the management of complications of sickle cell anemia. The use of this therapy is frequent and it constitutes the ultimate bulwark in case of a prognosis committed. OBJECTIVE - The purpose of this study was to describe the immunological transfusional accidents in patients in our cohort and to identify their risk factors.
MATERIAL AND METHODS - Immuno-hematologic data from 18 pediatric sickle cell patients, reported by healthcare professionals as problematic for subsequent transfusion management, and the characteristics of red blood cell pellets issued to them were collected at from the medical records and transfusion records of each patient and then compared.
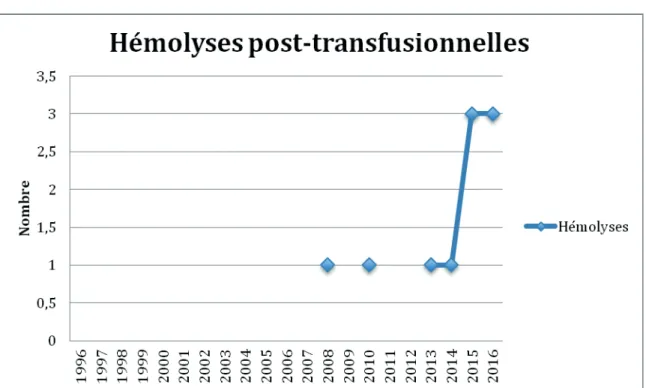
RESULTS - 26 transfusion accidents, including 16 alloimmunizations and 10 post-transfusion haemolysis, occurred in 18 sickle-cell children followed at the Transversal Sickle Cell Disease Unit during the period September 1996 to June 2016.
The analysis of the extensive phenotypes of the globular pellets and that of the patient showed that the antigens present on the surface of the red blood cells were different between the patient and the donor. Antigenic exposure was found in 10/16 cases of alloimmunization. Of these 10 cases, 7 of the identified antigens were included in the Duffy, Kidd, MNS and 3 systems of the RH system. 4 of the cases developed the antibody against the antigen to which they were exposed (anti-C, anti-Fya, anti-U), in 1 case predisposing exposure in the transfusion history (anti-FY3). In 2 other cases the antibodies found were linked to the existence of antigenic variants.
In 8/10 of cases of post-transfusion haemolysis we found antigenic exposure. Of these 8 cases, 2 of the identified antigens were included in the Duffy system, 1 in the Kidd system, 2 in the MNS system, 2 in the LE system, 1 in the LU system, and in 1 cases the patient was exposed to a combination of antigens belonging to Duffy, MNS and LE systems. Of these 8 cases, 4 cases developed an antibody. 1 of the cases developed the antibody against the antigen to which it was exposed (anti-Jkb), in 1 case predisposing exposure was found in the transfusion history (anti-U).
CONCLUSION - Exposures to antigens and the presence of antigenic variants have been found in most children with a transfusion event. The concordance of erythrocytic phenotypes of red blood cells with those of patients is an important aspect of prevention of alloimmunization. The identification of variants also helps to reduce this risk. The lack of local donors forces the blood banks to use globular pellets from the metropolis, exposing these patients to the genetic polymorphism of blood groups. Thus, the promotion of blood donation in our region is a way to reduce transfusion accidents.
KEY WORDS: Sickle cell anemia; Transfusion; Erythrocyte phenotype; Alloimmunization; Post-transfusion haemolysis; Transfusion safety
LISTE DES ABREVIATIONS
AVC Accident vasculaire cérébral CGR Concentré de Globules Rouges CVO Crise vaso-occlusive
Duffy Antigènes du système Duffy ETP Echange transfusionnel partiel FY Antigènes du système Duffy
GR Globule Rouge
HB Hémoglobine
HbS Hémoglobine S
HTAP Hypertension artérielle pulmonaire
HPLC Chromatographie en phase liquide haute performance
Ht Hématocrite
HTAP Hypertension artérielle pulmonaire IRM Imagerie par résonance magnétique JK Antigènes du système Kidd
KELL Antigènes du système KELL Kidd Antigènes du système Kidd LE Antigènes du système Lewis MNS Antigènes du système MNS
NO Monoxyde d’azote
ONTF Ostéonécrose de la tête fémorale
P Antigènes du système P
RAI Recherche d’Agglutinines Irrégulières
RH Rhésus
SDM Syndrome drépanocytaire majeur SSA Séquestration splénique aiguë STA Syndrome thoracique aigu
UTD Unité Transversale de la Drépanocytose
-8
I- GENERALITES
1. EPIDEMIOLOGIE
La drépanocytose est la maladie génétique la plus fréquente en France [1]. Près de 6000 patients et 330 nouveau-nés par an sont atteints de cette maladie. C’est environ 1/ 720 nouveau-nés qui est drépanocytaire.
466 syndromes drépanocytaires majeurs (SDM) ont été repérés en 2015 sur les 335 360 naissances de nouveau-nés (295 951 nés en métropole et 39 409 nés en Outre-Mer). En Guadeloupe, sur l’année 2015, 22 SDM ont été identifiés sur 5805 nouveau-nés testés, c’est 1/264 nouveau-nés testés.
De 1985 à 2014 sur 199 363 nouveau-nés dépistés, on compte 691 patients atteints de drépanocytose [2].
Cette prévalence est liée à la composition de la population, majoritairement d’origine africaine, suivi des populations de l’Inde, du Moyen-Orient et de l’Europe.
2. ENJEU MEDICAL
Le geste transfusionnel est réservé à la prise en charge des complications de la drépanocytose, il est aussi le dernier rempart lorsque le pronostic vital des patients est engagé.
Pour les patients évoluant sur un mode dit sévère les transfusions sont souvent récurrentes.
On conçoit alors qu’il ne faut pas risquer que le patient drépanocytaire se retrouve en situation d’impasse transfusionnelle, à la suite d’une allo-immunisation ou d’une hémolyse post-transfusionnelle.
Lorsque le patient développe une allo-immunisation complexe ou une hémolyse post-transfusionnelle, les indications transfusionnelles seront restreintes aux situations mettant en jeu le pronostic vital. Dans ces situations, la transfusion devra être encadrée par un protocole d’immuno suppression destiné à tenter d’éviter un nouvel accident transfusionnel chez le patient. Toute nouvelle transfusion lui étant potentiellement fatale.
Dans la drépanocytose les donneurs sont majoritairement européens et les receveurs afro- antillais, les différences d’antigènes exprimés par ces deux populations [3], peuvent engendrer la production par le receveur d’anticorps dirigés contre les antigènes exprimés sur les globules rouges des donneurs et expliquent l’importance du taux des allo-immunisations et de l’hémolyse post-transfusionnelle chez les patients drépanocytaires par rapport à d’autres maladies hématologiques [4].
En effet, les antigènes qui sont présents ou absents à la surface du globule rouge, sont fonction des individus, mais aussi de leur origine géographique. On parle de polymorphisme des antigènes des groupes sanguins [5].
3. CONTEXTE TRANSFUSIONNEL DANS LA DREPANOCYTOSE
Les sujets d’origine afro-antillaise présentent un certain nombre de particularités immunohématologiques par rapport à la population de référence, celle des donneurs, qui est européenne.
Ces particularités se retrouvent à 3 niveaux. Au niveau des antigènes courants avec des fréquences d’expression différentes notamment pour les antigènes des systèmes Rhésus (RH), Duffy (FY), Kidd (JK) et MNS; au niveau des phénotypes rares caractérisés par l’absence d’un antigène de fréquence élevée dans les systèmes RH, KEL, FY et MNS ; au niveau des antigènes de basse fréquence dans les systèmes RH et KEL [6]. Les fréquences des groupes ABO varient peu en fonction des populations; cependant, le groupe B est plus fréquent chez les Afro-Antillais que chez les Caucasiens. Les différences sont plus marquées pour d’autres groupes, tels les groupes RH, FY, JK et MNS.
Ainsi, pour le groupe RH, on décrit 5 antigènes principaux qui peuvent ou non être exprimés à la surface du globule rouge: l’antigène D ou Ag RH1 (communément appelé facteur Rhésus), les antigènes C, E, c et e. La fréquence de l’expression de l’antigène D est de 85% dans la population européenne, et un peu plus élevée dans les populations afro-antillaises.
Certains antigènes sont moins fréquents chez les populations afro-antillaises [7]. Les différences majeures concernent surtout les antigènes C et E, fréquemment exprimés dans la population européenne et peu exprimés chez les populations Africaines et Antillaises. Ainsi le groupe (ou phénotype) RH commun dans la population eu-ropéenne est D+C+E-c+e+ et D+C-E-c+e+ dans la population sub-saharienne. Ce dernier phénotype est ainsi présent chez 50 à 75% des individus d’origine afro-antillaise, alors que sa fréquence est de moins de 2% chez les individus d’origine européenne [6]. Ainsi si l’on transfuse à un patient drépanocytaire du sang de donneur européen, il y a de fortes chances qu’on lui apporte l’antigène C. Le patient pourra réagir en produisant des anticorps vis-à-vis de cet antigène, appelés anti-C. Ces anti-C, par des mécanismes divers, peuvent aller jusqu’à détruire les globules rouges transfusés en se fixant sur l’antigène C du globule rouge du donneur, on parle d’hémolyse.
Au-delà du système RH, on retrouve les groupes sanguin DUFFY, KIDD et MNS, pour lesquels les antigènes Fya, Jkb et S sont fréquemment exprimés par les donneurs d’origine européenne et peu fréquemment exprimés par les patients d’origine afro-antillaise, d’où la fréquence des anticorps correspondants chez les patients et des hémolyses post-transfusionnelles associées.
Pour exemple, l’antigène MNS3 (S) du système MNS est absent chez plus de 70 % des sujets noirs d’origine africaine et antillaise alors qu’on le retrouve chez plus de 55 % des sujets caucasiens ; l’antigène FY1 (Fya) du système FY est absent chez 90 % des sujets noirs et présent chez plus de 60 % des sujets caucasiens ; l’antigène JK2 (Jkb)
10 du système JK est absent chez plus de 50 % des sujets noirs et présent chez plus de 75 % des sujets caucasiens [8].
Ainsi, un patient afro-antillais immunisé vis-à-vis d’un certain nombre d’antigènes courants pourra se retrouver rapidement dans une situation où les unités disponibles deviennent de plus en plus rares. À titre d’exemple, dans la population caucasienne, la fréquence du sang de phénotype FY : –1 ; JK : –2, MNS : –3 (Fya–, Jkb–, S–) nécessaire pour un sujet immunisé vis-à-vis des antigènes FY1, JK2 et MNS3 n’est que de 4 %. Le deuxième niveau de particularités immunohématologiques des populations afro-antillaises est représenté par les antigènes de fréquence élevée.
L’absence d’expression d’un antigène de fréquence élevée correspond aux groupes rares.
Un certain nombre de phénotypes rares ne se rencontrent que dans les populations afro-antillaises. On les décrit essentiellement dans les systèmes RH, KEL, FY et MNS. Le plus connu est le phénotype FY : –1, –2 (Fy (a– b–)). Il constitue un phénotype rare par rapport à la population de référence des donneurs en France métropolitaine; 65 % des sujets noirs sont FY :-1,-2 [Fy (a-b-)], mais ils ne s’immunisent que très rarement dans le système FY.
Le second phénotype rare rencontré est le phénotype MNS : –3, –4, –5 (S–, s–, U–). La dangerosité de l’anticorps anti-MNS5 [9] est bien établie.
Trois spécificités rares du système RH sont retrouvées : RH : 32, –46 (phénotype RN ; origine peule); RH : –18 (origine bantoue); RH : –34. Il faut ajouter à ces 3 phéno-types, l’existence d’antigènes RH5 (e) partiels dont l’expression à l’état homozygote peut induire une situation d’impasse transfusionnelle. L’exposition à des hématies de phénotype RH courant via la transfusion peut induire respectivement la production des anticorps anti-RH46, anti-RH18, anti-RH34 et anti-RH5. Dans tous les cas, ces anticorps sont potentiellement dangereux et nécessitent le recours à des unités de sang de phénotype rare équivalent. Certains de ces phénotypes peuvent être dépistés avant immunisation car ils sont associés à des affaiblissements des antigènes RH2 et/ou RH5. C’est le cas des phénotypes RH : –46 et RH5 partiels. Les altérations de réactivité sont beaucoup moins évidentes pour les phénotypes RH : –18 et RH : –34 dont la découverte est toujours liée à la présence de l’anticorps correspondant.
Le troisième niveau de particularités immuno-hématologiques des populations afro-antillaises est représenté par les antigènes érythrocytaires de faible fréquence ou antigènes « privés ». Un certain nombre d’antigènes sont considérés comme « privés » dans la population de référence des donneurs en France métropolitaine alors qu’ils sont en fait fortement répandus dans la population afro-antillaise. C’est le cas de l’antigène RH20 ou VS produit par un allèle RHce portant une mutation au niveau de l’exon 5 [10]. L’antigène VS est retrouvé chez plus de 30 % des sujets noirs et est quasi inexistant dans la population caucasienne. De la même manière, l’antigène KEL6 (Jsa) est retrouvé chez près de 20 % des sujets noirs. Enfin, il faut citer un certain nombre
d’antigènes de basse fréquence associés à des variants D partiels caractéristiques des sujets noirs (RH23, RH30). Ceux-ci sont cependant rares puisqu’ils suivent la fréquence des D partiels correspondants. Ces antigènes « privés » ne posent en règle pas de problèmes particuliers dans un contexte transfusionnel classique. En revanche, ils doivent être pris en compte lorsque la transfusion nécessite du sang de phénotype érythrocytaire rare. En effet, en raison du faible nombre de donneurs pour la même spécificité rare (MNS : –3, –4, –5), les unités transfusées proviennent souvent des mêmes donneurs. L’exposition répétée aux mêmes marqueurs antigéniques (RH20, KEL6) peut aboutir à une immunisation et à terme à une impasse transfusionnelle. De même que l’on tient compte des antigènes courants, il est donc nécessaire de tenir compte des marqueurs antigéniques spécifiques des populations afro-antillaises lors de la transfusion intra-ethnique et recourir à la BNSPR (Banque nationale de sang de phénotype rare). Un programme de détermination de ces marqueurs au CNRGS (Centre national de référence pour les groupes sanguins) est d’ailleurs en cours pour tous les donneurs et receveurs afro antillais répertoriés dans le fichier national de phénotypes érythrocytaires rares.
Un dernier élément est à évoquer concernant les particularités immunohématologiques des sujets afro-antillais, c’est l’existence d’antigènes variants partiels ou affaiblis et d’auto-anticorps.
On retrouve le polymorphisme moléculaire du phénotype RH : –1 (D négatif). Celui-ci prend toute son importance dans la mise en place des techniques de génotypage qui à ce jour sont essentiellement réalisées dans le cadre de la maladie hémolytique du nouveau-né. Chez les sujets caucasiens, le phénotype RH : –1 est essentiellement lié à la délétion du gène RHD [11]. En revanche, dans les populations afro-antillaises, 2 gènes RHD silencieux sont retrouvés avec une fréquence non négligeable : le pseudogène RHDw [12] et le gène hybride RHD-CE-D associé à l’haplotype (C)ce et produisant un antigène RH2 (C) affaibli [13]. Le génotypage RhD étant fondé sur la présence de séquences géniques spécifiques du gène RHD, il en résulte des faux positifs lorsque ces gènes silencieux sont présents. Une stratégie de génotypage tenant compte de ces gènes doit donc être établie chez les sujets d’origine afro-antillaise.
Les patients porteurs d’un antigène C+ partiel, éventualité fréquente dans cette population, peuvent produire un anti-C dirigé contre les épitopes non exprimés, s’ils reçoivent des CGR C+ de donneurs caucasiens [14]. Sachant que la production d’auto-anticorps est fréquente dans la population drépanocytaire [15] un anti-C associé à un C partiel peut être considéré à tort comme un auto-anticorps et non pris en compte au niveau de la sélection des culots de globules rouges. De la même manière, des anti-D, anti-e, anti-RH18 ou anti-RH34 peuvent être facilement confondus avec des auto-anticorps chez des patients drépanocytaires fréquemment auto-immunisés [16,17]. Le risque d’accidents hémolytiques post-transfusionnels augmente donc, si ces antigènes partiels ne sont pas identifiés et respectés.
Les individus qui possèdent des antigènes RH partiels devraient recevoir des culots de globules rouges négatifs à l’antigène RH.
12 Tableau 1. Différences inter-ethniques d’expression des antigènes
4. L’ALLO-IMMUNISATION
Les différences antigéniques entre les globules rouges du donneur et du re-ceveur sont nécessaires pour le déclenchement initial de l’allo-immunisation. Des anticorps produits par le receveur sont dirigés contre des antigènes présents sur des globules rouges transfusés.
Toutefois tous les patients ne développent pas d’anticorps après l’exposition à des globules rouges transfusés [18].
Des facteurs de risque spécifiques à la drépanocytose sont associés à l’allo-immunisation autres que le polymorphisme des antigènes des groupes sanguins tel que le nombre cumulé de culots globulaires reçus [18,19] le contexte inflammatoire du patient au moment de la transfusion [20-25]. L’âge du début de la prise en charge transfusionnelle semble influer sur l’allo-immunisation.
L’allo-immunisation érythrocytaire implique des étapes multiples comprenant la reconnaissance de l’antigène présent sur le globule rouge du donneur, le traitement et la présentation de l’antigène par le complexe HLA de classe II au récepteur des cellules T (TCR), l’activation des lymphocytes T auxiliaires CD4, l’interaction des lymphocytes T et B et enfin la différenciation des cellules B dans les plasmocytes. Des facteurs individuels influençant cette immunisation ont été retrouvés, tels que les différences du génotype HLA de classe II prédisposant à différents types de réponses à un antigène [26], des modifications de l’activité des lymphocytes T régulateurs sont
12
Tableau 1. Différences inter-ethniques d’expression des antigènes
4. L’ALLO-IMMUNISATION
Les différences antigéniques entre les globules rouges du donneur et du receveur sont
nécessaires pour le déclenchement initial de l'allo-immunisation. Des anticorps produits par le
receveur sont dirigés contre des antigènes présents sur des globules rouges transfusés.
Toutefois tous les patients ne développent pas d'anticorps après l'exposition à des globules
rouges transfusés [18].
Des facteurs de risque spécifiques à la drépanocytose sont associés à l'allo-immunisation
autres que le polymorphisme des antigènes des groupes sanguins tel que le nombre cumulé de
culots globulaires reçus [18,19] le contexte inflammatoire du patient au moment de la
transfusion [20-25]. L’âge du début de la prise en charge transfusionnelle semble influer sur
l’allo-immunisation.
L'allo-immunisation érythrocytaire implique des étapes multiples comprenant la
reconnaissance de l'antigène présent sur le globule rouge du donneur, le traitement et la
présentation de l'antigène par le complexe HLA de classe II au récepteur des cellules T
(TCR), l'activation des lymphocytes T auxiliaires CD4, l'interaction des lymphocytes T et B et
enfin la différenciation des cellules B dans les plasmocytes.
Des facteurs individuels influençant cette immunisation ont été retrouvés, tels que les
différences du génotype HLA de classe II prédisposant à différents types de réponses à un
antigène [26], des modifications de l’activité des lymphocytes T régulateurs sont décrites chez
des patients drépanocytaires [25,27] ainsi que le
polymorphisme dans le gène TRIM 21
immunorégulateur [28].
Fréquence Caucasienne
Fréquence Africaine
DCe/dce
35 %
21 %
Dce/DCe
18.5 %
2%
Dce/dce
2%
46 %
Dce/Dce
13 %
4%
dce/dce
15 %
7%
Fya -
34 %
90 %
Jkb -
26 %
50 %
S-
45 %
70 %
décrites chez des patients drépanocytaires [25,27] ainsi que le polymorphisme dans le gène TRIM 21 immunorégulateur [28].
On retrouve également la présence d’auto-anticorps dont le mécanisme d’apparition pourrait se rapprocher de celui de l’anémie hémolytique auto-immune avec une dysrégulation de l’activité immunitaire lors de l’allo-immunisation [4].
5. L’HEMOLYSE POST-TRANSFUSIONNELLE
L’hémolyse post-transfusionnelle du drépanocytaire est un accident sévère mettant en jeu le pronostic vital du patient. Les décès surviendraient dans 6 à 10 % des cas [4,29].
C’est le plus grave des risques immunologiques liés à la transfusion.
La survenue d’une hémolyse retardée complique l’avenir transfusionnel du patient. L’hémolyse transfusionnelle se manifeste par la destruction des globules rouges du donneur mais aussi de ceux du receveur, conduisant à une hyper hémolyse [4].
Elle associe une anémie extrêmement profonde, aggravée par la présence quasi constante d’une réticulopénie. L’hémolyse retardée post-transfusionnelle se manifeste le plus souvent à distance d’une transfusion (5 à 15 jours) par des douleurs diffuses ou localisées prenant l’allure d’une crise vaso-occlusive associée à une hémoglobinurie. La physiopathologie de l’hémolyse reste incertaine.
La première hypothèse est celle d’un conflit antigène-anticorps entre les antigènes des globules rouges transfusés et les anticorps des receveurs. Lorsque l’hémolyse post-transfusionnelle est immédiate, une erreur dans le système ABO ou la présence d’un anticorps non détecté par la RAI pré-transfusionnelle est souvent mise en cause. Lorsque l’hémolyse post-transfusionnelle est retardée la re-stimulation d’un anticorps devenu indétectable est souvent mise en cause [4].
Les hémolyses retardées sur conflit antigène-anticorps représenteraient 70 % des cas. Dans environ 30 % des hémolyses retardées, aucun anticorps susceptible d’ex-pliquer l’hémolyse n’est mis en évidence [4]
L’existence d’hémolyses post-transfusionnelles sans anticorps détectables ou la destruction des globules rouges autologues (hyperhémolyse) a fait formuler d’autres hypothèses à ce phénomène, tel que le mécanisme inflammatoire.
Dans la drépanocytose la lyse des globules rouges du patient entrainent la libération d’hème libre, de stromas et une diminution de la disponibilité du NO ce qui libère des facteurs plasmiques pro-inflammatoires tels que les cytokines (cytokines C3a et C5a) [30].
Cet environnement inflammatoire peut avoir un impact sur les globules rouges du receveur. Les globules rouges du receveur ont une membrane qui est fragilisée par la falciformation, ils vont exprimer à leurs surfaces la phosphatidylsérine (PS) qui est un marqueur d’apoptose. L’expression de la phosphatidyl sérine augmente
14 l’adhérence des globules rouges aux cellules endothéliales, favorise la phagocytose par les macrophages et contribue à la fixation non spécifique des fractions activées du complément (C5b-C9) [31].
Des études sur modèle murin ont montré qu’en situation inflammatoire les souris produisaient plus souvent des anticorps et à des taux élevés.
Par ailleurs, l’environnement oxydatif, résultant de la physiopathologie de la drépanocytose, peut entrainer une suractivation des cellules effectrices comme les macrophages qui vont médier la pathogénicité des antigènes présents sur la membrane des globules rouges du donneur.
Autre mécanisme décrit, celui de la destruction prématurée des globules rouges du donneur. La destruction des globules rouges du donneur par les macrophages ne peut se produire que si les membranes des globules rouges sont altérées. Les facteurs plasmatiques qui causent ces changements sont inconnus, mais on peut supposer que l’environnement oxydatif chez les receveurs pourrait endommager les globules rouges sains des donneurs.
La phosphatidyl sérine (PS) marqueur d’apoptose s’externalise sur la membrane globulaire quand le globule rouge vieillit ; elle possède un récepteur sur les macrophages. Plusieurs études ont montré que l’expression de la phosphatidyl sérine est augmen-tée après incubation de globules rouges de donneurs sains dans le sérum de patients drépanocytaires au cours d’une complication aiguë ; cette surexposition conduit à l’élimination prématurée des globules rouges par les macrophages [31,32].
L’environnement oxydatif peut interférer avec le mécanisme responsable de l’expression de la phosphatidyl sérine sur la membrane des globules rouges provenant de donneurs sains.
De plus, les globules rouges des donneurs sont exposés au risque d’endommagement de leurs membranes par oxydation, dès qu’ils sont stockés sous poche.
Autre mécanisme cité, celui de la régulation défectueuse de la formation du complexe d’attaque de la membrane du complément [33]. La fixation du complément sur les macrophages, via les récepteurs FcγR* 7 a lieu grâce à la participation du complexe d’attaque membranaire (CAM), ce qui facilite la phagocytose des globules rouges sensibilisés [31].
Ces globules rouges sensibilisés, expriment à leur surface des immunoglobulines (Ig) ce qui permet la fixation du complément puis l’activation de la cascade du complément. La fixation et l’activation du complément sont fonction des IgG1, IgG3, IgM. Plus le nombre de sites antigéniques est élevé plus le risque d’hémolyse est important et grave [34]. Les globules rouges qui exposent les antigènes et présentent un niveau élevé d’IgG superficielles peuvent être plus sensibles à l’hémolyse [34].
D’autres auteurs suggèrent un mécanisme de «bystander hemolysis » décrivant le phénomène au cours duquel on observe une hémolyse des cellules pourtant négatives vis-à-vis de l’antigène contre lequel l’anticorps est dirigé [35]. Des anticorps dirigés contre des antigènes autres que des antigènes érythrocytaires (HLA, protéines plasmatiques) seraient impliqués, provoquant l’activation du complément et menant à l’hémolyse des globules rouges autologues par phénomène d’entraînement.
6. REGLES DE TRANSFUSION CHEZ LE DREPANOCYTAIRE
Les risques liés à la transfusion sont les mêmes que pour la population générale. On retrouve le risque viral, le risque de surcharge martiale et le risque immunologique. Mais leurs fréquences sont différentes. Le risque immunologique est plus fréquent chez la population drépanocytaire [36].
Dès que le diagnostic de drépanocytose est posé, un bilan est réalisé avant toute situation de transfusion. Ce bilan comprend la détermination des groupes sanguins ABO Rhésus Kell, la recherche d’agglutinines irrégulières (RAI) pré transfusionnelles réglementaires comme pour la population générale, auquel on ajoute la réalisation du phénotypage étendu aux systèmes les plus couramment impliqués dans l’immunisation (système Duffy, Kidd, MNS) afin de tenir compte des antigènes communs immunogènes de ces systèmes.
La détermination du phénotype par biologie moléculaire (génotypage) permet de mettre en évidence des variants d’expression, essentiellement au niveau du système RH, qui peuvent avoir un impact sur l’allo-immunisation.
Le type de produits sanguins prescrits dépend de la RAI. En France, pour les patients non immunisés (RAI négatives le jour de la transfusion et dans l’historique), les concentrés érythrocytaires délivrés sont phénotypés Rhésus (D, C, E, c, e) et Kell, et compatibilisés au laboratoire.
Les épreuves de compatibilité réalisées au laboratoire permettent de ne pas méconnaître un anticorps anti-privé (les anticorps contre les antigènes de faible fréquence ne sont généralement pas détectés par les tests de dépistage systématique, car la population de référence n’exprime pas ces antigènes).
Avant la transfusion une identification positive ou une positivité dans l’historique de la recherche d’agglutinines irrégulières doit conduire à étendre le phénotype des concentrés érythrocytaires transfusés, aux systèmes de groupes sanguins immunogènes au-delà des systèmes Rhésus Kell soit les systèmes Kidd, Duffy, MNS.
Les individus ayant des antigènes RH partiels détectés par la mise en place en routine des techniques de génotypage des groupes sanguins devraient recevoir des culots globulaires rouges ne présentant pas ces antigènes.
Il est recommandé de transfuser des culots globulaires peu conservés chez ces patients, des études récentes chez la souris ayant montré un impact de l’âge des globules rouges sur l’allo-immunisation [37].
En situation inflammatoire aigue, il est recommandé de transfuser en phénotype élargi.
Tous ces moyens visent à limiter l’allo-immunisation comme l’hémolyse post-transfusionnelle.
En cas d’existence d’antécédents d’hémolyse post-transfusionnelle ou d’inefficacité transfusionnelle, d’allo-immunisation complexe ou de poly allo-immunisation les indications transfusionnelles seront restreintes aux situations mettant en jeu le pronostic vital.
16 Par ailleurs, le risque de surcharge en fer doit être suivi, analysé et maîtrisé par la mise en place précoce d’une chélation efficace, chez les patients en programme transfusionnel. 7. ENCADREMENT DU GESTE TRANSFUSIONNEL
CHEZ LE DREPANOCYTAIRE
L’acte transfusionnel nécessite une surveillance biologique, notamment après un échange transfusionnel.
Chez les patients drépanocytaires, le contrôle du taux d’hémoglobine sur l’hémogramme et du pourcentage d’hémoglobine A post-transfusionnel en chromatographie haute performance en phase liquide (HPLC) permet d’apprécier le rendement transfusionnel. Les patients drépanocytaires ne produisant pas d’hémoglobine A, les culots globulaires transfusés sont reflétés par son pourcentage. Une HbA inférieure à 10% dans les trois semaines qui suivent la transfusion rend compte d’une destruction anormale d’HbA. Le dosage des fractions est l’examen de référence pour évaluer l’efficacité transfusion-nelle.
Les taux d’hémoglobine S et A permettent de surveiller l’efficacité de l’échange. En moyenne, après une transfusion, l’hémoglobine S diminue de 6 à 12 % par culot érythrocytaire, inversement l’hémoglobine A augmente du même taux. Si le taux d’hémoglobine S est supérieur ou diminue difficilement après les échanges, il faut évoquer le diagnostic d’accident transfusionnel retardé ou d’inefficacité transfusionnelle. Il est important de surveiller la réapparition des symptômes de la maladie pouvant té-moigner d’une d’hémolyse post-transfusionnelle dont le diagnostic et la déclaration sont probablement sous-estimés [29] et qu’il convient d’analyser pour mettre en œuvre les traitements et protocoles transfusionnels adaptés. Une nouvelle transfusion, comme précisé précédemment, fait courir au patient un danger d’exacerbation de l’hémolyse. Il est aussi indispensable de faire une recherche d’agglutinines irrégulières 3 semaines à 1 mois après la transfusion. Des allo-anticorps peuvent apparaître à cette période et ne plus être détectables à distance. Cette recherche d’agglutinines irrégulières post-transfusion permettra de sécuriser immunologiquement une prochaine transfusion en permettant de tenir compte des allo-anticorps détectés, et ainsi, d’éviter une re-stimulation pouvant conduire à une hémolyse post-transfusionnelle [1].
8. INDICATIONS DU GESTE TRANSFUSIONNEL
Réservé à la prise en charge des complications de la drépanocytose, le geste transfusionnel, transfusion simple ou échange transfusionnel, a pour but soit de corriger une anémie mal tolérée, soit de diminuer la proportion d’hématies drépanocytaires dans le but d’améliorer la perfusion tissulaire.
Les indications et modalités transfusionnelles chez le patient drépanocytaire sont variées.
La transfusion simple
La transfusion simple est réservée aux cas d’anémie aigue - patients ayant un taux d’hémoglobine bas, souvent inférieur à 6 g/dl, d’installation rapide, mal tolérée, accompagnée d’une érythropoïèse insuffisante.
L’indication de la transfusion simple se discute en fonction de la tolérance clinique, de l’amplitude de la réponse réticulocytaire (rapidité de la ré-ascension de la concentration de réticulocytes), de l’hémoglobine de base [38] et de la complication en cause. Le but est d’abord l’apport d’oxygène et non pas la diminution du taux d’HbS.
Parmi les indications de la transfusion simple, on retrouve l’érythrobastopénie post-infectieuse dont la plus typique est liée au parvovirus B19, la séquestration splénique aigue, la séquestration hépatique aigue, l’hyper-hémolyse liée à une infection ou contemporaine d’une vaso-occlusion.
La crise vaso-occlusive osseuse non compliquée ne représente pas une indication à la transfusion.
De même, il n’y a pas de nécessité à transfuser un patient drépanocytaire bien portant avec un taux d’Hb ≥ 6 g.dL et des réticulocytes supérieurs à 150000/mm3.
L’échange transfusionnel partiel (ETP)
Il s’agit d’un acte transfusionnel associant une saignée et une transfusion, dont l’objectif est de diminuer la concentration en Hb S tout en n’augmentant pas ou peu l’hématocrite (Ht).
Les échanges transfusionnels partiels visent à diminuer la proportion d’hématies drépanocytaires. L’objectif d’hémoglobine S final dépend de l’indication et varie entre 30 à 40%.
Par ailleurs cette technique est préférable dans les programmes transfusionnels au long cours, car elle permet d’éviter l’hyperviscosité et la surcharge martiale.
Parmi les indications de l’échange transfusionnel partiel ponctuel on retrouve, les échanges à visée curative lors des complications aiguës graves tels que l’AVC, le syndrome thoracique aigu, le priapisme aigu (à plus de 3 heures d’évolution), la défaillance multi-viscérale, l’infection sévère, la séquestration hépatique aigue.
La pratique de l’ETP peut être étendue aux crises douloureuses résistantes aux antalgiques, à la nécrose médullaire, à la surdité brutale, et dans certain cas au vertige.
Parmi les indications de l’échange transfusionnel ponctuel à visée préventive on retrouve la préparation en vue d’un acte chirurgical. Le risque de complications post-opératoires infectieuses ou vaso-occlusives est élevé chez les patients drépanocytaires. La pratique habituelle est de procéder à un échange transfusionnel préopératoire abaissant HbS en dessous de 30 à 40%, attitude qu’il est recommandé de moduler selon la durée de l’anesthésie et le type d’intervention.
Parmi les indications de l’échange transfusionnel au long cours on retrouve la prévention ou le traitement d’une complication chronique sévère: la prévention primaire de l’AVC en cas de doppler transcrânien pathologique ou de vasculopathie cérébrale sténosante
18 avérée à l’imagerie, la prévention secondaire de l’AVC en cas de vasculopathie sténosante. L’échange transfusionnel est alors programmé toutes les 3 à 6 semaines. L’objectif est le maintien de l’hémoglobine S en dessous de 30 %.
Sont aussi des indications au programme transfusionnel au long cours, la récidive de syndromes thoraciques aigus graves ou récidivants en attendant l’efficacité de traitement par hydroxyurée ou en cas d’échec ou de contre-indication d’un traitement par hydroxyurée; les crises douloureuses fréquentes, en attendant l’efficacité de l’hydroxyurée ou en cas d’échec ou de contre-indication d’un traitement par hydroxyurée; l’hypertension artérielle pulmonaire confirmée au cathétérisme; l’insuf-fisance rénale chronique sévère; l’insufl’insuf-fisance cardiaque chronique symptomatique; les ulcères de jambe rebelles; la grossesse sans être systématique. L’objectif est alors le maintien de l’hémoglobine S en dessous de 40 à 60 % [1].
L’anémie chronique stable, les crises douloureuses non compliquées, les infections non sévères, la petite chirurgie ne nécessitant pas d’anesthésie générale prolongée, l’ostéonécrose aseptique de hanche ou d’épaule sont des situations cliniques ou la réalisation d’un geste transfusionnel n’est pas indiquée.
II-ETUDE
1. INTRODUCTION
L’allo-immunisation anti-érythrocytaire et l’hémolyse post-transfusionnelle sont des accidents potentiellement graves. Ils sont redoutés par les professionnels de santé.
En effet, lorsque les patients développent une allo-immunisation, les possibilités de leurs trouver ultérieurement des culots globulaires compatibles s’amoindrissent ; certains développent des impasses transfusionnelles. Les enfants qui développent une hémolyse post-transfusionnelle sont exclus de tous protocoles transfusionnels.
Le but de cette étude a été de faire un état des lieux des allo-immunisations et des hémolyses post-transfusionnelles survenues au sein de notre cohorte de pédiatrie et d’identifier les facteurs de risques associés à la survenue de ces accidents potentiellement graves, afin de proposer des solutions et ainsi d’en diminuer l’incidence.
2. PATIENTS ET METHODES 2.1 PATIENTS
Cette étude observationnelle descriptive et analytique, a porté sur des patients drépanocytaires suivis à l’unité transversale de la drépanocytose du Centre Hospitalier Universitaire de Pointe-à-Pitre/Abymes ; les patients étaient en âge pédiatrique au moment de l’accident transfusionnel, c’est-à-dire d’âge compris entre 0 à 18 ans. 2.2 METHODES
Critères d’inclusion
Des patients de la cohorte pédiatrique de l’UTD qui ont présenté un accident transfusionnel et qui ont été signalés par les professionnels de santé comme posant problème pour la prise en charge transfusionnelle ultérieure ont été inclus.
Etait considéré comme des accidents transfusionnels, les allo-immunisations et les hémolyses post-transfusionnelles.
L’allo-immunisation a été définie comme la production par le patient (receveur) d’un anticorps dirigé contre un antigène présent à la surface des globules rouges qu’il a reçu lors d’une transfusion sanguine.
L’hémolyse post-transfusionnelle a été définie comme la destruction des globules rouges transfusés, dans un délai de 5 à 10 jours après la transfusion. Cette complication
20 avait été révélée par des signes clinico-biologiques indiquant une hémolyse accélérée:
- l’hémoglobinurie,
- le développement ou l’intensification de symptômes suggérant une crise va so-oc clusive (CVO) et/ou un syndrome thoracique aigu (STA),
- l’augmentation de la déshydrogénase lactique,
- Un taux d’Hb inférieur ou égal à sa valeur pré-transfusionnelle, - la chute anormale de l’HbA post-transfusionnelle.
Période d’étude
Nous avons rétrospectivement analysé les cas d’accidents transfusionnels signalés par les professionnels de santé comme posant un problème pour la prise en charge transfusionnelle ultérieure, qui ont eu lieu sur la période de septembre 1996 et juin 2016 parmi les patients d’âge pédiatrique (0-18 ans) suivis à l’unité transversale de la drépanocytose.
Recueil des données
Les données recueillies à partir du dossier médical de chaque patient étaient le génotype (Hb SS, SC ou Sß thalassémie), l’âge, le sexe, le phénotype ABO/RH/KEL et au-delà (FY/KIDD/MNS), et les résultats de biologie moléculaire pour les variants RH s’ils étaient réalisés.
L’indication de la transfusion source de l’accident a été recueillie à partir des dossiers médicaux.
Les données recueillies à partir des fiches transfusionnelles obtenues auprès de l’Etablissement Français du Sang Guadeloupe/Guyane étaient l’histoire transfusionnelle des patients :
- les caractéristiques immuno-hématologiques des patients, - le nombre et le phénotypage des culots globulaires reçu, - le résultat des RAI pré et post-transfusionnelles
- la quantité totale de culots globulaires délivrés à ce patient par l’EFS Guadeloupe /Guyane depuis le début de sa prise en charge,
- les allo-anticorps développés. Traitement et analyse des données
Les phénotypes érythrocytaires du patient et des culots globulaires transfusés ont été comparés. Les éventuelles expositions antigéniques ont été analysées.
Les résultats des RAI pré et post-transfusionnelles ont été étudiés. La saisie des données a été faite sur le logiciel Excel.
Le calcul des moyennes et des écarts-types a été effectué au moyen du logiciel « GraphPad Prism 5.0 ».
3. RESULTATS
Nous avons analysé rétrospectivement les données immuno-hématologiques liées à 26 accidents transfusionnels.
On a dénombré 16 allo-immunisations et 10 hémolyses post-transfusionnelles. Il y avait 16 patients de génotype SS et 2 patients de génotype SC.
3 enfants sur les 18 étaient en programme transfusionnel.
Le sex-ratio était de 10 filles pour 8 garçons; l’enfant le plus âgé au moment de l’accident transfusionnel avait 18 ans et l’enfant le plus jeune avait 2 ans.
3.1 LES ALLO-IMMUNISATIONS
Nous avons répertorié 16 allo-immunisations survenues chez 10 patients. Les principales caractéristiques cliniques de ces épisodes sont présentées dans le tableau 1. Les principales caractéristiques immuno-hématologiques sont présentées dans le tableau 2, figure 3 et 4, ainsi que le tableau 1 des annexes.
Caractéristiques cliniques du patient
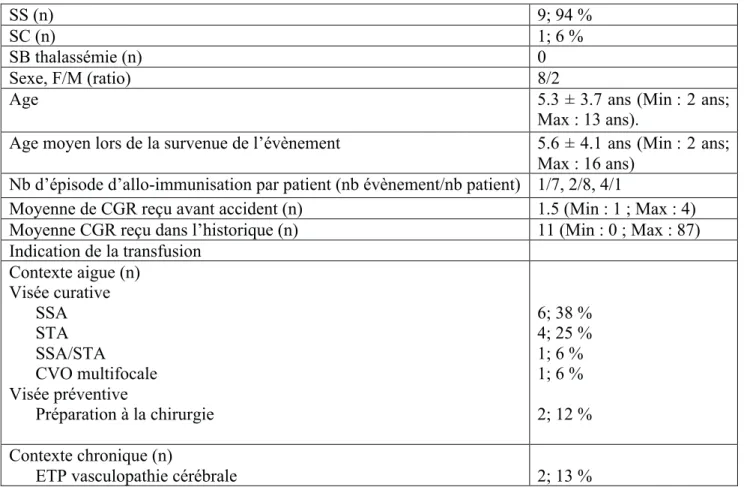
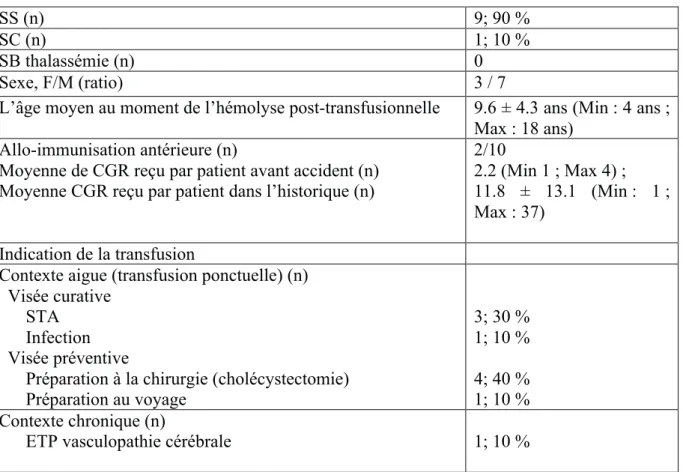
Parmi ces 10 patients, 9/10 (90 %) patients avaient un génotype SS, 1/10 (9%) SC. On dénombre 8 filles et 2 garçons, le rapport fille/garçon était de 8/2.
L’âge moyen au moment du premier épisode d’allo-immunisation était de 5.3 ± 3.7 ans (Min : 2 ans; Max : 13 ans).
2 enfants font partie d’un programme d’échange transfusionnel partiel pour la prévention primaire et secondaire d’une vasculopathie cérébrale.
Caractéristiques des épisodes d’allo-immunisation
94% (15/16) survenus chez des SS et 6% (1/16) chez des SC.
81% (13/16) survenus chez des filles et 19% (3/16) chez des garçons. Age moyen lors de la survenue: 5.6 ± 4.1 ans (Min 2 ans; Max : 16 ans). Complications ayant justifié l’acte transfusionnel
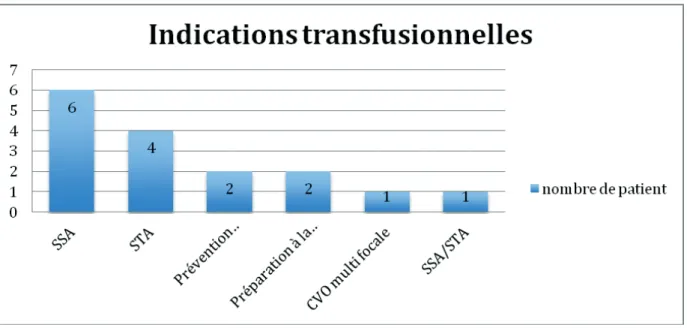
L’indication transfusionnelle, comme le montre la figure 1, était une séquestration splénique aigue (SSA) dans 6/16 (38%), un syndrome thoracique aigu (STA) dans 4/16 (25%), la prévention d’une vasculopathie cérébrale dans 2/16 (13%), la préparation à la chirurgie 2/16 (12 %), une CVO multifocale dans 1/16 (6%), l’association STA/SSA dans 1/16 (6%).
22 Figure 1. Répartition des indications ayant justifiées l’acte transfusionnel
Historique transfusionnel
Les patients avaient reçu de 0 à 87 culots globulaires avant le premier épisode d’allo-immunisation.
4 patients avaient reçu 0 CGR, 1 patient avait reçu 1 CGR, 1 patient avait reçu 8 CGR, 1 patient avait reçu 10 CGR, 1 patient avait reçu 13 CGR, 1 patient avait reçu 87 CGR. Le patient qui avait reçu 87 CGR était en programme d’échange transfusionnel partiel. 9/16 (56 %) des épisodes surviennent chez des patients précédemment non immunisés. 6/16 (38 %) des épisodes surviennent chez des patients antérieurement immunisés. 1/16 (6 %) des épisodes surviennent chez des patients suspects d’être immunisés (le dépistage anticorps en pré-transfusionnel signalait la présence d’un anticorps de nature indéterminé).
9 événements sur les 16 sont des premières fois.
Les allo-immunisations ont été observées principalement chez les patients de sexe féminin, de phénotype SS ; elles sont survenues majoritairement entre 2 et 4 ans. Deux des patients étaient inclus dans un programme transfusionnel chronique pour la prise en charge primaire et secondaire d’une vasculopathie cérébrale.
La séquestration splénique aigue (SSA) suivie du syndrome thoracique aigue (STA) ont été les complications qui ont le plus souvent justifié un geste transfusionnel. Ces indications représentent respectivement 38% et 25% des motifs de transfusion au sein de cette cohorte.
22
Figure 1. Répartition des indications ayant justifiées l’acte transfusionnel
Historique transfusionnel
Les patients avaient reçu de 0 à 87 culots globulaires avant le premier épisode d’allo-immunisation.
4 patients avaient reçu 0 CGR, 1 patient avait reçu 1 CGR, 1 patient avait reçu 8 CGR, 1 patient avait reçu 10 CGR, 1 patient avait reçu 13 CGR, 1 patient avait reçu 87 CGR.
Le patient qui avait reçu 87 CGR était en programme d’échange transfusionnel partiel. 9/16 (56 %) des épisodes surviennent chez des patients précédemment non immunisés. 6/16 (38 %) des épisodes surviennent chez des patients antérieurement immunisés.
1/16 (6 %) des épisodes surviennent chez des patients suspects d’être immunisés (le dépistage anticorps en pré-transfusionnel signalait la présence d’un anticorps de nature indéterminé). 9 événements sur les 16 sont des premières fois.
Les allo-immunisations ont été observées principalement chez les patients de sexe féminin, de phénotype SS ; elles sont survenues majoritairement entre 2 et 4 ans. Deux des patients étaient inclus dans un programme transfusionnel chronique pour la prise en charge primaire et secondaire d’une vasculopathie cérébrale.
La séquestration splénique aigue (SSA) suivie du syndrome thoracique aigue (STA) ont été les complications qui ont le plus souvent justifié un geste transfusionnel.
Ces indications représentent respectivement 38% et 25% des motifs de transfusion au sein de cette cohorte.
Tableau 1. Description des patients ayant développé une allo-immunisation
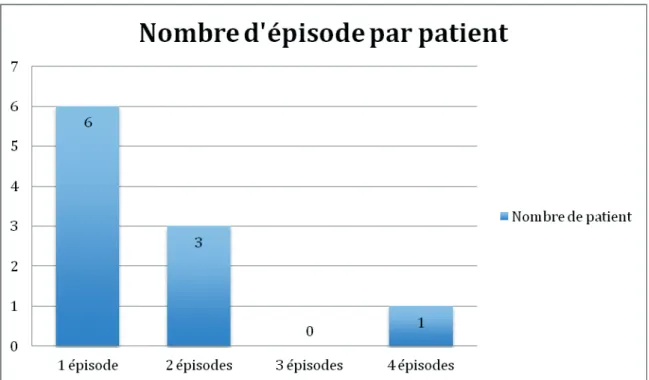
Caractéristiques immuno-hématologiques des allo-immunisations. Nombre d’épisodes d’allo-immunisations par patients
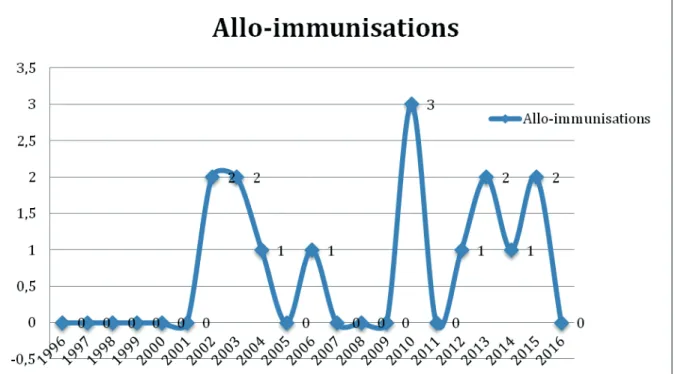
Les patients ont présenté 1 à 4 épisodes d’allo-immunisations pour chacun d’entre eux. 6 patients avaient présenté 1 épisode, 3 patients avaient présenté 2 épisodes et 1 patient avait présenté 4 épisodes d’allo-immunisation.
Sur 16 événements, 9 sont des premières fois.
23
Tableau 1. Description des patients ayant développé une allo-immunisation
SS (n) 9; 94 % SC (n) 1; 6 %
SB thalassémie (n) 0
Sexe, F/M (ratio) 8/2
Age 5.3 ± 3.7 ans (Min : 2 ans;
Max : 13 ans).
Age moyen lors de la survenue de l’évènement 5.6 ± 4.1 ans (Min : 2 ans; Max : 16 ans)
Nb d’épisode d’allo-immunisation par patient (nb évènement/nb patient) 1/7, 2/8, 4/1
Moyenne de CGR reçu avant accident (n) 1.5 (Min : 1 ; Max : 4) Moyenne CGR reçu dans l’historique (n) 11 (Min : 0 ; Max : 87) Indication de la transfusion Contexte aigue (n) Visée curative SSA STA SSA/STA CVO multifocale Visée préventive Préparation à la chirurgie 6; 38 % 4; 25 % 1; 6 % 1; 6 % 2; 12 % Contexte chronique (n)
ETP vasculopathie cérébrale 2; 13 %
Caractéristiques immuno-hématologiques des allo-immunisations Nombre d’épisodes d’allo-immunisations par patients
Les patients ont présenté 1 à 4 épisodes d’allo-immunisations pour chacun d’entre eux.
6 patients avaient présenté 1 épisode, 3 patients avaient présenté 2 épisodes et 1 patient avait présenté 4 épisodes d’allo-immunisation.
24 Figure 2. Répartition du nombre d’épisodes d’allo-immunisations par patient
Nombre de culots globulaires (CG) reçus
Une moyenne de 1.5 culots globulaires rouges ont été reçus avant l’accident.
13/16 (81.25%) des culots globulaires reçus avant l’accident étaient de phénotype élargi au delà des systèmes Rh/Kell.
Concordance des phénotypes érythrocytaires patient/CG
Dans 10/16 des actes transfusionnels, l’analyse des phénotypes étendus des CG et du patient montre que 1 voir jusqu’à 4 antigènes présents à la surface des globules rouges du donneur ne sont pas exprimés par les globules rouges du patient. Il y a une exposition à des antigènes pour ces cas.
Dans 3/16 des actes transfusionnels, l’analyse des phénotypes étendus des CG et du patient montre que les antigènes présents à la surface des globules rouges du donneur sont similaires à ceux exprimés par les globules rouges du patient. Il y a une absence d’exposition à des antigènes pour ces cas.
Dans 3/16 des actes transfusionnels, la concordance entre les phénotypes des CG et du patient ne peut être établie au-delà des systèmes Rh-Kell, car le phénotypage des culots n’est pas étendu au-delà des systèmes Rh-Kell. On ne peut exclure ici une exposition antigénique indéterminée.
Les expositions antigéniques sont mises en évidence dans 81% des cas d’allo-immunisation. Caractéristiques des expositions antigéniques
Parmi les 10 cas associés à une exposition d’antigène :
7/10 étaient associés à une exposition d’antigène dit dangereux (anti-Fya, anti-S, anti-Jkb) ; 3/10 étaient associés à une exposition d’antigène dit non dangereux (anti-Lea, anti-Leb).
24
Figure 2. Répartition du nombre d’épisodes d’allo-immunisations par patient
Nombre de culots globulaires (CG) reçus
Une moyenne de 1.5 culots globulaires rouges ont été reçus avant l’accident.
13/16 (81.25%) des culots globulaires reçus avant l’accident étaient de phénotype élargi au delà des systèmes Rh/Kell.
Concordance des phénotypes érythrocytaires patient/CG
Dans 10/16 des actes transfusionnels, l’analyse des phénotypes étendus des CG et du patient montre que 1 voir jusqu’à 4 antigènes présents à la surface des globules rouges du donneur ne sont pas exprimés par les globules rouges du patient. Il y a une exposition à des antigènes pour ces cas.
Dans 3/16 des actes transfusionnels, l’analyse des phénotypes étendus des CG et du patient montre que les antigènes présents à la surface des globules rouges du donneur sont similaires à ceux exprimés par les globules rouges du patient. Il y a une absence d’exposition à des antigènes pour ces cas.
Dans 3/16 des actes transfusionnels, la concordance entre les phénotypes des CG et du patient ne peut être établie au-delà des systèmes Rh-Kell, car le phénotypage des culots n’est pas étendu au-delà des systèmes Rh-Kell. On ne peut exclure ici une exposition antigénique indéterminée.
Les expositions antigéniques sont mises en évidence dans 81% des cas d’allo-immunisation.
Caractéristiques des expositions antigéniques
Parmi les 10 cas associés à une exposition d’antigène :
7/10 étaient associés à une exposition d’antigène dit dangereux (anti-Fya, anti-S, anti-Jkb) ; 3/10 étaient associés à une exposition d’antigène dit non dangereux (anti-Lea, anti-Leb).
Figure 3. Caractéristiques des expositions antigéniques au sein des allo-immunisations.
Production d’anticorps après la transfusion
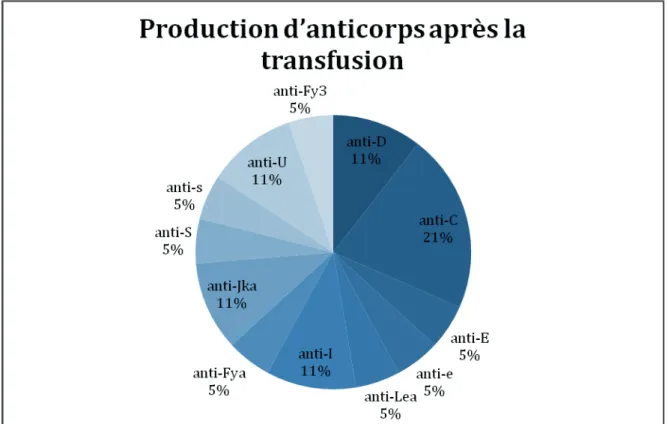
Pour 16/16 (100%) des allo-immunisations, des anticorps nouvellement formés ont été développés et identifiés.
On retrouve :
Dans 4/16 des cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-C – dont deux en association avec respectivement un anti-e et un anti-Lea.
Dans 3/16 cas des anticorps nouvellement formés, il s’agissait d’anticorps spécificité anti-I– dont un en association avec un anti-E et anti-Jka.
Dans 2/16 cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-D – dont un en association avec un anti-Lex.
Dans 2/16 cas des anticorps nouvellement formés, il s’agissait d’anticorps correspondant aux antigènes classiquement dit dangereux (anti-Fya, anti-S).
Dans 2/16 cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-U. Dans 1/16 cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-Jka. Dans 1/16 cas des anticorps nouvellement formés, il s’agissait d’un auto-anticorps anti-e. Dans 1/16 cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-FY3.
25
Figure 3. Caractéristiques des expositions antigéniques au sein des allo-immunisations.
Production d’anticorps après la transfusion
Pour 16/16 (100%) des allo-immunisations, des anticorps nouvellement formés ont été développés et identifiés.
On retrouve :
Dans 4/16 des cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-C – dont deux en association avec respectivement un anti-e et un anti-Lea.
Dans 3/16 cas des anticorps nouvellement formés, il s’agissait d’anticorps spécificité anti-I– dont un en association avec un anti-E et anti-Jka.
Dans 2/16 cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-D – dont un en association avec un anti-Lex.
Dans 2/16 cas des anticorps nouvellement formés, il s’agissait d’anticorps correspondant aux antigènes classiquement dit dangereux (anti-Fya, anti-S).
Dans 2/16 cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-U. Dans 1/16 cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-Jka. Dans 1/16 cas des anticorps nouvellement formés, il s’agissait d’un auto-anticorps anti-e. Dans 1/16 cas des anticorps nouvellement formés, il s’agissait d’un anticorps anti-FY3.
26 Figure 4. Représentation des anticorps produits après la transfusion
Tableau 2. Caractéristiques des allo-immunisations par patient
Ac : anticorps ; CG : culot globulaire ; RAI : recherche d’agglutinine irrégulière ; T : transfusion
26
Figure 4. Représentation des anticorps produits après la transfusion
Tableau 2. Caractéristiques des allo-immunisations par patient
Patients Ac antérieure Phénotype
CG
RAI
pré-T
RAI
post-T
Analyse
moléculaire
1
0 Leb M 0 Anti-C eVariant suspecté
(e)
Inconnu (C)
2
NI Non étendu 0 Anti-I3
0 S s M Fyb 0 Anti-U4
0 Non étendu 0 Anti-Jka5
Anti-Jka Fya Fyb 0 Anti- I E Jka6
Anti- I E Jka Fya 0 Anti- Fya7
Anti- I E Jka Fya Lea 0 Anti-FY38
0 Non étendu 0 Anti-S s9
Anti-S s Leb 0 Anti-I10
0 0 0 Anti-CInconnu (C)
11
0 S M Leb 0 Anti-DVariant suspecté
12
0 0 0 Anti-C LeaInconnu (C)
13
Anti-C Lea 0 0 Anti-D LexVariant suspecté
14
0 Fya M Leb 0 Anti-eAuto-ac
26
Figure 4. Représentation des anticorps produits après la transfusion
Tableau 2. Caractéristiques des allo-immunisations par patient
Patients Ac antérieure Phénotype
CG
RAI
pré-T
RAI
post-T
Analyse
moléculaire
1
0 Leb M 0 Anti-C eVariant suspecté
(e)
Inconnu (C)
2
NI Non étendu 0 Anti-I3
0 S s M Fyb 0 Anti-U4
0 Non étendu 0 Anti-Jka5
Anti-Jka Fya Fyb 0 Anti- I E Jka6
Anti- I E Jka Fya 0 Anti- Fya7
Anti- I E Jka Fya Lea 0 Anti-FY38
0 Non étendu 0 Anti-S s9
Anti-S s Leb 0 Anti-I10
0 0 0 Anti-CInconnu (C)
11
0 S M Leb 0 Anti-DVariant suspecté
12
0 0 0 Anti-C LeaInconnu (C)
13
Anti-C Lea 0 0 Anti-D LexVariant suspecté
14
0 Fya M Leb 0 Anti-eAuto-ac
27
15
0 S s M 0 Anti-U16
Anti-U C Jkb 0 Anti-CAc : anticorps ; CG : culot globulaire ; RAI : recherche d’agglutinine irrégulière; T : transfusion ; - : non fait
Le cas 2 a développé un anticorps anti-I. Les expositions antigéniques n’ont pas pu être
retracées au-delà des systèmes RH-Kell. Dans l’historique transfusionnel on retrouve une réaction faible, sans spécificité détectable. Le test de dépistage avant la transfusion était négatif.
Les cas 4 et 8 ont développé respectivement un anticorps anti-Jka et un anticorps anti-S s. Les
expositions antigéniques n’ont pas pu être retracées au-delà des systèmes RH-Kell. Les patients n’avaient pas d’antécédent d’allo-immunisation. Les tests de dépistage avant la transfusion étaient négatifs.
Le cas 9 a développé un anticorps anti-I. Il a été exposé à l’antigène Leb. Il avait un
antécédent d’allo-immunisation, avec la production des anticorps anti-S et anti-s. Le test de dépistage avant la transfusion était négatif.
Le cas 6 a développé un anticorps anti-Fya. Il a été exposé à l’antigène Fya. Il avait un
antécédent d’allo-immunisation, avec la production des anticorps anti-I, anti-E et anti-Jka. Le test de dépistage avant la transfusion était négatif.
Le cas 3 a développé un anticorps anti-U. Il a été exposé aux antigènes S s M et Fyb. Il
n’avait pas d’antécédent d’allo-immunisation. Le test de dépistage avant la transfusion était négatif.
Le cas 15 a développé un anticorps anti-U. Il a été exposé aux antigènes S s M. Il n’avait pas
d’antécédent d’allo-immunisation. Le test de dépistage avant la transfusion était négatif.
Le cas 7 a développé un anticorps anti-FY3; il a été exposé à l’antigène Lea. Il avait un
antécédent d’allo-immunisation, avec la production des anticorps anti-I, anti-E, anti-Jka et anti-Fya. Le test de dépistage avant la transfusion était négatif.
Le cas 1 a développé un anticorps anti-C et anti-e. Le patient a été exposé aux antigènes Leb
et M. Le culot globulaire transfusé était C négatif et e positif chez un patient C positif et e positif.
Le cas 16 a développé un anticorps anti-C. Il a été exposé à l’antigène C. Le culot globulaire
transfusé était C positif chez un patient C négatif. Il avait un antécédent d’allo-immunisation. Le test de dépistage avant la transfusion était négatif.
Les cas 11 et 13 ont développé un anticorps anti-D. Pour le cas 11 les culots globulaires
transfusés étaient D positif chez un patient D négatif. Pour le cas 13 le culot globulaire transfusé était D positif chez un patient D positif.
Les cas 10, 12 ont développé un anticorps anti-C. Les culots transfusés étaient C-négatif chez
des patients C-négatif.
Le cas 5 a développé un anticorps anti-E. Les culots transfusés étaient E-négatif chez un
patient E-négatif.
Le cas 14 a développé un anticorps anti-e. Les culots transfusés étaient e-positif chez un