T
T
H
H
È
È
S
S
E
E
Pour obtenir le grade de
D
D
O
O
C
C
T
T
E
E
U
U
R
R
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
DELIVRE PAR L’UNIVERSITE DE TOULOUSE–PAUL SABATIER
DISCIPLINE OU SPECIALITE :ECOPHYSIOLOGIE VEGETALE
Soutenue le 30 juin 2009 devant le jury composé de: Didier ALARD, Professeur, Université de Bordeaux Pablo CRUZ, Chargé de recherches, INRA Toulouse François GASTAL, Directeur de recherches, INRA Lusignan Alain GOJON, Directeur de recherches, INRA Montpellier Philippe GRIEU, Professeur, ENSA Toulouse Thierry LAMAZE, Professeur, Université Toulouse III André PORNON, Maître de conférences, Université Toulouse III Rapporteur Examinateur Examinateur Rapporteur Membre invité Directeur de thèse Co‐directeur de thèse Présentée et soutenue par
Charles MARTY
N
UTRITION ET REPONSES DES PLANTES SUBALPINES PYRENEENNES A LA CONTRAINTE AZOTEEEcole doctorale : SEVAB
Unité de recherche : Centre d’Etudes Spatiales de la Biosphère (CESBIO). Directeurs de Thèse : Pr. Thierry LAMAZE
Remerciements
Je tiens tout d’abord à remercier Thierry Lamaze et André Pornon de m’avoir accordé leur confiance, de m’avoir soutenu dans les moments de doutes et d’avoir su me transmettre, avec patience et attention, leur savoir-faire et leurs connaissances.
Merci également à Jérome Viers et Priscia Oliva pour leur initiation à la pratique de la géochimie, ainsi que pour leurs conseils bienveillants et leur disponibilité.
Je tiens aussi à remercier Alain Gojon et Didier Alard d’avoir accepté de juger mon travail, ainsi que Pablo Cruz, François Gastal et Philippe Grieu d’avoir consenti à faire partie du jury.
Un grand merci également à Paola Chavez, JB Benoit, Aurélie Khimoun et Anne Dozières pour leur aide précieuse sur le terrain.
Avantpropos
La thématique centrale de cette thèse est la nutrition, en particulier azotée, des plantes de l’étage subalpin pyrénéen. Plusieurs aspects de la nutrition ont été étudiés pour différents types de plantes présents dans cet habitat. Les problématiques abordées au cours de ce travail sont diverses et parfois spécifiques de l’espèce étudiée, ce qui est susceptible de conférer au manuscrit un aspect quelque peu hétérogène. Ces différentes problématiques sont déclinées au travers de cinq articles rédigés en anglais et répartis en trois parties. Chaque partie est introduite par une synthèse bibliographique rédigée en français qui permettra au lecteur de disposer de tous les éléments pour comprendre l’intérêt des questions posées dans cette thèse, mais aussi pour définir le cadre théorique des thématiques abordées dans les articles. Pour conclure, une synthèse générale des résultats fait apparaître les éléments majeurs qui ont émergé de nos travaux et qui pourront peut-être servir de base à de nouvelles recherches dans le domaine.
TABLE DES MATIERES
Remerciements ... 2 Avantpropos... 3 Introduction ...8 1 Utilisation des ressources par les plantes ... 9 1‐1 Le concept de « stratégie » en écologie végétale... 9 1‐2 Les schèmes de stratégies écologiques...10 1‐3 Le spectre d’économie des feuilles ...12 2 Utilisation de l’azote par les plantes...14 2‐1 Distribution de l’azote dans les plantes...14 2‐2 Efficacité d’utilisation de l’azote...16 3 Adaptations et stratégies d’utilisation des ressources dans les milieux d’altitude...17 3‐1 Ecologie des milieux alpins...17 3‐1‐1 Conditions climatiques... 18 3‐1‐2 Sols... 18 3‐2 Adaptations aux conditions climatiques ...19 3‐2‐1 Adaptations morphologiques... 19 3‐2‐2 Adaptations phénologiques ... 20 3‐2‐3 Adaptations physiologiques ... 20 3‐3 Adaptations à la faible disponibilité des ressources dans le sol...21 3‐3‐1 Prélèvement des nutriments... 21 3‐3‐2 Croissance des plantes ... 21 4 Communautés végétales de l’étage subalpin Pyrénéen...22 4‐1 Description de l’étage subalpin Pyrénéen ...22 4‐2 Espèces étudiées ...24 4‐2‐1 Festuca eskia Ram... 24 4‐2‐2 Nardus stricta L... 25 4‐2‐3 Festuca nigrescens Lam... 26 4‐2‐4 Rhododendron ferrugineum L... 27 4‐2‐5 Trifolium alpinum L... 28 5 Description des sites d’études...29 5‐1 Vallon d’Estaragne...29 5‐1‐1 Situation géographique... 29 5‐1‐2 Sol et végétation... 30 5‐1‐3 Conditions climatiques... 31 5‐2‐ La vallée de Bethmale...31 6 Objectifs de la thèse ...33 PARTIE 1 ... 35 Nutrition azotée et interactions entre plantes a l’étage subalpin Pyrénéen ... 35 1 Introduction...36 1‐1 Origine de l’azote dans les écosystèmes...36 1‐1‐1 Fixation biologique ... 36 1‐1‐2 Retombées atmosphériques ... 38 1‐2 Dynamique de l’azote dans les sols ...38 1‐3 Prélèvement et assimilation de l’azote par les plantes ...40 1‐3‐1 Prélèvement... 40 1‐3‐2 Réduction et assimilation de l’azote minéral... 42
1‐3‐3 Transport de l’azote dans la plante ... 42 1‐4 Objectifs ...44 2 Etude du prélèvement net de l’azote minéral par une plante caractéristique du milieu montagnard (Festuca nigrescens)...45 2‐1 Résumé...45 2‐2 High NH4+ efflux from roots of the common alpine grass, Festuca nigrescens, at field‐relevant concentrations restricts net uptake. ...46 3 Effets de la fixation symbiotique de l’azote atmosphérique sur la nutrition azotée des plantes et les interactions interspecifiques dans les communautés végétales subalpines ...55 3‐1 Contexte de l’étude...55 3‐2 Résumé...56 3‐3 Complex interactions between a legume between a legume and two grasses in a subalpine meadow ...57 PARTIE 2 ... 79 Longévité foliaire et contrainte azotée chez R. ferrugineum : conséquences sur la nutrition carbonée... 79 1 Introduction...80 1‐1 La longévité foliaire...80 1‐1‐1 Aspects évolutifs... 80 1‐1‐2 Longévité foliaire et typologie des plantes ... 80 1‐2 Distribution des espèces sempervirentes et décidues ...82 1‐3 Théories de la longévité foliaire ...83 1‐3‐1 Longévité foliaire et conservation des nutriments... 83 1‐3‐2 Longévité foliaire et assimilation du carbone... 85 1‐3‐3 Modèles d’optimisation de l’azote ... 88 1‐4 Variabilité de la longévité foliaire au niveau intra‐spécifique ...90 1‐4‐1 Réponse de la longévité foliaire à la fertilisation azotée ... 90 1‐4‐2 Réponse de la longévité foliaire à l’éclairement ... 91 1‐5 Sénescence foliaire et résorption de l’azote ...92 1‐6 Equilibre entre résorption et prélèvement des nutriments...93 1‐7 Objectifs ...95 2 Description des deux sites d’études...96 2‐1 Matériels et méthodes...96 2‐1‐1 Description et analyses multi‐élémentaires des sols ... 96 2‐1‐2 Disponibilité en azote dans les deux sites ... 98 2‐1‐3 Productivité des landes à Rhododendron ferrugineum ...102 2‐2‐ Résultats & Discussion ...103 2‐2‐1 Analyse des profils des sols ...103 2‐2‐2 Analyses chimiques ...103 2‐2‐3 Disponibilité de l’azote in situ...106 2‐2‐4 Nutrition azotée des plantes...107 2‐2‐5 Productivité des landes à R. ferrugineum dans chaque site...109 2‐3‐ Conclusion...113 3 Contribution de l’azote endogène à la croissance des pousses en relation avec la disponibilité en azote et la longévité foliaire chez Rhododendron ferrugineum ... 114 3‐1 Résumé...114 3‐2 Endogenous sink‐source interactions and soil N regulate leaf life span in an evergreen shrub...116 4 Variation de l’efficacité d’utilisation de l’azote pour la photosynthèse avec l’âge des feuilles et effet de la longévité foliaire sur la capacité photosynthétique de Rhododendron ferrugineum... 141
4‐2 Long leaf life span increases plant photosynthetic nitrogen use efficiency in an evergreen shrub ...143 PARTIE 3 ...168 Prélèvement et dynamique des éléments chez R. ferrugineum ...168 1 Introduction... 169 2 Matériels et méthodes... 170 2‐1 Analyses multi‐élémentaires...170 2‐1‐1 Echantillonnage...170 2‐1‐2 Préparation des échantillons...171 2‐1‐3‐ Méthodes analytiques...172 2‐2 Etude des sources de variations des concentrations dans la plante ...172 2‐3 Discrimination des éléments dans la plante...174 2‐4 Transpiration et efficacité d’utilisation de l’eau pour la photosynthèse ...175 3 Résultats... 176 3‐1 Analyses multi‐élémentaires...176 3‐1‐1 Sols...178 3‐1‐2 Plante ...182 3‐2 Variabilité inter‐populationnelle des concentrations en éléments traces....185 3‐3‐ Dynamique des éléments dans les feuilles ...188 3‐3‐1 Calcium (Ca)...188 3‐3‐2 Potassium (K)...189 3‐3‐3 Magnésium (Mg)...189 3‐4 Dynamique de l’azote dans les feuilles ...191 3‐5 Discrimination des éléments dans les plantes...191 3‐6 Transpiration et efficacité d’utilisation de l’eau pour la photosynthèse ...194 4 Discussion... 195 Conclusion & Perspectives ...200 1 Rappels des principaux objectifs ... 201 2 Synthèse des principaux résultats... 201 2‐1 Capacité de prélèvement de l’azote minéral d’une poacée montagnarde...201 2‐2 Conséquences de la présence d’une espèce fixatrice d’azote atmosphérique sur les plantes associées...202 2‐3 Contribution des différentes sources d’azote à la croissance des pousses chez R. ferrugineum...203 2‐4 Longévité foliaire et efficacité d’utilisation de l’azote chez R. ferrugineum..204 2‐5 Dynamique des éléments traces dans la plante ...205 3 Conclusions & Perspectives ... 206 3‐1 Les plantes subalpines sont‐elles limitées en azote ?...206 3‐2 Interactions « puits‐source » et conservation des nutriments ...207 3‐3 Limitation de la productivité et effets sur la fitness des plantes...208 3‐4 Pertinence des modèles de durée de vie des feuilles dans les milieux alpins 211 Références bibliographiques ...213 Annexes...225 Méthodes analytiques ... 226 SAA (Spectométrie d’absorption atomique)...226 Principe et fonctionnement du SAA...226 ICP‐OES (Inductively Coupled Plasma‐ Optic Emission Spectrometry)...228 Principe et fonctionnement de l’ICP‐OES...228 ICP‐MS (Inductively Coupled Plasma‐Mass Spectrometry) ...229 Schéma et fonctionnement de l’ICP‐MS ...229 Description des profils des sols... 231
Méthodes des pointscontacts... 232 Mesure des échanges gazeux foliaires ... 233 Enrichissement de l’azote foliaire au 15N... 235 Concentrations des éléments dans le profil des sols ... 237 Concentrations des éléments dans la plante ... 241
I
NTRODUCTION
Introduction générale
1
Utilisation des ressources par les plantes
Toutes les plantes ont besoin des mêmes ressources (eau, nutriments, lumière etc.) en proportions relativement comparables et sont de ce fait en compétition pour leur acquisition. Une fois acquises, ces ressources peuvent être soit stockées soit investies dans la production de différents organes (feuilles, tiges, racines etc.). Elles participent alors en retour à l’acquisition de nouvelles ressources qui pourront à leur tour être stockées ou réinvesties. La capacité des plantes à se procurer et à utiliser les ressources du milieu est de première importance car elle conditionne la production photosynthétique qui elle-même détermine en partie la fitness1 des plantes (Bloom et al., 1985; Westoby et al., 2000). Les plantes ont donc développé des « stratégies » d’acquisition des ressources adaptées à leur environnement, leur permettant d’optimiser les potentialités offertes par leur habitat (Grime & Campbell, 1991). De nombreuses données ont en effet montré que les espèces à fort potentiel de croissance sont très souvent associées aux milieux riches et que les sites peu productifs sont composés essentiellement d’espèces à faible productivité (Chapin, 1980; Aerts & Chapin, 2000).
1‐1 Le concept de « stratégie » en écologie végétale
En écologie, le terme de « stratégie » a été défini comme « un ensemble de caractéristiques génétiques similaires ou analogues qui apparaissent fréquemment chez différentes espèces et populations, et qui leur confèrent des ressemblances écologiques » (Grime, 1979; Grubb, 1998). Cet ensemble de caractéristiques écologiques représente le moyen pour une espèce de maintenir une population dans un environnement où elle développe des interactions (notamment compétition) avec d’autres espèces (Westoby 1998). Le terme de stratégie a également été défini comme la manière dont les plantes assurent leur gain de carbone pendant la période végétative, ainsi que la transmission de leur gènes (Westoby et al. 2002).
1‐2 Les schèmes de stratégies écologiques
Plusieurs théories de stratégies écologiques ont été proposées dans le but de classer les espèces en catégories fonctionnelles ou de les positionner dans un spectre de caractéristiques écologiques (Westoby, 1998).
Une des plus acceptées dans la communauté scientifique est la théorie de sélection de type r-K proposée par Mac Arthur & Wilson (1967). Dans ce modèle, les pressions de sélection sont supposées diriger l’évolution vers un des deux pôles qui correspondent à deux types de stratégies opposées. La stratégie de type K regroupe des organismes dont l’espérance de vie est longue et dont l’investissement en énergie et nutriments dans la reproduction est faible. Ces organismes se trouvent par conséquent dans des milieux relativement peu perturbés, à mortalité dépendante de la densité de population. La stratégie de type r regroupe des organismes à faible espérance de vie et qui investissent beaucoup dans leur reproduction. Ces organismes peuvent par conséquent occuper des milieux perturbés.
Quelques années plus tard, Grime (1977) proposait une théorie des stratégies des plantes généralement reprise dans la littérature sous l’appellation de théorie CSR. Ce modèle repose sur les variations de stabilité et de potentialités de croissance offertes aux plantes entre habitats, qui donnent naissance à différentes stratégies écologiques chez les plantes. Selon ce modèle, les facteurs externes qui limitent les quantités de biomasse produites par les plantes sur un milieu peuvent être classés en deux catégories : le stress2 et la perturbation3. A l’échelle de la planète, ces deux paramètres varient considérablement, si bien que l’on peut positionner les espèces végétales le long de deux axes définis par les propriétés de la communauté ou de l’environnement : la productivité (dont la caractéristique opposée est le « stress » ) et la stabilité de l’habitat (l’inverse du niveau de « perturbation »). Cette matrice productivité de l’habitat × stabilité de l’habitat génère selon Grime (1977) un panel de conditions et de stratégies associées qui peuvent former la base pour une classification écologique universelle des plantes et des animaux. La théorie C-S-R admet l’existence de trois types de stratégies qui se trouvent aux extrémités d’un triangle inclus dans la matrice productivité de l’habitat × stabilité de l’habitat: les
2 Ensemble des phénomènes qui restreignent la production photosynthétique.
Introduction générale compétiteurs (C) se trouvent dans des milieux peu stressants - peu perturbés, les tolérantes au stress (S) dans les milieux fortement stressants - peu perturbés, et enfin les rudérales (R) dans les milieux peu stressants - fortement perturbés.
A la même période, Tilman (1982) élaborait une série de modèles mathématiques, à la base de la théorie pour la compétition des ressources, qui permettait de prédire les phénomènes d’exclusion compétitive et la coexistence des espèces à partir de leurs exigences nutritives. Cette théorie repose sur l’hypothèse que lorsqu’une ressource est utilisée pour le développement d’une espèce, sa concentration dans le milieu chute jusqu’à ce que la population atteigne l’état d’équilibre, i.e. lorsque le taux de prélèvement de la ressource limitante équivaut à son taux de perte par le biais de la litière. La concentration de la ressource dans le sol à l’état d’équilibre est R*. Chaque espèce a sa propre valeur de R*. En dessous de cette valeur, la taille de la population diminue alors et ne peut par conséquent pas subsister. La conclusion de ce modèle est que lorsque plusieurs espèces sont en compétition pour la même ressource, l’espèce la moins exigeante, c’est-à-dire celle avec le R* le plus faible, supplante toutes les autres, indépendamment des densités initiales des autres espèces. Contrairement à la théorie CSR, qui prédit que les espèces ayant le taux d’acquisition des ressources le plus fort sont les plus compétitives, les modèles de Tilman prédisent que les espèces ayant le plus faible niveau d’exigence nutritive sont les plus compétitives.
Face aux difficultés à établir une théorie des stratégies des plantes cohérente et généralisable à l’ensemble des biomes, Westoby (1998) préconise une approche pragmatique pour classer les espèces vasculaires en groupes fonctionnels. Il propose une classification basée sur l’étude et la comparaison de traits à forte signification écologique et facilement mesurables sur le terrain. Dans ce modèle, la stratégie d’une espèce est définie en fonction de sa position dans le volume formé par la valeur des traits sur les axes. Le choix des traits permet non seulement de capturer une part importante du spectre de variation des stratégies de la théorie CSR, mais il permet surtout de regrouper des espèces sur la base d’un protocole clair et de manière assez simple. Cette méthode ouvre ainsi la voie à des comparaisons et des méta-analyses à l’échelle du globe (Westoby, 1998).
1‐3 Le spectre d’économie des feuilles
L’existence de plusieurs théories relatives aux stratégies des plantes a nourri de nombreux débats dans la communauté scientifique (Grubb, 1980; Grubb, 1985; Grace, 1990; Grubb, 1998; Craine, 2005; Grime, 2007). Face aux tentatives infructueuses de réconciliation ou de consensus sur une théorie, la recherche s’est par la suite focalisée davantage sur la compréhension des trade-offs qui sous-tendent les stratégies (Westoby, 1998), notamment par l’étude des traits foliaires. Depuis plus de 25 ans, des campagnes de mesures systématiques des caractéristiques morphologiques, biochimiques, phénologiques et physiologiques des plantes sont réalisées par les écologues. Cette méthode de « screening » initiée par Grime (1977) lors de l’élaboration de la théorie C-S-R et encouragée par Westoby (1998) pour un nombre restreint de traits a depuis été poursuivie par de nombreux chercheurs partout dans le monde. Récemment, le traitement des données récoltées sur l’ensemble de la planète a effectivement fait apparaître un ensemble de covariations de certains traits foliaires opérant indépendamment des formes de croissance, des types fonctionnels ou des biomes (Reich et al., 1997; Reich et al., 1999; Wright et al., 2004). Ce pattern, dénommé « spectre d’économie foliaire » (« leaf economics spectrum ») (Wright et al. 2004), est vu comme la représentation d’un trade-off universel entre la maximisation du taux de retour sur investissement et l’allongement de la durée des bénéfices issus de l’investissement (Lusk et al., 2008). A une extrémité de ce spectre, se trouve une stratégie à retour sur investissement rapide, effective grâce à des traits foliaires permettant une acquisition rapide des ressources et un fort taux de croissance. A l’autre extrémité, on trouve une stratégie d’investissement sur le long terme, caractérisée par des traits qui ne permettent pas un taux de croissance rapide mais une bonne conservation des ressources. En d’autres termes, ces résultats décrivent le compromis entre l’acquisition rapide des nutriments et leur conservation. De ce compromis émerge donc deux grands types de stratégie : une stratégie de
court terme (« fast economics ») et une stratégie de long terme (« slow
economics »).
La longévité foliaire (LLS) est un des traits du spectre d’économie des feuilles. Elle est négativement corrélée à la surface spécifique (SLA), i.e. la surface foliaire produite par unité de biomasse investie par la plante, la teneur en azote (% ou g.m-2),
Introduction générale la capacité photosynthétique (Amax) et au taux de croissance relatif de la plante, i.e.
la biomasse produite par unité de temps et de biomasse (RGR). De ce fait, une forte LLS participe de la stratégie de long terme évoquée plus haut.
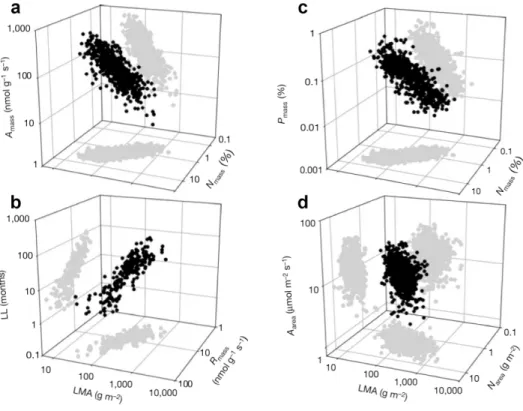
Fig. 1 Relations entre deux traits parmi les six du spectre d’économie des feuilles et leur masse surfacique (LMA). Chaque point représente une espèce. a- 706 espèces ; b- 217 espèces ; c- 733 espèces et d- 706 espèces (d’après Wright et al. (2004)).
2
Utilisation de l’azote par les plantes
Pour se développer, survivre et se reproduire, les plantes ont besoin de 17 éléments (Marschner, 1995). La matière organique contient plus de 40% de carbone. L’acquisition de cet élément par les plantes est conditionnée par la transpiration stomatique (flux opposés de CO2 et de vapeur d’eau), ce qui fait de l’eau la ressource
considérée comme la plus limitante de la productivité végétale. Après le carbone, dont l’acquisition dépend fortement de la disponibilité de l’eau dans le sol, l’azote est souvent considéré comme le principal élément qui limite la croissance des plantes (Chapin, 1980; Aerts & Chapin, 2000). Cet élément est extrêmement important pour le métabolisme des organismes vivants car c’est un constituant essentiel des nucléotides (acides nucléiques, ATP, NAD etc.), des lipides membranaires, des acides aminés et donc des protéines enzymatiques et de structure (Marschner, 1995; Aerts & Chapin, 2000).
2‐1 Distribution de l’azote dans les plantes
Il existe une forte relation entre la capacité photosynthétique des plantes (Amax) et
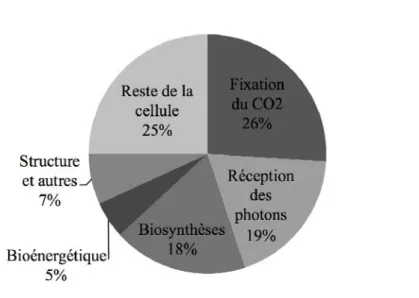
la concentration en azote dans les feuilles. Cette relation est due au fait que la majorité de l’azote foliaire est contenue dans des enzymes qui interviennent dans la photosynthèse (Fig. 2). En effet, 75% de l’azote foliaire est présent dans les chloroplastes (Poorter & Evans, 1998), les protéines photosynthétiques représentant à elles seules environ 50% de l’azote présent dans les feuilles (Hikosaka & Terashima, 1996). L’azote impliqué dans la photosynthèse peut être divisé en deux catégories : 1) les protéines solubles, comme la Rubisco, laquelle peut représenter jusqu’à 30% de l’azote foliaire (Warren & Adams, 2004), les autres enzymes du cycle de Calvin et les enzymes des mitochondries et des peroxysomes impliquées dans la photorespiration ; et 2) les protéines des membranes des thylakoïdes, englobant les complexes pigments-protéines, les centres réactionnels des photosystèmes, les composants de la chaine de transport des électrons (essentiellement le cytochrome b/f et le complexe ferrédoxine NADP réductase) et les facteurs de couplage (ATP synthase). Dans de nombreux écosystèmes naturels, l’azote est l’un des facteurs principaux pouvant limiter la croissance des plantes car la disponibilité de cet élément est souvent faible
Introduction générale alors que les besoins de la plante en azote, notamment pour la machinerie photosynthétique, sont très grands (Hikosaka & Hirose, 2001).
L’efficacité d’utilisation de l’azote pour la photosynthèse (PNUE), i.e. la capacité photosynthétique par unité d’azote foliaire (µmol CO2. s-1. g N-1), est très variable
d’une espèce à l’autre et caractérise leur stratégie écologique (voir partie 2). Les facteurs responsables des différences de PNUE entre espèces sont essentiellement i) la distribution de l’azote au sein de la feuille (parois cellulaires, mitochondries, métabolisme cytosolique, appareil photosynthétique etc.) et à l’intérieur de la machinerie photosynthétique (protéines des thylakoïdes et du stroma) et ii) les propriétés mécaniques comme la conductance du mésophylle pour la diffusion du CO2 qui varie avec les propriétés structurales des feuilles (Hikosaka, 2004). Les
espèces à faible PNUE ont généralement une faible conductance du mésophylle pour la diffusion du CO2, une faible proportion de l’azote foliaire allouée à l’appareil
photosynthétique et une distribution de l’azote dans la machinerie photosynthétique inefficace, la Rubisco servant de protéine de stockage de l’azote (Warren & Adams, 2004). Ces espèces vivent généralement dans des milieux stressants où la disponibilité en azote est faible. Au contraire, les plantes à fort PNUE ont un fort potentiel de croissance et occupent les milieux productifs et perturbés (Hikosaka, 2004).
2‐2 Efficacité d’utilisation de l’azote
Du fait de l’importance de l’azote dans le métabolisme et la structure des plantes, une bonne efficacité d’utilisation de l’azote (NUE) contribue à l’amélioration de leur fitness (Vitousek, 1982; Field & Mooney, 1986; Aerts & Chapin, 2000). Le concept de NUE a été défini de différentes manières selon les disciplines et le contexte des études (plantes étudiées, échelle temporelle, organes etc.) (voir Garnier & Aronson, 1998 pour une revue complète). Selon Vitousek (1982), la NUE peut être définie comme la quantité de biomasse produite par une plante par unité d’azote prélevée au cours d’une année (Eqn. 1). A l’état d’équilibre (« steady-state »), la quantité d’azote prélevée est égale à celle perdue dans la litière. Dans ces conditions, la NUE peut donc être exprimée comme la biomasse produite au cours d’une année par unité d’azote perdue au cours de la même période (Eqn 2). La résorption de l’azote contenu dans les feuilles associée au processus de sénescence réduit la quantité d’azote perdue dans la litière chaque année et par conséquent celle à prélever dans le sol. De ce fait, il a été suggéré que l’efficacité de résorption devait nécessairement augmenter la NUE. Comme l’azote résorbé des feuilles sert à la production de nouveaux tissus ou est stocké dans les parties pérennes de la plante, le processus de résorption permet d’augmenter le temps de résidence de cet élément (MRT) dans la plante. Par la suite, Berendse & Aerts (1987) ont proposé une définition de la NUE incluant le MRT de l’azote dans la plante et une composante décrivant la manière dont une unité d’azote est utilisée par la plante (aNP). Une nouvelle expression de la NUE, faisant apparaître ces deux termes (Eqn. 3), peut être obtenue de l’équation 2 :
NUE=dXA dt ⋅ 1 Np Eqn. 1 NUE = dXA dt ⋅ 1 N
[ ]
L ⋅ e ⋅ XA Eqn. 2 NUE = 1 NA ⋅ dXA dt ⋅ NA N[ ]
L⋅ e ⋅ XA = aNP ⋅ MRT Eqn. 3où Np est la quantité d’azote prélevé dans le sol en un an, NA est le pool moyen annuel
d’azote de la plante (mol), [N]L, est la concentration en azote dans la litière (mmol
Introduction générale de la plante, aNP est la productivité moyenne annuelle de l’azote, i.e. la quantité de biomasse produite par période de végétation par unité d’azote (1/NA . dXA/dt), et MRT,
le temps de résidence moyen de l’azote dans la plante (NA/([N]L.e.XA). La longévité
foliaire permet potentiellement d’augmenter la NUE puisque elle augmente le MRT (voir partie 2). Cependant, il existe un trade-off entre les deux composantes de la NUE. Les traits qui confèrent aux plantes une bonne capacité de conservation des nutriments (fort MRT), conduisent en effet à une diminution de la productivité (faible aNP) (Berendse & Aerts, 1987; Aerts, 1990; Reich et al., 1992).
3
Adaptations et stratégies d’utilisation des ressources dans
les milieux d’altitude
3‐1 Ecologie des milieux alpins
Dans les zones montagneuses de l’hémisphère nord, on peut distinguer plusieurs étages ou zones de végétation en fonction de l’altitude. L’étage alpin se réfère à la zone dépourvue d’espèces ligneuses de grande taille, située au-dessus de la limite supérieure des forêts (Kudo, 1993). La limite inférieure de cet étage est souvent graduelle. Elle correspond à ce que l’on appelle « l’étage subalpin ». Cette zone aussi nommée « tree-line ecotone » (Körner, 1995), représente une transition plus ou moins brutale entre la forêt et les pelouses d’altitude. Les types morphologiques dominants la végétation de cet étage sont généralement les arbustes sempervirents à faible croissance, les petites plantes herbacées pérennes, les bryophytes et les lichens. La petite taille des plantes dans ces milieux est considérée comme une adaptation leur permettant d’être protégées des vents et des faibles températures par le couvert neigeux pendant la période hivernale. A l’échelle du globe, la fourchette altitudinale dans laquelle se trouve l’étage subalpin est énormément variable. Sa limite inférieure varie de 300 mètres dans les régions subpolaires à plus de 3500 mètres dans les zones tropicales (Körner, 1995). Dans les Pyrénées, il s’étend en moyenne entre 1600 et 2300 mètres dans la chaine centrale (Dupias, 1985).
311 Conditions climatiques
Bien que le climat varie fortement selon la latitude, l’exposition ou plus généralement la situation géographique, les zones alpines sont caractérisées par des conditions climatiques contraignantes pour les plantes. La température est souvent considérée comme le facteur environnemental le plus stressant pour les organismes vivants (Grime, 2001). Elle diminue en moyenne de 0,55º C tous les 100 mètres (Körner, 1995). Parallèlement, l’intensité du rayonnement lumineux et la proportion de radiations ultraviolettes augmentent (Körner, 1999). En dehors de la zone inter-tropicale, la période propice à la croissance des plantes dans ces milieux peut être extrêmement courte. Elle est souvent réduite aux quelques mois de la période estivale en raison des trop faibles températures et de l’enneigement qui perdurent le reste de l’année. Dans les Pyrénées, le passage de l’étage montagnard au subalpin est marqué par une diminution importante de la nébulosité, entrainant une irradiation plus intense. Les précipitations augmentent aussi avec l’altitude et sont relativement importantes. Au versant Nord, elles sont généralement comprises entre 1500 et 2500 mm et sont assez régulières au cours de l’année. Une large part tombe sous forme de neige.
312 Sols
Les sols des habitats d’altitude sont généralement pauvres en azote (Atkin, 1996; Körner, 1999). Les faibles températures ralentissent en effet la minéralisation de la matière organique par les microorganismes du sol et les apports d’azote au sol sont faibles car les plantes produisent une faible quantité de litière à rapport C:N élevé. Dans ces conditions, les micro-organismes hétérotrophes peuvent être limités en azote et utiliser l’ammonium ou le nitrate parallèlement à la décomposition de macromolécules (Kaye & Hart, 1997). En revanche, lorsque les micro-organismes sont limités en carbone (ratio C:N de la litière inférieur à 30), la minéralisation de l’azote augmente la quantité d’azote minéral du sol, entrainant de ce fait une augmentation du prélèvement par les plantes. La compétition entre micro-organismes et plantes pour l’acquisition de l’azote minéral a été mise en évidence dans les milieux arctiques. La stérilisation des sols conduit en effet à une augmentation du
Introduction générale prélèvement de l’azote par les plantes (Schmidt et al., 1997) et l’apport d’azote minéral stimule la croissance et l’activité des micro-organismes (Jonasson et al., 1996). Ces résultats indiquent que dans les sols pauvres en éléments nutritifs, les micro-organismes représentent un puits important d’azote minéral et peuvent limiter la croissance des plantes. La disponibilité en azote minéral pour les plantes ne dépend donc pas uniquement de la minéralisation de la litière et de la matière organique du sol, mais aussi de leur capacité à entrer en compétition avec les micro-organismes du sol pour l’acquisition de l’azote minéral (Jonasson et al., 1996).
3‐2 Adaptations aux conditions climatiques
Les plantes des milieux subalpins et alpins ont développé des adaptations en réponse à ces contraintes environnementales. Ces adaptations sont de types morphologique, physiologique et phénologique.
321 Adaptations morphologiques
La végétation présente dans la zone alpine se répartit en quatre principaux types morphologiques: 1) les arbustes à port prostré, 2) les plantes herbacées graminoïdes (poacées et cypéracées), 3) les plantes herbacées pérennes en rosettes, et 4) les plantes en forme de coussin (Körner, 1999). Les plantes appartenant à ces quatre groupes peuvent être classées en différents types biologiques selon la position de leurs bourgeons pendant la période hivernale (Raunkiaer, 1934). Les types dominants sont les chaméphytes4, les hémicryptophytes5 et les nanophanérophytes6. La dominance de ces types biologiques dans ces milieux est due à la protection qu’offrent le sol et la couverture neigeuse aux bourgeons pendant la période hivernale. Leur port prostré et parfois en coussinet leur confère également une protection contre les vents. La miniaturisation des feuilles et la présence de poils est une autre caractéristique des plantes alpines qui permet de limiter la dessiccation et les dommages des rayonnements ultra-violets sur l’appareil photosynthétique.
4
Plantes dont les bourgeons passent l’hiver à quelques cm au dessus de la surface du sol. Plantes dont les bourgeons passent l’hiver à la surface du sol.
322 Adaptations phénologiques
Dans ces milieux, les différentes phénophases, i.e. débourrement, floraison et fructification, sont courtes et se produisent conjointement à la croissance végétative de la plante, en raison de la courte durée de la période favorable. La date de débourrement est essentiellement contrôlée par la date de fonte du manteau neigeux (Kudo, 1991). La croissance des plantes est ensuite conditionnée par la température, la disponibilité en eau et l’éclairement (Schlüssel & Theurillat, 2000). La plupart des plantes alpines se reproduisent de manière sexuée et asexuée. La reproduction végétative est principalement réalisée par rhizomes, propagules, bulbilles et stolons mais aussi, chez les arbustes, par marcottage (Escaravage et al., 1998). Elle représente un moyen de compenser le faible recrutement par graine observé dans ces milieux et de permettre la survie des génotypes (Körner, 1999).
323 Adaptations physiologiques
Les faibles températures altèrent le fonctionnement des processus physiologiques. Cependant, les plantes des milieux froids ont développé des adaptations qui rendent leurs processus physiologiques moins sensibles à la température que ne le sont ceux des plantes des milieux tempérés (Chapin, 1983). La température optimale de la photosynthèse est par exemple plus faible chez les plantes alpines. De plus, la photosynthèse est très peu sensible à une réduction de la température, ce qui leur permet de fixer du carbone même à des températures proches de 0°C et parfois même sous un couvert neigeux (Starr & Oberbauer, 2003). De ce fait, l’assimilation de carbone sur l’ensemble de la période de végétation est moins limitée par les effets directs de la température que par la durée et l’intensité de l’ensoleillement.
Le prélèvement des nutriments dans le sol diminue généralement avec la température. L’absorption des nutriments par les plantes des milieux arctiques ne semble cependant pas trop affectée par les faibles températures (Chapin, 1983). En effet, il a été montré que le prélèvement du phosphate dans ces milieux est mieux corrélé à la quantité disponible dans le sol qu’à la température (Chapin et al., 1978). Ceci semble indiquer que le taux de minéralisation, fortement réduit par la
Introduction générale température du sol, limite plus le prélèvement des nutriments que la température elle-même.
3‐3 Adaptations à la faible disponibilité des ressources dans le sol
331 Prélèvement des nutriments
De nombreuses plantes vivant sur des sols acides absorbent préférentiellement voire exclusivement l’azote sous forme d’ammonium (Aerts & Chapin, 2000). Cependant, plusieurs études ont montré que dans les milieux froids, le taux de minéralisation nette de l’azote organique est bien plus faible que le taux de prélèvement d’azote par les plantes (Dyck et al., 1987; Chapin et al., 1988), suggérant ainsi que les plantes prélèvent une quantité non négligeable d’azote organique, par exemple sous la forme d’acides aminés solubles (Chapin et al., 1993; Chapin FS, 1995; Schimel & Bennet, 2004).
Il a été suggéré que les plantes à faible taux de croissance relative7 (RGR) qui vivent dans les milieux pauvres investissent une part plus importante de biomasse dans le système racinaire que les plantes des milieux riches (Grime, 1979; Chapin, 1980; Poorter et al., 1990). Cependant, cette tendance semble varier fortement entre groupes taxonomiques (Garnier, 1991; Aerts & Chapin, 2000). La morphologie, notamment la longueur spécifique des racines8 (SRL), joue aussi un rôle important dans la stratégie de capture des nutriments. Certaines études ont montré que les plantes peu productives compensent la faible production de biomasse racinaire par une forte SRL (Aerts et al., 1991).
332 Croissance des plantes
Les plantes des milieux pauvres ont généralement un RGR inférieur à celui des plantes des milieux riches (Aerts & Chapin, 2000). Ceci est en partie dû à une allocation de biomasse dans les feuilles et à une surface spécifique des feuilles9 (SLA)
7 La production de biomasse par unité de temps et de biomasse.
inférieures (Westoby et al., 2002). Plutôt que de favoriser une croissance rapide, les traits fonctionnels qui caractérisent les espèces de milieux pauvres permettent d’augmenter la conservation des nutriments, notamment grâce à un faible turnover des feuilles, qui sont faiblement concentrées en nutriments et contiennent un part importante de composés secondaires pour lutter contre l’herbivorie (Aerts & Chapin, 2000).
4
Communautés végétales de l’étage subalpin Pyrénéen
4‐1 Description de l’étage subalpin Pyrénéen
Dans les Pyrénées, la zone subalpine est très étroite vers l’ouest et s’élargit vers les Pyrénées centrales. Elle est présente sur une bande d’environ 45 km de largeur au niveau du massif du Néouvielle (Fig. 3). L’étage subalpin Pyrénéen est particulièrement riche en espèces endémiques. Elles représentent en effet 34% des communautés végétales dans les Pyrénées centrales, contre seulement 24% dans l’étage alpin et 5% dans l’étage montagnard (Dupias, 1985). Selon H. Gaussen, l’étage subalpin Pyrénéen s’étend entre la limite supérieure des forêts denses (hêtraie-sapinière) et la limite supérieure des arbres (pin à crochets). Néanmoins, on considère généralement les arbrisseaux (rhododendrons, genévriers, raisin d’ours, myrtilles etc.) qui ne pénètrent pas dans l’étage alpin pour l’identification de la limite supérieure du subalpin. Dans les Pyrénées, l’étage subalpin est donc une zone de transition, caractérisée par le passage progressif des forêts denses à des îlots de pins à crochets (Pinus Uncinata) et des mosaïques composées de landes à éricacées et de pelouses. Dans sa partie inférieure, l’étage subalpin des Pyrénées centrales est composé d’un mélange de landes à éricacées (Rhododendron ferrugineum, Vaccinium myrtillus, Calluna vulgaris) et de peuplements de pins (Pinus sylvestris et uncinata). Dans sa partie supérieure, il est essentiellement dominé par des pelouses à Festuca eskia et Nardus stricta parsemées d’îlots de landes à R. ferrugineum.
Introduction générale
4‐2 Espèces étudiées
Dans ce travail de thèse, cinq espèces parmi les plus communes et les plus représentatives de l’étage subalpin Pyrénéen ont été étudiées.
421 Festuca eskia Ram.
F. eskia Ram. (Poaceae) est une plante orophyte vivace de 20 à 50 cm de haut, endémique des Pyrénées et des Monts Cantabriques. Elle forme des touffes compactes, raides et très piquantes la rendant peu appétante. Elle est fréquemment présente du sommet de l’étage collinéen à l’étage alpin, i.e. entre 500 et 3000 m d’altitude. On la retrouve néanmoins essentiellement à l’étage subalpin supérieur, sur des sols pauvres en éléments nutritifs et à pH acide, où elle compose des pelouses appelées gispetières. Cette espèce est à l’origine de deux grands types de pelouses acidophiles. Sur les fortes pentes exposées au sud, elle forme des associations végétales ouvertes en gradin (Gonzalo-Turpin, 2008). Son important réseau racinaire, deux à trois fois plus profond que celui du nard (Palmier et al., 1989) lui confère un avantage compétitif en présence d’un stress hydrique prolongé. Ce caractère morphologique lui permet entre autre de coloniser des milieux à réserves en eau faibles. Sa floraison a lieu en juillet et la pollinisation est anémogame. La reproduction se fait soit par voie sexuée, soit par voie asexuée (tallage).
Introduction générale 422 Nardus stricta L.
N. stricta L. (Poaceae) est une plante vivace formant des touffes compactes raides et piquantes de 10 à 30 cm de haut. On trouve cette espèce communément au dessus de 400 m d’altitude, de l’étage collinéen à l’étage alpin. Comme F. eskia, on la retrouve néanmoins principalement à l’étage subalpin, sur des sols pauvres en éléments nutritifs et acides, où elle constitue des pelouses appelées nardaies. C’est une espèce mésophile, pouvant subsister sur des terrains à conditions hydriques variables au cours de l’année. Cependant, cette plante, peu économe en eau en condition d’alimentation hydrique peu limitante (Palmier et al., 1989), reste vulnérable à des périodes de stress hydrique trop longues. La floraison a lieu de mai à juillet et la pollinisation est anémogame. La reproduction se fait soit par voie sexuée, soit par voie asexuée (tallage). Cette espèce est fréquemment associée à F. eskia dans les pelouses de l’étage subalpin.
423 Festuca nigrescens Lam.
F. nigrescens Lam. (Poaceae) est une plante herbacée vivace formant des touffes de 20-60 cm de hauteur. On trouve cette espèce aux étages montagnard, subalpin et alpin sur différents types de sol. Cependant, elle est particulièrement présente au dessus de 2200 m d’altitude, sur des zones à ressource en eau abondante. La floraison a lieu de mai à juillet et la pollinisation est anémogame. La reproduction se fait soit par voie sexuée, soit par voie asexuée (tallage).
Introduction générale 424 Rhododendron ferrugineum L.
R. ferrugineum L. (Ericaceae) est un arbuste sempervirent aux branches tortueuses et flexibles de 70-80 cm de hauteur. Cette espèce est fréquente dans les Alpes, les Pyrénées, les Apennins et le nord-est des Balkans. Elle nord-est en revanche très localisée dans le Jura méridional. Les feuilles persistantes sont localisées dans les 10-20 cm supérieurs du houppier. Elles présentent les caractéristiques d’une adaptation à la sécheresse : elles sont coriaces, recouvertes d’une épaisse cuticule et la présence d’écailles pédicellées sur la face inférieure recouvrant les stomates, limite ainsi la transpiration. La couleur rouille que prennent les écailles au cours de la première année des feuilles est à l’origine du nom de l’espèce. Cette espèce est largement distribuée dans les Alpes et les Pyrénées entre 1600 et 2200 m d’altitude (Ozenda, 1985) où il peut dominer les communautés végétales, particulièrement dans les zones où la pression de pâturage est faible ou nulle. Le débourrement et la floraison ont lieu simultanément au mois de mai-juin, quelques jours après la fonte du couvert neigeux. Comme la majorité des plantes de milieu alpin, cette espèce se reproduit à la fois par reproduction sexuée et par propagation végétative (Escaravage et al., 1998, Pornon et al., 2000). L'étude de la biologie de la pollinisation de cette espèce a révélé qu'elle est capable de se reproduire aussi bien par auto que par allogamie (système mixte de reproduction sexuée) (Pornon et al., 1997) . Les pollinisateurs les plus abondants sont les Diptères, suivi des Hyménoptères, principalement les abeilles (Escaravage & Wagner, 2004).
425 Trifolium alpinum L.
T. alpinum L. (Fabaceae) est une plante vivace, hémicryptophyte, de 5 à 15 cm de hauteur. Cette espèce est caractérisée par ses tiges souterraines épaisses et ligneuses à saveur sucrée (goût de réglisse). On retrouve cette orophyte sud-européenne de façon assez commune dans cinq massifs montagneux français (Alpes, Pyrénées, Massif Central, Cévennes, Corbières), de l’étage montagnard à l’étage alpin (de 1000 à 3000m d’altitude). Son optimum de croissance se situe à l’étage subalpin, sur des sols siliceux relativement acides et pauvres en éléments nutritifs. La floraison a lieu de juin à août et la pollinisation se fait par les insectes. Les espèces du genre Trifolium ont un gros système racinaire qui les rend compétitifs pour des minéraux autres que l’azote, notamment le phosphore qui est nécessaire pour la fixation symbiotique du N2 atmosphérique (Thomas &
Bowman, 1998). Selon la disponibilité an azote dans le sol, la fixation symbiotique peut apporter entre 60 et plus de 90% de l’azote total du trèfle (Peoples et al., 1995).
Introduction générale
5
Description des sites d’études
5‐1 Vallon d’Estaragne
511 Situation géographique
Le Vallon d’Estaragne (65) est situé dans la zone axiale des Pyrénées (Latitude N : 42º 48’ ; Longitude E : 0º 9’) en bordure du massif hercynien du Néouvielle (Fig. 4), entre le lac de Cap de Long et le lac d’Orédon (Fig. 5). Le vallon est orienté Nord-Sud et s’étend sur 2 km entre 1850 et 3000 m a.s.l. La partie haute du vallon, au-dessus de 2070 m, est constituée de trois cirques d’origine glaciaire :
• le cirque inférieur, qui s’étend de 2130 à 2200 m
• le cirque moyen, dont l’altitude varie entre 2190 et 2300 m • le cirque supérieur, au-dessus de 2350 m.
L’ensemble des travaux a été réalisé dans les cirques inférieur et moyen de la partie haute du vallon.
512 Sol et végétation
Le vallon se trouve sur la zone externe du pluton du Néouvielle (≈ 46 km2, largeur ≈ 2 km), composée pour l’essentiel de granodiorites métalumineuses à biotite + amphibole (Alibert et al., 1988). La roche mère du massif du Néouvielle a une composition typique des monzogranites (Tableau 1). Les composantes majeures en sont les quartz (environ 30%), les feldspaths potassiques (environ 25%) et les plagioclases (environ 35%) (Oliva et al., 2004). Les sols supra-forestiers du massif du Néouvielle ont été étudiés dans le vallon d’Estibère par Remaury (2000). Cette étude a mis en évidence la présence d’un type de sol particulier à horizon humifère de profondeur, alumineux de couleur chocolat, situé au contact de l’arène granitique, au-dessous d’un horizon ocre. Ils présentent généralement en surface, un humus de forme moder et un horizon organo-minéral de juxtaposition. L’horizon éluvial est, selon les cas, plus ou moins bien différencié.
La végétation de la partie haute du vallon est caractéristique de l’étage subalpin Pyrénéen. Elle est composée d’une mosaïque de pelouses parsemées de patches d’arbustes (essentiellement R. ferrugineum et V. myrtillus) et d’arbres (P. uncinata).
Tableau 1 Analyses chimiques de la roche mère granitique du massif du Néouvielle. Les valeurs sont exprimées en % pour les éléments majeurs et en ppm pour les éléments traces.
Monzogranite du Néouvielle
Oliva et al. (2004) Debon et al. (1995)
SiO2 71,01 68,9 Al2O3 15,64 15,36 Fe2O3 2,44 3,41 MnO 0,04 0,06 MgO 0,68 0,96 CaO 2,28 3,02 Na2O 3,19 3,02 K2O 4,15 4,02 TiO2 0,24 0,36 P2O5 0,09 0,08 LOI 0,57 0,84 Sr (ppm) 161 185 Rb (ppm) 187 166 Zr (ppm) 107 -
Introduction générale 513 Conditions climatiques
Les conditions climatiques qui règnent à cette altitude sont rigoureuses. L’enneigement dure en moyenne de la fin du mois d’octobre à la fin du mois de mai. Toutefois, le climat sur le site est relativement adouci par l’influence Ibéro-Mediterranéenne qui s’étend sur l’ensemble du massif du Néouvielle. Les précipitations annuelles sont de l’ordre de 1500 mm.
5‐2‐ La vallée de Bethmale
La vallée de Bethmale (42°51’N ; 1°4’E) est située dans les Pyrénées Ariégeoises à environ 15 km de Moulis et 20 km de St-Girons (Fig. 6). Le site est situé à environ 1600 m d’altitude en versant Nord. La végétation est une mosaïque de pelouses à N. stricta, F. eskia et F. nigrescens, et de landes à R. ferrugineum plus ou moins fermées. Le substratum rocheux est composé de formations métamorphiques de type gneiss-magmatite. Le site est caractérisé par une forte pression pastorale et des précipitations annuelles comprises entres 1500 et 2000 mm.
Fig. 5 Photographie aérienne et représentation en 3D du vallon d’Estaragne (source : Google Maps)
Fig. 6 Localisation du site de Bethmale (source : Google Maps).
Introduction générale
6
Objectifs de la thèse
L’objectif de cette thèse est d’étudier le prélèvement de l’azote et les réponses des plantes à la disponibilité de cet élément dans un habitat particulier, l’étage subalpin Pyrénéen. Ce milieu présente la particularité d’être pauvre en azote et pourrait donc être significativement affecté par les activités humaines qui, depuis plus d’un siècle augmentent la disponibilité de cet élément dans la majorité des écosystèmes terrestres (Vitousek et al., 1997; Suding et al., 2005). Ce travail est donc particulièrement important dans le contexte actuel, puisqu’il participe à l’amélioration de notre compréhension des mécanismes impliqués dans la réponse des plantes et des communautés végétales aux changements du milieu d’origines anthropiques.
Du fait de l’importance de l’azote dans le développement des plantes, des adaptations et des stratégies permettant d’optimiser l’utilisation de cette ressource ont vu le jour chez les végétaux supérieurs. Le travail de recherche sur un habitat pauvre en azote comme les pelouses subalpines permet donc d’étudier les traits ou les mécanismes qui confèrent à ces plantes une bonne « gestion » de cette ressource, ainsi que la manière dont les communautés végétales s’organisent autour de cette contrainte.
Nous nous proposons ici de répondre à cinq questions principales qui ont trait à l’acquisition et à l’utilisation de l’azote, et aux interactions inter-spécifiques relatives à la disponibilité de cet élément en milieu montagnard :
1. Comment le prélèvement de l’azote minéral par les plantes subalpines répond-il à une augmentation de la disponibrépond-ilité de cet élément dans le mrépond-ilieu ? Il a été proposé que dans les milieux pauvres en éléments nutritifs, la sélection repose moins sur la capacité à prélever rapidement les éléments qu’à les conserver. On peut donc penser que les plantes subalpines, qui ont évolué dans un milieu où la disponibilité en azote est faible, ont des exigences et des capacités de prélèvement de l’azote limitées. Cette hypothèse a été testée sur F. nigrescens.
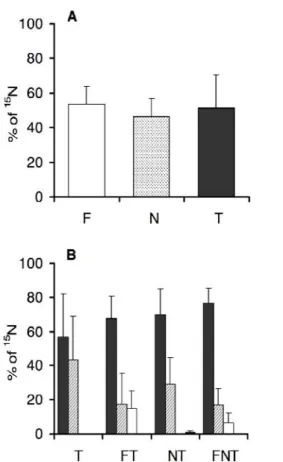
2. Quel est l’implication des espèces fixatrices d’azote atmosphérique dans la nutrition azotée des espèces non-fixatrices ? De nombreuses études ont montré que des flux de composés azotés plus ou moins directs ont lieu des espèces fixatrices vers les espèces non-fixatrices. Nous avons cherché à savoir dans
quelle mesure ces flux peuvent agir sur les interactions entre espèces dominantes des pelouses (ici N. stricta, F. eskia et T. alpinum) et influencer la structure des communautés végétales.
3. Comment certains traits ou mécanismes impliqués dans la conservation de l’azote, comme la durée de vie des feuilles ou la résorption, varient-ils avec la disponibilité en azote dans le sol ? Cette dernière peut-elle expliquer la variabilité de la durée de vie des feuilles à l’intérieur d’une même espèce sempervirente (Rhododendron ferrugineum) ?
4. Quelles sont les conséquences de la variabilité de la longévité foliaire sur la nutrition carbonée de cette espèce ?
5. La dynamique de l’azote dans les feuilles de R. ferrugineum est-elle similaire à celle d’autres éléments majeurs et traces ?
Pour répondre à ces questions, des expérimentations ont été conduites à la fois en serre et en milieu naturel, sur des espèces emblématiques de l’étage subalpin (voir introduction). Ces questions seront traitées successivement au travers de cinq articles. Ces articles sont réparties en trois parties, introduites par des rappels théoriques et/ou une synthèse bibliographique permettant de circonscrire la ou les problématiques abordées.
PARTIE
1
N
UTRITION AZOTEE ET INTERACTIONS
ENTRE PLANTES A L
’
ETAGE SUBALPIN
1
Introduction
1‐1 Origine de l’azote dans les écosystèmes
A l’échelle de la planète, la plus grande réserve d’azote est l’atmosphère, dans laquelle il se trouve majoritairement sous sa forme moléculaire (N2). L’azote
atmosphérique gagne les écosystèmes par le biais de deux voies principales : la fixation biologique par des organismes procaryotes, symbiotiques ou non, qui réduisent N2 et l’intègrent dans des composés organiques, et les retombées atmosphériques de composés azotés d’origines anthropique et/ou naturelle (éclairs).
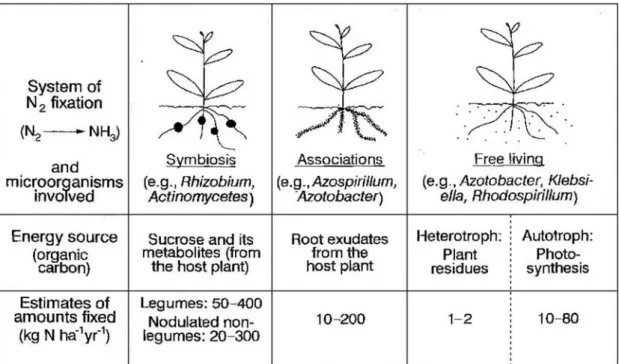
111 Fixation biologique
La fixation biologique est une source majeure d’azote pour de nombreux écosystèmes naturels (Lagerstrom et al., 2007; DeLuca et al., 2008). On estime qu’entre 90 et 130 millions de tonnes d’azote entrent dans les écosystèmes terrestres par ce biais chaque année (Vitousek et al., 1997). Trois types de stratégies de fixation de l’azote atmosphérique ont été recensés : la fixation symbiotique, l’association dans la rhizosphère et la fixation libre (Fig. 1-1). Dans les milieux où la compétition pour les ressources nutritives est intense, la fixation symbiotique d’azote moléculaire constitue un moyen considérable d’approvisionnement en azote, non seulement pour les espèces fixatrices, mais également pour les plantes qui se développent dans le même milieu. Ainsi, une étude a montré que dans certains milieux boisés, 20% de l’azote contenu dans les pins provenait du N2 atmosphérique
fixé par Alnus glutinosa (Arnebrandt et al., 1993). Les flux d’azote entre les espèces de la communauté peuvent être directs, via des champignons mycorhiziens connectant les systèmes racinaires de deux plantes, ou indirects par décomposition de la litière ou/et par exsudations racinaires de composés azotés (Paynel & Cliquet, 2003). Ces transferts sont généralement facilités lorsque les espèces sont spatialement proches ou que l’abondance relative des Fabaceae dans la communauté est importante (Brophy et al., 1987).
Dans les écosystèmes alpins ou dans les zones boréales, l’azote fixé par les micro-organismes libres représente une part importante de l’azote disponible pour les
Partie 1 Introduction
plantes (Haselwandter et al., 1983; DeLuca et al., 2002). Il a été montré que la fixation de l’azote atmosphérique est d’autant plus importante que les apports d’azote par les précipitations et la litière sont faibles (DeLuca et al., 2008). De plus, ces apports sont particulièrement importants dans les écosystèmes en phase de rétrogression10 (Lagerstrom et al., 2007).
A l’étage subalpin, la présence de légumineuses génère un apport d’azote non négligeable pour les communautés végétales (Holzmann & Haselwandter, 1988). Les Fabaceae peuvent fixer entre 70 et 100% de leur azote (Körner, 1999). Cependant, la contribution de la fixation symbiotique diminue avec l’altitude au profit de la fixation par les cyanobactéries libres (Holzmann & Haselwandter, 1988). Ceci résulte de la raréfaction des Fabaceae avec l’altitude (Körner, 1999). La fixation biologique de l’azote est diminuée par la présence d’azote biodisponible dans le sol (DeLuca et al., 2007), par le manque d’humidité (Chapin et al., 1991) et par les faibles températures (Holzmann & Haselwandter, 1988).
Fig. 1-1 Type, source d’énergie et capacité de la fixation biologique dans le sol (d’après Marschner, 1995).
112 Retombées atmosphériques
Depuis quelques décennies, on assiste à une intensification des retombées atmosphériques de composés azotés en raison de l’activité humaine (Reich et al., 2001; Manning et al., 2006). Ces apports d’azote provoquent des changements dans la structure et le fonctionnement des écosystèmes (Manning et al., 2006). Les communautés végétales peuvent être affectées par une diminution de la diversité (Gough et al., 2000; Suding et al., 2005) ou par le recul de certaines espèces au profit d’autres, possédant des traits plus avantageux face à un enrichissement du milieu en azote (Suding et al., 2005). Par exemple, les graminées ont tendance à supplanter les arbustes de la famille des Ericaceae dans les landes exposées à de fortes retombées azotées (Aerts & Berendse, 1988). Des apports d’azote similaires aux fortes retombées atmosphériques occasionnées dans certaines parties du globe (40-44 kg/(ha.an)) augmentent de manière significative la production de biomasse par les plantes (Manning et al., 2006). Cependant, cette augmentation n’est significative que pour les communautés végétales à forte diversité fonctionnelle (Reich et al., 2001). En revanche, les retombées azotées modifient les processus biogéochimiques du sol, comme le stockage de carbone et la minéralisation de la matière organique, quelle que soit la composition végétale (Reich et al., 2001; Manning et al., 2006). Dans les écosystèmes montagnards, les retombées sont en général momentanément immobilisées dans la couverture neigeuse pendant l’hiver. Les eaux de fonte peuvent donc être fortement chargées en ammonium et nitrate et fournir aux plantes une quantité d’azote considérable lors de leur croissance végétative (Körner, 1999).
1‐2 Dynamique de l’azote dans les sols
Le principal réservoir d’azote d’un sol est la matière organique. En effet, sous sa forme minérale, l’azote a une faible durée de vie dans le sol car il est soit lessivé (NO3-), soit prélevé et converti en matière organique par les plantes ou les
micro-organismes (NO3-, NH4+). La minéralisation de l’azote organique peut-être de nature
physico-chimique (conditions de pH très bas et de températures élevées) ou biologique par les macro- et micro-organismes du sol. La première étape de ce processus - l’ammonification - est le résultat de l’activité métabolique de
micro-Partie 1 Introduction
organismes hétérotrophes utilisant des substrats carbonés comme source d’énergie (Fig. 1-2). Ces mêmes microorganismes puisent une partie de leur azote dans des composés organiques simples (acides aminés, acides nucléiques, etc.) résultant du clivage, par des enzymes extracellulaires, de macromolécules azotées trop lourdes pour être assimilées (Schimel & Bennet, 2004). Lorsque l’azote n’est pas limitant, la quantité de NH4+ dans le sol augmente et une population de micro-organismes
chimiolithotrophes peut se développer. L’ammonium est alors converti en ion nitrate (NO3-) : c’est la nitrification. Les plantes entrent alors en compétition avec les
microorganismes hétérotrophes pour le NH4+ et le NO3- et avec les microorganismes
lithotrophes nitrifiants pour le NH4+ (Kaye & Hart, 1997). Le prélèvement suivi de
l’assimilation de l’azote minéral par les micro-organismes hétérotrophes est appelé organisation ou immobilisation. Ce processus diminue le pool d’azote minéral disponible pour les plantes. La différence entre la minéralisation brute (ammonification + nitrification) et l’organisation correspond à la minéralisation nette. Elle est sous l’influence du climat (température et humidité) et des caractéristiques édaphiques (texture, nature et quantité de matière organique) (Jarvis et al., 1996; Bechtold & Naiman, 2006). La disponibilité de l’azote pour les plantes dépend donc 1) de la taille du réservoir d’azote organique, 2) du taux de minéralisation de l’azote organique par les microorganismes du sol, lequel dépend des conditions physico-chimiques qui règnent dans le sol, et 3) du taux de prélèvement par les plantes et du lessivage.
Fig. 1-2 Cycle de l’azote dans le sol.
1‐3 Prélèvement et assimilation de l’azote par les plantes
131 Prélèvement
L’azote présente la particularité d’être disponible dans le sol sous plusieurs formes : minérale, nitrate (NO3-) et ammonium (NH4+), et organique (N-organique).
La plupart des plantes peuvent absorber toutes les formes d’azote solubles présentes dans le sol (Atkin, 1996). Cependant, bien que le prélèvement d’azote organique soit probablement sous-estimé pour certains types d’écosystèmes (Aerts & Chapin, 2000; Schimel & Bennet, 2004), il est communément admis que les plantes des zones tempérées absorbent préférentiellement l’azote minéral (Marschner, 1995; Britto & Kronzucker, 2005). Dans les sols bien aérés des agro et écosystèmes, l’azote minéral est essentiellement prélevé sous sa forme la plus oxydée (NO3-), mais certaines
Partie 1 Introduction
réduite NH4+ (Aerts & Chapin, 2000; Britto & Kronzucker, 2005). La capacité des
différentes espèces à prélever telle ou telle forme d’azote est en relation avec la forme majoritaire présente dans leur habitat naturel (Aerts & Chapin, 2000). Le prélèvement cellulaire d’azote est la résultante d’un influx (« entrée ») et d’un efflux (« sortie ») se produisant sur la membrane plasmique. Influx et efflux résultent du fonctionnement de transporteurs protéiques spécifiques de chaque forme d’azote.
L’absorption de NO3- (influx) est un processus actif quelle que soit la
concentration de l’ion dans le milieu (symport NO3- - 2 H+) principalement en raison
du potentiel électrique négatif qui règne dans le cytosol des cellules. Le caractère actif (symport avec H+) ou passif (uniport) du prélèvement de NH4+ dépend de sa
concentration dans le milieu. Pour les deux formes de l’azote minéral comme pour les autres ions minéraux majeurs, la cinétique de l’influx en fonction de la concentration de l’ion dans le milieu est complexe et fait apparaître deux mécanismes (« Epstein »). Le premier opère à faible concentration et l’influx (dont l’évolution rappelle celle d’une cinétique de saturation d’activité enzymatique de type Michaelis-Menten) sature à des valeurs peu élevées (mécanisme 1, « High Affinity Transport System »). Pour des concentrations supérieures à quelques centaines de µM, l’influx redémarre et ne semble pas saturer même pour des concentrations très élevées (plusieurs dizaines de mM ; mécanisme 2, « Low Affinity Transport System »). De très nombreux transporteurs de nitrate et ammonium ont été identifiés depuis 1993 (approche moléculaire). La plupart de ces protéines sont spécifiques d’un des deux mécanismes mais il est à noter qu’un même transporteur peut correspondre aux mécanismes 1 et 2. On parle dans ce cas de transporteur « dual ».
A moyen terme, une carence en azote a pour conséquence d’augmenter la capacité du prélèvement racinaire en raison de la levée de l’inhibition sur la synthèse de certains transporteurs par l’azote organique endogène (Touraine & Gojon, 2001). Sur le long terme, le mécanisme 1 étant inductible par son « substrat » et l’impact sur le fonctionnement et le développement racinaire devenant prépondérant, les conséquences sont complexes.
132 Réduction et assimilation de l’azote minéral
Une particularité du nitrate est qu’il a la propriété d’induire la synthèse des protéines impliquées dans son prélèvement et son assimilation (Aerts & Chapin, 2000; Britto & Kronzucker, 2005). Après son absorption par les cellules racinaires, le nitrate est réduit en ammonium sous l’action de deux métallo-protéines : la nitrate- et la nitrite-réductase. La première réduit le nitrate en nitrite dans le cytosol et la seconde le nitrite en ammonium dans les plastes. Ces deux réductions successives peuvent avoir lieu selon les espèces dans les feuilles et/ou dans les racines (Gojon et al., 1991). Cependant, les espèces de la famille des Éricacées ne possèdent pas ces deux enzymes au niveau des feuilles. Pour ces espèces, la réduction du nitrate se fait donc exclusivement dans les parties racinaires.
L’assimilation de l’ammonium est réalisée chez les végétaux supérieurs par la voie Glutamine synthétase-Glutamate synthase (GS-GOGAT) dans les racines et dans les feuilles. Ce cycle d’assimilation, associé à des réactions de transamination, est à la base de la synthèse des acides aminés à partir de l’oxoglutarate et de l’ammonium provenant du prélèvement racinaire, de la réduction du nitrate, de la photorespiration ou/et de la fixation symbiotique du N2 atmosphérique pour les
espèces fixatrices (Fig. 1-3).
133 Transport de l’azote dans la plante
Contrairement au nitrate, on considère généralement que l’ammonium n’est pas ou très peu transporté des racines vers les parties aériennes via le xylème. Une majorité de l’ammonium qui est prélevé par les racines est en effet rapidement assimilée sur place. L’investissement en carbone pour le transport de l’azote des racines vers les feuilles ou les fruits est réduit du fait de l’implication de composés à faible poids moléculaire et à fort ratio N/C. Ce sont essentiellement la glutamine (2N/5C), l’asparagine (2N/4C) et l’arginine (4N/6C). Cependant, certaines légumineuses utilisent l’uréide allantoïne et l’acide allantoïque (4N/4C) (Lamaze et al., 1985).