Université de Sherbrooke
Développement d’outils de prédiction des complications et des récidives de l’infection à Clostridium difficile
Par
Claire Nour Abou Chakra Programme de sciences cliniques Concentration Santé communautaire
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.)
en sciences cliniques
Sherbrooke, Québec, Canada Janvier, 2017
Membres du jury d’évaluation
Président : Pr. Alan Cohen, Ph.D., Département de médecine de famille,
Centre de recherche sur le vieillissement et Centre de recherche clinique du CHUS Membre externe au programme : Pr Tamàs Fülöp, M.D., Ph. D.
Service de gériatrie, Département de médecine Membre externe : Pr. Rodica Gilca, M.D., Ph.D.
Département de médecine sociale et préventive, Faculté de médecine, Université Laval
Directeur de recherche : Dr. Louis Valiquette, M.D., MSc. Co-directeur de recherche : Dr. Jacques Pépin, M.D., MSc., Département de microbiologie et infectiologie, FMSS
RÉSUMÉ
Développement d’outils de prédiction des complications et des récidives de l’infection à Clostridium difficile
Par
Claire Nour Abou Chakra Programme de sciences cliniques
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de philosophiae doctor (Ph.D.) en sciences cliniques, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
Depuis 2002, une augmentation des taux d’issues défavorables de l’infection à
Clostridium difficile (ICD) a été attribuable à l’émergence de la souche NAP1/BI/R027. Il
est indispensable d’identifier les facteurs de risque de développer des complications (ICDc) et des récidives (ICDr), et de pouvoir les prédire lors du diagnostic afin d’optimiser le traitement. Le projet de recherche a comme objectifs: i) l’identification des facteurs de risque pour le développement d’ICDc et ICDr et ii) le développement et la validation d’un outil de prédiction à partir de variables mesurées dans les 48h du diagnostic d’une ICD. Méthode: Une cohorte multicentrique prospective de patients adultes hospitalisés pour une ICD. Les données suivantes ont été recueillies: i) démographiques; ii) comorbidités; iii) traitements et procédures reçus dans les 2 mois avant le diagnostic; iv) paramètres cliniques, vi) biochimiques, hématologiques et vii) microbiologiques (ribotypage). Un suivi à 30 et 90 jours a été effectué. Les facteurs de risque ont été identifiés par des modèles multivariés de régression logistique et d'analyse de survie. La méthode de validation croisée a été utilisée pour la dérivation et la validation interne. Différents modèles ont été comparés selon l’aire sous la courbe ROC (ASC), l’erreur de prédiction (EP) et les paramètres de performance. Un score prédictif a été dérivé à partir du modèle optimal. Résultats: Au total, 1380 patients ont été inclus dont 96% suivis 90 jours. Une ICDc a été observée chez 8% et une ICDr chez 26%. La souche R027 représentait 52% des souches caractérisées. Les ICDc sont associées à un âge ≥80 ans, un rythme cardiaque >90/min, un rythme respiratoire >20/min, globules blancs (GB) <4 et ≥20×109/L, albumine sérique <25 g/L, urée sérique >7 mmol/L, et CRP ≥150 mg/L. Les ICDr sont associés à l'âge ≥ 65 ans, à l’exposition à des macrolides et/ou clindamycine, CRP ≥150 mg/L, R027, et une hospitalisation ≥14 jours suivant l'ICD. Un sous-groupe de 1038 cas complets a été utilisé pour la modélisation prédictive. Le modèle optimal contenait l’âge ≥80 ans, GB ≥12×109/L, albumine sérique <26 g/L et urée sérique >7 mmol/L, avec une ASC de 0,84 et une EP de 6%. Un score variant entre 0 et 17 points a été construit. En validation, un score 10 points présentait une sensibilité de 50% (IC95% = 28-72), une spécificité de 85% (81-89), une valeur prédictive positive de 17% (7-27) et une valeur prédictive négative de 96% (94-99). Conclusions: En utilisant une large cohorte prospective multicentrique et plusieurs étapes de modélisation prédictive et de validation interne, nous avons identifié les facteurs associés aux ICDc et ICDr et dérivé un score prédictif des ICDc ayant une performance acceptable. Au moment du diagnostic de l’ICD, ces facteurs sont à considérer pour envisager le traitement le plus optimal afin de prévenir ces issues.
SUMMARY
Development and validation of clinical prediction tool for complicated and recurrent Clostridium difficile infection
By
Claire Nour Abou Chakra Clinical sciences Program
Thesis presented at the Faculty of medicine and health sciences for the obtention of Doctor degree diploma philosophiae doctor (Ph.D.) in Clinical sciences, Faculty of medicine and
health sciences, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 A significant increase in Clostridium difficile infection (CDI) unfavourable outcomes was observed since 2002 and was associated with the emergence of the strain NAP1/BI/R027. Identifying patients at high risk of developing complications (cCDI) and recurrences (rCDI), and predicting these outcomes early in the course of illness could improve clinical decision-making. The main objectives of this research were to: i) identify risk factors for cCDI and rCDI, and ii) develop and validate a clinical prediction rule for cCDI using predictors measured within 48h of CDI diagnosis.
Methods: Adult inpatients with confirmed CDI diagnosis in 10 acute care hospitals, were enrolled in a prospective cohort. Data at enrolment were collected: demographics, underlying illnesses, past medical and drug history (two months prior to CDI), clinical signs, blood tests, and C. difficile strain type. A follow-up was completed on day 30 and 90 after enrolment. Risk factors were identified by multivariate logistic regression and survival analyses. Split-sample technique was used for training and validation sets. Several predictive models were derived and assessed in both sets by AUC/ROC, prediction error (PE), and performance parameters. A predictive score was built using the optimal predictive model.
Results: A total of 1380 patients were enrolled and 96% had 90 days follow-up. cCDI was observed in 8% and rCDI in 26%. R027 was identified in 52% of patients. Age ≥80 years, heart rate >90/min, respiratory rate >20/min, white cell count <4 or ≥20 × 109/L, albumin <25 g/L, blood urea nitrogen >7 mmol/L, and C-reactive protein (CRP) ≥150 mg/L were independently associated with cCDI. Age ≥65 years, increased CRP, exposure to macrolides/clindamycin, R027, and prolonged hospital stay were associated with rCDI. A sub-group of 1038 complete cases was used for predictive modelling. In the training set, the optimal model with 6% PE and AUC 0.84 included age≥80, WBC≥12x109/L, BUN7mmol/L, and serum albumin <26 g/L. A predictive score was built with minimum 0 and maximum 17 points. A score 10 points showed 50% sensitivity (95%CI, 28-72), 85% specificity (81-89), 17% (7-27) positive predictive value, and 96% (94-99) negative predictive value.
Conclusion: Through a large multicenter prospective cohort and multiple modelling approached, independent risk factors of complications and recurrence of CDI were identified. We derived a predictive score that included easily available measures at the bedside and showed acceptable performance. At time of CDI diagnosis, these predictors could be used by clinicians to identify patients at higher risk and adjust for the most optimal treatment that could prevent unfavourable outcomes.
À meem et tous les beaux jours au Québec
« Evidence based medicine is the conscientious, explicit, and judicious use of current best evidence in making decisions about the care of individual patients.
The practice of evidence based medicine means integrating individual clinical expertise with the best available external clinical evidence from systematic research.[…]
By best available external clinical evidence we mean clinically relevant research, often from the basic sciences of medicine, but especially from patient centred clinical research into the accuracy and precision of diagnostic tests (including the clinical examination), the power of prognostic markers, and the efficacy and safety of therapeutic, rehabilitative, and preventive regimen. » (Sackett et al. 1996)
TABLE DES MATIÈRES
Résumé ... iii
Summary ... iv
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations ... xi
Introduction ... 1
I. Recension des écrits ... 2
I.1 L’infection associée à Clostridium difficile ... 2
I.1.1 Pathogénicité ... 2
I.1.2 Facteurs de risque d’acquisition ... 4
I.1.3 Méthodes de diagnostic ... 5
I.1.4 Traitements ... 6
I.1.5 Réaction immunitaire ... 8
I.1.6 Épidémiologie ... 10
I.1.7 Récidive(s), complications et décès ... 13
I.1.8 Facteurs de risque des issues défavorables ... 14
I.1.8.1 Effet des souches bactériennes ... 15
Article 1 ... 18
I.1.9 Fardeau économique ... 57
I.2 Les outils de prédiction ... 58
I.2.1 Développement et validation ... 59
I.2.2 Outils de prédiction des issues de l’ICD ... 65
Article 2 ... 66
I.2.2.1 Mise à jour sur les outils de prédiction ... 88
Hypothèse/problématique ... 94
II. Projet De Recherche ... 95
Question de recherche ... 95
Objectifs ... 95
II.1 Matériel et méthodes ... 96
Schéma de l’étude ... 96
Critères d’inclusion ... 96
Critères d’exclusion ... 96
Recrutement des patients et recueil des données ... 97
Données recueillies à l’inclusion ... 97
Données de suivi ... 98
Taille de l’échantillon ... 99
Considérations éthiques ... 99
II.2 Résultats ... 101
II.2.1 Facteurs de risque ... 101
II.2.1.1 Les complications ... 101
Article 3 ... 102
II.2.1.2 Les récidives ... 128
II.2.1.2.1 Méthodes d’analyse ... 129
II.2.1.2.2 Résultats ... 130
II.2.1.2.3 Discussion ... 142
II.2.2. Scores de prédiction ... 146
II.2.2.1 Méthodes d’analyses ... 147
II.2.2.2 Résultats des analyses préliminaires ... 148
Article 4 ... 151 Discussion ... 174 Retombées et contribution ... 184 Perspectives de recherche ... 185 Remerciements ... 186 Références ... 187 ANNEXES ... 199
ANNEXE 1- Réponse immunitaire innée à l’ICD ... 200
ANNEXE 2- Revue des études évaluant l’association entre les souches de C. difficile et les issues défavorables en analyses multivariées ... 201
ANNEXE 3- Équipes de recherche ayant participé au projet et description des centres ... 207
ANNEXE 4- Questionnaire d’inclusion ... 209
ANNEXE 5- Questionnaire de suivi ... 219
ANNEXE 6- Caractéristiques des patients à risque et résultats des associations bivariées en analyse de survie entre les covariables et le risque de récidive ... 223
ANNEXE 7- Courbes LML pour le risque de récidive parmi les patients à risque et évaluation de la proportionnalité ... 230
ANNEXE 8- Invitation envoyée aux experts pour participer à l’enquête de sélection des prédicteurs de l’ICDc ... 233
LISTE DES TABLEAUX
Tableau 1-Taux moyen d’incidence de l’ICD estimé dans les provinces et territoires
canadiens (2012) ... 12
Tableau 2- Description des outils de prédiction récents ... 91
Tableau 3- Évaluation de la qualité des outils de prédiction récents ... 93
Tableau 4- Incidence des récidives en fonction de l’année d’inclusion ... 131
Tableau 5- Description des récidives et de leurs traitements ... 132
Tableau 6- Description des récidives en excluant les cas sans traitement(s) ... 133
Tableau 7- Table de survie pour la 1ère récidive à 15 jours d’intervalle ... 134
Tableau 8- Facteurs associés avec les ICDr à travers les modèles de Cox multivariés chez tous les patients à risque ... 139
Tableau 9- Facteurs associés avec les ICDr à travers les modèles de Cox multivariés chez les cas d’ICD primaires ... 141
Tableau 10- Résultats du MAG ajusté ... 148
LISTE DES FIGURES
Figure 1- Courbe de survie pour la 1ère récidive ... 134 Figure 2- Courbe de risque ... 135 Figure 3- Courbe de fonction de risque d’ICDr selon l’âge et le ribotype des souches ... 136 Figure 4- Modèle de Random Forest obtenu avec tous les prédicteurs (A) et importance des prédicteurs (B) ... 149 Figure 5- Comparaison des méthodes prédictives ... 150
LISTE DES ABRÉVIATIONS
ASC Aire sous la courbe
BUN Blood urea nitrogen, urée sérique
CDT Clostridium difficile transférase
CRP Protéine C réactive (de l’anglais «C-reactive proteine»)
ECP Électrophorèse sur champs pulsés
EIA Enzyme immunoassay
EIQ Écart interquartiles EP Erreur de prédiction
GB Globules blancs
HR Rapport des risques instantanés (de l’anglais «Hazards ratio») IC Intervalle de confiance
ICD Infection à Clostridium difficile ICDc ICD compliquée
ICDr ICD récidivante ou récidive de l'ICD IDSA The Infectious Diseases Society of America
Ig Immunoglobuline(s)
IPP Inhibiteurs de la pompe à protons
IV Intraveineux
LR Rapport de vraisemblance (de l’anglais «Likelihood ratio») MAG Modèle additive généralisé
MLG Modèle linéaire généralisé
MLST Typage par séquençage multilocus (de l’anglais «Multilocus Sequence Typing») MLVA Multiple-Locus Variable number tandem repeat Analysis
NAP1 North American Pulse-field type 1
OR Rapport des cotes (de l’anglais «Odds ratio»)
PCR Polymerase chain reaction
PCT Procalcitonine
PH Proportional hazards
PO Per os (voie orale)
REA Restriction endonuclease analysis
ROC Receiver operating characteristic curve
SI Soins intensifs
VPP Valeur prédictive positive VPN Valeur prédictive négative
INTRODUCTION
L’infection à Clostridium difficile (ICD) est à ce jour la première cause des diarrhées nosocomiales dans les pays occidentaux, et représente entre 20 et 30% des diarrhées associées à une exposition à des antimicrobiens (2). Certains patients colonisés par C. difficile demeurent porteurs asymptomatiques représentant entre 7,4% et 14% des patients hospitalisés, et ces taux augmentent durant les périodes épidémiques (3, 4).
Jusqu’au début des années 2000, l’ICD était une infection nosocomiale relativement commune (2). En 1997, son incidence au Canada dans un réseau d’hôpitaux sentinelles a été estimée à 5,9/1000 admissions (5). À partir de 2000-2002, les hôpitaux canadiens et américains (38 États) ont connu une augmentation du nombre et de la sévérité des cas d’ICD notamment chez les personnes âgées (6-8). Une augmentation significative des récurrences a également été observée (9). En Estrie, l’incidence de l’ICD chez les patients de 65 ans et plus est passée de 102/100 000 personnes en 1991-92 à 866/100 000 personnes (7) et une incidence moyenne de 22,5/1000 admissions a été enregistrée en 2004 dans 12 hôpitaux québécois (6). Cette éclosion dans les hôpitaux nord-américains a été associée à une souche hypervirulente nommée NAP1/BI/027 (North American Pulse-field type 1 en électrophorèse sur gel à champs pulsé, profil BI en analyse d’endonucléase de restriction, et ribotype 027) (2). De nouveaux traitements et vaccins sont en cours de développement (10). Cependant, il n’existe toujours pas d’outils cliniques recommandés qui permettraient aux médecins d’identifier les patients les plus à risque d’une évolution défavorable afin d’optimiser précocement le traitement.
Cette thèse porte principalement sur les facteurs de risque des complications (ICDc) et des récidives de l’ICD (ICDr), et le développement d’un score de prédiction clinique de ces issues. À travers deux revues systématiques de la littérature (11, 12), nous avons identifié les faiblesses méthodologiques dans les études sur les facteurs de risque de ces issues et dans celles qui avaient tenté de développer un outil de prédiction clinique. Nous proposons une étude pronostique qui pourrait combler ces lacunes, en utilisant une cohorte multicentrique dans deux provinces canadiennes formée spécifiquement pour ces objectifs. De plus, nous avons testé l’effet de l’utilisation de définitions strictes des ICDc et ICDr et celui des définitions plus larges fréquement retrouvées dans d’autres études, et nous avons également évalué le potentiel prédictif de marqueurs inflammatoires.
Dans les sections suivantes, nous présentons un aperçu de l’infection et des facteurs favorisant son acquisition, les traitements actuels, son épidémiologie et son fardeau économique. Une section est consacrée aux facteurs de risque des issues défavorables et aux outils de prédiction. Enfin, le projet de recherche est présenté à travers une synthèse et des articles décrivant les résultats.
I.RECENSION DES ÉCRITS
I.1 L’infection associée à Clostridium difficile
Isolée en 1935, C. difficile est une bactérie en forme de bacille, Gram positif anaérobie stricte, qui forme des spores et se transmet par voie oro-fécale (13). Une grande majorité de la forme végétative est détruite par l’acidité gastrique, mais les spores y survivent. Les sels biliaires (tel que le taurocholate) favorisent la germination des spores et c’est la nouvelle forme végétative qui colonise les parois du côlon (2). L’ICD se manifeste par des diarrhées modérées à sévères qui peuvent être accompagnées de fièvre, de douleurs abdominales, de vomissements, d’un choc septique et d’une colite pseudomembraneuse (1). Chez les patients âgés, la fièvre peut être absente et les diarrhées sont accompagnées par la confusion, de l’anorexie et de la fatigue (14). Bien que le C. difficile soit très fréquemment retrouvé dans les matières fécales des nouveau-nés et des enfants jusqu’à l’âge de deux ans, ces derniers développent moins l’infection que les adultes probablement parce qu’ils n’ont pas encore les récepteurs nécessaires à l’action des toxines (2).
I.1.1 Pathogénicité
La pathogénicité du C. difficile est principalement due à la production des toxines A et B qui ont un effet cytotoxique et pro-inflammatoire à plusieurs niveaux des cellules du côlon (2, 15). Ces toxines sont codées (gènes tcdA et tcdB) et régulées par un ensemble génétique (tcdC, tcdD, et tcdE) appelé locus de pathogénicité ou PaLoc (2). L’effet cytotoxique se traduit par la rupture des jonctions intracellulaires provoquant la perte de l’intégrité de la couche protectrice et l’apoptose des cellules épithéliales, des hémorragies et des perforations coliques (16). Une fois en contact avec les cellules intestinales, les macrophages et les mastocytes, les toxines sont aussi capables d’induire la libération des cytokines et médiateurs pro-inflammatoires. Ces derniers vont recruter les cellules
inflammatoires en circulation comme les neutrophiles. L’action combinée des cytokines et des histamines augmente la perméabilité de la couche endothéliale des vaisseaux provoquant ainsi la sécrétion de fluides. L’afflux massif des neutrophiles dans la muqueuse et, dans certains cas plus sévères, leur mouvement dans la lumière intestinale, va contribuer à la formation de pseudomembranes observées en endoscopie et confirmant le diagnostic d’ICD (17). Une troisième toxine est produite par environ 6% des souches (région génétique CdtLoc), appelée toxine binaire (ou CDT pour C. difficile transférase), et possède une fonction ADP-ribosylase avec comme principal substrat l’actine du cytosquelette (18). En inhibant, entre autres, la polymérisation de l’actine, cette toxine entraine ultimement la destruction du cytosquelette ce qui favoriserait la colonisation du côlon. Cependant, le rôle de la toxine binaire dans le mécanisme infectieux n’est toujours pas précisé, et son effet sur la sévérité et les issues de l’ICD est encore peu étudié (18).
D’autres facteurs de virulence ont été identifiés, incluant des éléments de motilité telle que la capsule et la flagelle, des éléments d’adhésion à la surface épithéliale du côlon (ex. protéines de surface, adhésine, …etc.) (15). Il faut noter que les récepteurs des toxines sur les cellules humaines ne sont toujours pas bien identifiés (19). Une protéine membranaire (LSR) retrouvée dans les cellules du foie et du côlon a été identifiée comme récepteur cellulaire potentiel de la CDT (18).
Les variations génétiques dans PaLoc par rapport à la souche de référence VP10463 ont permis de répertorier à ce jour 34 profils différents ou toxinotypes (20). La souche NAP1 présente une délétion de 18 nucléotides dans le gène du facteur qui régule la production de toxines (anti-sigma; tcdc) et une mutation (frame-shift Δ117) induisant un facteur tronqué à cause d’un codon stop, ce qui augmenterait les quantités produites de toxines pendant toute la phase de germination de la bactérie (21). Il a été démontré in vitro que cette souche produit jusqu’à 16 fois plus de toxine A et 23 fois plus de toxine B (22). Ces augmentations seraient reliées à une durée prolongée de production de toxines (21). Au niveau épidémiologique, le rôle des souches sur les issues cliniques de l’ICD est discuté dans la section I.1.8.1.
I.1.2 Facteurs de risque d’acquisition
Les recherches réalisées à partir des années 70 (1974) avaient établi un lien entre la prise d’antibiotiques et le développement de colites pseudomembraneuses (2). Le « scénario typique » est que suite à l’exposition aux antibiotiques, l’équilibre de la flore intestinale est modifié (dysbiose), ce qui permet la colonisation par le C. difficile (2). Dans une revue systématique avec méta-analyse des études publiées entre 2002 et 2012, l’acquisition d’ICD nosocomiale était associée à une exposition aux fluoroquinolones, aux céphalosporines (de 2ème, 3ème et 4ème génération), aux carbapénèmes, à la clindamycine et aux sulfamides, majoritairement entre 28 jours et 3 mois avant une hospitalisation, avec un risque relatif entre 1,7 et 3,2 (23). Le risque relatif d’acquisition est encore plus élevé durant l’antibiothérapie et jusqu’à un mois après son arrêt (entre 6,7 et 10,4) (24).
Deux autres facteurs importants augmentent le risque d’ICD : l’âge et la durée d’hospitalisation auxquels s’ajoutent les comorbidités, les traitements immunosuppresseurs et antipéristaltiques, les chirurgies et procédures gastriques (2). Un modèle appliqué sur les dossiers médicaux électroniques a été développé afin d’identifier la prédisposition des patients à l’ICD (25). Ce modèle comprend 4 variables (les diarrhées, un épisode antérieur, l’utilisation de plusieurs antibiotiques dans les 3 mois précédents et le transfert depuis d’autres types de résidences) et présente une validité non négligeable (ASC = 0,905 ; IC95% = 0,9-0,91). Parmi les patients hospitalisés, l’incidence de l’ICD est 5 à 10 fois plus élevée chez les personnes âgées que les adultes plus jeunes (26). Avec l’âge, la diversité de la flore naturelle est réduite, laissant de la place à des bactéries opportunistes et résistantes (27). En outre, au cours d’une année dans les résidences pour personnes âgées, entre 47 et 79% des résidents rapportaient avoir reçu au moins un traitement par des antibiotiques (28). Une étude ontarienne dans 363 résidences de soins de longue durée a montré que 21% des résidents recevaient une antibiothérapie de plus de 90 jours, probablement plus en prophylaxie qu’en traitement (29). En comparant la composition de la flore intestinale chez des individus colonisés ou infectés par C. difficile à celle des donneurs sains (personnes ne présentant pas de diarrhées), l’infection par la souche NAP1 semble être associée à une dysbiose intestinale plus importante que les autres souches (30). Par ailleurs, l’exposition aux antiulcéreux, notamment les inhibiteurs de la pompe à protons (IPP), est un facteur controversé quant au risque de développement d’ICD. Les méta-analyses sur le sujet
montrent une grande hétérogénéité entre les études et un manque d’ajustement à de potentiels facteurs confondants, cependant une alerte a été émise par la FDA (« The U.S.
Food and Drug Administration ») en 2012 suggérant un diagnostic d’ICD chez les patients
exposés à des IPP développant des diarrhées qui ne se résolvent pas (31-33).
I.1.3 Méthodes de diagnostic
Les guides de pratiques recommandent que, lorsque des patients hospitalisés, et/ou ayant récemment reçu des antibiotiques présentent des diarrhées intenses et fréquentes, un échantillon de selles soit prélevé et testé pour la présence de toxines pour confirmer l’ICD, sans préciser un test particulier (1). Il existe plusieurs tests diagnostiques et c’est un domaine qui connait une évolution rapide avec les techniques moléculaires. Les tests détectent la présence de la bactérie dans les matières fécales du patient, ou celle des toxines, ou celle des gènes des toxines par les techniques moléculaires.
À ce jour, le test de cytotoxicité ou la détection de l’effet cytotoxique sur une culture de cellules humaines, et la culture toxigénique (culture du C. difficile et détection subséquente de toxines) sont les tests de références. Ces tests détectent les souches toxinogènes, mais comme la majorité des tests disponibles, ne distinguent pas entre un porteur asymptomatique et un état infectieux (34). Il existe d’autres tests du type immunologique («Enzyme Immunoassay» ou EIA; «Enzyme-linked Immunosorbent Assay» ou ELISA), incluant un EIA détectant la présence de la glutamate déshydrogénase (GDH), que toutes les souches du C. difficile produisent sur leur membrane. Ces tests sont rapides, montrent l’existence du C. difficile dans les matières fécales, mais présentent une faible spécificité et ne distinguent pas les souches toxinogènes, et les tests EIA qui détectent les toxines A et B sont peu sensibles. Les méthodes moléculaires sont de plus en plus utilisées et portent sur l’amplification des gènes (test d’amplification des acides nucléiques ou TAAN) incluant la méthode d’amplification en chaîne par polymérase (ACP ou PCR pour «Polymerase chain reaction») et l’amplification isothermique («Loop-mediated isothermal
amplification» ou LAMP). D’après une méta-analyse les comparant à la culture
toxigénique, ces tests moléculaires présentent une sensitivité moyenne de 95% et une spécificité moyenne de 99% (35). Or ces tests détectent les gènes des toxines et non pas la présence des toxines actives et donc un état infectieux.
La rapidité des tests pour obtenir le résultat (quelques heures pour la PCR vs. 48-96 heures pour la culture toxigénique), le coût et les équipements nécessaires sont des éléments également considérés dans le choix des centres hospitaliers. Cependant, en plus de la sensibilité élevée, il faut tenir compte du taux de faux positifs engendrés par les tests (présence de bactérie et/ou de toxines ou leurs gènes) qui mènent à un certain biais de détection, surtout avec la fréquence de porteurs sains qui auraient des diarrhées sévères d’autres origines (36). Le fait de se baser uniquement sur la détection de la bactérie, dont certaines souches sont non toxinogènes, mènerait à une prise en charge médicamenteuse qui n’est pas nécessaire.
Le test de la GDH est souvent utilisé dans une approche en deux temps, ce qui permet l’exclusion rapide des spécimens négatifs, mais qui demande une confirmation des tests positifs par un test toxigénique (cytotoxicité, EIA, ou PCR) (1). Selon la prévalence du C. difficile, la valeur prédictive positive (VPP) de la technique PCR pourrait atteindre 93% (37). L’impact de l’utilisation des tests diagnostiques moléculaires a été évalué dans des études prospectives. Polage et al. avaient conclu à travers leur étude sur 1416 adultes hospitalisés qu’un test de PCR positif mais avec un EIA négatif n’est pas suffisant pour prescrire un traitement pour l’ICD (36). Dans l’étude de Longtin et al. sur 1321 spécimens de 888 patients, l’utilisation de la PCR pour le gène de la toxine B seule a augmenté de 50% l’estimation du taux d’incidence de l’ICD dans un centre hospitalier de la région de Québec par rapport à une approche en deux temps : GDH-EIA contre toxine A ou B, ou GDH-cytotoxicité de la toxine B (38). Une autre étude sur une large cohorte de 6522 patients suggère d’utiliser un test hautement sensible pour identifier les patients colonisés tel que le test de la GDH, et confirmer l’infection par des tests très spécifiques pour détection des toxines (39).
I.1.4 Traitements
Le principal traitement de l’ICD est antibiotique : les guides de pratique recommandent le métronidazole comme traitement de première ligne (500 mg, 3 fois par jour (t.i.d) pendant 10 à 14 jours) et la vancomycine (125 mg-500 mg per os (PO) q.i.d. pendant 10 à 14 jours) en cas de détérioration de l’état du patient ou de la sévérité de
l’épisode (1, 40). Un autre antibiotique, la fidaxomicine (200 mg PO b.i.d pendant 10 jours), a été récemment commercialisé (en 2012 au Canada, pour les patients adultes).
La métronidazole agit au niveau de l’ADN du C. difficile et inhibe sa division, alors que la vancomycine inhibe la synthèse des peptidoglycanes de la paroi. Les deux présentent une efficacité comparable d’environ 90% pour le traitement de l’épisode initial (2, 41). La fidaxomicine, un macrocycle ayant un effet bactéricide puissant, inhibe la synthèse de l’ARN et des protéines, et altèrerait moins la flore intestinale naturelle en étant inactive contre les bactéries Gram négatif anaérobies. Un autre de ses avantages serait l’inhibition de la production et l’expression des gènes pour la germination des spores du C. difficile (42). La vancomycine semble agir plus efficacement in situ contre la forme végétative et réduit les quantités de toxines, mais est moins efficace contre les spores (43).
Une meilleure inhibition de la germination des spores et un effet moindre sur le microbiome intestinal pourraient expliquer le taux de récidives moindre dans les 28 jours suivant le diagnostic de l’ICD observé avec la fidaxomicine dans les essais cliniques (15% vs 25% avec la vancomycine; p = 0,005) enpermettant une restauration plus rapide de la flore tout en ayant uneinnocuité comparable (44, 45). Cependant, la fidaxomicine n’a pas d’indication approuvée pour le traitement en cas de colites pseudomembraneuses ou d’ICD fulminante et, en utilisant les mêmes données des essais cliniques randomisés, cet antibiotique n’a pas démontré un effet plus important que la vancomycine contre la souche NAP1 (46), ni un rapport coût-efficacité suffisant pour être inscrit sur la liste des médicaments remboursés par la Régie de l’assurance maladie du Québec : pour un traitement de 10 jours, le coût de la fidaxomicine s’élève à $1584 CAD comparés à $3,60 pour le métronidazole, et le coût de la vancomycine (14 jours) varie entre $38 à $153 en milieu hospitalier et entre $290 et $1160 en milieu communautaire (47). La fidaxomicine est inscrite sur la liste des médicaments d’exception et n’est recommandée qu’en cas d’allergie à la vancomycine (www.ramq.gouv.qc.ca).
Ceci étant dit, des stratégies thérapeutiques pourraient être adaptées à l’état et aux comorbidités du patient. À ce jour, la vancomycine (PO ou intrarectale) combinée au métronidazole (intraveineux (IV)) est recommandée pour les cas sévères et/ou compliqués. Un traitement prolongé par la vancomycine (42 à 56 jours) avec des doses quotidiennes réduites graduellement est recommandé pour les épisodes récurrents (1), vu que, outre
l’incidence de l’ICD et de la sévérité qui l’accompagne, la récurrence des épisodes est un défi de taille pour les cliniciens. L’épidémiologie des récidives est présentée dans la section I.1.7. Il existe d’autres antibiotiques contre l’ICD, tel que la rifaximine, la nitazoxanide, la tigécycline, et l’acide fusidique, mais le peu de données cliniques et/ou leur disponibilité restreinte limitent leur utilisation au Canada. Il existe des approches thérapeutiques qui ne nécessitent pas d’agents antibiotiques et qui visent essentiellement les récidives : les anticorps monoclonaux qui neutraliseraient les toxines et renforceraient la réponse immunitaire (48), la transplantation fécale, et les probiotiques. Il n’y a pas encore assez d’études qui démontrent leur efficacité et leur coût est assez élevé, ce qui limite leur utilisation (10, 41). Récemment, un anticorps monoclonal humain neutralisant la toxine B qui semble prometteur dans la prévention des récidives dans les essais cliniques multicentriques (bezlotoxumab), fait l’objet d’une évaluation par la FDA pour une éventuelle commercialisation (49). La transplantation fécale (ou FMT pour « Fecal
microbiota transplantation »), une technique aussi utilisée en cas de récidives, consiste à
transplanter la flore intestinale d’un donneur sain (généralement un proche du patient) pour repeupler la flore du patient altérée par la prise d’antibiotiques. Cette méthode démontre une efficacité élevée à travers les études sur des cas de récidives (85%), mais la majorité des données proviennent de séries de cas (50) et peu d’essais randomisés sont réalisés (51). De plus, cette technique nécessite de l’équipement et du personnel entrainé, en plus des désagréments pour le patient. Bien que le donneur et les matières fécales soient testés au préalable, le risque de transmission d’infections n’est pas exclu. Les probiotiques, contenant des bactéries ou des levures non pathogènes vivantes, recommandés comme adjuvants pour la prévention de l’ICD et des récidives, semblent avoir une efficacité (effet protecteur), surtout certains groupes de bifidobacterium ou de lactobacilles, mais la qualité des études démontrant cette efficacité est sous-optimale (52, 53).
I.1.5 Réaction immunitaire
Un aperçu de la réaction immunitaire innée contre le C. difficile et ses toxines est présenté dans l’Annexe 1. Bien que cet aspect de l’infection soit encore peu connu, de nombreux médiateurs sont impliqués principalement par l’action des toxines (54). En étudiant 36 marqueurs, les niveaux fécaux d’IL-8 et IL-23, de lactoferrine et de
calprotectine étaient significativement plus élevés chez des patients avec ICD que des patients ayant d’autres causes de diarrhées (55).
Peu d’études ont évalué la relation entre le niveau de la réponse immunitaire et les issues cliniques de l’ICD sur un échantillon assez large avec des analyses multivariées pour en tirer des conclusions claires. Dans une étude prospective sur 63 patients, une association a été observée entre les récidives et une faible concentration des immunoglobulines M (IgM) antitoxine A (OR ajusté à la sévérité de l’ICD = 9 ; IC95% = 2-49) (56). Dans une autre étude, en comparant le niveau d’IgM contre les protéines de surface (SLP) chez des patients ayant un seul épisode aux cas de récidives (n = 34), un faible niveau d’IgM au jour 3 après le diagnostic était associé aux récidives (OR ajusté à l’âge, la sévérité de l’ICD et aux antibiotiques prescrits pendant le suivi = 25; IC95% = 2-376) (57). Mesurés le jour du diagnostic et après 18 à 21 jours, une autre étude prospective sur 114 patients a montré qu’un faible niveau d’IgA anti-toxine B et anti-toxine A et d’IgG anti-toxine A ajustés à l’âge et aux comorbidités sont associés à un risque de récidive (OR = 5 (1-20), 6 (1,4-26), et 5,4 (1,2-23) respectivement) (58). Dans une autre étude, les récidives sont associées à une leucopénie (définie comme un nombre absolu de globules blancs (GB) <1x109/L) mesurée à la fin du traitement de l’ICD dans une étude prospective de 100 patients (OR ajusté à l’âge, au sexe, sérologie positive contre les toxines = 2 (IC95% = 1,1-4) (59). La mortalité dans les 30 jours et toutes causes, a été associée à un niveau faible d’IgG anti-toxine A mesuré 12 jours après le diagnostic (n = 86; OR ajusté à l’âge et aux comorbidités = 0,97; IC95% = 0,95-0,99) (60).
Avec l’effet protecteur des anticorps contre l’action des toxines, plusieurs vaccins prévus pour renforcer la réaction immunitaire sont en cours de développement (48, 61), mais seuls deux ont atteints à date des phases avancées d’essais cliniques : CdiffenseTM, une anatoxine A et B (toxines neutralisées) pour laquelle le recrutement multicentrique est en cours pour la prévention de l’ICD primaire chez des patients à risque (NCT01887912, www.clinicaltrials.gov), et ACAM-CDIFF™ une autre anatoxine A et B pour la prévention des récidives dans les 3 mois suivant son injection dont l’efficacité et l’innocuité de phase II a été complété (NCT00772343). Parmi les autres possibilités, on retrouve un vaccin avec les toxines A et B génétiquement modifiées (essais en phase II), des toxines recombinantes,
des antigènes ciblant d’autres éléments pathogènes tels que les protéines de surfaces et du flagelle, mais dont le développement est encore au niveau de modèle animal (61).
I.1.6 Épidémiologie
Comme indiqué précédemment, la détection du C. difficile dans les matières fécales ne confirme pas un état infectieux. Cette bactérie peut être acquise sans avoir d’effets, ce qui représente le concept de porteur asymptomatique. Chez un individu exposé aux facteurs de risque notamment la dysbiose (§ I.1.2), la bactérie agit par pression de sélection et colonise le côlon (16). Dans la grande majorité des cas, l’ICD apparait chez des individus colonisés: une méta-analyse a démontré un risque de développer l’ICD chez les individus colonisés, au moment de l’hospitalisation, par une souche toxigénique 6 fois plus élevé (IC95% = 4,2-8,2) par rapport aux individus non colonisés (8 études, un total de 2858 patients) (4). Le délai entre l’acquisition de la bactérie et l’apparition des symptômes est peu documenté. Une étude ontarienne sur 127 cas d’ICD hospitalisés a estimé un délai médian de 9 jours (écart interquartile (EIQ) = 5-17 jours) entre l’admission et l’apparition des symptômes (62). En étudiant la transmission du C. difficile dans le même département hospitalier à travers un séquençage génétique, Walker et al. ont trouvé que la durée médiane d’incubation précédant une potentielle transmission était de 18 jours avec un EIQ entre 8 et 42 jours (63).
La transition entre le portage asymptomatique, la colonisation et l’apparition des symptômes est aussi peu documentée. Une revue de 125 études publiées entre 1980 et 2015 a souligné le manque de définition standard des différents états, et a estimé la prévalence de colonisation asymptomatique selon les populations (64): elle varie entre 18 et 90% chez les nouveau-nés et les enfants, entre 0 et 15% dans la population générale adulte et entre 0 et 51% chez les personnes âgées institutionnalisées. En milieu hospitalier, la colonisation varie entre 0,6 et 15% chez les personnes âgées, et entre 4 et 29% chez les autres classes d’âge. Une étude canadienne (5232 patients admis dans 6 hôpitaux au Québec et en Ontario; 2006-2007) a estimé à 4% la fréquence de colonisation (65). Dans une récente étude réalisée dans un seul centre à Québec, 4,8% des patients dépistés aux urgences étaient porteurs sains (66). À l’aide d’une approche quasi-expérimentale, cette étude a démontré que le dépistage et l’isolation des porteurs sains limiteraient la dissémination des
spores et réduirait graduellement l’incidence de l’ICD nosocomiale de 7% dans ce centre (par période de 4 semaines de surveillance) par rapport au taux global de la province.
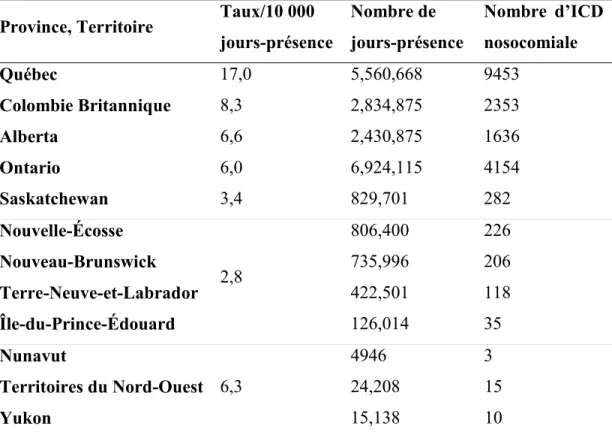
Au Canada, d’après le Programme canadien de surveillance des infections nosocomiales (PCSIN) basé sur les déclarations volontaires de 60 hôpitaux dans les 10 provinces, le taux d’incidence national de l’ICD nosocomiale en 2014 était de 4,3/10 000 jours-patient (2847 cas, données préliminaires) (67). Jusqu’à présent, il n’existe pas de système de surveillance national qui regroupe les données provinciales. Dans une étude récente, la prévalence médiane des cas d’ICD a été estimée à 1,1/100 patients hospitalisés (min 0- max 4,5) dans 159 hôpitaux et 34,150 patients à travers les provinces sans variation significative par rapport à 2010 et 2012 (68). Une étude à visée économique a estimé le taux d’incidence moyen de nouvelles infections dans les provinces en 2012, et ce à partir d’algorithmes et non pas à partir des données de surveillance provinciale disponibles (Tableau 1- Traduction libre) (69). Les nombres de cas et les taux d’incidence d’ICD par province ont été surestimés (70). Au Québec, un système de participation obligatoire pour la déclaration des cas d’ICD hospitaliers a été instauré en 2004 suite au pic épidémique (2004-2005) et à l’émergence de la souche NAP1. Entre 2010 et 2013, le taux d’incidence de l’ICD nosocomial était d’environ 7/10 000 patients-jours (70) comparé à 17/10 000 d’après Levy et al. (69). Entre avril 2015 et mars 2016 (année fiscale), 4529 cas d’ICD ont été déclarés par 95 hôpitaux (71). Malgré la diminution considérable des taux d’incidence depuis le pic épidémique, les données de surveillance indiquent un taux d’incidence nosocomial de l’ICD de seulement 5,9/10 000 jours-présence (n = 2977 cas, 66% de tous les cas) et de 3,3/10 000 jours-présence en 2015-2016 dans les deux installations pédiatriques (71). L’Ontario a instauré en 2008 un système de déclaration obligatoire et une publication des taux d’ICD de chaque centre hospitalier (72). Le taux moyen provincial était aussi moins élevé avec 2,2/10 000 jours-présence en août 2016 (n = 185 cas) variant entre 2,3 et 3,5/10 000 jours-présence entre janvier 2013 et décembre 2015 (73).
Contrairement au Royaume-Uni, où environ 14165 cas ont été rapportés en 2014-2015 correspondant à un taux d’incidence de 15/100 000 jours-présence alors que ce taux national était de 90/100 000 en 2007-2008 (74), l’incidence de l’ICD aux États-Unis
augmente avec encore un demi-million de cas chaque année (2011-2012). Il n’existe pas de système de surveillance national aux États-Unis non plus, les taux d’incidence sont estimés à partir d’échantillons provenant de 10 régions et considérés représentatifs (75). Le taux ajusté d’ICD nosocomiale était estimé à 95,3/100 000 habitants (IC95% = 86-105) en 2011 et à 6,3/100 000 en pédiatrie (IC95% = 5-8).
Tableau 1-Taux moyen d’incidence de l’ICD estimé dans les provinces et territoires canadiens (2012)
Province, Territoire Taux/10 000 jours-présence Nombre de jours-présence Nombre d’ICD nosocomiale Québec 17,0 5,560,668 9453 Colombie Britannique 8,3 2,834,875 2353 Alberta 6,6 2,430,875 1636 Ontario 6,0 6,924,115 4154 Saskatchewan 3,4 829,701 282 Nouvelle-Écosse 2,8 806,400 226 Nouveau-Brunswick 735,996 206 Terre-Neuve-et-Labrador 422,501 118 Île-du-Prince-Édouard 126,014 35 Nunavut 6,3 4946 3 Territoires du Nord-Ouest 24,208 15 Yukon 15,138 10
Le nombre de cas au Manitoba a été utilisé comme référence. Le taux d’incidence y était de 63,5/100,000 population avec 807 cas en 2012 d’après les rapports de surveillance de 2013.
Bien que l’ICD demeure une infection principalement nosocomiale, de plus en plus d’études recensent des cas acquis en communauté. Les guides de pratique considèrent un cas d’ICD comme acquis en communauté lorsqu’un patient n’a pas eu de contact connu avec un centre de soins depuis 4 à 12 semaines (1). Au Québec, 20% des cas déclarés en 2015-2016 (n = 909) ont été considérés d’origine communautaire chez les patients hospitalisés, mais diagnostiqués moins de 72 heures après l’admission et n’ayant aucun lien
avec un milieu de soin dans les 28 jours précédents (71). L’exposition aux antibiotiques et aux corticostéroïdes, certaines comorbidités telles que les maladies inflammatoires de l’intestin et l’insuffisance rénale y sont des facteurs associés (méta-analyse de 12 études) (76). En utilisant les données de surveillance de 2011 dans 9 États américains, l’incidence des cas acquis en communauté a été estimée entre 40 et 139/100 000 habitants selon les régions (77). Cette étude a démontré qu’une réduction de 10% de la prescription des antibiotiques entrainerait une diminution de 17% des cas d’ICD. Le taux ajusté des cas acquis en communauté a été estimé entre 30,7 (IC95% = 15,1-47,7) et 41,3 (23,6-60,9)/100 000 habitants (78). Cependant, ces taux d’incidence sont moins élevés dans d’autres pays (1,5% aux Pays-Bas, 2,1% au Royaume-Uni et 29% en Australie) (79).
I.1.7 Récidive(s), complications et décès
Les données épidémiologiques rapportent généralement l’incidence des épisodes d’ICD déclarés sans distinguer les épisodes primaires des épisodes récurrents. Pourtant, un des aspects importants qui ont accompagné l’éclosion de la souche NAP1 était le taux plus élevé de récidives (9). Un taux médian de récidives de 22% variant entre 12% et 64% a été identifié à travers 26 études ayant estimé le risque de récidives en analyses multivariées (Article 1- Abou Chakra et al. PLoS ONE 2014) (12). Une autre revue de 39 études entreprises entre 2001 et 2010 a montré un taux moyen de récidive de 19% (80). Ce taux était plus élevé dans les études nord-américaines qu’européennes et asiatiques (30,6 % vs. 27,6% et 14,7% respectivement; p <0,001). Le taux moyen d’échec au traitement initial (persistance des symptômes) était de 26,8%. Une revue systématique plus récente a identifié un risque médian de récidive de 22% (variant entre 10 et 51%) dans 33 études (81). Dans une étude rétrospective de tous les cas d’ICD diagnostiqués au CHU de Sherbrooke entre 1998 et 2013 (1527 épisodes), le risque d’une première récidive a été estimé à 25% (dans les 14 à 60 jours suivant le diagnostic d’un épisode initial), d’une seconde à 38% et une troisième à 29% (82). Le risque de récidives multiples (2 ou plus) a été estimé à 9% (n = 128 patients). Environ la moitié des premières récidives et le tiers des secondes étaient sévères selon la définition des lignes directrices de l’IDSA (GB ≥15x10³/μL et/ou élévation de la créatinine sérique ≥ 50%) (1).
D’autres complications plus importantes peuvent survenir suite à une ICD, telles qu’une perforation colique, un mégacôlon toxique, un besoin de colectomie, partielle ou totale, et un état de choc. Le taux médian de complications et/ou d’ICD sévère (incluant ou pas la mortalité) se situait à 18% (entre 7% et 48%) à travers 15 études observationnelles et le risque médian de mortalité dans les 30 jours était de 19% (14 études) et variait entre 8% et 53%. Ce risque était de 38% chez les patients ayant besoin de colectomie ou d’admission aux soins intensifs (SI) (Article 1). D’après deux autres revues, le taux de mortalité attribuable à l’ICD dans les 30 jours suivant l’apparition des symptômes variait entre 5,7 et 6,9%, allant jusqu’à 37% chez les patients hospitalisés (83, 84).
Au Québec, depuis 2008, la déclaration est obligatoire pour les décès (toutes causes) survenant dans les 30 jours après le diagnostic des ICD d’origine nosocomiale, les complications et les colectomies. Ainsi 381 décès (14%), 23 colectomies (0,8%) et 80 transferts aux SI (2,9%) liés à l’ICD ont été déclarés en 2015-16 (71). Aux États-Unis, le taux national de mortalité toutes causes a été estimé à 8,9/100 000 habitants chez les cas d’ICD nosocomiale en 2011 (IC95% = 5-13) mais n’était que de 0,7/100 000 (IC95% = 0,4-0,9) parmi les cas acquis en communauté, sans noter de décès chez les patients de moins de 45-65 ans (75).
I.1.8 Facteurs de risque des issues défavorables
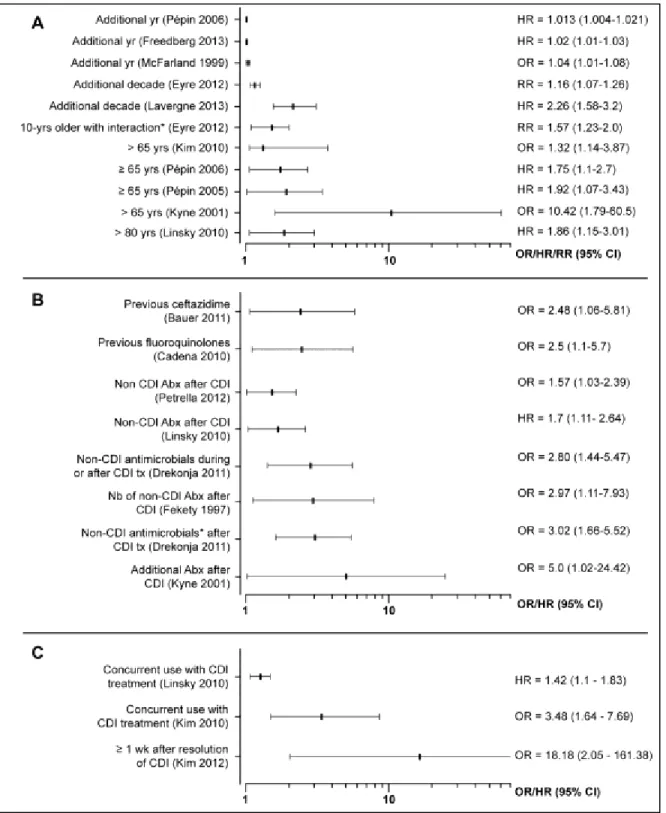
Nous avons effectué une revue systématique des études ayant procédé à des analyses multivariées permettant d’estimer les facteurs de risque de récidive(s),de complications, de la mortalité et de l’échec du traitement de l’ICD (12). Un sommaire suivi de l’article publié sont présentés dans la section suivante (Article 1).
Depuis la fin de la recherche électronique effectuée pour cette revue, nous avons identifié de nouvelles études qui respectaient les critères d’inclusion. Comme dans les études précédentes, l’âge et l’utilisation d’IPP ont été retrouvés associés à un risque plus élevé de récidives dans 3 études chacun avec un taux de récidives entre 10 et 26% (85-88). Dans notre étude rétrospective sur les récidives multiples, la sévérité de l’épisode initial a été identifiée comme facteur de risque de première récidive (HR ajusté à l’âge, à l’année de diagnostic = 1,6; CI95% = 1,3-2) (82). L’âge et l’utilisation d’antibiotiques pour d’autres infections ont été associés aux complications dans deux études (85, 89). D’autres facteurs
ont été associés avec les complications et la mortalité dans une seule étude chacun (comorbidités, leucocytose et diminution de l’albumine sérique).
I.1.8.1 Effet des souches bactériennes
En plus du toxinotypage ou l’étude des variations génétiques dans les gènes des toxines A et B, il existe plusieurs méthodes pour caractériser les souches du C. difficile, les plus récentes identifient des variations génétiques en analysant le génome bactérien entier ou certains gènes, mais ayant une faisabilité et un niveau de discrimination variable (90).
La technique d’électrophorèse sur gel à champs pulsé (ECP) est la technique de référence en Amérique du Nord. Avec l’analyse par endonucléase de restriction (REA), ces techniques portent sur la coupure du génome par des enzymes et la lecture du profil des produits d’ADN en électrophorèse. Le ribotypage est la technique de référence en Europe, avec un projet de standardisation des procédures d’identification et de typage des souches à travers les centres participants dans 34 pays (European Clostridium difficile infection
surveillance network (ECDIS-net)). Cette technique cible les variations dans la séquence
ADN d’une région hautement conservée à travers l’évolution entre les gènes codant pour les ARN ribosomaux 16S et 23S. Plus de 200 ribotypes ont été identifiés à ce jour (91), certains ont été systématiquement associés à la présence de toxine binaire, tels que les ribotypes 027, 078, et 023 (18). La technique MLVA (« Multiple-Locus Variable number
tandem repeat Analysis ») se base sur la variation du nombre de séquences répétées en
tandem (entre 2 et 9 paires de bases (pb)) dans 7 loci utilisés pour identifier des profils et construire des dendrogrammes permettant d’établir des liens entre les souches. La technique MLST (« Multilocus sequence typing ») consiste à analyser la séquence de sept gènes conservés dans des régions de 400 à 500 pb. Il existe d’autres techniques ciblant des gènes particuliers mais elles sont moins fréquemment utilisées, du moins dans les études observationnelles, telles que la technique AFLP (« Amplified Fragment-Length
Polymorphism »), le typage du gène de la flagelline (fliC) et du gène codant un précurseur
des protéines de surface (slpA).
Plus récemment, le séquençage génomique complet (« Whole genome sequencing ») fournit une multitude d’informations qui ne sont pas disponibles avec les autres techniques, et permet de distinguer une récidive d’une réinfection, mais nécessite une expertise
technique et bio-informatique pour l’interprétation des résultats, en plus du coût élevé du matériel. Avec la MLVA, le séquençage génomique présente un potentiel pour l’étude de la transmission et des éclosions du C. difficile au niveau populationnel (90, 92, 93).
La souche NAP1 (pulsovar A) représentait 58% (n = 236) des souches analysées au Québec en 2015 (n = 407 à partir des 10 premiers échantillons de selles ayant un test positif pour les toxines soumis par 69 centres hospitaliers (communication personnelle avec Dre Cindy Lalancette, microbiologiste, Identification bactérienne et épidémiologie moléculaire, Laboratoire de santé publique du Québec) et entre 40 et 50% des souches identifiées en Ontario. Dans 10 régions américaines, la souche NAP1 représentait 27% des souches typées, 34% des cas nosocomiaux et 21% des cas d’origine communautaire (75). Les données de surveillance rapportent une augmentation du ribotype 027 dans de nombreux pays européens, où il était le plus fréquent (12% de 866 isolats provenant de 39 sites dans 22 pays) (94). De plus, des analyses phylogéographiques ont démontré que 2 lignées de souches résistantes aux fluoroquinolones ont été transmises de l’Amérique du Nord vers l’Europe et l’Australie (95). L’éclosion de la souche NAP1 a été associée à des taux plus élevés de sévérité, de récidive et de mortalité. Toutefois, d’autres études menées sur de larges échantillons n’ont pas démontré une association significative avec ces issues (Article 1). De plus, le tiers des études incluses dans la revue systématique (23 études) a rapporté le type des souches bactériennes impliquées et seules 14 de ces études l’ont inclus dans les analyses statistiques. Ainsi nous avons conclu à une association entre le type de souches et les récidives, mais différentes méthodes de typage ont été utilisées. L'ICDc a été associée aux ribotype 018 et 056. Seule la mortalité à 30 jours a été associée au ribotype 027 dans 5 études.
Les tableaux 2.1-2.3 de l’annexe 2 présentent un recensement (non-exhaustif) plus récent des études ayant analysé l’association entre le type de souche du C. difficile et l’issue clinique en analyses multivariées. En plus des études identifiées dans la revue systématique, une seule étude a retrouvé une association significative entre le ribotype 027 et la mortalité attribuable à l’ICD (89) et plusieurs études ont retrouvé une association significative mais avec une mortalité toutes causes (Tableau 2.3, Annexe 2). La sévérité a été associée avec le ribotype 027 et le profil NAP1 dans une seule étude chacun avec un risque de 1,7 par rapport aux autres ribotypes (89, 96).
Plusieurs éléments devraient être pris en compte dans la lecture des résultats de ces études principalement les différences dans la définition de l’issue et la technique utilisée pour le typage, la variation des souches et de l’incidence de l’ICD dans le temps (période de recueil des échantillons) et l’espace (pays, ville, centre et nombre de centres), et le nombre de souches typées. La plupart des études ont été effectuées dans un seul centre notamment dans les études qui n’ont rapporté que des comparaisons univariées. La majorité des études portant sur des données de surveillance avaient évalué rétrospectivement la mortalité toutes causes. Les différences entre les résultats des études pourraient aussi s’expliquer par la diversité génétique importante du C. difficile (97), des éventuelles mutations non-détectées par les méthodes de typage à faible pouvoir discriminatoire, et la diminution de l’incidence de l’ICD suite à des mesures de contrôle de l’infection, notamment lorsque des issues telles que les complications sont de faible fréquence.
Par ailleurs, l’association entre chacune des issues défavorables et la toxine binaire n’a été significative que dans une seule étude (98-100). Or, la présence du gène n’implique pas forcément une production in vivo de la toxine binaire, et il n’y a pas encore de trousse commerciale pour la détection de cette toxine dans les matières fécales comme les essais immunologiques ou moléculaires pour la détection des toxines A et B (18).
Article 1
Risk Factors for Recurrence, Complications and Mortality in Clostridium difficile Infection: A Systematic Review
Auteurs de l’article: Claire Nour Abou Chakra, Jacques Pépin, Stéphanie Sirard, Louis Valiquette.
Statut de l’article: publié. PLoS One 2014; 9(6): e98400.
Avant-propos: Toutes les étapes de la recherche électronique des publications ont été réalisées par C.N. Abou Chakra. Elle a également réalisé l’extraction des données (en double avec Mme Stéphanie Sirard), leur synthèse et le principal de la rédaction sous les conseils et la supervision du Dr Pépin et Dr Valiquette. Tous les coauteurs ont révisé le manuscrit et donné leur accord pour sa publication et son intégration dans cette thèse. L’article a été publié sous licence Creative Commons (CC BY).
Résumé : Nous avons réalisé une revue systématique des études publiées entre 1978 et octobre 2013 ayant procédé à des analyses multivariées permettant d’estimer les facteurs de risque de récidive,complications, mortalité et échec du traitement de l’ICD.
Nous y avons inclus 68 études : 18 qui avaient identifié les facteurs de risque de récidive(s), 13 les facteurs des complications (incluant la mortalité), 18 les facteurs de la mortalité seule et 6 l’échec du traitement.
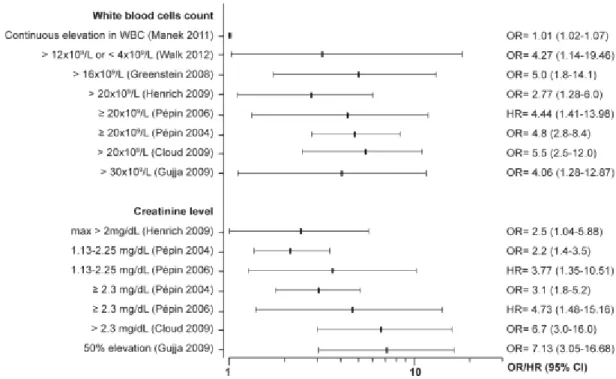
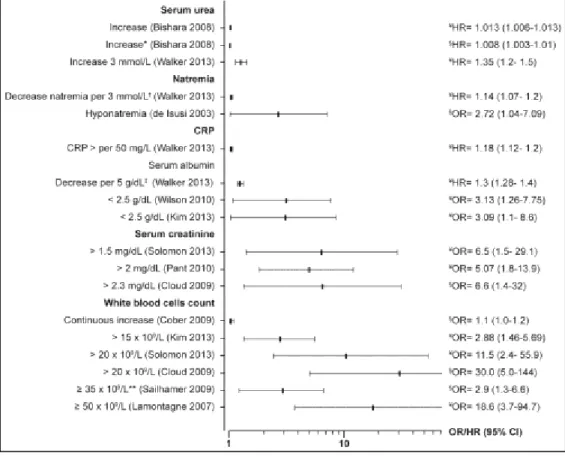
En synthétisant les facteurs à partir d’au moins 3 études, les récidives sont associées à l’âge > 65 ans (risque entre 1,3 et 10,4), à l’exposition à des antimicrobiens après l’épisode initial (risque entre 1,6 et 5), ainsi qu’à l’utilisation concomitante d’IPP (risque entre 1,4 et 18,2). Les complications (incluant ou pas la mortalité) sont aussi associées à l’âge (risque ~3,3), aux comorbidités, à l’augmentation du nombre de GB (risque entre 2,7 et 5,5) et de la créatinine sérique (risque entre 3 et 7). La mortalité dans les 30 jours est associée à l’âge, aux comorbidités, à plusieurs biomarqueurs et au ribotype 027 (risque entre 1,3 à 10,4). De nombreux autres facteurs sont associés aux issues défavorables, mais chacun est retrouvé dans une ou deux études seulement. De plus, 45 des études incluses ont utilisé des cohortes rétrospectives et des petits échantillons (taille médiane = 128 patients). Comme critères de qualité, nous avons identifié les éléments nécessaires pour une étude sur le C. difficile. En plus du petit nombre d’études à inclure le type de souches impliquées, nous avons trouvé, entre autres, que seulement les 2/3 des études avaient documenté et/ou inclus la prise antérieure d’antimicrobiens et la moitié avait rapporté l’origine de l’infection et/ou les épisodes antérieurs. Par ailleurs, aucune méta-analyse n’a pu être effectuée à cause de la grande hétérogénéité des méthodes et des populations des études, le manque de données, ainsi que toutes les différences dans la définition même des issues, des délais de suivi et de la définition des facteurs de risque.
ABSTRACT
Background: Clostridium difficile infection (CDI) can lead to complications, recurrence, and death. Numerous studies have assessed risk factors for these unfavourable outcomes, but systematic reviews or meta-analyses published so far were limited in scope or in quality.
Methods: A systematic review was completed according to PRISMA guidelines. An electronic search in five databases was performed. Studies published until October 2013 were included if risk factors for at least one CDI outcome were assessed with multivariate analyses.
Results: 68 studies were included: 24 assessed risk factors for recurrence, 18 for complicated CDI, 8 for treatment failure, and 30 for mortality. Most studies accounted for mortality in the definition of complicated CDI. Important variables were inconsistently reported, such as previous episodes and use of antibiotics. Substantial heterogeneity and methodological limitations were noted, mainly in the sample size, the definition of the outcomes and periods of follow-up, precluding a meta-analysis. Older age, use of antibiotics after diagnosis, use of proton pump inhibitors, and strain type were the most frequent risk factors for recurrence. Older age, leucocytosis, renal failure and co morbidities were frequent risk factors for complicated CDI. When considered alone, mortality was associated with age, co-morbidities, hypo-albuminemia, leucocytosis, acute renal failure, and infection with ribotype 027.
Conclusion: Laboratory parameters currently used in European and American guidelines to define patients at risk of a complicated CDI are adequate. Strategies for the management of CDI should be tailored according to the age of the patient, biological markers of severity, and underlying co-morbidities.
INTRODUCTION
Highly associated with exposure to antibiotics, Clostridium difficile infection (CDI) causes 20 to 30% of antibiotic-associated diarrhea and is the most common cause of nosocomial diarrhea (1-4). The risk of CDI increases up to 6-fold during antibiotic therapy and in the subsequent month (5,6). In the early 2000s, a renewed interest in CDI followed the emergence of a hypervirulent strain (NAP1/BI/027) associated with frequent recurrences and higher severity (7,8). Several novel treatments of CDI are being studied, some of which have been associated with a lower risk of recurrence (9-11).
Identifying clinical parameters or host-related factors associated with adverse outcomes would improve the management of CDI in the early stage of the disease. In a previous systematic review (12), we showed that several studies used empirically-defined risk factors for the derivation of clinical prediction rules for unfavourable outcomes of CDI, while others used univariate comparisons between CDI and non-CDI groups. Few clinical variables remained significant in multivariate analyses.
Risk factors for unfavourable outcomes of CDI have been studied before and after the emergence of NAP1/BI/027. To our knowledge, only one systematic review with a meta-analysis, published in 2008, has addressed risk factors for recurrence with a search limited to PubMed (13). More recently, a systematic review of risk factors for mortality pooled results of univariate and multivariate analyses of hospital-based studies (14). Two other reviews that ascertained CDI-related mortality were performed but specific risk factors were not reported (15,16). Consequently, we performed a systematic review of all publications that identified risk factors for recurrence, treatment failure, complications and/or mortality in patients diagnosed with CDI.
METHODS
Search strategy and selection criteria
A systematic review was performed according to PRISMA guidelines (17) (Checklist S1) using an electronic search of all studies published from January 1978 until October 2013. The search was limited to human studies and used the following online libraries and databases: MEDLINE, PubMed, Cochrane Library for evidence based-medicine, Embase and Web of Science (Text S1). The final electronic search was performed on 21 October
2013. Publications from all sources were merged into one file and duplicates were removed. A first screening of titles and abstracts followed by a full-text review were performed. In addition, the reference lists of identified studies were searched manually.
We included studies that: i) targeted C. difficile as the main pathogen; ii) measured at least one relevant outcome: severity, complications, mortality, treatment failure and/or recurrence; iii) identified risk factors for the main outcome(s) using risk assessment measures such as odds ratios (OR), relative risks or ratios (RR) and hazard ratios (HR). Any complication, fulminant colitis, ICU admission, shock, and/or death (when used as part of a composite outcome) were grouped under ‘‘complicated CDI’’. We excluded all studies that used only univariate comparisons of groups, aimed to develop a risk stratification tool or a predictive model (12), and those conducted exclusively in children, in populations with selected pathologies or undergoing particular procedures (e.g. organ transplants, CT-scans, or endoscopies).
Data extraction
Two reviewers (CAC and SS) extracted the following data into a standardized matrix: year of publication, location, year of diagnosis, type of tests for the laboratory diagnosis of CDI, definition and frequency of the outcome(s) of interest, study design, duration of follow-up, population and comparison groups, sample size, statistical analyses, number of variables and number of events per variable (EPV) in the final model, and main results in relation with the objectives of the review. Correspondences requesting clarifications were sent to authors in case of missing or incomplete data (n = 9).
Studies that assessed two or more outcomes were allocated to each category of outcomes. Results from included studies were plotted using GraphPad Prism 6.01 (GraphPad Software, San Diego, CA). Due to the small number of studies assessing common risk factors for defined outcomes, ORs, RRs and HRs with their confidence intervals (CI) are reported in the same forest plots. Some factors such as multi-organ failure or other severe medical status immediately preceding mortality were considered too closely related to death in the pathogenic pathway and were therefore not considered as risk factors in this review.
Risk of bias assessment
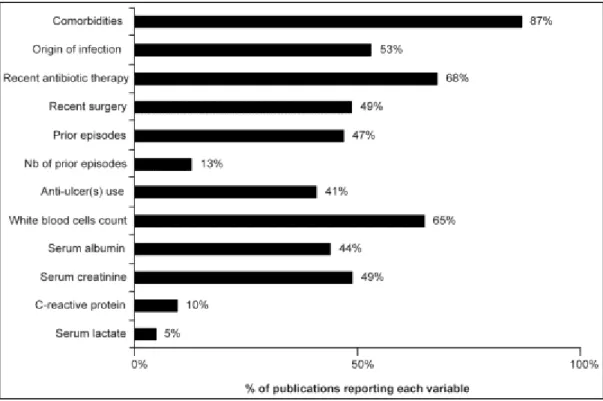
A quality control process was performed on 10% of the first screening of abstracts (LV), as well as on included studies. Reviewers had a good agreement concerning eligible studies and final inclusion (87%). Disagreements were resolved by a third party (JP). Two methods were used for the assessment of the individual and overall risk of bias across studies: i) the number of EPV (recurrence, treatment failure, complications, and/or death) in the final multivariate model of each study, assuming that at least 10 EPV are necessary (18,19);ii) relevant clinical and epidemiological variables in relation with CDI in each study, and adjustment for these variables in multivariate analyses. The main variables were: confirmed diagnosis of CDI, age, gender, the site of acquisition of the infection (SI), co-morbidities, occurrence and number of previous episode(s) of CDI (PE), recent antibiotic therapy (AB), immunosuppression (IS), use of anti-ulcer medication (AU), recent surgery or procedure (RS), and blood tests (white cell count, haematocrit, serum lactate, serum albumin, serum creatinine, and C-reactive protein).
RESULTS
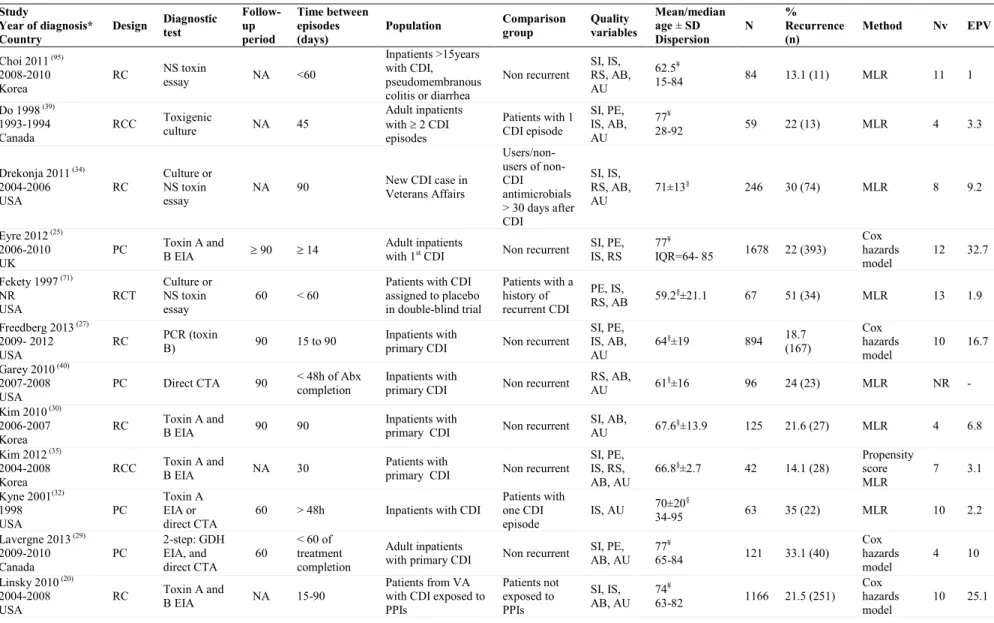
The electronic search led to 6839 publications. After excluding duplicates, 2537 were reviewed by their title and abstract (Figure 1), among which 2301 were excluded at the first screening and 178 after full-text verification. We included in this review 68 studies that examined risk factors for one or more outcomes: 19 assessed risk factors for recurrence only, 11 for complicated CDI only (including or not mortality), two for treatment failure only, 23 for mortality alone (among them six in patients needed colectomy), and 13 for multiple outcomes (including six for treatment failure). The characteristics of included studies are shown in tables S1 to S4. The majority of included studies used retrospective cohorts (45; 66%), 15 used prospective cohorts (22%), four were retrospective case-control studies (6%), and four were clinical trials (6%). Except for six studies using administrative databases (20–26), sample sizes were small with a median of 128 patients (range 13-2042). Most studies (14/18) on complicated CDI included death (mostly all-cause 30-day mortality) within a composite outcome. The method used for CDI toxin detection was reported in 94% (n = 64) of studies: Toxin A and B enzyme immunoassay (EIA) was used in 39% (n = 25), direct cytotoxin assay (CTA) in 19% (n = 12), toxin A EIA in 9% (n = 6),