BADJI MOKHTAR - ANNABA UNIVERSITY
UNIVERSITE BADJI MOKHTAR –ANNABA
Faculté des Sciences Année 2009
Département des Sciences de la Mer
MEMOIRE
Présenté en vue de l’obtention du diplôme de Magister
Option
ENVIRONNEMENT LITTORAL
Par : Melle. HADEF Hala
Directeur de Mémoire : M. OUNISSI Makhlouf
Pr. U. Annaba
Devant Le Jury :
Président : M. DERBAL Farid
MC. U. Annaba
Examinateur : M. FREHI Hocine
MC. U. Annaba
Examinateur : M. DRAREDJA Brahim
MC. U. Annaba
ﺔﺑﺎﻨﻋ -رﺎﺘﺨﻣ ﻲﺟﺎﺑ ﺔﻌﻣﺎﺟ
ﻲﻤﻠﻌﻟا ﺚﺤﺒﻟا و ﻲﻟﺎﻌﻟا ﻢﻴﻠﻌﺘﻟا ةرازو
LE ZOOPLANCTON DE L’ESTUAIRE MARITME DU
MAFRAG EN 2005 : COMPOSITION ET BIOMASSE
Avant-propos
Ce projet d’étude a été réalisé au Département des Sciences de la Mer,
Ministère de l’Aménagement du Territoire et de l’Environnement.
(L’abondance, composition et biomasse du zooplancton du Mafrag).
visant la compréhension d’abondance, composition et biomasse du
zooplancton du Mafrag.
Je voudrais d’abord remercier vivement Monsieur OUNISSI Makhlouf,
Professeur au Département des Sciences de la Mer et directeur de
laboratoire d'Environnement littoral à l'université d'Annaba pour avoir
dirigé de façon infaillible mon travail. Il a orienté la pratique,
présentation et la mise en forme du mémoire. Il m’a encouragé et aidé
pour achever mon projet d’étude. J’ai le grand plaisir de lui exprimé m’a
profonde gratitude et respect.
Je suis très heureuse que ce travail soit jugé par, Monsieur DERBAL
Farid Maître de conférences au Science de la Mer était toujours
disponible, je lui exprime toute ma gratitude.
Je suis également honoré par la présence de Monsieur FREHI Hocine
Professeur au Département de Science de la Mer. Je lui exprime toute
ma gratitude.
Je remercier Monsieur DRAREDJA Brahim Maître de conférences au
Département de Science de la Mer. Je suis honoré par sa présence
parmi les jurys, et je lui exprimé ma profonde gratitude et respect.
Je remercier vivement Monsieur HARIDI Ahcène. Maître de
conférences au Département de Science de la Mer, pour m’avoir aidé
dans les relevés de terrain et dans le traitement des échantillons au
laboratoire et m’a encouragé pendant toute la période du stage pour
achever m’a recherche dans les meilleures conditions. Je lui exprimé
ma profonde gratitude et respect.
Je remercier vivement Madame BELBACHA-Khelifi-Touhami Meriem,
qui m'a toujours encouragé pour assurer un travail de qualité. Je lui
exprime toute ma gratitude et respect.
Comme je remercier vivement les étudiants de magistères et ingénieurs
inféodés au laboratoire et encouragé à plusieurs titres, je souhaite tout
le succès dans leurs études actuelles et futures sur les écosystèmes
côtières.
Sommaire
Introduction ………...
Chapitre I : Matériel et Méthodes
1. Le système estuarien de la Mafrag ………..
2. Méthodes de prélèvements et d’analyse………..
Chapitre II : Environment hydrologique
1. Salinité………
2. Sels nutritifs………
3. Matière organiques………...
Chapitre III : Composition et abondance du zooplancton
1. Caractères biologique………
2. Echantillonnage et analyse de récoltes planctonique………...
3. Variabilité et composition du zooplancton………..
3.1. Variabilité numérique du zooplancton total………...
3.2. Composition………...
4.Principaux groupes zooplanctoniques……….
. Les Copépodes……….
. Les Cladocères……… ………
. Les Rotifères ………...………….
. LesTunicier………...
.Les larves de Cirrhipèdes ………
. l’Ichtyoplancton………..
.Les larves de Décapodes ………
.Les larves de polychètes………..
. Groupe Divers……….
Chapitre IV :
La Biomasse
1.Méthodes d’estimation de la biomasse………..
2. Biomasse individuelle moyenne………...
3. Variations de la biomasse……….
4. Approximation des variables énergétique ………..
4.1. Respiration ………...
4.2. La production………
4.3. Les rendements énergétiques ………..
Discussion et conclusion... Références bibliographiques………. Résumé de Français... Résumé d’Anglais………. Résumé en Arabe ……….. 01 04 06 08 0911
13
13
15
15
16
20
20
25
29
30
31
31
31
31
32
33 34 36 39 39 41 43 45 49 54 55 56Liste des figures
Figure 01 : Localisation géographique du système estuarien du Mafrag et des stations
de prélèvement………..…. 04
Figure 02 : Photos à gauche vue de l’embouchure de l’estuaire du Mafrag ouverte en
période humide, à droite vue de l’estuaire amont, à 12 km de l’embouchure………. 05
Figure 03 : Photos à gauche vue de l’embouchure de l’estuaire du Mafrag semi
ouverte en période printanière, à droite vue de la fermeture de l’Embouchure de l’estuaire en période de sécheresse………. 05
Figure 04 : WP2 Filet cylindro-conique de 57cm de diamètre, une ouverture de 0,15m²
et 170 µm de vide de maille. ………...14
Figure 05: Evolution de la densité (ind.m-3, échelle logarithmique) du zooplancton total dans les trois stations du système estuarien du Mafrag………...16
Figure 06 : Valeur de la biomasse zoo planctonique exprimée en µg Ps.m-3 et µg C.m-3 en 2005………....38
Figure 7. Evolution de la respiration zooplanctonique exprimée en mg C/m-3/j (échelle logarithmique) au cours du cycle annuel 14 mars-29 décembre 2005 dans le bas estuaire du Mafrag………...40
Figure 8 : Evolution de la production zooplanctonique exprimée en mg C/m-3/j (échelle logarithmique) au cours du cycle annuel 14 mars-29 décembre 2005 dans le bas estuaire du Mafrag………...42
Figure 9 : Définition des principaux types de rendements ou d’efficiences énergétiques
utilisés en écologie (d’après Ricklefs, 1980)………...43
Liste des tableaux
Tableau 01 : Résumé des méthodes d’analyses des éléments chimiques………06 Tableau 02 : Variation saisonnières (Mars 2005-Décembre2005)de la température
(°C)et la salinité des eaux superficielles et des eaux du fond dans les stations du système estuarien du Mafrag………...08
Tableau 03 : variation saisonnière des teneurs des sels nutritifs et matières organique
dans les eaux de surface et dans la station Embouchure (mars- décembre 2005)………..10
Tableau 04 : variation saisonnière des teneurs des sels nutritifs et matières organique
dans les eaux de surface et dans la station El-Kébir (mars- décembre 2005)……….……….10
Tableau 05 : variation saisonnière des teneurs des sels nutritifs et matières organique
dans les eaux de surface et dans la station Bounamoussa pour la période (mars- décembre 2005). ……….………11
Tableau 06 : caractéristique géographique des stations étudiées en 2005……….….13 Tableau 07 : Abondance et fréquence relative (%) annuelles des taxons zoo
planctoniques récoltés en 2005 dans la station Embouchure du système estuarien duMafrag ………...18
Tableau 08 : Abondance et fréquence relative (%) annuelles des taxons zoo
planctoniques récoltés en 2005 dans la station El-Kébir du système estuarien duMafrag ………..…..18
Tableau 09 : Abondance et fréquence relative (%) annuelles des taxons zoo
planctoniques récoltés en 2005 dans la station Bounamoussa du système estuarien duMafrag ……….19
Tableau 10 : la liste systématique des espèces identifiées ……….21 Tableau 11 : Abondance et fréquence (%)bimensuelle des copépodes récoltés en 2005
dans la station Embouchure du système estuarien du Mafrag……….23
Tableau 12 : Abondance et fréquence (%)bimensuelle des copépodes récoltés en 2005
dans la station El-Kébir du système estuarien du Mafrag………..………24
Tableau 13 : Abondance et fréquances (%)bimensuelle des copépodes récoltés en 2005
dans la station Bounamoussa du système estuarien du Mafrag. ………25
Tableau 14 : Abondance et fréquances (%)bimensuelle des cladocères récoltés en 2005
dans la station Embouchure du système estuarien du mafrag………27
Tableau 15 : Abondance et fréquances (%)bimensuelle des cladocères récoltés en 2005
dans la station el kébir du système estuarien du mafrag……….……… 28
Tableau 16 : Abondance et fréquances (%)bimensuelle des cladocères récoltés en 2005
Tableau 17 : Abondance et fréquence (%) bimensuelle des Rotifères récoltés en 2005
dans la station embouchure du système estuarien du mafrag………30
Tableau 18 : Abondance et fréquence (%) bimensuelle des Rotifères récoltés en 2005
dans la station El-kébir du système estuarien du mafrag ……….……30
Tableau 19 : Abondance et fréquence (%) bimensuelle des Rotifères récoltés en 2005
dans la station Bounamoussa du système estuarien du mafrag ………..…30
Tableau 20 : nombre élément zooplanctonique utilisés dans l’estimation de la biomasse
on que 7182 individus ont été isolés est traités pour les pesés ………..33
Tableau 21 : Poids sec (µg /ind),poids en carbone (µg /ind)et rapport en carbone sur le
poids sec des différents groupes zooplanctonique et espèces de copépodes récoltés dans le système estuarien de Mafrag………...…………35
Tableau 22 : Bilan énergétique estimé à partir de la biomasse zooplanctonique dans le
Résumé
HADEF Hala 54
Résumé
L’estuaire du Mafrag est zone humide littorale très atypique à la fois par le régime hydrologique et par la diversité d’habitats (rivières, estuaire, marécages, intrusion marine). La diversité de biotopes et la discontinuité hydrologique induisent une dynamique très particulière du milieu et du peuplement. L’objectif de ce travail est de quantifier le compartiment zooplanctonique, élément clé dans le chaîne trophique estuarienne souvent très linéaire. La salinité est très variable à la fois dans l’espace et verticalement dans la colonne d’eau (0-36 pus). Il faut également relever la forte stratification de l’estuaire en particulier au printemps qui provoque l’isolement de la couche profonde de celle de la surface. Le zooplancton a été étudie à partir de pêches mensuelles réalisées dans la couche de surface dans trois stations. En période d’échange avec la mer, très allongée cette année 2005, le zooplancton est abondant où la densité peut atteindre une moyenne de densité 400ind. m-3, ce qui correspond à 1.1 mg C. m-3. Sur le plan de la diversité zooplanconique, on recense 44 espèces dont plus de 50% d’espèces reviennent aux Copépodes et aux Cladocères. De même, numériquement les Copépodes et les Cladocères forment l’essentiel de l’abondance et de la biomasse en particulier lors de la période d’échange maximum avec la mer et les marécages. Lorsque l’estuaire se confine quelque peu en été, la biomasse diminue au minimum. Au niveau écosystémique, la respiration est un indice de dégradation de la matière organique totale et donc un bon indice des flux de carbone organique à travers la communauté,au niveau de l’estuaire du Mafrag les variations annuelles moyenne de l’ordre de 44 mg C/m-3/j. Et la valeur annuel de production est de l’ordre de 29 mg C /m-3/j. Si l’estuaire est à vocation eutrophe, la richesse ne se traduit pas cependant au niveau de la production secondaire en raison peut-être de problèmes d’échantillonnage. En effet les résultats ne concernent que la couche de surface échantillonnée dans cette étude.
Mots-clés :
Zooplancton, biodiversité, zone humide, biomasse, salinité,Résumé
HADEF Hala 55
Abstrat
The estuary of Mafrag is littoral wetland very atypical at the same time by the hydrological mode and the diversity of habitats (rivers, estuary, marshes, and marine intrusion).The diversity of biotopes and hydrological discontinuity induce a very particular dynamics of the medium and settlement. The objective of this work is to quantify the compartment zooplankton, key element in the trophic chain estuarine often very linear. Salinity is very variable at the same time in the space and vertically in the water column (0-36 pus). It is also necessary to raise the strong stratification of the estuary in particular in spring which causes the insulation of the deep layer of that of surface. The zooplankton was studies starting from monthly fishings carried out in the surfacing in three stations. In period of exchange with the sea, very lengthened this year 2005, the zooplankton is abundant where the density can reach an average of density 400ind. m3, which corresponds to 1.1 Mg C m3 In the field of zooplankton diversity, one counts 44 species of which more than 50% of species return to the Copepoda and Cladocera. In the same way, numerically the Copepoda and Cladocères form the essence of abundance and the biomass in particular at the time of the maximum period of exchange with the sea and the marshes. When the estuary is confined somewhat in summer, the biomass decreases at least. On the level ecosystemic, breathing is an indication of degradation of the total organic matter and thus a good index of the organic carbon flow through the community, on the level of the estuary of Mafrag the annual variations average of about 44 Mg C/m-3/d. And the value annual of production is about 29 Mg C / m-3/d.
If the estuary is with eutrophic vocation, the richness however does not represent on the level secondary production because perhaps of problems of sampling. Indeed the results relate to only the surfacing sampled in this study.
Key words Zooplancton, biodiversity, wetland, biomass, salinity, estuary breathing, energitic production, and assessment.
Résumé
Résumé
Introduction
HADEF Hala 1
Introduction
En tant que zones de transitions entre le continent et la mer, les estuaires forment des écosystèmes aquatiques particuliers, caractérisés par d’intenses
échanges et transformations chimiques, physiques et biologiques (Telesh, 2004).
Il constituent donc de véritables zones filtres (Lisitzin, 1999 ; Conley et al., 2000).
Ces zones agissent comme filtres en piégeant les nutriments et les contaminants et par les transformations biologiques de la matière introduite à la côte. On a pu suggérer que les estuaires fonctionnent comme de véritables zones tampon entre
la rivière et la mer (Lisitzin, 1999).
Sur un autre plan écologique, des relations directes entre l’importance des apports en eaux douces et les nutriments qui s’en issus et la production
biologique littorale sont maintenant bien établis (Deegan et al., 1986 ; Budgen et
al., 1982; El-Sayed et van Gert, 1995 ; Estrada, 1996 ; Tsai et al., 1997 ; Postel et al.,
1998 ; Daskalov, 1999). L’environnement côtier peut donc être hautement contrôlé
par les enrichissements en nutriments d’origines fluviale et estuarienne.
Pour comprendre la dynamique des écosystèmes côtiers, il est important
d’étudier la structure et la fonction du compartiment zooplanctonique
(
Ulf Lie etal., 1983
).
Le zooplancton joue en effet, un rôle particulièrement important dansla dynamique des écosystèmes marins : contrôle sur la croissance du phytoplancton, régénération des nutriments et cheminement de l’énergie et la matière, de la production pélagique au réseau trophique.
L’importance du plancton au point de vue de l’économie générale de la mer a été reconnue pratiquement déjà par les pêcheurs italiens du Moyen Age : ‹‹ qui dit poissons, dit plancton››. De simples praticiens ont décelé ainsi, depuis des siècles, les relations étroites qui existent entre l’abondance du plancton et le rendement des pêches qui les faisaient vivre. Toutefois l’importance du plancton au point de vue alimentaire ne se limite pas aux poissons, mais intéresse tous les peuplements marins hétérotrophes, qu’ils soient benthiques, nectoniques ou
pélagiques (Tregouboff et Rose, 1978). De part l’indication hydrologique qu’apporte
le zooplancton, l'ensemble des taxons zooplanctoniques marins constituent aussi
des sources nutritives pour beaucoup de poissons dans l’aquaculture (Yufera et
Pascual, 1984 ; Barnabé, 1986). La gestion intégrée des zones côtières suppose
Introduction
HADEF Hala 2 particuliers la structuration du réseau trophique de part la qualité chimique des
eaux.
Le zooplancton constitue un élément essentiel et forme un indicateur direct intégrateur de la variabilité des caractéristiques océanographiques et halieutique du milieu. Sa variation, structure et composition, corrélativement aux paramètres du milieu, fertilité et hydrodynamisme, reflètent et décrivent directement l’état global et les caractéristiques du milieu.
Le zooplancton des côtes algériennes est peu connu. Les études qui s’y
rapportent, en dépit de leur qualité, n’ont concerné que la baie d’Alger (Viguier
1911 ; Rose, 1925, 1926, 1927, 1930, 1933, 1934, 1937 ; Ramult et Rose 1945 ; Rose
et Hamon 1953 ; Hamon 1950, 1951, 1952, 1953 ; Bernard 1955, 1958 ; Seguin, 1972)
et plus récemment la baie d’Annaba (Ounissi et al., 1998), le littoral d’El-Kala
(Ounissi et Khélifi-Touhami, 1999) et la lagune Mellah (Ounissi et al., 2002). La côte
Ouest est explorée par Mazza (1962). Récemment, les compagnes Mediprod (1972-1990), ont intégré les zones Ouest et centre du bassin algérien. Parmi ces travaux, les Copépodes du bassin algérien ont été étudies en relation avec les
conditions hydrologiques du bassin algérien (Haffarssas, 1996).
Il important de souligner au préalable qu’aucune étude se rapportant au zooplancton de l’estuaire de la Mafrag. Etant donnée son importance du point de vue trophique par rapport aux échelons trophique supérieurs, il intéressant de connaître la composition zooplanctonique de la région.
Les estuaires maintiennent d’importantes activités économiques : irrigation, pêche, aquaculture, extraction de sédiments, navigation, transport, tourisme et sont ainsi soumis aux modifications environnementales défavorables. Bien que les estuaires restent parmi les plus importants systèmes résilients sur la terre, ils maintiennent pourtant encore leur attraction pour la vie sauvage, en dépit des
activités anthropiques et des agressions terrestres (Elliot and McLusky, 2002). Ces
écosystèmes offrent des potentialités unique au profit de l’homme : ils entretiennent la santé des écosystèmes par le piégeage des contaminants dans leurs sédiments alors qu’ils accueillent les poissons marins et les oiseaux migrateurs et leurs offrent les meilleurs conditions de fraye et de nourriture. On constate qu’au gradient de salinité, qui caractérise les estuaires, se superposent une large variété d’habitats pour les populations marines, saumâtres et
Introduction
HADEF Hala 3
Les récentes études hydrologiques menées en 2003 sur oued Mafrag (
Khélifi-Touhami et al, 2006 ; Haridi et al, 2008 ; Ounissi et al., 2004 ; Gouiez, 2006 ; Saker &
Kennouche, 2003), ont fournis les premières observations hydrologiques et
écologiques de cet estuaire .ces études décrivent la Mafrag comme un véritable estuaire ou la mer pénètre, augrés de la marée, dans le contient de plus de10-20 km.
L’objectif de la présente étude est de décrire la composition, l’abondance et la structure des peuplements zooplanctonique de l’estuaire Mafrag en relation avec la mer.
L’étude comporte quatre chapitres dont le premier consiste en une description du milieu et la méthodologie utilisée. Le second s’attache à l’étude hydrologique et géographique du système estuarien du Mafrag. Le troisième est consacré à l’abondance et la composition du zooplancton et de ses principaux taxons. Et le dernier chapitre expose les résultats de l étude de la biomasse zooplanctonique.
Chapitre I: Matériel et méthodes
HADEF Hala
4
Chapitre I : Matériel et méthodes
1. Le système estuarien de la Mafrag
L’estuaire du Mafrag est alimenté par Oued El-Kébir, Oued Bounamoussa et par leurs marécages. Le bassin versant avec 3 200 Km² s’étend jusqu’au frontières tunisiennes (Fig.1). Il reçoit essentiellement les eaux agricoles et les effluents domestiques et industrielles. L’estuaire se déverse sur une rive littorale très exposée aux vents du Nord et du Nord-Ouest. Son parcours traverse, à l’approche du littoral, une masse de dune littorale très mouvante sur sa rive Est. Il s’ensuit un colmatage accentué lors des périodes d’étiages (3-4 mois).
Figure 1. Localisation géographique du système estuarien du Mafrag et des stations de prélèvement. E : station embouchure ; C : station confluence ; B : station Bounamoussa ; K : station El-Kébir.
En l’absence de décharge d’eau fluviale en été, l’embouchure se colmate par la formation de bancs de sable. La fermeture de l’embouchure peu durer entre quelques jours à plusieurs mois selon la pluviométrie. En 2002 par exemple, l’estuaire est resté colmaté toute l’année et n’a pas aboutit à la mer par suite de son faible débit et de l’ensablement rapide entretenu par la progradation des sables marin et dunaire. En 2005, l’estuaire s’est fermé seulement pendant une semaine en août. Lors de la période d’étiage, la Mafrag se comporte comme une véritable lagune par suite du faible débit et de la marée barométrique induite par
les vents soufflant du Nord (Khélifi_Touhami et al., 2006 ; Haridi et al. sous presse
(remind the tilte of the journal of coastal research … Haridi).
Mediterranée Algérie Estuaire du Mafrag Mediterranée Golfe d’Annaba Annaba Bounamoussa El-Kébir Seybouse N 5 Km 8° E 37°N E ◉ ◉ C ◉ K B ◉ Stations de prélèvement
Chapitre I: Matériel et méthodes
HADEF Hala
5
En période de pluies, le volume de l’estuaire augmente et envahit la pleine environnante créant ainsi de vastes marécages. En crue, lorsque l’embouchure et fermée, les marécages se remplissent et l’eau excédentaire envahit les villages riverains (Berrihene) occasionnant des dégâts sur les infrastructures. Entre mars et juin, et en l’absence de crue, l’estuaire retrouve son régime d’estuaire à marée semi-diurne avec deux pleines mers et deux basses mers par jour.
Figure 2 : Photos à gauche vue de l’embouchure de l’estuaire du Mafrag ouverte en période humide, à droite vue de l’estuaire amont, à 12 km de l’embouchure.
Figure 3 : Photos à gauche vue de l’embouchure de l’estuaire du Mafrag semi ouverte en période printanière, à droite vue de la fermeture de l’Embouchure de l’estuaire en période de sécheresse.
Le débit et le comportement de la Mafrag sont ainsi très variables en fonction des précipitations dans la région et de l’action des courants de marées astronomique et barométrique. On trouve dans les travaux de Khélifi-Touhami et al. (2006) une synthèse sur le régime hydrologique de l’estuaire. Le cycle hydrologique du Mafrag est du type méditerranéen comme les estuaires de l’Afrique du Sud et de
l’Australie (Perissinotto et al. 2000 ; Daniel & Potter, 1995).
Les stations étudiées ont choisies selon un plan d’échantillonnage à choix raisonné. La station d’embouchure situé à environ 100 m du niveau du rivage (N 36° 50’ 745:E 7° 56’ 880), la station Confluence dénommée C, se situe à environ
Chapitre I: Matériel et méthodes
HADEF Hala
6
1Km (N 36° 50’ 362:E 7° 58’ 380) de la mer au point de confluence de Bounamoussa et du Kébir. Les stations du Kébir ou K (N 36° 50’ 123 : E 7° 57’ 662) et de Bounamoussa ou B (N 36° 50’ 90:E 7° 57’ 540) sont situées à environ 1K de leur confluence.
2. Méthodes de prélèvements et d’analyse
Les relevés hydrologiques et les prélèvements d’eau destinée aux analyses chimiques ont été effectués dans trois stations deux fois par mois entre le 24 février 2005 et le 29 décembre 2005. Les programmes de surveillances de l’environnement suggèrent en effet un contrôle bimensuel des eaux pour obtenir des données statistiquement exploitables en particulier lors des traitements de séries temporelles.
Les relevés de température (°C) et de salinité (Practical Salinity Unit ou psu) ont été effectués à l’aide d’un multiparamètre type WTW 901i. La vitesse du courant a été mesurée par un GPS de type Garmin 12 et la profondeur est donnée par un sondeur de type EAGLE Fish Easy.
En plus des relevées hydrologiques des eaux de surface et de fond, des profils verticaux de température et de salinité ont été réalisés quand cela est possible. Les méthodes d’analyses chimiques sont succinctement résumées dans le Tableau 1.
Tableau 1. Résumé des méthodes d’analyses des éléments chimiques.
Eléments Méthodes Références
Azote ammoniacal (NH3 +
NH4+) Dosage spectophotométrique (λ = 630 nm) Parsons et al. (1989)
Nitrates (NO2 -) Dosage spectrophométrique (λ = 543 nm) Parsons et al.
(1989)
Nitrites (NO3-) Réduction des nitrates en nitrites et dosage
spectrophométrique des nitrites (λ = 543 nm) Parsons et al. (1989)
Phosphate (PO43-) Dosage spectrophotométrique (λ = 885 nm) Aminot et
Chaussepied (1983) Azote Organique Dissous
(NOD)
Oxydation en nitrate, réduction des nitrates en nitrites et dosage spectrophométrique des nitrites (λ = 543 nm)
Parsons et al. (1989) Matière organique
particulaire (COP)
Méthode volumétrique : oxydation et évaluation de la matière organique en équivalent-carbone (glucose)
Chapitre I: Matériel et méthodes
HADEF Hala
7
Si le suivi des sels nutritifs, renseigne sur la fertilité chimique des eaux, l'étude de la matière organique dissoute et particulaire renseigne sur l'activité et la production biologique, en particulier celle du plancton. La quantité d'azote organique dissous, provenant de l'activité métabolique, et de la dégradation de la matière (Iyse et vieillissement des cellules), dans l'eau, donne une indication précieuse sur la biomasse en présence. L'évaluation des quantités en carbone organique particulaire reflète directement celle du plancton. Il s'agit d'une évaluation directe de la production planctonique du milieu.
Chapitre II: Environnement hydrologique (paramètre physico – chimique)
HADEF Hala 8
Chapitre II : Environnement hydrologique
(paramètre physico – chimique)1. Hydrologie
La salinitéLes valeurs de salinité des eaux du fond sont toujours largement supérieurs à celles de la surface et varient généralement entre 30-36 tout au long des saisons (Tableau 2). En revanche la salinité de surface à fortement fluctué (0.10-20) conformément au influences continentale dominante en hivers et au printemps (S<5), ou marine dominante en été et en automne (5<S<20). En raison de la faible profondeur, les eaux de la branche de l’estuaire bounamoussa sont plus salées et fortement stratifiées en été que les eaux de kébir, comme le montre le tableau 2. La Mafrag est un estuaire très atypique ne pouvant pas se classer selon le système de venise dans lequel les eaux saumâtres sont catégorisées
selon des gammes de salinité (Eliot et Mclusky,2002).
Tableau 2 : Variation saisonnières (Mars 2005-Décembre2005)de la température (°C)et la salinité des eaux superficielles et des eaux du fond dans les stations du système estuarien du Mafrag (d'après Haridi, 2005). Salinité (Psu) Mm Mk Mb MOIS S F S F S F 14.03.05 00,10 00,20 00,10 00,20 00,10 00,20 24.03.05 02,40 34,00 00,50 35,00 00,50 00,20 13.04.05 02,40 00,20 00,20 27.04.05 03,40 36,00 00,60 35,40 00,70 29,40 10.05.05 06,00 36,20 01,90 34,40 03,60 32,20 24.05.05 03,70 35,00 01,40 35,30 07,40 28,30 15.06.05 32,50 36,90 03,80 35,80 12,70 34,80 30.05.05 16,10 37,30 14,20 28,70 20,10 13.07.05 12,50 35,20 03,00 36,00 06,50 33,9 27.07.05 19,50 36,30 11,50 36,10 15,10 16,10 13.08.05 11,50 35,50 06,50 35,60 11,50 28,20 31.08.05 06,00 36,00 04,00 36,20 06,20 35,60 14.09.05 07,80 36,70 04,40 34,10 07,70 32,00 27.09.05 15,40 36,00 05,90 36,40 12,40 34,00 12.10.05 07,00 36,20 05,70 36,30 07,50 29,40 25.10.05 07,60 34,00 06,10 30,30 09,50 33,00 15.11.05 11,20 34,60 09,90 34,40 11,80 31,00 30.11.05 03,80 34,40 01,50 36,50 03,50 31,10 14.12.05 00,80 30,40 00,60 35,01 29.12.05 06,90 33,00 05,10 31,20 01,80 35,00
Chapitre II: Environnement hydrologique (paramètre physico – chimique)
HADEF Hala 9
Sels nutritifs
Les teneurs en nitrates sont beaucoup varie avec les saisons (1 à 48µM) mais restent globalement élevés, traduisant la richesse des eaux du système estuarien (Tableaux 3,4,5) les plus fortes concentrations sont relevés en automne par suite d’apports supplémentaire d’azote d’origine agricole. Dans la région, les amendaments de terrains agricoles par les engrais se font en effet en automne. L’évolution saisonnière des teneurs en nitrites sont sensiblement celle de nitrate avec une forte valeurs en automne et un appauvrissement générale en été (Tableau 3,4,5) .Les ions nitrites sont présents faible quantités restant souvent en deçà de la valeur norme pour les eaux de surface (4µM). Formant ainsi un petit stock convertible d’azote minéral. Les nitrites forment une fraction de 10% de l’azote minérale totale. Dans l’ensemble des stations, les eaux de fond bien que moins riches en nitrates que les eaux de surface. Les eaux du système estuarien du Mafrag sont très riches en ammonium (10-15 µM en moyenne, selon la station).et au printemps par suite d’importants apports continentaux (jusqu’à 46µM, tableau3). A l’exception des valeurs enregistrées dans l’ensemble des stations (Tableau 3), les teneurs des ions phosphates sont comprises entre 0.5 et 7µM .En ce concerne la répartition verticale, on ne constate pas une tendance quelconque, parfois les eaux du fond semblent être en revanche plus riche comparés a celles de surface. Cette tendance et surtout constatée dans kébir et à l’embouchure. Pour Bounamoussa, les difficultés pratique nous empêché d’échantillonner le fond (Tableau 5). Mais l’ordre des teneurs reste sensiblement comparable à celui des autre stations globalement, les teneurs en ions phosphates ne reflètent pas une tendance saisonnière bien clair. Et que les eaux de l’estuaire ne sont pas polluées par cet élément car les valeurs rencontrés sont très inférieurs à la norme (9µM pour les eaux de surface)
Chapitre II: Environnement hydrologique (paramètre physico – chimique)
HADEF Hala 10
Tableau 3: Variation saisonnière des teneurs des sels nutritifs et matières organique dans les eaux de surface et dans la station Marine pour la période mars- décembre 2005, (d'après Haridi, 2005).
Sels nutritifs Matières organique
NO-2(µm) NO-3(µm) NH+4(µm) PO3-4(µm) NOD(mg/l) COP (mg/l) Mois S F S F S F S F S F S F 14.03.05 0 ,92 1 ,49 9,82 6, 34 7,56 5,58 1,11 1,62 7,24 4,64 0,06 0 ,81 24.03.05 1, 33 0,92 7,20 7,20 8,47 7,20 0,60 0,55 7,95 8,76 3,90 5,53 27.04.05 1 ,02 0,02 2,01 0,21 6,84 2,32 0,80 0,65 13 9,33 6,76 4,70 10.05.05 2,04 0,59 2,760 O,60 9,55 2,80 7,89 0,50 3,67 0,65 5 ,52 5,29 24.05.05 1,44 2,82 4,14 1,45 8,41 7,73 0,75 2,23 2,88 2,31 5,86 5,29 15.06.05 1,68 1,85 1,11 0,83 5,33 6,96 7,48 3,71 0,41 0,23 1,23 0,66 30.05.05 0,85 0,26 11,41 3,29 1,42 2,14 3,66 3,81 1,05 5,70 3,80 4,36 13.07.05 1,52 1,44 1,24 1,23 7,14 1,96 1,21 1,01 0,56 0,48 1,14 0,44 27.07.05 2, 39 1,87 6,28 3,13 3,23 0,82 3,71 3,86 18,9 2,72 0,00 0,71 13.08.05 2,06 0,64 7,52 3,78 14,0 10,1 0,60 0,75 10,7 8,94 1,14 3,14 31.08.05 4,34 2,32 15,98 5,99 12,9 7,14 0,24 1,52 3,28 16,6 2,79 4,11 14.09.05 2,47 1,04 18,01 5,01 12,7 7,86 2,03 29,3 12,6 2,26 2,97 4,61 27.09.05 4,67 3,61 44,86 5,91 4,37 10,8 28,2 0,60 1,29 20,0 1,89 1,82 12.10.05 5,41 2,56 31,91 9,49 20,7 34,1 0,09 0,65 2,10 7,60 2,78 4,90 25.10.05 2,92 1,35 25,40 7,62 18,1 0,82 0,75 1,57 0,00 2,60 0,00 3, 37 15.11.05 1,56 1,14 26,43 7, 34 1,72 1,18 0,85 0,85 3,40 0,52 2,87 30.11.05 5,60 3,27 45,62 5,81 29,4 8,77 0,85 0,50 18,9 2,65 1,90 3,65 29.12.05 2,87 2,42 17,61 7,01 7,86 48,9 2,43 3,56 1,38 1,37 3, 32
Tableau 4 : variation saisonnière des teneurs des sels nutritifs et matières organique dans les eaux de surface et dans la station El-Kébir mars- décembre 2005, (d'après Haridi, 2005).
Sels nutritifs Matières organique NO-2(µm) NO-3(µm) NH+4(µm) PO3-4(µm) NOD (mg/l) COP (mg/l) Mois S F S F S F S F S F S F 14.03.05 1,01 1,02 5,79 5,79 7,80 7,80 1,26 1,26 3,17 3,17 1,15 1,15 24.03.05 2,54 0,23 21,15 5,64 3,88 0,44 0,29 4,11 0,00 3,01 27.04.05 1,28 0,24 1,05 1,16 5,88 5,15 1,16 3,05 5,66 0,82 5,26 5,03 10.05.05 2, 37 0,95 2,34 0,71 8,77 7,80 0,70 1,16 6,66 4,34 7,80 4,92 24.05.05 2,06 3,44 8,68 1,77 46,60 8,17 0,90 0,85 2,00 2,74 4,81 4,95 15.06.05 3,11 0,00 0,00 2,74 8,15 0,42 1,25 30.05.05 1,16 0,26 2,98 4,91 3,91 3,86 2,29 1,08 5,30 13.07.05 3,91 2,06 11,57 2,14 7,80 4,31 3,05 2,79 0,33 0,65 0,00 0,39 27.07.05 2,51 2,06 0,45 1,49 3, 35 0,76 12,8 4,27 16,7 4,40 3,90 0,24 13.08.05 3,06 0,85 6,80 3,85 7,80 4,97 0,55 0,60 3,47 18,53 1,85 2,59 31.08.05 5,70 0,80 11,62 4,36 12,26 5,84 3,25 1,46 18,5 3,40 2,76 2,67 14.09.05 3,11 0,40 19,40 1,59 18,11 6,78 0,29 27,03 0,04 3,44 3,62 4,46 27.09.05 10,07 1,18 22,93 4,20 4,13 4,61 0,39 3,66 2,80 1,58 1,45 12.10.05 3,25 8,43 10,14 12,62 5,76 0,29 0,14 1,69 2,95 4,12 2,71 25.10.05 2,51 1,73 43,86 2,81 9,49 27,3 0,19 0,60 2,46 3,54 6,34 3,74 15.11.05 2,47 1,99 21,98 4,50 8,35 23,9 0,50 0,39 1,99 1,83 2,91 4,32 30.11.05 4,04 3, 37 13,73 5,26 28,95 11,9 1,31 0,24 1,13 2,98 2,03 3,18 29.12.05 2,85 1,82 20,46 6,91 15,46 5,03 2,49 1,01 2,39 0,30 3,98
Chapitre II: Environnement hydrologique (paramètre physico – chimique)
HADEF Hala 11
Tableau 5 : variation saisonnière des teneurs des sels nutritifs et matières organique dans les eaux de surface et dans la station Bounamoussa pour la période mars- décembre 2005, (d'après Haridi, 2005).
Sels nutritifs Matières organique NO-2(µm) NO-3µm) NH+4(µm) PO3-4(µm) NOD(mg/l) COP (mg/l) Mois S F S F S F S F S F S F 14.03.05 1,54 1,54 5,30 5,30 25,03 25,03 1,67 1,67 00 00 0,63 0,63 24.03.05 1,42 5,03 2,32 4,13 0,65 0,77 00 0,68 27.04.05 1,49 0,92 0,69 0,21 2,08 17,58 1,62 28,96 3,76 4,45 3,46 5,32 10.05.05 1,68 1,59 3,09 3,09 2,93 2,14 0,34 0,70 3,23 5,38 7,01 6,27 24.05.05 1,63 1,61 5,53 7,91 34,9 30,0 0,55 0,39 3,43 6,72 6,81 4,08 15.06.05 2,54 00 00 2,38 29,5 0,48 0,66 30.05.05 0,66 0,30 8,60 3,27 2,44 1,18 3,96 3,91 2,62 0,43 4,87 13.07.05 3,37 1,71 0,40 0,62 6,54 2,43 0,95 0,62 1,01 2,21 3,96 27.07.05 1,99 2,04 3,42 6,40 2,93 4,01 4,32 4,53 3,27 12,4 1,14 0,18 13.08.05 1,94 0,49 7,96 3,32 4,43 9,31 0,70 0,55 12,5 19,4 3,45 3,12 31.08.05 2,77 3,53 4,27 0,82 8,83 20,8 0,24 0,70 3,12 2,51 3,19 2,15 14.09.05 1,21 12,1 2,26 0,19 1,37 4,46 27.09.05 4,67 22,7 2,50 0,65 1,58 2,27 3,81 12.10.05 4,67 31,6 13,9 0,24 9,70 1,34 25.10.05 3,30 2,13 21,2 7,18 15,1 17,6 0,85 0,29 1,99 1,28 15.11.05 2,28 9,93 5,94 0,39 1,79 00 3,38 30.11.05 4,91 37,7 21,7 0,11 7,72 2,40 29.12.05 3,08 2,01 15,8 8,00 18,8 12,14 2,23 1,57 3,51
2. Matières Organiques
Les teneurs en NOD ont varié fortement entre 0,20 et 20 mg/l au cours des saisons comme on peut le remarquer aux tableaux 3, 4 et 5.
Les valeurs les plus faibles sont observées entre mai -juin alors que le maximum est noté à la fin de l’été et en automne. Les eaux du fond sont souvent plus riches que les eaux de surface en particulier en été et en automne où la masse d’eau profonde est franchement isolée.
En fait, la matière organique dissoute azotée n’aurait pas pour origine les apports terrestres puisqu’il s’agit de molécules (urée, acides amines, précurseur d’acides nucléiques principalement) très labiles se dégradant rapidement à la suite d’un long transport. L’origine du NOD est donc endogène et il s’agit de production biologique estuarienne dont la fraction planctonique y contribue pour l’essentiel. La lyse des cellules phytoplanctoniques et les déchets métaboliques zooplanctoniques (urée notamment) constituent des sources majeurs de NOD dans l’estuaire. Le zooplancton fournirait d’importantes quantités de NOD par
Chapitre II: Environnement hydrologique (paramètre physico – chimique)
HADEF Hala 12
et Acartia latisetosa) et des larves de la crevette du genre Paleamon. La compréhension de la dynamique du NOD est à rechercher donc dans la dynamique du plancton.
Le mélange de deux eaux différentes par leur composition chimique, biologique et surtout par leur salinité aboutirait à des altérations biologiques aux confluences de ces deux catégories d’eaux. L’augmentation des valeurs (Tableau 3) du NOD dans l’Embouchure confirme son origine interne (biologique).
Le système estuarien du Mafrag montre une forte production organique particulaire (Tableaux 3, 4 et 5). Les concentrations varient avec la saison
(1-8 mg/l) avec deux maximums l’un au printemps et l’autre moins accusé en automne. En avril et en mai les teneurs en COP sont presque comparables cependant qu’en été et en automne, la masse d’eau profonde est plus productive notamment dans l’embouchure (Tableau 3) où les valeurs sont en moyenne de l’ordre de 4 mg/l. Cette distribution est en relation avec la forte stratification de l’estuaire. Le faible hydrodynamisme dans un système à deux couches avantage en effet la sédimentation des particules d’où la supériorité des valeurs du fond. Plus généralement, on comprend que l’estuaire décharge dans la côte voisine d’importantes masses de matières organiques particulaires pouvant sur enrichir le littoral adjacent. De ce point de vue écologique, l’estuaire constitue une source de fertilisation intense et continue du littoral est du golfe d’Annaba.
Chapitre III: Composition et abondance du zooplancton
HADEF Hala 13
Chapitre III :
Composition et abondance du zooplancton de surface1. Caractères biologique
Notre souci de fournir des informations complémentaires pouvant aider le lecteur à mieux comprendre le texte principal, a nécessité l’élaboration de ces définitions. Les être planctoniques végétaux et animaux sont caractérisés par leur passivité vis-à-vis des mouvements des masses d’eaux à l’exception toutefois de certains déplacements verticaux, ils sont ainsi entraînés par l’eau.Le plancton se situe dans les premiers niveaux de la production, le phytoplancton correspond à la plus grande part des océans et les zooplanctontes se trouvant aux niveaux 2,3 et 4 constituent une partie considérable de la production secondaire.
Le zooplancton ou plancton animal est constitué par l’ensemble des organismes
hététrophes à nutrition animale. Le zooplancton est composé de l’holoplancton et le méroplancton
• L’holoplancton c’est l’ensemble des organismes dont la totalité du cycle vital se déroule au sein de la masse d’eau
• Tandis qu’on regroupe dans le méroplancton (plancton temporaire), les espècesdont une partie du cycle biologique, généralement la vie larvaire se déroule au sein des masses d’eaux.
2. Echantillonnage et analyse de récoltes planctonique
Les prélèvements furent effectués au néveau de trois stations ont été choisies de façon raisonnée, le positionnent, la distance a l’embouchure et la nature de fond de l’ensemble de stations sont résumé au tableau suivant :
Tableau 6 : Caractéristique géographique des stations étudiées en 2005.
Position profondeur Distance
Station Embouchure (N 36° 50’ 745:E 7° 56’ 880) 3 -3.30m 0,01km
Station El kébir (N 36° 50’ 123 : E 7° 57’ 662) 4.5 -8.80m 1km
Station Bounamoussa (N 36° 50’ 90:E 7° 57’ 540) 1.10-1.80m 1km
Les prélèvements des échantillons ont été effectué dans les trois stations deux fois par mois entre le 14 mars 2005 jusqu’à le 29 décembre 2005. Et on note l’absence des échantillons de deux sorties (14 avril et 14 décembre 2005) causer
Chapitre III: Composition et abondance du zooplancton
HADEF Hala 14 par deux crue. Le zooplancton a été récolté à partir d’un trait horizontal par une
vitesse limitée à l’aide d’un filet WP2 de 170 µm de vide de maille et 30 cm de diamètre. Le filet est laissé immerger à la surface avec une vitesse limitée.
Chaque échantillon du zooplancton correspond à un prélèvement de 4 à 16 m-3
d’eau. Le volume filtré a varié d’une sortie à une autre dans la même station en raison de la dérive du filet, occasionnée par les conditions hydrodynamiques. L’échantillon 6 est ensuite filtré sur un tissu de filet à plancton de maille 170µm et le contenu du filtrat est conservé dans une solution de formol à 5%. L’ensemble des échantillons sont été analysées à partir de fractionnement représentant 1-10% du volume total. Chaque récolte est analysée à partir de trois sous échantillons ou fractions de 5-20ml chacun; et parfois sa demande le filtrage de la bouteille et cela coinside la densité de l’échantillon.
Figure 4 : Filet WP2. Filet cylindro-conique de 30 cm de diamètre, une ouverture de 0,15m² et 170 µm de vide de maille.
Le dénombrement est effectué sur une cuve de Dolffus sous microscope au grossissement 10. Les Copépodes formant le groupe le plus abondant du zooplancton sont déterminés jusqu’à l’espèce 40 (G×10) et même grossissement 100 (G×10), L’identification est facilitée par la consultation des ouvrages et publications suivants : Tregouboff et Rose (1978); Rotiféra.in fresh-water
biology, 2 nd end (New York: John Wiley) ; Dussart (1967), Dussart (1989),
Cladocera sueciae.
Les Résultats de dénombrement sont exprimés en densité absolue ou abondance
(individus par mètre cube ou ind. m-3) et en pourcentage de d’abondance ou
fréquence relative (%).
Chapitre III: Composition et abondance du zooplancton
HADEF Hala 15
3. Variabilité et composition du zooplancton
3.1. Variabilité numérique du zooplancton total
Au cours de la période d'étude, l'abondance du zooplancton est faible et a
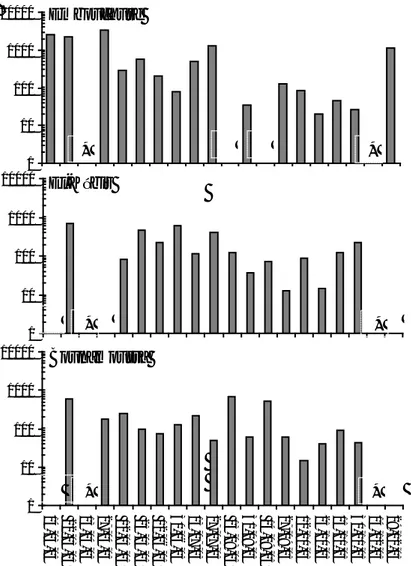
fortement varié entre 13 et 3399 ind.m-3 (Figure 5). Cette cinétique est en
relation directe avec les évènements hydrauliques de fermeture et d'ouverture de l'estuaire. On comprend en effet que le zooplancton estuarien n'est que la somme des apports marins et continentaux d'espèces respectivement marines et dulçaquicoles en plus de quelques rares formes typiquement estuariennes. On s'attendrait la dominance des formes continentales en hiver et des formes marines en été alors qu'au cours du printemps et de l'automne se développent les espèces estuariennes susceptibles de tolérer la variabilité imprévisible de la salinité. La dynamique du zooplancton de l'estuaire du Mafrag suit sensiblement ces influences contrastées. La faune planctonique dulçaquicole abonde en hiver avec les Copépodes, les Cladocères et les Rotifères en provenance des marécages et des rivières. Il d'une recolonisation à partir des œufs de résistance de ces crustacés, puisque les marécages s'assèchent entièrement en été alors que les ces Crustacés passent sous forme de résistance pour assurer la survie. C'est en effet en cette époque de l'année que l'abondance arrive au maximum et se traduit par des densités moyennes de l'ordre de quelques milliers en hiver (Figure 5). Les populations marines de quelques Copépodes, les œufs d'Anchois et quelques Cladocères prennent le relais à partir du printemps avec une présence juste fugace puisqu'ils n'arrivent pas à se maintenir dans l'estuaire. C'est le cycle de marée qui commande leur présence d'où les fluctuations en dents de scie (Figure 5). L'essentiel de l'effectif zooplanctonique revient au
Copépode côtier (
Acartia latisetosa
), très caractéristique des aires côtières peuChapitre III: Composition et abondance du zooplancton
HADEF Hala 16
Figure 5 : Evolution de la densité (ind.m-3, échelle logarithmique) du zooplancton total dans les trois stations du système estuarien du Mafrag.* : période de crue non échontillonnée, ● : pas d’échontillon.
3.2. Composition
Le zooplancton totale comprend 11 groupes zoologique .leurs fréquences d’abondance est donnée dans les tableaux 6, 7et 8. Le groupe le plus important est ce lui des copépodes représentent avec une proportion annuel 51% dans l’ensemble du stations de la faune zoologiques. La dominance des copépodes varie entre 2%-98% ou la fréquence maximale est représentée dans El-Kébir en hiver 98% (Tableau 8). Ces crustacés sont suivis par le méroplancton les larves de cirripèdes qui forment une part non négligeable atteignent une fréquence annuel de l’ordre de24%,la fréquence maximal et de 95% dans Bounamoussa en été (Tableau 9 ). Viennent ensuite les cladocères qui sont présent pendant toutes l’année est qui atteignent une fréquence annuel de l’ordre de 8%, le maximale de fréquence est observé dans Bounamoussa 62% (Tableau 9). 1 10 100 1000 10000
●
●
*
*
1 10 100 1000 10000●
●
●
*
*
1 10 100 1000 10000 14, 03, 05 22, 03, 05 13, 04, 05 27, 04, 05 12, 05, 05 25, 05, 05 12, 06, 05 30, 06, 05 13, 07, 05 27, 07, 05 13, 08, 05 31, 08, 05 14, 09, 05 27, 09, 05 12, 10, 05 25, 10, 05 15, 11, 05 30, 11, 05 14, 12, 05 29, 12, 05●
*
*
●
El-Kébir Embouchure BounamoussaChapitre III: Composition et abondance du zooplancton
HADEF Hala 17
On ne peut pas négliger le groupe de rotifères qui sont représenté avec une fréquence annuelle de l’ordre de 2%, mais en hiver une fréquence très importante atteint jusqu’à 36% dans l'Embouchure (Tableau 7).
Ce qui concerne les larves de décapodes est présent annuellement avec une fréquence de l’ordre de 7%. Pendant toute l’année il y’a une variation de fréquence mais la plus remarquable c’est on été avec une fréquence maximale 57% dans El-Kébir (Tableau 8). L’ichtyoplancton et la forme tomporairement la moins abondante avec une fréquence annuel de 4%, ou à l’Embouchure atteignent une valeur maximale de l’ordre de 66% (Tableau 7) en été. Ensuite les Ostracodes sont présents avec une faible fréquence annuelle de l’ordre de 3%, ce groupe zoologique est remarqué avec une proportion maximale de l’ordre de 33% à El-Kébir en Automne (Tableau 8). Les appendiculaires qui sont présent au période de printemps ces filtreures présentent avec une fréquence annuelle de l’ordre de 0.22 %, et un maximum de fréquence de l’ordre de 6% à l’Embouchure (Tableau 7). Les larves de polychètes sont présentes par une faible fréquence de l’ordre de 3%. En fin, les plus rare sont les mysidacés et les amphipodes avec des faibles fréquences ne dépassent pas 1%, sauf une exception remarquable dans Bounamoussa pour les amphipodes ou la fréquence maximale est de l’ordre de 9% (Tableau 9) en automne.
Sur le plan numérique dans l’ensemble de la zone étudié l’abondance du
zooplancton superficiel fortement varié entre 13 et 3399 ind.m-3, On considère
que ces valeurs sont très faibles et peuvent ne pas représenter fidèlement l'abondance de la colonne d'eau. Cette sous-estimation est liée aux manœuvres du filet d'une part qui ne récolte que le plancton de surface et aux problèmes d'entraînement irrégulier du filet d'autre part. Dans le temps la forte densité du zooplancton total de surface dans l’air étudiée, se rencontre en hiver par suite des apports supplémentaires du plancton de marécages environnants et du plancton dulçaquicole. L’été montre aussi des densités zooplanctoniques comparables à celles de l’hiver dans Bounamoussa et l’Embouchure en raison des apports marins. Le printemps qui caractérise la phase proprement estuarienne se trouve presque défauné par suite de la forte variabilité de la salinité au grès de la marée. Lorsque l'on passe à l'automne où l'estuaire est franchement déconnecté à la fois de la mer et du continent, le milieu s'appauvrit et l'on récolte ainsi les formes typiquement estuariennes, très peu abondantes par ailleurs.
Chapitre III: Composition et abondance du zooplancton
HADEF Hala 18
Tableau 7 : Abondance et fréquence relative (%) annuelles des taxons zoo planctoniques récoltés en 2005 dans la station Embouchure du système estuarien du Mafrag.
Groupes zoologiques 14,03,05 22,03,05 27,04,05 12,05,05 25,05,05 12,06,05 30,06,05 13,07,05 27,07,05 Annélides polychètes 0,00 1,10 0,00 0,00 2,45 0,87 0,10 0,22 1,34 Rotifères 23,74 36,26 0,48 1,81 0,00 0,00 0,00 0,13 0,00 Cladocères 26,75 28,92 0,97 9,06 3,53 0,00 3,46 53,41 0,67 Ostracodes 0,00 0,34 0,09 0,10 0,14 0,94 0,63 2,50 0,36 Copépodes 48,31 29,27 87,74 57,40 12,09 9,08 61,39 14,23 94,51 Larves de cirripèdes 0,00 0,00 1,93 18,83 15,01 82,50 21,72 23,20 1,96 Mysidacés 0,00 0,00 0,00 0,00 0,20 0,00 0,00 0,06 0,04 Amphipodes 0,00 0,00 0,00 0,00 0,20 0,87 0,42 0,29 0,00 Larves de décapodes 0,13 0,41 2,95 12,39 0,00 1,27 12,28 5,80 1,07 Appendiculaires 0,00 3,63 5,85 0,10 0,07 0,00 0,00 0,03 0,00 Ichtyoplancton (œufs et larves de poissons) 1,07 0,07 0,00 0,30 66,30 4,48 0,00 0,13 0,04 Zooplancton total 2536 2294 3399 293 578 208 79 496 1277 Groupes zoologiques 31,08,05 27,09,05 12,10,05 25,10,05 15,11,05 30,11,05 29,12,05 Annélides polychètes 0,00 0,86 0,00 0,00 0,00 0,31 0,20 Rotifères 0,00 1,24 0,00 0,00 0,00 0,00 5,09 Cladocères 0,82 1,14 0,53 21,52 40,00 2,50 4,35 Ostracodes 20,23 0,67 0,40 0,30 4,93 0,94 0,00 Copépodes 48,19 72,24 87,55 70,61 40,80 85,31 89,73 Larves de cirripèdes 3,13 19,58 7,55 1,82 12,40 2,81 0,59 Mysidacés 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Amphipodes 0,82 0,00 0,40 0,00 0,13 2,50 0,00 Larves de décapodes 21,71 3,42 3,58 2,42 0,00 0,00 0,05 Appendiculaires 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Ichtyoplancton (œufs et larves de
poissons) 5,10 0,86 0,00 3,33 1,73 5,62 0,00
Zooplancton total 36 129 81 19 44 26 1136
Tableau 8 : Abondance et fréquence relative (%) annuelles des taxons zoo planctoniques récoltés en 2005 dans la station El-Kébir du système estuarien du Mafrag .
Groupes zoologiques 22,03,05 12,05,05 25,05,05 12,06,05 30,06,05 13,07,05 27,07,05 Annélides polychètes 1,88 0,40 2,67 1,31 0,05 0,00 0,00 Rotifères 10,82 0,99 0,25 0,00 0,00 1,38 0,00 Cladocères 20,47 2,38 13,75 0,13 0,00 17,68 0,04 Ostracodes 1,18 0,00 0,00 0,19 0,23 4,58 4,49 Copépodes 62,35 79,21 63,92 9,46 7,91 15,23 21,64 Larves de cirripèdes 0,00 0,99 1,25 33,56 86,45 47,07 71,50 Mysidacés 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Amphipodes 0,00 1,98 0,83 0,19 0,18 0,32 0,00 Larves de décapodes 1,88 13,27 16,17 54,23 4,81 13,53 2,34 Appendiculaires 0,71 0,00 0,00 0,00 0,00 0,00 0,00 Ichtyoplancton (œufs et larves de
poissons) 0,71 0,79 1,17 0,94 0,37 0,21 0,00
Chapitre III: Composition et abondance du zooplancton
HADEF Hala 19
Tableau 8 : Suite abondance et fréquence relative (%) annuelles des taxons zoo planctoniques récoltés en 2005 dans la station El-Kébir du système estuarien du Mafrag .
Groupes zoologiques 13,08,05 31,08,05 14,09,05 27,09,05 12,10,05 25,10,05 15,11,05 30,11,05 Annélides polychètes 0,00 0,00 1,58 0,92 0,00 0,82 0,00 0,00 Rotifères 0,00 0,00 0,26 0,00 0,00 1,23 0,00 0,00 Cladocères 0,00 0,82 0,00 0,00 2,29 0,41 23,79 0,00 Ostracodes 13,29 20,23 2,63 33,49 3,05 0,00 1,75 0,00 Copépodes 42,98 48,19 24,47 20,18 56,49 62,55 38,53 98,49 Larves de cirripèdes 42,49 3,13 0,26 23,39 17,56 13,58 35,26 0,38 Mysidacés 0,00 0,00 0,00 0,00 0,00 0,41 0,00 0,00 Amphipodes 0,00 0,82 2,63 6,42 3,05 0,82 0,00 0,57 Larves de décapodes 0,55 21,71 57,11 2,29 5,34 0,82 0,00 0,00 Appendiculaires 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,28 Ichtyoplancton (œufs et larves de poissons) 0,69 5,10 11,05 13,30 12,21 19,34 0,66 0,28 Zooplancton total 119 36 71 13 87 14 124 221
Tableau 9 : Abondance et fréquence relative (%) annuelles des taxons zoo planctoniques récoltés en 2005 dans la station Bounamoussa du système estuarien du Mafrag .
Groupes zoologiques 22,03,05 27,04,05 12,05,05 25,05,05 12,06,05 30,06,05 13,07,05 27,07,05 Annélides polychètes 0,13 0,00 0,19 0,25 0,22 2,77 0,12 1,20 Rotifères 2,65 2,44 0,10 0,00 0,00 0,00 0,12 0,00 Cladocères 62,20 2,89 0,38 0,12 0,00 1,61 2,01 0,17 Ostracodes 0,80 1,11 0,00 0,00 1,91 0,58 2,62 6,84 Copépodes 31,43 83,78 2,87 24,29 10,34 58,74 29,20 34,36 Larves de cirripèdes 0,00 1,56 95,32 72,74 72,70 32,69 56,75 36,41 Mysidacés 0,00 0,00 0,00 0,00 1,12 0,00 0,06 0,17 Amphipodes 0,00 0,44 0,00 0,00 0,90 0,84 0,00 0,51 Larves de décapodes 1,46 4,89 0,57 1,36 7,75 1,68 8,45 16,75 Appendiculaires 0,00 0,00 0,00 0,00 0,00 0,06 0,00 0,00 Ichtyoplancton (œufs et larves
de poissons) 1,33 2,89 0,57 1,24 5,06 1,03 0,30 0,51 Zooplancton total 592 177 247 95 74 129 210 48 Groupes zoologiques 13,08,05 31,08,05 14,09,05 27,09,05 12,10,05 25,10,05 15,11,05 30,11,05 Annélides polychètes 0,00 0,00 0,00 0,20 0,00 0,74 0,00 0,39 Rotifères 0,00 0,00 0,25 0,00 0,00 0,00 0,00 0,00 Cladocères 0,00 0,00 0,00 0,00 0,00 2,38 12,00 0,58 Ostracodes 7,68 1,16 0,50 3,36 1,18 0,15 1,34 0,00 Copépodes 66,02 80,53 94,88 53,61 86,67 37,59 39,54 91,07 Larves de cirripèdes 23,98 11,72 3,30 30,27 0,00 54,38 45,58 3,11 Mysidacés 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,39 Amphipodes 0,00 1,49 0,41 8,90 0,39 0,30 0,07 0,78 Larves de décapodes 1,73 1,16 0,17 1,38 4,31 0,15 0,00 0,00 Appendiculaires 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Ichtyoplancton (œufs et larves
de poissons) 0,59 3,96 0,50 2,27 7,45 4,31 1,47 3,69
Chapitre III: Composition et abondance du zooplancton
HADEF Hala 20
4. Principaux groupes zooplanctoniques
4.1. Les Copépodes
Les copépodes constituent le groupe le plus abondant, l’essentiel de l’abondance numérique revient portent à des espèces qui sont présentent densité très variables. L’ensemble d’espèces constitué 95% de copépode défèrent considérablement d’une population à l’autre, les déférences sont reliées avec le cycle biologique, condition thermique, halin, photique ……..etc.
La fréquence maximale de zooplancton superficielle est remarquée dans l’Embouchure en été avec une fréquence de 94% a l’Embouchure (Tableau 7). L’étude systématique de l’ensemble du zooplancton récolté en 2005 dans le système estuarien de la mafrag, on a permis d’identifier 44 espèces appartenant à 5 embrenchement (Tableau 10).
Les copépodes dominés d’un point de vue taxonomique par les Calanoides (9 espèces), les cyclopides (4 espèces),les harpacticoides (1espèces). Les
principaux éléments de copépodes ont une affinité néritique comme
: Acartia
latisétosa, Acartia clausi, Centropage typicus, Euterpina acutifrens, Oithona nana, les autres
espèces de copépodes étudiés ont une affinité côtière tel que :Eudiaptomus coeruleus,
Hémidiaptomus amblyodon, Arctodiaptomus wierzejski, Calanépida aqua-dulcis .
Chapitre III: Composition et abondance du zooplancton
HADEF Hala 21
Tableau 10: la liste systématique des espèces de zooplancton récolté dans l’estuaire du Mafrag entre mars – décembre 2005.
Cette dominance numérique revient seulement à 7 espèces (Tableau 11, 12 et 13) ces principales espèces sont :
Acartia latisetosa
C’est une espèce a une affinité néritique elle représenté dans
l’ensemble des stations étudiés avec une densité de l’ordre de 35 ind.m-3, une
proportion maximale de l’ordre de 27% des copépodes (Tableau 11) à l’embouchure en décembre.
ASCHELMINTHES Rotifères
Brachionus sp.,
Brachionus quadridentatus ( Hermann, 1783) Brachionus plicatilis (O.F.M, 1786) Platyias quadricornus (Ehrenberg , 1832) Keratella valga (Ehrenberg, 1834) Lecane sp.,
ANNELIDES
● Polychètes
Larves (Grégoire Trégouboff et Maurice Rose, 1978)
Arthropodes
● BRANCHIOPODES
Cladocères
Podon polyphémoides (Leukart, 1859) Evaden spinifera (P.E.Muller, 1867)
Daphnia longispina (Rhode et G.Frey, 1900) Simocephalus expinosus (Rhode et G.Frey 1900) Cériodaphnia mégalops (Rhode et G.Frey, 1900) Cériodaphnia pulchella typica (Rhode et G.Frey, 1900) Bosmina longirostris (Rhode et G.Frey, 1900)
Pleuroxus striatus (Rhode et G.Frey, 1900) Pleuroxus sp. (Rhode et G.Frey, 1900) Chydorus globosus (Rhode et G.Frey, 1900) Chydorus ovalis (Rhode et G.Frey, 1900)
● OSTRACODES
Myodocopes
Xestolebris depressa (Grégoire Trégouboff et Maurice
Rose, 1978)
Cythéridès sp. (Grégoire Trégouboff et Maurice Rose,
1978)
● COPEPODES
Calanoides Diatomidae
Hémidiaptomus amblyodon (Marenzeller, 1873) Eudiaptomus coeruleus (S.Fischer, 1853) Arctodiaptomus wierzejskii (Richard, 1888) Pseudodiaptomidae
Calanipéda aqua-dulcis (Kritchaguine, 1873 Acartidae
Acartia latisétosa (Kritchaguine, 1873) Acartia clausi (Giesbrecht, 1889) Acartia grani ( Sars, 1904) Centropage typicus (Kroyer, 1849) Centropage ponticus (Karavaey, 1894) Cyclopoides
Oithona nana (Giesbrecht, 1892) Oithona sp.
Acanthocyclops américanus (Marsh, 1893) Halicyclops neglectus (Kiefer, 1935) Harpacticoides
Euterpina acutifrons (Dana, 1847) ● CIRRIPEDES Balanus sp. ● PERACARIDES Amphipodes (indéterminé) ● EUCARIDES Décapodes (larves)
Eriphia spinifrons (Herbst, 1785) TUNICIERS
● APPENDICULLAIRES
Oikopleura sp. VERTEBRES
● Poissons ACTINOPTERYGIENS
(Œufs et larves) Larves (Grégoire Trégouboff et Maurice Rose, 1978)
Chapitre III: Composition et abondance du zooplancton
HADEF Hala 22
Hemdiaptomus amblyodon
Cette espèce est moins fréquente que la précédente, elle vit dans les eaux plus ou moins temporaires et les endroits marécageux des foret, elle est rencontré de
dans les trois stations avec une variété de densité la plus élevés est 18ind.m-3,
soit 18% de l'effectif zooplanctonique (Tableau 12) dans El-Kébir .
Eudiaptomus coeruleus
C’est une espèce planctonique se trouve dans les lacs eurytherme, dicyclique parfois monocyclique, très phototropique négative, elle existe parfois dans les fleuves à cours lent. Le maximum est noté dans El-Kébir avec une une densité de
l’ordre de 83 ind.m-3 et proportion de 17% de copépodes (Tableau 12).
Arctodiaptomus wierzejski
C’est une espèces d’eau temporaire et des lacs eurytherme et euryhalin, rencontrés aussi bien en eaux chaudes qu’en eaux permanentes pouvant geler l’hiver, on note que c’est une espèce marécageuse qui a existé au début et à la fin du cycle étudié correspondant aux périodes humides, pendant la récolte zooplanctonique en 2005 est rencontré uniquement dans l’Embouchure en hiver
avec une densité 37 ind.m-3, soit 3 % de l'effectif zooplanctonique (Tableau 11).
Calanipida aqua –dulcis
C’est une espèces d’eau douce, eurytherme, euryhaline, elle a développement hivernal, on note une augmentation consédérable de fréquence au niveau de
El-Kébir 61% (Tableau 12) avec une densité de l’ordre de 136 ind.m-3.
Centropage ponticus
C’est une espèce néritique s’abondance n’évolue pas tros d’une station à l’autre,
une densité maximale se trouve au niveau de l’Embouchure en juillet de
l’ordre386 ind.m-3, avec une proportion de 30% de copépodes (Tableau 11).
Acanthocyclops americanus
Cette espèce Elle est rencontrée presque tout le long de l’année mais avec des faibles densités et proportions, une densité la plus élevés et de l’ordre de 380
ind.m-3, avec une fréquence 33% de copépodes (Tableau 11) dans l’Embouchure.
On constate que les plus forts effectifs se rencontrent à la station embouchure durant la période d’ouverture. Il semble que l’espèce proviendrait des marécages environnants pour coloniser périodiquement l’estuaire conformément à ces aptitudes d’euryhalinité.
Chapitre III: Composition et abondance du zooplancton
HADEF Hala 23 Les autres copépodes sont représenté avec des faibles proportions ne dépasse
pas 1% les résultats sont exprimer au tableau 11, 12 et 13, sauf pour quelque
exception. Tel que
Halicyclops neglectus
qu’elle est présente avec une proportionde l’ordre de 3.62% en décembre (Tableau 11) dans l’embouchure. Et pour
l’espèce
Centropage typicus
cette espèces a une affinité néritique, pendant larécolte zooplanctonique elle est rencontré uniquement dans l’Embouchure avec une très faible fréquence de l’ordre de 0.94% des copépodes (Tableau 11).
Tableau 11 : Abondance et fréquences (%) bimensuelle des Copépodes récoltés en 2005 dans la station Embouchure du système estuarien du Mafrag.
14,03,05 22,03,05 27,04,05 12,05,05 25,05,05 12,06,05 30,06,05 13,07,05
Calanoides Acartia latisétosa 0,00 0,00 0,00 0,00 0,00 0,27 0,52 4,82
Acartia clausi 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Acartia grani 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Hémidiaptomus omblyodon 9,71 5,14 12,34 9,16 1,63 0,00 0,00 0,13 Eudiaptomus coeruleus 3,08 1,23 7,51 7,85 0,82 0,00 0,00 0,06 Arctodiaptomus weirzejskii 2,08 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Calanépida aqua-dulcis 0,00 0,00 0,00 0,00 0,00 0,00 0,21 0,03 centrpages ponticus 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,03 Centropages typicus 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00
Cyclopoides Oithona nana 0,00 0,00 0,04 0,91 0,75 0,07 0,00 0,76
Oithona sp 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,70
Acanthocyclops méricanus 1,14 2,54 1,14 1,81 0,95 0,00 0,00 0,13
Halicyclops neglectus 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,19
Harpcticoides Euterpina acutéfrons 0,20 0,00 0,13 0,20 0,07 0,13 0,07 0,25
Copépodes divers 1,44 0,00 2,24 2,11 0,48 0,13 0,00 0,00
Copépodites divers 28,32 17,49 52,22 34,74 7,34 8,22 60,02 5,01
Nauplii 2,34 2,88 11,99 0,60 0,07 0,27 0,63 2,12
copépode total 1168,10 671,54 2980,66 168,08 69,59 18,89 48,75 70,60
27,07,05 31,08,05 27,09,05 12,10,05 25,10,05 15,11,05 30,11,05 29,12,05
Calanoides Acartia latisétosa 2,50 1,48 27,28 0,66 1,82 5,47 0,00 0,00
Acartia clausi 0,00 0,66 0,00 0,00 0,00 2,40 0,00 0,00 Acartia grani 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Hémidiaptomusomblyodon 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Eudiaptomus coeruleus 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,59 Arctodiaptomus weirzejskii 0,00 0,00 0,00 0,00 0,00 0,00 0,00 3,28 Calanépida aqua-dulcis 0,00 18,59 2,38 22,12 21,21 0,27 37,50 0,00 centrpages ponticus 30,20 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Centropages typicus 0,94 0,00 0,00 0,00 0,00 0,00 0,00 0,00
Cyclopoides Oithona nana 0,18 0,33 0,67 0,00 0,00 0,00 0,00 0,00
Oithona sp 0,18 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Acanthocyclopsaméricanus 0,00 0,00 0,00 0,00 0,00 0,00 0,00 33,50 Halicyclops neglectus 0,09 0,49 0,00 0,00 0,00 0,00 1,25 3,62
Harpcticoides Euterpina acutéfrons 0,98 0,00 0,19 0,00 0,00 0,00 0,00 0,00
Copépodes divers 0,00 0,66 1,24 1,32 0,00 0,13 0,00 0,00 Copépodites divers 59,37 24,51 37,55 60,66 42,73 22,53 45,94 42,35 Nauplii 0,09 1,48 2,95 2,78 4,85 10,00 0,62 6,41