HAL Id: dumas-01684591
https://dumas.ccsd.cnrs.fr/dumas-01684591
Submitted on 15 Jan 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
vivant avec le VIH en Guyane Française
Sophie Morote
To cite this version:
Sophie Morote. Histoplasmose cutanéo-muqueuse chez les patients vivant avec le VIH en Guyane Française. Médecine humaine et pathologie. 2017. �dumas-01684591�
ET DE LA GUYANE 2017
HYACINTHE BASTARAUD N° 2017ANTI0190
HISTOPLASMOSE CUTANEO-MUQUEUSE
CHEZ LES PATIENTS VIVANT AVEC LE VIH
EN GUYANE FRANCAISE
THESE
Présentée et soutenue publiquement en visioconférence à la Faculté de Médecine de Marseille,
pour la Faculté de Médecine Hyacinthe BASTARAUD des Antilles et de la Guyane et examinée par les Enseignants des dites Facultés.
Le 3 octobre 2017
Pour obtenir le grade de DOCTEUR EN MEDECINE
Par
Sophie MOROTE
Examinateurs de la thèse:
Monsieur Pierre COUPPIE Professeur, Président
Monsieur Philippe BROUQUI Professeur
Madame Magalie DEMAR Professeur
Monsieur Mathieu NACHER Professeur
Monsieur Stéphane RANQUE Maître de conférence
LISTE DES ENSEIGNANTS
Université des Antilles et de la Guyane
Faculté de médecine Hyacinthe Bastaraud
UNIVERSITE DES ANTILLES
**************************************************
FACULTE DE MEDECINE HYACINTHE BASTARAUD
***
Administrateur Provisoire : Jacky NARAYANINSAMY Doyen de la Faculté de Médecine : Raymond CESAIRE
Vice-Doyen de la Faculté de Médecine: Suzy DUFLO
Professeurs des Universités - Praticiens Hospitaliers
NEVIERE Rémi Physiologie
CHU de MARTINIQUE Tel : 05 96 - Fax : 05 96
Bruno HOEN Maladies Infectieuses
CHU de POINTE- À -PITRE/ABYMES
Tel : 05 90 89 15 45
Pascal BLANCHET Chirurgie Urologique
CHU de POINTE- À -PITRE/ABYMES
Tel : 05 90 89 13 95 - Tel/Fax 05 90 89 17 87
André-Pierre UZEL Chirurgie Orthopédique et Traumatologie
CHU de POINTE-A-PITRE/ABYMES
Tel : 05 90 89 14 66 – Fax : 0590 89 17 44
Pierre COUPPIE Dermatologie
CH de CAYENNE Tel : 05 94 39 53 39 - Fax : 05 94 39 52 83
Thierry DAVID Ophtalmologie
CHU de POINTE-A-PITRE/ABYMES Tel : 05 90 89 14 55 - Fax : 05 90 89 14 51
Suzy DUFLO ORL – Chirurgie Cervico-Faciale
CHU de POINTE-A-PITRE/ABYMES
Tel : 05 90 93 46 16
Eustase JANKY Gynécologie-Obstétrique
Tel 05 90 89 13 89 - Fax 05 90 89 13 88
DE BANDT Michel Rhumatologie
CHU de MARTINIQUE
Tel : 05 96 55 23 52 - Fax : 05 96 75 84 44
François ROQUES Chirurgie Thoracique et Cardiovasculaire
CHU de MARTINIQUE Tel : 05 96 55 22 71 - Fax : 05 96 75 84 38
Jean ROUDIE Chirurgie Digestive
CHU de MARTINIQUE Tel : 05 96 55 21 01 Tel : 05 96 55 22 71 - Fax : 05 96 75 84 38
Jean-Louis ROUVILLAIN Chirurgie Orthopédique
CHU de MARTINIQUE
Tel : 05 96 55 22 28
SAINTE-ROSE Christian Neurochirurgie Pédiatrique
CHU de MARTINIQUE
Tel : 05 96
André CABIE Maladies Infectieuses
CHU de MARTINIQUE Tel : 05 96 55 23 01
Philippe CABRE Neurologie
CHU de MARTINIQUE Tel : 05 96 55 22 61
Raymond CESAIRE Bactériologie-Virologie-Hygiène option virologie
CHU de MARTINIQUE Tel : 05 96 55 24 11
Michel CARLES Anesthésiologie/Réanimation
CHU de POINTE- À -PITRE/ABYMES
Tel : 05 96 89 11 82
Maryvonne DUEYMES-BODENES Immunologie
CH de CAYENNE Tel : 05 96 55 24 24
Régis DUVAUFERRIER Radiologie et imagerie Médicale
CHU de MARTINIQUE Tel : 05 96 55 21 84
Annie LANNUZEL Neurologie
CHU de POINTE- À -PITRE/ABYMES
Tel : 05 90 89 14 13
Louis JEHEL Psychiatrie Adulte
CHU de MARTINIQUE Tel : 05 96 55 20 44
Mathieu NACHER Epidémiologie
CH de CAYENNE Tel : 05 94 93 50 24
Guillaume THIERY Réanimation
CHU de POINTE-A-PITRE/BYMES
Magalie DEMAR-PIERRE Parasitologie et Infectiologue
CH de CAYENNE
Tel : 05 94 39 53 09
Vincent MOLINIE Anatomie Cytologie Pathologique
CHU de MARTINIQUE
Tel : 05 96 55 20 85/55 23 50
Philippe KADHEL Gynécologie-Obstétrique
CHU de POINTE-A-PITRE/ABYMES
Tel : 05 90
Jeannie HELENE-PELAGE Médecine Générale
Cabinet libéral au Gosier Tel : 05 90 84 44 40 - Fax : 05 90 84 78 90
MEJDOUBI Mehdi Radiologie et Imagerie
CHU de MARTINIQUE Tel : 05 96
Professeurs des Universités Associé
Karim FARID Médecine Nucléaire
CHU de MARTINIQUE
Tel : 05 96
Maître de Conférences des Universités - Praticiens Hospitaliers
Christophe DELIGNY Gériatrie et biologie du vieillissement
CHU de MARTINIQUE Tel : 05 96 55 22 55
Jocelyn INAMO Cardiologie
CHU de MARTINIQUE
Tel : 05 96 55 23 72 - Fax : 05 96 75 84 38
Franciane GANE-TROPLENT Médecine générale
Cabinet libéral les Abymes Tel : 05 90 20 39 37
Fritz-Line VELAYOUDOM épse CEPHISE Endocrinologie
CHU de POINTE- À -PITRE/ABYMES Tel : 05 90 89 13 03
Marie-Laure LALANNE-MISTRIH Nutrition
CHU de POINTE- À -PITRE/ABYMES Tel : 05 90 89 13 00
Sébastien BREUREC Bactériologie &Vénérologie
Tel : 05 90 89 12 80
Narcisse ELENGA Pédiatrie
CH de CAYENNE
Tél : 0590 Tel : 05 94
GELU-SIMEON Moana Gastroentérologie
CHU de POINTE-A-PITRE/ABYMES Tel : 05 90 - Fax : 05 90 75 84 38
Chefs de Clinique des Universités - Assistants des Hôpitaux
DARCHE Louis Chirurgie Générale et Viscérale
CHU de MARTINIQUE Tel : 05 96 55 21 01
MARY Julia Rhumatologie
CHU de MARTINIQUE Tel : 05 96 55 23 52
MOINET Florence Rhumatologie et Médecine Interne
CHU de MARTINIQUE
Tel : 05 55 22 55 Tel : 05 90 89 14 55
Philippe CARRERE Médecin Générale
CHU de POINTE- À -PITRE/ABYMES
Tel : 06 90 99 99 11
DE RIVOYRE Benoit Ophtalmologie
CHU de POINTE- À -PITRE/ABYMES
Tel : 05 90 89 14 50
SEVERYNS Mathieu Orthopédie
CHU de MARTINIQUE Tel : 05 90 55 22 28
NABET Cécile Parasitologie et Mycologie
CH de CAYENNE Tel : 05 94
DOURNON Nathalie Maladies Infectieuses
CHU de POINTE- À -PITRE/ABYMES Tel : 05 96
BORJA DE MOZOTA Daphné Gynécologie Obstétrique
CHU de POINTE- À –PITRE/ABYMES Tel : 0590 89 19 89
DEBBAGH Hassan Urologie
CHU de MARTINIQUE Tel : 0596 55 22 71
JACQUES-ROUSSEAU Natacha Anesthésiologie/Réanimation
CHU de POINTE- À -PITRE/ABYMES
Tel : 05 96 89 11 82
BANCEL Paul ORL
Tel : 05 90 93 46 16
MONFORT Astrid Cardiologie
CHU de MARTINIQUE
Tel : 05 96 55 23 72
PARIS Eric Réanimation
CHU POINTE-A-PITRE/ABYMES
Tel : 05 94 3953 39
SAJIN Ana Maria Psychiatrie
CHU de MARTINIQUE
Tel : 05 96 55 20 44
GHASSANI Ali Gynécologie Obstétrique
CHU de POINTE- À –PITRE/ABYMES Tel : 0590 89 19 89
PIERRE-JUSTIN Aurélie Neurologie
CHU POINTE-A-PITRE/ABYMES
Tel : 05 90 89 13 40
GALLI-DARCHE Paola Neurologie
CHU de MARTINIQUE
MOUREAUX Clément Urologie
CHU POINTE-A-PITRE/ABYMES Tel : 05 9089 13 95
MOUNSAMY Josué Médecine Générale
Clinique les Nouvelles Eaux Marines et Cabinet Tel : 0590
PLACIDE Axiane Médecine Générale
CHU de MARTINIQUE Tel : 0590
NIEMETZKY Florence Médecine Générale
CH de CAYENNE Tel : 0596 55 22 28
Professeurs EMERITES
CARME Bernard Parasitologie
CHARLES-NICOLAS Aimé Psychiatrie Adulte
A Monsieur le Professeur Pierre Couppié,
Vous me faites l’honneur de présider ce jury de thèse.
Je vous remercie de m’avoir proposé ce sujet, ainsi que pour votre pédagogie et la grande disponibilité dont vous avez fait preuve à mon égard durant mon stage dans votre service de Dermatologie à Cayenne.
Veuillez trouver ici l’expression de ma sincère gratitude et de ma plus grande estime.
A Monsieur le Professeur Philippe Brouqui, Vous me faites l’honneur de juger ce travail.
Vous m’avez accueillie en tant qu’externe dans votre service de Maladies Infectieuses où j’ai pu apprendre les bases de la médecine et de l’infectiologie.
Veuillez trouver ici l’expression de toute ma reconnaissance et de mon profond respect.
A Madame le Professeur Magalie Demar,
Vous me faites l’honneur de juger ce travail. Veuillez recevoir l'expression de toute ma gratitude.
A Monsieur le Professeur Mathieu Nacher,
Vous me faites l’honneur de juger ce travail.
Vos nombreux travaux m’ont énormément aidée dans mes recherches. Veuillez trouver ici l’expression de mon profond respect.
A Monsieur le Docteur Stéphane Ranque,
Vous me faites l’honneur de juger ce travail.
Veuillez trouver ici l’expression de ma profonde reconnaissance.
A Monsieur le Docteur Antoine Adenis,
Merci de me faire l’honneur de juger ce travail.
Tu m’as accompagnée tout au long de cette étude, avec une grande disponibilité, un enthousiasme, une gentillesse et une patience à toute épreuve.
A Monsieur le Docteur Vincent Vantilcke, chef de service de Médecine au Centre Hospitalier de l’Ouest Guyanais, et son équipe ;
A Monsieur le Docteur Fernand Alvarez, chef de service de Médecine au Centre Médico Chirurgical de Kourou ;
A Monsieur le Docteur Felix Djossou, chef de service de l’Unité des Maladies Infectieuses et Tropicales au Centre Hospitalier de Cayenne.
Merci de m’avoir accueillie dans vos services, afin de me permettre d’effectuer ce travail.
A toute l’équipe du service de Dermatologie de l’Hôpital de Cayenne, A Madame le Docteur Dominique Sainte-Marie,
A Madame le Docteur Julie Dufour, A Madame le Docteur Emilie Sambourg,
à Claire, Christiane, et toute l’équipe paramédicale.
A ma famille ...
A mon père…
Tu as toujours été un modèle pour moi, tu nous as transmis le goût d’apprendre, l'opiniâtreté, l’intégrité et le courage. Tu as toujours tout fait pour nous donner les moyens de réussir, et nous convaincre que tout était possible. Sans toi je n’en serais pas là aujourd’hui et aucun mot n’est assez fort pour te dire combien je t’aime et je t’admire.
A ma mère…
Tu m’as supporté tout le long de ces études et tellement plus encore, tu m’épaules tout au long de ma vie. Merci pour ta patience, ta douceur et ton optimisme sans failles. Tu es une femme exceptionnelle et je t’aime de tout mon cœur.
A Marie…
Tu es la meilleure sœur du monde, ma lumière et mon repère de toujours. Je suis si fière de toi, de ta bravoure et de ta détermination. Tu n’as aucune idée du bonheur que tu m’as apporté et que tu m’apportes chaque jour. Tu pourras toujours compter sur moi.
A Aeneli...
Tu as bouleversé mon existence et l’illumine au quotidien. Merci pour ton soutien indéfectible, ta patience et tes encouragements si précieux... Tu es une personne unique, optimiste, généreuse, tolérante et tellement plus... qui me fait grandir chaque jour. Je t’aime.
A ma Tante Sylvie pour ta bienveillance.
A mes grands parents, Lucette, Simone, Jacques et Gérard, que j’admire. A Cédric, Melissa et leurs jolies familles. A Brigitte et Eric.
A Didier.
A Régine, Réginou, Olivia, Marc, Eva, David, Christina et Aston, Marcos et Daniel, Claudet, Manon, Catherine et Laurence. A mon oncle Marcel. Vous êtes loin mais je ne vous oublie pas.
A Fatima, Bibi et ses enfants, Ahmed et toute la famille M’Madi, merci de m’avoir si bien accueillie parmi vous.
A mes proches...
A Elsa, ma sœur de cœur, tu es une personne extraordinaire, présente à mes côtés depuis toujours, dans les meilleurs comme dans les pires moments. Je suis heureuse, chanceuse et fière d’avoir une amie comme toi.
A Saïd, Owwwww ! La famille, mon compère et comparse, pour toutes ces péripéties, souvenirs inoubliables, et ton éternelle joie de vivre.
A Lindsay, présent depuis le Lycée, et Julie et Louis (MSJ). A toutes ces années qui ne nous rajeunissent pas et qui ont fait de toi un frère.
A Charles, mon cher confrère. Merci pour ton humour et ta présence, je ne t’oublierai jamais. A Monique, pour m’avoir accueillie si souvent à St Pons, pour ta bonne humeur et ta bonté.
A mes co-externes et ami(e)s, Anne et Kevin, Agnès, Laura, Ben, les Fabrices, et toute l’équipe de nord!
A Claire et Aurélia, mon duo gagnant! Je suis tellement heureuse de vous avoir retrouvées. Pétillantes, folles et sages, vous avez embelli mes années de fac, que ce soit à Nord ou dans toutes ces escapades ponctuées de musique en tout genre, qui sont maintenant de précieux souvenirs...
A Judith et Teddy, la famille Winners, je vous souhaite énormément de bonheur, sous le signe du basket bien sûr! A Penda, mon phénomène. Merci pour ces moments mémorables à Cocoyer, je sais que vous êtes bien au soleil, même si vous me manquez...
A mes co-internes des Antilles-Guyane, Yann, Martin, Eugénie, Gülen, Christelle, Elsa, Zora, Gregory, Leïla, Stéphanie, Charlotte, Juliette et tous ceux avec qui j’ai eu le plaisir de travailler à l’hôpital, merci d’avoir fait de mon internat une si belle aventure.
A Micky, ton beau sourire me manque mais je n’ai qu’à t’imaginer pour le voir ! Je te souhaite tellement de bonheur ! 100 10 QT
A Charlotte et Lycia, Tiané, Chloé, Thomas.
A la Martinique, la Guadeloupe, la Guyane, ces régions magnifiques. Aux Antillais et Guyanais, que j’ai eu l’honneur de connaître et qui m’ont tant apporté.
ABSTRACT
Introduction: French Guiana is the French territory the most affected by human
immunodeficiency virus (HIV) epidemic, and histoplasmosis is the most frequent opportunistic infection and the first cause of mortality in HIV infected patients in this country. Mucocutaneous lesions of histoplasmosis are considered as rare and late manifestations of the disease. The objective of this study was to describe the clinical presentation, frequency, prognosis and temporal trends of those forms. The secondary objective was to compare them to other forms of disseminated histoplasmosis. Methods: A retrospective study of patients with AIDS-related disseminated histoplasmosis followed in the three hospitals of French Guiana was performed between 1981 an 2014. Only incident cases of histoplasmosis, proved at the
anatomopathologic and/or mycological analysis, were considered. Mucocutaneous
histoplasmosis was confirmed by a positive cutaneous or mucosal biopsy. Results: mucocutaneous lesions were polymorphic. The proportion of deep immunocompromised patients (CD4<50/mm3) was significantly superior among mucocutaneous histoplasmosis cases. Frequency of early death of mucocutaneous forms in disseminated histoplasmosis patients significantly decreased over time (p<0,001). Conclusions: Mucocutaneous forms are polymorphic, increasingly rare, and don’t seem to be associated with a bad prognosis in the highly active antiretroviral therapy (HAART) era. However, those non-specific lesions confirm the necessity, in French Guiana, to always seek histoplasmosis in every mucosal or cutaneous lesion in HIV infected patients, and perform a HIV screening test if the serological status of the patient is unknown.
RESUME
Introduction : La Guyane est le territoire français le plus touché par l’épidémie de virus de
l’immunodéficience humaine (VIH), et l’histoplasmose y représente l’infection opportuniste la plus fréquente et la première cause de mortalité chez les patients vivant avec le VIH. Les lésions cutanéo-muqueuses d’histoplasmose sont décrites comme des formes rares et tardives de la maladie. L’objectif de cette étude était de décrire les présentations cliniques de ces formes, leur fréquence, et leur pronostic, ainsi que leurs tendances temporelles. L’objectif secondaire était de les comparer aux autres formes d’histoplasmose disséminée. Matériel et
méthode : Une étude rétrospective a été menée de 1981 à 2014 parmi les patients co-infectés
par le VIH et l’histoplasmose suivis dans les trois hôpitaux de Guyane. Seuls les cas incidents d’histoplasmose, prouvés à l’analyse anatomopathologique et/ou mycologique, ont été considérés. Les cas d’histoplasmose cutanéo-muqueuse devaient être confirmés par une biopsie cutanée et/ou muqueuse positive. Résultats : Les lésions cutanéo-muqueuses étaient polymorphes. La proportion de patients au stade d’immunodépression profonde (CD4<50 / mm3) était significativement supérieure parmi ceux présentant une forme cutanéo-muqueuse d’histoplasmose. La fréquence et le nombre de décès précoces des formes cutanéo-muqueuses parmi l’ensemble des formes d’histoplasmose disséminée diminuaient dans le temps de manière significative (p<0,001). Conclusion : Les formes cutanéo-muqueuses sont polymorphes, de plus en plus rares et ne semblent pas être associées à un mauvais pronostic à l’heure des trithérapies antirétrovirales. Cependant ces lésions aspécifiques confirment la nécessité, en Guyane, de rechercher systématiquement une histoplasmose devant toute lésion cutanéo-muqueuse chez les patients vivants avec le VIH, et d’effectuer un dépistage du VIH face à ces lésions si le statut sérologique du patient est inconnu.
TABLE DES MATIERES
ABSTRACT 13
RESUME 14
LISTE DES ABREVIATIONS 16
TABLEAUX ET FIGURES 18 INTRODUCTION 20 MATERIEL ET METHODE 28 TYPE D’ETUDE ... 28 POPULATION SOURCE ... 28 POPULATION CIBLE ... 28 DEROULEMENT DE L’ETUDE ... 29 DONNEES RECUEILLIES ... 30 ANALYSE STATISTIQUE ... 31 ASPECT ETHIQUE ... 32 RESULTATS 34 I/ DESCRIPTION DES CAS D’HISTOPLASMOSE CUTANEO-MUQUEUSE ... 34
1. DESCRIPTION DES LESIONS CUTANEO-MUQUEUSES. ... 34
2. DESCRIPTION DES CAS D’HISTOPLASMOSE CUTANEO-MUQUEUSE ... 36
3. CAS CLINIQUES ... 38
2/ COMPARAISON DES CARACTERISTIQUES DEMOGRAPHIQUES, CLINICO-BIOLOGIQUES ET THERAPEUTIQUES DES CAS D’HISTOPLASMOSE CUTANEO-MUQUEUSE AVEC LES AUTRES CAS D’HISTOPLASMOSE DISSEMINEE ... 45
3/ DESCRIPTION DES TENDANCES TEMPORELLES D’INCIDENCE ET DE MORTALITE. ... 53 1. INCIDENCE ... 53 2. MORTALITE ... 56 DISCUSSION 59 CONCLUSION 66 REFERENCES BIBLIOGRAPHIQUES 67 SERMENT D’HYPPOCRATE 70
LISTE DES ABREVIATIONS
ALAT Alanine aminotransférase
AMM Autorisation de Mise sur le Marché
ASAT Aspartate aminotransférase
BAAR Bacille Acido-Alcoolo-Résistant
BK Bacille de Koch
CCTIRS Comité Consultatif pour le Traitement de l’Information en matière de Recherche
dans le domaine de la Santé
CD4 Cluster de Différenciation 4
CHAR Centre Hospitalier Andrée Rosemon
CHOG Centre Hospitalier de l’Ouest Guyanais
CIM-10 Classification internationale des maladies, 10e révision
CMCK Centre Médico Chirurgical de Kourou
CMV Cytomégalovirus
CNIL Commission Nationale Informatique et Libertés
COREVIH Coordination Régionale pour la lutte contre le VIH
CRP C-réactive protéine
CQI Comité de Qualification Institutionnel
DMI-2 Dossier Médical, épidémiologique et économique de l’Immunodéficience
EIA Enzyme Immunoassay
EORTC/MSG European Organization for the Research and Treatment of Cancer / Mycoses Study Group
FHDH French Hospital Database on HIV
HAART Highly Active Antiretroviral Therapy
INSEE Institut National de la Statistique et des Etudes Economiques
INSERM Institut National de la Santé et de la Recherche Médicale
IV Intraveineux
LDH Lactate Déshydrogénase
LT Lymphocytes T
OMS Organisation Mondiale de la Santé
PAS Periodic Acid Schiff
PCR Polymerase Chain Reaction
SIDA Syndrome d’immunodéficience acquise
TABLEAUX ET FIGURES
TABLEAU 1:TYPE ET LOCALISATION DES LESIONS D'HISTOPLASMOSE CUTANEO-MUQUEUSE LIEE AU VIH PARMI LES
31 CAS OBSERVES EN GUYANE FRANÇAISE DE 1981 A 2014. ... 35
TABLEAU 2: COMPARAISON DES DONNEES SOCIO-DEMOGRAPHIQUES DES CAS D'HISTOPLASMOSE CUTANEO
-MUQUEUSE ET DES AUTRES FORMES D'HISTOPLASMOSE DISSEMINEE, LIEES AU VIH, EN GUYANE FRANÇAISE,
DE 1981 A 2014. ... 46
TABLEAU 3: COMPARAISON DES DONNEES CONCERNANT L'INFECTION PAR LE VIH DES CAS D'HISTOPLASMOSE CUTANEO-MUQUEUSE ET DES AUTRES FORMES D'HISTOPLASMOSE DISSEMINEE EN GUYANE FRANÇAISE, DE
1981 A 2014. ... 48
TABLEAU 4:COMPARAISON DES DONNEES CLINIQUES ET PARACLINIQUES OBSERVEES LORS DE L'HOSPITALISATION DES CAS D'HISTOPLASMOSE CUTANEO-MUQUEUSE ET DES AUTRES FORMES D'HISTOPLASMOSE DISSEMINEE,
LIEES AU VIH, EN GUYANE FRANÇAISE, DE 1981 A 2014. ... 50
TABLEAU 5: COMPARAISON DES DONNEES BIOLOGIQUES ET DES CRITERES BIOLOGIQUES DE GRAVITE (1,2)
OBSERVES LORS DE L'HOSPITALISATION DES CAS D'HISTOPLASMOSE CUTANEO-MUQUEUSE ET DES AUTRES FORMES D'HISTOPLASMOSE DISSEMINEE, LIEES AU VIH, EN GUYANE FRANÇAISE, DE 1981 A 2014. ... 51
TABLEAU 6:COMPARAISON DES METHODES DIAGNOSTIQUES ET DE LA PRISE EN CHARGE THERAPEUTIQUE DES CAS D'HISTOPLASMOSE CUTANEO-MUQUEUSE ET DES AUTRES FORMES D'HISTOPLASMOSE DISSEMINEE, LIEES AU
FIGURE 1 :REPARTITION DE L'OFFRE DE SOINS EN GUYANE FRANÇAISE (CDPS :CENTRES DEPARTEMENTAUX DE PREVENTION ET DE SANTE)CREDIT :POLE DES CENTRES DELOCALISES DE PREVENTION ET DE SOINS (CDPS), CENTRE HOSPITALIER DE CAYENNE,GUYANE FRANÇAISE ... 20
FIGURE 2ULCERATION BOURGEONNANTE DE LA BASE DE LA LANGUE DUE A HISTOPLASMA CAPSULATUM CHEZ UN PATIENT DE 52 ANS AU STADE SIDA.CREDIT PHOTO:SERVICE DE DERMATOLOGIE,PR COUPPIE,CENTRE
HOSPITALIER DE CAYENNE,GUYANE FRANÇAISE. ... 39
FIGURE 3 :COUPE SAGITTALE TOMODENSITOMETRIQUE DE LA FACE MONTRANT UNE VOLUMINEUSE LESION ULCEREE DE LA BASE DE LA LANGUE LIEE A UN EPISODE D’HISTOPLASMOSE CUTANEO-MUQUEUSE CHEZ UN PATIENT VIVANT AVEC LE VIH EN GUYANE FRANÇAISE. ... 40
FIGURE 4 :ULCERATION PALATINE ET FISTULE BUCCO-NASALE TRANSPALATINE CHEZ UN PATIENT ATTEINT D’HISTOPLASMOSE MUQUEUSE LIEE AU VIH.CREDIT PHOTO:SERVICE DE DERMATOLOGIE,PR COUPPIE, CENTRE HOSPITALIER DE CAYENNE,GUYANE FRANÇAISE. ... 42
FIGURE 5:ULCERATIONS DU PALAIS MOU ET LESIONS VEGETANTES GINGIVALES INFERIEURES CHEZ UN PATIENT AU STADE SIDA, ATTEINT D'HISTOPLASMOSE CUTANEO-MUQUEUSE.CREDIT PHOTO:SERVICE DE
DERMATOLOGIE,PR COUPPIE,CENTRE HOSPITALIER DE CAYENNE,GUYANE FRANÇAISE. ... 43
FIGURE 6:INCIDENCE ANNUELLE DES CAS D'HISTOPLASMOSE CUTANEO-MUQUEUSE DE 1989 A 2014. ... 53
FIGURE 7:INCIDENCE DES CAS D'HISTOPLASMOSE CUTANEO-MUQUEUSE (CUTANEE, MUQUEUSE, OU MIXTE) CHEZ LES PATIENTS VIVANT AVEC LE VIH EN GUYANE FRANÇAISE, PAR PERIODES DE TEMPS, DE 1989 A 2014. ... 54
FIGURE 8:INCIDENCE ANNUELLE DES FORMES CUTANEO-MUQUEUSES D’HISTOPLASMOSE ET AUTRES FORMES D'HISTOPLASMOSE DISSEMINEE, LIEES AU VIH, EN GUYANE FRANÇAISE, DE 1989 A 2014. ... 55
FIGURE 9:POIDS DES FORMES CUTANEO-MUQUEUSES D’HISTOPLASMOSE PARMI L'ENSEMBLE DES CAS D'HISTOPLASMOSE DISSEMINEE, CHEZ LES PATIENTS VIVANT AVEC LE VIH EN GUYANE FRANÇAISE, PAR PERIODES DE TEMPS, DE 1989 A 2014. ... 56
FIGURE 10:MORTALITE PRECOCE DES FORMES CUTANEO-MUQUEUSES ET DE L'ENSEMBLE DES FORMES
D'HISTOPLASMOSE DISSEMINEE, CHEZ LES PATIENTS VIVANT AVEC LE VIH, EN GUYANE FRANÇAISE, DE 1989 A
2014. ... 57
FIGURE 11 :PROPORTION DE DECES A UN MOIS, PAR PERIODES DE TEMPS, DES FORMES CUTANEO-MUQUEUSES D'HISTOPLASMOSE, PARMI L'ENSEMBLE DES FORMES D'HISTOPLASMOSE DISSEMINEE CHEZ LES PATIENTS VIVANT AVEC LE VIH EN GUYANE FRANÇAISE. ... 58
FIGURE 12:MORTALITE PRECOCE, PAR PERIODES DE TEMPS, DES FORMES CUTANEO-MUQUEUSES D'HISTOPLASMOSE ET DES AUTRES FORMES D’HISTOPLASMOSE DISSEMINEE, PARMI L'ENSEMBLE DES FORMES D'HISTOPLASMOSE DISSEMINEE CHEZ LES PATIENTS VIVANT AVEC LE VIH EN GUYANE FRANÇAISE. ... 58
INTRODUCTION
Guyane Française
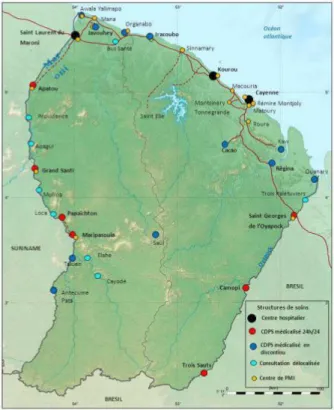
La Guyane française, département français d’outre-mer, se situe sur la côte nord-est du continent d’Amérique du Sud. Elle est frontalière du Suriname à l’ouest, et du Brésil au sud-est. Quatre vingt dix pourcent du territoire est constitué de forêt tropicale. Le climat y est équatorial, chaud et humide, et les saisons sont rythmées par les précipitations : saison sèche et saisons des pluies. Les villes sont côtières, et les trois hôpitaux de Guyane sont exclusivement situés sur le littoral : le Centre Hospitalier de Cayenne, le Centre médico chirurgical de Kourou, et le Centre Hospitalier de l’Ouest Guyanais à Saint Laurent du Maroni. Dans les communes intérieures, qui ne sont parfois accessibles que par voie fluviale ou aérienne, la médecine de proximité est assurée par 18 centres de santé, dont 7 sont médicalisés en continue.
Figure 1 : Répartition de l'offre de soins en Guyane Française (CDPS : Centres départementaux de prévention et de santé)
La situation géographique de la Guyane en fait le siège de forts flux migratoires depuis des années. Ce phénomène s’explique essentiellement par des conditions socio-économiques favorables par rapport aux pays voisins, dont les populations ont fui leur pays d’origine, notamment du fait de conflits politiques en Haïti, ou encore d’une guerre civile au Surinam à la fin des années 80… Aussi, il existe une certaine facilité d’accès par ses frontières, extrêmement vastes, composées de forêt dense et de deux fleuves, le Maroni et l’Oyapock. La richesse aurifère des sols amazoniens entraine une forte activité d’orpaillage illégal qui favorise aussi l’immigration clandestine sur le territoire guyanais.
D’après l’INSEE, la population officielle a doublé depuis 1990. Dès 1980, la part de la population immigrée constituait plus d’un quart des habitants. En 1999, les communautés les plus représentées étaient, dans l’ordre, les surinamais, haïtiens, brésiliens, guyaniens, asiatiques et saint-luciens.
VIH en Guyane Française
En Guyane française, et dans le bassin amazonien, la prévalence du VIH est estimée aux alentours de 1% (3). La Guyane représente le territoire français le plus affecté par l’épidémie (4). Le mode de transmission est très majoritairement hétérosexuel, les femmes sont les plus touchées, et l’âge médian des patients infectés est de 43 ans. Parmi les patients suivis, 76,6 % sont d’origine étrangère (5), le plus souvent issus d’Haïti ou du Suriname (4).
L’épidémie de VIH en Guyane est marquée par l’extrême précarité de la majorité des personnes infectées, dont certaines n’ont même pas de titre de séjour, avec un risque de
transmission plus élevé lors de rapports monétisés, et une association fréquente avec des poly addictions (alcool, crack, cocaïne..) (4,5).
Plus de 90% des patients suivis sont traités en Guyane, mais seulement deux tiers d’entre eux ont une charge virale indétectable, ce qui reflète des difficultés d’observance (5) liées à des déterminants multiples dont la précarité sociale, et certaines croyances culturelles privilégiant les traitements dits « traditionnels ». Un tiers des patients sont perdus de vue ; parmi eux les patients les plus jeunes, les patients non traités, ceux diagnostiqués à un stade tardif de l’infection et les patients de nationalité étrangère ont été identifiés comme des patients particulièrement à risque de rupture de suivi (6).
Histoplasmose
Le premier cas d’histoplasmose a été observé en 1905 par Samuel T. Darling au Panama, alors qu’il examinait des lames de biopsies effectuées chez un patient d’origine martiniquaise dont les symptômes évoquaient une tuberculose disséminée (7). Les premiers cas d’histoplasmose liés au VIH ont été rapportés aux Etats-Unis au début des années 1980 (8). Depuis 1987, l’histoplasmose disséminée ou extra-pulmonaire fait partie de la liste des pathologies classant SIDA (9).
Consécutive à une infection par Histoplasma capsulatum, sa distribution est mondiale. Les vallées du Mississipi et de l’Ohio aux Etats-Unis, et pratiquement tous les pays d’Amérique centrale et Amérique du Sud, dont la Guyane française, sont des zones d’endémie (10). Dans les zones de non-endémie, même si la plupart des cas d’histoplasmose sont des cas importés, des cas autochtones ont cependant été décrits, notamment en Europe (11).
En Guyane française, l’histoplasmose est l’infection opportuniste la plus fréquente (avant la candidose œsophagienne, la toxoplasmose cérébrale, la tuberculose et la pneumocystose) et la première pathologie classant SIDA (12). Elle y représente la première cause de décès chez les patients vivant avec le VIH (13).
Historiquement, trois variétés phénotypiques d’Histoplasma capsulatum ont été décrites:
Histoplasma capsulatum var. capsulatum, responsable de l’histoplasmose américaine, et
Histoplasma capsulatum var. duboisii retrouvée en Afrique, sont pathogènes pour l’homme ;
Histoplasma capsulatum var. farciminosum est pathogène chez l’équidé. Récemment, huit
lignées phylogénétiques géographiquement distinctes ont été décrites : North American class 1 et 2 (Nam1, Nam2), Latin American group A et B (LamA, LamB), Australian, Netherland, Eurasian et African. (14)
Histoplasma capsulatum est un champignon ascomycète dimorphique : on le trouve sous
forme de moisissure filamenteuse à l’état saprophyte, formant des macroconidies ou microconidies, dans les sols riches en azote et enrichis en matériaux organiques tel que les déjections d’oiseaux et le guano de chauves souris ; et sous forme de levure à l’état parasitaire, dans les tissus et fluides corporels des mammifères. La contamination se fait par inhalation d’hyphes ou de microconidies, qui sont secondairement converties en levures dans les poumons. Celles-ci sont phagocytées et peuvent, par le biais des macrophages, disséminer à l’ensemble du système réticulo-endothélial (foie, rate, moelle osseuse, et ganglions lymphatiques) (15). L’évolution de l’infection est étroitement liée à l’immunité cellulaire de l’hôte (16).
Chez l’immunocompétent, l’infection est souvent asymptomatique ou pauci-symptomatique, limitée au poumon, et spontanément résolutive. Une dissémination
hématogène asymptomatique est cependant possible et, comme dans la tuberculose, peut engendrer la formation de foyers latents dans certains organes, susceptibles de se réactiver des années plus tard (17).
Chez les patients immunodéprimés au stade SIDA, elle est symptomatique et disséminée dans 95% des cas. Son mode d’évolution peut aller de la latence extrême, à la forme fulminante qui représente 10 à 20% des cas, avec une mortalité allant de 50 à 70% suite à différentes complications : choc septique, coagulation intravasculaire disséminée, défaillance multi-viscérale, syndrome d’activation macrophagique. La forme la plus fréquemment observée chez les patients vivants avec le VIH est la forme subaiguë. Evoluant sur un à deux mois, elle associe des signes cliniques et paracliniques variés et aspécifiques : fièvre, asthénie, amaigrissement, signes respiratoire, digestifs, adénopathies, hépatosplénomégalie, syndrome interstitiel radiologique, augmentation des LDH, de la ferritine, pancytopénie, perturbations du bilan hépatique. (15,17–19)
Il existe différents moyens diagnostiques pour l’histoplasmose. Les examens biologiques standards ne peuvent constituer que des éléments d’orientation. L’examen direct mycologique de prélèvements sur lames colorées au May-Grünwald Giemsa est la méthode la plus simple et rapide, et permet en cas de positivité d’initier le traitement antifongique sans délais (20). L’analyse anatomopathologique, grâce à des colorations spéciales (PAS, Gomori Grocott) permet d’éliminer les principaux diagnostics différentiels (15,20). La culture sur milieu de Sabouraud est la méthode de référence avec une spécificité de 100% et une sensibilité entre 85 et 90%. Le délai est de une à six semaines, sa réalisation comporte un risque infectieux élevé, et ne peut être pratiquée que dans des laboratoires de sécurité biologique de niveau 3 (20). La sérologie, peu sensible en cas d’immunodépression, ne permet pas de discriminer les infections actives ou passives (15). La détection d’antigènes (MVista Histoplasma antigen EIA
de troisième génération) est la meilleure méthode actuellement validée pour le diagnostic d’histoplasmose liée au VIH (21) mais reste coûteuse (80$ par test) et uniquement disponible aux Etats-Unis (20). Enfin le diagnostic moléculaire par réaction en chaîne par polymérase (PCR) offre de bonnes sensibilités et spécificités (22) mais sa validité externe n’a pas encore été établie et aucune méthode n’a été commercialisée (23).
Le traitement de l’histoplasmose dépend de sa sévérité. L’itraconazole est le traitement des formes non sévères (24), à la dose de 600mg/j pendant trois jours puis 400mg/j pendant au moins un an (25). Fongistatique, l’itraconazole est administré per os et les effets secondaires sont rares. Les formes modérées à sévères nécessitent un traitement d’attaque par amphotéricine B à la dose de 3mg/kg/j pendant une à deux semaines jusqu’à amélioration clinique, suivi d’un traitement de consolidation par itraconazole aux mêmes posologies que celles décrites plus haut. L’amphotéricine B est fongicide, et s’administre par voie intraveineuse. La forme liposomale a remplacé l’amphotéricine B déoxycholate depuis son AMM en juin 1998 : elle offre une meilleure tolérance, est moins néphrotoxique et plus efficace (26). Un traitement d’entretien par itraconazole à la dose de 200mg/j doit être maintenu jusqu’à ce que les CD4 soient durablement supérieurs à 150/mm3. (25)
L’histoplasmose est sous diagnostiquée en Amérique du sud car en plus d’être peu souvent évoquée du fait d’une symptomatologie aspécifique, son diagnostic nécessite le plus souvent des explorations invasives ou des techniques onéreuses indisponibles localement. Les études épidémiologiques sur le sujet restent rares et l’ampleur de l’épidémie est probablement largement sous-estimée (27). La tuberculose est le principal diagnostic différentiel de l’histoplasmose, et de nombreux patients infectés par le VIH sont probablement décédés d’une
tuberculose qualifiée de « résistante au traitement » confondue avec une authentique histoplasmose (28). Toutefois, l’apparition de lésions cutanéo-muqueuses observée dans l’histoplasmose est le principal élément d’orientation clinique entre ces deux maladies (20).
Lésions cutanéo-muqueuses de l’histoplasmose
Les manifestations cutanéo-muqueuses de l’histoplasmose sont variées tant par leur morphologie que par leur distribution, localisées ou diffuses, multiples ou isolées. Des lésions cutanées à type de papules, nodules, ulcérations, vésicules, ou des lésions érosives, ulcéreuses, ulcéro-végétantes de la muqueuse orale ou nasale ont été décrites. (17,29–31). Ce polymorphisme en fait un signe clinique peu spécifique, d’autant que leur spectre morphologique est partagé avec de nombreuses pathologies infectieuses et non infectieuses communes aux patients atteints du SIDA (30). Cependant, elles constituent un site de prélèvement très facilement accessible et peu invasif pour la réalisation de biopsies, autorisant un diagnostic de certitude rapide, pour une maladie potentiellement mortelle et difficile à diagnostiquer (20). Elles peuvent également motiver une consultation médicale face à des lésions cutanéo-muqueuses parfois très gênantes, chez des patients peu suivis sur le plan médical.
Ces formes d’histoplasmose sont considérées comme des formes tardives de la maladie, survenant à un stade avancé d’immunodépression (29,30). Peu communes aux Etats-Unis, elles sont très fréquemment décrites en Amérique Latine (18,26,32–39). Ce contraste entre les deux continents pause la question d’une virulence différente entre les souches d’histoplasmose : ont-elles un dermatotropisme particulier en Amérique Latine, ou bien ces manifestations
cutanéo-muqueuses tardives sont-elles la conséquence d’un manque de moyens diagnostiques et thérapeutiques (20)? En Guyane française, une baisse significative de ces formes a déjà été observée après l’ouverture d’un laboratoire de mycologie à l’Hôpital de Cayenne (29).
Objectif de l’étude :
L’objectif de cette étude était de décrire les formes cutanéo-muqueuses de l’histoplasmose chez les patients vivant avec le VIH en Guyane Française : leurs aspects socio-démographiques, clinico-biologiques, thérapeutiques, pronostiques ainsi que leurs tendances temporelles.
L’objectif secondaire de cette étude était de comparer ces formes cutanéo-muqueuses avec les autres formes d’histoplasmose disséminée.
MATERIEL ET METHODE
TYPE D’ETUDE
Une étude observationnelle, transversale, rétrospective, multicentrique, a été menée sur la période allant du 1er janvier 1981 au 1er octobre 2014.
POPULATION SOURCE
La population source était représentée par l’ensemble des patients vivant avec le VIH connus et suivis dans l’un des trois centres hospitaliers de Guyane française.
POPULATION CIBLE
La population cible était définie par toute personne présentant une co-infection par le VIH et l’histoplasmose inclue dans la base de données Histoplasmose et VIH en Guyane.
Les critères d’inclusion étaient : - Age supérieur à 18 ans
- Infection par le VIH confirmée,
- Premier épisode d’histoplasmose prouvé par examen direct mycologique, culture mycologique ou examen histologiques (hors PCR) pratiqués sur divers prélèvements (plasmatique, lavage broncho-alvéolaire, myélogramme, biopsies digestives, biopsies cutanées…) selon les critères EORTC/MSG (40).
Ainsi, les patients présentant une récidive d’histoplasmose, un épisode d’histoplasmose non prouvé (traitement antifongique empirique efficace) ou un diagnostic uniquement basé sur la positivité de la PCR n’étaient pas retenus.
CRITERE DE JUGEMENT
Le critère de jugement principal était défini par la présence d’Histoplasma capsulatum, confirmée par une biopsie cutanée et/ou de la muqueuse orale ou nasale à l’examen direct mycologique et/ou à la culture mycologique et/ou à l’examen anatomopathologique des tissus (critère EORTC/MSG (40)).
Le critère de jugement pronostique était défini par la mortalité dans les 30 jours après mise en route du traitement antifongique.
DEROULEMENT DE L’ETUDE
La base de données Histoplasmose et VIH a été créée par le Pr Pierre Couppié en 1992. Elle concernait les cas incidents d’Histoplasmose Américaine chez les patients infectés par le VIH dans les trois centres hospitaliers de Guyane (le Centre Hospitalier de Cayenne, le Centre médico chirurgical de Kourou et le Centre hospitalier de l’Ouest Guyanais à Saint Laurent du Maroni). Le premier cas a été identifié rétrospectivement en 1981.
Les données épidémiologiques, cliniques, paracliniques, immunovirologiques et thérapeutiques ont été saisies sur une fiche standardisée, qui a été secondairement informatisée par le Dr Antoine Adenis au moyen d’un masque de saisie créé sur la version 3.1 du logiciel EPIDATA®.
Au moment de l’étude, cette base avait été complétée jusqu’au 1er
janvier 2011.
Un recueil rétrospectif des donnés des trois centres hospitaliers de Guyane, sur la période du 1er janvier 2011 jusqu’au 1er octobre 2014, a été réalisé en s’assurant pour chaque inclusion de la confirmation de l’identification de l’agent pathogène et en évitant les données manquantes dans la mesure du possible.
Afin de procéder à l’identification exhaustive des cas, une requête a été soumise au département d’information médicale de chacun des trois centres hospitaliers à partir des codes CIM-10 correspondants à « maladies due au VIH » et « Histoplasmose » ; dont la date de sortie du séjour était supérieure ou égale au 1er janvier 2011.
La base de données ne concernant que les cas incidents d’Histoplasmose, les patients déjà présents dans la base Histoplasmose et VIH ont été exclus.
Les données épidémiologiques, cliniques, paracliniques et thérapeutiques ont été recueillies à partir des dossiers médicaux et paramédicaux d’hospitalisation des patients sur une fiche standardisée numérique (logiciel EPIDATA®).
DONNEES RECUEILLIES
Les données recueillies intéressaient tout épisode incident d’histoplasmose chez un patient infecté par le VIH, connu ou de découverte concomitante, hospitalisé dans une des trois structures hospitalières de Guyane, et se composaient des éléments suivants :
- Données socio-démographiques : sexe, âge, lieu de naissance…
- Données paracliniques : bilan immunovirologique, biologie standard, examens d’imagerie, mycologie, anatomopathologie.
- Données thérapeutiques : type de traitement reçu, durée, dosage, voie d’administration. - Données de survie sur la période d’étude et à 30 jours après la mise en route du
traitement antifongique.
ANALYSE STATISTIQUE
L’analyse statistique a été réalisée à l’aide du logiciel STATA 11®.
Pour répondre à l’objectif principal, la fréquence a été calculée pour les variables qualitatives ou catégorielles. La moyenne, ou la médiane, avec respectivement la déviation standard ou l’intervalle interquartile, ont été calculées suivant la distribution normale ou non des variables continues.
L’objectif secondaire, qui consistait à comparer les formes cutanéo-muqueuses d’histoplasmose liées au VIH avec les autres formes d’histoplasmoses, nécessitait de réaliser une analyse comparative avec un groupe contrôle composé de cas d’histoplasmose pour lesquels l’identification cutanéo-muqueuse était négative ou non pratiquée en l’absence de lésions.
Pour répondre à l’objectif secondaire, une analyse comparative univariée a été menée à l’aide de tests statistiques standards:
- Test du Chi2 ou Test exact de Fisher pour comparer les variables qualitatives ou catégorielles,
- Test du Chi2 de tendance pour décrire les tendances temporelles des variables qualitatives ou catégorielles.
- Test T de Student ou Test de Mann Withney pour comparer les variables continues, selon leur distribution normale ou non (vérifiée graphiquement).
Le seuil de significativité statistique considéré était p < 0,05.
ASPECT ETHIQUE
L’ensemble des patients vivant avec le VIH suivis dans les trois centres hospitaliers de Guyane ont été inclus dans la base de données du DMI-2, actuellement administrée par la Coordination Régionale pour la lutte contre le VIH (COREVIH). Cette base de données appartient à la French Hospital Database on HIV (FHDH) qui est une cohorte nationale de patients vivant avec le VIH dont les données socio-démographiques, clinico-biologiques, et thérapeutiques sont inclues prospectivement depuis le 1er janvier 1992 par des technicien(ne)s d’études cliniques. Cette base de données a reçu un avis favorable de la Commission Nationale Informatique et Libertés (CNIL) le 27 novembre 1991. L’ensemble des patients inclus reçoit une information et signe un consentement éclairé.
L’objectif principal de la FHDH est la description et l’étude de la morbi-mortalité des patients vivant avec le VIH au stade SIDA. Dans ce cadre, le Pr Pierre Couppié a mis en place en 1992 une base de données anonymisées, Histoplasmose et VIH, qui répertorie les cas incidents d’Histoplasmose chez les patients vivant avec le VIH en Guyane.
Cette base de données a fait l’objet d’une demande d’autorisation CNIL (n°JZU0048856X, le 16/07/2010). Elle a également reçu les avis favorables du Comité de Qualification Institutionnel (CQI), de l’Institut National de la Santé et de la Recherche Médicale (INSERM) (IRB0000388, FWA00005831 le 18/05/2010) et du Comité Consultatif
pour le Traitement de l’Information en matière de Recherche dans le domaine de la Santé (CCTIRS) (N°10.175bis, le 10/06/2010).
RESULTATS
I/
DESCRIPTION DES CAS D’HISTOPLASMOSE
CUTANEO-MUQUEUSE
Trente et un cas d’histoplasmose cutanéo-muqueuse ont été répertoriés parmi 349 cas d’histoplasmose, entre le 1er
janvier 1981 et le 1er octobre 2014, dans l’ensemble des centres hospitaliers de Guyane.
1. DESCRIPTION DES LESIONS CUTANEO-MUQUEUSES.
Fréquence
Parmi les 31 cas d’histoplasmose cutanéo-muqueuse observés sur la période d’étude, on dénombre 15 cas de lésions cutanées, 13 cas de lésions muqueuses et 3 cas de lésions mixtes, simultanément cutanées et muqueuses.
Type et distribution des lésions
i. Cutanées
Les lésions cutanées observées étaient principalement des papules (78%). Quelques ulcérations et nodules étaient également retrouvés.
Ces lésions étaient diffuses la plupart du temps, plus fréquemment localisées sur la face. (Tableau 1)
ii. Muqueuses
Parmi les lésions muqueuses, les lésions ulcératives étaient les plus fréquentes (67%), parfois ulcéro-végétantes (20%). On retrouvait également deux cas de fistules palatines décrits sur cette période.
Les lésions muqueuses étaient majoritairement endobuccales (62%) touchant principalement le palais, et labiales (50%). On retrouvait un cas d’atteinte de la muqueuse nasale. (Tableau 1)
Tableau 1: Type et localisation des lésions d'histoplasmose cutanéo-muqueuse liée au VIH parmi les 31 cas
observés en Guyane française de 1981 à 2014.
n(%) Type N=18 Papule 14 (78) Ulcération 3 (17) Nodule 1 (6) Erosion 0 (0) Plaque 0 (0) Localisation N=18 Face 14 (78) Tronc 11 (61) Membres 11 (61) n(%) Type N=15 Ulcération 10 (67) Ulcéro végétant 3 (20) Fistule 2 (13) Erosion 1 (7) Vésicule 1 (7) Localisation N=16 Endobuccales 10 (62) Palais n(%) 7 (44) Langue n(%) 1 (6) Gencive n(%) 1 (6) Loge amygdalienne n(%) 1 (6) Pharynx n(%) 1 (6) Lèvres 8 (50) Muqueuse nasale 1 (6)
* Un patient peut présenter plusieurs types de lésions et plusieurs localisations.
Lésions muqueuses * Lésions cutanées *
2. DESCRIPTION DES CAS D’HISTOPLASMOSE CUTANEO-MUQUEUSE
Données socio-démographiques
L’âge moyen des cas d’histoplasmose cutanéo-muqueuse était de 41 ans (+/- 10 ans). Les cas étaient majoritairement des hommes avec un sexe ratio (H :F) de 2,9, souvent d’origine étrangère, notamment haïtienne (32%), mais avec une durée médiane de séjour sur le territoire guyanais de 18 [7-32] ans (Tableau 2).
Donnés concernant l’infection par le VIH
Le mode de transmission du VIH était principalement hétérosexuel. La grande majorité des patients n’avait aucun traitement antirétroviral à l’inclusion, ni de traitement prophylactique des infections opportunistes. Un peu plus d’un tiers d’entre eux présentait des antécédents d’infection opportuniste.
L’histoplasmose était l’événement classant SIDA dans plus de la moitié des cas (67,7%). La médiane du taux de CD4 était de 30 [15-42] /mm3 et la majorité des cas était à un stade d’immunodépression profonde (90,3%) avec un taux de CD4 inférieur à 50/mm3 (Tableau 3).
Données clinico-biologiques
Une fièvre était présente chez 83,9% des patients, et une altération de l’état général importante avec un score OMS>2 était retrouvée dans 38,7% des cas. La moitié des patients avait des signes respiratoires à l’admission et/ou des signes pulmonaires radiologiques
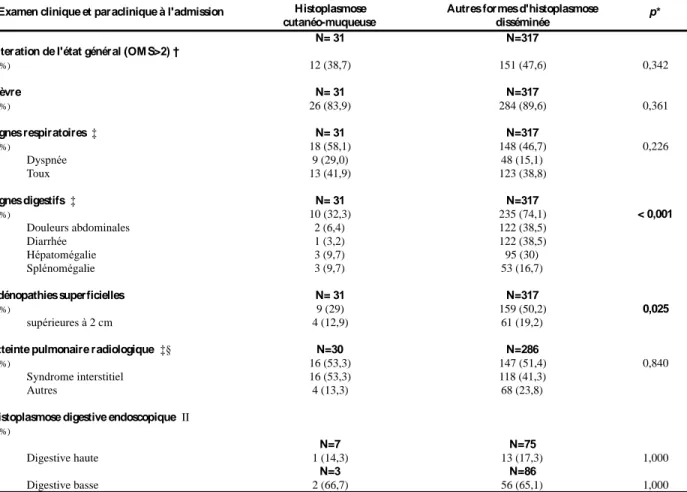
majoritairement à type de syndrome interstitiel. Des signes digestifs étaient retrouvés dans près d’un tiers des cas (Tableau 4).
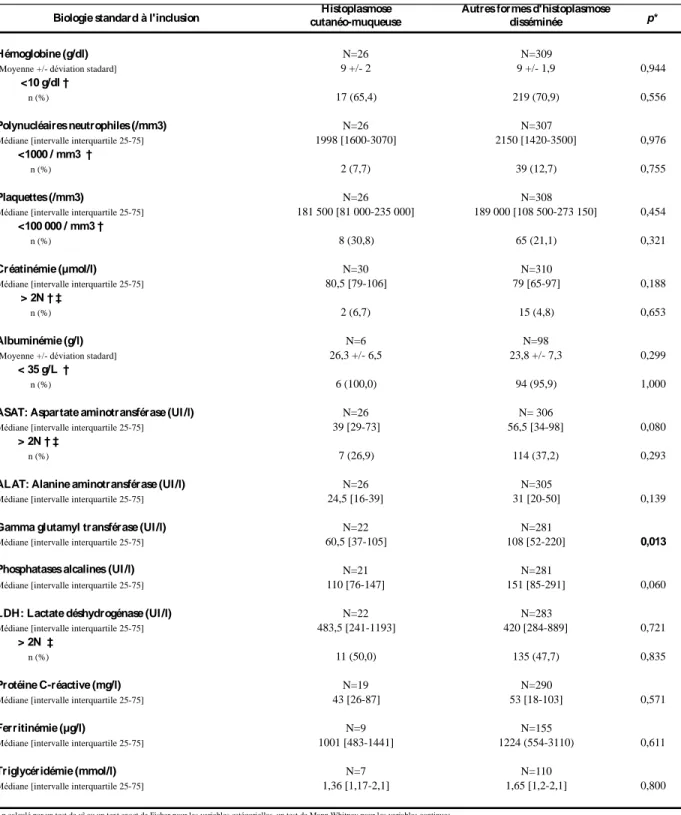
Le taux d’hémoglobine moyen était de 9 +/- 2 g/dL avec une anémie inférieure à 10 g/dL chez 65% des patients, la médiane des polynucléaires neutrophiles était de 1,9 G/L [1,6-3], et pour les plaquettes de 181 G/L [81-235]. L’élévation de la CRP était en médiane de 43 [26-87] mg/L. La majorité des cas ne présentait pas d’insuffisance rénale avec une médiane de créatinémie à 80,5 [79-106] µmol/L. La totalité des patients était dénutrie et présentait en moyenne une albuminémie à 26,3 +/- 6,5 g/L. Le bilan hépatique était modérément perturbé avec des médianes d’aspartate aminotransférase et d’alanine aminotransférase respectivement de 39 [29-73] UI/L et 24,5 [16-39] UI/L. Les médianes de gamma glutamyl transférases et de phosphatases alcalines étaient respectivement de 60,5 [37-105] UI/L de 110 [76-147] UI/L. Le taux de lactates déshydrogénases retrouvait une médiane de 483,5 [241-1193] UI/L et était supérieur à deux fois la normale dans la moitié des cas. La ferritinémie et la triglycéridémie étaient disponibles pour moins d’un tiers des patients, avec pour médianes respectives 1001 [483-1441] µg/L et 1,36 [1,17-2,1] mmol/L (Tableau 5).
Donnes diagnostiques et thérapeutiques
La sérologie histoplasmose n’a été pratiquée que dans quatre cas et était toujours négative. La majorité des cas a été diagnostiquée par examen direct mycologique (93,5%) et/ou anatomopathologique (83,9%). Les cultures mycologiques ont contribué au diagnostic de certitude d’histoplasmose dans 67,7% des cas.
L’itraconazole constituait le traitement d’attaque antifongique dans 67,8% des cas, tandis que 25,8% ont bénéficié d’amphotéricine B, dont seulement 2 cas sous forme
liposomale. Un patient a reçu du fluconazole par voie intraveineuse en première intention et un autre n’a bénéficié d’aucun traitement d’attaque (Tableau 6).
Mortalité à un mois
On compte 8 décès précoces sur les 31 cas d’histoplasmose cutanéo-muqueuse répertoriés, soit un taux de mortalité à un mois de 25,8% parmi ces formes sur la totalité de la période étudiée.
3. CAS CLINIQUES
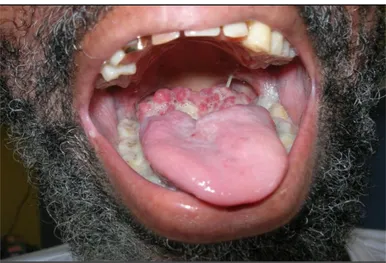
Trois cas parmi les plus récents de l’étude, ayant des lésions muqueuses imputables à l’histoplasmose, sont présentés ci-après. Le premier présentait une lésion bourgeonnante de la base de la langue, le deuxième une fistule bucco-nasale transpalatine et le dernier des lésions ulcéro-végétantes du palais mou et de l’arc gingival inférieur.
Lésion bourgeonnante de la base de la langue (2011)
Cette lésion a été observée chez un homme de 52 ans qui était admis aux urgences pour altération de l’état général fébrile. Il était sans domicile fixe, d’origine haïtienne et habitait en Guyane depuis 10 ans. Il présentait une infection par le VIH diagnostiquée depuis 7 ans, actuellement au stade SIDA (révélé par une co-infection tuberculose et pneumocystose). Il ne prenait par ailleurs aucun traitement.
Il signalait une fièvre à 38,5°, une anorexie, un amaigrissement de 15 kg en quelques mois, et une dysphonie d’apparition récente.
L’examen clinique retrouvait une ulcération bourgeonnante et nécrotique de la base de la langue en avant des piliers du voile du palais, et recouverte d’un enduit blanchâtre (Figure 2). Il présentait également de signes pulmonaires à type de toux et expectorations. Le reste de l’examen était sans particularités avec notamment une absence d’adénopathies.
Figure 2 Ulcération bourgeonnante de la base de la langue due à Histoplasma capsulatum chez un patient de 52 ans au stade SIDA. Crédit photo: Service de Dermatologie, Pr COUPPIE, Centre Hospitalier de Cayenne, Guyane Française.
La biologie retrouvait un syndrome inflammatoire très modéré avec une CRP à 45 mg/L et des leucocytes normaux, une anémie à 9,3 g/dL, une hypoalbuminémie à 26 mg/L, des LDH à 210 UI/L, une ferritinémie à 482 µg/L, une créatinémie à 49 µmol/L et un bilan hépatique normal. Les LT CD4 étaient très bas, à 40 /mm3. La tomodensitométrie montrait une
volumineuse lésion ulcérée irrégulière de la langue avec envahissement de la loge amygdalienne bilatérale, prédominant à droite, une extension en arrière de la paroi antérieure
de l’oropharynx, ainsi qu’une infiltration des muscles du plancher buccal (Figure 3). Elle mettait également en évidence une miliaire pulmonaire ainsi que des lésions cicatricielles de dilatation des bronches du poumon droit et un emphysème centro-lobulaire disséminé.
Figure 3 : Coupe sagittale tomodensitométrique de la face montrant une volumineuse lésion ulcérée de la base de la langue liée à un épisode d’histoplasmose cutanéo-muqueuse chez un patient vivant avec le VIH en Guyane française.
Le diagnostic d’histoplasmose disséminée à Histoplasma capsulatum a été confirmé par examen direct, culture et analyse anatomopathologique, tous trois positifs, des biopsies multiples de la base de la langue et des loges amygdaliennes. L’analyse anatomopathologique du lavage broncho-alvéolaire était également positive à Histoplasma capsulatum. La recherche de BAAR (Bacille Acido-Alcoolo-Résistant) était négative.
Le patient a reçu un traitement d’attaque de 600 mg d’itraconazole les trois premiers jours, puis une dose fixe de 400 mg par jour, avec une restitution ad integrum de la cavité buccale à 6 mois de traitement.
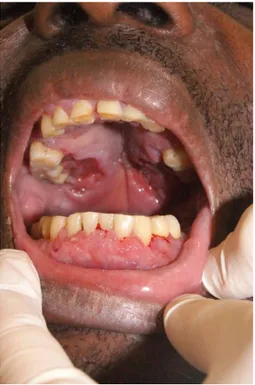
Fistule bucco-nasale transpalatine (2010)
L’un des deux cas de fistule palatine observé dans l’étude concernait un homme de 51 ans, d’origine surinamaise, dont l’infection par le VIH avait été diagnostiquée en 1989 suite à un zona. Il était sous traitement antirétroviral depuis 8 ans avec une observance douteuse et un suivi difficile. Sans couverture sociale, il vivait en forêt et présentait une addiction à la cocaïne ainsi qu’un éthylisme chronique.
Il consultait aux urgences pour une fièvre depuis quelques jours et rapportait une éruption d’eau par les narines lorsqu’il buvait. Le patient était subfébrile à 37,8°, et présentait des adénopathies latéro-cervicales gauches et inguinales non inflammatoires ainsi que des râles crépitants du poumon droit accompagnés de râles sibilants. L’examen endobuccal mettait en évidence une leucoplasie en plage avec ulcération douloureuse du palais ainsi qu’une fistule naso-buccale transpalatine (Figure 4).
Figure 4 : Ulcération palatine et fistule bucco-nasale transpalatine chez un patient atteint d’histoplasmose muqueuse liée au VIH. Crédit photo: Service de Dermatologie, Pr COUPPIE, Centre Hospitalier de Cayenne, Guyane française.
Le bilan biologique montrait une anémie à 9,9 g/dL, des leucocytes à 3,3 G/L, des plaquettes a 293 G/L, une CRP à 67 mg/L, une créatinémie à 139 µmol/L, des ASAT et ALAT
à 22 UI/L, une ferritinémie à 356 µg/L et des LDH à 210 UI/L. Les LT CD4 étaient effondrés à
9/mm3. Le scanner thoracique retrouvait un syndrome alvéolo-interstitiel diffus bilatéral, un foyer de condensation excavé du lobe supérieur droit associé à une pleurésie droite abondante.
La fistule transpalatine était confirmée par le scanner du massif facial et mesurait 5mm de diamètre. La recherche de BK (Bacille de Koch) par BK-crachats et BK-tubages était négative.
L’examen direct du frottis de l’ulcération palatine effectué au 3e
jour d’hospitalisation retrouvait des spores évocatrices d’Histoplasma capsulatum, dont la présence a été confirmée à la culture un mois après.
Le patient a été traité par 600 mg/j d’itraconazole pendant 3 jours puis par 400mg/j. L’évolution était favorable après une semaine de traitement, semaine au bout de laquelle le patient a fugué du service.
Lésion ulcéro-végétantes gingivales et palatines (2014)
Des lésions palatines et gingivales associées ont été observées et concernaient l’un des cas les plus récents de l’étude. Le patient âgé de 55 ans, d’origine haïtienne, résidant en Guyane depuis 26 ans, s’était présenté aux urgences pour apparition de lésions endobuccales depuis deux semaines, douloureuses, associées à une dysphagie. Le patient était drépanocytaire SC, porteur d’une hépatite B active, et diagnostiqué infecté par le VIH depuis 2004 sans antécédents d’infection opportuniste mis à part une colite à CMV. L’examen d’entrée ne retrouvait pas de fièvre mais une légère altération de l’état général (OMS=1), des lésions végétantes multiples de la gencive inférieure associées à deux lésions ulcérées du palais mou bilatérales, symétriques, ainsi que des adénopathies inguinales infracentimétriques bilatérales (Figure 5).
Figure 5: Ulcérations du palais mou et lésions végétantes gingivales inférieures chez un patient au stade SIDA, atteint d'histoplasmose cutanéo-muqueuse. Crédit photo: Service de Dermatologie, Pr COUPPIE, Centre Hospitalier de Cayenne, Guyane française.
La biologie retrouvait une hémoglobine à 11,9 g/dL, des leucocytes à 4,4 G/L, des plaquettes à 206 G/L, une créatinémie à 93 µmol/L, un bilan hépatique normal, une CRP à 29 mg/L, des LDH à 150 UI/L, une ferritinémie à 309 µg/L, et une triglycéridémie à 1,2 mmol/L.
Le scanner thoraco-abdomino-pelvien réalisé alors mettait en évidence une hépatosplénomégalie et des adénopathies coelio-mésentériques. L’endoscopie digestive retrouvait une vaste ulcération de la valvule iléo-cæcale ainsi qu’une vingtaine de lésions ulcérées centimétriques du colon droit et transverse. Les biopsies des lésions palatines et gingivales étaient positives à Histoplasma capsulatum à l’examen direct, à la culture et à l’analyse histopathologique. L’analyse anatomopathologique des biopsies coliques retrouvait une histoplasmose digestive associée.
L’évolution a été favorable sous traitement per os par itraconazole à la dose de 400 mg par jour.
2/ COMPARAISON DES CARACTERISTIQUES DEMOGRAPHIQUES,
CLINICO-BIOLOGIQUES ET THERAPEUTIQUES DES CAS
D’HISTOPLASMOSE CUTANEO-MUQUEUSE AVEC LES AUTRES CAS D’HISTOPLASMOSE DISSEMINEE
Données socio-démographiques
Les données socio-démographiques étaient comparables entre les deux groupes, sans différences significatives concernant l’âge, le sexe ratio, l’origine géographique et le nombre d’années passées en Guyane française.
Il existait une différence significative concernant les centres d’inclusions avec 93,6% des cas d’histoplasmose cutanéo-muqueuses diagnostiqués au Centre hospitalier de Cayenne, contre un peu plus de la moitié des diagnostics des autres cas d’histoplasmose disséminée diagnostiqués dans ce même centre (Tableau 2).
Tableau 2: Comparaison des données socio-démographiques des cas d'histoplasmose cutanéo-muqueuse et des autres formes d'histoplasmose disséminée, liées au VIH, en Guyane française, de 1981 à 2014.
Données socio - démographiques Histoplasmose cutanéo-muqueuse
Autres formes d'histoplasmose
disséminée p*
Age (années) N=31 N=318
Moyenne +/- déviation standard 41,1 +/- 10 40 +/- 9,7 0,539
Sexe ratio (H/F) N=31 N=318 Valeur absolue 2,9 1,8 0,263 Origine géographique N=31 N=316 0,051 n(%) Guyane Française 10 (32,3) 89 (28,2) Haïti 10 (32,3) 71 (22,5) France métropolitaine 4 (12,9) 7 (2,2) Brésil 3 (9,7) 43 (13,6) Suriname 2 (6,4) 72 (22,8) Guyana 1 (3,2) 20 (6,3)
Autre (Antilles, Sénégal) 1 (3,2) 14 (4,4)
Nombre d'années en Guyane française N=30 N=264
Médiane [intervalle interquartile 25-75] 18 [7-32] 25 [10-38] 0,270
Centre d'inclusion† N=31 N=318 <0,001
n(%)
CHAR 29 (93,6) 184 (57,9)
CHOG 1 (3,2) 97 (30,5)
CMCK 1 (3,2) 37 (11,6)
* p calculé par un test de χ² ou un text exact de Fisher pour les variables catégorielles, un test de Mann Whitney pour les variables continues.
Histoplasmose cutanéo-muqueuse = signes cutanés et/ou muqueux d'histoplasmose confirmés par biopsie à l'examen direct et/ou mise en culture et/ou analyse histologique.
Autre forme d'histoplasmose disséminée = histoplasmose disséminée confirmée par prélèvement biopsique autre que cutané ou muqueux, à l'examen direct et/ou mise en culture et/ou analyse histologique.
Données concernant l’infection par le VIH
Le mode de transmission était majoritairement hétérosexuel dans les deux groupes, et aucune différence significative concernant la proportion de patients sous traitement antirétroviral ou sous prophylaxie primaire à l’inclusion n’a été retrouvée.
Il existait significativement plus d’antécédents d’infections opportunistes parmi les cas atteints de formes cutanéo-muqueuses d’histoplasmose, soit un tiers des cas, en comparaison avec les cas d’autres formes d’histoplasmose disséminée.
Le taux médian de LT CD4 était inférieur à 50/mm3 dans les deux groupes. Cependant,
le nombre de cas présentant une immunodépression profonde (CD4<50/mm3) était significativement supérieur parmi les cas d’histoplasmose cutanéo-muqueuse (90,3% contre 62,8%) (Tableau 3).
Tableau 3: Comparaison des données concernant l'infection par le VIH des cas d'histoplasmose cutanéo-muqueuse et des autres formes d'histoplasmose disséminée en Guyane française, de 1981 à 2014.
Données sur l'infection par le VIH
Histoplasmose
cutanéo-muqueuse N=31
Autres formes d'histoplasmose
disséminée N=318 p* N= 31 N=318 M ode de transmission n (%) <0,001 Hétérosexuel 24 (77,4) 296 (93,1) Homosexuel 3 (9,7) 4 (1,3) Toxicomanie intraveineuse 2 (6,5) 1 (0,3) Transfusion sanguine 1 (3,2) 0 (0,0) Inconnu 1 (3,2) 17 (5,3) 1,000
Traitement antirétroviral à l'inclusion
n (%) 6 (19,3) 34 (10,7) 0,146
Prophylaxie primaire à l'inclusion
n(%) 2 (6,4) 40 (12,6) 0,560
L'histoplasmose est l'événement classant SIDA
n(%) 21 (67,7) 258 (81,1) 0,076
Antécédents d'infection opportuniste
n(%) 11 (35,5) 62 (19,5) 0,037
I nfection opportuniste concomitante
n(%) 9 (29) 128 (40,2) 0,222
Taux de CD4 à l'admission (/mm3) †
Médiane [intervalle interquartile 25-75] 30 [15 - 42] 32 [11,5 - 73] 0,276
Stade d'immunodépression † 0,013 n(%) CD4 ≥ 500/mm3 n (%) 0 (0) 2 (0,6) 500/mm3 > CD4 ≥ 200/mm3 n (%) 1 (3,2) 18 (5,8) 200/mm3 > CD4 ≥ 50/mm3 n (%) 2 (6,5) 96 (30,8) CD4 < 50/mm3 n (%) 28 (90,3) 196 (62,8)
* p calculé par un test de χ² ou un text exact de Fisher pour les variables catégorielles, un test de Mann Whitney pour les variables continues.
Histoplasmose cutanéo-muqueuse = signes cutanés et/ou muqueux d'histoplasmose confirmés par biopsie à l'examen direct et/ou mise en culture et/ou analyse histologique.
Autre forme d'histoplasmose disséminée = histoplasmose disséminée confirmée par prélèvement biopsique autre que cutané ou muqueux, à l'examen direct et/ou mise en culture et/ou analyse histologique.
Données clinico-biologiques
Il n’existait pas de différences significatives entre les deux groupes concernant l’état général des patients à l’admission, l’existence d’un syndrome fébrile, et de signes respiratoires ou d’atteinte pulmonaire radiologique.
La proportion de cas présentant des signes digestifs (douleurs abdominales, diarrhée, hépatosplénomégalie) et des adénopathies superficielles était significativement supérieure dans le groupe des autres formes d’histoplasmose disséminée (Tableau 4).
Les données biologiques étaient comparables, et il n’existait pas de différences significatives notables concernant les signes de gravité biologiques (1,2) entre les deux groupes (Tableau 5).