1 UNIVERSITE PICARDIE JULES VERNE
2019
Thèse numéro 2019 - 159
Indice de masse corporelle et développement d’infections ?
Diplôme d’Etat de docteur en médecine Spécialité médecine interne
Soutenue publiquement le 14 Octobre 2019 Matthieu METZELARD
Président du jury : Mr le Professeur Jean SCHMIDT Thèse dirigée par le Pr Pierre DUHAUT
Membres du jury :
- Mr le Professeur Pierre DUHAUT
- Mme le Professeur Rachel DESAILLOUD - Mr le Professeur Julien MAIZEL
3 A Monsieur le Professeur Jean SCHMIDT
Professeur des Universités - Praticien Hospitalier
(Médecine interne), pour avoir accepté de présider ce jury de thèse, pour l’enseignement apporté durant tout ce cursus d’internat, votre soutien et votre encadrement.
A Monsieur le Professeur Pierre DUHAUT Professeur des Universités-Praticien Hospitalier (Médecine Interne)
Chef du service de Médecine interne et maladies systémiques
Pôle "Médico-chirurgical digestif, rénal, infectieux, médecine interne et endocrinologie" (D.R.I.M.E), pour m’avoir accompagné pendant tout ce travail de thèse, pour votre patience, et votre gentillesse durant cet internat Amiénois.
A Madame le Professeur Rachel DESAILLOUD Professeur des Universités-Praticien Hospitalier
(Endocrinologie, Diabétologie et Maladies Métaboliques), pour m’avoir fait l’honneur
d’accepter de faire partie du jury de ce travail, et pour l’apport de votre expertise pour discuter des résultats de ce travail.
A Monsieur le Professeur Julien MAIZEL Professeur des Universités-Praticien Hospitalier
(Réanimation, médecine d’urgence), pour m’avoir fait l’honneur de faire partie de mon jury de thèse, pour l’accompagnement au sein de ma formation de médecine intensive et de réanimation.
A Monsieur le Docteur Jean-Philippe LANOIX
Maître de Conférences des Universités – Praticien Hospitalier
Maladies infectieuses et tropicales, pour avoir accepté de discuter en faisant partie mon jury les résultats de ce travail avec un regard d’infectiologue.
A Amandine ma femme adorée, pour ton amour et soutien indéfectible depuis que j’ai eu la chance de te rencontrer, pour ta présence durant les moments de doutes, et les bien plus joyeux. Pour faire mon bonheur tout simplement.
A Sayam, mon fils, pour le bonheur et la joie que tu m’apportes, je suis si fier de toi. A mes adorables parents, Michel et Nadia, qui m’ont épaulé au quotidien durant toutes mes études et bien avant évidemment. À mon frère Laurent et mes sœurs Diane et Sandrine. A ma famille de Picardie Régine, Jean-François, Elodie, Christophe, Lucille, David, pour votre accueil chaleureux, votre gentillesse, votre soutien. A mes neveux et nièces, Guyanais, Picards, Toulousains que j’aime.
A tous mes co-internes de médecine interne, de médecine intensive et réanimation et de spécialités d’accueil que j’ai eu la chance de croiser durant mon cursus. A tous les seniors qui m’ont transmis leur savoir. A mes chefs et co-internes Lillois de réanimation pour cet inter-CHU mémorable.
A tous mes amis pour votre présence et pour tous les moments de joie partagés. A tous ceux que j’ai croisé durant ce parcours infirmier (es), aide-soignant(es), ASH, secrétaires qui nous épaulent pour prendre soins de nos patients.
4 TABLE DES MATIERES
INTRODUCTION
MATERIEL ET METHODES I. Schéma d’étude
II. Sujets étudiés
1. La population de l’étude
2. Les critères d’inclusion et d’exclusion III. Variables étudiées
IV. Critères de jugement
V. Organisation pratique de la collection et de la gestion des données VI. Analyse statistique des données
VII. Considérations éthiques
RESULTATS
I. Population de l’étude
II. Taux d’infections selon les classes d’IMC en analyse univariée 1- Taux d’infections bactériennes
2- Taux de pneumonies
3- Taux de pyélonéphrites aigües 4- Taux d’érysipèle
5- Taux d’endocardites infectieuses 6- Taux des autres infections
III. Paramètres autres que l’indice de masse corporelle associés aux infections bactériennes en analyse univariée.
IV. Taux d’infections selon les classes d’IMC en analyse multivariée V. Taux d’infections selon le sexe
VI. Taux de mortalité selon le sexe
5 DISCUSSION
I. Taux d’infections bactériennes selon l’IMC II. Taux d’infections pulmonaires selon l’IMC III. Taux de pyélonéphrites aigües selon l’IMC IV. Taux d’érysipèles selon l’IMC
V. Taux d’endocardites infectieuses selon l’IMC
VI. Taux des autres infections selon l’IMC. Différences selon le sexe. VII. Les forces de l’étude
VIII. Les faiblesses de l’étude
CONCLUSION
REFERENCES BIBLIOGRAPHIQUES
7 INTRODUCTION :
L'OMS définit le surpoids comme une accumulation anormale ou excessive de graisse corporelle qui peut nuire à la santé. Un des marqueurs chez l’adulte utilisable pour classer les individus entre l’insuffisance pondérale, le surpoids, et l’obésité est l’indice de masse corporelle (IMC). L’IMC est calculé en divisant le poids en kilogrammes par le carré de la taille en mètres. Les individus ayant un IMC inférieur à 18.5 kg/m² sont classés comme maigres, ceux ayant un IMC entre 18.5 et 24.9 kg/m² sont classés comme normaux, ceux qui ont un IMC supérieur ou égal à 25 kg/m² sont en surpoids et ceux qui ont un IMC supérieur à 30Kg/m² sont classés comme obèses. Parmi les sujets obèses on note plusieurs grades de sévérité : modérée de 30 à 34.9 kg/m², sévère de 35 à 39.9 kg/m² et morbide à partir de 40 kg/m². Au niveau mondial en 2016, plus de 1,9 milliard d’adultes de plus de 18 ans avaient un IMC supérieur à 25kg/m² et plus de 650 millions avaient un IMC supérieur à 30 kg/m². Le surpoids concerne donc 39% des adultes de plus de 18 ans (39% des hommes et 40% des femmes) et l’obésité concerne 13% de la population adulte mondiale (11% des hommes et 15% des femmes)(1).
En France selon l’étude ESTEBAN réalisée entre 2014 et 2016, 54 % des hommes et 44 % des femmes étaient en surpoids ou obèses (IMC ≥25 kg/m²) et la prévalence de l'obésité (IMC ≥30 kg/m²) est estimée à 17 %, sans distinction entre hommes et femmes(2).
Dans l'obésité on note une augmentation des taux circulants de leptine qui a un rôle central dans le rétrocontrôle de la prise alimentaire mais aussi dans la régulation du système immunitaire en induisant la réponse immune inflammatoire.
La leptine est un polypeptide de 167 acides aminés qui a un rôle connu dans le développement des cellules myéloïdes, augmente la sécrétion d'IL-2 et d'interféron gamma, et diminue la sécrétion d'IL-4. La leptine augmente la production des cytokines Th1 et diminue la sécrétion cytokinique Th2 (3) On note aussi dans l’obésité une carence en adiponectine.
L’adiponectine contribue à la sensibilité à l'insuline et lutte contre le syndrome métabolique. Cette protéine a aussi une activité anti-inflammatoire en lien avec l'inhibition de la production d'IL-6, et l'augmentation de la sécrétion de récepteurs antagonistes à l'IL-10 et à l'IL-1.
8 la hausse de la mortalité. L’obésité pourrait être dans certains sous-groupes d’IMC être statistiquement protectrice vis-à-vis du risque infectieux, ce qui a fait émerger la notion de paradoxe de l’obésité. Kwon et al ont publié une méta-analyse de 16 études qui mettait en évidence une association non linéaire entre l’IMC et la mortalité de toute cause chez les patients diabétiques de type II. Ce risque avait un nadir dans le groupe 29-31 kg/m², puis ce risque réaugmentait avec un IMC supérieur à 31 kg/m². Cependant les analyses de sous-groupes suggéraient que le lieu de l’étude, la durée d’évolution du diabète, le tabagisme pourraient contribuer à une hétérogénéité parmi les études (4).
L'objectif principal de cette étude était de mettre en évidence que le surpoids et l'obésité entraînaient la survenue d’un sur-risque significatif d'infections motivant l'hospitalisation en médecine interne, ou de développement d'infections durant le séjour en médecine interne, ou faisant augmenter la probabilité de retrouver des infections dans les antécédents des patients obèses ou en surpoids.
Les objectifs secondaires de cette étude étaient de décrire la fréquence des sites infectieux, de vérifier si cette relation était proportionnelle à l’importance de la surcharge pondérale, et d’identifier d’autres facteurs que l’indice de masse corporelle comme facteur de risque d’infections.
9 MATERIEL ET METHODES
I. Schéma d’étude
Il s'agissait d'une étude observationnelle, analytique, de type cohorte prospective monocentrique au sein du service de médecine interne du CHU d’Amiens.
II.Sujets étudiés
1. La population de l’étude
Il s’agissait de patients de médecine interne du CHU d’Amiens, hospitalisés en médecine interne entre Janvier 2016 et Septembre 2018.
Il y avait en tout 6 groupes d’IMC que nous avions définis comme suit : IMC <20 kg/m², 20 à 24.9 kg/m², 25 à 29.9 kg/m², 30 à 34.9 kg/m², 35 à 39.9 kg/m² et > 40 kg/m².
2. Les critères d’inclusion et d’exclusion
Le critère d’inclusion était d’avoir été hospitalisé en médecine interne, et d’avoir un âge supérieur ou égal à 16 ans.
Le critère d’exclusion était l’absence de données disponibles dans la base de base de données (cette base de données est remplie exclusivement par le chef de service, qui accuse parfois un certain retard…).
III.Variables étudiées
Les variables quantitatives étaient : l'indice de masse corporelle (IMC) exprimé en kg/m², l’âge en années à l’admission. Les variables qualitatives étaient les antécédents infectieux, le sexe, l’antécédent de diabète, le tabagisme actif ou passif, l’éthylisme chronique, le déficit immunitaire commun variable (DICV), le diagnostic d’infections bactériennes ayant causé l’hospitalisation ou s’étant développées durant l’hospitalisation, les antécédents ou diagnostics durant l’hospitalisation d’infections digestives, de pneumonies, de pyélonéphrites aigües, d’infections neuroméningées, d’endocardites infectieuses, de prostatites, d’infections
10 de la région tête et cou, d’érysipèles, d’infections cutanées autres que les érysipèles, de tuberculoses, d’infections génito-urinaires, de sepsis, d’infections ostéoarticulaires, d’infections bactériennes autres et de viroses.
IV. Critères de jugement
Le critère de jugement principal était le développement d’une infection durant l’hospitalisation ou bien l’hospitalisation pour une cause infectieuse ou la présence d’un antécédent infectieux bactérien ou viral.
Le critère de jugement secondaire était le taux de développement de ces infections selon le sexe.
Les sujets classés comme non-malades étaient les patients admis pour une cause autre qu'infectieuse dans le service de médecine interne du CHU d'Amiens, qui n'avaient pas développé d’infection durant l’hospitalisation et qui n’avaient pas d’antécédents infectieux.
Les sujets classés comme malades étaient les patients admis pour une cause infectieuse dans le service de médecine interne du CHU d'Amiens, ou qui avaient développé une infection durant l'hospitalisation ou qui comportaient dans leurs antécédents une infection.
On retenait le diagnostic d’infection bactérienne actuelle lorsque des critères consensuels étaient retrouvés dans le dossier (documentation bactériologique, signes septiques, amélioration sous antibiothérapie) et que cette infection était la cause de l’hospitalisation, ou lorsque cette infection s’était développée pendant le séjour hospitalier.
On retenait le diagnostic de pneumonie, pyélonéphrite, érysipèle, infections intra-abdominales, infections neuro-méningée, endocardites infectieuse, prostatite, infections de la sphère tête-cou, infection d’origine cutanée hors érysipèle, tuberculose, infections génito-urinaire basse, sepsis, infection ostéoarticulaire, infection bactérienne autres, virose si ce diagnostic était la cause de l’hospitalisation, ou lorsque cette infection s’était développée pendant le séjour hospitalier, ou que cette infection figurait dans les antécédents du patient.
11 V. Organisation pratique de la collection et de la gestion des données
Les patients incluables dans l’étude ont été extraits d’une base de données primaire du service de médecine interne remplie après analyse du dossier médical du patient. Les données étaient stockées grâce au logiciel DBASE.
VI. Analyse statistique des données
L’analyse statistique a été réalisée grâce au logiciel SAS.
Les analyses ont été faites, au sein de la cohorte prospective, comme des études cas-témoins nichées. Les résultats sont donc exprimés en odds ratio.
Les variables dichotomiques ont été comparées par un test de chi-2 lorsque le nombre d’événements attendus était supérieur à 5 ou par un test de Fisher exact bilatéral lorsque le nombre d’événements attendus était inférieur à 5. Les variables quantitatives étaient comparées par le test de U-Mann-Whitney. Les variables ayant une distribution suivant la loi normale étaient présentées en moyenne avec déviation standard et les variables ne suivant pas une distribution normale étaient présentées en médiane avec 25ème et 75èmes percentiles.
Nous avons réalisé une analyse univariée par un test de rang de Wilcoxon afin de comparer le taux d’infections bactériennes parmi 6 classes d’IMC réparties comme suit : <20 kg/m², 20-24.9 kg/m, 25-29.9 kg/m², 30-34.9 kg/m², 35-39.9 Kg/m² et ≥40 kg/m². Nous avons répété ce test pour obtenir les taux d’infections suivantes : pneumopathies, pyélonéphrites aigües, infections digestives, infections neuroméningées, érysipèles, endocardites infectieuses, prostatites, infections de la région tête et cou, les infections cutanées autres que les érysipèles, les tuberculoses, les infections génito-urinaires, les sepsis, les infections ostéo-articulaires, les infections bactériennes autres et les viroses.
Nous avons ensuite réalisé une nouvelle analyse univariée par test de Chi2 en introduisant les facteurs confondants suivants autres que l’indice de masse corporelle qui pouvaient expliquer les infections bactériennes, les pyélonéphrites aigües, les pneumonies et les infections ostéo-articulaires : le tabagisme, le diabète de type 1 et 2, l’alcoolisme et le diagnostic de DICV dans les groupes.
12 Nous avons ensuite réalisé une régression logistique avec les facteurs confondants qui ressortaient significatifs et qui auraient pu expliquer une différence entre les groupes d’IMC en analyse univariée. Les facteurs confondants étaient le tabac, le diabète de type 1 ou 2, l’éthylisme chronique ou le diagnostic de DICV.
VII. Considérations éthiques
Les données des patients étaient anonymisées et n’apparaissaient pas dans les résultats d’analyses statistiques. Nous n’avons pas réalisé de prélèvement invasif ou d’examen supplémentaire puisqu’il s’agit d’une étude sur dossier clinique, observationnelle, ne nécessitant pas d’autorisation du comité de protection des personnes selon la loi Jardet.
13 RESULTATS
I. Population de l’étude
Nous avons répertorié 2659 dossiers de patients hospitalisés dans le service de médecine interne entre Janvier 2016 et Septembre 2018.
Le ratio hommes/femmes de la population était de 1162 hommes et 1497 femmes soit un ratio hommes/femmes de 1/1,3, 820 patients dans le groupe d’IMC normal, 697 dans le groupe d’IMC compris entre 25 et 29.9 Kg/m², 350 dans le groupe d’IMC compris entre 30 et 34,9 kg/m², 127 dans le groupe d’IMC compris entre 35 et 39.9 kg/m² et 73 patients dans le groupe d’IMC supérieur ou égal à 40 kg/m². L’âge moyen des femmes était de 60.4 ans avec une médiane d’âge à 64.7 ans (25ème percentile à 45.01 ans et 75ème percentile à 77.3 ans). L’âge
moyen des hommes était de 60.4 ans avec une médiane d’âge à 62.4 ans (25ème percentile à 48.9 ans et 75ème percentile à 73.3 ans).
505 patients soit 18.99 % de la population de l’étude était hospitalisée pour une cause infectieuse bactérienne ou avaient développé une infection bactérienne pendant l’hospitalisation dans le service de médecine interne.
Si l’on prenait en compte toutes les infections actives à l’origine de l’hospitalisation ou développées au cours de l’hospitalisation et celles notées dans les antécédents des patients on retrouvait 1104 infections avec 264 pneumopathies ou surinfections de BPCO ayant nécessité une antibiothérapie, 81 pyélonéphrites aigües, 96 infections intra-abdominales, 18 infections neuro-méningées, 48 érysipèles, 19 endocardites infectieuses, 27 prostatites, 32 infections de la sphère tête-cou, 34 infections d’origine cutanée hors érysipèle, 56 tuberculoses, 86 infections génito-urinaires basses, 98 sepsis, 66 infections ostéoarticulaires, 10 infections bactériennes autres, 169 viroses. La répartition de ces infections est représentée sur la figure 1.
14 Figure 1. Répartition en pourcentage des infections actives à l’origine de l’hospitalisation ou développées au cours de l’hospitalisation ou notées dans les antécédents des patients parmi les pneumonies, les pyélonéphrites, les érysipèles, les infections intra-abdominales, les infections neuro-méningées, les endocardites infectieuses, les prostatites, les infections de la sphère tête et cou, les infections d’origine cutanée hors érysipèles, les tuberculoses, les infections génito-urinaires basses, les sepsis, les infections ostéoarticulaires, les infections bactériennes autres, les viroses.
15 II Taux d’infections selon les classes d’IMC en analyse univariée :
1. Taux d’infections bactériennes.
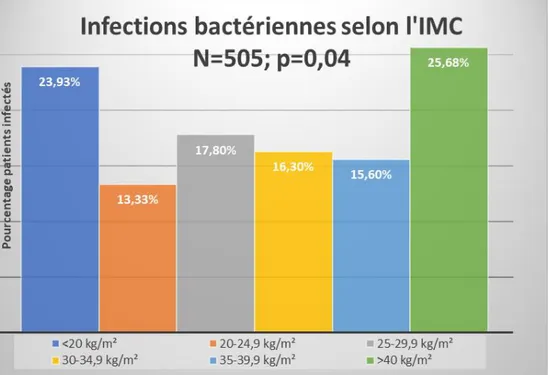
Sur les 505 infections bactériennes retrouvées dans la population, 84 (23.93%) étaient retrouvées parmi les patients d’IMC<20 kg/m², 184 (19.33%) chez les patients d’IMC entre 20 et 24.9 kg/m², 136 (17.80%) chez les patients d’IMC entre 25 et 29.9 kg/m², 60 (16.13%) chez les patients d’IMC entre 30 et 34.9 kg/m², 22 (15.60%) chez les patients d’IMC entre 35 et 39.9 kg/m² et 19 (25.68%) chez les patients d’IMC > 40 kg/m², cette différence était statistiquement significative avec un p=0.04. La comparaison de ces taux d’infections bactériennes est représentée sur la figure 1.
Figure 2. Comparaison des taux d’infections bactériennes selon l’IMC (IMC : Indice de masse corporelle (poids/taille²). Les barres d’histogrammes représentent le pourcentage d’infections bactériennes ayant causé l’hospitalisation ou s’étant développées durant le séjour en médecine interne au sein des six classes d’IMC <20 kg/m², 20 à 24.9 kg/m², 35 à 29.9 kg/m², 30 à 34.9 kg/m², 35 à 39.9 kg/m², et >40kg/m². On retrouve un maximum de taux de patients infectés dans les classes d’IMC extrêmes <20 kg/m² et >40 kg/m². On remarque qu’au sein de patients d’IMC élevé le risque n’est pas linéaire mais qu’il dessine une courbe en U avec un nadir parmi les patients d’IMC compris entre 35 et 39.9 kg/m².
16 2. Taux de pneumonies.
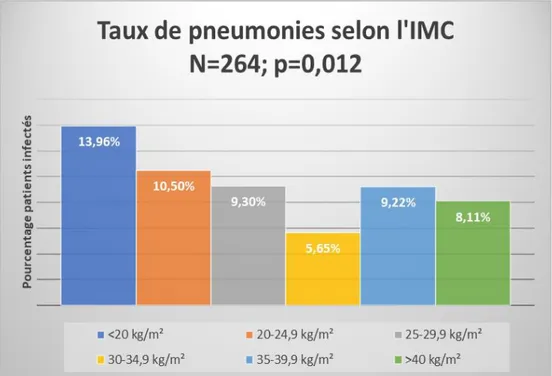
Sur les 264 pneumonies retrouvées dans la population, 49 (13.96 %) étaient retrouvées parmi les patients d’IMC<20 kg/m², 100 (10.50 %) chez les patients d’IMC entre 20 et 24.9 kg/m², 75 (9.83 %) chez les patients d’IMC entre 25 et 29.9 kg/m², 21 (5.65 %) chez les patients d’IMC entre 30 et 34.9 kg/m², 13 (9.22 %) chez les patients d’IMC entre 35 et 39.9 kg/m² et 6 (8.11 %) chez les patients d’IMC > 40 kg/m², cette différence était statistiquement significative avec un p=0.012. La comparaison de ces taux est représentée sur la figure 2.
Figure 3. Comparaison des taux de pneumonies selon l’IMC
IMC : Indice de masse corporelle (poids/taille²). Les barres d’histogrammes représentent le pourcentage de pneumonies ayant causé l’hospitalisation ou s’étant développées durant le séjour en médecine interne ou paraissant dans les antécédents des patients au sein des six classes d’IMC <20 kg/m², 20 à 24.9 kg/m², 35 à 29.9 kg/m², 30 à 34.9 kg/m², 35 à 39.9 kg/m², et >40kg/m². Le maximum de pneumonies est retrouvé chez les sujets d’IMC bas soit inférieur à 20 kg/m². Le nadir de taux de pneumonies est chez les patients d’IMC compris entre 30 et 34.9 kg/m². On retrouve un aspect de courbe en U lorsque l’on s’intéresse aux groupes de patients d’IMC> 25 kg/m².
17 3. Taux de pyélonéphrites aigües.
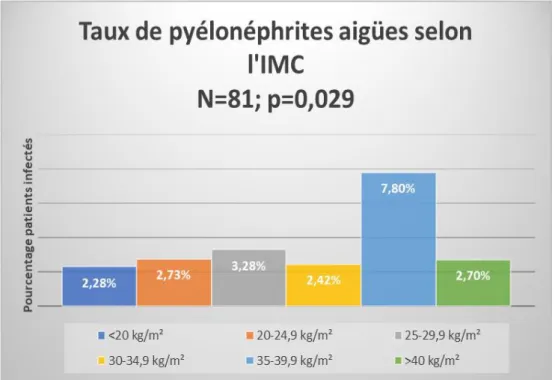
Sur les 81 pyélonéphrites aigües retrouvées dans la population, 8 (2.28 %) étaient retrouvées parmi les patients d’IMC<20 kg/m², 26 (2.73 %) chez les patients d’IMC entre 20 et 24.9 kg/m², 25 (3.28 %) chez les patients d’IMC entre 25 et 29.9 kg/m², 9 (2.42 %) chez les patients d’IMC entre 30 et 34.9 kg/m², 11 (7.80 %) chez les patients d’IMC entre 35 et 39.9 kg/m² et 2 (2.70 %) chez les patients d’IMC > 40 kg/m², cette différence était statistiquement significative avec un p=0.029 . La comparaison de ces taux de pyélonéphrites est représentée sur la figure 3.
Figure 4. Comparaison des taux de pyélonéphrites aigües selon l’IMC. IMC : Indice de masse corporelle (poids/taille²). Les barres d’histogrammes représentent le pourcentage de pyélonéphrites aigües ayant causé l’hospitalisation ou s’étant développées durant le séjour en médecine interne ou paraissant dans les antécédents des patients au sein des six classes d’IMC <20 kg/m², 20 à 24.9 kg/m², 35 à 29.9 kg/m², 30 à 34.9 kg/m², 35 à 39.9 kg/m², et >40kg/m². Le maximum de taux de pyélonéphrites aigües est dans le groupe 35-39 kg/m². Le taux ne semble pas statistiquement différent entre les autres groupes d’IMC de patients.
18 4. Taux d’érysipèles.
Sur les 48 érysipèles retrouvés dans la population, 2 (0.57 %) étaient retrouvés parmi les patients d’IMC<20 kg/m², 16 (1.68 %) chez les patients d’IMC entre 20 et 24.9 kg/m², 9 (1.18 %) chez les patients d’IMC entre 25 et 29.9 kg/m², 12 (3.23 %) chez les patients d’IMC entre 30 et 34.9 kg/m², 1 (0.71 %) chez les patients d’IMC entre 35 et 39.9 kg/m² et 8 (10.81 %) chez les patients d’IMC > 40 kg/m², cette différence était statistiquement significative avec un p <0.001 . La comparaison de ces taux de pyélonéphrites est représentée sur la figure 4.
Figure 5. Comparaison des taux d’érysipèles selon l’IMC. IMC : Indice de masse corporelle (poids/taille²). Les barres d’histogrammes représentent le pourcentage d’érysipèles ayant causé l’hospitalisation ou s’étant développées durant le séjour en médecine interne ou paraissant dans les antécédents des patients au sein des six classes d’IMC <20 kg/m², 20 à 24.9 kg/m², 35 à 29.9 kg/m², 30 à 34.9 kg/m², 35 à 39.9 kg/m², et >40kg/m². Le taux d’érysipèles semble corrélé aux grands IMC. Le maximum était retrouvé parmi les patients d’IMC> 40 kg/m². Encore une fois, lorsque l’on s’intéresse aux patients d’IMC >24.9 kg/m² il y a encore un aspect en U avec un nadir parmi les patients d’IMC entre 35 et 39.9 kg/m².
19 5. Taux d’endocardites infectieuses.
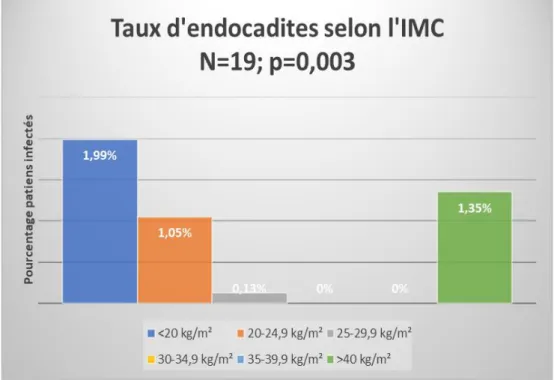
Sur les 19 endocardites retrouvées dans la population, 7 (1.99 %) étaient retrouvées parmi les patients d’IMC<20 kg/m², 10 (1.05 %) chez les patients d’IMC entre 20 et 24.9 kg/m², 1 (0.13 %) chez les patients d’IMC entre 25 et 29.9 kg/m², aucune dans les groupes d’IMC entre 30 et 34.9 kg/ et entre 35 et 39.9 kg/m² et 1 (1.35%) chez les patients d’IMC > 40 kg/m², cette différence était statistiquement significative avec un p <0.004 (p discutable compte tenu de la rareté des événements) . La comparaison de ces taux d’endocardites est représentée sur la figure 5.
Figure 6. Comparaison des taux d’érysipèles selon l’IMC
IMC : Indice de masse corporelle (poids/taille²). Les barres d’histogrammes représentent le pourcentage d’endocardites ayant causé l’hospitalisation ou s’étant développées durant le séjour en médecine interne ou paraissant dans les antécédents des patients au sein des six classes d’IMC <20 kg/m², 20 à 24.9 kg/m², 35 à 29.9 kg/m², 30 à 34.9 kg/m², 35 à 39.9 kg/m², et >40kg/m². Le maximum de taux d’endocardites est retrouvé parmi les IMC extrêmes avec une absence d’endocardites retrouvées lorsque l’IMC est entre 30 et 39.9 kg/m².
20 6. Taux des autres infections.
Concernant les infections digestives, les infections neuroméningées, les prostatites, les infections de la région tête et cou, les infections cutanées autres que les érysipèles, les tuberculoses, les infections génito-urinaires, les sepsis, les infections ostéoarticulaires, les infections bactériennes autres et les viroses, on ne notait pas de différence significative entre les différents groupes d’IMC. Les taux de ces infections selon les groupes d’IMC sont donnés dans le tableau 2. Groupe d’infection Nombres d’infections IMC>20 kg/m² IMC 20-24.9 kg/m² IMC 25-29.9 kg/m² IMC 30-34.9 kg/m² IMC 35-39.9 kg/m² IMC >40 kg/m² P Digestives 96 4.56% 3.89% 2.75% 4.57% 2.13% 2.70% 0.445 Neuroméningées 18 1.14% 0.63% 1.05% 0% 0% 0% 0.082 Prostatites 27 0.85% 1.37% 0.92% 0.81% 0.71% 0% 0.321
Inf. tête et cou 32 1.71% .37% 1.05% 1.08% 0.71% 0% 0.149 Cutanées autres 34 1.14% 1.89% 0.52% 1.08% 2.13% 1.35% 0.204
Tuberculoses 56 3.42% 2.21% 1.96% 2.15% 0% 0% 0.175
Génito-urinaires 86 1.99% 3.57% 3.28% 2.15% 5.67% 5.41% 0.203
Sepsis 98 4.56% 3.99% 3.15% 6.49% 2.84% 4.05% 0.852
Ostéoarticulaires 66 3.99% 2.52% 1.70% 3.49% 0.71% 1.52% 0.110
Inf. bac. autres 10 0.85% 0.11% 0.79% 0% 0% 0% 0.277
Viroses 169 8.55% 6.83% 6.16% 4.03% 4.26% 8.11% 0.155
Tableau 1 : répartition selon l’IMC des infections digestives, neuroméningées, des prostatites, des infections de la région tête et cou, des infections cutanées autres que les érysipèles, des tuberculoses, des infections génito-urinaires, des sepsis, des infections ostéoarticulaires, des autres infections bactériennes, et des infections virales. Aucune différence globale
21 III. Paramètres autres que l’indice de masse corporelle associés aux infections bactériennes en analyse univariée.
On retrouvait 2154 patients non infectés et 505 patients infectés. Parmi les patients non infectés 983 (45.64%) étaient fumeurs, contre 216 (42.77%) parmi les patients infectés avec un OR à 0.890 IC95% [0.732 ; 1.083] p=0.244. Parmi les patients non infectés 397 (18.43%) avaient un diabète non insulino-dépendant, contre 124 (24.55%) parmi les patients infectés avec un OR à 1.440 [1.144 ; 1.813], p= 0.02. Parmi les patients non infectés 85 (3.95%) avaient un diabète de type 1, contre 4.36 % parmi les patients infectés avec un OR à 1.109 [0.687 ; 1.790] p=0.673. Parmi les patients non infectés 320 (14.86%) étaient éthyliques chroniques, contre 95 (18.81%) parmi les patients infectés avec un OR à 1.327 [1.031 ; 1.709] p=0.028. Parmi les patients non infectés 10 (0.46%) avaient un déficit immunitaire commun variable, contre 3 (0.59%) parmi les patients infectés avec un OR à 1.281 [0.351 ; 4.673] p=0.722. OR IC 95% p Tabac 0.890 [0.732 ; 1.083] 0.244 Diabète de type 2 1.440 [1.144 ; 1.813] 0.02 Diabète de type 1 1.109 [0.687 ; 1.790] 0.673 Alcool 1.327 [1.031 ; 1.709] 0.028 DICV 1.281 [0.351 ; 4.673] 0.722
Tableau 2 : OR des facteurs confondant potentiels pour les infections bactériennes.
Tabac : tabagisme actif ou passif, DICV : Déficit immunitaire commun variable. OR : odds ratio. IC 95% : intervalle de confiance à 95%. On retrouvait un surrisque significatif dans le sous-groupe diabète de type 2 et le sous-groupe alcool.
IV. Taux d’infections selon les classes d’IMC en analyse multivariée :
Après régression logistique sur les infections bactériennes, pneumopathies, pyélonéphrites et les infections ostéoarticulaires on retrouvait les résultats d’odds ratio significatifs classés par ordre d’importance colligés dans les tableaux 3 à 6.
22 Facteur confondant OR IC 95% P Sexe féminin 1.42 (1.158 ;1.175) 0.0008 Age 1.033 (1.027 ; 1.039) 0.0001 IMC à risque* 1.390 (1.177 ; 1.664) 0.0001 Alcool 1.360 (1.035 ; 1.786) 0.0274 Intercept 84.34 [47.24 ; 150.57] 0.0001
Tableau 3. Odds ratio de développer une infection bactérienne après régression logistique
Facteur confondant OR IC 95% p Sexe masculin 1.418 (1.081 ; 1.859) 0.0115 Age 1.038 (1.029 ;1.046) 0.0001 IMC à risque* 1.522 (1.213 ;1.910) 0.0003 Alcool 1.537 (1.087 ; 2.174) 0.0151 Intercept 306 [137.486 ; 681.074] 0.0001
Tableau 4. Odds ratio de développer une pneumopathie après régression logistique
Facteur confondant OR IC 95% p
Sexe féminin 5.680 (2.979 ; 10.83) 0.0001
Alcool 2.220 (1.214 ; 4.059) 0.0096
Intercept 22.284 (17.265 ; 28.76) 0.0001
Tableau 5 Odds ratio de développer une pyélonéphrite aigüe après régression logistique
Facteur confondant OR IC 95% p
Sexe masculin 2.158 (1.298 ; 3.588) 0.003
Âge 1.026 (1.010 ; 1.042) 0.001
Intercept 303.657 (99.47 ; 926.972) 0.0009
Tableau 6. Odds ratio de développer une infection ostéoarticulaire après régression logistique
Tableaux 3 à 6. Tabac : tabagisme actif ou passif, OR : odds ratio. IC 95% : intervalle de confiance à 95%. Alcool : éthylisme chronique. Intercept ensemble des autres facteurs explicatifs autres que les paramètres testés. IMC à risque : IMC<20 kg/m², ou 25 à 29.9 kg/m², ou >40 kg/m².
23 V. Taux d’infections selon le sexe (analyse univariée) :
On retrouvait de manière significative une relation statistique entre sexe masculin et infections bactériennes avec un OR 1.439 (1.185-1.747) p= 0.002, les pneumonies : OR 1.436 (IC 95% : (1.113 ; 1.852) p= 0.05 et les infections ostéoarticulaires OR : 2.145 (1.297 ; 3.549) p= 0.002. On retrouvait une relation statistique significativement protectrice entre le sexe masculin et la survenue de pyélonéphrites OR : 0.215 (IC 95 % : 0.116-0.399) p= 2.08-08. Ces résultats sont consignés dans le tableau 8.
Type d’infection OR et IC 95% P Infections bactériennes 1.439 (1.185;1.747) 0.002 Pneumonies 1.436 (1.113;1.852) 0.005 Pyélonéphrites aigües 0.215 (0.116;0.399) 2.08-08 Infections digestives 0.652 (0.425;0.999) 0.06 Infections neuroméningées 1.610 (0.633;4.091) 0.347 Erysipèles 1.404 (0.793;2.486) 0.245 Endocardites 0.933 (0.374;2.327) 1.00 Tête et cou 1.287 (0.641;2.585) 0.476
Infections cutanées autres 0.792 (0.395 ;1.589) 0.511
Tuberculoses 1.291 (0.760;2.193) 0.343
Infections génito-urinaires 0.793 (0.510;1.234) 0.303
Sepsis 1.048 (0.698;1.572) 0.822
Infections ostéoarticulaires 2.145 (1.297;3.549) 0.002 Autres infections bactériennes 0.549 (0.144;2.086) 0.528
Viroses 1.000 (0.730;1.369) 0.999
Tableau 7 : odds ratio des infections d’organes selon le sexe. OR : odds ratio de développer une infection si on est de sexe masculin, IC 95% : intervalle de confiance à 95%. Le sexe masculin était associé à plus d’infections bactériennes, plus de pneumonies, et d’infections ostéoarticulaires. Le sexe féminin était associé à plus de pyélonéphrites aigües. Pour les autres
24 infections d’organes il n’y avait pas de différence significative entre les deux sexes.
VI. Taux de mortalité selon le sexe.
Sur 2659 patients étudiés on notait 28 décès (1.87%) chez les femmes et 25 décès (2.15%) chez les hommes, on ne notait pas de différence significative de mortalité toutes causes confondues entre les groupes de sexe masculin et féminin, l’odds ratio pour le groupe masculin de mortalité était à 1.150 IC 95% [0.667 ; 1.982] avec un p=0.615.
VII. Imprécision du diagnostic selon le sexe.
La variable « diagnostic imprécis » était renseignée pour 2646 patients et correspondait à une incertitude des conclusions diagnostiques à la fin de l’hospitalisation. Cette imprécision était retrouvée chez 379 femmes (25.45%) et 306 hommes (26.45%) cependant cette différence n’était pas significative avec un p=0.562.
25 DISCUSSION :
I. Taux d’infections bactériennes selon l’IMC
On retrouvait le maximum de risque dans les extrêmes d’IMC <20 kg/m² et > 40 kg/m². Le surrisque d’infections bactériennes chez les patients de <20 kg/m² pourrait correspondre à des patients cachectiques dans le cadre de cancers et hémopathies, d’un éthylisme chronique responsable d’un état de dénutrition. Les grands IMC >40 kg/m² cumulaient probablement des facteurs de risque infectieux mécaniques (respiratoires, cutanés) et immunologiques.
Cela concorde avec l’étude de Henry E. Wang et al qui ont publié en 2013 en s’appuyant sur les données collectées dans la cohorte REGARDS (REasons for Geographic and Racial Differences in Stroke) les résultats suivants : Sur les 975 sepsis recensés il n’était mis en évidence qu’une différence entre les groupes d’IMC> 40 kg/m² et IMC normal avec un risque relatif de 1.57 avec in IC 95% [1.16-2.14].(5)
26 II. Le taux d’infections pulmonaires selon l’IMC.
Le taux maximal d’infections pulmonaires était retrouvé dans la population d’IMC bas <20 kg/m². On retrouve dans la littérature une courbe en J avec un risque d’infections pulmonaires élevé chez les patients maigres et également chez les obèses.
Concernant le surrisque chez les patients d’IMC<20 kg/m² on peut supposer qu’il s’agit d’une conséquence d’une immunosuppression relative, mais on pourrait également explorer la possibilité qu’il s’agisse de patients ayant des tumeurs bronchiques qui soient responsables d’infections pulmonaires plus ou moins à répétition.
Cela est à mettre en comparaison avec les résultats de l’étude de D. T. Phung et al qui ont publié une méta-analyse portant sur 25 études qui comparait les odds ratio entre les patients d’IMC normal et les patients maigres, en surpoids, obèses et obèses morbides de développer une pneumopathie aigüe communautaire, une pneumonie grippale, une pneumonie
nosocomiale. Dans les groupes, surpoids, obèses, et obèses morbides, il n’y avait pas de différence significative concernant les pneumonies aigües communautaires, et pour les
pneumonies nosocomiales par contre, on retrouvait une différence significative concernant les pneumonies grippales où le surpoids était un facteur protecteur avec un Odds ratio à 0,88 (IC 95% [0.79 ; 0,99], p 0.03), et ce risque augmentait dans le sous-groupe de patients obèses avec un Odds ratio à 1,31 (IC 95% [1,05 ; 1,63] p 0,02) et 4,6 (IC95% [2,2 ; 9,8], p<0.01) dans le sous-groupe de patients obèses morbide (6).
III. Le taux de pyélonéphrites et infections urinaires selon l’IMC.
L’explication du sur-risque de pyélonéphrite aigüe franc dans le groupe d’IMC 35 à 39.9 kg/m² vient probablement du fait du peu de patients ayant un IMC >40 kg/m² (74 patients sur 2653) et parmi ces 74 patients 2 ayant fait une pyélonéphrite. On peut donc supposer que les groupes d’IMC >30 kg/m² ne sont pas différents et que c’est l’obésité qui est globalement responsable du sur-risque infectieux.
27 Semins et al ont mené une étude sur une base de données d’assurances aux Etats unis sur 3,7 millions d’assurés sur une période de 5 ans et ont également retrouvé des résultats en faveur d’une augmentation de l’odds ratio de développer une pyélonéphrite aigüe avec l’augmentation de l’obésité. Leurs résultats sont visibles dans le tableau 8.(7)
IMC OR p Hommes <30 30-34.9 35-39.9 40-44.9 45-49.9 >50 -- 1.21 (0.81-1.8) 2.47 (1.50-4.07) 2.46 (1.06-5.67) 3.00 (1.22-20.85) 5.05 (1.22-20.85) -- 0.3464 0.0004 0.0354 0.1275 0.0252 Femmes <30 30-34.9 35-39.9 40-44.9 45-49.9 >50 -- 1.71 (1.42-2.05) 1.75 (1.36-2.27) 2.81 (2.06-3.83) 1.79 (0.95-3.37) 1.68 (0.74-3.78) -- <0.0001 <0.0001 <0.0001 0.0724 0.214
Tableau 8. Odds ratio de développer une pyélonéphrite aigüe selon le sexe et l’IMC dans l’étude de Semins et al. IMC : indice de masse corporelle en kg/m², OR : odds ratio, p : p-value.
IV. Taux d’érysipèles selon l’IMC
Le risque semble augmenter avec l’importance de l’indice de masse corporelle. Cependant c’est le taux bas d’érysipèles au sein du groupe d’IMC 35-39.9 kg/m² qu’il n’est pas possible d’expliquer avec cette étude. Il faudrait réaliser une nouvelle étude en investiguant comme facteurs confondants un état veineux sous-jacent, ou plus d’ulcères cutanés, d’intertrigos, et de facteurs d’immunosuppression.
Dans une étude prospective menée par Karpelin et al, portant sur 90 patients d’un service de maladies infectieuses aux Etats Unis, l’odds ratio de développer une dermohypodermite non nécrosante était de 4.7 IC 95% [1.9–11.3] et de9.5 (95% CI 2.2–40.8 ] de développer une nouvelle dermohypodermite (8).
28 V. Taux d’endocardites selon l’IMC
On retrouve plutôt des endocardites infectieuses chez nos patients d’IMC bas, ce qui pouvait être attendu dans cette infection parfois trainante et cachectisante. Il faudrait réaliser une nouvelle étude si possible prospective en prenant en compte les facteurs de risques connus d’endocardites infectieuses.
La significativité de la différence de taux d’endocardites selon l’IMC calculée par un test de Chi-2 est à interpréter avec précaution vu le faible nombre d’événements.
VI. Taux des autres infections selon l’IMC. Différences selon le sexe.
Il est très probable que l’absence de différence significative entre les différents groupes d’IMC dans la survenue d’infections digestives, neuroméningées, d’endocardites infectieuses, de prostatites, d’infections de la région tête et cou, d’infections cutanées autres que les érysipèles, de tuberculoses, infections génito-urinaires, de sepsis, d’infections ostéoarticulaires, d’infections bactériennes autres et de viroses viennent du recrutement spécialisé de ces dernières et ne relevant pas d’infections fréquentes vues en médecine interne.
Le fait que le sexe masculin soit associé à plus d’infections bactériennes, plus de pneumonies, et d’infections ostéoarticulaires mérite d’être exploré en recherchant au sein de cette population les facteurs confondants potentiels (tabac, immunosuppresseurs, plus de bactériémies, de procédures invasives osseuses). Concernant les autres infections d’organes, le fait il n’y ait pas de différence significative entre les deux sexes nécessite d’être contrôlé dans une nouvelle étude au mieux prospective, incluant plus de patients.
VII. Les forces de l’étude
Il s’agit à notre connaissance de la première étude s’intéressant à la relation entre l’IMC et le risque infectieux dans une population ciblée de médecine interne. Les forces de l’étude étaient le caractère d’étude en vie réelle avec une population non sélectionnée. Le choix de réaliser cette étude dans un service de médecine interne a été motivé par la polyvalence du
29 recrutement des patients. En effet, cela diminuait le risque de biais de sélection contrairement à une spécialité d’organe où le type d’infection d’organe en question aurait été sur-représenté.
Cette étude permet de mettre en évidence l’hétérogénéité du risque infectieux selon les groupes d’IMC notamment au sein même des groupes d’IMC supérieurs à 25 kg/m². Cela rejoint la notion du paradoxe de l’obésité.
La force de cette étude est qu’elle repose sur un faible nombre de données manquantes concernant le poids et la taille des patients, qui soit étaient colligés durant l’hospitalisation, soit ont pu être retrouvés dans le reste du dossier médical.
VIII. Les faiblesses de l’étude
Les faiblesses de l’étude sont d’abord son caractère rétrospectif (au niveau des antécédents) et monocentrique hospitalier donc ne permettant pas de généraliser les résultats à la population générale.
Il existe aussi un potentiel biais de mémorisation, car les antécédents ou la taille reposaient sur l’interrogatoire des patients.
L’autre risque était de mal dater un antécédent infectieux : avec l’incertitude que l’IMC était comparable à celui de l’hospitalisation (variations pondérales parfois rapides).
L’IMC est un indice imparfait pour apprécier de manière fiable le taux de masse grasse ou maigre et ne permet pas de supposer de la répartition périphérique ou viscérale des adipocytes. La mesure du tour de taille et du tour de hanche est la mieux corrélée au risque infectieux et cardiovasculaire dans la littérature, mais nous n’avions pas ces données dans le dossier médical.
Les diagnostics notamment infectieux peuvent être incertains. Ce risque était diminué par la possibilité de vérifier les devenir du patient en regardant une éventuelle consultation de contrôle après la sortie d’hospitalisation et les résultats définitifs parvenus après cette sortie.
30 immunosuppresseurs non stéroïdes, l’éthylisme chronique, les déficits immunitaires communs variables et permettaient une analyse multivariée afin de vérifier le poids de chacun de ces facteurs de confusion. Cependant, la régression logistique n’est pas habilitée à caractériser une courbe en U d’association entre le taux d’infections par organes et l’IMC.
Il existe aussi un possible manque d’effectif concernant certains types d’infection, et il est possible que certains résultats rendus non significatifs le soient si plus de patients avaient pu être étudiés.
31 CONCLUSION :
Il existe une hétérogénéité du risque infectieux parmi les classes d’IMC. En particulier parmi les patients d’IMC élevé au-dessus de 25 kg/m² où le risque ne semble pas linéaire mais avec paradoxalement un risque moindre dans les classes 30-34.9 kg/m² ou 35-39.9 kg/m² selon les infections. Cette différence de probabilité d’infection n’est pas retrouvée dans tous les types d’infections. Cette étude mériterait d’être reconduite de manière prospective avec un questionnaire standardisé concernant les antécédents infectieux et les potentiels facteurs confondants, la mesure systématique du tour de taille et d’être conduite soit en population générale, soit de manière multicentrique.
32 REFERENCES BIBLIOGRAPHIQUES
1. Principaux repères sur le surpoids et l’obésité de l’OMS. Disponible sur: https://www.who.int/fr/news-room/fact-sheets/detail/obesity-and-overweight 2. Balicco A, Oleko A, Szego E, Boschat L, Deschamps V, Saoudi A, et al. Protocole
Esteban : une Étude transversale de santé sur l’environnement, la biosurveillance, l’activité physique et la nutrition (2014–2016). Toxicol Anal Clin. 2017; 29 : 517‑537. 3. de Heredia FP, Gómez-Martínez S, Marcos A. Obesity, inflammation and the immune
system. Proc Nutr Soc. 2012; 71 : 332‑328.
4. Kwon Y, Kim HJ, Park S, Park Y-G, Cho K-H. Body Mass Index-Related Mortality in Patients with Type 2 Diabetes and Heterogeneity in Obesity Paradox Studies: A Dose-Response Meta-Analysis. PLoS ONE 2017;12 .
5. Wang HE, Griffin R, Judd S, Shapiro NI, Safford MM. Obesity and risk of sepsis: A population-based cohort study: Obesity and Risk of Sepsis. Obesity 2013; 21: 762‑769. 6. Phung DT, Wang Z, Rutherford S, Huang C, Chu C. Body mass index and risk of
pneumonia: a systematic review and meta-analysis: BMI and pneumonia. Obes Rev. 2013; 14 : 839‑857.
7. Semins MJ, Shore AD, Makary MA, Weiner J, Matlaga BR. The Impact of Obesity on Urinary Tract Infection Risk. Urology 2012;79 : 266‑269.
8. Karppelin M, Syrjänen J, Siljander T, Vuopio-Varkila J, Kere J, Huhtala H, et al. Factors predisposing to acute and recurrent bacterial non-necrotizing cellulitis in hospitalized patients: a prospective case–control study. Clin Microbiol Infect. juin 2010;16 :729‑734.
34 IMC et développement d’infections ?
BMI and infections development ?
RESUME ET MOTS CLES :
INTRODUCTION :
L'OMS définit le surpoids et l’obésité comme une accumulation anormale ou excessive de graisse corporelle qui peut nuire à la santé. L'objectif principal de cette étude était de mettre en évidence une différence de taux d'infections et d’antécédents infectieux en médecine interne selon le groupe d’indice de masse corporelle (IMC). MATERIEL ET METHODES :
Il s'agissait d'une étude observationnelle, analytique, de cohorte monocentrique au sein du service de médecine interne du CHU d’Amiens. Les patients étaient répartis en 6 classes d’IMC : <20 kg/m², 20-24.9 kg/m², 25-29.9 kg/m², 30-34.9 kg/m², 35-39.9 Kg/m² et ≥40 kg/m².
RESULTATS :
Le taux d’infections bactériennes était de 23.94% chez les patients d’IMC <20 kg/m² et 25.68% chez ceux d’IMC >40 kg/m². Il y avait 5.63% de pneumonies dans le groupe d’IMC 30 à 34.9 kg/m². Les érysipèles étaient plus fréquents dans les groupes d’IMC élevés 30-34.9 kg/m² et >40 kg/m² et les pyélonéphrites étaient plus fréquentes dans le groupe d’IMC 35 à 39.9 kg/m².
DISCUSSION :
Le surrisque d’infections bactériennes chez les patients de <20 kg/m² pourrait être en lien avec un état de dénutrition. Les IMC >40 kg/m² cumulaient probablement des facteurs de risque infectieux mécaniques (respiratoires, cutanés) et immunologiques. Le surrisque de pneumonie chez les patients d’IMC<20 kg/m² pourrait venir d’une dénutrition voire de tumeurs endo-bronchiques. Le surrisque de pyélonéphrite aigüe et d’érysipèle dans l’obésité est connu dans la littérature.
CONCLUSION :
Cette étude fait apparaitre une hétérogénéité du risque infectieux selon l’IMC et au sein de patients en surpoids et obèses.
MOTS CLES : Indice de masse corporelle, infections, surpoids, obésité, infections bactériennes, infections virales.
ABSTRACT AND KEYWORDS: OBJECTIVE:
To show a difference in rates of infection and a history of infection in internal medicine. STUDY DESIGN : this study was an observational, analytical, monocentric cohort study in the internal
medicine unit of Amiens hospital. PATIENTS:
2659 patients were divided into 6 classes of BMI: 20 kg/m², 20-24.9 kg/m², 25-29.9 kg/m², 30-34.9 kg/m², 35-39.9 Kg/m² and 40 kg/m².
METHODS:
The primary endpoint was the development of an infection during hospitalization or hospitalization for an infectious cause or the presence of a bacterial or viral history of infection.
RESULTS:
Bacterial infections were 23.94% in BMI patients <20 kg/m² and 25.68% in BMI patients >40 kg/m². There were 5.63% pneumonia in the BMI group 30 to 34.9 kg/m². Erysipelas were more common in the high BMI groups 30-34.9 kg/m² and >40 kg/m² and pyelonephritis were most common in the BMI group 35 to 39.9 kg/m².
CONCLUSIONS:
This study shows heterogeneity of infectious risk in BMI and in overweight and obese patients. KEYWORDS: Body mass index, infections, overweight, obesity, bacterial infections, viral infections.