Modélisation du lessivage de l’azote en grande
culture en champ drainé
Mémoire
Jean-Pascal Matteau
Maîtrise en sols et environnement
Maître ès sciences (M.Sc.)
Québec, Canada
Modélisation du lessivage de l’azote en grande
culture en champ drainé
Mémoire
Jean-Pascal Matteau
Sous la direction de :
Silvio J. Gumiere, directeur de recherche
Aubert Michaud, codirecteur de recherche
III
Résumé
Les pertes de fertilisant azoté utilisé en agriculture sont parmi les principaux polluants impliquées dans la dégradation de la qualité de l’eau au Québec. Sous couvert de grande culture, les nitrates lessivés peuvent atteindre 185 kg ha-1. Synchroniser la fertilisation azotée avec le prélèvement des
cultures serait une manière d’optimiser l’utilisation de l’azote et ainsi de réduire le lessivage de nitrate. La modélisation déterministe du cycle de l’azote couplé à un modèle de dynamique de l’eau dans le sol pourrait aider à cette optimisation. Les objectifs de l’étude étaient : (1) de développer un modèle empirique de production de nitrate à la surface du sol, (2) de combiner ce modèle avec HYDRUS afin de prédire la quantité de nitrate lessivé vers les drains et (3) d’évaluer la contribution de l’azote fourni par la matière organique du sol au lessivage de nitrate.
Dans cette étude, nous avons utilisé des équations d’estimations des pools d’azotes et de leurs transformations. Les équations ont été combinées en 60 patrons de relâchement du N utilisant une fonction de mise en solution de N pour le nitrate, 4 fonctions pour l’ammonium, 5 pools d’azote organique du sol et 3 fonctions de relâchement de N de l’azote organique du sol et des lisiers. Ces patrons de relâchement de N ont été appliqués dans un traitement de fertilisation minérale et quatre traitements de fertilisation organiques pour un total de 300 patrons uniques de relâchement de nitrate. Les résultats démontrent que les méthodes d’évaluation des contributions des formes d’azote basées sur des données atmosphériques, de rotation de culture ou de granulométrie du sol peuvent mener à des résultats intéressants. La méthode de prédiction doit être différente si le fertilisant appliqué sur la parcelle est organique ou minéral.
IV
Abstract
Agricultural nitrogen fertilizer losses are among the main pollutants involved in water quality degradation in Quebec. Under maize crop, leached nitrate can reach up to 185 kg ha-1. Synchronizing
nitrogen fertilization with crop uptake would be a way to optimize the use of nitrogen fertilizer and reduce nitrate leaching. The process-oriented modeling of the nitrogen cycle coupled with a soil water model could contribute to simplifying the optimisation of nitrogen fertilizer use. The objectives of this study were to: (1) to determine the most suitable soil surface empirical nitrate production model, (2) to couple this model with HYDRUS in order to predict nitrate leaching into subsurface drains, and (3) to evaluate the soil organic nitrogen contribution to nitrate leaching.
In this study, we used nitrogen pools and transformations in governing mass balance equation. The equations were combined into 60 N-release patterns taking into account one dissolution function of nitrate, 4 transformation and dissolution functions for the ammonium, 5 organic nitrogen pools and 3 N organic nitrogen from the soil and manure release functions. These N release patterns were applied for a mineral fertilizer treatment and four organic fertilizer treatments for a total of 300 unique nitrate release patterns.
The results demonstrate the accuracy of the methodological framework to evaluate the contributions of nitrogen based on atmospheric data, crop rotation or soil particle size. The prediction method must be different if the fertilizer applied to the plot is organic or mineral. In addition, the study showed that the soil organic nitrogen contribution tends to decrease as the organic fertilizer application rates increases. The simulations also showed that the nitrate masses leached are closely related to the fertilizer supply nitrogen content.
V
Table des matières
Résumé ... III Abstract ... IV Remerciements ... XI Avant-propos ... XIII
Chapitre 1 Introduction générale ... 1
Bibliographie ... 4
Chapitre 2 Revue de littérature ... 5
2.1 Enjeux environnementaux ... 6
2.2 Enjeux économiques ... 7
2.3 Les outils opérationnels de prévision de la disponibilité de l’azote ... 8
2.4 Le cycle de l’azote : Perspective agronomique ... 9
2.4.1 Minéralisation ... 9
2.4.2 Prélèvement par les plantes ... 10
2.4.3 Volatilisation ... 10
2.4.4 Dénitrification... 11
2.4.5 Immobilisation ... 11
2.4.6 Lessivage... 11
2.5 Modélisation ... 12
2.6 Le choix des modèles pour l’étude... 12
2.7 HYDRUS ... 13
2.8 Modélisation de l’azote dans HYDRUS ... 14
2.9 Équation empirique de libération du nitrate ... 15
2.9.1 Équation de transformation de l’ammonium ... 16
2.10 Équation de minéralisation ... 16
2.10.1 Détermination du pool d’azote organique potentiellement minéralisable ... 17
2.10.2 Taux de libération de l’azote organique du sol ... 19
Bibliographie ... 21
Chapitre 3 Coupling of a nitrate production model with HYDRUS to predict nitrate leaching... 27
Résumé ... 28
Abstract ... 29
3.1 Introduction ... 30
VI
3.2.1 Experimental sites ... 32
3.2.2 Soil description ... 33
3.3 Nitrate production model ... 34
3.3.1 Soil organic nitrogen pools ... 37
3.3.2 Soil organic nitrogen release function ... 38
3.4 Leaching modeling strategy ... 39
3.5 Model calibration ... 39
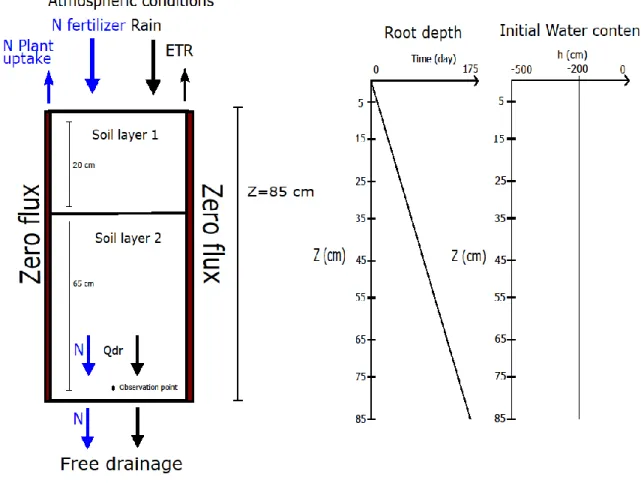
3.6 Initial and boundary conditions ... 40
3.7 Model evaluation criteria ... 41
3.8 Results and discussion ... 42
3.8.1 Water Transport ... 42
3.8.2 Predictive N release pattern analysis ... 43
3.8.3 Nitrogen plant uptake ... 49
3.9 Conclusions ... 49
Acknowledgement ... 51
Bibliographie ... 52
Chapitre 4 Conclusion générale ... 58
VII
Liste des tableaux
Tableau 1 : Teneur et fourniture annuelle moyenne du sol en azote à la suite de différentes rotations ... 17 Tableau 2 : Variables nécessaires à l'estimation du pool I tiré de Dessureault-Rompré et al. (2010a). ... 18 Table 3: Variation of soil properties with depth. ... 34 Table 4: Nitrogen supply and chemical distribution of fertilizer per treatment for mineral fertilizer (0 Mg ha-1) and the four doses of organic fertilizer (30, 60, 90 and 120 Mg ha-1) ... 36
Table 5: Optimized van Genuchten parameters. θr is the residual water content, θs is the saturated water content, α is the air entry parameter, n is a porosity distribution measure, Ks is the saturated hydraulic conductivity and l is a tortuosity parameter. ... 40 Table 6: N release patterns with Nash-Sutcliffe efficiency coefficient above 0.70 and RMSE for each treatment, 0 Mg- mineral fertilization treatments, 30 Mg- 30 Mg ha-1 organic fertilizer, 60 Mg- 60
VIII
Liste des figures
Figure 1: Cycle terrestre de l'azote adapté de Neitsch et al., (2011) ... 9 Figure 2: Historique du développement d'HYDRUS et des différents modèles reliés adapté de Simunek et al (2012). ... 14 Figure 3 : Long-term manure fertilizer test diagram. The solid red line in the middle of each plot represents the subsurface drain, the broken line represents a collector containing an individual pipe for each plot. The shelter contains a tipping bucket for each plot. LSM refer to the organic fertilizer (liquid swine manure) and the x refer to the application rate ( 30 Mg ha-1, 60 Mg ha-1, 90 Mg ha-1,
120 Mg ha-1). ... 32
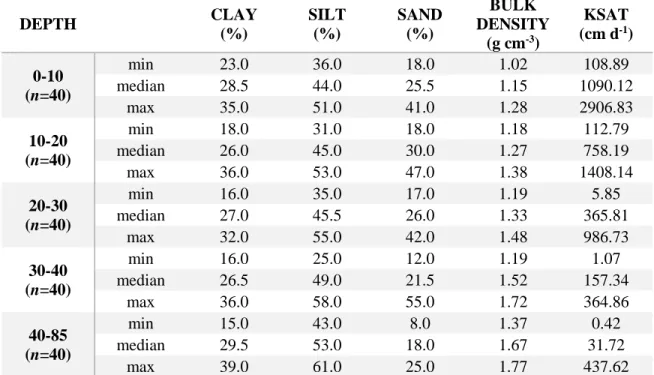
Figure 4 : The nitrate production model conceptual diagram for one treatment, illustrating the three nitrogen pools and the eight N release functions. X can have a value of either 0, 30, 60, 90 or 120 Mg ha-1 and represents the fertilizer treatment organic nitrogen contribution (0 is the mineral
fertilisation treatment). The upper level shows the three nitrogen pools: NO3, NH4 and Organic
nitrogen. The intermediate level shows the N release functions for the three pools where the nitrogen is transformed to nitrate and distributed daily. The lower level shows the N release pattern from each pool and the total daily nitrate used as input to HYDRUS. The inset frame shows how the 300 permutations were obtained. For the ammonium N release function, equation 1 was developed by Gasser et al. (2003) and equation 2 was developed by Hanson et al. (2006) where the significant lengths of the nitrification process are 75 and 30 days, respectively. For the organic nitrogen N release functions, equation 6 was developed by Dessureault-Rompré et al. (2010b) and equation 7 was developed from the data measured by Sbih et al. (2003). ... 35 Figure 5 : Boundary and initial conditions modeling schemes, where the blue and black arrow represent respectively the nitrate and the water. ... 41 Figure 6 : Observed (red dot) and modelled (blue line) drainage water in the subsurface drain for each treatment. (A) Maize growing season in 2009. (B) Wheat growing season in 2011. ... 42 Figure 7 : A to E, Envelop of the cumulative nitrate mass in drainage water modeled by the release functions (N=60) in 2009 for each treatment (in grey). (A) mineral fertilization treatments, (B) 30 Mg ha-1 organic fertilizer, (C) 60 Mg ha-1, (D) 90 Mg ha-1 and (E) 120 Mg ha-1. ... 44
Figure 8 : A to E, Simulated cumulative nitrate mass as a function of time for the N release patterns with Nash-Sutcliffe efficiency coefficient above 0.70; the black dots represent observations in 2009.
IX
(A) mineral fertilization treatments, (B) 30 Mg ha-1 organic fertilizer, (C) 60 Mg ha-1, (D) 90 Mg ha-1
X
«All that is gold does not glitter, Not all those who wander are lost» J.R.R Tolkien
XI
Remerciements
Je tiens à remercier mon directeur de recherche, le professeur Silvio Gumiere, pour son encadrement, son aide et ses précieux conseils tout au long de mon projet. Ta passion contagieuse, ton ardeur et ta rigueur au travail, ton énergie et ta bonne humeur m’ont, à la fois, aidé à accomplir ce travail tout comme à me former comme futur professionnel.
Je remercie, également, mon codirecteur, Aubert Michaud, de m’avoir offert la chance de participer à ce projet. Ta grande ambition et tes conseils m’ont inspiré et m’ont permis de progresser tout au long de ce travail.
Ensuite, je tiens à remercier le professeur Jacques Gallichand pour sa patience et sa rigueur lors des nombreuses (23) relectures et réécritures de mon article. Cette expérience, mais aussi ton expérience, auront contribué à la structure et à la qualité scientifique de ma pensée et de ma rédaction. Lors de mes prochaines rédactions, tes conseils continueront de résonner dans mon esprit.
Je remercie, également, Marc-Olivier Gasser qui, en plus de m’avoir fourni les données nécessaires à l’élaboration de mon projet, m’a toujours appuyé et m’a apporté de précieux conseils pour la compréhension et ensuite la réalisation de mon projet. Ta contribution et ton expertise ont été essentielles à la réussite de ce travail et à la progression de ma formation.
Je tiens à remercier, également, le professeur Lotfi Khiari pour ses conseils et ses validations tout au long de mon projet. J’ai, grandement, apprécié ta disponibilité et ta grande volonté à m’aider malgré ton horaire toujours très chargé.
Ensuite, je tiens à remercier Jacynthe Dessureault-Rompré pour sa contribution à mes connaissances et son aide pour l’élaboration du modèle.
Il convient, ensuite, de remercier les deux « Pro » de l’équipe. D’abord, à Guillaume Létourneau, merci pour tes critiques acerbes, tes commentaires tranchants et tes suggestions intransigeantes. Ton aide a été essentielle pour la réussite de ce travail et la rédaction de mon article. Je t’en remercie sincèrement.
Ensuite, à Jonathan Lafond, merci. Bien que ta contribution n’apparaisse pas officiellement sur mon travail, tu m’as toujours soutenu et appuyé au travers des deux dernières années et je l’apprécie énormément. Ton expérience et ta sagesse auront été d’habiles conseillères.
Andréanne, Francis, Jean-Michel et Laurie, mes partner de maîtrise de tous les départements, merci pour le support, les séances de travail multidisciplinaire en groupe et surtout pour les activités sociales
XII
de soutien moral collectif! Tous ces aspects ont été importants et très agréables tout au long des différentes étapes de ce travail.
Ma belle Jennifer, je tiens aussi à te remercier. Ton soutien et tes encouragements m’ont aidé à conserver la cadence dans les moments de travail acharné. Ton écoute patiente et passionnée et ton intérêt à tous les aspects de mon mémoire ont été plus qu’agréable et ont contribué à m’aider à finaliser ce travail.
Finalement, un énorme merci à mon père, ma mère et ma sœur. Vous m’avez soutenu et encouragé depuis toujours. Vous m’avez aidé et conseillé lorsque vous le pouviez et vous vous êtes investi dans mes nombreux projets. Vous m’avez aidé à rester déterminé, à conserver l’objectif en tête, à terminer ce mémoire pour débuter de nouveaux projets. Merci.
Au final, ce sont les petites choses qui font les grandes différences. Chacune des briques que l’on ajoute aux immenses constructions que sont les sciences pourront contribuer et feront une différence. Elles sont toutes importantes.
XIII
Avant-propos
Ce mémoire est rédigé sous forme d’article scientifique. Les chapitres 1, 2 et 4 sont rédigés en français et correspondent, respectivement, à l’introduction générale, la revue de littérature et la conclusion générale. Le chapitre 3, rédigé en anglais, est constitué de l’article qui s’intitule « Coupling of a nitrate production model with HYDRUS to predict nitrate leaching». Cet article sera soumis sous peu au Science of the Total Environnement Journal. J’atteste être le principal responsable des travaux de recherche, du traitement et de l’analyse des données ainsi que de la rédaction de l’article en tant que premier auteur. Le Dr Silvio J. Gumiere, mon directeur de recherche et le Dr Aubert Michaud, mon codirecteur de recherche sont coauteurs de l’article. Le Dr Jacques Gallichand, le Dr Lotfi Khiari, le Dr Marc-Olivier Gasser et Guillaume Létourneau M. Sc. sont les autres coauteurs de cet article. L’article est présenté dans son intégralité. Sa stylistique a cependant été modifiée pour répondre aux exigences de l’Université Laval en matière de publication d’un mémoire.
Chapitre 1
2
Au Québec entre 2009 et 2011, 42% des rivières avaient un indice de qualité générale de l’eau considérée entre douteuse et très mauvaise (Ministère du Développement durable, 2012). Plus précisément au niveau des nitrites et des nitrates, pour la période entre 2006 et 2008, 16% des rivières avaient une concentration médiane au-dessus de 1.01 mg L-1, considérée comme douteuse à mauvaise,
cette tendance était particulièrement présente dans les milieux agricoles (Ministère du Développement durable, 2012). Il a aussi été démontré que les superficies sous grande culture peuvent être sensibles aux pertes de nitrate par lessivage (Gollamudi, 2006). Bien que son utilisation comporte des risques pour les cours d’eau, l’azote demeure la base de l’agriculture moderne en tant qu’élément nutritif le plus important pour le rendement et la croissance des cultures (N’Dayegamiye et al., 2007). L’utilisation et l’importance de l’azote à travers le monde a amené certains auteurs à avancer que la société d’aujourd’hui peut être considérée dépendante à une économie basée sur l’azote (Erisman et al., 2008). Le cycle de l’azote ainsi que les réactions et les interactions qui en découlent ont une influence sur l’agriculture et l’environnement. L’agriculture moderne est en partie basée sur l’utilisation de l’azote alors que des analyses statistiques et des expériences à long terme ont conclu qu’environ 40 à 60% des récoltes provenaient des fertilisants commerciaux. Il serait réaliste d’estimer qu’aux États-Unis le retrait de la fertilisation azotée causerait une baisse de production de 41% pour le maïs et de 37% pour le coton (Stewart et al., 2005).
Pour être utilisé de manière efficace, l’azote doit être géré de façon précise. Cependant, la gestion optimale de l’azote est difficile, car elle varie d’une année à l’autre selon la variabilité du climat (Jeuffroy et al., 2013; Moebius-clune et al., 2007). La majorité des systèmes de recommandation de la fertilisation azotée sont basés sur le potentiel de production et sur des courbes empiriques de réponse de l’azote. Plusieurs aussi feront les mêmes recommandations indépendamment des effets des conditions météorologiques. Ces systèmes ont tendance à mener à une fertilisation inadéquate, parfois trop élevée que certains appellent fertilisation d’assurance, ou au cours d’autres années à un taux de fertilisation trop faible (Moebius-clune et al., 2007). Certaines simulations amènent à penser qu’il serait possible de diminuer les pertes d’azotes reliés au lessivage de près de 77%, en utilisant une gestion plus précise de la fertilisation azotée (Van Es et al., 2012). Les avantages reliés à une telle amélioration seraient non négligeables pour l’environnement, pour la rentabilité des entreprises agricoles et pour la société. Une méthode possible pour améliorer la précision de la fertilisation azotée serait la prédiction des besoins des plantes selon les conditions environnementales précises par la modélisation. Il existe des modèles empiriques basés sur les processus et des modèles physiques basés sur les propriétés et les équations de physique du sol permettant ce type d’estimation.
Ce mémoire intègre l’utilisation d’un modèle empirique construit avec des équations basées sur des données agroclimatiques telles que les degrés-jours, le contenu en argile, la température du sol, la
3
teneur en eau, la rotation de culture ou l’évapotranspiration potentielle (Dessureault-Rompré et al., 2015, 2010a; Giroux and Lemieux, 2002) pour évaluer la disponibilité en nitrate dans les premiers centimètres du sol avec le modèle HYDRUS, un modèle physique, pour le transport de l’eau et de solutés vers les drains souterrains. Cette combinaison permet la simplification de la prise de données nécessaires à la modélisation du transport de solutés, l’évaluation de leur utilisation par les plantes et de leur déplacement dans le sol.
4
Bibliographie
Dessureault-Rompré, J., Zebarth, B.J., Burton, D.L., Georgallas, A., 2015. Predicting soil nitrogen supply from soil properties. Can. J. Soil Sci. 95, 63–75. doi:10.4141/cjss-2014-057
Dessureault-Rompré, J., Zebarth, B.J., Burton, D.L., Sharifi, M., Cooper, J., Grant, C. a., Drury, C.F., 2010. Relationships among Mineralizable Soil Nitrogen, Soil Properties, and Climatic Indices. Soil Sci. Soc. Am. J. 74, 1218. doi:10.2136/sssaj2009.0213
Erisman, J.W., Sutton, M. a., Galloway, J., Klimont, Z., Winiwarter, W., 2008. How a century of ammonia synthesis changed the world. Nat. Geosci. 1. doi:10.1038/ngeo325
Giroux, M., & Lemieux, M. (2002). Comparaison de différentes méthodes d ’ évaluation de la fertilité azotée des sols et détermination de la dose N optimale du maïs ensilage. Agrosolutions, 17(1), 39–50.
Gollamudi, A., 2006. Hydrological and water Quality modeling of agricultural fields in Quebec. M.Sc. Thesis, Department of Bioresource Engineering, McGill University, Montreal.
Jeuffroy, M., Gate, P., Machet, J., Recous, S., 2013. Gestion de l’azote en grandes cutlures : les connaissances et outils disponibles permettent-ils de concilier exigences agronomiques et environnementales ? Cah. Agric. 22, 249–257. doi:10.1684/agr.2013.0639
Ministère du Développement durable, de l’environnement et des parcs. (MDDEP), 2012. Portrait de la qualité des eaux de surface au Québec 1999-2008, Québec, Direction du suivi de l’état de l’environnement. ISBN 978-2-550-63649-6 (PDF), 97p.
Moebius-Clune, B., Van Es, H. M., & Melkonian, J. (2007). Adapt-N Uses Models and Weather Data to Improve Nitrogen Management for Corn. Better Crops with Plant Food, 97(4), 7–9.
N’Dayegamiye, A., Giroux, M., Gasser, M.O., 2007. La contribution en azote du sol reliée à la minéralisation de la MO : facteur climatique et régies agricoles influençant les taux de minéralisation d ’ azote, Colloque sur l’azote, CRAAQ-OAQ.
Stewart, W.M., Dibb, D.W., Johnston, a. E., Smyth, T.J., 2005. The contribution of commercial fertilizer nutrients to food production. Agron. J. 97, 1–6. doi:10.2134/agronj2005.0001
Van Es, H. M., Moebius-Clune, B. N., Melkonian, J. J., & Severson, K. (2012). A Case Study: Donald & Sons Farm Sees Money-Saving Potential in Adapt-N Tool for Corn N Rate Recommendations. What’s Cropping Up?, 22(2), 8–9.
Chapitre 2
Revue de littérature
6
2.1 Enjeux environnementaux
Une majorité des perturbations anthropogéniques du cycle de l’azote découle des activités terrestres, principalement de l’utilisation de nitrate dans la fertilisation azotée en agriculture (Fowler et al., 2013). L’arrivée excessive d’azote dans les cours d’eaux peut accélérer le processus d’eutrophisation (Dupas et al., 2015; Erisman et al., 2013). Les pesticides et les nitrates représentent la principale source de contamination des aquifères en zones agricoles (Dupuy et Banton, 2012). Les nitrates sont aussi une des principales sources de contamination des cours d’eau en zone agricole, dus à la sensibilité au lessivage des nitrates dans les terres arables en comparaison aux forêts et aux prairies (Billen et al., 2013). Les écosystèmes aquatiques possédant un pouvoir tampon faible, tel que les cours d’eau douce, sont plus sensibles à l’acidification et à l’eutrophisation causée par les nitrates (Erisman et al., 2013). Certaines espèces capables d’assimiler plus efficacement ces nutriments seront favorisées alors que d’autres espèces seront défavorisées. Dans ces situations, des éclosions de cyanobactéries et d’algues peuvent se produire et causer l’hypoxie de l’eau à la surface et le relâchement de toxines (Erisman et al., 2013).
En plus d’avoir un impact sur la qualité des cours d’eau et la santé des écosystèmes aquatique, les fertilisants azotés contenus dans l’eau peuvent avoir un impact sur les activités et la santé humaine. (Erisman et al., 2013; Hébert, 2012; MDDELCC, 2014). La concentration de nitrates dans l’eau potable peut être classée selon quatre catégories, moins de 0,2 mg N/L qui n’aurait aucune influence sur les humains, 0,21 à 3,0 mg N/L qui aurait une influence possible sur les humains, 3,1 à 10 mg N/L qui influencerait les activités humaines, mais n’aurait pas d’impact apparent sur la santé et plus de 10 mg N/L qui aurait des impacts majeurs sur les activités humaines et des effets possibles sur la santé des enfants en très bas âges (Chaussé et al., 2003).
Malgré ses risques environnementaux, la fertilisation azotée demeure la base de l’agriculture moderne. L’azote est un élément essentiel aux cultures, il est même souvent appelé le «pivot de la fertilisation» du fait qu’il est l’élément nutritif le plus important pour le rendement et la croissance des cultures et qu’il est limitant dans plusieurs écosystèmes naturels et semi-naturels (Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010; Erisman et al., 2013; N’Dayegamiye et al., 2007). Selon des estimations, près de la moitié de la population humaine du 21e siècle dépend de la fertilisation azotée pour se nourrir (Erisman et al., 2008).
Une expérience ayant eu lieu sur deux sites, avec des conditions de sol différentes sous culture de maïs, dans le bassin versant de la Rivière-Aux-Brochets dans le sud du Québec a permis d’évaluer des exportations d’azote total de 189.74 kg ha-1 et 69.53 kg ha-1. De cette quantité, respectivement
7
97.5% et 88.3% de l’azote sous forme de nitrates mesurés provenait du lessivage, ou de l’écoulement souterrain (Gollamudi, 2006).
Une méthode pour réduire le lessivage des nitrates est de synchroniser la fertilisation azotée avec le prélèvement des cultures. Les facteurs environnementaux influençant la dynamique de l’azote dans le sol ainsi que l’absorption par les cultures sont nombreux. Ceux-ci inclus notamment (1) les propriétés physiques du sol, tel que la texture, la profondeur, le drainage et la matière organique du sol (2) les caractéristiques du fertilisant, incluant la quantité, la forme, l’emplacement ainsi que la période d’application, (3) la rotation des cultures et la couverture des plants, (4) la méthode de préparation du sol et les résidus de cultures (5) la température et les précipitations. Les plus importants étant le climat et l’hydrologie (Dupas et al., 2015; Moebius-clune et al., 2007). Une méthode d’obtenir cette synchronisation est de prévoir le prélèvement des cultures et le lessivage à l’aide de la modélisation des facteurs environnementaux.
2.2 Enjeux économiques
Les engrais azotés sont un investissement important pour les entreprises agricoles. Les budgets établis par le CRAAQ (Beauregard et Fortier, 2014) pour le maïs fourrager prévoient un coût de 127$ par hectare en fertilisants minéraux (160-50-140) ce qui correspond à 26% des charges variables et 11% du coût total de production. La fertilisation est la deuxième étape la plus coûteuse après l’achat des semences et avant la récolte avec la fourragère. Les achats d’engrais correspondaient à 9.3% des dépenses des exploitations agricoles en 2009. Au cours de cette même année au Canada, près de 75% des types d’engrais utilisés étaient des engrais azotés (Agriculture and Agri-Food Canada, 2014). Les chercheurs d’une équipe américaine ont noté que dans le cas de la ferme d’un producteur participant à leurs essais, les dépenses reliées à la fertilisation azotée avaient quadruplé depuis l’année 2000 (Van Es et al., 2012). Il est possible d’avancer que les implications monétaires reliées aux pertes de fertilisants azotées n’iront pas en diminuant dans les prochaines années malgré un plafonnement des coûts et même une légère baisse au Canada en 2009 (Agriculture and Agri-Food Canada, 2014). Les pertes de fertilisants azotés dans l’environnement ont donc des implications monétaires substantielles pour les agriculteurs. La gestion précise de l’azote sur les entreprises agricoles pourrait contribuer à soutenir les producteurs tentants d’assurer la rentabilité de leur exploitation tout en permettant de réduire les pertes environnementales d’azote (Moebius-clune et al., 2013; Van Es et al., 2012).
8
2.3 Les outils opérationnels de prévision de la disponibilité de l’azote
Les outils opérationnels de prévision de la disponibilité de l’azote pouvant être utilisés par les producteurs et les professionnels sont très nombreux. La majorité de ceux disponibles en Amérique du Nord sont simples et généraux. Ils sont basés sur des moyennes de réponses empiriques aux nitrates ou sur des potentiels de récolte (Moebius-clune et al., 2007). Au Québec, le principal outil de prévision de la disponibilité de l’azote avant et au cours de la saison de croissance est le calcul du bilan prévisionnel d’azote. Soit le calcul de la dose d’azote recommandée selon la culture à laquelle sont soustraites la contribution de la matière organique et la contribution du précédent cultural (Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010). Cette méthode, appelée méthode du bilan a été développé dans les années 1970, est aussi la méthode la plus utilisée en Europe (Jeuffroy et al., 2013). Elle correspond à estimer la dose d’engrais azotée qui doit être appliquée, d’après la différence entre les besoins d’une culture pour atteindre un rendement donné et la disponibilité de l’azote du sol. Cette méthode ne prend pas en compte le climat et son influence sur les besoins en fertilisation azotée des cultures. De plus, la méthode du bilan est basée sur un objectif de récolte qui peut ne pas être atteint, ce qui cause une surfertilisation et donc une augmentation des pertes dans l’environnement (Jeuffroy et al., 2013; Moebius-clune et al., 2013). La méthode du bilan considère qu’aucun facteur limitant, autre que l’azote, n’influence la culture (Jeuffroy et al., 2013).D’autres tests existent tels que le test de nitrate en pré-semis, utile pour identifier les champs possédant une grande quantité d’azote minéral avant le début de la saison. Le test de nitrate du sol en post-levée du maïs permettant d’ajuster la dose de fertilisant en post-levée et reflétant bien le potentiel de minéralisation du sol. Les lecteurs de chlorophylle et les analyses foliaires permettent aussi d’avoir des mesures bien corrélées avec la teneur en azote. Après la saison, il est possible de déterminer le surplus d’azote par un test sur les tiges de maïs afin de déterminer a posteriori la performance de la fertilisation azotée. Il est aussi possible de faire un suivi de nitrates résiduels après la récolte (Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010). Certains outils et modèles ont été créés en Europe, aux États-Unis et au Québec basés sur ces différents tests tels qu’Héliotest, Jubil, HNTester, MANNER, Farmstar, PNM (precision nitrogen management), Agriflux et plusieurs autres(Chambers et al., 1999; Jeuffroy et al., 2013; Larocque et al., 2002; Sogbedji et al., 2006).
9
2.4 Le cycle de l’azote : Perspective agronomique
Le cycle de l’azote comprend des entrées et des sorties. Pour comprendre la dynamique de l’azote dans une perspective agronomique, il est important de s’attarder aux différents processus de son cycle. Le cycle de l’azote comprend trois principales entrées, les engrais (minéraux ou organiques), la minéralisation de la matière organique du sol et la fixation biologique de l’azote atmosphérique. Il est généralement reconnu que la minéralisation ainsi que le processus de nitrification sont les étapes limitantes du cycle de l’azote (Hodge et al., 2000). Les sorties du bilan correspondent à l’absorption par les plantes, la volatilisation, la dénitrification, le lessivage et l’immobilisation (Yang et al., 2013).
Figure 1: Cycle terrestre de l'azote adapté de Neitsch et al., (2011)
2.4.1 Minéralisation
La minéralisation correspond au recyclage des nutriments dans le système sol-plante par la décomposition des matières organiques du sol par la flore et la faune du sol (Azam et al., 2003; Kende, 2010). La matière organique peut être catégorisé en trois fractions : (1) la matière organique labile, qui est la fraction la plus active, (2) la matière organique lentement minéralisable et finalement, (3) la fraction stable très difficilement minéralisable (Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010). La minéralisation de l’azote de la matière organique se
10
déroule principalement en deux phases, la première est une minéralisation intense de la fraction labile active qui est rapide et dure environ 60 jours. La deuxième est une phase plus lente de décomposition de la fraction lentement minéralisable (N’Dayegamiye et al., 2007). Au Québec, sous de bonnes conditions climatiques et édaphiques, le sol peut fournir plus du deux tiers des besoins des cultures en azote(N’Dayegamiye et al., 2007). Par contre, les sols à faible potentiel de minéralisation comme les sols compactés ou les sols peu fertiles peuvent fournir moins d’un tiers des besoins en azote de la culture, ce qui se situe entre 60 et 400 kg N ha-1 (N’Dayegamiye et al., 2007). La quantité d’azote
minéralisée et l’intensité de la minéralisation dépend de plusieurs facteurs tels que le rapport carbone/azote, les résidus organiques, la teneur en eau, la température, la texture et la structure du sol, la porosité, le pH, la salinité, le travail du sol et la rotation des cultures (Chambenoit, 2002; Kende, 2010; N’Dayegamiye et al., 2007).
2.4.2 Prélèvement par les plantes
L’absorption par la culture est l’une des principales sorties d’azote dans le calcul du bilan d’azote et elle correspond à la quantité d’azote présente dans la biomasse fraîche (Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010). Il a été établi qu’il y aurait un ajustement réciproque entre le prélèvement d’azote et la vitesse de croissance (Lemaire et al., 1984). Les besoins de la plante varient quant à eux selon la culture, le cultivar et le stade de croissance (Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010). L’absorption et l’utilisation de l’azote par les plantes comportent plusieurs étapes, dont le prélèvement, l’assimilation, la translocation, et lorsque la plante est plus âgée le recyclage et la remobilisation (Masclaux-Daubresse et al., 2010). La capacité des plantes à absorber l’azote du sol varie selon le type de sol, l’environnement et l’espèce (Masclaux-Daubresse et al., 2010).
2.4.3 Volatilisation
La volatilisation a lieu lorsque l’ammoniac (NH3), un gaz formé lorsque l’ammonium est mis en
solution, s’échappe en partie de la solution du sol (Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010). La volatilisation dépend de la concentration en ammonium dans la solution, l’alcalinité et la température. Selon les circonstances, les pertes de NH3
peuvent être minimes ou elles peuvent représenter la plus grande part de l’azote appliqué, particulièrement si elle est appliquée sous forme d’urée ou d’urine (Freney et al., 1983). Sous certaines conditions la favorisant, la volatilisation peut atteindre 75% de l’azote total appliqué (Centre
11
de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010). La méthode d’application a aussi un impact significatif sur la volatilisation de l’ammoniac (Rochette et al., 2009).
2.4.4 Dénitrification
Le processus de dénitrification correspond à la réduction du nitrate (NO3-) en azote moléculaire (N²)
(Firestone et Davidson, 1989; Clark, 2007). Cette réaction a lieu en absence d’oxygène et elle est affectée par la disponibilité de l’oxygène, de l’ammoniac (NH3) et du carbone organique. La
dénitrification est aussi influencée par le taux d’humidité et la température (Aulakh et Rennie, 1987; Maag et Vinther, 1999). La dénitrification peut avoir lieu dans des sols non gorgés d’eau dans des microsites anaérobiques. Ces sites peuvent être des accumulations d’eau, des endroits où la consommation d’oxygène par les microorganismes est très élevée (Aulakh et Rennie, 1987) ou encore dans des zones anaérobiques autour des racines (Firestone et Davidson, 1989).
2.4.5 Immobilisation
L’immobilisation de l’azote est un processus par lequel l’azote minéral, de manière préférentielle l’ammonium NH4+ (Powlson et al., 1986; Recous et al., 1990), est absorbé par les microorganismes
qui le transforme en azote organique (Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010). L’immobilisation de l’azote provenant de fertilisant peut être rapide et avoir lieu à l’échelle de quelques semaines. L’azote contenu par les microorganismes sera reminéralisé par la suite au cours de la saison de croissance ou à plus long terme (Cameron et al., 2013; Sørensen et al., 1994). Des expériences à long terme, effectué sur le site de Rothamsted, soutiennent l’hypothèse d’une faible rétention des fertilisants azotés. Les chercheurs ont mesurés des rétentions de 3% dans des dispositifs expérimentaux datant de 1843 (Powlson et al., 1986).
2.4.6 Lessivage
Le lessivage correspond à la perte des nitrates qui s’infiltrent dans les profils de sols emportés par l’eau des pluies. L’azote voyage en majeure partie sous forme dissoute dans l’eau jusqu’aux nappes souterraines puis vers le cours d’eau (Billen et al., 2013). Les propriétés intrinsèques de l’azote font que le lessivage a un impact plus important que le ruissellement (Berrouard et al., 2001; Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010). La charge de nitrate lessivé ainsi que la concentration en NO3- des eaux de drainage dépend principalement de deux facteurs : la
quantité de nitrate dans les sols et la quantité d’eau drainée (Berrouard et al., 2001; Cameron et al., 2013; Gasser et al., 2003). La quantité totale de pluie et l’intensité des événements pluvieux sont des facteurs importants modulant les pertes de nitrate, car l’eau des précipitations est le principal moyen
12
transport des nitrates. C’est pour cette raison que l’automne, au Québec, est une période sensible pour les pertes de nitrates puisque le sol est à nu (Berrouard et al., 2001). Le lessivage des nitrates est aussi influencé par la structure et la texture du sol. En effet, le lessivage est plus important dans les sables peu structurés que dans les argiles, principalement à cause de la diminution du mouvement d’eau et du plus grand potentiel de dénitrification dans les sols argileux (Cameron et al., 2013). Une expérience ayant eu lieu sur deux sites du bassin versant de la Rivière-aux-brochets dans le sud du Québec a évalué des exportations d’azote totales de 189.74 kg ha-1 et 69.53 kg ha-1. De cette
quantité, 97.5% et 88.3% de l’azote, sous forme de nitrate, provenait du lessivage, ou de l’écoulement souterrain. Ces deux sites sont respectivement un loam sableux Rubicon et principalement une argile Sainte-Rosalie sous culture de maïs (Gollamudi, 2006).
Le cycle de l’azote est donc dépendant de conditions locales et saisonnières qui vont varier selon les années. Il est donc très difficile d’appliquer une fertilisation azotée de précision. Pour le faire, il faudrait être capable de prédire tous les processus du cycle de l’azote, tout au long de la saison de croissance, afin d’appliquer les bonnes doses de fertilisants en pré-semis ou en post-levé.
2.5 Modélisation
Un modèle est une façon de représenter ou de prévoir une situation ou un processus de manière mathématique ou graphique en se basant sur des données, sur des processus physiques ou sur un mélange des deux. Les modèles sont utilisés régulièrement en hydrologie depuis longtemps. D’après un historique de la modélisation hydrologique effectué par Ezio Todini de l’université de Bologne en Italie, cette discipline a débuté en 1850 par la méthode rationnelle de Mulvany. Par la suite, la modélisation s’est développée, au cours du siècle, en deux types de modèles, soit les modèles déterministes, basés sur les processus physiques et les modèles empiriques, input-output, dirigés par les données (Todini, 2007).
2.6 Le choix des modèles pour l’étude
Les modèles existants étant nombreux, il faut savoir choisir le modèle approprié. Xu (2002) a suggéré quatre aspects à considérer lors du choix d’un modèle, soit : (1) la nature des processus physiques impliqués, (2) l’utilisation qui sera faite du modèle, (3) les données disponibles et (4) la manière dont seront utilisés les résultats du modèle. D’autres aspects sont aussi à considérer tels que la qualité des résultats obtenus par les modèles dans la région concernée. Dans le cadre de cette étude, le modèle utilisé sera HYDRUS (Šimůnek et al., 2008). HYDRUS est un modèle largement utilisé entre autres
13
dans l’étude des transport de solutés. Les données de caractérisation physique doivent être exhaustives pour utiliser HYDRUS avec précision.
2.7 HYDRUS
HYDRUS est un logiciel de modélisation permettant la simulation des transports de l’eau, de la chaleur et des solutés dans le milieu poreux en une, deux et trois dimensions (“PC-PROGRESS - Programs,” 2015). HYDRUS est un modèle basé sur les processus physiques qui utilise l’équation de Richards (Richards, 1931) pour les mouvements d’eau dans les milieux poreux et l’équation d’advection-dispersion pour le transport des solutés. L’utilisation de ces équations implique que le modèle a besoin de certaines données de base telles que les courbes de rétention en eau du sol, la conductivité hydraulique ainsi que les conditions initiales de pression d’eau et les flux d’eau ou le contenu en eau aux limites (Shein, 2015).
HYDRUS tel qu’il est disponible aujourd’hui est le résultat de nombreuses années d’amélioration. En 1998, HYDRUS 1-D basé sur Windows a été publié, les modèles précédents étaient des modèles DOS. Le développement d’HYDRUS basé sur Windows est considéré comme une étape importante dans le développement de modèles de mouvement de l’eau et des solutés dans les sols basés sur les processus physiques (Shein, 2015). Le code d’HYDRUS inclut et combine les processus et les procédures numériques de ses nombreux prédécesseurs, soit UNSAT, SWMII, SWMS_2D (Šimůnek et al., 2008). En 1995, la création de l’interface graphique des utilisateurs (GUI’s, graphical user interface) débute, elle sera incluse dans les versions subséquentes (Šimůnek et al., 2008). En 2006 et 2007, HYDRUS offre la possibilité de traiter des situations en deux dimensions puis en trois dimensions.
14
Figure 2: Historique du développement d'HYDRUS et des différents modèles reliés adapté de Simunek et al (2012).
D’après les créateurs du programme, l’intérêt suscité par HYDRUS se reflète dans les nombreux téléchargements du modèle, qui s’élevaient à plus de 1000 en 2006 et 200 en 2007 répartis dans 20 pays. Le site internet d’HYDRUS reçoit aussi en moyenne 700 visites par jour. L’utilisation à grande échelle de leur programme serait due en partie à l’interface graphique qui en facilite l’utilisation (Šimůnek et al., 2008). En 2016, 71 articles publiés ont utilisé HYDRUS 1-D dans leur recherche et 32 articles publiés ont utilisé HYDRUS 2-D ou 3-D.
2.8 Modélisation de l’azote dans HYDRUS
Le transport de l’azote, tout comme le transport d’autres solutés, est prédit par HYDRUS au moyen de la résolution de l’équation d’advection-dispersion. Cette équation inclut le flux de transport dans les macropores, la dispersion dans les micropores, un facteur retard et l’équation de conservation du soluté (Radcliffe et Šimůnek, 2010). Les paramètres de transport permettent d’ajuster la dispersion du flux du soluté selon ses caractéristiques ou les conditions du milieu. Des coefficients et plusieurs solutés peuvent être utilisés avec cette équation pour prendre en compte les différents processus du cycle de l’azote. Avec HYDRUS, pour prendre en compte le cycle de l’azote, plusieurs solutés et plusieurs constantes représentant les taux de dégradation doivent être utilisés. Pour chacun des solutés, les isothermes d’adsorptions prendront en compte l’adsorption aux particules de sols. La
15
solution de l’équation de transport advectif-dispersif est fonction de la dimensionnalité, des conditions initiales et des conditions aux limites (Radcliffe et Šimůnek, 2010).
Les valeurs des coefficients de dispersion et de diffusion dans l’eau et dans l’air doivent être fournies au modèle. Ces valeurs, comme les valeurs constantes de réaction, peuvent être trouvées dans la littérature ou optimisées par le modèle à partir des données mesurées. Le prélèvement de l’azote par les plantes et le prélèvement d’eau sont décrits par le modèle de Feddes (Feddes et al., 1978).
2.9 Équation empirique de libération du nitrate
La disponibilité du nitrate, pour le prélèvement par les plantes et pour le lessivage, est une donnée primordiale à une approche prévisionnelle de la fertilisation. En grande culture, l’azote peut provenir de la fertilisation minérale, de la fertilisation organique et de la minéralisation de l’azote organique du sol. Le nitrate est régulièrement considéré comme étant totalement dissout dans l’eau instantanément après l’application de fertilisant (Gasser et al., 2003; Hanson et al., 2006). Par contre, l’ammonium (contenu dans les engrais minéraux et organique) et l’azote organique (contenu dans les fertilisants organiques et dans la matière organique du sol) ne deviendront pas disponibles suivant le même schéma.
Des chercheurs ont proposé des méthodes pour décrire la transformation de l’ammonium en nitrate d’après des caractéristiques spécifiques du sol (Gasser et al., 2003) ou comme une équation de dégradation de premier ordre (Hanson et al., 2006). La volatilisation de l’ammoniac contenu dans les fertilisants organiques peut être prise en compte par l’utilisation d’un coefficient d’efficacité relié à la méthode d’application et d’incorporation du fertilisant (Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010).
Des équations et des relations empiriques ont été développées afin de décrire l’azote organique potentiellement minéralisable basée sur différentes combinaisons de propriétés agro-climatiques telles que les degrés-jours, le contenu en argile, la température du sol, la teneur en eau, la rotation de culture ou l’évapotranspiration potentielle (Dessureault-Rompré et al., 2015, 2010a; Giroux et Lemieux, 2002).
D’autres relations décrivent l’effet de la température et du contenu en eau du sol sur le taux de transformation et la disponibilité journalière de l’azote organique en nitrate selon les conditions au cours de la saison (Dessureault-Rompré et al., 2010b) ou le nitrate produit par la matière organique du sol relâché au cours de la saison de croissance (Sbih et al., 2003).
L’utilisation de ces équations permet de modéliser avec HYDRUS un seul soluté, le nitrate, permettant de simplifier la modélisation. De plus, elles permettent d’estimer l’apport en nitrate provenant de la minéralisation de la matière organique du sol dans le cadre de la présente étude.
16
2.9.1 Équation de transformation de l’ammonium
La première équation, dans le contexte de l’étude, décrit la disponibilité du nitrate provenant de l’ammonium d’un fertilisant. Elle a été développée d’après des mesures au champ sous culture de pomme de terre au Québec (Gasser et al., 2003).
𝑁𝑓(𝑡) = 𝑁𝐻4𝑓
√2𝜋 × 𝜎𝑡𝑒𝑥𝑝 {−
[ln(𝑡) − 𝜇]²
2𝜎² } (2.1)
Où Nf(t) est la disponibilité du nitrate distribué journalièrement en masse de soluté appliquée (M) par flux d’eau infiltrée (L²), NH4f (kg ha-1) est l’apport d’ammonium du fertilisant, µ (-) et σ (-) sont des
paramètres optimisés spécifiques au site, respectivement 2.66 et 0.76, et t est le temps après l’application de fertilisant en jours.
La deuxième équation utilise un coefficient de 0.2 jour-1. Ce coefficient représente la médiane des
valeurs de nitrification de l’ammonium en nitrate retrouvé dans la littérature par Hanson et al (2006). L’équation 2 représente cette équation distribuée journalièrement.
𝑁𝑓(𝑡) = 0.2 × (𝑁𝐻4𝑓) × 1.25 (1 +(−6.45E−05×𝑇)
4.48 ) (− 1
6.45E−05)
(2.2)
Où NH4f est l’apport d’ammonium du fertilisant (kg ha-1) et T est le temps après l’application du
fertilisant en jours.
2.10 Équation de minéralisation
L’équation de minéralisation permet d’évaluer la quantité potentielle d’azote minéralisé de la matière organique du sol (N0). La minéralisation suit une cinétique de premier ordre, à un taux de minéralisation k (Stanford and Smith, 1972). La quantité d’azote organique du sol contrôle la minéralisation potentielle, comme c’est un processus à ressource limitée. La minéralisation potentielle peut être exprimée par l’équation différentielle 3 (Stanford and Smith, 1972).
𝑑
𝑑𝑡𝑁𝑚𝑖𝑛 = 𝑘[𝑁0 − 𝑁𝑚𝑖𝑛] (2.3)
Où Nmin est la quantité cumulative d’azote minéralisée au temps t et N0 est le contenu du pool d’azote
organique du sol.
Si on assume qu’aucun azote n’a été minéralisé avant le début du processus de minéralisation (i.e. Nmin= 0 à t=0), l’équation 3 peut être simplifiée à l’équation 4 :
17
Où N0 est le pool d’azote organique potentiellement minéralisable du sol, et k est le paramètre qui représente les conditions environnementales influençant le taux de minéralisation.
Pour utiliser l’équation de la minéralisation, le pool d’azote organique potentiellement minéralisable du sol (N0) et le paramètre des conditions environnementales (k) doivent être définis.
2.10.1 Détermination du pool d’azote organique potentiellement minéralisable
La détermination du N0 par la rotation des cultures a été proposée par Giroux et Lemieux (2002). Dans cette étude, quatre systèmes de rotation ont été évalués et le prélèvement d’azote des cultures sans fertilisant azoté a été associé à la fourniture en azote du sol. Le tableau 1 tiré du guide du Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), (2010) montre les valeurs de N0 associées à chaque système de rotation.
Tableau 1 : Teneur et fourniture annuelle moyenne du sol en azote à la suite de différentes rotations
SYSTÈME DE ROTATION N TOTAL DU SOL (kg/ha) N FOURNI PAR LE SOL (kg/ha)
MAÏS ENSILAGE CONTINU 3400 49
MAÏS ENSILAGE-ORGE
(2ANS)-BLÉ 3610 94
MAÏS ENSILAGE-ORGE-PRAIRIE
(2ANS) 4030 116
PRAIRIE (CYCLE DE 4 ANS) 4590 168
Le N0 peut aussi être basé sur des variables agro-climatiques en étant estimé par régression linéaire avec le pool I, le pool d’azote organique facilement minéralisable (Dessureault-Rompré et al., 2015). Le pool I est estimé par régressions multiples à partir de l’évapotranspiration potentielle (PET), les degrés-jours au-dessus de 5°C (GDD>5°C), un paramètre de température du sol (re_temp), le contenu en argile en g kg-1 (Clay) et la température de l’air en degrés Celcius (T,°C) (Dessureault-Rompré et
al., 2010a).
L’équation 5 montre la relation linéaire entre le pool I et N0. 𝑁0 = 1.76 ∗ 𝑃𝑜𝑜𝑙 𝐼 + 65 (2.5)
18
Le tableau 2 tiré de Dessureault-Rompré et al (2010a) montre les variables nécessaires à l’estimation du pool I.
Tableau 2 : Variables nécessaires à l'estimation du pool I tiré de Dessureault-Rompré et al. (2010a).
VARIABLE PARAMÈTRE ESTIMÉ R² PARTIEL R² AJUSTÉ ORDONNÉE À L’ORIGINE 89.6 0.56 PET, MM -0.064 0.25 GDD >5°C -0.051 0.32 RE_TEMP (-) 177 0.48 CLAY, G kg-1 0.031 0.53 T, °C 4.39 0.60
Le calcul du paramètre re_temp est fait en trois étapes. D’abord, la température du sol de surface est estimée d’après la température de l’air avec l’équation 6 (Katterer and Andren, 2009).
𝑇𝑠𝑢𝑟𝑓 = {𝑇𝑎𝑖𝑟[𝑠1+ (1 − 𝑠1)exp (−𝑠2(𝐿𝐴𝐼 − 𝐿𝐴𝐼𝑟𝑒𝑓))]; 𝑇𝑎𝑖𝑟≥ 0} (2.6)
Où Tair est la température de l’air en °Celcius et les valeurs de S1, S2 sont respectivement de 0.95 et
0.40 pour les sols minéraux et le LAIref est fixé à une valeur standart de 3.0. LAI réfère à l’indice de
surface foliaire.
Ensuite, la température du sol est estimée d’après la température du sol de surface avec l’équation 7 (Katterer and Andren, 2009).
19
Où TT-1 est la température du sol le jour précédent, Tsurf est la température du sol de surface, et α, kz
et kLai sont respectivement 0.24, 0.017 et 0.15 pour les sols minéraux. LAIT réfère à l’indice de surface
foliaire au temps T.
Finalement, re_temp est calculé d’après la température du sol avec l’équation 8 (Andrén et al., 2004). 𝑟𝑒_𝑡𝑒𝑚𝑝 =(𝑇𝑠𝑜𝑙−𝑇𝑚𝑖𝑛)²
(30−𝑇𝑚𝑖𝑛)² (2.8)
Où Tsol est la température du sol et Tmin est la limite de température minimale d’activité des organismes
décomposeurs fixés à -3.8°C d’après Katterer et al. (1998).
2.10.2 Taux de libération de l’azote organique du sol
Une fois le N0 déterminé, la minéralisation doit être répartie au long de la saison de croissance. Le k de l’équation de minéralisation (équation 4) sert de taux de relâchement de l’azote organique et représente l’effet des différentes conditions environnementales. Les équations représentant le taux de relâchement donnent le résultat du rapport k/k0 où k0 est un taux de minéralisation de référence à une température de référence identifiée respectivement à 0.014 mg/kg/jr et 25°C (Dessureault-Rompré et al., 2010b).
Dessureault-Rompré et al. (2010b) ont comparé trois équations (Arrhenius, Q10 et Logistique) pouvant estimer k en utilisant un jeu de données comprenant 87 sites. Dans cet article, ils ont aussi testé différents paramètres, libres ou fixes, pour optimiser l’équation logistique. Les chercheurs ont conclu qu’il n’y avait pas de différence significative entre les différentes équations. Ils ont suggéré que l’équation logistique serait la plus appropriée, car elle s’adapte mieux aux conditions de basse et de haute température. Elle est donc plus représentative de la température naturelle où les microorganismes du sol sont actifs. L’équation logistique est basée sur la température du sol (équation 9). L’effet du contenu en eau peut être pris en compte en multipliant le résultat de l’équation logistique par un modificateur de taux calculé à l’aide de la fonction biophysique de l’eau avec l’eau contenue dans les pores du sol (Dessureault-Rompré et al., 2011).
𝑘/𝑘0 = 𝑀
[1+𝐶𝑒−𝑟 (
(𝑇−273.16) (𝑇−273.16))]
(2.9)
Où M, C et r sont des paramètres sans unité ayant des valeurs respectivement de 4.00, 31.30 et 2.45 pour les sols Canadiens, T est la température du sol en Kelvin et t0 est la température de référence (299 K) (Dessureault-Rompré et al., 2010b).
Une autre méthode d’évaluation du taux de relâchement de l’azote organique consiste à effectuer des essais de minéralisation sur des sols en incubation. Sbih et al. (2003) ont mesuré des taux de
20
minéralisation dans des sols provenant de 34 sites situés sur des fermes laitières. Le taux de relâchement (k) peut être obtenu en normalisant les résultats de la distribution des taux de minéralisation mesurés en incubation. L’équation 10 montre le modèle rationnel décrivant le taux de minéralisation avec cette méthode.
𝑘 𝑘0=
5.80𝐸−03+(7.92𝐸−03×𝑡)
1+(−5.74𝐸−02×𝑡)+(1.06𝐸−03×𝑡2) (2.10)
21
Bibliographie
Agriculture and Agri-Food Canada, 2014. Canada: achats de carburant et d’engrais dans les exploitations agricoles [WWW Document]. Agric. Agroaliment. Canada. URL
http://www.agr.gc.ca/fra/industrie-marches-et-commerce/statistiques-et-information-sur-les- marches/par-produit-secteur/cultures/information-commerciale-sur-les-cultures-industrie-canadienne/rapport-sur-les-perspectives-du-marche/canada-achats-de-carburant (accessed 7.25.15).
Allen, R.G., Pereira, L.S., Raes, D., Smith, M., 1998. Crop evapotranspiration: Guidelines for computing crop requirements. Irrig. Drain. Pap. No. 56, FAO 300.
doi:10.1016/j.eja.2010.12.001
Andrén, O., Kätterer, T., Karlsson, T., 2004. ICBM regional model for estimations of dynamics of agricultural soil carbon pools. Nutr. Cycl. Agroecosystems 70, 231–239.
doi:10.1023/B:FRES.0000048471.59164.ff
Arnold, J. ., Srinivasan, R., Muttiah, R. S., & Williams, J. R. (1998). LARGE AREA
HYDROLOGIC MODELING AND ASSESSMENT PART I : MODEL DEVELOPMENT. The American water resources Association American Water Resources Association, 34(1), 73–89. https://doi.org/10.1111/j.1752-1688.1998.tb05961.x
Aulakh, M.S., Rennie, D. a., 1987. Effect of Wheat Straw Incorporation on Denitrification of N Under Anaerobic and Aerobic Conditions. Can. J. Soil Sci. 67, 825–834. doi:10.4141/cjss87-079
Azam, F., Farooq, S., Lodhi, A., 2003. Microbial biomass in agricultural soils - determination synthesis dynamics and role in plant nutrition. Pakistan J. Biol. Sience 6, 629–639.
Baram, S., Couvreur, V., Harter, T., Read, M., Brown, P.H., Kandelous, M., Smart, D.R., Hopmans, J.W., 2016. Estimating Nitrate Leaching to Groundwater from Orchards: Comparing Crop Nitrogen Excess, Deep Vadose Zone Data-Driven Estimates, and HYDRUS Modeling. Vadose Zo. J. 15. doi:10.2136/vzj2016.07.0061
Beauregard, G., & Fortier, E. (2014). Maïs fourrager, Budget à l’hectare. Québec: Centre de référence en agriculture et agroalimentaire du Québec.
Bendschneider, K., Robinson, R.J., 1952. A New Spectrophotometric Method for the Determination of Nitrite in Sea Water. J. Mar. Res. 11, 87–96.
Bergström, L., Johnsson, H., Torstensson, G., 1991. Simulation of soil nitrogen dynamics using the SOILN model. Fertil. Res. 27, 181–188. doi:10.1007/BF01051126
Berrouard, A., Giroux, M., & Blackburn, M. (2001). Effets comparatifs de différentes cultures et modes de fertilisation sur la teneur en nitrates dans les sols en fin de culture et dans les eaux de drainage souterrain. Québec: Institut de recherche et de développement en
agroenvironnement.
Billen, G., Garnier, J., Lassaletta, L., 2013. The nitrogen cascade from agricultural soils to the sea: modelling nitrogen transfers at regional watershed and global scales. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 368, 20130123. doi:10.1098/rstb.2013.0123
Bouyoucos, G.J., 1962. Hydrometer Method Improved for Making Particle Size Analyses of Soils1. Agron. J. 54, 464. doi:10.2134/agronj1962.00021962005400050028x
22
Cameron, K.C., Di, H.J., Moir, J.L., 2013. Nitrogen losses from the soil/plant system: A review. Ann. Appl. Biol. 162, 145–173. doi:10.1111/aab.12014
Castellanos, J.Z., Pratt, P.F., 1981. Mineralization of Manure Nitrogen Correlation with Laboratory Indexes. Soil Sci. Soc. Am. J. 45, 354–357. doi:10.2136/sssaj1981.03615995004500020025x Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), 2010. Guide de
référence en fertilisation, 2e édition. Québec.
Chambenoit, C., 2002. Fertilisation azotée de la pomme de terre: Guide Pratique, Quae. ed.
Chambers, B.J., Lord, E.I., Nicholson, F. a., Smith, K. a., 1999. Predicting nitrogen availability and losses following application of organic manures to arable land: MANNER. Soil Use Manag. 15, 137–143. doi:10.1111/j.1475-2743.1999.tb00079.x
Chaussé, K., Phaneuf, D., Levallois, P., 2003. Fiches synthèses sur l’eau potable et la santé Humaine [WWW Document]. Inst. Natl. santé publique. URL https://www.inspq.qc.ca/eau-potable/nitrates (accessed 7.17.15).
Clark, K., 2007. Transformations de l'azote dans deux sols froids après l'application d'un lisier de porc enrichi en 15 N. University Laval.
Dessureault-Rompré, J., Zebarth, B.J., Burton, D.L., Georgallas, A., 2015. Predicting soil nitrogen supply from soil properties. Can. J. Soil Sci. 95, 63–75. doi:10.4141/cjss-2014-057
Dessureault-Rompré, J., Zebarth, B.J., Burton, D.L., Sharifi, M., Cooper, J., Grant, C. a., Drury, C.F., 2010a. Relationships among Mineralizable Soil Nitrogen, Soil Properties, and Climatic Indices. Soil Sci. Soc. Am. J. 74, 1218. doi:10.2136/sssaj2009.0213
Dessureault-Rompré, J., Zebarth, B.J., Georgallas, A., Burton, D.L., Grant, C.A., 2011. A
biophysical water function to predict the response of soil nitrogen mineralization to soil water content. Geoderma 167–168, 214–227. doi:10.1016/j.geoderma.2011.10.005
Dessureault-Rompré, J., Zebarth, B.J., Georgallas, A., Burton, D.L., Grant, C.A., Drury, C.F., 2010b. Temperature dependence of soil nitrogen mineralization rate: Comparison of
mathematical models, reference temperatures and origin of the soils. Geoderma 157, 97–108. doi:10.1016/j.geoderma.2010.04.001
Doherty, J., 2002. Model-Independent Parameter Estimation. Watermark Numer. Comput. 2005, 279.
Dupas, R., Delmas, M., Dorioz, J.-M., Garnier, J., Moatar, F., Gascuel-Odoux, C., 2015. Assessing the impact of agricultural pressures on N and P loads and eutrophication risk. Ecol. Indic. 48, 396–407. doi:10.1016/j.ecolind.2014.08.007
Dupuy, A., Banton, R., Moumtaz O, 2012. Contamination nitratée des eaux souterraines d’un bassin versant agricole hétérogène. Rev. des Sci. l’eau 10, 185–198.
Erisman, J.W., Galloway, J.N., Seitzinger, S., Bleeker, A., Dise, N.B., Petrescu, a M.R., Leach, A.M., de Vries, W., 2013. Consequences of human modification of the global nitrogen cycle. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 368, 20130116. doi:10.1098/rstb.2013.0116
Erisman, J.W., Sutton, M. a., Galloway, J., Klimont, Z., Winiwarter, W., 2008. How a century of ammonia synthesis changed the world. Nat. Geosci. 1. doi:10.1038/ngeo325
FAO water development and management unit, 2015. Crop Water Information : Wheat [WWW Document]. URL http://www.fao.org/nr/water/cropinfo_wheat.html (accessed 8.8.16).
23
Feddes, R.A., Kowalik, P.J., Zaradny, H., 1978. Simulation of field water use and crop yield. Wagenigen : Pudoc, New York, NY.
Firestone, M.K., Davidson, E.A., 1989. Microbiological basis of NO and N2O production and consumption in soil, in: Andreae, M.O., Schimel, D.S. (Eds.), Exchange of Trace Gases Between Terrestrial Ecosystems and the Atmosphere. Department of Plant and Soil Biology, University of California, pp. 7–21.
Fowler, D., Pyle, J. a, Raven, J. a, Sutton, M. a, 2013. The global nitrogen cycle in the twenty-first century : introduction The global nitrogen cycle in the twenty- first century : introduction. Philos. Trans. R. Soc. Ser. B, Biol. Sci. 368, 2013–2015.
Freney, J.R., Simpson, J.R., Denmead, O.T., 1983. Volatilization of ammonia, in: Gaseous Loss of Nitrogen from Plant-Soil Systems. Springer Netherlands, pp. 1–32.
Gasser, M.O., Caron, J., Lagacé, R., Laverdière, M.R., 2003. Predicting nitrate leaching under potato crops using transfer functions. J. Environ. Qual. 32, 1464–1473.
doi:10.2134/jeq2003.1464
Giroux, M., & Lemieux, M. (2002). Comparaison de différentes méthodes d ’ évaluation de la fertilité azotée des sols et détermination de la dose N optimale du maïs ensilage.
Agrosolutions, 17(1), 39–50.
Gollamudi, A., 2006. Hydrological and water Quality modeling of agricultural fields in Quebec. McGill University, Montreal.
Grossman, R.B., Reinsch, T.G., 2002. The solid phase. Bulk density and linear extensibility, in: Dane, J.H., Topp, G.C. (Eds.), Methods of Soil Analysis. Part 4.- Physical Methods. Soil Science Society of America, Inc., Madison, WI., pp. 201–228.
Hanson, B.R., Šimůnek, J., Hopmans, J.W., 2006. Evaluation of urea-ammonium-nitrate fertigation with drip irrigation using numerical modeling. Agric. Water Manag. 86, 102–113.
doi:10.1016/j.agwat.2006.06.013
Hébert, S., 2012. Portrait de la qualité des eaux de surface au Québec 1998-2008 [WWW Document]. MDDELCC. URL http://www.mddelcc.gouv.qc.ca/eau/portrait/eaux-surface1999-2008/index.htm (accessed 7.17.15).
Hodge, A., Robinson, D., Fitter, A., 2000. Are microorganisms more effective than plants at competing for nitrogen? Trends Plant Sci. 5, 304–308. doi:10.1016/S1360-1385(00)01656-3 Hutson, J.L., Wagenet, R.J., 1991. Simulating nitrogen dynamics in soils using a deterministic
model. Soil Use Manag. 7, 74–78.
Jeuffroy, M., Gate, P., Machet, J., Recous, S., 2013. Gestion de l’azote en grandes cutlures : les connaissances et outils disponibles permettent-ils de concilier exigences agronomiques et environnementales ? Cah. Agric. 22, 249–257. doi:10.1684/agr.2013.0639
Katterer, T., Andren, O., 2009. Predicting daily soil temperature profiles in arable soils in cold temperate regions from air temperature and leaf area index. Acta Agric. Scand. Sect. B-Soil Plant Sci. 59, 77–86. doi:10.1080/09064710801920321
Katterer, T., Reichstein, M., Andren, O., Lomander, A., 1998. Temperature dependence of organic matter decomposition: A critical review using literature data analyzed with different models. Biol. Fertil. Soils 27, 258–262. doi:10.1007/s003740050430
24
Kende, S., 2010. Minéralisation de l’azote dans deux sols amendés avec deux composts enrichis d’un antibiotique. Université Laval.
Kirkby, C.A., Kirkegaard, J.A., Richardson, A.E., Wade, L.J., Blanchard, C., Batten, G., 2011. Stable soil organic matter: A comparison of C:N:P:S ratios in Australian and other world soils. Geoderma 163, 197–208. doi:10.1016/j.geoderma.2011.04.010
Larocque, M., Banton, O., Gagnon, J., Camiré, C., 2002. Using Models to Manage Soil Inorganic Nitrogen in Forest Tree Nurseries. Soil Sci. Soc. Am. J. 66, 602. doi:10.2136/sssaj2002.0602 Lemaire, G., Salette, J., Sigogne, M., Terrasson, J., 1984. Relation entre dynamique de croissance et
dynamique de prélèvement d’azote pour un peuplement de graminées fourragères. I.-Étude de l’effet du milieu. Agronomie 4, 423–430.
Li, Y., Šimůnek, J., Zhang, Z., Jing, L., Ni, L., 2015. Evaluation of nitrogen balance in a direct-seeded-rice field experiment using Hydrus-1D. Agric. Water Manag. 148, 213–222. doi:10.1016/j.agwat.2014.10.010
Louks, D.P., Van Beek, E., Stedinger, J.R., Dijkman, J.P.., Villars, M.T., 2005. Water Resources Systems Planning and Management. An Introduction to Methods, Models and Applications, Unesco Publishing.
Maag, M., Vinther, F.P., 1999. Effect of Temperature and Water on Gaseous Emissions from Soils Treated with Animal Slurry. Soil Sci. Soc. Am. J. 63, 858. doi:10.2136/sssaj1999.634858x Margeson, J.H., Suggs, J.C., Midgett, M.R., 1980. Reduction of nitrate to nitrite with cadmium.
Anal. Chem. 52, 1955–1957. doi:10.1021/ac50062a039
Masclaux-Daubresse, C., Daniel-Vedele, F., Dechorgnat, J., Chardon, F., Gaufichon, L., 2010. Nitrogen uptake , assimilation and remobilization in plants : challenges for sustainable and productive agriculture. Ann. Bot. 105, 1141–1157. doi:10.1093/aob/mcq028
MDDELCC, 2014. Rapport sur l’état de l’eau et des écosystème aquatique au Québec [WWW Document]. MDDELCC. URL http://www.mddelcc.gouv.qc.ca/rapportsurleau/Etat-eau-ecosysteme-aquatique-qualite-eau-Effets-sur-vs.htm (accessed 7.17.15).
Ministère du Développement durable, de l’environnement et des parcs. (MDDEP), 2012. Portrait de la qualité des eaux de surface au Québec 1999-2008. Québec. Direction du suivi de l’état de l’environnement. ISBN 978-2-550-63649-6 (PDF), 97 p.
Moebius-Clune, B., Carlson, M., Van Es, H.M., Melkonian, J., 2013. Adapt-N Proves Economic and Environmental Benefits in Two Years of Strip-Trial Testing in New York and Iowa. Moebius-Clune, B., Van Es, H.M., Melkonian, J., 2007. Adapt-N Uses Models and Weather Data to
Improve Nitrogen Management for Corn. Better Crops with Plant Food 97(4): 7-9 Molnar, G.S., Viraraghavan, T., 1990. Modelling of Nitrate Movement in Groundwater: a Case
Study. Can. Water Resour. J. 15, 12–23. doi:10.4296/cwrj1501012
N’Dayegamiye, A., Giroux, M., Gasser, M.O., 2007. La contribution en azote du sol reliée à la minéralisation de la MO : facteur climatique et régies agricoles influençant les taux de minéralisation d ’ azote, Colloque sur l’azote, CRAAQ-OAQ.
Neitsch, S.., Arnold, J.., Kiniry, J.., Williams, J.., 2011. Soil & Water Assessment Tool Theoretical Documentation Version 2009 1–647.