HAL Id: hal-02806258
https://hal.inrae.fr/hal-02806258
Submitted on 6 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Rôle de l’azote du sol dans l’établissement du rapport de
dominance entre le jeune chêne sessile (Quercus petraea
(Matt.) Liebl.) et la molinie (Molinia caerulea (L.)
Moench) suite à une éclaircie
Ludivine Guinard
To cite this version:
Ludivine Guinard. Rôle de l’azote du sol dans l’établissement du rapport de dominance entre le jeune chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia caerulea (L.) Moench) suite à une éclaircie. [Stage] Université Blaise Pascal (Clermont Ferrand 2) (UBP), FRA. 2011, 17 p. + annexes. �hal-02806258�
UFR Sciences et Technologies
Master Biologie et Environnement
Spécialité professionnelle : Enseignement des Sciences de la Vie et de la Terre
Rapport de stage de Master 1
soutenu le 26 Août 2011 par Ludivine GUINARD
Rôle de l’azote du sol dans l’établissement du rapport de dominance entre
le jeune chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia
caerulea (L.) Moench) suite à une éclaircie
Membres du jury : Monsieur Rémi Cadet (MCU) Monsieur Stéphane Herbette (MCU) Madame Catherine Lenne (MCU)
Institut National de la Recherche Agronomique Centre INRA de Clermont-Ferrand - Theix
Unité Mixte de Recherche Physique et Physiologie Intégrée de l'Arbre Fruitier et Forestier (UMR PIAF, Inra-Université Blaise Pascal, Clermont-Ferrand)
INRA Site de Crouël Université Blaise Pascal
234, avenue du Brézet Les Cézeaux, 24 avenue des Landais
63100 Clermont-Ferrand 63177 Aubière
Tel : 04 73 62 43 73 Tel : 04 73 40 79 09 Fax : 04 73 62 44 54 Fax : 04 73 40 79 51
Maître de stage : Philippe Malagoli, Maître de Conférences (UBP)
Je tiens à remercier tout particulièrement pour l’expérience enrichissante et pleine d’intérêt Monsieur Philippe Malagoli pour son accueil, son encadrement et ses conseils.
Je tiens à remercier Monsieur Marc Vandame pour son aide, ses conseils et sa disponibilité lors des mesures de photosynthèse avec le LI-6400, Li-Cor, Lincoln, NE et lors des broyages ainsi que Monsieur Philippe Balandier pour ses conseils et sa sympathie.
Je remercie également l’ensemble de l’équipe du PIAF pour son accueil et sa sympathie. Je remercie plus spécifiquement Madame Aline Faure, Monsieur Patrice Chaleil, Monsieur André Marquier et Monsieur Stéphane Ploquin pour leur aide précieuse lors de la récolte des racines mais également Madame Brigitte Saint-Joanis pour son aide lors des broyages ainsi que pour sa sympathie. Je remercie aussi Monsieur Nobert Frizot pour son aide concernant les questions et les petits déboires informatiques, et Madame Dominique Tiziani pour son aide chaleureuse lors des recherches bibliographiques et de l’impression de ce rapport.
TABLE DES MATIERES REMERCIEMENTS
LISTE DES ILLUSTRATIONS LISTE DES ABREVIATIONS
I - INTRODUCTION ...1
A - La structure d’accueil ...1
B - Contexte général ...1
C - Contexte scientifique ...3
1 - Présentation botanique et aires de répartition du chêne sessile (Quercus petraea (Matt.) Liebl.) et de la molinie bleue (Molinia caerulea (L.) Moench) ...3
a - Le Chêne sessile : Quercus petraea (Matt.) Liebl. ...3
b - La molinie bleue : Molinia caerulea (L.) Moench ...3
c - Interaction plantes ligneuses-plantes herbacées ...3
2 - Compétition pour l’accès aux ressources à l’échelle du couvert ...4
a - Rayonnement solaire incident ...4
b - Ressources du sol ...5
C - Problématique et objectif du stage ...6
II - MATERIEL & METHODES ...7
A - Mise en place du dispositif et conditions de culture ...7
B - Apport de l’azote marqué ...7
C - Mesure de la photosynthèse ...8
D - Récolte ...8
E - Analyses et dosage 14N/15N ...9
F- Calculs ...9
1 - Paramétrage de la courbe de réponse de la photosynthèse au PAR ...9
2 - Calcul de la quantité d’azote total et de 15N dans la plante ...9
III - RESULTATS & DISCUSSION ... 10
A - Croissance du chêne et de la molinie ... 10
B - Statut azoté chez le chêne et la molinie et allocation de l’azote in planta ... 12
1 - Statut azoté du chêne et de la molinie ... 12
2 - Partage de l’azote total entre le chêne et la molinie et distribution in planta ... 12
3 - Partage de l’azote absorbé entre le chêne et la molinie et allocation in planta ... 13
C - Capacités photosynthétiques chez le chêne et la molinie... 14
IV - CONCLUSIONS & PERSPECTIVES ... 15
V - REFLEXIONS PERSONNELLES ... 17 REFERENCES BIBLIOGRAPHIQUES
ANNEXES
LISTE DES ILLUSTRATIONS Figure 1 : Volume sur pied de la forêt française : 2.4 milliards de m3
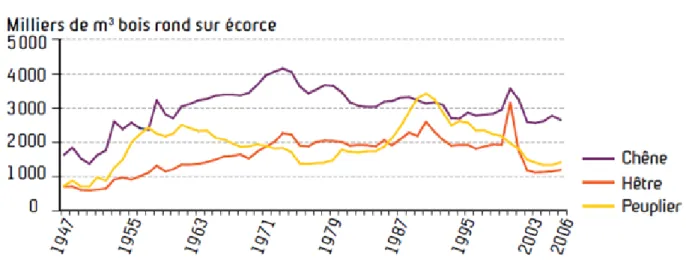
Figure 2 : Evolution de la récolte de bois d’œuvre des principales essences feuillues
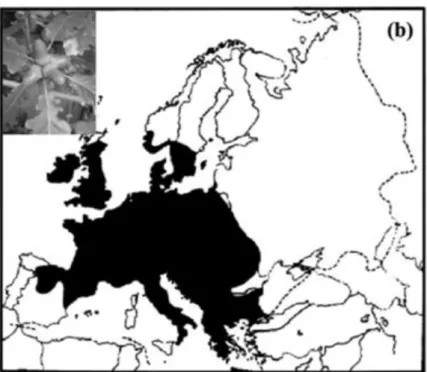
Figure 3 : Aire de distribution du Chêne sessile (Quercus petraea (Matt.) Liebl.) d’après Petit
et al., 2004.
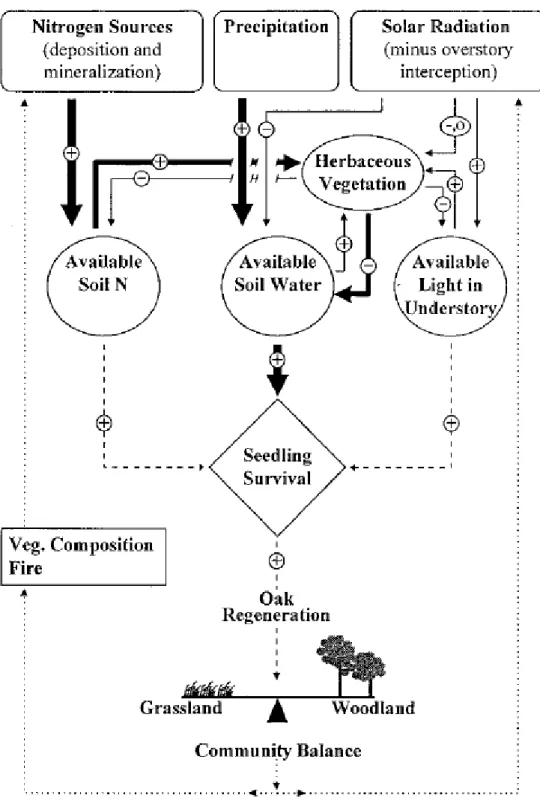
Figure 4 : Modèle représentant l’effet de l’azote, de l’eau et de la lumière sur l’établissement du chêne (Davis et al., 1999)
Figure 5 : Synoptique des interactions possibles entre la structure, le fonctionnement du couvert végétal, la distribution des ressources et l’effet de l’éclaircie sur ces trois compartiments.
Figure 6 : Dispositif expérimental mis en place. C : chêne ; M : molinie ; 15N : pot ayant reçu une solution de K15NO3.
Figure 7 : Photographie du système racinaire du chêne sessile (Quercus petraea (Matt.) Liebl.) et de la molinie bleue (Molinia caerulea (L.) Moench) à la récolte, après rinçage. Figure 8 : Courbe théorique de réponse de la photosynthèse aux rayonnements photosynthétiquement actifs.
Figure 9 : Quantité d’azote total (A ; mg. plante-1) et de 15N (B ; mg. plante-1) dans les différents compartiments (feuilles, tiges, racines) chez le chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia caerulea (L.) Moench) quand le chêne est cultivé seul (C+C) ou en association (C+M), avec ou sans ombrière.
Figure 10 : Courbe de réponse de l’assimilation du CO2 (µmoles CO2. m-2. s-1) à une gamme de rayonnements photosynthétiquement actifs (PAR ; µmoles photons. m-2. s-1) chez le chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia caerulea (L.) Moench) quand le chêne (C+C) ou la molinie (M) est cultivé seul ou en association (C+M) avec ou sans ombrière.
Tableau I : Matières sèches (feuilles, tige et racines ; g), hauteurs (cm), diamètres (mm) et teneurs en azote total (% de la matière sèche) chez le chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia caerulea (L.) Moench) quand le chêne est cultivé seul (C+C) ou en association (C+M) avec la molinie pour deux niveaux de rayonnements (avec ou sans ombrière).
Tableau II : Valeurs des paramètres de la courbe de réponse de la photosynthèse au PAR chez le chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia caerulea (L.) Moench) quand le chêne est cultivé seul (C+C) ou en association (C+M) avec la molinie pour deux niveaux de rayonnements (avec ou sans ombrière).
LISTE DES ABREVIATIONS Amax : assimilation nette de la photosynthèse (µmoles C02. m-2. s-1) EA : Environnement et Agronomie
EFPA : Ecologie des forêts, prairies et milieux aquatiques INRA : Institut National de Recherche Agronomique
α: rendement quantique apparent (µmoles CO2. µmole photons-1) MF : matière fraîche (g)
MS : matière sèche (g)
ONF : Office nationale des Forêts PA : partie aérienne
PAR: Photosynthetically Active Radiations (µmoles CO2. m-2. s-1) Rd : respiration (µmoles C02. m-2. s-1)
UMR : Unité Mixte de Recherche vpdL : vapour pressure deficit leaf (kPa)
1
I - INTRODUCTION A - La structure d’accueil
J’ai réalisé mon stage de Master I au sein de l’Unité Mixte de Recherche 547 « Physique et Physiologie Intégratives de l’Arbre Fruitier et Forestier » (PIAF). Cette UMR résulte de l’association de deux établissements : l’Université Blaise Pascal-Clermont 2 et l’INRA (Institut National de la Recherche Agronomique).
L’INRA est un organisme de recherche scientifique publique finalisée. Placé sous la double tutelle du ministère de l'Alimentation, de l’Agriculture et de la Pêche et du ministère de l'Enseignement Supérieur et de la Recherche, il constitue par sa taille (8000 personnes) le premier institut de recherche agronomique en Europe et le 3ème EPST (établissement publique à caractère scientifique et technologique) en France, après le CNRS et l’INSERM. Les missions de l’INRA sont de fournir des connaissances par la recherche et de les valoriser afin de tendre vers une agriculture à la fois durable, économiquement compétitive et capable de produire une alimentation saine et équilibrée. Rattachée aux départements EA (Environnent – Agronomie) et EFPA (Ecosystèmes Forestiers, Prairiaux et Aquatiques) de l’INRA, les recherches menées au sein de l’UMR PIAF visent à mieux comprendre le fonctionnement de l’arbre soumis à des contraintes biotiques et abiotiques en tenant compte des aspects fonctionnels et architecturaux tout au long du cycle annuel des espèces étudiées (Noyer, Pommier, Peuplier, Hévéa, Chêne). Les niveaux d’études s’échelonnent de la molécule au couvert végétal en passant par la cellule et l’organe. L’unité est composée de quatre équipes distinctes : AMi (Architecture et Microclimat), BioDHiv (Biologie Hivernale Des ligneux), HYDRO (Hydraulique et résistance à la sécheresse des arbres) et MECA (contraintes Mécaniques et activité des zones en croissances). J’ai été accueillie par l’équipe AMi qui focalise plus précisément ses recherches sur l’écophysiologie de l’arbre en caractérisant les interactions entre le couvert végétal et sa structure, la conduite de l’arbre et l’environnement microclimatique.
B - Contexte général
Selon l’ONF (Office Nationale des Forêts) et la FAO (Organisation des Nations unies pour l’alimentation et l’agriculture), les forêts recouvrent une superficie d’environ 4 milliards d’hectares équivalent à 30% des terres émergées. Toujours selon l’ONF (guide des chênaies continentales), la France possède un riche patrimoine forestier avec près de 800.000 ha sur lesquels est récolté annuellement plus d’un million de m3
Figure 1 : Volume sur pied de la forêt française : 2.4 milliards de m3 (source : Inventaire forestier national -IFN-)
Figure 2 : Evolution de la récolte de bois d’œuvre des principales essences feuillues (source : Direction Générale des Politiques Agricole, Agroalimentaire et des Territoires –DGPAAT-, Ministère de l’agriculture et de la pêche)
2
houppier1 et affouage2). Ainsi, la filière bois, qui représente 425 000 emplois en France, atteint un chiffre d’affaire de 60 milliards d’euros par an (organisme France Bois Forêt, Les chiffres clés de la forêt privée édition 2008-2009). Plus particulièrement, la sylviculture du chêne de qualité constitue une des principales caractéristiques de la foresterie en France. Ainsi, selon l’ONF, le bois d’œuvre de chêne prélevé dans les forêts domaniales représente 28% du volume sur pied (Figure 1), près de 15% du volume total de bois vendu et 40% de la recette bois totale de l’ONF. Au-delà des quantités prélevées, l’atout du chêne français s’explique par sa qualité et son prix unitaire associé. En effet, le cours du prix du chêne (Annexe n°1) est supérieur à celui des autres bois de feuillus ou de conifères (Coopératives forestières, Forêt Privée Française). Globalement, les gains économiques liés à l’exploitation du chêne résultent, d’une part, de sa qualité et, d’autre part, des volumes récoltés (Figure 2) pour alimenter des marchés spécifiques tels que celui de la tonnellerie pour le vin. Pour ces raisons économiques, une augmentation du prélèvement de chênes en France est préconisée, et ce d’autant plus que le stock annuel ne cesse de croître. Par ailleurs, d’autres considérations en faveur d’une accélération de l’exploitation du chêne sont aussi à évoquer telle que l’utilisation de la biomasse comme une alternative intéressante à « l’après-pétrole » dans laquelle les chênaies pourraient en être un fournisseur non négligeable ou encore une augmentation de la contrainte hydrique (date d’apparition et durée d’installation de la contrainte) liée aux changements climatiques (GIEC, 2007). En effet, face à une offre réduite en eau dans les sols, un prélèvement accru permettrait de réduire la demande en eau pendant les périodes critiques du cycle annuel à l’échelle de la chênaie et ainsi de limiter l’effet délétère de cette contrainte sur la croissance des individus restants. Cependant, ce recours à un retour plus fréquent sur les chênaies doit s’inscrire dans une gestion durable et donc modifier des pratiques forestières afin de préserver, à long terme, le potentiel économique et environnemental des chênaies. En effet, dans le cadre de la limitation de l’émission des gaz à effet de serre, ces dernières sont capables de fixer près de 65 millions de tonnes par an équivalent CO2, représentant plus de 10% des émissions nationales. (ONF – La France face au défi du changement climatique). En outre, les chênaies continentales, le plus grand bassin de production, contribuent à la protection des milieux et des paysages mais aussi au maintien d’une importante biodiversité. Enfin, il est à noter que les chênes sessiles et pédonculés sont des essences emblématiques de la forêt française (Guide des sylvicultures – Chênaies continentales, ONF).
1
Houppier : ensemble des branches formant la cime d’un arbre
2
Figure 3 : Aire de distribution du Chêne sessile (Quercus petraea (Matt.) Liebl.) d’après Petit
3
A la lumière des éléments rappelés ci-dessus, le prélèvement forestier, notamment au niveau des chênaies, sera intensifié dans les années à venir. Dans la perspective d’une gestion forestière durable, la conservation des capacités de régénération des chênes et de ce fait de survie des jeunes plants dans un environnement perturbé suite à des prélèvements plus fréquents est cruciale.
C - Contexte scientifique
1 - Présentation botanique et aires de répartition du chêne sessile (Quercus petraea (Matt.) Liebl.) et de la molinie bleue (Molinia caerulea (L.) Moench)
a - Le Chêne sessile : Quercus petraea (Matt.) Liebl.
Le Chêne sessile, Quercus petraea (Matt.) Liebl., est le chêne, avec le chêne pédonculé, le plus connu et le plus typique des forêts françaises. Il appartient à la famille des Fagacées et est considéré comme une espèce post-pionnière. Il recouvre la majeure partie de l’Europe (Figure 3) et présente une large amplitude écologique ce qui peut faire de lui un bon fournisseur de biomasse. Cependant, cet arbre n’apprécie pas l’ombre du couvert et aime les climats très lumineux. Ainsi, il s’installe en lisière ou en haie au niveau de sols compacts, profonds, frais et humides en dessous de 500 m d’altitude (ONF – Sa majesté le Chêne). b - La molinie bleue : Molinia caerulea (L.) Moench
Cette espèce fait partie de la famille des Poacées. De part sa grande plasticité phénotypique (Taylor et al., 2001), elle colonise une grande diversité de milieux cependant elle affectionne les sites infertiles et humides comme le chêne. Elle est de ce fait présente sur l’intégralité du territoire français. La molinie est qualifiée de plante compétitrice herbacée à croissance rapide et intolérante à l’ombre (Taylor et al., 2001).
c - Interaction plantes ligneuses-plantes herbacées
La présence de plantes herbacées a un effet négatif fort sur la croissance (MS et diamètre) des jeunes plants d’arbres dans des sites ouverts, comme cela a été montré chez des jeunes plants de chêne et de hêtre (Löf, 2000). Cependant, il s’avère aussi que l’intensité de dépression de croissance dépend de l’espèce considérée en raison des nombreuses interactions possibles entre les espèces : (i) l’allélopathie, (ii) l’augmentation de la présence de pathogènes colonisant les herbacées et pouvant endommager les jeunes arbres et (iii) réduction des ressources disponibles (Jarvis, 1964 ; Kozlowski et al., 1991 ; Nambiar et Sands, 1993).
4
Dans notre étude, nous concentrerons sur la compétition pour l’accès aux ressources dans un contexte de modification de la disponibilité des ces dernières suite à une éclaircie dans un couvert mixte (Chêne-Molinie).
2 - Compétition pour l’accès aux ressources à l’échelle du couvert
La concurrence exercée peut s’expliquer, en partie, par la compétition pour l’accès aux ressources du milieu et par des perturbations susceptibles d’en modifier leur intensité. Ainsi Fotelli et al. (2001) ont montré que les implantations végétales successives étaient fortement impactées par une modification de l’environnement lumineux au niveau de trouées et dans des milieux dégagés. L’identification des compétitions pour des ressources-clés est donc primordiale afin de garantir le succès de l’établissement des jeunes plants de chêne lors de la phase de régénération dans les zones de prélèvement. Les principales ressources concernées sont le rayonnement solaire incident, l’eau et l’azote du sol.
a - Rayonnement solaire incident
Dans un couvert forestier fermé, selon Jennings et al. (1999), la lumière est communément considérée comme le principal facteur limitant le développement du couvert végétal. En effet, la quantité de PAR interceptée par les espèces de sous-bois n’est pas très importante. Par exemple, dans une hêtraie, seul 60% de PAR est transmis 20 cm en-dessous de l’apex des arbres (Coll et al., 2003). Aussi, le rayonnement incident transmis ainsi que la température et l’humidité de l’air dans le sous-bois vont dépendre de la structure et de la densité de ce couvert végétal. Par conséquent, la faible transmission de rayonnement par un couvert végétal dense va pénaliser à la fois le développement et la croissance des jeunes arbres et des espèces de sous-bois (Gemmel et al., 1996). Cependant, les travaux de Pages et Michalet (2003) ont montré chez plusieurs espèces forestières (Picea abies, Abies alba, Fagus sylvatica, Acer
pseudoplatanus et Quercus petraea) en présence de molinie que des processus de facilitation
indirecte aboutissaient à un taux amélioré de survie des jeunes plants dans un couvert fermé. L’identification des facteurs limitant n’est donc pas aisée. Dans le cas d’un couvert ouvert, la disponibilité du rayonnement solaire incident n’est plus limitée par la structure du couvert et le poids relatif d’autres variables sur la croissance telle que l’eau et les nutriments du sol augmente.
5 b - Ressources du sol
L’eau du sol
Il est clairement établi que, dans les sites ouverts, une contrainte hydrique apparaît au point de réduire la croissance, voire d’entraîner une mortalité importante lors de la phase de régénération (Kozlowski et Davies, 1975). Cela s’explique, dans un premier temps, par une faible capacité de contact entre les racines et le sol. Par la suite, cela impacte sur la capacité de prélèvement en eau par effet de compétition avec les herbacées (Kolb et Steiner, 1990). En effet, les Poacées, par leur système racinaire dense, réduisent intensément la teneur en eau du sol et par conséquent sa disponibilité pour les jeunes plants d’arbres. Elles sont les végétaux les plus nuisibles à la croissance des jeunes arbres à cause de leur compétitivité pour l’eau et les nutriments (Davies 1987, Frochot et al., 1986). Cependant, l’abondance racinaire diminue fortement avec la profondeur car elles ne colonisent que l’horizon superficiel (0-20cm ; Coll
et al., 2003). Or il est observé que la disponibilité en eau augmente généralement avec la
profondeur (Balandier et al., 2006). Ainsi lors de longues périodes de sécheresses, le profond système racinaire du chêne peut être un moyen de promouvoir la survie de l’espèce. L’eau du sol peut donc être considérée comme une ressource limitante pour le développement et/ou la croissance des jeunes plants de chêne (Löf, 2000). En effet, un manque d’eau affecte l’absorption des nutriments selon Löf et Welander (2004). L’approvisionnement en nutriments au niveau racinaire est limité par le taux d’humidité du sol car celui-ci a une grande influence sur la disponibilité des nutriments et l’absorption de ces derniers par les jeunes plantes (Barber, 1962). La réduction de la disponibilité en eau dans le sol va aussi entraîner une diminution de la mobilité du nitrate et de l’ammonium vers les racines (Löf, 2000). Par ailleurs, il se peut que l’eau ne soit pas en condition limitante mais que la concentration en éléments nutritifs le soit, nuisant ainsi à la survie des semis.
L’eau du sol joue donc un important rôle dans la compétition entre les Poacées et les plants de chêne (Davis et al., 1999) en raison d’une chute du potentiel hydrique du sol par la végétation , même si la teneur en eau (et la concentration en nutriments) montre de larges fluctuations saisonnières.
Azote du sol
L’azote minéral est essentiellement obtenu grâce aux dépôts d’azote atmosphérique et par sa minéralisation dans le sol. Les bactéries et les champignons vont transformer l’azote organique en ammonium (NH4+). Celui-ci va être oxydé en nitrates (NO3-) par des bactéries
Figure 4 : Modèle représentant l’effet de l’azote, de l’eau et de la lumière sur l’établissement du chêne (Davis et al., 1999)
6
chimiotrophes utilisant le CO2 comme source de carbone, ou par des bactéries hétérotrophes se servant de la matière organique comme source de carbone et d’azote (De Boer et al., 2001). Il est à noter que les espèces à feuilles caduques comme le chêne tendent à faciliter la nitrification (Son et al., 1997). En parallèle, la formation de trouée dans les chênaies va favoriser les communautés d’organismes nitrifiants (Zeller et al., 2007). En plus de l’azote minéral, le sol contient une vaste gamme de composés organiques azotés (acides aminés libres, peptides, protéines) qui ne représente qu’une petite fraction de l’azote organique du sol (Yu et al., 2002). Par ailleurs, le changement climatique va jouer sur l’absorption racinaire car elle est étroitement liée à la teneur en eau du sol (Barber 1962). Selon Rennenberg et al. (2009) ce changement climatique devrait induire une réduction de la disponibilité en eau du sol au-delà de la teneur optimale pour la nitrification, ce qui devrait par conséquent diminuer l’ampleur de ce processus dans les écosystèmes forestiers lors de périodes de sécheresse. L’effet de ces dernières sur la minéralisation azotée est aussi plus prononcé lorsque les températures du sol sont élevées. Par ailleurs, les concentrations en oxygène du sol sont affectées lors d’inondations et d’engorgement de ces sols. Une importante concentration en eau dans le sol et une faible disponibilité en oxygène vont modifier la transformation de l’azote et de la matière organique. Les Poacées possèdent un grand nombre de racines fines ayant une forte capacité d’absorption (Laîné et al., 1995). Ainsi, une meilleure exploration racinaire permet un meilleur prélèvement d’azote chez la plante. Cette concurrence herbacée va par conséquent induire un affaiblissement des jeunes arbres concernant leur développement et leur croissance (Löf et al., 2004). Ceci va donc poser problème lors de la phase de régénération des jeunes chênes sessiles au niveau des zones de prélèvements. En résumé, Davis et al (1999) ont élaboré un model décrivant comment l’azote, l’eau et la PAR affectent la régénération du chêne sous nos climats (Figure 4).
C - Problématique et objectif du stage
L’intensification du prélèvement forestier dans les chênaies va aboutir à une modification du microclimat y régnant (températures, rayonnement, humidité). Ainsi, les trouées résultantes vont entrainer une augmentation de la disponibilité des PAR incidents parvenant aux espèces de sous-bois. Les jeunes chênes sessiles, lors de leur phase de régénération, vont entrer en compétition avec ces espèces pour l’accès aux ressources souterraines et aériennes. Au regard de la bibliographie, leur potentiel de croissance en sera limité et leur survie sur le long terme pourra en être affectée. L’identification des facteurs contrôlant la dominance d’un type d’espèce sur l’autre ainsi que l’identification des
Figure 5 : Synoptique des interactions possibles entre la structure, le fonctionnement du couvert végétal, la distribution des ressources et l’effet de l’éclaircie sur ces trois compartiments.
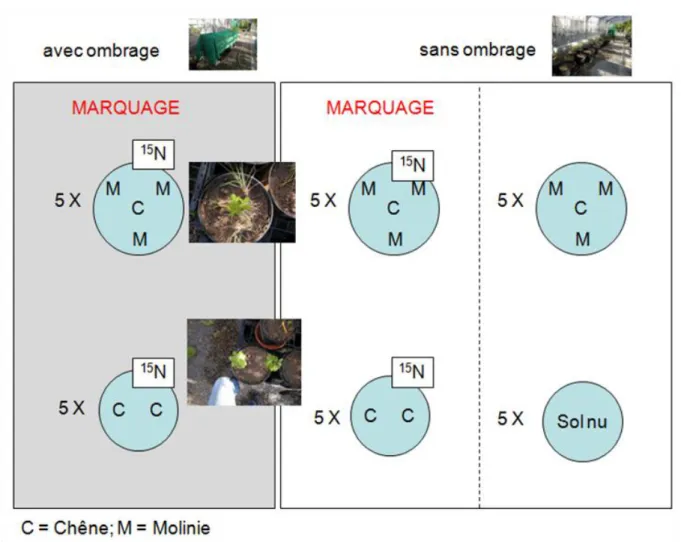
Figure 6: Dispositif expérimental mis en place. C : chêne ; M : molinie ; 15N : pot ayant reçu une solution de K15NO3.
survie
o Réponse des plantes à la disponibilité des ressources o Structure du couvert o Distribution des ressources Eclaircie Développement, croissance aérienne/racinaire
Règles de partage rayonnement, azote et eau
Prélèvement N, surface foliaire, photosynthèse
Etats du milieu et du peuplement
7
interactions entre ces dernières sont capitales pour une amélioration de la gestion des parcelles forestières. La disponibilité en azote, qui représente plus de 80% de l’absorption totale d’ions par les racines des plantes (Marschner 1995), pourrait être une variable-clé dans la mise en place du rapport de dominance lors de cette phase de régénération du chêne. La perturbation de l’absorption pourrait induire une perte de vitalité des arbres affectés (Rennenberg et al., 2009). Ainsi, l’objectif de cette étude est de tester cette hypothèse en s’intéressant à la (i) structure (croissance), (ii) au partage de l’azote entre le chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie bleue (Molinia caerulea (L.) Moench) via l’utilisation de 15N et (iii) au fonctionnement en établissant les courbes de réponse à la lumière (Figure 5).
II - MATERIEL & METHODES A - Mise en place du dispositif et conditions de culture
L’objectif de l’expérimentation est de déterminer si la disponibilité en azote du sol peut piloter l’établissement du rapport de dominance entre le chêne et la molinie, et ce pour deux niveaux de disponibilité en rayonnements. Des plants de chênes et de molinie ont été plantés dans des pots en serre. Les plants de chênes (Quercus petraea (Matt.) Liebl.) âgés de deux ans proviennent d’une pépinière. Les plants de molinie (Molinia caerulea (L.) Moench) ont été prélevés dans la forêt du domaine Saint-Augustin (Annexe n°2) et ramenés au laboratoire le 12 avril 2011. Après avoir été pesées (Annexe n°3), les plantes ont été transplantées dans des pots de 20 L rempli avec du sol de Theix (argilo-limoneux, pH = 6.15 ; Annexe n°4) et réparties de la façon suivante pour deux niveaux de rayonnements différents (Figure 6) :
- Chêne en culture pure : 2 plants par pot (5 répétitions),
- Chêne et molinie en association : 1 plant de chêne et 3 touffes de molinie disposées autour du plant de chêne (5 répétitions)
La mise en place d’une ombrière a entraîné une atténuation de 80% du rayonnement solaire incident au-dessus du couvert. Cinq pots de sol nu sont également mis en lumière naturelle. La température dans la serre est 19,5°C et les valeurs d’humidité relative sont : 33% sous l’ombrière et 24% sans ombrière.
B - Apport de l’azote marqué
Quatre semaines après l’installation du dispositif, 30 mg de 15
Figure 7 : Photographie du système racinaire du chêne sessile (Quercus petraea (Matt.) Liebl.) et de la molinie bleue (Molinia caerulea (L.) Moench) à la récolte, après rinçage.
8 forme d’une solution de K15
NO3 (EI = 99% ; 1 mM) dans chaque pot (Annexe n°5). L’arrosage a été contrôlé de sorte que la quantité d’eau présente dans le pot, équivalente à la capacité de rétention en eau du pot, ne soit pas dépassée. Cela a permis d’éviter à la fois les pertes de 15N par percolation et l’apparition d’une contrainte hydrique. Le traçage de l’azote absorbé via l’utilisation de l’isotope lourd 15N permet de suivre le partage de cet élément à l’échelle du couvert (entre le Chêne et la Molinie) et à l’échelle de la plante entière (allocation entre les différents compartiments du végétal).
C - Mesure de la photosynthèse
Pendant les deux semaines précédant la récolte, les courbes de réponse de la photosynthèse aux rayonnements photosynthétiquement actifs (PAR) ont été établies chez le chêne et la molinie au moyen du LI-COR Portable Photosynthesis System (Annexe n°6). Les mesures ont été effectuées pour des valeurs de PAR s’échelonnant de 1700 à 0 µmol photons m-2 s-1. Pour chaque mesure, la température de la feuille dans la chambre est fixée à 25°C et l’humidité relative est gardée constante (vpdL proche de 1,3).
D - Récolte
Les plantes sont récoltées quatre semaines après l’apport de l’azote marqué. La semaine précédant la récolte, la hauteur et le diamètre des plants de chênes ont été mesurés. Lors de la récolte, les plants de chêne sont séparés en trois compartiments : feuilles, tiges et racines. Pour la molinie, seuls deux compartiments sont récoltés : les feuilles et les racines.
Un effort particulier a été porté à la récupération de l’ensemble du système racinaire de chaque espèce. Deux étapes ont été réalisées. La première étape a consisté à prélever les racines les plus grosses et les plus apparentes. Ensuite, le sol du pot a été tamisé (mailles de 2 mm) à l’aide d’un jet d’eau pour récupérer les racines restantes. Enfin, toutes les racines pour une espèce et un traitement donné ont été lavées afin de retirer le sol adhérent. Dans le cas des couverts mixtes (chêne + molinie), le tri des racines s’est appuyé sur l’architecture et les couleurs contrastées des deux espèces (Annexe n°7). En effet, le système racinaire du chêne est constitué d’une racine pivot et de racines fines, tandis que la molinie possède des racines peu ramifiées en forme de touffe (Figure 7).
A l’issue de la récolte, l’ensemble des échantillons est placé à l’étuve pendant au moins 48h à 60°C avant la détermination de la matière sèche.
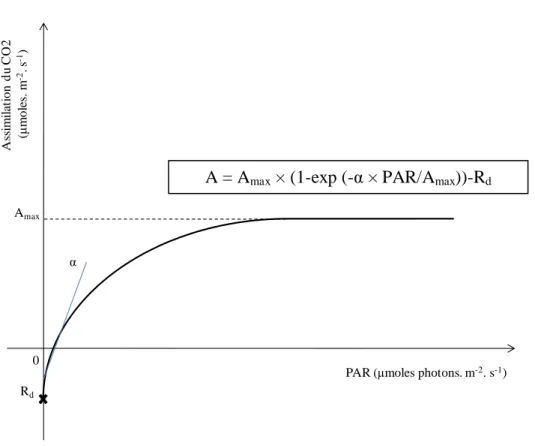
Figure 8 : Courbe théorique de réponse de la photosynthèse aux rayonnements photosynthétiquement actifs. Amax : photosynthèse maximale (µmoles CO2. m-2. s-1) ; α : rendement quantique apparent (µmoles CO2. µmole photons-1) ; Rd : respiration mesurée pour une valeur de rayonnement égale à zéro (µmoles CO2. m-2. s-1).
0
PAR (μmoles photons. m-2. s-1)
A ss im il at ion d u C O 2 (μ m ol es . m -2. s -1) Amax Rd α
9 E - Analyses et dosage 14N/15N
Les échantillons ont ensuite été finement broyés, micropesés et envoyés pour analyse à l’UMR INRA EVA de Caen afin de mesurer les teneurs en azote et en 15
N dans chaque échantillon. Le système utilisé pour les analyses isotopiques comprend un spectromètre de masse (twenty-twenty", Europa Scientific) permettant de mesurer le rapport 15N/14N, couplé à un appareil assurant la production de N2 à partir d'échantillons solides ou liquides (Roboprep CN) (Annexe n°8).
F- Calculs
1 - Paramétrage de la courbe de réponse de la photosynthèse au PAR
L’ajustement d’une équation de type exponentiel rappelée ci-dessous à la courbe de réponse de la photosynthèse au PAR (Figure 8) a permis de déterminer les valeurs de l’assimilation maximale (Amax ; µmoles CO2. m-2. s-1), du rendement quantique apparent (α ; µmoles CO2. µmole photons-1) et de la respiration (Rd ; µmoles CO2. m-2. s-1) chez le chêne et la molinie :
A Amax 1 – e
α PAR
Amax - Rd
Les valeurs des paramètres ont été déterminées selon la méthode des moindres carrés en utilisant le solveur sous Excel (Microsoft). Les valeurs du coefficient de détermination (R2) oscillent entre 0.71 et 0.94.
2 - Calcul de la quantité d’azote total et de 15N dans la plante
Les quantités d’azote total (Ntot, mg) et de 15N (mg) dans chaque échantillon sont calculées de la façon suivante :
Ntot =
%N total MS
100 1000
avec % N total : teneur en azote (% MS) ; MS : matière sèche (g)
15
N = AIéchantillon - AInat N tot
100
avec AIéchantillon (%) : abondance isotopique en 15N de l’échantillon marqué ; AInat (%) : abondance isotopique de l’échantillon non marqué. L’abondance isotopique correspond à la proportion d’azote 15 de la quantité d’azote total présent dans l’échantillon, comme rappelé ci-dessous : AI 15N
10
III - RESULTATS & DISCUSSION
Lors de l’installation du dispositif, les matières fraîches des plants de chênes (issus d’une pépinière) et des plants de molinie (issus du prélèvement en forêt) ont été déterminées afin de sélectionner des plants de MF équivalentes et réduire les écarts de MF pour une même espèce (Annexe n°3). De plus, le statut azoté (teneur en azote total) n’a pas été déterminé. Cependant, il est raisonnable de faire l’hypothèse que le statut azoté des plants de molinie était équivalent entre les plants étant donné qu’ils ont été prélevés simultanément, sur le même site (conditions pédo-climatiques identiques) et au même stade de développement. Enfin, il est à noter que les plants de chêne ne possédaient pas ou peu de feuilles et de racines fines, en raison de leur stade de développement (début de débourrement). Par ailleurs les plants de chêne ont une courte période de choc après le rempotage (Löf, 2000). Par conséquent, les différences de croissance foliaire et racinaire mesurées peuvent être attribuées à l’effet des traitements appliqués.
A - Croissance du chêne et de la molinie
Dans le traitement « avec ombrière » (qui correspondrait à une situation de couvert fermé
au-dessus des plantes en régénération), la présence de la molinie a peu d’effet sur la croissance du chêne (MS du chêne = 8.78±0.87 g et 9.9±1.17 g sans et avec la molinie, respectivement) (Tableau I). En absence et en présence de molinie, les valeurs de ratio PA/PR mettent en évidence une allocation préférentielle de la matière sèche vers les parties aériennes chez le chêne (1.37±0.05 et 1.35±0.05 sans et avec la molinie, respectivement) et vers les parties racinaires chez la molinie (0.22±0.02), suggérant une prospection plus importante du sol par les racines de la molinie. En effet, la MS racinaire de la molinie (27.20±2.59 g) est nettement supérieure à celle du chêne (4.53±1 g), caractérisant une meilleure occupation du sol du pot par la molinie dans nos conditions expérimentales. En revanche, la MS des PA chez les deux espèces est équivalente (5.46 g et 5.89 g chez le chêne et la molinie, respectivement). Cependant, une appréciation visuelle au cours de l’expérimentation montre que les feuilles de chêne sont situées à l’apex et donc au-dessus des feuilles de molinie, rendant ici compte de la différence d’architecture (port droit vs herbacé) des deux espèces. Selon Harmer et Morgan (2007), les jeunes arbres ont une taille plus importante que les herbacées avec lesquelles ils sont en présence. Cependant, les mesures de hauteurs et de diamètres chez le chêne n’ont pas permis de mettre en évidence de différences fortes en fonction de la présence de la molinie (Tableau I) De même, l’allocation de la matière sèche entre les feuilles et les tiges chez le
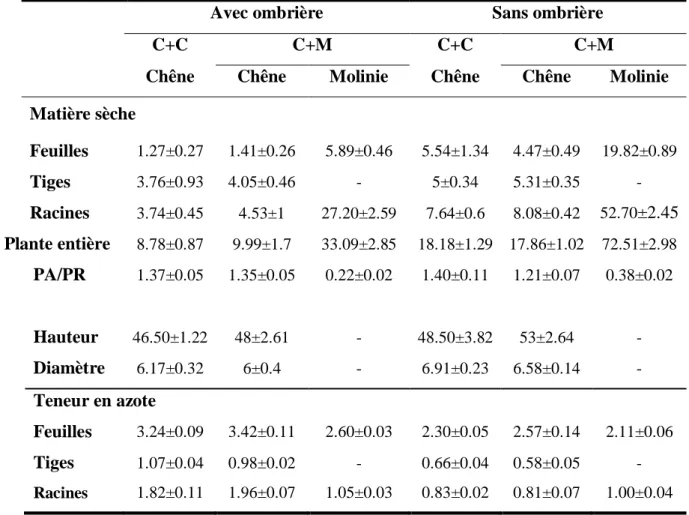
Tableau I : Matières sèches (feuilles, tige et racines ; g), hauteurs (cm), diamètres (mm) et teneurs en azote total (% de la matière sèche) chez le chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia caerulea (L.) Moench) quand le chêne est cultivé seul (C+C) ou en association (C+M) avec la molinie pour deux niveaux de rayonnements (avec ou sans ombrière). PA : parties aériennes ; PR : parties racinaires. Les valeurs représentent la moyenne ± erreur-standard (n=3-10).
Avec ombrière Sans ombrière
C+C C+M C+C C+M
Chêne Chêne Molinie Chêne Chêne Molinie
Matière sèche Feuilles 1.27±0.27 1.41±0.26 5.89±0.46 5.54±1.34 4.47±0.49 19.82±0.89 Tiges 3.76±0.93 4.05±0.46 - 5±0.34 5.31±0.35 - Racines 3.74±0.45 4.53±1 27.20±2.59 7.64±0.6 8.08±0.42 52.70±2.45 Plante entière 8.78±0.87 9.99±1.7 33.09±2.85 18.18±1.29 17.86±1.02 72.51±2.98 PA/PR 1.37±0.05 1.35±0.05 0.22±0.02 1.40±0.11 1.21±0.07 0.38±0.02 Hauteur 46.50±1.22 48±2.61 - 48.50±3.82 53±2.64 - Diamètre 6.17±0.32 6±0.4 - 6.91±0.23 6.58±0.14 - Teneur en azote Feuilles 3.24±0.09 3.42±0.11 2.60±0.03 2.30±0.05 2.57±0.14 2.11±0.06 Tiges 1.07±0.04 0.98±0.02 - 0.66±0.04 0.58±0.05 - Racines 1.82±0.11 1.96±0.07 1.05±0.03 0.83±0.02 0.81±0.07 1.00±0.04
11
chêne n’est pas modifiée par la présence de la molinie (Tableau I). Dans le traitement « sans ombrière » (qui correspondrait à une situation de couvert ouvert suite à une éclaircie), la MS du chêne, en absence (18.18±1.29 g) ou en présence (17.86±1.02 g) de molinie, et celle de la molinie (72.51±2.98 g) sont deux fois supérieures par rapport à celles mesurées avec le traitement « avec ombrière ». A l’instar du traitement « avec ombrière », la présence de la molinie n’a pas d’effet sur la croissance du chêne (Tableau I). En revanche, les valeurs de ratio PA/PR montrent une réduction du ratio chez le chêne en présence de molinie (1.40±0.11 et 1.21±0.07 chez le chêne sans et avec molinie, respectivement). Comparativement au traitement « avec ombrière », le ratio PA/PR est augmenté chez la molinie (Tableau I). Pour le chêne, cette valeur de ratio PA/PR (en présence de la molinie) résulte d’une allocation plus élevée de la MS vers les feuilles plutôt que vers les racines. En effet, les MS des feuilles, de la tige et des racines sont respectivement 3.5, 1.5 et 2.5 fois supérieures dans le traitement « sans ombrière ». Parallèlement, l’augmentation de la MS de la tige est associée à une augmentation de la hauteur de l’arbre, d’autant plus prononcée en présence de molinie (53±2.62 cm vs 48.50±3.82 cm avec et sans molinie, respectivement). Peu de différences sont mesurées après la mesure du diamètre (Tableau I). Chez la molinie, en plus d’une augmentation très importante de la MS racinaire (facteur 2), la MS des PA à la récolte est nettement plus élevée dans le traitement « sans ombrière » (19.82±0.89 g vs 5.89±0.46 g sans et avec ombrière, respectivement).
En conclusion, il ressort que la présence de la molinie impacte peu sur la croissance des plants de chêne, et ce quel que soit le niveau de rayonnement dans nos conditions expérimentales et pendant notre période d’étude. En revanche, il peut aussi être conclu qu’une augmentation de la disponibilité en lumière (traitement « sans ombrière ») entraîne une croissance améliorée de chaque espèce. Plus précisément, les rapports de MS entre parties racinaires et parties aériennes du chêne et de la molinie ne sont pas modifiés. En ce qui concerne la molinie, au-delà d’une croissance accrue des racines, l’ouverture du couvert se traduit par une allocation plus importante de la MS au profit des PA permettant une meilleure captation de la lumière. Selon Coll et al. (2003), la stratégie des herbacées consiste à étendre rapidement de nombreuses racines fines au niveau de l’horizon superficiel. Quant au chêne, l’ouverture du couvert entraîne principalement une croissance plus élevée des racines. En effet, les arbres vont développer des racines moins nombreuses que les Poacées mais plus longues capables d’atteindre des horizons plus profonds (Coll et al., 2003). Les arbres auront
12
une croissance folliaire plus élevée car les jeunes chênes sont considérés comme étant sensibles à l’ombrage (Löf et al., 1998). Par ailleurs, un second « flush » au niveau des parties aériennes a été observé à la mi-juin au niveau des jeunes plants de chêne disposés sans ombrière. En effet, le chêne a le potentiel de produire de multiples « flush » pendant sa période de croissance lorsque les conditions sont favorables (Löf 2000).
B - Statut azoté chez le chêne et la molinie et allocation de l’azote in planta 1 - Statut azoté du chêne et de la molinie
Dans le traitement « avec ombrière », les teneurs en azote dans les compartiments du
chêne sont hétérogènes à la récolte. En effet, les valeurs en ordre décroissant sont 3.24±0.09, 1.82±0.11 et 1.07±0.04% pour les feuilles, les racines et les tiges chez le chêne en absence de molinie. Ces valeurs varient peu en présence de molinie (Tableau I). Les teneurs en azote mesurées dans les feuilles (2.60±0.03%) et les racines (1.05±0.03%) de molinie sont globalement plus faibles que celles mesurées chez le chêne.
Dans le traitement « sans ombrière », les teneurs en azote sont fortement réduites chez
le chêne, en présence ou en absence de molinie (Tableau I). Cette diminution est de l’ordre de 1%, à l’exception des tiges (-0.5% environ). Chez la molinie, seule la teneur en azote des feuilles est réduite (2.11±0.06 % sans ombrière vs 2.60±0.03% avec l’ombrière).
La chute de la teneur en azote dans le traitement « sans ombrière » peut s’expliquer par la modification de deux variables : une réduction du prélèvement en azote du sol et/ou une augmentation de la croissance. Au regard de la conclusion du paragraphe précédent (cf. II.A), la seconde hypothèse peut être avancée. En effet, cet accroissement de MS entraîne une dilution de l’azote présent dans le végétal, ce qui aboutit à une réduction de la teneur en azote. Les données relatives au partage de l’azote total entre les espèces et in planta ainsi que les données isotopiques vont permettre d’apporter des éléments de réponse quant à la première hypothèse.
2 - Partage de l’azote total entre le chêne et la molinie et distribution in planta
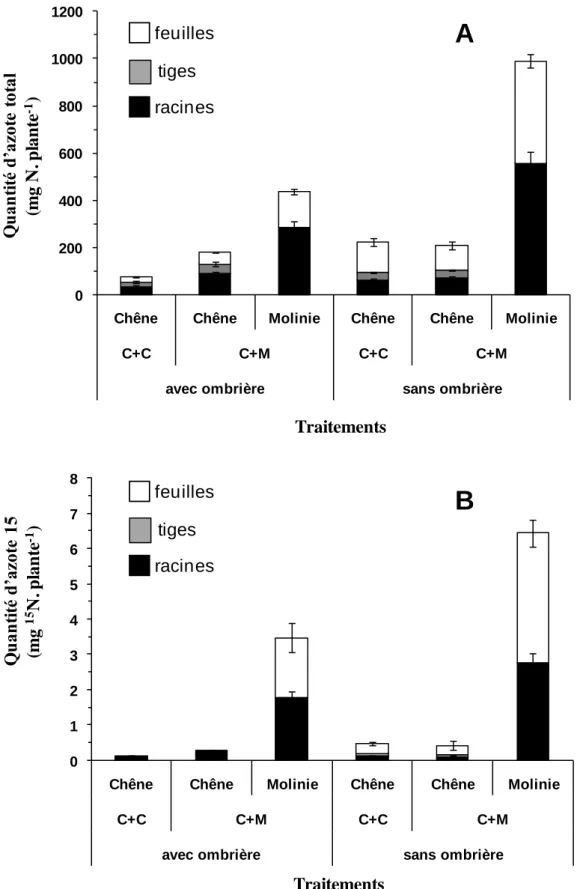
Dans le traitement « avec ombrière », les quantités d’azote total dans le plant de chêne
en absence de molinie est de 75 mg, également réparti entre les racines, les tiges et les feuilles (Figure 9A). En présence de molinie, la quantité d’azote total présent dans le plant de chêne est fortement augmentée (environ 180 mg ; Figure 9A), en raison d’une forte accumulation de l’azote dans les racines (50 % de l’azote total de la plante entière). La quantité d’azote total
Figure 9 : Quantité d’azote total (A ; mg. plante-1) et de 15N (B ; mg. plante-1) dans les différents compartiments (feuilles, tiges, racines) chez le chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia caerulea (L.) Moench) quand le chêne est cultivé seul (C+C) ou en association (C+M), avec ou sans ombrière.
0 200 400 600 800 1000 1200
Chêne Chêne Molinie Chêne Chêne Molinie
C+C C+M C+C C+M
avec ombrière sans ombrière
racines
feuilles tiges 0 1 2 3 4 5 6 7 8Chêne Chêne Molinie Chêne Chêne Molinie
C+C C+M C+C C+M
avec ombrière sans ombrière
racines
feuilles tiges Q u an ti té d ’az ot e tot al (m g N . p lan te -1 ) Q u an ti té d ’az ot e 15 (m g 15 N . p lan te -1) TraitementsA
B
Traitements13
dans les plants de molinie (436 mg) représente 70% de la quantité de l’azote total du couvert. Selon Pages et Michalet (2003), la molinie induit une diminution importante de la disponibilité de l’azote. Or, il représente l’élément nutritif le plus limitant.
Dans le traitement « sans ombrière », les quantités d’azote total dans le chêne et la
molinie à la récolte sont fortement augmentées par rapport à celle mesurées dans le traitement « avec ombrière » : +200%pour le chêne en absence de molinie, +130% pour la molinie (Figure 9A). Pour le chêne en présence de molinie, une augmentation de + 16% est mesurée. A l’échelle de la plante entière, cela se traduit par une augmentation la quantité d’azote total dans les feuilles chez le chêne et dans les racines et, dans une moindre mesure, dans les PA chez la molinie (Figure 9A). En revanche, le partage de l’azote total à l’échelle du couvert est réalisé largement au bénéfice de la molinie (989 mg) qui représente 83 % de l’azote du couvert. Par ailleurs, l’accumulation d’azote total par le chêne n’est pas augmentée en présence de molinie, comme c’était le cas dans le traitement « avec ombrière ».
En conclusion, en faisant l’hypothèse que les statuts azotés initiaux étaient équivalents entre les différents traitements pour une même espèce, ces résultats montrent que (i) une ouverture de couvert entraîne une augmentation du prélèvement azoté, et ce de façon plus prononcée à l’avantage de la molinie dans le cas d’un couvert mixte chêne-molinie, (ii) dans un couvert fermé, le chêne est capable d’augmenter le prélèvement d’azote en présence de molinie.
3 - Partage de l’azote absorbé entre le chêne et la molinie et allocation in planta Globalement, entre 0.4 et 22.8 % de l’azote marqué (15
N) apporté (30 mg ; cf Matériel & méthodes) ont été dosés dans le couvert végétal à l’issue de la période de marquage. Ce taux de recouvrement du 15N dépend du traitement mais d’autres hypothèses peuvent aussi être proposées pour rendre compte de la quantité non recouvrée tel qu’un arrosage insuffisant (diminution de la disponibilité en eau qui entraîne une réduction des flux de convection et donc la mobilité des ions nitrate et ammonium dans le sol ; Barber, 1962) ou au contraire trop important aboutissant à une percolation du 15N. Cependant, il est peu probable que ces deux facteurs de suivi de culture puissent totalement expliquer le taux de recouvrement, parfois très faible (cf. « Matériel & Méthodes »). Par ailleurs, ce faible taux de prélèvement de 15N peut être dû à la compétition entre la plante et les micro-organismes du sol (Rennenberg et al., 2009). Enfin, cela pourrait être dû au fait que la forme azotée ajoutée est indisponible pour le chêne. Une grande partie du prélèvement de l’azote du sol est réalisé
14
grâce à des symbioses mycorhiziennes capables d’absorber préférentiellement des formes organiques d’azote. Or, c’est du K15
NO3 qui a été ajouté dans notre étude Dans les deux traitements, il apparaît que le traceur est massivement capté par la molinie : 92% et 94% de l’azote prélevé par le couvert mixte avec ou sans ombrière, respectivement (Figure 9B), confirmant les résultats obtenus chez le hêtre par Coll et al. (2003).
Dans le traitement « avec ombrière », les quantités de 15N absorbé par le chêne, bien que faibles, sont multipliées par deux en présence de molinie (0.12 mg en absence de molinie
vs 0.29 mg en présence de molinie ; Figure 9B). De plus, les quantités de 15N exportées vers les PA chez le chêne (tiges et feuilles) sont très faibles. A contrario, environ 50% de l’azote absorbé par la molinie est exporté vers les feuilles (Figure 9A).
Dans le traitement « sans ombrière », les quantités absorbées sont de deux à quatre
fois supérieures par rapport à celles mesurées dans le traitement « avec ombrière » (Figure 9B), et ce pour les deux espèces. L’augmentation de prélèvement s’accompagne d’une modification de l’allocation du 15
N au profit des feuilles, aussi bien chez le chêne que chez la molinie (Figure 9B). Selon Coll et al. (2003), la plupart de l’azote 15 des Poacées est alloué aux feuilles.
En conclusion, il apparaît que la molinie, dans nos conditions expérimentales et pendant notre période d’étude, est plus compétitive pour prélever l’azote du sol, cette aptitude étant renforcée lors d’une ouverture du couvert. En ce qui concerne le chêne, les quantités prélevées sont très faibles. Par ailleurs, la présence de la molinie dans un couvert ouvert a peu d’impact sur le prélèvement d’azote (Figure 9A et B) chez le chêne. En revanche, et de façon plus surprenante, il semble que la présence de la molinie dans un couvert fermé aboutisse à une augmentation du prélèvement d’azote du sol par le chêne, résultat déjà suggéré par l’analyse de quantités en azote total et confirmé par l’accumulation du traceur dans le végétal.
C - Capacités photosynthétiques chez le chêne et la molinie
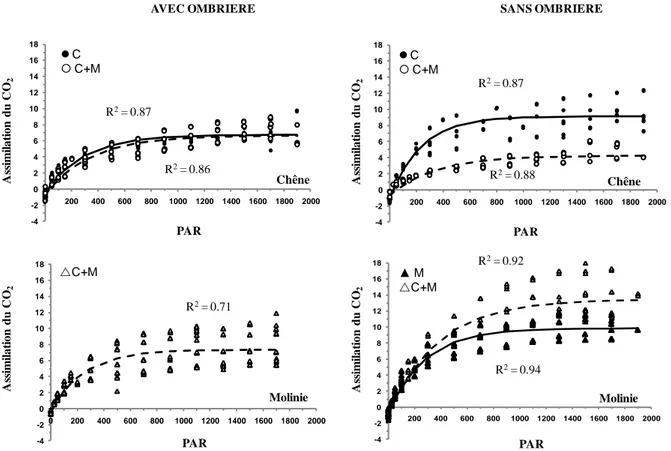
Dans le traitement « avec ombrière », aucune différence n’a été mise en évidence
entre les capacités photosynthétiques des plants de chêne en absence ou en présence de molinie (Figure 10). En effet, les valeurs de Amax (taux de photosynthèse en lumière saturée ou taux maximal d’assimilation) et de α sont environ 7.5 µmoles CO2. m-2. s-1 et 0.025 µmoles CO2. µmole photons-1, respectivement. Par ailleurs, la courbe de réponse de la photosynthèse au PAR établie chez la molinie met en évidence des capacités photosynthétiques légèrement supérieures : Amax = 8.16 µmoles CO2. m-2. s-1 et α 0.035 µmoles CO2. µmole photons-1.
Figure 10 : Courbe de réponse de l’assimilation du CO2 (µmoles CO2. m-2. s-1) à une gamme de rayonnements photosynthétiquement actifs (PAR ; µmoles photons. m-2. s-1) chez le chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia caerulea (L.) Moench) quand le chêne (C+C) ou la molinie (M) est cultivé seul ou en association (C+M) avec ou sans ombrière.
Tableau II : Valeurs des paramètres de la courbe de réponse de la photosynthèse au PAR chez le chêne sessile (Quercus petraea (Matt.) Liebl.) et la molinie (Molinia caerulea (L.) Moench) quand le chêne est cultivé seul (C+C) ou en association (C+M) avec la molinie pour deux niveaux de rayonnements (avec ou sans ombrière). Amax : photosynthèse maximale (µmoles CO2. m-2. s-1) ; α : rendement quantique (µmoles CO2. µmole photons-1) ; Rd : respiration mesurée pour une valeur de rayonnement égale à zéro (µmoles CO2. m-2. s-1). Les valeurs représentent la moyenne ± erreur-standard (n=3-10).
PAR -4 -2 0 2 4 6 8 10 12 14 16 18 0 200 400 600 800 1000 1200 1400 1600 1800 2000 A ss im il at ion d u C O2 Chêne SANS OMBRIERE C C+M R2= 0.87 R2= 0.88 -4 -2 0 2 4 6 8 10 12 14 16 18 0 200 400 600 800 1000 1200 1400 1600 1800 2000 -4 -2 0 2 4 6 8 10 12 14 16 18 0 200 400 600 800 1000 1200 1400 1600 1800 2000 PAR PAR A ss im il at ion d u C O2 A ss im il at ion d u C O2 Molinie Chêne AVEC OMBRIERE C C+M C+M R2= 0.87 R2= 0.86 R2= 0.71 PAR A ss im il at ion d u C O2 Molinie M C+M R2= 0.92 -4 -2 0 2 4 6 8 10 12 14 16 18 0 200 400 600 800 1000 1200 1400 1600 1800 2000 R2= 0.94
Avec ombrière Sans ombrière
C+C C+M C+C C+M
Chêne Chêne Molinie Chêne Chêne Molinie
Amax 7.53±1.06 7.47±0.55 8.16±1.23 9.73±0.84 5.16±0.48 12.62±1.22
α 0.029±0.006 0.022±0.003 0.035±0.004 0.039±0.003 0.014±0.001 0.039±0.004
15
(Figure 10 ; Tableau II). Il ressort que les capacités photosynthétiques sont peu différentes entre les deux espèces. Il peut être intéressant de noter que le Amax varie chez toutes les espèces selon les saisons, les valeurs les plus importantes étant obtenues au printemps et à l’automne. Le α, quant à lui, diminue l’été à cause du stress lié à cette saison (Vaz et al., 2010) mais il augmente avec l’azote (Balandier et al., 2007).
A l’inverse, dans le traitement « sans ombrière », les capacités photosynthétiques chez les plants de chêne en absence de molinie sont nettement supérieures à celle mesurées « avec ombrière » (Amax = 9.73 µmoles CO2. m-2. s-1 et α = 0.039 µmoles CO2. µmole photons-1 ; Figure 10 ; Tableau II). Parallèlement, la courbe de réponse de la photosynthèse au PAR établie chez la molinie en absence de chêne montre un profil équivalent à celui du chêne, décrit ci-dessus (Amax = 10.60 µmoles CO2. m-2. s-1 et α = 0.038 µmoles CO2. µmole photons -1
). La présence de la molinie se traduit par une chute des capacités photosynthétiques chez le chêne (-40% pour le Amax et -67% pour le α par rapport au chêne en absence de molinie) alors que, dans le même temps, une augmentation des capacités de photosynthèse est mesurée chez la molinie (+20 % pour le Amax et peu de variation pour α). Dans le traitement « sans ombrière », les valeurs de Rd sont supérieures à celles mesurées dans le traitement « avec ombrière » (facteur 3), sauf chez le chêne en présence de molinie (Tableau II).
En conclusion, dans des conditions de couvert fermé, la présence de la molinie semble avoir peu d’effet sur la photosynthèse du chêne. En revanche, dans un couvert ouvert, la présence de la molinie est corrélée à une réduction importante des capacités de photosynthèse du chêne. Il peut être intéressant de noter qu’il y a beaucoup de variation de Amax au cours de l’été (Morecroft et al., 2003).
IV - CONCLUSIONS & PERSPECTIVES
L’objectif de cette étude était de mettre en évidence un éventuel rôle de l’azote du sol dans l’établissement du rapport de dominance lors de la régénération du chêne sessile (Quercus petraea (Matt.) Liebl.) en présence de molinie bleue (Molinia caerulea (L.) Moench) suite à une éclaircie.
Dans le cadre expérimental de notre étude (en serre et sur une période de deux mois), il apparaît que la présence de la molinie impacte peu sur la croissance (MS, hauteur, diamètre) du jeune chêne. Nos résultats ne permettent donc pas de mettre en évidence un effet sur la structure lors de la mise en place du peuplement. L’hypothèse de la courte
16
durée de l’expérimentation peut être avancée. En effet, des études précédentes réalisées in situ montrent un effet négatif sur la croissance du chêne en régénération au bout de la deuxième année d’étude (Harmer, 2005, 2007 ; Löf, 2004).
L’utilisation du marqueur 15N et la caractérisation des capacités de photosynthèse foliaire ont clairement montré une modification, dans un laps de temps court, du fonctionnement du couvert végétal. A partir de ces résultats, une ébauche de l’effet de l’ouverture du couvert en lien avec la disponibilité peut être proposée. L’ouverture du couvert entraîne une réduction significative de la photosynthèse chez le chêne et une augmentation concomitante de cette dernière, dans une moindre mesure, chez la molinie. Ce résultat suggère une interaction entre les deux espèces, qui pourrait être due au partage de l’azote du sol, qui influencerait à son tour le statut azoté de chaque espèce. En effet, il s’avère que l’azote du sol est plus largement capté par la molinie (données 15
N), en raison d’un système racinaire plus prospectif mais aussi en raison de capacités d’absorption racinaire du nitrate plus élevées que chez le chêne (symbioses mycorhiziennes). L’ouverture du couvert accentue cet avantage de compétition pour la captation de cette ressource du sol (« sans ombrière » dans notre étude) en raison d’une demande en azote plus importante par les PA chez la molinie. Ainsi, l’azote prélevé est massivement alloué vers les parties aériennes pour assurer la mise en place des feuilles et optimiser la photosynthèse et, in fine, la croissance et l’allocation de MS vers les racines de la molinie permettant une meilleure exploration du sol par cette dernière.
En termes de perspectives, plusieurs pistes pourront être explorées afin de mieux cerner les interactions entre la structure, le fonctionnement et la partage des ressources pour améliorer, in fine, les capacités de régénération des chênaies :
au niveau du sol :
- l’effet de l’eau sur la disponibilité de l’azote pourrait être testé au moyen de différents régimes hydriques. Cependant, le suivi de variables rendant compte du statut hydrique du végétal (conductance stomatique, δ13C) au cours de cette expérimentation pourra être utilement analysé pour déterminer l’effet croisé de la disponibilité en azote et d’un stress hydrique sur les capacités photosynthétiques.
- Des prélèvements de sols ont été effectués lors de l’expérimentation afin de doser les concentrations en nitrate et en ammonium. Ces données devraient permettre de mieux caractériser le niveau de disponibilité en azote minéral du sol. Une expérimentation avec des teneurs en azote contrastées (s’appuyant sur l’utilisation de sols différents, par exemple)
17
devrait permettre de mieux cerner le poids de l’azote du sol dans l’établissement du rapport de dominance.
- La symbiose mycorhyzienne représente un processus par lequel une part prépondérante de l’azote est prélevée chez le chêne. L’utilisation de coloration pour quantifier les taux de mycorhyzation chez le jeune chêne pourrait fournir des informations utiles quant à (i) la cinétique d’installation du champignon et son éventuelle modification en présence de molinie après une éclaircie et (ii) la nature des formes d’azote préférentiellement prélevées par le jeune plant de chêne.
au niveau de l’environnement aérien : il est fortement probable que l’ouverture du couvert puisse modifier la température de l’air. Des expérimentations testant l’impact de cette variable physique seraient utiles.
V - REFLEXIONS PERSONNELLES
Mon cursus universitaire m’oriente dans un parcours professionnel en vue de me préparer à la session 2012 du concours du CAPES en SVT (Certificat d’aptitude au professorat de l’enseignement du second degré). Du fait de la masterisation de ma formation, il m’a été permis d’effectuer un stage en laboratoire de recherches de deux mois et demi. Mes pérégrinations m’ont amenées au site de Crouël de l’INRA et me voilà agréablement satisfaite de ce que j’ai pu y découvrir. Ce stage m’a permis d’apprécier l’aspect recherche de mon étude et d’avoir une vision plus concrète de la recherche. J’ai pu mettre en pratique une démarche scientifique rigoureuse et d’organiser mon travail. J’ai également eu la possibilité de revoir et d’acquérir de nouvelles connaissances. La rédaction d’un rapport m’a incité à développer une chronologie et une interprétation élaborée nécessaire tant en recherche qu’en milieu scolaire.
Par rapport à ma formation en SVT, je pense que ce stage m’apporte une vision de la recherche aspirant à l’élaboration de connaissances que j’enseignerai par la suite aux élèves de collège et lycée. De plus, cela m’a également permis de communiquer et de travailler en interaction avec l’équipe du PIAF. L’échange et la collaboration sont indispensables dans les métiers de l’éducation. L’acquisition de ces compétence est motivante aussi bien pour mon développement personnel que pour mon futur travail professionnel. Après ces onze semaines, j’ai la volonté de poursuivre dans l’enseignement des Sciences de la Vie et de la Terre malgré un bénéfice certain de cette expérience.
REFERENCES BIBLIOGRAPHIQUES
Balandier, P., Collet, C., Miller, J. H., Reynolds, P. E. and Zedaker, S. M. (2006). Designing forest vegetation management strategies based on the mechanisms and dynamics of crop tree competition by neighbouring vegetation. Forestry 79, 3-27.
Balandier, P., Sinoquet, H., Frak, E., Giuliani, R., Vandame, M., Descamps, S., Coll, L., Adam, B., Prevosto, B. and Curt, T. (2007). Six-year time course of light-use efficiency, carbon gain and growth of beech saplings (Fagus sylvatica) planted under a Scots pine (Pinus
sylvestris) shelterwood. Tree Physiol 27, 1073-82.
Barber, S. A. (1962). A diffusion and mass-flow concept of soil nutrient availability. Soil
Science 93, 39-49.
Coll, L., Balandier, P., Picon-Cochard, C., Prevosto, B. and Curt, T. (2003). Competition for water between beech seedlings and surrounding vegetation in different light and vegetation composition conditions. Annals of Forest Science 60, 593-600.
Davies, E. (1987). Action potentials as multifunctional signals in plants: a unifying hypothesis to explain apparently disparate wound responses. Plant, Cell and Environment 10, 623-631.
Davis, M. A., Wrage, K. J., Reich, P. B., Tjoelker, M. G., Schaeffer, T. and Muermann, C. (1999). Survival, growth, and photosynthesis of tree seedlings competing with herbaceous vegetation along a water-light-nitrogen gradient. Plant Ecology 145, 341-350.
De Boer, W. and Kowalchuk, G. A. (2001). Nitrification in acid soils: micro-organisms and mechanisms. Soil Biology & Biochemistry 33, 853-866.
Fotelli, M. N., Gessler, A., Peuke, A. D. and Rennenberg, H. (2001). Drought affects the competitive interactions between Fagus sylvatica seedlings and an early successional species,
Rubus fruticosus: responses of growth, water status and delta C-13 composition. New Phytologist 151, 427-435.
Frochot, H., Levy, G., Wehrlen, L., Lefevre, Y. and Lorsin, G. (1986). Effectiveness of a mulching with newspapers on juvenile growth of wild cherry-tree (prunus-avium l). Annales
REFERENCES BIBLIOGRAPHIQUES
Gemmel, P., Nilsson, U. and Welander, T. (1996). Development of oak and beech seedlings planted under varying shelterwood densities and with different site preparation methods in southern Sweden. New Forests 12, 141-161.
Harmer, R., Boswell, R. and Robertson, M. (2005). Survival and growth of tree seedlings in relation to changes in the ground flora during natural regeneration of an oak shelterwood.
Forestry 78, 21-32.
Harmer, R. and Morgan, G. (2007). Development of Quercus robur advance regeneration following canopy reduction in an oak woodland. Forestry 80, 137-149.
Jarvis, P. G. (1964). The adaptability to light intensity of seedlings of Quercus petraea (Matt.) Liebl. Journal of Ecology 52, 545-571.
Jennings, S. B., Brown, N. D. and Sheil, D. (1999). Assessing forest canopies and understorey illumination. Canopy closure, canopy cover and other measures. Forestry 72, 59-73.
Kolb, T. E. and Steiner, K. C. (1990). Growth and biomass partitioning of northern red oak and yellow poplar seedlings. Effects of shading and grass root competition. Forest Science 36, 34-44.
Kozlowski, T. T. and Davies, W. J. (1975). Control of water balance in transplanted trees.
Journal of Arboriculture 1, 1-10.
Kozlowski, T. T., Kramer, P. J. and Pallardy, S. G. (1991). The physiological ecology of woody plants. In Physiological ecology, a series of monographs, texts and treatises, (ed. M. H. A.), pp. 657 pp. San Diego: Academic Press.
Laine, P. (1995). Modalités et regulations de l’absorption du nitrate chez Brassica napus L. et
Lolium multiflorum Lam. Thèse de l’Université de Caen, 91 p.
Löf, M. (2000). Establishment and growth in seedlings of Fagus sylvatica and Quercus
robur: influence of interference from herbaceous vegetation. Canadian Journal of Forest Research-Revue Canadienne De Recherche Forestiere 30, 855-864.
Löf, M., Gemmel, P., Nilsson, U. and Welander, N. T. (1998). The influence of site preparation on growth in Quercus robur L. seedlings in a southern Sweden clear-cut and shelterwood. Forest Ecology and Management 109, 241-249.