UNIVERSITE DE GENEVE FACULTE DE MEDECINE Section de Médecine Fondamentale Département Neurosciences Cliniques et Dermatologie, Division de Recherche Neuromusculaire
Département de Physiologie ET
Département de Chirurgie
Thèse préparée sous la direction des Professeurs Charles R. Bader, Laurent Bernheim et Pierre Hoffmeyer
« Investigation fonctionnelle des complexes enzymatiques
mitochondriaux de patients présentant une suspicion de
myopathie mitochondriale »
Thèse
présentée à la Faculté de Médecine de l’Université de Genève
pour obtenir le grade de Docteur en médecine
par
Antonio Arturo FAUNDEZ de Carouge (Genève) Thèse Méd. n° 10351
« Investigation fonctionnelle des
complexes enzymatiques mitochondriaux
de patients présentant une suspicion de
myopathie mitochondriale »
A mes grands-parents analphabètes.
A ma mère Ruth et à mon père Antonio.
A mes sœurs, Ana et Tamara. A mes frères, Marcello et Alexandre.
Je tiens tout particulièrement à remercier mes directeurs de thèse, les Professeurs
Charles Bader et Laurent Bernheim, pour leur amitié, leur soutien et leur
stimulation intellectuelle.
Merci au Professeur Pierre Hoffmeyer, Médecin Chef de Service de la Clinique
et Policlinique de Chirurgie Orthopédique et Traumatologie des Hôpitaux
Universitaires de Genève pour m’avoir donné l’opportunité de découvrir le
monde de la recherche fondamentale.
Un grand merci à Philippe Perrotet, laborantin, pour être resté de nombreux soirs
à terminer nos expériences.
Table des matières
I. Introduction
et
but
de
l’étude
p.
8
- Moyens d’investigation à disposition
p.
10
- Hypothèse
de
travail
p. 11
- But de l’étude
p. 11
II.
Analyse du Contrôle Métabolique
p.
13
- Régulation et contrôle d’un processus enzymatique
p. 13
- Homéostasie : un équilibre dynamique
p. 13
- Thermodynamique des voies métaboliques
p. 14
- Réactions de non-équilibre et contrôle métabolique
p. 15
- Principes de Régulation et de Contrôle
p. 17
- Concept du Coefficient de Contrôle
p. 18
- Théorème
de
la
Somme
p. 23
III. Méthode : Respirométrie de Haute Résolution
p. 24
A.
Prélèvement
musculaire
p.
24
- Technique
de
prélèvement
p. 25
- Dissection et perméabilisation
p. 27
B.
L’appareil
oxygraphique
p.
29
- Description
des
composants
p. 29
- L’électrode
de
mesure p. 30
- Calibration des flux d’oxygène
p. 31
- Protocole
de
calibration
p. 32
C. Milieux d’expérimentation, substrats et inhibiteurs
p. 36
- Milieux de transport, de préservation et d’incubation
p. 36
- Substrats
p. 38
- Inhibiteurs
p. 38
D.
Expérimentation
p.
40
- Flux maximal d’O
2p.
41
- Test fonctionnel du Complexe I
p. 41
- Test fonctionnel du Complexe IV
p. 42
IV.
Autres
methodes
p.
44
A. Méthode de mesure de
protéines p.
44
- Choix
de
la
méthode
p. 44
- Protocole
de
mesure
p. 46
B.
Biochimie
p.
48
C.
Histologie
p.
49
D.
Carnitine
p.
51
E. Génétique mitochondriale p.
52
V.
Analyse
statistique p.
53
A.
Oxygraphie
p.
53
B.
Biochimie
p.
55
C.
Carnitine
p.
57
VI. Description des patients et résultats
p. 58
A. Description des Sujets « Contrôles » et résultats
p. 58
- Valeurs « contrôles » oxygraphie
p. 58
- Carnitine
libre
p. 60
- Activités biochimiques des Complexes I et IV
p. 61
B. Description des Patients « Investigués » et résultats
p. 62
VII.
Discussion
p.
107
A. Interprétation détaillée des
résultats
p.
107
1. Patients « contrôles » et valeurs « contrôles »
p. 107
- Patients « contrôles »
p. 107
- Histologie
p. 108
- Biochimie
p. 108
- Carnitine
libre
p. 109
- Flux respiratoires exprimés en mg de protéines
p. 109
2. Patients « investigués » et leurs résultats
p. 111
- Oxymétrie
p. 111
a. Patients présentant des éléments concordants
p. 112
pour
une
mitochondriopathie
b. Patients présentant des éléments discordants
p. 114
pour une mitochondriopathie
c. Patients avec un diagnostic histologique
p. 116
- Carnitine
p. 120
VIII.
Conclusion
p.
122
- Flux
respiratoires
p. 123
- Carnitine p. 123
- Histologie p. 124
- Génétique
mitochondriale
p. 124
- Biochimie
p. 124
- Coefficient
de
Contrôle
p. 125
IX. Impression d’ensemble sur la Respirométrie de Haute Résolution
p. 128
- Quelques réflexions sur la méthode
p. 128
- Quelques réflexions sur l’implication
p. 129
de plusieurs centres indépendants
- Le but principal de l’étude a-t-il été atteint ?
p. 129
I. Introduction et but de l’étude
Introduction
De 1995 à 1997 en Suisse Romande, il n’a pas été possible de poser un diagnostic précis chez soixante-dix à quatre-vingts patients sur plus de deux cents investigués en raison d’une symptomatologie de fatigabilité et/ou de douleurs musculaires. Un petit nombre d’entre eux présentait des anomalies biologiques et/ou histologiques telles que, dans le sang, des enzymes musculaires légèrement au-dessus de la norme ou, histologiquement, une accumulation mitochondriale sous-sarcolemmale discrète ou une augmentation des gouttelettes lipidiques dans le muscle squelettique. Bien que compatibles avec une
mitochondriopathie, ces anomalies restent non spécifiques, pouvant se rencontrer dans
presque toute pathologie musculaire métabolique ou même structurelle parfois, comme par exemple l’accumulation sous-sarcolemmale de mitochondries dans la maladie de Duchenne avancée.
La mitochondrie est une organelle impliquée dans plusieurs processus
métaboliques ne se limitant pas uniquement à la production d'ATP, bien que ce soit dans la plupart des tissus son rôle prépondérant. De nombreux enzymes, transporteurs et substrats participent à la synthèse d'ATP et théoriquement, tout déficit suffisamment intense dans l'une ou l'autre de ces voies métaboliques amène à un trouble fonctionnel mitochondrial. Ainsi, les pathologies mitochondriales forment un groupe hétérogène de troubles métaboliques, caractérisés par des anomalies ultrastructurelles mitochondriales ou du métabolisme oxydatif (OXPHOS).
D’autre part, il faut distinguer différents degrés de gravité physiopathologique. Les déficits enzymatiques touchant directement un enzyme essentiel du cycle de Krebs (déficit en fumarate par exemple) ne permettent pas la survie et les patients atteints décèdent souvent rapidement après la naissance. D'autres déficits semblent se manifester de façon moins bruyante et présentent une évolution plus lente, tels les mitochondriopathies liées à la carnitine ou à son récepteur. Toutes ces pathologies prennent leur origine dans des anomalies génétiques nucléaires.
Nous nous sommes plus particulièrement intéressés au métabolisme OXPHOS. Le métabolisme OXPHOS est responsable de la production d’ATP à l’intérieur de la chaîne respiratoire mitochondriale qui est composée de plusieurs étapes, dont font partie cinq complexes enzymatiques (Complexes I à V). Les différentes sous unités (molécules
nucléaire, en plus petite partie (molécules fonctionnelles) par le génome mitochondrial. Cependant, les anomalies du fonctionnement du métabolisme OXPHOS sont dues à des
mutations du DNA mitochondrial (mtDNA), et rarement à des mutations des gènes
nucléaires codant pour les complexes respiratoires mitochondriaux, par exemple les gènes codant pour la protéine frataxine dans le cas de l’ataxie de Friedreich [1].
Les mitochondriopathies dues à des mutations du mtDNA sont d’apparition tardive et de progression lente. Plusieurs travaux ont démontré que le pourcentage de
mutation mtDNA doit dépasser les 75 à 80% avant qu’une mitochondriopathie ne se
manifeste cliniquement et qu’elle puisse être détectée histologiquement ou biochimiquement [2, 3], c’est à dire, pour que le seuil où la demande énergétique du tissu dépasse l’apport, soit atteint (cf. plus loin « L’effet de seuil »). D’autres examens tels que l’ENMG (électro-neuro-myogramme) ou le test d’effort n’ont pas une sensibilité ou spécificité suffisante pour mettre en évidence une perturbation modérée. L’analyse du génome mitochondrial reste aléatoire par le fait que plusieurs mutations peuvent se manifester par des symptômes identiques et
inversement, une même mutation du mtDNA peut se manifester par des tableaux cliniques différents [4].
De nombreux syndromes dus à une ou plusieurs anomalies du mtDNA ont été décrits dans la littérature médicale (Syndrome de Leigh, LHON, ophtalmoplégie externe progressive ou CPEO, syndrome MERRF, etc.) et parfois l’équipe médicale peut poser un diagnostic parce que les symptômes sont bruyants et le taux de mutation de mtDNA
suffisamment important pour être détecté (cf. table 6). Bien plus souvent, il s’agit de tableaux cliniques intermédiaires avec une symptomatologie bâtarde et d’apparition progressive où le médecin ne sait pas vers quel diagnostic s’orienter, mais où il suspecte un dysfonctionnement du métabolisme mitochondrial [1].
L’ensemble de ces raisons fait qu’encore actuellement, les médecins et les chercheurs rencontrent d’importantes difficultés dans le cheminement diagnostique des mitochondriopathies.
Une autre caractéristique essentielle des dysfonctionnements mitochondriaux est l’effet de seuil, notion qui vient encore accentuer la difficulté du diagnostic.
- L'effet de seuil [3, 5-7]
Il existe deux effets de seuil d’après une théorie émise en 1997 par l’équipe du laboratoire de J.-P. Mazat [3]. Chaque tissu, chaque colonie de mitochondrie, chaque mitochondrie elle-même possède un pool mixte de mtDNA natif (non muté) et de mtDNA
muté, de proportion variable : c’est l’hétéroplasmie. Le premier effet de seuil (seuil biochimique) en est la conséquence et il sera plus ou moins bas selon la proportion de mtDNA natif/mtDNA muté présente dans le tissu.
Le deuxième effet de seuil est lié à la demande énergétique de l’organe impliqué (seuil énergétique).
On parle du double effet de seuil qui résulte de la dynamique de production d'ATP par la chaîne respiratoire mitochondriale et de la demande en ATP du tissu.
Moyens d’investigation à disposition
Différents types d'investigations in vitro sont disponibles dans la recherche d'une myopathie mitochondriale.
L'Histologie musculaire permet au moyen de plusieurs colorations chimiques et
marquages immunohistochimiques de mettre en évidence certaines anomalies,
malheureusement non spécifiques, telles que des Red Ragged Fibers (RRF), accumulations sous-sarcolemmales de mitochondries, un déficit spécifique en Déhydrogénase (SDH) ou en Cytochrome c Oxydase (COX). On peut également déterminer le nombre et la taille des gouttelettes lipidiques (coloration ORO), la distribution du glycogène (coloration PAS), la distribution et la proportion des fibres de type 1 (coloration du NADH) ou de type 2 (coloration ATPase).
La Biochimie permet parfois de mettre en évidence certains déficits d'activité in
vitro des complexes de la chaîne respiratoire mitochondriale [8, 9]. Dans le cadre de ce travail
de recherche, nous avons désiré mesurer les « activités spécifiques » et « activités
rapportées » à la Citrate Synthase des complexes I, II, III, IV, II partiel (SDH) et du segment II-III [8].
La mesure du contenu en Carnitine, effectué de routine dans la Clinique de Pédiatrie, a également été mesurée dans le cadre d’une étude à Genève. Les maladies touchant ce transporteur d'acyl se rencontrent plutôt dans l'enfance. Toutefois elles concernent
indirectement le fonctionnement mitochondrial et nous avons désiré mesurer le contenu en carnitine chez les adultes inclus dans cette étude, en particulier ceux dont l'analyse
histologique avait révélé une accumulation anormale de gouttelettes lipidiques.
L'analyse de la génétique mitochondriale a également été effectuée, ceci de la façon la plus ciblée possible en fonction des éventuelles anomalies découvertes à l'oxymétrie et lors de la mesure d'activité biochimique. Les délétions et les mutations ponctuelles les plus
fréquentes de l'ADN mitochondrial humain ont été recherchées dans un premier temps (cf. table 6) et, dans un deuxième temps, selon les anomalies oxygraphiques et/ou histologiques etc., les altérations moins fréquentes, mais plus spécifiques.
Malheureusement, ces examens in vitro sont limités par leur manque de spécificité et de sensibilité. En effet, les altérations histologiques et ultrastructurelles rencontrées dans les mitochondriopathies peuvent également se voir dans d'autres situations « normales » comme chez les sportifs de haut niveau ou « anormales » comme les myopathies structurelles telles que la maladie de Duchenne ou d’autres pathologies neuromusculaires, chez les patients sidéens sous AZT ou encore dans le myocarde ischémié [10] [11] [12]. De plus, la présence d'une activité biochimique dans un intervalle de normalité ou le marquage positif à l'histologie d'un enzyme de la chaîne respiratoire n'exclut en rien une anomalie fonctionnelle
mitochondriale.
Hypothèse de travail
Comme nous l’avons déjà souligné, la sensibilité et la spécificité des méthodes d’investigation actuelles des mitochondriopathies sont insuffisantes. Il fallait trouver un instrument diagnostique plus précis.
Notre hypothèse de travail repose sur le fait que la mitochondrie consomme de l’oxygène pour oxyder les substrats et produire de l’ATP lors de la phosphorylation
oxydative. Cette consommation peut être mesurée dans un volume fermé, par un oxygraphe composé d’une électrode à haute résolution placée dans une chambre de mesure constituée de matériaux inertes vis à vis l’oxygène [13, 14, 16, 17, 21, 22]. Par ce moyen, nous pouvons déterminer deux valeurs, le flux maximal d’oxygène ou consommation maximale au stade 3 de la respiration (cf. table 4) [23], et les coefficients de contrôle des complexes respiratoires de la chaîne mitochondriale. Ces valeurs devraient permettre une caractérisation fonctionnelle d’une population de mitochondries représentative d’un groupe de fibres musculaires
« perméabilisées » (cf. Méthode). Nous insistons sur l’aspect fonctionnel des mesures car il s’agit d’étudier le métabolisme mitochondrial dans des conditions quasi physiologiques. Ceci est un concept nouveau dans les moyens diagnostics de dysfonctionnement mitochondrial.
But de l’étude
Plusieurs groupes de recherche français, allemands et autrichiens s’intéressent depuis plus de quinze ans au métabolisme mitochondrial [13] [14] [15] [16]. En particulier, ils
ont employé une méthode d’investigation fonctionnelle, la Respirométrie ou Oxymétrie [17] utilisant des fibres musculaires perméabilisées par de la saponine [18].
La théorie de l’Analyse du Contrôle Métabolique développée dans les années 70 par Heinrich, Burns, Kacser et Rapoport s’appuie sur le concept d’homéostasie et permet une approche beaucoup plus physiologique des processus métaboliques [19, 20]. Elle permet notamment de déterminer les coefficients de contrôle, c’est-à-dire l’effet limitant de chaque complexe respiratoire mitochondrial sur le fonctionnement de l’ensemble de la chaîne de la phosphorylation oxydative.
Appliquant ces méthodes, la Division de Recherche Neuromusculaire et la Clinique et Policlinique d’Orthopédie et Chirurgie de l’Appareil Moteur des Hôpitaux Universitaires de Genève ont entrepris, d’une part d’optimaliser l’investigation
respirométrique à haute résolution, et d’autre part de déterminer son applicabilité clinique de routine dans le diagnostic des mitochondriopathies musculaires.
L’étude clinique s’est déroulée sur un an et a porté sur 33 sujets « contrôles » et 26 sujets souffrant de symptômes musculaires, désignés sous le terme « investigués ». Les 26 sujets investigués avaient une moyenne d’âge de 38.2 années (19-80, médiane 34.5). Il
s’agissait de 14 personnes de sexe masculin (âge moyen 38.6, médiane 36) et de 12 personnes de sexe féminin (âge moyen 39.3, médiane 35).
Le protocole d’étude, les méthodes précises appliquées, la description des sujets « contrôles » et « investigués » ainsi que leurs résultats sont décrits dans ce qui suit.
II. Analyse du Contrôle Métabolique [24]
L’oxygraphe à haute résolution est un appareil de haute précision permettant de mesurer des variations de concentration d’oxygène dans un volume fermé. Appliquant la théorie de l’Analyse du Contrôle Métabolique (en anglais Metabolic Control Analysis ou MCA), nous pouvons obtenir au moyen de cet appareil des informations sur la fonction mitochondriale in vitro dans des conditions d’homéostasie.
Nous allons donc maintenant exposer la théorie du MCA en définissant un « coefficient de contrôle » que nous allons déterminer dans la partie expérimentale pour chacun des patients inclus dans cette étude.
- Régulation et Contrôle d'un processus enzymatique
La Régulation peut se définir comme l'ensemble des moyens qu'un système métabolique possède pour répondre aux altérations environnementales dans le but de maintenir l'homéostasie.
Le Contrôle quant à lui correspond au pouvoir de modifier l'homéostasie par une action extérieure ou stimulus. Son étude nous permet de déterminer quels sont les sites ou les mécanismes impliqués dans le dysfonctionnement d'un organisme, mais nous permet
également de trouver comment les altérer afin de rétablir autant que possible l'homéostasie. Ces deux notions sont importantes dans l'étude moderne de la Biochimie. La Biochimie Classique nous apprend l'existence d'enzymes ou d'étapes limitantes dans un processus métabolique. Elles sont le siège de l'activité enzymatique la plus lente dans une chaîne métabolique et toute variation de cette activité est sensée influencer la cinétique de la chaîne. Ce concept n'est applicable qu'à un équilibre statique et non dynamique. Ce dernier est également appelé homéostasie.
- Homéostasie: un équilibre dynamique
En physiologie, l'homéostasie est la capacité d'un organisme à maintenir sa composition constante (on ne tient pas compte du vieillissement dans cette définition) tout en consommant des substrats d'un côté et excrétant des produits à l'autre bout. Cet organisme ne peut donc maintenir son état que par ce flux constant de matière et d'énergie à travers les voies métaboliques de ses cellules. Jamais un véritable équilibre n'est atteint car cela signifierait l'accumulation d'un produit quelque part dans la chaîne et finalement la mort de l'organisme.
Mathématiquement, nous pouvons considérer qu'un système en homéostasie tend toujours vers un équilibre sans jamais l'atteindre.
- Thermodynamique des voies métaboliques
La thermodynamique classique concerne les systèmes fermés où le seul équilibre qui peut résulter est l'équilibre chimique. Les organismes vivants au contraire sont considérés comme des systèmes ouverts où peut se développer un équilibre dynamique.
Dans la thermodynamique classique, la variation d'énergie libre ∆G à l'équilibre est égale à zéro, mais n'est pas égale à zéro si la réaction est déplacée de l'équilibre.
Dans la réaction:
A+B ' C+D
L'énergie libre de cette réaction à une concentration donnée de substrats et produits à pH 7 est de ∆G'. Elle est relié à l'énergie libre standard ∆G0
' (définie comme
l'énergie libre lorsque le pH=7) par l'équation:
R: constante de gaz T: température absolue
∆G' = ∆G0
' + R*T*ln(CD/AB) (1.1)
Le rapport d'action de masse Γ est défini comme le rapport des produits CD/AB. A l'équilibre, ∆G' = 0 et Γ = Keq (constante d'équilibre) et donc finalement:
∆G0 ' = - R*T*ln(Keq) (1.2) Par substitution: ∆G'= - R*T*ln(Keq) + R*T*ln(Γ) (1.3) et ∆G'= R*T*ln(Keq / Γ) et (Keq / Γ) = ρ (1.4)
Dans cette équation, ρ est appelé index de déséquilibre. Il nous donne une mesure du déplacement de la réaction par rapport à l'équilibre. En effet, si ∆G'= 0, alors ρ = 1. Et si
∆G'< 0, alors, ρ >1. On verra plus loin que la valeur de ρ nous est utile pour déterminer si une réaction est potentiellement un site de régulation ou de contrôle.
Classiquement, les réactions biochimiques peuvent être décrites comme étant en non-équilibre (non-equilibrium) ou proches de l'équilibre (near-equilibrium). Dans ces cas, ρ peut être respectivement soit très petit, soit très grand. On peut également les définir comme les réactions ayant respectivement une énergie libre très négative (non-equilibirum) ou très proche de zéro (near-equilibrium). Dans ce dernier cas de figure, si l'on prend l'équation (1.2), lorsque l'on se rapproche de l'équilibre, ∆G' tend vers 0 et donc Keq tend vers 1. Pour des raisons physiologiques (forces osmotiques), on peut supposer que les concentrations de substrats et de produits doivent être de l'ordre du micromolaire ou du millimolaire, et partant,
les réactions avec un Keq très élevé se maintiendront loin de l'équilibre pour que les
concentrations de métabolites restent dans le domaine physiologique. A l'inverse, les
réactions possédant un Keq faible (proche de 1) devront être proches de l'équilibre. Cette
théorie a été démontrée mathématiquement en 1974 par Heinrich et Rapoport [25]. De même, Atkinson [26, 27] a insisté sur le fait que les réactions de couplage d'énergie libre, telles que la production d'ATP, doivent être loin de l'équilibre. Ceci constitue une autre définition de l'homéostasie.
- Réactions de non-équilibre et contrôle métabolique
On peut théoriquement démontrer que les réactions de non-équilibre seraient celles qui influencent de façon significative le flux métabolique d'une chaîne enzymatique.
Soit la réaction réversible suivante:
vf: vitesse "forward",
de la réaction A vers B
vr: vitesse "backward"
de la réaction B vers A
On peut également définir la vitesse vi comme une constante ki multipliée par la concentration du substrat ou du produit. Ainsi, vf = kf* A et vr = kr* B. Puisqu'à l'équilibre B/A = Keq, donc
Si l'on considère des conditions de non-équilibre on peut définir ce rapport
autrement :
(kr* B) /( kf* A) = Γ* (kr / kf)
et Γ (1.6) / Keq = ρ
Maintenant si l’on accepte que cette réaction réversible a fini par atteindre un état stationnaire tel qu’il existe un flux constant vp à travers elle :
La condition nécessaire à l’état stationnaire est que : vf – vr = vp Ainsi :
Rappel :
ρ = rapport de déséquilibre
Et finalement, (1.7) vp/vf = 1-ρ
Il faut se souvenir (Eq. 1.4) que l’équilibre (vf = vr) est atteint lorsque ρ = 1. Dans ce contexte d’état stationnaire, puisque vp > 0, cette réaction ne pourra être que proche de l’équilibre (near-equilibrium) si vf >> vp de telle manière que vf ≈ vr. Par contre, une réaction de non équilibre (non-equilibrium) possède alors un ρ proche de 0 de telle façon que vp ≈ vf.
Cette démonstration est séduisante et nous amènerait à définir les réactions de non équilibre comme potentiellement limitantes (car vp ≈ vf) dans une voie métabolique au
contraire des réactions de « near-equilibrium ». Les expériences de laboratoire ont montré que ce n’était pas le cas. L’une des carences de cette théorie réside dans l’omission de l’effet du ou des produits sur les réactions en amont de la chaîne enzymatique. L’autre erreur consiste à ne s’être concentré que sur une étape et ne pas avoir considéré toute la chaîne.
- Principes de Régulation et de Contrôle
Le terme de « étape limitante » dans une chaîne métabolique est erroné. A l’origine elle est définie comme l’étape possédant la vitesse enzymatique la plus lente dans une chaîne métabolique. Cependant plusieurs questions restées sans réponse ont toujours remis en cause cette définition. De plus, les résultats expérimentaux ont montré qu’en réalité le flux métabolique à travers une chaîne enzymatique dépendait de la cinétique de chaque réaction.
Plutôt que d’étape limitante ou enzyme limitant, il faut parler d’enzyme
régulateur. Deux rôles peuvent être distingués pour un tel enzyme:
1) Homéostasie métabolique : adaptation de la consommation ou de la production d’un métabolite au reste du métabolisme, impliquant des signaux internes. Exprimé par le coeff. d’élasticité (ε).
2) Contrôle : pouvoir de changer l’état d’une chaîne métabolique en réponse à des stimulis extérieurs. Exprimé par les coeff. de contrôle (Cι), mesure quantitative du contrôle.
Le coefficient de contrôle est une mesure quantitative et spécifique de l'effet régulateur qu'exerce un complexe sur le flux métabolique de toute la chaîne respiratoire, dans le cas ici de la mitochondrie. Il existe différentes méthodes pour mesurer un coefficient de contrôle : la régulation de l'expression génétique d'un enzyme, la régulation de cofacteurs nécessaires au fonctionnement de l'enzyme et d'autres moyens sur lesquels on ne s’étendra pas. Dans toutes ces situations il s’agit de faire varier l'activité biochimique d'un enzyme afin
d'étudier l'effet de cette variation sur le flux métabolique et, par-là, définir le contrôle qu'exerce l'enzyme sur ce flux.
Dans cette étude, nous avons utilisé une méthode permettant de faire varier l'activité biochimique de différents enzymes de la chaîne respiratoire mitochondriale: la
titration à l’aide d’un inhibiteur spécifique.
La théorie du contrôle métabolique part du principe qu'il n'existe pas d'étape limitante dans une chaîne métabolique avec un flux constant, c'est-à-dire en état stationnaire. Plusieurs paradoxes ont permis d'arriver à cette conclusion: les biochimistes de la première moitié du vingtième siècle étaient d'accord sur l'existence d'un enzyme limitant dans une chaîne métabolique, mais ne s'entendaient pas sur sa localisation. Comment pouvait-il exister une étape la plus lente alors qu'à l'équilibre tous les enzymes travaillent à la même vitesse ? Pourquoi n'arrivait-on pas à accélérer la production d'un métabolite en augmentant la
concentration de son enzyme limitant, ce qui aurait dû se produire d'après la théorie de l'étape limitante ?
- Concept du Coefficient de Contrôle
Dans la théorie de l'étape limitante, la question est de savoir s'il existe un enzyme limitant. La réponse est restrictive: "oui" ou "non". Dans la théorie du Contrôle Métabolique il s'agit de savoir comment (qualitativement) ou combien (quantitativement) la variation
d'activité d'un enzyme va influencer le flux à travers une chaîne métabolique. Les possibilités de réponses sont plus riches, les protagonistes également plus nombreux puisque l'on
considère en même temps plusieurs réactions biochimiques.
Pour définir théoriquement le coefficient de contrôle, prenons une voie
métabolique en état stationnaire avec une source (X0) et une sortie (XI) telle que représentée
sur la figure 1.
a)
Figure 1
Si l'on s'intéresse à l'étape ydh et son flux spécifique Jydh et que ce flux (ou activité de l'enzyme) est exprimé sur un graphique (fig. 1-b) en fonction de la variation de
concentration de l'enzyme correspondant Exase, on peut alors définir un "domaine limitant" et un "domaine non-limitant" de l'enzyme sur ce même graphique. Le premier est défini comme l'intervalle sur l'abscisse où une faible variation dans la concentration enzymatique
non-limitant" correspond à l'intervalle où une forte variation de concentration ne provoquera qu'un faible changement du flux.
Sur cette même courbe (cf. fig. 1-b), si l'on induit un changement suffisamment faible de la concentration enzymatique, alors le rapport δJydh/δExase représente la pente de la courbe à l'endroit étudié. Elle correspond donc à une mesure quantitative du changement
d'activité enzymatique suite à une variation de la concentration de ce même enzyme. A partir
de là, le Coefficient de contrôle C de l'enzyme sur le flux Jydh peut être défini en éliminant les unités de la façon suivante:
Ou autrement encore :
Répétons qu'il ne s'agit là que d'une définition théorique et que les chercheurs ne se sont intéressés aux moyens de mesurer expérimentalement les coefficients de contrôle que plus tard. A noter que le coefficient de contrôle peut également être défini à partir d'un graphique exprimé en logarithmes (cf. fig. 1-c).
Mathématiquement, le coefficient de contrôle étant défini essentiellement comme la pente d'une courbe, il ne peut varier qu'entre une valeur minimale de -1 et maximale de +1. Une valeur située entre -1 et 0 signifie qu'il existe des embranchements métaboliques dans l'étape enzymatique que l'on étudie. Une valeur de +1 signifie qu'une variation x de la concentration de l'enzyme provoque une variation de proportion identique du flux (ou
activité). En réalité, la définition du coefficient de contrôle stipule que les valeurs extrêmes ne sont jamais atteintes, le coefficient "tend vers" sans jamais atteindre. Il est intéressant
toutefois de constater que théoriquement un enzyme avec un coefficient de contrôle de 1 est un enzyme limitant. Expérimentalement, l'équilibre biochimique n'existe pas, et par
L'expérimentation génétique sur des organismes diploïdes comme la drosophile (Drosophila Melanogaster) a démontré théoriquement que la grande majorité des enzymes possédait des coefficients de contrôle très faibles (conclusion théorique basée sur une observation génétique par Fisher RA, 1928, [24]).
La définition mathématique telle que proposée par Kacser et Burns en 1973 [20] est donc comme nous l’avons déjà présentée plus haut :
Cette dernière équation définit le coefficient de contrôle Cι comme la mesure
quantitative du changement fractionnel du flux dans une voie métabolique induit par un changement fractionnel de l’activité de l’enzyme considérée. Il faut rappeler que Jydh est le flux d’une étape métabolique tel que déterminé par l’activité de l’enzyme Exase.
Kacser, Burns, Heinrich et Rapoport ont également énoncé le théorème de la
somme que nous avons décrit plus haut. Il stipule que si les concentrations du substrat initial et du produit final sont maintenues constantes, alors la somme des coefficients de contrôle dans la voie métabolique en question est égale à 1. Kacser et Burns ont aussi démontré que
l’effet d’un inhibiteur sur le flux d’une voie métabolique dépendait de deux paramètres [20] :
1) l’effet de l’inhibiteur sur l’enzyme lorsque celui-ci est isolé et lorsqu’il est inclus dans une voie métabolique
Ceci est exprimé selon la relation suivante :
J = flux dans la voie en homéostasie (ss = steady state) I = concentration de l’inhibiteur
v
i = vitesse de l’enzyme quand isolée de la voie métabolique mais soumise à desconcentration similaires de substrat et de produit au flux J dans la voie métabolique (Si et Pi).
De cette équation on peut déterminer mathématiquement et expérimentalement le coefficient de contrôle d’un enzyme lorsque la concentration de l’inhibiteur I tend vers zéro. Nous obtenons donc :
Le numérateur de cette équation peut être dérivé de la pente initiale de la courbe de titration à l’inhibiteur. Le dénominateur quant à lui peut être calculé à partir des
caractéristiques d’inhibition de l’enzyme, réversible ou irréversible. Lorsque l’inhibiteur est
irréversible, le coefficient de contrôle peut être calculé directement à partir de la courbe de
Une expérience décrite dans cet article laisse supposer de façon intéressante qu’il n’existe pas une seule étape de contrôle ou étape limitante, mais que le contrôle métabolique est distribué sur plusieurs autres étapes [28]. Dans le cas de la chaîne respiratoire
mitochondriale, l’un de ces autres éléments de contrôle est la perméabilité passive de la membrane mitochondriale aux protons (« proton leak ») qui est d’autant plus important en expérimentation que la température d’incubation est élevée.
Les inhibiteurs réversibles peuvent être compétitifs ou non compétitifs. Nous n’avons travaillé qu’avec des inhibiteurs non compétitifs, à nouveau pour des questions de facilité technique et de disponibilité de temps. La formule telle que proposée par Groen [28] est :
Ci = Coefficient de contrôle. Ki = constante de dissociation. dJ/dI = pente des premiers points
d’une courbe flux en fonction de la dose d’inhibiteur.
J = flux maximal (I = 0)
Dans le cas des inhibiteurs réversibles, nous devons tenir compte du fait que l’enzyme se trouve sous deux formes en présence de l’enzyme qu’il inhibe, libre et en
complexe avec l’enzyme, selon l’équilibre :
E + I
'
EI.
Cet équilibre est régi par une constante de dissociation Kd ou Ki, exprimée dans
la formule plus haut et qui peut être déterminée pour chaque inhibiteur en utilisant une méthode biochimique d’inhibition par titration de l’enzyme cible. Elle dépend entre autres de la température d’incubation des réactifs. Nous aurions souhaité mesurer les valeurs de Kd à
une température de 30°C puisque c’est dans ces conditions que les fibres musculaires étaient incubées dans l’oxygraphe. Cependant pour des raisons de disponibilité du laboratoire de biochimie, nous avons finalement utilisé les valeurs de Kd déterminées par Kunz à 25°C pour
l’azide et l’amytal [29] [30]. Notre hypothèse est que la différence étant probablement proportionnelle, l’interprétation des valeurs mesurées n’en est pas altérée.
La Kd de l’amytal à 25°C telle que calculée sur une courbe spectrophotométrique
obtenue par titration du complexe I était de 170µM.
La Kd de l’azide calculée de la même façon, mais par titration du complexe IV
Comme on peut assez aisément le comprendre, l’abscisse d’une courbe de titration à l’inhibiteur peut être exprimée en concentration soit de l’enzyme soit de l’inhibiteur. Nous avons décidé d’utiliser la concentration de l’inhibiteur puisque la concentration de l’enzyme intra mitochondrial étudié, c’est-à-dire de l’un des complexes de la chaîne respiratoire, est difficile à mesurer.
- Le Théorème de la Somme (« Summation Theorem »)
Défini par Kacser et Burns en 1973 [19], ce théorème stipule que dans une chaîne métabolique linéaire (sans embranchements) en équilibre dynamique (homéostasie) en condition de saturation (stade III de la respiration dans la mitochondrie, (cf. table 4) le contrôle du flux est partagé entre les différents intervenants de la chaîne. Ceci s’exprime mathématiquement par :
Théoriquement ceci implique que la somme des coefficients de contrôle de tous les enzymes présents dans une cellule est égale à 1. En pratique, on peut émettre l’hypothèse que des enzymes connectés de façon très distante les uns des autres n’ont que peu d’influence sur leurs voies métaboliques respectives. En d’autres mots, leurs coefficients de contrôle sur une voie métabolique distante tendent vers ou sont égaux à zéro.
Dans la discussion des résultats, nous reviendrons sur ce théorème et l’information qu’il peut nous apporter dans l’étude du contrôle métabolique.
Dans la section suivante, nous allons présenter notre méthodologie et exposer comment nous avons appliqué expérimentalement la théorie du « coefficient de contrôle » sur des mitochondries de fibres musculaires « perméabilisées ».
III. Méthode
A. Le prélèvement musculaire
Nous sommes partis de l’hypothèse que, puisque l’oxymètre mesure une consommation d’oxygène et que l’appareil possède une sensibilité de 1 à 2 pmol/seconde (data transmis par E. Gnaiger, concepteur de l’appareil), il devait certainement être capable de détecter des différences de flux entre différentes localisations anatomiques. Il était donc important de focaliser l’investigation sur un muscle particulier. En effet, selon leur
localisation, les muscles ont des fonctions différentes qui se traduisent histologiquement par des populations de fibres soit à majorité de type 1 (fibres dites lentes, riches en mitochondries et fonctionnant sur le métabolisme oxydatif) soit à majorité de type 2 (fibres dites rapides, pauvres en mitochondries et fonctionnant sur le métabolisme anaérobique). Il était également primordial, pour déterminer des valeurs oxymétriques de contrôle, de choisir un muscle facilement accessible et fréquemment exposé lors d’interventions orthopédiques. Nous avons opté pour le muscle deltoïde qui possède en outre d’autres avantages :
- les patients souffrant de pathologies de l’épaule nécessitant une intervention ont une moyenne d’âge plus basse avec une dispersion en âge chronologique plus importante que ceux souffrant d’autres pathologies orthopédiques, comme par exemple les arthroses de hanche où la moyenne d’âge est élevée. - très souvent, le muscle deltoïde n’est pas directement affecté
fonctionnellement dans les pathologies de l’épaule nécessitant une
intervention. Par exemple une rupture de la coiffe des rotateurs suffisamment aiguë ou subaiguë ne provoque pas une atrophie deltoïdienne. Par ailleurs dans l’instabilité d’épaule, autre raison d’intervention chirurgicale, aucune
anomalie histologique ou fonctionnelle du muscle deltoïde n’a pour l’instant été décrite.
- il est facilement et rapidement accessible en chirurgie élective de l’épaule ce qui nous garantit des conditions de prélèvement atraumatiques contrairement à la chirurgie de la hanche où le muscle est souvent lésé avant même de pouvoir effectuer le prélèvement.
Les arguments qui viennent d’être exposés nous ont logiquement amené à biopsier les patients suspects de pathologie mitochondriale au deltoïde. Il était évidemment prévisible que nous nous retrouverions parfois dans des situations où nous devrions prélever ce muscle du membre supérieur chez des patients présentant surtout ou exclusivement des symptômes aux membres inférieurs. C’est un désavantage puisque l’on sait que la distribution des mitochondries est hétéroplasmique non seulement dans les cellules d’un tissu donné, mais également entre tissus de localisations différentes, une condition résultant de la ségrégation
réplicative lors de l’embryogenèse. Cependant, on peut aussi supposer que le pool mixte de
mtDNA est distribué de façon homogène quel que soit la localisation et que si certains patients se plaignent des muscles des membres inférieurs, cela pourrait être lié au fait que ces mêmes muscles sont particulièrement sollicités.
En résumé, nous avons choisi pour cette étude de biopsier le muscle deltoïde aussi bien chez les patients contrôles lors d’interventions orthopédiques en anesthésie générale, que chez les patients à investiguer. Chez ces derniers, l’intervention s’est faite en anesthésie locale.
Les patients des deux catégories de prélèvement ont été dûment informés oralement et par écrit et ont dû signer un formulaire de consentement éclairé autorisant le prélèvement de muscle sur leur personne. Le protocole d’étude a été accepté par la commission d’éthique des Hôpitaux Universitaires de Genève.
Technique de prélèvement
L’incision cutanée chez les patients contrôles a été effectuée par un chirurgien orthopédiste des HUG lors d’une intervention élective de l’épaule. Le prélèvement musculaire a toujours été effectué par la même personne (AAF) par souci de reproductibilité. L’incision cutanée chez les patients investigués était de 4cm environ, longitudinale et à la face antérieure du moignon de l’épaule au membre supérieur non dominant. Dans ce dernier cas, toute la procédure chirurgicale a été exécutée par AAF.
n o
Figure 2.
n : matériel utilisé pour le prélèvement musculaire.
o : matériel en place sur le muscle deltoïde exposé par une incision de 4cm env., juste avant excision du faisceau musculaire. p : faisceau excisé, longueur max. de 2cm. En haut de l’image, les prélèvements pour les analyses biochimiques, de carnitine et de génétique mitochondriale.
p
Un faisceau de muscle sectionné se tétanise et libère de grandes quantités de calcium intracellulaire pouvant entraîner des altérations osmotiques des mitochondries. Pour prévenir cela, nous avons employé une technique où le muscle était soigneusement disséqué in situ avant d’être fixé par deux fils résorbables (vycril 2.0) à un tuteur en bois préalablement plongé dans du liquide physiologique (cf. fig. 2, n, o, p). Cette contrainte mécanique associée à un transport dans un milieu de relaxation à 5°C jusqu’au laboratoire (Biops, cf. plus loin pour la composition) minimise la contraction des fibres et préviennent l’épuisement des réserves énergétiques cellulaires. Les dimensions de la biopsie sont environ de 20mm pour la longueur et 3mm pour l’épaisseur ce qui représente un poids humide de 100 à 150mg. A côté de cela, nous avons également prélevé 50mg de tissu pour l’étude des activités
biochimiques des complexes respiratoires (Hugues Henry et Olivier Boulat, Laboratoire Central de Chimie Clinique, CHUV, Lausanne), 50 autres mg pour la mesure de l’activité de la carnitine (Laboratoire du Prof. E. Girardin, Clinique de Pédiatrie, HUG, Genève) et encore 50 mg pour une étude histologique selon les méthodes conventionnelles (Dr G. Pizzolato, Dpt de Pathologie Clinique, HUG, Genève). A la fin de la dissection des fibres (cf. plus loin), environ 10 des 100mg de départ ont été utilisés pour l’analyse du génome mitochondrial (Dr M. Morris, Dpt de Génétique Médicale, HUG, Genève). Nous avons donc prélevé un total de 300mg environ pour chaque patient.
Dissection et perméabilisation
Les mesures oxygraphiques peuvent être effectuées soit sur des mitochondries isolées, soit sur des fibres perméabilisées. Les techniques d’isolation mitochondriale sont toutefois assez traumatiques pour ces organelles et la survie n’est que de 10 à 40% [9]. Ceci impose des prélèvements plus importants, entre 500 et 1000mg de tissu musculaire.
Il nous a donc paru plus intéressant de travailler sur des fibres musculaires perméabilisées selon la technique décrite pour les fibres musculaires cardiaques par Veksler qui permet d’accéder à 90% des mitochondries musculaires [17]. Il a été démontré que les caractéristiques respiratoires des mitochondries sur fibres perméabilisées étaient similaires à celles obtenues sur mitochondries isolées [13]. De plus, les quantités tissulaires nécessaires sont nettement plus réduites puisque 20mg de fibres musculaires en l’occurrence suffisent pour plusieurs expériences oxymétriques. Le bénéfice pour le patient, en particulier le patient pédiatrique, est évident. Dans notre étude, nous avons été obligés de faire des prélèvements plus importants afin de pouvoir couvrir toutes les analyses : oxymétrie, biochimie, etc.
L’intégrité structurelle des mitochondries est vérifiée par un test assez simple, le
test au cytochrome C. Dans des conditions idéales, la membrane externe de la mitochondrie
est intacte et le cytochrome C reste dans l’espace intermembranaire. Un apport artificiel de cytochrome n’a alors aucun effet sur a courbe respiratoire. Lorsque la membrane n’est plus imperméable comme cela peut arriver avec un traitement trop agressif à la saponine, le cytochrome C se dilue dans le cytosol. A ce moment là, du cytochrome C apporté
artificiellement s’incorpore à la membrane mitochondriale et stimule la respiration de plus de 5% (Wolfram Kunz, données non publiées).
La perméabilisation des fibres musculaires présente ainsi un net avantage par rapport à l’isolation des mitochondries. La technique est décrite dans ce qui suit.
Une fois prélevé, le muscle est disséqué aussi délicatement et aussi rapidement que possible dans un bain de Biops à 5°C (cf. composition plus loin). L’un des problèmes de l’oxymétrie sur fibres musculaires est la diffusion de l’oxygène entre le milieu
d’expérimentation et les fibres d’une part et d’autre part la diffusion qui existe entre le milieu et la membrane semi-perméable placée sur l’électrode ainsi que celle entre cette membrane et l’électrode elle-même. Toutes ces composantes sont exprimées dans une constante de temps τ (tau) pouvant être déterminée par une manœuvre de calibration (« stirrer test ») comme expliqué dans la partie technique de cette étude.
La dissection est effectuée à la loupe binoculaire d’abord en gros paquets de fibres. Ces paquets sont secondairement plus finement disséqués de manière à finalement
obtenir des paquets de 7 à 10 fibres maximum. Ces fibres sont stockées avant perméabilisation dans du Biops.
La perméabilisation ou « saponification » consiste à créer des pores dans les membranes sarcolemmales de façon à permettre une pénétration des substrats et des inhibiteurs utilisés dans les expériences oxymétriques. La saponine a cette particularité de s’attaquer spécifiquement aux membranes phospholipidiques riches en cholestérol, ce qui n’est pas le cas des membranes mitochondriales : on ne perméabilise que les membranes des cellules musculaires [18]. La spécificité de cette action est cependant dépendante du temps : plus la fibre est exposée à la saponine, plus elle risque de présenter une altération de ses mitochondries (cf. fig. 3). Une courbe flux d’oxygène versus temps de saponification permet de détecter le temps optimal d’exposition à la saponine. Un premier groupe de plusieurs paquets d’environ 7 fibres est plongé dans un tube Eppendorf 1.5ml rempli d’une solution de saponine 50µg/ml dans du Biops. Ce tube est agité durant le temps optimal de
perméabilisation sur un microshaker (MS, Mika ). Il est primordial d’utiliser un agitateur de bonne qualité avec une agitation très régulière et constante. A la fin du temps de
perméabilisation, l’échantillon est plongé successivement pendant dix minutes dans deux tubes d’un bain de stockage constitué notamment d’albumine bovine (mitomed 1) permettant de stopper la réaction avec la saponine. L’albumine a également pour fonction de protéger les fibres et leurs mitochondries de l’effet des protéases libérées par le muscle.
10
20
30
40
60
t = 27 min
Time (min)
Figure 3.
Courbe de saponine effectuée sur des
fibres du muscle deltoïde d’un sujet sain.
Les fibres sont soumises à divers temps d’exposition à la saponine (abscisse). Le temps optimal de perméabilisation permettant une consommation maximale d’O2
(ordonnée) est ainsi déterminé sur la courbe (entre 25 et 30 minutes).
Resp. (nmolO
2
/min/mg
prot
)
16
14
12
10
8
6
B. L’appareil oxygraphique (cf. fig 4.)
Description des composants
L’oxymètre ou oxygraphe que nous avons utilisé, dessiné et conçu par Paar en Autriche, se compose d’une unité de mesure et d’une unité de contrôle. L’unité de contrôle, qui n’est pas représentée sur la figure 4, est un bloc électronique nous permettant de régler certains paramètres expérimentaux tels que la vitesse de rotation des barreaux magnétiques, la température d’incubation. C’est également dans cette unité de contrôle que sont traitées les informations transmises par l’unité de mesure. L’unité de mesure est un monobloc dans lequel deux chambres de mesure en verre (duran polished glass) sont placées l’une à côté de l’autre thermiquement isolées par une couche de polystyrène expansé (cf. fig. 4). Chaque chambre est en contact à sa base avec une électrode à oxygène type « électrode de Clark ». Le milieu d’expérimentation est agité par un barreau magnétique entouré de polyéthylène (PEEK) mu par quatre électro-aimants placés sous la base de chaque chambre en verre. Un
thermorégulateur ou thermostat de haute précision permet un contrôle précis et constant de la température d’expérimentation.
Les chambres sont scellées par deux pistons dont le fond est constitué de titane et possédant en leur centre un orifice capillaire. Ceci permet d’obtenir un espace fermé dans lequel on peut tout de même injecter les substrats et les inhibiteurs grâce à des seringues de haute précision (seringues de Hamilton). Il est primordial que tous les joints et les matériaux en contact avec le milieu d’expérimentation (chambre en verre, mélangeur, fond des pistons) soient totalement inertes vis-à-vis de l’oxygène afin de minimiser les phénomènes
d’absorption et de relarguage (« backdiffusion ») à hautes et basses concentrations d’oxygène respectivement. Ces deux types de phénomènes peuvent être corrigés par une calibration effectuée par titration à l’oxygène (cf. fig. 5). Lorsqu’ils deviennent trop importants, les mesures oxymétriques sont ininterprétables.
Figure 4
L’électrode de mesure (cf. fig. 4)
Il s’agit d’un système comprenant une cathode (pôle négatif) en or entourée d’une anode (pôle positif) en argent. La cathode est étroitement en contact avec la membrane semi-perméable de tefcel (dérivé du téflon). L’oxygène diffuse à travers elle et est réduit en H2O au
O2 + 4H
+
+ 4e- = 2H2O
Le circuit se termine au niveau de l’anode en argent qui est lentement oxydée par le KCl :
Ag + Cl- = AgCl + 1e
-Ce processus dépend, comme déjà mentionné, de la distance de diffusion entre le milieu d’expérience et l’électrode. Cependant d’autres facteurs entrent en jeu comme la température, la viscosité du milieu d’expérience, l’épaisseur et la perméabilité de la membrane, la vitesse de rotation du barreau magnétique.
La réduction de l’oxygène en H2O est un processus qui consomme lui-même de
l’oxygène. Ceci signifie que le signal du flux d’O2 mesuré représente la somme des
consommations du système de mesure (électrode) et du système biologique (fibres musculaires perméabilisées). Le « background » ou « calibration » permet de mesurer la consommation en O2 du système de mesure.
Calibration des flux d’oxygène
La calibration du système, c’est-à-dire la détermination de ses propriétés de base, doit être effectuée aussi fréquemment que possible. En effet, ces propriétés peuvent changer rapidement même sur des périodes aussi courtes que quelques heures. Le problème majeur sur ces petits intervalles de temps est la contamination bactérienne qui peut se traduire par une consommation anormalement élevée d’oxygène. Afin d’éviter ceci, nous remplissons régulièrement les chambres de verre avec de l’alcool 70% et laissons tourner l’appareil pendant une vingtaine de minutes afin de les désinfecter.
Nous avons déjà mentionné que pour mesurer un flux, le système consomme de l’oxygène. La « backdiffusion » d’O2 à basses concentrations est un autre phénomène qui a
son importance. Dans le but de minimiser ce phénomène, il est important de choisir des matériaux possédant une perméabilité minimale à l’oxygène. Ainsi des matières telles que le plexiglas et le téflon sont à proscrire. La calibration nous permet donc de vérifier la fiabilité des mesures oxygraphiques mitochondriales dans les conditions expérimentales.
Plusieurs méthodes sont à disposition pour effectuer une calibration, comme par exemple l’utilisation de produits chimiques tels que l’hydrosulfite de sodium. Nous avons opté pour une autre méthode peut-être un peu moins précise, mais techniquement plus simple aussi. Elle consiste à faire une titration à l’argon (Ar), gaz lourd qui se substitue à l’oxygène dans la chambre d’expérimentation. Après avoir fermé les chambres d’expérimentation, les
variations barométriques de l’air n’ont plus d’influence sur la calibration et seule la pression partielle d’O2 dans l’air au départ (en équilibre avec l’air) est prise en compte pour le calcul de
la concentration d’O2 dans le milieu d’expérimentation. D’autres facteurs tels que la
température, la saturation en vapeur d’eau de l’air sont pris en compte par l’unité de contrôle de l’appareil pour calculer la concentration d’O2 (CO2) dans le milieu et la relation finale entre
tous ces facteurs est :
CO2 = C * (pb- pH2O) / {(101.325-pH2O)*0.20946} * Fm
C = conc. d’O2 dans l’eau en l’équilibre avec l’air à 760mmHg. pb = pression barométrique.
pH2O = pression de la vapeur d’eau dans l’air. Fm = facteur de solubilité de l’oxygène dans un
milieu m donné. La solubilité de l’oxygène (et Fm) diminue avec la salinité du milieu. La température intervient dans le calcul de pH2O.
Nous utilisons un milieu d’expérience composé de mannitol, KCl et de chélateurs ioniques (cf. « Milieux d’expérimentation, substrats et inhibiteurs »). Le facteur de solubilité de ce milieu est estimé à 0.9 (Fm mitomed 2, tel que donné sur une table fournie par les concepteurs de ce milieu).
Protocole de calibration
Chaque fois que l’on change un paramètre du système nous effectuons une calibration. On met en route l’oxygraphe rempli du milieu d’expérimentation. Après avoir baissé les pistons, nous attendons la stabilisation du signal, ce qui peut souvent prendre une vingtaine de minutes (fig. 5.a).
Figure 5.a
Courbe d’oxygène lors d’une calibration. Le signal de consommation d’O2 est représenté sur la figure x. Close : fermeture du piston.
1à 4 : paliers de titration O2. Le premier (1) apparaît
après la fermeture (close) et représente la
consommation du système à 100% d’O2. Les autres
sont crées artificiellement par injection d’Argon (R). Pour obtenir une déplétion totale en O2, nous injectons dans la chambre des myoblastes stimulés ensuite par des substrats (Myoblasts). Remarquer la valeur de conc. O2 avant et après. Noter aussi
l’artéfact provoqué par l’entrée d’une faible quantité d’oxygène lors de l’injection des myoblastes.
Par la suite, trois ou mieux quatre paliers différents de vingt minutes environ sont produits par injection d’Argon dans les deux chambres. Finalement, pour atteindre la valeur de concentration d’O2 la plus basse, on utilise des myoblastes produits en culture que l’on
stimule (stade 3 de la respiration, cf. table 4) au moyen des substrats adéquats. La dérivation du tracé de la courbe de concentration d’oxygène dans la chambre oxygraphique lors de la calibration est représenté dans la figure 5.b et correspond à la consommation d’oxygène en fonction du temps.
Figure 5.b
Courbe de signal (consommation O2) de la
figure x.
R : Argon. 1 à 4 : signaux (soulignés en bleu)
correspondants aux paliers d’O2 de la figure
x.
Chaque injection (Argon, Myoblastes et Substrats) provoque un artéfact dû à la diminution rapide d’O2 dans la chambre.
Noter la respiration des myoblastes, puis leur épuisement à des concentration d’O2 proches
de 0%
Le programme Datlab 2.1® permet l’analyse des datas. On obtient ainsi la relation entre la consommation d’oxygène par le système et la concentration d’oxygène. Cette relation est linéaire (fig. 5.c) et peut donc être représentée par l’équation :
y = a0 + b0 * x
L’intersection de cette droite avec l’ordonnée (a0) correspond à la consommation
située entre –1 et -2 pmol/sec/cm3 (cf. fig. 5.c) pour que les mesures oxygraphiques soient
fiables. Lorsque l’on dépasse cette limite de plus de 1 pmol/sec/cm3, soit dans un sens soit dans l’autre, un contrôle soigné de l’appareil est nécessaire. Si la consommation dépasse –3 pmol/sec/cm3
(c’est-à-dire de –3 à -∞) à une concentration de 0% O2, on doit suspecter une
perte d’imperméabilité du système à l’oxygène de l’extérieur ou une « backdiffusion » trop importante due à l’emploi d’un matériau relarguant de l’oxygène par exemple. Si au contraire, elle est entre –1 et 0 pmol/sec/cm3, il faudra suspecter une contamination bactérienne. Une
valeur plus grande que 0 pmol/sec/cm3 est théoriquement impossible à une concentration de
0% O2 à moins qu’il y ait une erreur mathématique. La pente de cette droite (b0) est
idéalement de 0.025.
Figure 5.c :
Courbe de calibration où la valeur d’intersection a0 = -1.92 et la pente
de la droite b0 = 0.021 selon la
relation y = a0 + b0* x
Constante de temps τ (tau)
La constante de temps nous donne une indication de la vitesse de réponse de l’électrode. En général elle est augmentée lorsque la membrane est défectueuse, par exemple mal adaptée avec une couche trop importante d’électrolyte entre elle et la cathode ou alors lorsqu’elle est contaminée par de la graisse servant à étanchéifier les joints en caoutchouc. Bien entendu, elle peut également être augmentée par une électrode altérée.
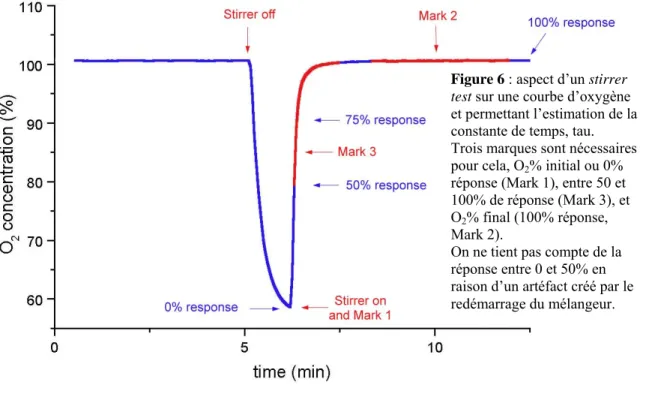
Il existe une méthode très simple pour évaluer tau, c’est le test du mélangeur ou « stirrer test ». Lorsque l’on arrête le mélangeur, on perd l’homogénéité du milieu
d’expérimentation et la concentration d’oxygène diminue rapidement à proximité de
l’électrode qui continue à consommer de l’oxygène (cf. fig 6) ce qui se traduit par une chute de la courbe de concentration sur l’écran. Au redémarrage, l’électrode répond normalement selon une courbe exponentielle définie par l’équation :
yt = A + b * exp(-t/τ)
La constante de temps tau est le temps nécessaire pour atteindre le 63% de la réponse (cf. fig. 6). Techniquement, sur un stirrer test, on considère comme exponentiel
seulement la partie de la courbe située entre 50 et 75% de réponse, le début étant perturbé par le redémarrage du mélangeur. Une valeur pour tau située entre 4 et 6 secondes est suffisante pour nos expériences où l’on n’étudie pas la cinétique rapide de la consommation d’oxygène.
Figure 6 : aspect d’un stirrer test sur une courbe d’oxygène
et permettant l’estimation de la constante de temps, tau. Trois marques sont nécessaires pour cela, O2% initial ou 0%
réponse (Mark 1), entre 50 et 100% de réponse (Mark 3), et O2% final (100% réponse,
Mark 2).
On ne tient pas compte de la réponse entre 0 et 50% en raison d’un artéfact créé par le redémarrage du mélangeur.
La vitesse du mélangeur n’affecte que peu τ contrairement à la température qui en s’élevant diminue linéairement sa valeur. Intuitivement, ceci est en accord avec le processus de diffusion : ce dernier est facilité par des températures plus élevées puisque la viscosité du fluide diminue.
C. Milieux d’expérimentation, substrats et inhibiteurs
Milieux de transport, de préservation et d’incubation
Le Biops est un milieu de relaxation pour les fibres musculaires dans lequel elles sont plongées immédiatement après le prélèvement. Nous les préservons ensuite et les
disséquons dans ce milieu qui reste à 5°C environ (glace mouillée). La composition du Biops est détaillée dans la table 1.
Composé Conc. Finale
CaK2-EGTA 2.77 mM K2-EGTA 7.23 mM Na2-ATP 5.7 mM Ca++ libre 0.1 µM MgCl2 6H2O 6.56 mM Mg ++ libre 1 mM Taurine 20 mM MgATP 5 mM
Na2-PCréatine 15 mM force ionique 160 mM
Imidazole 20 mM
Dithiothreitol 0.5 mM
MES 50 mM Table 1 : Composition du Biops.
Il faut retenir plusieurs éléments de la composition de ce milieu. D’abord la grande quantité de chélateurs qui permettent de maintenir la concentration libre de calcium à un maximum de 0.1 µM, c’est-à-dire proche de la concentration physiologique intracellulaire. On empêche ainsi un éventuel flux calcique intracellulaire qui pourrait générer une
contraction de la fibre musculaire et donc un épuisement des réserves énergétiques, en particulier mitochondriales, ce qui se traduirait finalement en oxygraphie par une respiration diminuée ou altérée. Egalement dans le but d’éviter un épuisement mitochondrial, l’ATP (Mg-ATP) maintient une activité ATPase, notamment myosine-ATPase. Il faut aussi se rappeler que les fibres sont préservées à 5° C de telle manière à ralentir leurs processus métaboliques et maintenir fonctionnelles le plus longtemps possible leurs mitochondries.
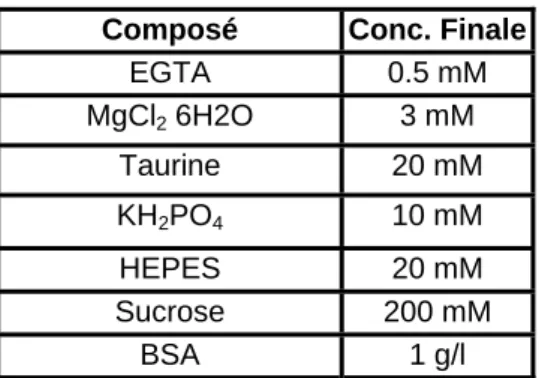
Après saponification, les fibres sont plongées dans un bain de mitomed 1 (cf. table 2) contenant de la BSA pour stopper la réaction avec la saponine. Elles sont stockées dans ce milieu en attendant les mesures d’oxygraphie.
Composé Conc. Finale EGTA 0.5 mM MgCl2 6H2O 3 mM Taurine 20 mM Ca++ libre 0.0 µM KH2PO4 10 mM Mg ++ libre 2.07 mM
HEPES 20 mM EGTA libre 0.44 mM
Sucrose 200 mM force ionique 34 mM
BSA 1 g/l
Table 2 : composition du Mitomed 1
A constater l’absence de calcium libre dans le mitomed 1 et la présence de BSA. Ce milieu peut aussi être utilisé comme milieu d’expérimentation, en particulier avec des mitochondries isolées.
Le milieu d’expérimentation que nous utilisons pour les mesures oxygraphiques est le mitomed 2 (table 3). Ce choix s’explique notamment par l’absence de BSA qui pourrait fausser nos mesures de contenu protéique des fibres, mesures utilisées pour la normalisation des flux respiratoires.
Composé Conc. Finale
Na2-EDTA 0.5 mM
MgCl2 6H2O 5 mM Ca
++
libre 0.0 µM
KH2PO4 10 mM Mg++ libre 3.1 mM
Mannitol 110 mM EDTA libre 0.32 µM
KCl 60 mM force ionique 116 mM
Tris 60 mM
Substrats
Différents substrats sont à disposition selon le type d’expérience oxygraphique que l’on veut mener. Nous définissons ces substrats en fonction des complexes qu’ils vont stimuler.
- Pyruvate
Acide pyruvique (C3H3O3Na), FW (Poids Mol.) 110, concentration de
la solution stock à 1M. Doit être préparé à partir de la poudre pour chaque expérience en raison de son instabilité.
Substrat du Complexe I (NADH déhydrogénase) - Malate
Acide L-malique (C4H6O5), FW 134.1, solution stock à 1M.
Active le cycle de Krebs en augmentant la disponibilité d’oxaloacétate. - Glutamate
Acide L-glutamique (C5H8NO4Na), FW 187.1 (hydreux) ou FW 169.1
(anhydreux), solution stock à 1M.
Substrat du Complexe I (NADH déhydrogénase). - ADP
Adénosine 5’diphosphate (C10H15N5O10K), FW 491.2 ou FW 427.2
(acide libre). Solution stock à 500mM. Sensible à la lumière et à la chaleur (transformation en AMP).
Activateur du stade 3 de la respiration (saturation en substrats et ADP). - Succinate
Acide succinique (C4H4O4Na2 6H2O), FW 270.1, solution stock à 1M.
Substrat du complexe II (Succinate déhydrogénase, SDH).
Inhibiteurs
Différents inhibiteurs sont utilisés. Pour des raisons pratiques de calcul des coefficients de contrôle, nous n’utilisons que des inhibiteurs réversibles. Il existe donc un équilibre entre la forme liée au complexe et la forme libre selon la formule :
L’équilibre est défini par une constante d’équilibre Kd dont nous devons tenir compte dans le calcul des coefficients de contrôle (cf. Analyse du Contrôle Métabolique). Tant que les concentrations d’inhibiteur restent situées en dessous de cette Kd, nous sommes certains d’avoir un effet spécifique sur le complexe étudié. Dans une titration par inhibiteur, la région définie par une concentration plus basse que la valeur de Kd est appelée « domaine non-limitant de l’enzyme ».
Nous testons les activités respiratoires de deux complexes en particulier, car plus fréquemment touchés dans les mitochondriopathies d’après la litérature [1]. Ce sont les Complexes I et IV (NADH déhydrogénase et Cytochrome c oxydase). Les inhibiteurs respectifs que nous avons utilisés sont l’amytal et l’azide.
- Amytal
Amobarbital (C11H17N2O3Na), FW 248.3, solution stock à 200mM.
Sensible à la lumière. A diluer dans de l’éthanol 50%.
Inhibiteur spécifique du Complexe I (NADH déhydrogénase).
- Azide
Azide de sodium (NaN3), FW 65, solution stock à 1M. Substance très
toxique.