MICHELE BROCHU
M
UL
19
;IMMUNOETALONNAGE DE STEROÏDES AVEC ANTICORPS MONOCLONAUX ET TRACEURS ISOTOPIQUES ET NON ISOTOPIQUES
L'ETUDE DES 5ot-STEROIDES-CI9-GLUCURONIDES, METABOLITES
DES STEROIDES-C19 TESTICULAIRES ET SURRENALIENS
Thèse présentée
à L'Ecole des gradués de l'Université Laval
pour 1'obtention
du grade de Philosophiae Doctor (Ph.D.)
FACULTÉ DE MEDECINE UNIVERSITÉ LAVAL
QUÉBEC
DÉCEMBRE 1986
Si j’ai appris une chose au cours de ma longue vie, c’est que tout notre
science, confrontée à la réalité apparaît primitive et enfantine; et pourtant, c'est ce que nous possédons
de plus précieux.
Dans la première partie de cette thèse, nous avons démontré la faisabilité de produire des anticorps monoclonaux contre la progestérone à partir de cellules de myélome de souris et de souris immunisée contre la progestérone liée à 1'albumine
sérique de boeuf. Nous avons obtenu des anticorps monoclonaux que nous avons comparé à des anticorps polyclonaux selon deux méthodes d'immunoétalonnage, le dosage radioimmunologique et le
dosage immunoenzymatique par bioluminescence. Nous avons constaté que dans le dosage radioimmunologique, 11 interaction d'anticorps monoclonaux avec le marqueur iodé est différente de celle o'bservée entre les anticorps polyclonaux et le marqueur iodé. Nous avons pour la première fois observé que la
sensibilité de ce dosage avec les anticorps monoclonaux est proportionnelle à la dilution de 11 anticorps. Un dosage radioimmunologique très sensible peut donc être obtenu aussi bien avec un traceur homologue qu'avec un traceur hétérologue. Les méthodes de dosage par bioluminescence sont aussi sensibles que les dosages par radioactivité et cette méthode permet
d'éliminer l'étape de séparation de la fraction liée et celle non liée.
Dans la deuxième partie de cette thèse, nous avons étudié les conjugués stéroïdes-glucuronides dans le but de déterminer si ces métabolites pouvaient fournir une information pertinente sur les trans forma tions des stéroïdes-C19 en périphérie. Nous avons donc mesuré les concentrations plasmatiques de stéroïdes et de leur dérivé glucuronide en fonction de l'âge et en fonc tion de différentes pathologies telles que 1'hirsutisme et l’hyperplasie bénigne de la prostate. De plus, nous avons déterminé l'effet du Flutamide sur les niveaux de stéroïdes- glucuronides circulants chez des patients castrés atteints d'un
cancer de la prostate traités avec le Elut amid e.
Les 5a-stéroïdes-C19-glucuronides (androstérone-glucuronide et androstane-3 a, 17g diol-glucuronide) sont présents en plus grande concentration que leur correspondant non conjugué. Les résultats obtenus ont également démontré que chez l'homme,
1'androstérone-glucuronide est le dérivé glucuronidé dont les concentrations sériques sont les plus élevées. Ces stéroïdes conjugués sont donc plus faciles à dé terminer et sont un meil leur reflet du métabolisme des stéroldes-C19 surrénaliens et testiculaires. Nous constatons de plus que la mesure d'un seul stéroïde glucuronidé n'est pas suffisante pour constater une anomalie métabolique.
REMERCIEMENTS
VI
Cette thèse est 1'accomplissement de quatre années qui furent agréables et enrichissantes grâce à la collaboration de plusieurs amis et collègues. Je ne saurais terminer cette étape sans leur exprimer toute ma gratitude.
Tout d'abord, je voudrais remercier mon directeur de thèse, Alain Bélanger, qui m'a guidée tout au long de ces années , qui a
su stimuler ma curiosité intellectuelle et fournir les encoura gements nécessaires. Je lui suis reconnaissante de m'avoir donné l'opportunité d'assister à plusieurs congrès scienti fiques.
Je remercie également Fernand Labrie sans qui le laboratoire d'endocrinologie moléculaire ne serait pas ce qu'il est, un
laboratoire où règne une ambiance scientifique remarquable et où plusieurs facilités nous sont offertes .
Les contacts avec plusieurs chercheurs séniors, assistants de recherche et techniciens m'ont permis d'enrichir mes connais sances scientifiques et leurs conseils judicieux ont été très utiles pour 1'élaboration de mes protocoles. Je voudrais remer cier en particulier, Simon Caron qui, par son ardeur au travail, fut pour moi un exemple. Je lui suis redevable pour son aide à 1'animalerie et sa grande disponibilité pour répondre à mes
interrogations. Je suis très reconnaissante envers André Dupont qui a accepté la prélecture de ma thèse et l'a corrigée avec célérité. Dans mon travail sur les femmes hirsutes, la collabo ration de Roland Tremblay fut grandement appréciée de même que celle d'André Dupont, au niveau de la clinique du cancer de la prostate. Je remercie aussi Suzanne Croft pour sa disponibilité lors des prélèvements sanguins.
VII
Je ne pourrais passer sous silence le travail d'Ann Lorrain et de Raymonde Veilleux dans la mise au point et la production d'anticorps monoclonaux. Je remercie Ann pour son amitié et Raymonde pour ses judicieux conseils et son humour.
Chaque membre du groupe des stéroïdes, par son enthousiasme au travail, son esprit d'équipe et sa disponibilité a permis de maintenir une ambiance joviale au sein du groupe. Je remercie plus particulièrement ceux du S-139 pour leur encouragement const ant.
L'équipe de Montpellier, Jean-Claude Nicolas, Béatrice Térouanne et Anne-Marie Boussioux, mérite toute ma reconnais sance pour leur collaboration dans les techniques de mise au point de bioluminescence. Grâce à eux, mon séjour à ce labora toire fut très agréable.
Je remercie Jean Ouellet, Robert Girard, Kathleen Hall et Anne Borgeat ainsi que Sylvie Devault et Bertrand Vaillancourt respectivement en illustration et en photographie. Merci aussi à Paulette Paquet pour son dévouement.
L'excellente qualité dactylographique de cette thèse est l'oeuvre d'Elaine Leclerc et de Josée Poulin. J'apprécie énor mément tout le travail qu'elles ont fait et leur disponibilité. Je remercie aussi Dorothée Matthieu, Hélène Rodrique et Hélène Gagnon pour les nombreux services de secrétariat qu'elles m'ont rendus.
Toutes ces études ont été rendues possibles grâces à une bourse du F.C.A.R.
VIII
AVANT-PROPOS
Ce travail est divisé en deux parties , la première portant sur les immunoét alonnages de stéroïdes réalisés avec des anti corps monoclonaux, la deuxième traitant de la présence de stéroldes-g lueuronides dans le plasma et de leur importance comme marqueur du métabolisme des androgènes. Chaque section comprend une introduction générale rédigée en français, résumant l'état des connaissances dans le domaine. Pa*r la suite, chaque chapitre est composé d'une courte introduction en français résu mant le manuscrit et est suivi de l'article rédigé dans la lan gue d'édition, soit l'anglais car il est déjà publié ou soumis à un périodique scientifique. Finalement, pour chacune des sec tions, une conclusion générale en français résume les aspects essentiels qui ont été soulevés par les différents articles. La bibliographie ne fait référence qu'aux ouvrages cités dans l'in troduction et la conclusion de chaque section.
IX
TABLE DES MATIERES
REMERCIEMENTS VI
AVANT-PROPOS VIII
TABLE DES MATIERES ...IX LISTE DES ABREVIATIONS ... XIII SECTION I: IMMUNOETALONNAGE DE STÉROÏDES AVEC ANTICORPS
MONOCLONAUX ET TRACEURS ISOTOPIQUES ET NON
ISOTOPIQUES ... 1
1. DOSAGE IMMUNOLOGIQUE 1.1 Introduction ... ... . 2
1.2 Principe de base ... 3
1.3 Mise au point de 11 immunoêtalonnage ... 6
1.3.1 Marquage d'un antigène ... 6
1.3.2. Production d'anticorps spécifiques à 1 ' antigène ... ... ... 9
1.3.2.1 Structure des anticorps ... 9
1.3.2.2 Obtention des anticorps ... 10
1.3.3 Méthode de séparation entre le complexe anticorps-antigène et 11 antigène non lié.... 13
1.3.4 Applications des dosages immunologiques .... 14
1.3.4.1 Applications en clinique ... 14
1.3.4.2 Applications en recherche ... 15
1.4 Anticorps monoclonaux ... . 16
1.4.1 Historique ... ... ... 16
1.4.2 Principe de la technique des anticorps monoclonaux ... 17
1.4.3 Anticorps monoclonaux et anticorps polyclonaux ... 20
1.4.4 Application des anticorps monoclonaux ... 21
1.4.4.1 Applications en médecine clinique . 21 1.4.4.2 Applications en recherche ... 22
2. BIOLUMINESCENCE 2.1 Introduction ... ... ... . 24
2.2 Dosages enzymatiques ... 25
2.2.1 Dosage de l'ATP et de ses dérivés ... 25
2.2.2 Dosage de NAD(P)H et de ses dérivés ... 25
2.3 Dosage immunologique par bioluminescence ... 26
2.3.1 Introduction ... 26
X
CHAPITRE 1
Utilisation d'anticorps monoclonaux contre la proges térone dans les radioimmunoêtalonnages avec différents traceurs iodés
1. Introduction ... ... 31
2. Article ... 33
CHAPITRE 2 Immunoétalonnage bioluminescent de progestérone: étude comparative de trois méthodes de dosage 1. Introduction ... ... 54
2 . Article ... . 5 5 CHAPITRE 3 Dosage immunoenzymatique bioluminescent pour la proges térone avec des anticorps monoclonaux 1. Introduction ... 75
2. Article ... 77
CONCLUSION ... 96
REFERENCES ... 9 8 SECTION II: L'ÉTUDE DES 5a-STÉROIDES-Cl9-GLUCURONIDES, MÉTA BOLITES DES STÉR0IDES-C19 TESTICULAIRES ET SURRÉNALIENS 1 . Introduction ... 103
2. Etapes de glucuronidation ... . 103
2.1 Réactions chimiques ... 103
2.2 Structure du glucuronide ... 105
3. Enzyme g lucuronyl transféra se ... 107
3.1 Localisation ... 107
3.2 Spécificité de la glucuronyltransférase ... 108
4. Hydrolyse des glucuronides par la g-glucuronidase ... 109
4.1 In vivo ... 109
4.2 In vitro ... 110
XI
6. Importance des 5a-stéroïdes-CI9-glucuronides ... 112 6.1 Historique ... 112 6.2 Glucuronidation des 5a-stéroïdes ... 114 6.3 5a-stéroîde-glucuronide: marqueur de l'activité
androgénique ... 117 6.3.1 Influence de l'âge et du sexe sur les
niveaux plasma tiques et urinaires des
5a-s téro'îdes-glucuronides ... 117 6.3.2 Apport des surrénales et des gonades dans
la formation des 5 a-stéroldes-Cl9-
glucuronides ... 118 7. Les stéroïdes-glucuronides et les pathologies reliées au
métabolisme des stéroîdes-C19 ... 118 7.1 Les 5a-stéroïdes-C19-glucuronides chez des patients
atteints d'hyperplasie bénigne de la prostate ... 118 7.2 Les 5 a-stéroîdes-Cl9-glueuronides dans 1’hirsutisme.120 7.3 Effets de l'administration d'un antiandrogène sur
les niveaux plasmatiques des 5 or*s tér oîdes-Cl9- glucuronides chez les patients avec un cancer de
la prostate .... ... 12 3 8. Méthodologie ... ... 12 5 CHAPITRE 1
Concentrations plasmatiques des stéroïdes-glucuronides en fonction de l'âge chez l'homme.
1. Introduction ... . 127 2. Article ... 128 CHAPITRE 2
Relation entre les concentrations plasmatiques des 5 a- stéroîdes-C19-glucuronides et celles des stéroïdeS-C19 d'origine testiculaire et surrénalienne chez les jeunes garçons.
1. Introduction ... ..145 2. Article ... 146 CHAPITRE 3
Apport des surrénales et des gonades dans la formation des 5 a~s téro'îdes-glucuronides .
1 . Introduction ... ... 16 4 2 . Article ... 165
XII
CHAPITRE 4
Etude comparative sur les concentrations plasmatiques des stéroïdes et de leur glucuronide chez des hommes atteints d * hyperplasie bénigne de la prostate et chez des hommes no rmaux.
1. Introduction ... 185 2. Article ... 187 CHAPITRE 5
Concentrations plasmatiques des stéroîdes-Cl9 et des 5 a- stéroîdes-Cl9-glucuronides chez les femmes hirsutes hyper- androgéniques et idiopathiques
1. Introduction ... 20 8 2. Article ... 209 CHAPITRE 6
Effets du Flutamide et de 1'Aminoglutéthimide sur les concentrations plasmatiques des 5 a-stéroxdes-C19- glucuronides chez des patients castrés atteints d'un cancer de la prostate.
1. Introduction ... ... 23 3 2. Article ... 235
CONCLUSION ... 253
XIII
LISTE DES ABREVIATIONS Hormones et produits ACTH ADT AG AMP ATP DHEA DHEA-S DHT El E2 ELU FSH G GH GMP cyclique hCG LH LSD Prég 170H-Prêg Testo T3 T4 3a-dloi 3g-diol 4- ene-dione 5- ene-dio1 Divers Ac Ag HBP HH HI RIA BEI A g ng ml SEM Hormone adrénocorticotrope An dros térone Aminoglutéthimide
Acide adénosine 3', 5'-phosphorique cyclique Adénosine triphosphate Déhydroépiandrostérone Déhydroépiandrostérone—sulfate Dihydrotestostérone Estrone Estradiol F lutamide
Hormone folliculo-s timulan te Glueuronide
Hormone de croissance
Acide guanosine 3’, 5’-phosphorique cyclique
Hormone chorionique gonadotropine Hormone lutéinisante
Acide diéthylamine lysergique Prégnénolone
17-hydroxy-prégnénolone Testostérone
Triiodothyronine Thyroxine
Androstane 3 a,17 g-diol Andros tane 3 g, 1 7 g-dio 1
And ro s t-4-ene-3,17-dione Androst-5-ene-3 g,17g-diol
Anticorps Antigène
Hyperplasie bénigne de la prostate Hirsute hyperandrogénique
Hirsute idiopathique Dosage radioimmunologique
Dosage immunoenzymatique bioluminescent Gramme
Nanograme Millilitre
IMMUNOETALONNAGE DE STEROÏDES AVEC ANTICORPS MONOCLONAUX ET TRACEURS ISOTOPIQUES ET NON ISOTOPIQUES
2
1. POSAGE IMMUNOLOGIQUE
1.1 Introduction
Au début des années 50, un nouveau procédé a été mis au point pour l'étude in vivo du métabolisme en se servant de pro téines marquées à l'aide d'un produit radioactif (Berson et Yalow, 1953). Au moyen de 1'insuline marquée, Berson et ses collaborateurs (1956) ont observé que des anticorps contre l'in suline étaient présents dans le plasma de sujets diabétiques insulino-dépendants. Ils ont aussi noté que 1'insuline marquée pouvait être déplacée de 1'anticorps par une grande quantité d'insuline non marquée et que la quantité de traceur lié dépen dait de la quantité totale d'insuline. Yalow et Berson (1959, 1960) ont, par la suite, mis à profit ces réactions immunologi ques entre 1'insuline et son anticorps pour développer une tech nique radioisotopique de détermination quantitative in vitro. C'était le début des radioimmunoétalonnage s, une découverte qui devait mériter à l'un de ses auteurs, le Dr R. Yalow, le Prix Nobel de la médecine en 1977.
Quelques années plus tard, Ekins décrivait une technique semblable en utilisant une protéine liante soit la "Thyroxin Binding Globulin" à 1'instar d'un anticorps, et qui permettait de mesurer la thyroxine (Ekins, 1960).
Ces dosages radioimmunologiques offraient plusieurs avanta ges par rapport aux dosages biologiques classiques. L'émission énergétique de forte intensité, propriété du composé radioactif, permettait de détecter d'infimes quantités de protéines avec un équipement simple et ce, de façon précise. Dans le cas d'hormo nes présentes dans le plasma en faible concentration, cette nou velle technique sensible et spécifique devait s'avérer déter minante pour l'étude des mécanismes de sécrétion et de synthèse
3
des hormones ainsi que des endocrinopathies. De plus, cette technique était applicable à un grand nombre de substances naturelles ou synthétiques aussi bien en endocrinologie qu'en pharmacologie, en immunologie ou en hématologie. De nombreux dosages ont aussi été développés pour une diversité de
substances, des petites molécules comme les stéroïdes jusqu'aux protéines de poids moléculaire élevé.
1.2 Principe de base
Le principe du dosage immunologique est relativement simple: une substance à doser contre laquelle a été développée un anti corps, lorsque mis en présence de cet anticorps, formera un complexe antigène-anticorps dont la liaison obéira à la loi d'action de masse. Ce principe peut être simplement illustré par la réaction réversible suivante:
(équation 1) Ac + Ag
où Ac est l'anticorps, Ag, l'antigène (substance étrangère à l'organisme hôte) et Ac-Ag, le complexe antigène-anticorps.
Au départ, lorsque l'anticorps et l'antigène sont mis en contact, la vitesse de réaction pour former le complexe est plus grande que la vitesse de dissociation du complexe:
Ac + Ag --- - Ac-Ag (équation 2)
Au fur et à mesure que la réaction progresse, les concentra tions des anticorps et des antigènes non liés diminuent de même que la vitesse de formation du complexe. De l'autre côté, la concentration du complexe Ac-Ag et la vitesse de dissociation du complexe augmentent. Si la réaction se poursuit assez long
temps, un équilibre est atteint et le nombre de molécules de complexe formées est équivalent au nombre de molécules
disso-4
ciées, donc la vitesse de formation est égale à la vitesse de dissociation:
(équation 1) Ac + Ag
Dans les dosages immunologiques, il est préférable que le temps de réaction soit assez long pour atteindre 11 équilibre. Cette situation d'équilibre décrit par la loi d'action de masse est définie par une constante d'affinité qui est le rapport entre la concentration du complexe et le produit des deux con centrations de substrats :
[Ac-Ag] K =
---[Ag][Ac]
où [Ag], [Ac] et [Ac-Ag] sont les concentrations de 1’antigène, de 1'anticorps et du complexe antigène-anticorps.
Cette constante d'affinité (K) est une caractéristique de 1'anticorps. A 1'équilibre, pour une quantité donnée d'anti corps ayant une K déterminée, le rapport d'antigène lié sur celui non lié dépend de la concentration totale d'antigène pré sent. Ceci est le principe de base des essais immunologiques.
Lors d'un dosage, une concentration définie d'antigène mar qué par un isotope radioactif est introduite et entre en
compétition avec 1'antigène non marqué pour la liaison avec une concentration d'anticorps insuffisante par rapport aux
antigènes :
Ag* + Ag + Ac-Ag* + Ac-Ag (équation 3)
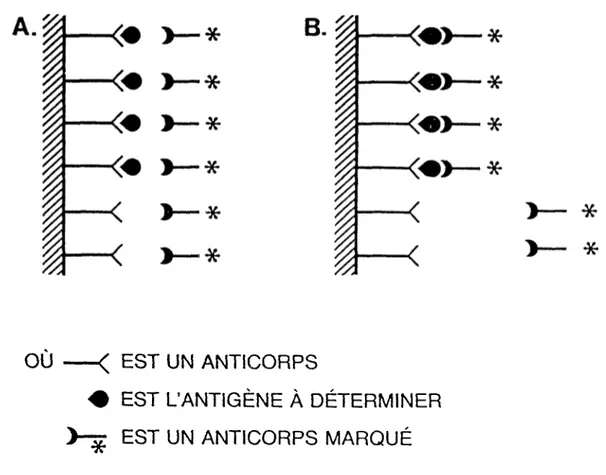
5 Lorsque la concentration d'antigène à déterminer augmente, les possibilités pour l’antigêne marqué de se lier diminuent (figure 1). De cette façon, en faisant une courbe du
pourcentage de liaison de l'antigène marqué en fonction de différentes concentrations connues d’antigène non marqué, une concentration inconnue dans un échantillon peut être déterminée par simple lecture sur la courbe d’étalonnage.
FIGURE 1. Dosage par immunoétalonnage.
<* <*
<
3
* <*
<]* <*
< <3
V OU 50% DU MARQUEUR LIE < EST L’ANTICORPSA
L'ANTIGÈNE À DÉTERMINERA*
L'ANTIGÈNE MARQUÉ<* <* <
3
*
<* <]*
< <3 <
<3
<1
<3
33* <]* <3*
33
* <
3
* <
3
*
tl <3 <3
<1 <1 <3
33% DU MARQUEUR LIÉ1.3 Mise au point de 1'immunoétalonnage
Les dosages immunologiques nécessitent certaines prépara tions et mises au point:
a) marquage d'un antigène;
b) production d'un anticorps spécifique à l'antigène;
c) méthode permettant de séparer le complexe anticorps-antigène de 1'antigène non lié à la fin de la réaction.
1.3.1 Marquage d'un antigène
L'incorporation d'un antigène marqué dans le dosage est une technique efficace pour mesurer la distribution entre la frac tion liée et celle non-liée. Plusieurs types de marquage exis tent et sont identifiés selon le type de réaction physico-chimi que auquel ils font appel soit la radioactivité, la fluorescence ou la réaction enzymatique.
Le marquage radioactif a été et est encore 1'immunoétalonna- ge le plus utilisé. Les traceurs radioactifs peuvent être divi sés en deux catégories : ceux avec marquage interne et ceux avec marquage externe. Dans le marquage interne, un élément figurant naturellement dans la molécule antigénique est remplacé par un atome radioactif chimiquement identique. Dans le marquage externe, un atome radioactif est lié de façon covalente à un atome de la molécule antigénique. La liaison d’un isotope à
1 * antigène ne doit pas affecter l'immunoréactivité de 1 ’ antigè ne , autrement dit sa capacité de lier l'anticorps ne doit pas être diminuée. L'activité spécifique qui est définie comme la radioactivité émise par unité de masse ou mole d'antigène (mCi/p g) doit être assez élevée pour permettre de mesurer une quantité minimale d'antigène marqué. Toutefois, une activité
7
spécifique trop élevée provoquerait de la radiolyse et nuirait ainsi à la stabilité de la molécule.
Parmi les marqueurs internes, le tritium [3H], un émetteur 0 de faible énergie, peut remplacer un atome hydrogène. Le
tritium est présentement 11 isotope radioactif le plus utilisé pour le marquage de petites molécules telles que les stéroïdes. La détection du tritium s * effectue en milieu liquide, soit un liquide scintillant qui amplifiera 1'énergie émise par cet isotope.
Parmi les traceurs de marquage externe, l'iode 125 [ 12 5I] , un émetteur de photon de basse énergie est très utilisé pour les peptides et fréquemment pour les petites molécules. Son
activité spécifique est élevée, ce qui en fait un bon marqueur. Parmi les méthodes d'introduction de 1*isotope radioactif, 12^I, plusieurs techniques sont utilisées dont les principales sont décrites ci-dessous.
L1 incorporation d'un iode radioactif dans une molécule peut se faire par substitution sur des acides aminés par exemple, la tyrosine, l'histamine, la thyramine ou sur une structure iodable d’un peptide. Cette substitution est possible à l'aide de la chloramine T qui est un agent oxidant puissant capable de rendre le sel d'iode en une forme plus réactive (I2)• C'est une
réaction simple où il suffit de préparer une solution de
peptide, d'iodure de sodium [ 1 2 5I ] et de chloramine T. Un agent réducteur, le métabisulfite de sodium, est ajouté pour arrêter la réaction afin d'éviter la dégradation de la molécule.
L'enzyme lactoperoxidase (EC 1.11.1.7), en présence de trace de peroxide d'hydrogène, est aussi utilisée pour 1'iodation. Cette méthode a 1'avantage de ne pas exposer l'antigène à des oxidants forts comme la chloramine T et ne requiert pas d'agent réducteur. Par contre, la préparation des réactifs et les
techniques sont plus élaborées que celles de 1’introduction par chloramine T.
8
L'iodogène (1,3,4,6 têtrachloro-3 a,6 a-diphenyl-glycouril), un agent oxidant peu soluble, est évaporé d’une solution de chlorure de méthylène, sur les parois d'un tube. L1 antigène et l'iode radioactif sont ajoutés au tube. La fin de la réaction se produit sans agent réducteur en enlevant le mélange du tube.
Finalement, un couplage avec une molécule marquée à l'iode radioactif est utilisé pour des peptides oxydables ou des peti
tes molécules comme les stéroïdes. Le porteur peut être iodé avant ou après conjugaison avec le ligand. Cette technique offre plusieurs avantages, 1'antigène n'est pas exposé aux dom mages associés par les réactions d'iodation et elle peut être appliquée à des peptides qui n'ont pas de résidu tyrosine ou à de petites molécules. Par contre, le traceur substitut étant beaucoup plus gros qu'un seul atome d'iode, des altérations de la réaction antigène-anticorps peuvent se produire.
L'introduction de l'iode radioactif à des molécules comme les stéroïdes exigent la préparation de dérivés portant un grou pement iodable. Ce dérivé peut avoir une structure similaire ou presque au dérivé utilisé pour 1'antigène. Avec des anticorps polyclonaux contre les stéroïdes, si les éléments de liaison (le bras) entre le stéroïde et la molécule porteuse d'iode sont
identiques à ceux entre ce même stéroïde et la molécule
d'immunogène, le marqueur peut lier fortement 1'anticorps mais une grande quantité de stéroïde non marqué est requise pour déplacer le marqueur. Puisque 1'anticorps a une affinité aussi pour le complexe stéroïde-bras, la sensibilité du dosage est donc diminuée. Si un marqueur ayant un bras de nature
différente de 1'immunogène est utilisé, le dosage est plus sensible. Ainsi, la structure du bras peut influencer la réaction antigène-anticorps, et de ce fait, la sensibilité du dosage. Plusieurs études ont été publiées sur les interactions entre les anticorps polyclonaux et différents traceurs iodés (Allen et Redshaw, 197 8 ; Scarisbrick et Cameron, 1975 ). Le chapitre 1 de cette thèse est d'ailleurs
consacré à l'étude de ces interactions avec des anticorps mono clonaux.
1.3.2 Production d'anticorps spécifiques à l'antigène
1.3.2.1 Structure des anticorps
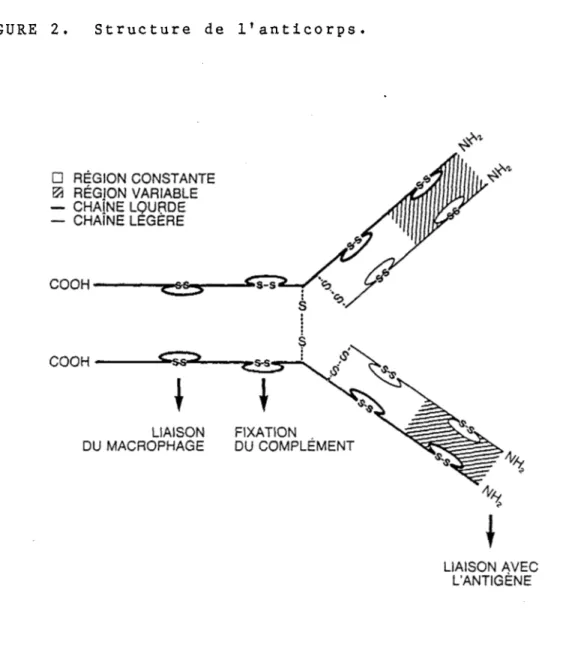
Tant la diversité et que la spécificité des anticorps ont suscité beaucoup d'intérêt chez les immunologistes. Dans les années 60, ces protéines sériques de la classe des immunoglobi- nes furent beaucoup étudiées et la structure de l'anticorps fut précisée (Edelman, 1970; Fleischman et coll., 1963; Putnam,
1969). Les molécules sécrétées par les lymphocytes B sont composées de quatre chaînes polypeptidiques; deux chaînes lourdes identiques (55 à 90 kilodaltons) et deux légères identiques (environ 25 kilodaltons) reliées par des ponts disulfures (figure 2). Chacune de ces chaînes est divisée en deux régions: une constante et une variable. La région dite constante est identique pour certaines classes d'anticorps (2 types de chaînes légères et 8 types de chaînes lourdes). C'est la partie carboxyle terminale de la chaîne et elle contient des sous-unités d'environ 110 acides aminés avec un lien disulfure intrachaîne par sous-unités. Cette région constante joue un rôle dans la fixation du complément, la liaison du macrophage et
d'autres fonctions biologiques. La région variable est la partie amino terminale de la chaîne et elle contient 100-120 acides aminés avec un lien intrachaîne disulfure. Cette région est responsable de la liaison avec l'antigène. L’hétérogénéité de cette région permet une grande variation de la structure
tri-dimensionelle, donnant la spécificité de l'interaction antigène-anticorps.
10
FIGURE 2. Structure de l’anticorps.
□ RÉGION CONSTANTE 8 RÉGION VARIABLE — CHAINE LOURDE — CHAINE LEGERE COOH COOH LIAISON DU MACROPHAGE FIXATION DU COMPLÉMENT LIAISON AVEC L’ANTIGÈNE
1.3.2.2 Obtention des anticorps
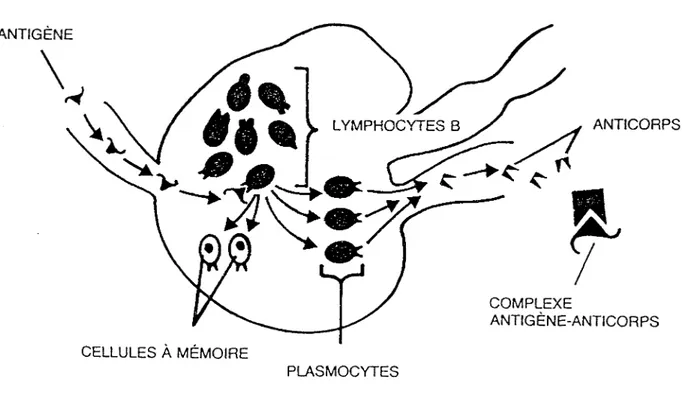
Le système immunitaire étant très complexe, nous ne donne rons ici que quelques notions utiles à la compréhension de la production d'anticorps. Il est connu qu'une stimulation antigé nique chez un animal entraîne la prolifération des cellules B qui se différencient en cellules sécrétant des anticorps,
processus schématisé dans la figure 3. Un antigène (substance étrangère à 1'organisme hôte) atteint les tissus lymphoïdes, soit la rate ou les ganglions lymphatiques et stimule certains lymphocytes B qui entreprennent une division cellulaire puis se différencient en plasmocytes. Ces derniers produisent des
11
et les libèrent dans le sang et la lymphe afin de lier la sub stance étrangère à 1'organisme et de 1'annihiler. Certains
autres lymphocytes B ne se différencient pas mais deviennent des cellule-s à mémoire. Ces cellules pourront répondre rapidement lors d'une seconde exposition à 1 * antigène.
FIGURE 3. Production d'anticorps par le système immunitaire.
CELLULES À MÉMOIRE
PLASMOCYTES
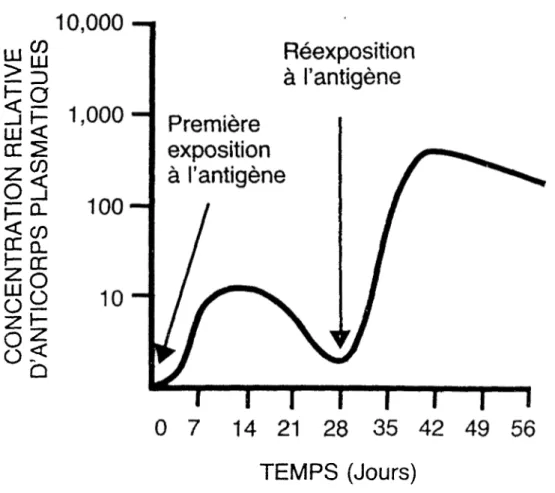
La figure 4 illustre les concentrations plasmatiques d'anti corps lors d'une réponse immunitaire. Suite à une première
exposition à 1'antigène, la réponse est lente et plusieurs jours s'écoulent avant que la concentration d'anticorps devienne suf fisamment grande pour être efficace. Lors d'une seconde exposi tion au même antigène, la concentration d'anticorps augmente plus rapidement grâce aux cellules à mémoire. Il est à noter que chaque clone cellulaire produit un anticorps spécifique.
CONCE
NTRA
TION
RE
LA
TIV
E
D
’
ANT
ICORPS
PLA
SMAT
IQUES
12FIGURE 4. Concentration plasmatique d'anticorps en fonction du temps et selon la stimulation antigénique.
10,000
Réexposition
à l’antigène
Première
exposition
à l’antigène
i—n
i—i—i
14
21
28
35
42
49
56
TEMPS (Jours)
13
Les anticorps pour les dosages immunologiques sont obtenus à partir de sérum d’animaux comme par exemple le cobaye, le lapin, la chèvre, etc. Pour cela l’antigène est injecté à l’animal en présence d'une substance auxiliaire d'immunisation appelée adju vant. Les petits antigènes de poids moléculaire inférieur à environ 5000, par exemple les stéroïdes, ne sont pas immunogènes par eux-mêmes. Ils doivent être couplés à une substance de
poids moléculaire plus élevé. Plusieurs revues de la littératu re ont porté sur la production d’anticorps de stéroïdes afin d'arriver à une spécificité acceptable. Il est maintenant
reconnu que le bras de couplage doit préférentiellement se lier en position 6, 7, 11, 12 ou 15. L’albumine bovine sérique est fréquemment utilisée comme molécule associée, stimulant la réponse antigénique.
Quelques jours après l'injection de l’antigène, les anti corps apparaissent dans le sérum, le système immunitaire est donc activé. Plusieurs injections répétées permettent d’obtenir un antisérum spécifique et contenant différentes populations d'anticorps dirigés contre différentes structures immunitaires de l'antigène. Ces anticorps en grande concentration peuvent avoir des affinités différentes.
1.3.3 Méthode de séparation entre le complexe anticorps-antigè ne et l'antigène non lié.
Dans les dosages immunologiques, lorsque l'équilibre est atteint entre l'antigène lié et celui non lié, une séparation est parfois nécessaire. La méthode de séparation idéale ne doit pas modifier l'équilibre de la réaction, tout en permettant une séparation totale dont la simplicité, la rapidité d’exécution et la reproductibilité en sont les caractéristiques majeures. La séparation dans un dosage radioimmunologique de petits antigènes peut être basée sur 1'adsorption de l'antigène tritiê non lié. Le charbon actif traité au dextran est un bon adsorbant et est
14
du complexe anticorps-antigène par un deuxième anticorps dirigé contre le premier anticorps ou par un agent dénaturant par
exemple le polyéthylène glycol (PEG) , sont les méthodes les plus couramment utilisées. Ces séparations entraînent 1'apparition de deux phases, une solide et une liquide. Le surnageant, après centrifugation, est séparé du culot par décantation et la radio activité est déterminée dans l'une de ces deux phases.
Lorsque le marqueur est enzymatique, certains dosages homo gènes ne nécessitent pas de séparation. Ce système exploite un changement enzymatique lorsque 1 'antigène marqué par 1'enzyme est lié ou non lié à 11 anticorps. Ceci est la base du système EMIT (enzyme multiplied immunoassay technic) très populaire pour la détermination de petites molécules à haute concentration
(Rubinstein, 1972).
1.3.4 Applications des dosages immunologiques
En théorie, le dosage radioimmunologique est applicable à tous les antigènes et toutes les petites molécules dont le cou plage avec une molécule porteuse est résolu. En pratique, c’est une méthode grandement utilisée aussi bien dans le domaine de la recherche que dans le domaine de la médecine clinique.
1.3.4.1 Applications en clinique
La méthode de dosage radioimmunologique a été mise au point pour le dosage de 1'insuline' chez des patients diabétiques insu- lino-dépendants (Yalow et Berson, 19 60) . Depuis, cette techni que s'est étendue à un ensemble d'hormones protéiques (GH, TSH, FSH, LH, ACTH et prolactine), d'hormones thyroïdiennes et de stéroïdes.
Les exemples suivants de 1'utilisation du RIA représentent un éventail de leur application recueilli dans les domaines les
15
plus importants à l'heure actuelle. En endocrinologie, les RIA développés pour les différentes hormones impliquées dans la fonction thyroïdienne permettent de localiser le niveau du défi cit hormonal et ainsi d'obtenir un diagnostic précis. Ainsi, l'hormone hypothalamique (thyrotropine releasing hormone, TRH) l'hormone hypophysaire (thyroid stimulating hormone, TSH), les hormones thyroïdiennes (triiodothyronine, T3; thyroxine, T4) et enfin la protéine de transport (thyroxin-binding globulin, TBG) peuvent être dosées.
En gynécologie, le dosage de la progestérone, de l'estra diol, de la FSH et de la LH plasmatique permet de prédire
rapidement l'ovulation, renseignement utile pour la fécondation in vitro.
En virologie, l'antigène de l'hépatite B est dosé par RIA. En hématologie, on dose la vitamine B12 ainsi que les fibrinogè
nes et les plasminogènes. En pharmacologie, la concentration de médicaments circulants dans le sang peut être mesurée et permet un réajustement de la posologie. Afin de détecter la toxicoma nie, les drogues, par exemple LSD, peuvent être dosées dans l'urine ou le sang.
1.3.4.2 Applications en recherche
Grandement utilisée dans les laboratoires de recherche en endocrinologie, cette technique permet d'étudier avec précision la régulation des hormones humaines ou animales et des média teurs cellulaires (AMP cyclique, GMP cyclique). C'est également un outil pour suivre l'activité biologique de nouvelles molécu les aussi bien que celle de molécules synthétiques. En immuno logie, elle est un bon outil pour mesurer l'influence de proto cole d'immunisation sur la réponse immunitaire et étudier les réactions antigène-anticorps. En histologie, les hormones
intracellulaires sont localisées par immunofluorescence avec des antisérums dont la spécificité est contrôlée par RIA.
16 1.4 Anticorps monoclonaux
1.4.1 Historique
Au début des années 70, la diversité des anticorps telle qu* exprimée par leur nombre et leur spécificité restait intri gante. Comment pouvait-on obtenir une telle diversité dans un seul individu? Les premières études sur la nature chimique de l'anticorps avaient clairement démontré la présence de structu res d’anticorps très diversifiés au niveau de la région varia ble. Afin d'expliquer cette hétérogénéité élevée, la recherche s'est dirigée vers la génétique des cellules somatiques.
L'hypothèse émise par Milstein et Pink (1970) qui associait la diversité des anticorps aux rearrangements du DNA durant la différenciation des cellules souches en cellules sécrétant des anticorps demeurait à vérifier. Afin d'étudier la réponse immunitaire, il fallait cependant trouver un système simplifié rendant possible l'étude du système immunitaire au niveau
cellulaire.
En 1967, Potter et Lieberman avaient étudié un désordre du système lymphocytaire: le myélome. Cette tumeur constituée de cellules sécrétant des anticorps survient spontanément chez l’animal. Cependant, elle peut être induite chez la souris par injection d'huile minérale. Ce système était avantageux
puisqu'il était immortel, la tumeur pouvant être passée d'un animal à l'autre indéfiniment et même maintenue en culture in vitro. Après induction par l'huile minérale, une immunoglobuline
(protéine myélome) est produite et sécrétée, cependant elle ne possède pas une fonction définie d'anticorps. L'induction ne dépendait donc pas des antigènes et aucun anticorps n'était produit. Ce modèle permettait d'étudier les transformations cellulaires mais sans production d'anticorps.
17
Une autre méthode d’isoler les cellules normales sécrétant des anticorps fut proposée par 1'équipe d1Askonas (Askonas et coll., 1970). Des souris étaient immunisées contre un antigène, puis leur rate était prélevée et une suspension de cellules préparée. Cette suspension de 1 à 5 x 106 cellules de rate était injectée avec 1'antigène par voie intraveineuse à une
souris rendue immuno-incompétente suite à des irradiations. Ces cellules proliféraient et produisaient des anticorps, ensuite elles étaient à nouveau prélevées, une nouvelle suspension préparée était injectée avec 1'antigène dans une autre souris immuno-incompétente. Ainsi, plusieurs passages étaient effec tués entraînant la prolifération et 11 expansion du clone origi nal. Une préparation monoclonale était essentiellement obtenue. Mais les cellules de rate ne sont pas immortelles et ne vivent pas en culture.
Suite aux études des groupes de Potter et d'Askonas,
Milstein et ses collaborateurs ont poursuivi leurs travaux sur la compréhension du système immunitaire en combinant les avanta ges de ces deux techniques (Kohler et Milstein, 1975 ) . Ils fusionnèrent des cellules de myélome induit, donc ne sécrétant pas d’anticorps, à des cellules de rates d’animaux hyperimmuni sés . Les cellules de myélomes qui croissent en culture donnaient 1'immortalité aux cellules de rate qui, elles, sécrétaient les anticorps. On avait donc un système qui permettait d'étudier in vitro les transformations cellulaires du système lymphocytaire pour la production d1 anticorps. Ces résultats ont permis au groupe de Milstein d'obtenir des données intéressantes sur le système immunitaire et également de mettre au point la technique des anticorps monoclonaux. Une retombée fort importante qui sera soulignée par la remise d'un prix Nobel à Milstein en 1984.
1.4.2 Principe de la technique des anticorps monoclonaux
La figure 5 illustre le principe de cette technique. Des cellules de rates de souris immunisées sont fusionnées à l'aide
18
du PEG (polyéthylèneglycol, un agent de fusion) à des cellules de myélome. Ces dernières sont déficientes en enzyme hypoxan thine guanine ribosyltransférase (HPRT) ou thymine kinase (TK). Elles sont incapables d'utiliser l'hypoxanthine ou la thymine exogènes pour synthétiser les pyrimidines et les purines néces saires à leur croissance. Un milieu contenant de l'aminopté rine, de l'hypoxanthine et de la thymine (HAT) permet la sélec tion des hybrides. L'aminoptérine bloque la synthèse endogène des purines et des pyrimidines. Dans ce milieu, les cellules de myélome déficientes en HPRT et TK cesseront de se reproduire et mourront. Par ailleurs, on sait que les cellules de rate ne vivent pas en culture de tissu. Les hybrides, par contre, sur vivront et croîtront car la cellule de rate fournira les enzymes nécessaires (HPRT et KT). Dans les puits où il y a croissance de cellules, le surnageant est testé afin de détecter la pré sence de 1 ' anticorps . Les cellules sécrétant des anticorps sont clonées afin d'obtenir une préparation monoclonale. Par la
suite, les cellules clonées sont mises en culture in vivo ou in vitro et congelées pour utilisation future (Galfre et Mils t ein,
1981). Théoriquement, il est donc possible de faire des anti corps contre n*importe quelle substance et en obtenir une quan tité illimitée.
19 Figure 5 Technique de la fusion cellulaire
d1 anticorps monoclonaux. pour l’obtention ANTIGENE CELLULES 0£ FATE (MEURENT EN CULTURE!
I:::
z
O O O • • • O O O • • •Y
FUSION AVEC PEG
CELLULES 0€ MYELOME H PR T OU TK (VIVENT EN CULTURE MEURENT EN MILIEU KAÎ|
1 O O O
O C O
O oc
I
SELECTION DES HYBRtOES AVEC MILIEU MAT
TEST OU SURNAGEANT POUR DETECTER PRESENCE O ANTICORPS
1
CONGELATION OES CELLULES —--- - Si ANTICORPS
t 1 TEST OU SURNAGEANT l CONGELATION « S* ANTICORPS 1 RECLONAGE TEST OU SURNAGEANT CONGELATION * - ' SI ANTICORPS }
PROPAGATION OU CLONE SELECTIONNE
EN CULTURE
ANTICORPS
SOURIS iRRAOiEE •AMUNO INCOMPETENTE
CELLULES PRODUISANT DES ANTICORPS
CULTURE IN VIVO
20
1.4.3 Anticorps monoclonaux et anticorps polyclonaux
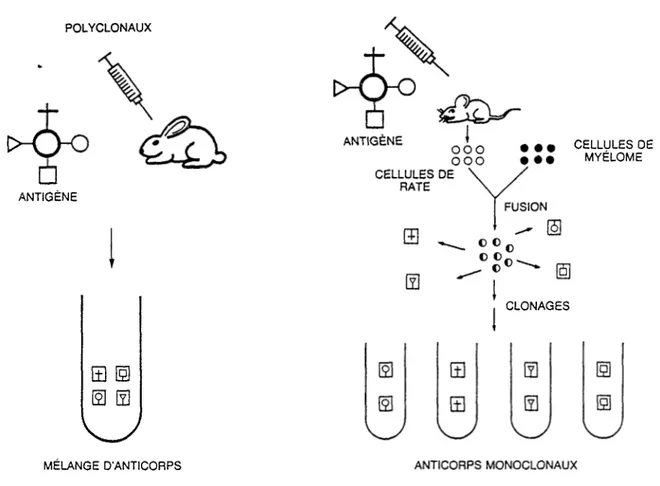
Dans les dosages de stéroïdes, des anticorps polyclonaux étaient utilisés depuis le début des années 1970. L'obtention d’un anticorps sensible et spécifique qu’il soit monoclonal ou polyclonal dépend de plusieurs facteurs dont le principal est la structure de 1’antigène. La figure 6 montre les étapes
successives pour l’obtention d'anticorps monoclonaux et polyclonaux.
Figure 6. Obtention d'anticorps polyclonaux et monoclonaux
POLYCLONAUX ANTIGÈNE ANTIGÈNE
• ••
ooo ooo• ••
CELLULES DE RATE FUSION CLONAGES CELLULES DE MYÉLOME s m 0 SV/
MÉLANGE D'ANTICORPS ANTICORPS MONOCLONAUX
Les anticorps polyclonaux sont obtenus à partir du sérum d'animaux immunisés. Le sérum contient un mélange de différen
tes populations d'anticorps de haute et de faible affinité dirigés contre différentes structures immunitaires d’un même
21
antigène. La proportion de ces différents anticorps varie d’un animal à l'autre et même d'une saignée à l'autre chez le même animal. Par contre, la préparation monoclonale, un peu plus complexe à obtenir (fusion cellulaire, mise en culture et clona ge), donne des anticorps ayant toujours la même affinité et dirigés contre un seul déterminant de 1'antigène. De plus, ces anticorps peuvent être, si le clone est stable, produits en
quantité illimitée. D'où 1'avantage de développer des anticorps monoclonaux.
1.4.4 Application des anticorps monoclonaux
Cette technique a beaucoup évolué depuis les années 80. Elle est maintenant appliquée dans plusieurs domaines.
1.4.4.1 Applications en médecine clinique
L'utilisation des anticorps monoclonaux est une nouvelle approche pour le dépistage et le traitement du cancer. Dans ce domaine, la haute reconnaissance d'une épitope précis d'un
antigène est exploitée. Il est reconnu que les cellules tumora les peuvent avoir des antigènes de surface spécifiques. Des anticorps monoclonaux peuvent être produits contre ces antigè nes, par exemple, Levy et ses collègues ont produit un anticorps monoclonal spécifique aux cellules malignes dans le sang et la moelle épinière de quelques enfants atteints de la leucémie lymphoïde aiguë (Levy et col1., 197 9 ; Meeker et coll. , 1985) . Les anticorps spécifiques aux cellules cancéreuses ont également été couplés à des substances radioactives qui permettent la
localisation des tumeurs (Larson et coll., 19 8 3) . De plus, ils peuvent être couplés à des substances cytotoxiques qui
détruiront les cellules malignes. Par exemple, Bregni et coll. (1986) ont conjugué un anticorps monoclonal à une chaîne de Ricine A. Cet anticorps était dirigé contre un antigène lymphoblastique de la leucémie.
22 1.4.4.2 Applications en recherche
Les techniques immunologiques tels que le RIA, 1'immunocyto chimie et la chromatographie d ' affinité ont profité de la pro duction d1 anticorps monoclonaux. Ce.tte technique permet de purifier et d'analyser des systèmes biologiques complexes. Par exemple, le récepteur g-adrénergique (Vente et Fraser , 1981) et 1'interféron (Secher et Burke, 1980) ont été purifiés à l’aide de chromatographie d'affinité.
Les anticorps monoclonaux ont aussi été développés pour le dosage radioimmunologique des hormones, comme la GH (Bund es en et coll. , 1980) et l’hCG (Bélanger et col1., 1986 ; Kof1er et coll., 1982; Bellet et coll., 1984). L'avantage majeur de l'anticorps monoclonal est sa spécificité. On peut augmenter la spécificité d'un dosage en combinant deux anticorps monoclonaux qui réagi ront sur deux déterminants antigéniques différents d'une même hormone. La disponibilité d'anticorps monoclonaux a ainsi
permis 1 ' extension des techniques d'analyse immunoradiomêtrique dénommée technique "à double sites". Cette technique appliquée
pour la mesure de protéines possédant au moins deux sites anti gèniques est illustrée à la figure 7.
Dans cette technique, un excédent d'anticorps non marqué est fixé sur une phase solide, par exemple sur les parois du tube. L’échantillon contenant l'antigène à déterminer est incubé et se lie à 1'anticorps fixé. Ensuite, 1'anticorps marqué est ajouté en excès, il réagit avec l'antigène lié. L'antigène est couplé des deux côtés par des anticorps de haute spécificité. Il faut bien comprendre que, contrairement au RIA où il y a une quantité déficiente d'anticorps, nous avons ici un excès d'anticorps.
L'excédent de traceur est séparé par décantation. La proportion de traceur lié croît avec la quantité d'antigène à déterminer, la courbe d'étalonnage est donc 1'inverse de celle du dosage RIA. L'utilisation d'anticorps monoclonaux a permis d'obtenir un système sensible et très spécifique.
23
FIGURE 7. Dosage immunoradiométrique.
OÙ --- ( EST UN ANTICORPS
+ EST L’ANTIGÈNE À DÉTERMINER
>-£ EST UN ANTICORPS MARQUÉ
La production d1anticorps monoclonaux contre les stéroïdes a été premièrement démontrée par F ant 1 et coll. (1982). Ils
avaient obtenu des anticorps monoclonaux contre la progestérone avec les antigènes 6g-hydroxyprogestérone-hêmisuccinate-BSA et 1la-hydroxyproges térone—hémisuccinat e-BSA. White et coll.(1982) ont aussi obtenu des anticorps monoclonaux à partir d’un antigè ne 1la-hydroxyprogestérone hémisuccinate. Des anticorps mono clonaux contre la testostérone ont aussi été développés par Kohen et ses collaborateurs (1982). Après ces premières études démontrant que des anticorps monoclonaux de stéroïdes pouvaient
24
être obtenus, la seconde étape était de caractériser les inter actions immunologiques avec des traceurs iodés ou des traceurs enzymatiques. Ces réactions immunologiques seront discutées dans les chapitres 1 et 3 de la première section de cette thése.
2. BIOLUMINESCENCE
2.1 Introduction
Le dosage immunologique est une des techniques les plus couramment utilisées en laboratoire clinique. Parmi les mar queurs des immunoétalonnages, les isotopes radioactifs sont de loin les plus utilisés. Ces substances sont cependant instables, l’introduction d'un élément radioactif est relativement com plexe, leur activité spécifique diminue avec le vieillissement augmentant la proportion d'élément dit non spécifique ; de plus, la manipulation de la radioactivité représente toujours un
danger potentiel pour la santé. Ces inconvénients ont encouragé la recherche de nouvelles méthodes de dosage. Parmi ces méthodes sensibles figure la luminescence. Cette technique comprend la chimiluminescence et la bioluminescence. L'émission de lumière par des réactions chimiques ou biologiques est un phénomène connu depuis longtemps (Harvey, 1940). La luminescence est l'émission de lumière par un atome ou une molécule lorsqu'un électron passe d'un état excité à un état stable. Il ne faut pas confondre avec la fluorescence où une radiation incidente est requise pour exciter la molécule. Dans la chimiluminescence ou la bioluminescence, c'est 1'énergie libre d'une réaction chimi que qui donne 1'énergie nécessaire pour exciter la molécule. La bioluminescence requiert une enzyme (par exemple la luciférase) ou une protéine qui augmente 1'efficacité de la réaction lumi nescent e .
25
2.2 Dosages enzymatiques
2.2.1 Dosage de l'ATP et de ses dérivés
Le dosage de l'ATP et de ses dérivés est réalisé à l'aide de la lucifêrase de luciole (De Luca, 1976). L'émission de la
lumière résulte de la décomposition de 1'adényloxyluciférine formée par la réaction ci-dessous :
Luciférase + luciférine + ATP
0 2
Y
Luciférase + oxiluciférine + AMP + CO 2 + lumière
La principale application de cette réaction est, bien enten du, la mesure de l'ATP (Stanley PE, 19 7 4) . La concentration d * ATP cellulaire étant proportionnelle à la densité de bacté ries, cette méthode est utilisée en bactériologie, en agro-ali mentaire pour l'étude de la contamination par des micro-organis mes et en écologie pour quantifier la biomasse d'un milieu.
2.2.2 Dosage de NAD(P)H et de ses dérivés
Des enzymes isolés de bactéries marines telles que Vibrio fischeri ou Beneckea harveyi (Hastings et coll., 1978)
permettent également le dosage du NAD(P)H grâce à 1'émission de lumière. Deux réactions sont impliquées dans cette production de lumière (Michaiis zyn et coll., 19 7 7 ):
N AD ( P ) H + H+ + FMN FMN oxidoréductase>NAD(P)+ + FMNH2
26
Ces réactions enzymatiques donnent une méthode sensible pour la mesure de NAD(P)H. Comme le NAD(P)H est un produit de l’en zyme déshydrogénase, la quantification du NAD(P)H pouvait donc être associée à la mesure de 1’activité enzymatique de la
déshydrogénase ou à la quantité de substrats :
Substrat oxidé+NAD(P) deshydrogenasesubtratruit+NAn(p)H
Cependant, le dosage de NAD(P)H comme celui de l’ATP n’est pas spécifique puisque les milieux biologiques contiennent un grand nombre de désydrogénases ainsi que leurs substrats.
L’avantage indéniable de cette technique demeure sa haute sensibilité. Après extraction du produit à doser ou dénaturation de 1'échantillon biologique, des quantités d'acides biliaires de l'ordre de la picomole peuvent être mesurées (Roda et coll. , 1982; Schoelmerich et coll., 1984). Nicolas et ses collabora teurs (1983) ont ainsi développé un dosage des estrogènes ayant une sensibilité supérieure au RIA en utilisant 1’estradiol
déshydrogénase placentaire permettant de produire une grande quantité de NADH (étape d'amplification) et une réaction de bioluminescence permettant de doser le NADH accumulé.
Malgré le développement de quelques nouvelles méthodes, la bioluminescence qui est pourtant simple et rapide n'offrait qu'un nombre restreint de dosage et son handicap majeur demeure les interférences.
2.3 Dosage immunologique par bioluminescence
2.3.1 Introduction
Par sa sensibilité élevée, 1'utilisation des réactions de bioluminescence comme instrument de mesure dans des dosages immunologiques était toutefois intéressante. Il suffisait
27 d'élaborer un système d'enzymoimmunoétalonnage qui induit la formation d'ATP ou de NAD(P)H. Les enzymes de bioluminescence sont, par la suite, utilisées comme révélateurs de la formation d’ATP ou de NADH permettant une détection très sensible.
2.3.2 Principe de base
Les premières applications de ces dosages ont été réalisées au début des années 80. Un dosage de type ELISA couplé à la bioluminescence a permis une mesure très sensible du trinitroto luene et du dinitrophénol (Wannlund et De Luca, 1982). Le N ADR s'accumule pendant un temps précis et le système enzymatique tique (FMN oxidoréductase et luciférase) permet de doser ce cofacteur. Cependant, ce système requiert un protocole contrai gnant : centrifugations, lavages, incubations minutées. De plus, le signal lumineux est instable. Il semblait avantageux d'utili ser la bioluminescence pour remplacer les traceurs radioactifs mais pour cela, les conditions de manipulation devaient être
améliorées. Un dosage en phase homogène, i.e. ne nécessitant pas d'étapes de séparation entre le marqueur lié et non lié était particulièrement favorisé. De plus, un signal lumineux stable et indépendant du temps d'incubation était recherché.
Les travaux de Marlène De Luca et de ses collaborateurs avaient démontré que l'immobilisation des enzymes de biolumines cence sur un support augmentait la stabilité des enzymes, de même que 11 efficacité catalytique des réactions couplées
(Jablonski et De Luca, 1978). Par la suite, en utilisant l'en zyme appropriée, ils ont développé des dosages de différents métabolites tels que D-glucose, L-lactate, 6-P-gluconate, L-ma- late, L-alanine, L-glut amat e, NAD et NADP (Wienhausen et De Luca, 19 8 2) . Nicolas et ses collaborateurs (Térouanne et
coll., 1986a) ont appliqué le principe d'enzymes coimmobilisées pour développer un dosage immunoenzymatique bioluminescent
homogène. Ils ont utilisé une réaction immunologique pour augmenter la concentration de la déshydrogénase dans le
28 voisinage des enzymes de luminescence (luciférase et FMN
oxidorêductase) qui sont déjà immobilisées sur le support solide. Ainsi, les réactions immunologiques, enzymatiques et luminescentes sont concentrées dans l’environnement du support solide alors que dans la solution, la grande dilution des
substrats entraîne une diminution de la réaction.
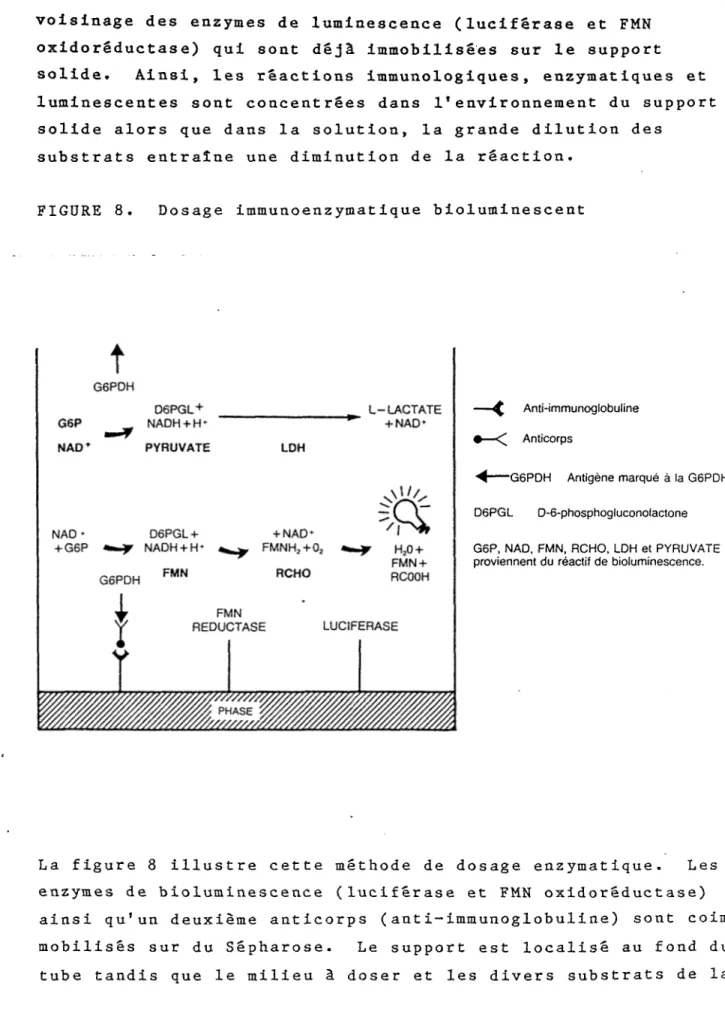
FIGURE 8. Dosage immunoenzymatique bioluminescent
G6PDH D6PGL+ NADH + H' PYRUVATE + NAD- FMNH2 + 0; D6PGL+ NADH + H + G6P FMN + RCOOH RCHO G6PDH LUCIFERASE REDUCTASE --- ( Anti-immunoglobuline •—<[ Anticorps --- G6PDH Antigène marqué à la G6PDH D6PGL D-6-phosphogluconolactone
G6P, NAD, FMN, RCHO, LDH et PYRUVATE proviennent du réactif de bioluminescence.
La figure 8 illustre cette méthode de dosage enzymatique. L enzymes de bioluminescence (luciférase et FMN oxidorêductase ainsi qu'un deuxième anticorps (anti-immunoglobuline) sont c mobilisés sur du Sêpharose. Le support est localisé au fond tube tandis que le milieu à doser et les divers substrats de
es
)
oim-du la
29 réaction sont en solution. La glucose-6-phosphate déshydrogéna- se couplée à l’antigêne se lie par réaction immunologique sur le 2ème anticorps et en présence du substrat (glucose-6-phosphate), il produit du NADH qui sera utilisé par les enzymes luminescen tes pour donner un signal lumineux. L'antigène marqué non lié produit du NADH en solution qui est cependant oxidé par l'enzy me, lactate déshydrogênase (LDH). Cette dernière enzyme et son substrat, le pyruvate, sont contenus dans le réactif de biolumi nescence diminuant ainsi la réaction lumineuse des substances en solution (Nicolas et coll., 1985). La méthode nécessite la
présence d'un support mais ne requiert aucune étape de sépara tion. De plus, le signal obtenu est stable pendant plusieurs heures. Le chapitre deux de la première section de cette thèse porte sur l'application de ce système d'immunoétalonnage pour la mesure de la progestérone. Durant nos travaux, cette méthode a également été appliquée pour le dosage de l'alpha foeto protéine (AFP) (Térouanne et coll., 1986b). Dans une seconde étude
(chapitre 3 de la première section de cette thèse), nous avons combiné cette nouvelle technique de mesure par bioluminescence à celle des anticorps monoclonaux.
CHAPITRE 1
UTILISATION D'ANTICORPS MONOCLONAUX CONTRE LA PROGESTERONE DANS LES RADIOIMMUNOETALONNAGES AVEC DIFFERENTS TRACEURS
31
Dans les immunoétalonnages de stéroïdes, 1’emploi d’un tra ceur iodé de haute activité spécifique implique la préparation d'un dérivé avec un groupement tyrosine, tyramine ou histamine afin de favoriser la réaction avec la molécule d'iode radioac tive. Si on utilise un bras entre le stéroïde et le groupe iodé semblable (traceur homologue) à celui employé par l'antigène, on obtient généralement une haute dilution de l'anticorps mais avec une sensibilité peu élevée et même inférieure à celle observée avec le marqueur tritiê qui possède une faible activité spécifi que. Il est, en fait, bien connu que les radioimmunoétalonnages de stéroïdes montrent une meilleure sensibilité lorsque le tra ceur utilisé possède un bras entre le stéroïde et le groupement iodé différent (traceur hétérologue) de celui entre le stéroïde et la molécule porteuse (BSA). Plusieurs observations indiquent cependant que la dilution de l'anticorps est moindre avec un traceur hétérologue qu'un traceur homologue. On expliquait cette observation par la liaison du traceur iodé hétérologue à une fraction des anticorps polyclonaux qui avaient simultanément une bonne affinité pour le traceur iodé et le stéroïde. Il était donc intéressant d'étudier ces interactions avec des anticorps monoclonaux. Dans cette étude, nous avons voulu déterminer les
interactions entre différents traceurs iodés dans un RIA et des anticorps monoclonaux développés contre la 11 hydroxyprogestéro- ne hémisuccinate-BSA. Cinq anticorps monoclonaux et un polyclo nal ont été comparés. Nous avons démontré que des anticorps mo noclonaux étaient capables de lier des traceurs hétérologues et, dans plusieurs cas, avec des dilutions supérieures à celles ob servées pour le traceur homologue. De plus, contrairement à l'observation notée avec des anticorps polyclonaux où une mau vaise sensibilité est reliée à une haute dilution de l'anti corps, les anticorps monoclonaux donnent un RIA de meilleure sensibilité en augmentant leur dilution. Nos résultats indiquent
32
que tous les anticorps monoclonaux pourraient donner des RIA sensibles à condition d'utiliser un traceur qui lui convienne. Il semble donc que la haute affinité d'un anticorps monoclonal pour son traceur iodé permette une dilution élevée mais que la faible concentration de l'anticorps monoclonal favorise une
bonne compétition avec le stéroïde et, par conséquent, une bonne sensibilité.
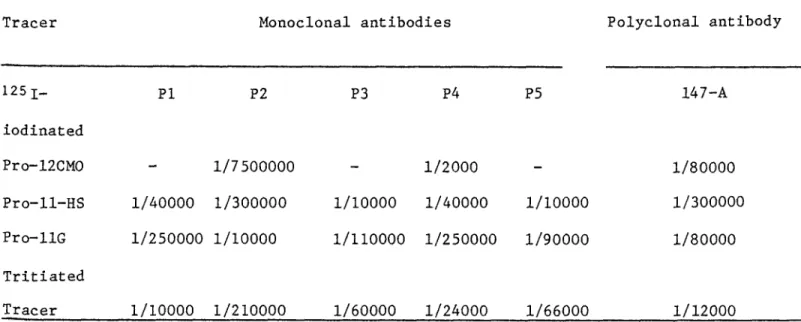
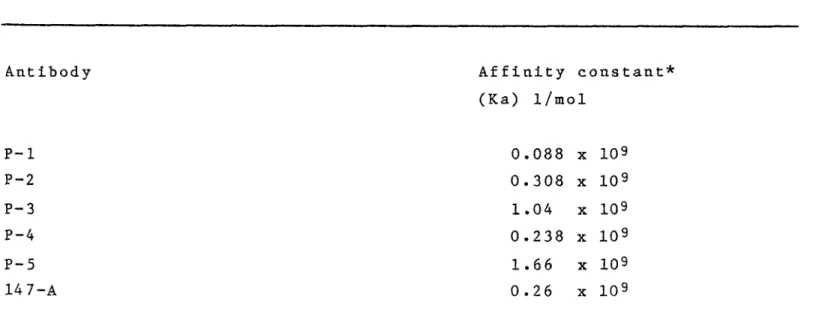
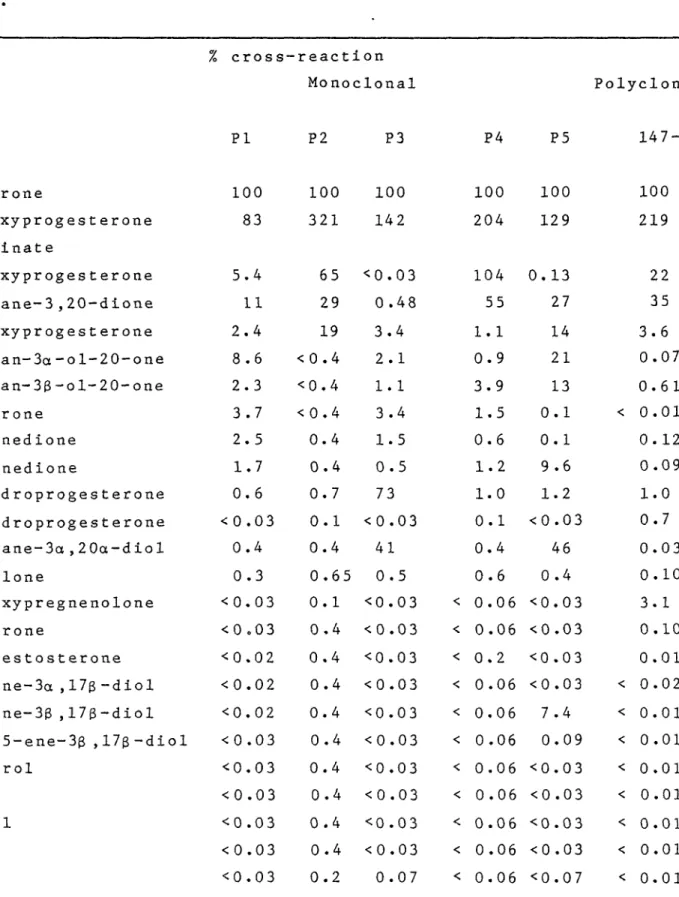
MONOCLONAL ANTIBODIES FOR USE WITH 125 IODINE-LABELED RADIOLIGANDS IN PROGESTERONE RADIOIMMUNOASSAY
MICHELE BROCHU, RAYMONDE VEILLEUX, ANNE LORRAIN and ALAIN BELANGER*
Department of Molecular Endocrinology,
Le Centre Hospitalier de 1'Université Laval, Quebec GlV 4G2, Canada
Short title: Monoclonal antibodies to progesterone
SUMMARY
The interactions of heterologous and homologous ^ 2 5 I- iodinated radioligand with polyclonal and monoclonal antibo dies directed against 11-hydroxyprogesterone hemisuccinate conjugated to bovine serum albumin were compared. Our data show that, with a polyclonal antibody, the use of the same bridge in the tracer and the antigen results in a low sensi tivity while a heterologous tracer can decrease markedly the titer of antibody but increases the sensitivity of the
radioimmunoassay. Due to the high specificity of monoclonal antibodies, the interaction with heterelogous and homologous iodinated tracers is extremely variable from one antibody to another but the present results demonstrate that radioimmu noassays of very high sensitivity can be obtained with homo logous and heterogenous tracers. However, an appropriate tracer has to be selected to meet the requirement of such an assay.
35
INTRODUCTION
The disadvantage of using homologous radioiodinated labels for steroid radioimmunoassay arises from the affinity that the antibody may show not only for the steroid but for the bridge through which it was attached to the carrier protein [1-5]. Consequently, assays using iodinated labels in which a bridge homologous to that in the immunogen is present are frequently much less sensitive that their tri- tiated counterparts. The best method that have been used to overcome the bridge-binding problem is the reduction of antibody recognition of the tracer bridge by making changes
in the nature or the position of the bridge [5, 6].
Recent reports have demonstrated the feasibility of raising monoclonal antibodies against steroid [7-9]. It has been shown that the affinity and the specificity of monoclo nal antibody against the steroid is extremely variable from one antibody to another suggesting that for some antibodies the bridge-binding phenomenon may not be present. In the present report, we have examined the interaction of [ 1 2 5I ] - iodo-labeled steroid derivatives as radioligands with mono clonal progesterone antibodies developed against lla-hydro- xyprogesterone hemisuccinate conjugated to BSA.
36
EXPERIMENTAL
Reagents
Non-radioactive steroids and 11-hydroxyprogesterone hemisuccinate conjugated to BSA were obtained from Research Plus Inc. Bayonne, New Jersey, USA, and [1,2,6,7-% (N)]pro gesterone (90-115 Ci/mmol) (Tracer A) from New England
Nuclear, Boston, Mass.
Bovine serum albumin (fraction V) was obtained from Sigma, St. Louis, US. Mouse IgG was purchased from Miles Biochemicals. Sheep anti-mouse IgG and anti-rabbit IgG sera were produced following monthly injection of 1 mg IgG subcu
taneously in Freund’s adjuvant.
L-tyrosine derivatives of 11-hydroxyprogesterone hemi succinate (tracer B) and progesterone-12(o-carboxymethyl)- oxime (tracer D) were used for iodination. Preparation of 125x-steroids has been already described [10]. 11-hydroxy- progesterone glucuronide 125l-iodotyramine (tracer C) was purchased from Radiochemical Center, Amersham.
Immunization
For the production of monoclonal antibodies, 6 female BALB/c mice of 15-20 g were immunized with 40 pg of 11- hydroxyproges terone hemisuccinate-BSA subcutaneously in Freund's complete adjuvant (DIFC0 Laboratories). At inter vals of 2 weeks for the first and the second month, booster injections were given exactly as above except incomplete Freund's adjuvant was used. At the third month, a similar amount of antigen in saline was given as intravenous boost. Three days after this boost, the spleen was removed for the cell fusion.