Open
Archive TOULOUSE Archive Ouverte (OATAO)
OATAO is an open access repository that collects the work of Toulouse researchers and makes it freely available over the web where possible.
This is an author-deposited version published in : http://oatao.univ-toulouse.fr/
Eprints ID : 19331
To cite this version :
Vulin, Lucas. Etude comparative de la composition lipidique de la
peau et de la laine chez l’alpaga (Vicugna pacos) et le mouton (Ovis aries). Thèse d'exercice, Médecine vétérinaire, Ecole
Nationale Vétérinaire de Toulouse - ENVT, 2017, 66 p.
Any correspondance concerning this service should be sent to the repository administrator: staff-oatao@inp-toulouse.fr.
5
Au président de thèse,
Monsieur le Professeur Gérard Campistron, Praticien hospitalier et Professeur des
Universités en Physiologie Hématologie qui m’a fait l’honneur de présider mon jury de thèse.
Hommages respectueux
Au directeur de thèse,
Madame le Professeur Marie-Christine Cadiergues, Docteur vétérinaire, Professeur en
dermatologie à l’ENVT pour avoir accepté d’encadrer cette thèse et m’avoir accompagnée dans ce travail.
Sincères remerciements
A l’assesseur,
Monsieur le Professeur François Schelcher, Professeur en pathologie des ruminants à
l’ENVT qui m’a fait l’honneur d’accepter de faire partie de mon jury de thèse.
Sincères remerciements
Au membre invité,
Monsieur Nicolas Amalric, Directeur de Synelvia qui a conduit l’analyse des échantillons et
qui s’est rendu disponible pour m’aider dans la compréhension des résultats.
1
TABLE DES MATIERES
Liste des illustrations ... 5
Introduction ... 7
PREMIERE PARTIE : ETUDE BIBLIOGRAPHIQUE ... 9
A. Place et importance de l’élevage d’alpaga en France ... 11
1. Classification phylogénétique ... 11
2. Population des alpagas en France ... 13
3. Utilisation de l’alpaga en France ... 14
a) La fibre d’alpaga ... 14
b) La viande d’alpaga ... 15
c) Les alpagas d’ornement ... 15
B. Importance des atteintes dermatologiques chez l’alpaga ... 15
1. Importance économique des atteintes dermatologiques chez l’alpaga ... 15
2. Principales atteintes dermatologiques ... 16
3. Les gales des alpagas ... 17
a) Cycles des agents de la gale ... 18
b) Signes cliniques et localisation des lésions ... 18
4. Difficultés du traitement de la gale chez l’alpaga ... 19
a) Pharmacocinétique des principales molécules utilisables ... 19
b) Traitements actuellement utilisés ... 20
C. Particularités histologiques de la peau d’alpaga ... 22
1. Généralités sur la peau... 22
2. L’épiderme... 23 3. La jonction dermo-épidermique ... 26 4. Le derme et l’hypoderme ... 26 5. Le poil et la laine... 27 a) Organisation ... 27 b) Densité... 28
D. Les lipides cutanés chez les mammifères ... 29
1. Organisation des lipides dans le stratum corneum ... 30
a) Le modèle « briques et mortier » ... 30
b) Conséquences sur l’utilisation de traitements topiques ... 31
2
a) Origine des lipides ... 32
(1) Céramides ... 33
(2) Acides gras ... 33
(3) Cholestérol ... 34
(4) Le squalène ... 34
(5) Les triglycérides et les cires ... 34
DEUXIEME PARTIE : ETUDE EXPERIMENTALE - ANALYSES DES LIPIDES DE LA SURFACE CUTANEE ET DES POILS CHEZ LE MOUTON ET L’ALPAGA ... 35
E. Protocole expérimental ... 37
1. Critère d’inclusion des individus ... 37
2. Prélèvements réalisés ... 37
a) lipides de la surface cutanée ... 37
b) Lipides de la surface pilaire ... 38
3. Méthode d’analyse ... 38
F. Résultats ... 39
1. Animaux inclus dans l’étude ... 39
a) Les alpagas... 39
(1) Répartition en âge et en sexe ... 39
(2) Traitements antérieurs ... 40
(3) Lésions encore présentes au moment des prélèvements... 41
b) Les moutons ... 41
2. Abondance des lipides de la surface cutanée ... 41
3. Analyse des acides gras des poils ... 45
G. Discussion ... 47
1. Limites de l’étude ... 47
a) Taille et composition des effectifs ... 47
b) Modification des résultats par l’atteinte cutanée provoqué par l’épisode de gale chez les alpagas ... 48
2. Comparaison avec les données disponibles dans la littérature ... 49
a) Chez l’alpaga et le mouton ... 49
b) Chez d’autres mammifères ... 49
(1) Composition totale chez l’Homme ... 49
(2) Comparaison avec d’autres mammifères ... 50
3 3. Implication des résultats sur la prise en charge thérapeutique des gales chez
l’alpaga ... 52
CONCLUSION ... 53
BIBLIOGRAPHIE ... 54
ANNEXES ... 61
Annexe 1 : résultats de la spectrophotométrie des lipides neutres de la surface cutanée chez les alpagas (haut) et les moutons (bas) ... 61
Annexe 2 : Profils en acides gras saturés (à m/z=74) des poils des alpagas (haut) et des moutons (bas) ... 62
Annexe 3 : exemple de fiche utilisée pour noter les informations épidémiologiques et lésionnelles sur les alpagas. ... 63
Annexe 4 : Tableau de la répartition en sexe et en âge des alpagas de l’étude ... 64
Annexe 5 : Tableau récapitulatif des lésions observées sur les alpagas le jour des prélèvements. ... 65
5
Liste des illustrations
Numéro de la figure
Type de figure Titre Page dans le manuscrit 1 Figure Classification phylogénétique des alpagas, d’après
(Kadwell et al., 2001)
11
2 Photographies Photographies d’alpaga Suri (A) et d’alpaga Huacaya (B) (photographies personnelles)
12
3 Photographies Comparaison morphologique des agents de la gale chez l’alpaga
17
4 Coupe histologique
Histologie de peau saine prélevée sur le dos d’un alpaga Huacaya, en coloration hémalun-éosine
23
5 Coupe histologique
Histologie de l’épiderme de la peau saine du dos d’alpaga en coloration émalun-éosine
24
6 Tableau Tableau de l’épaisseur de la peau, de l’épiderme et du stratum corneum chez l’alpaga d’après (Fleis,
Scott, 2010)
25
7 Coupe histologique
Histologie de peau d’alpaga en coupe longitudinale (x400) (Badajoz L. Et al., 2009)
27
8 Schéma Organisation générale des poils chez les mammifères Grasse, 1967
28
9 Coupes histologiques
Observation au même grossissement de la peau chez deux alpagas montrant les différences de taille et de densité des follicules pileux entre les individus (Moore
et al., 2015)
29
10 Tableau Densité en nombre de follicules par mm² chez trois races d’alpagas selon l’âge,
d’après (Antonini et al., 2004)
29
11 Figure Représentation des principaux lipides cutanés chez l’homme et leur répartition chez
l’homme, d’après (Pappas, 2009)
30
12 Schéma Schéma des voies d’absorption à travers l’épiderme, d’après (El Maghraby et al., 2008)
32
13 Schéma Lieux de prélèvements des lipides et poils sur les moutons et les alpagas
37
14 Graphiques Répartition des teneurs totales en lipides à la surface de la peau des moutons et des alpagas
42
15 Tableau Tableau comparatif des moyennes des teneurs lipidiques chez les alpagas et chez les moutons et p
value associées
43
16 Tableau Tableau comparatif de la répartition moyenne relative des lipides cutanés chez le mouton
et l’alpaga
44
17 Graphique Résultats superposés de la spectrophotométrie de masse dans les séries des moutons et des alpagas
45
18 Graphique profil spectrophotométrique des acides gras des poils du mouton (bleu) et de l’alpaga (noir)
45
19 Graphique répartition, moyenne et écart type des teneurs en acides gras totaux sur les poils des moutons et des
alpagas
46
20 Tableau Comparaison de la répartition en acide gras moyenne de la laine des alpagas et des moutons
47
21 Tableau Composition lipidique de l’épiderme du rat, des bovins, du chien et des porcins d’après (Stahl et al., 2009), en pourcentage de masse des lipides extraits
7
Introduction
Les alpagas (Vicugna pacos) sont des animaux originaires d’Amérique du Sud mais leur nombre est en augmentation en France et en Europe. Les vétérinaires sont ainsi de plus en plus sollicités pour intervenir sur cette espèce et notamment pour des motifs dermatologiques, qui sont fréquents. Parmi les maladies cutanées des alpagas, la gale consitue un véritable enjeu économique et pose de nombreux problèmes de traitement. La prise en charge est difficile avec de nombreux échecs de traitements décrits dans la littérature (Foster et al., 2007 ; Atlee et al., 1997 ; Folwer, 2010). Les alpagas sont en effet connus pour avoir un métabolisme des avermectines très rapide (Burkholder et al., 2004) ce qui rend les traitements par voie générale moins efficaces. L’utilisation de traitements topiques semble elle aussi montrer des limites (R. P. Hunter et al., 2004 ; Robert P. Hunter et al., 2004). Comparativement, l’utilisation de cette voie d’administration est généralement efficace chez le mouton (Plant et al., 2007). Une possible explication de la différence d’efficacité constatée entre les deux espèces pourrait être une différence dans la composition lipidique de la surface cutanée. En effet, celle-ci joue un rôle majeur dans l’absorption et la rémanence des antiparasitaires couramment utilisés.
L’objectif de ce travail est d’analyser et de comparer la composition lipidique de la surface cutanée et de la laine des moutons et des alpagas, sur des plans quantitatifs et qualitatifs. Dans une première partie, l’auteur s’appuiera sur les données bibliographiques pour synthétiser les données disponibles. Les résultats de l’étude prospective seront présentés dans une deuxième partie avant d’être discutés.
9
11
A. Place et importance de l’élevage d’alpaga en France
1. Classification phylogénétique
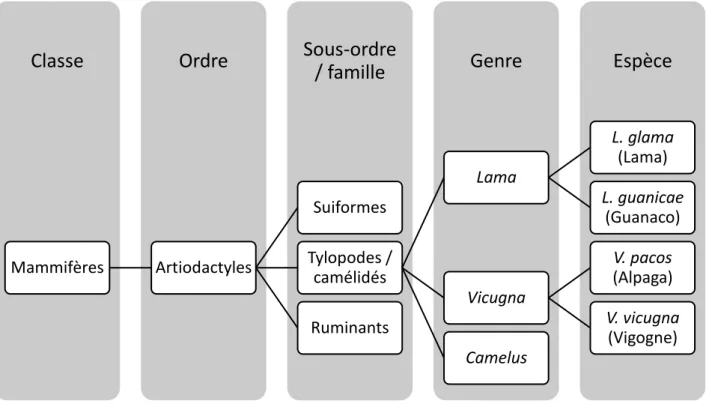
L’alpaga est un mammifère de l’ordre des Artiodactyla, du sous-ordre des Tylopoda et de la famille des Camélidae, il fait partie des animaux considérés comme des « Camélidés du nouveau monde ». La classification des Camélidés est la suivante (figure 1) :
Figure 1 : Classification phylogénétique des alpagas, d’après Kadwell et al., 2001
Pendant longtemps, l’alpaga a été apparenté aux guanacos mais des travaux d’analyse génétique menés en 2001 ont montré qu’il est plus proche de la vigogne (Kadwell et al., 2001).
Le guanaco et la vigogne sont des espèces sauvages contrairement au lama et à l’alpaga, dont la domestication remonte à environ 6000 ans dans la région de la Puna dans les Andes (Folwer, 2010).
L’alpaga est un animal plus petit que le lama avec une hauteur au garrot d’environ 1,10 m. Le poids varie généralement entre 60 kg et 80 kg pour les mâles et est d’environ 55 kg pour les femelles.
Espèce
Genre
Sous-ordre
/ famille
Ordre
Classe
Mammifères Artiodactyles Suiformes Tylopodes / camélidés Lama L. glama (Lama) L. guanicae (Guanaco) Vicugna V. pacos (Alpaga) V. vicugna (Vigogne) Camelus Ruminants12
C’est une espèce surtout connue pour la qualité de sa laine. Il existe deux types différents de toison qui permettent de distinguer deux races : huacaya et suri (figure 2). La laine des alpagas huacayas est courte, ondulée et spongieuse, ce qui donne un aspect comparable à l’aspect à la laine des moutons mérinos. Ce sont les plus nombreux (83% des alpagas). La laine des alpagas suris est plus longue, tombant sur le côté de l’animal. Les fibres de cette race sont décrites comme étant ordonnées, très brillantes, peu frisées, très fines et soyeuses. (Folwer, 2010).
Figure 2 : Photographies d’alpaga suri (A) et d’alpaga huacaya (B) (photographies peronnelles)
A
13 2. Population des alpagas en France
L’exportation de l’alpaga a longtemps été interdite hors de son continent d’origine. Elle n’a été possible qu’à partir des années 1980 avec de nombreux transferts vers l’Australie, l’Amérique du nord ou encore l’Europe (Folwer, 2010). Depuis cette période, le nombre d’alpagas n’a cessé d’augmenter dans ces différentes régions du monde.
Il est difficile d’évaluer le nombre exact d’alpagas en France car l’enregistrement n’est obligatoire que depuis 2016. Lors d’une question publique au gouvernement, le nombre de 8000 à 10 000 camélidés est évoqué, une grande partie étant représentée par les alpagas (Question orale n°0480S de Mme Nicole Bonnefoy au sénat). Le Décret n° 2016-119 du 5 février 2016 stipule que « l'article 41 de la loi n° 2014-1170 du 13 octobre 2014 d'avenir pour
l'agriculture, l'alimentation et la forêt a étendu aux camélidés et à leurs détenteurs les obligations d'identification et de déclaration prévues pour les équidés. Ce décret prévoit l'obligation de déclaration des détenteurs et des propriétaires de camélidés auprès de l'Institut français du cheval et de l'équitation. Il impose, par ailleurs, l'identification de tout camélidé par l'implantation sous-cutanée d'un transpondeur ou la pose de deux repères auriculaires d'identification agréés, dont une boucle électronique, et son enregistrement auprès de l'Institut français du cheval et de l'équitation. » Ainsi le nombre précis d’alpagas devrait être
connu rapidement.
Des associations regroupant éleveurs amateurs et professionnels ont vu le jour suite aux premières importations en France comme l’A.L.F (Association Lamas et Alpagas de
France), et l’A.F.P.C. (Association Française des Petits Camélidés) créées respectivement en
1986 et 1994. Le but de ces associations est la mise en commun des connaissances sur cette espèce et la promotion de son élevage. En 2010, une fusion entre l’A.F.L. et l’A.F.P.C a eu lieu, devenant l’A.F.L.A (Association Française Lamas et Alpagas), dont les objectifs sont identiques. Actuellement, elle compte plus de 200 membres actifs, éleveurs professionnels ou amateurs (AFLA, 2016). Cette association organise des rencontres et des concours afin de permettre les échanges entre les membres de l’association et de faire découvrir les alpagas au grand public. Un magazine trimestriel « Lamas et alpagas : revue de l'Association française lamas et alpagas » (ISSN 2112-5716) est également publié regroupant les comptes rendus des réunions d’association et des conseils d’élevage.
14
3. Utilisation de l’alpaga en France
a) La fibre d’alpaga
La qualité de la toison d’un alpaga est évaluée sur plusieurs critères : la finesse, la brillance, la densité, la longueur, l’uniformité ainsi que le « crimp » ou le « curl ». Le terme « crimp » est utilisé chez les alpagas huacayas pour désigner l’ondulation de la fibre en prenant en compte sa fréquence, son amplitude et sa régularité le long de la fibre. Celui de « curl » sert à décrire la qualité des boucles lâches formées par plusieurs fibres chez les alpagas suris (AFLA 2016). Le critère de qualité principalement retenu reste cependant le diamètre de la fibre (Canaza-Cayo et al., 2013).
La fibre d’alpaga est reconnue pour sa qualité, ce qui en fait un produit recherché. Ainsi la fibre est le principal produit de l’élevage d’alpaga constituant la principale source de revenu des éleveurs (Frank et al., 2006). Cette production demeure une spécialité des éleveurs andins qui assurent la plus grande partie des exportations de ce produit. Le Pérou reste le principal producteur même si la production augmente aux Etats-Unis et en Australie.
La qualité de la laine est inégale selon la zone de prélèvement : la toison la plus noble provient de la ligne du dos et des flancs car les fibres y sont les plus fines. Au contraire sur le garrot, les membres et la queue, les poils y sont plus grossiers et peuvent être souillés (Lupton et al., 2006).
Une des particularités de la fibre d’alpaga est la présence d’une cuticule composée de micro-écailles bien alignées, qui sont moins hautes que celles de la laine. Cela explique la faible résistance au toucher et donc la sensation de douceur (Badajoz L. et al., 2009). La présence de micro-poches d’air confère également une grande légèreté ainsi qu’un pouvoir isolant. De plus, il s’agit, après le mohair, de la fibre naturelle la plus résistante, la rendant particulièrement bien adaptée au processus industriel (Lupton et al., 2006).
15
b) La viande d’alpaga
En dehors des pays d’origine de l’alpaga, la viande d’alpaga reste une denrée alimentaire méconnue. Sur les plateaux andins, la viande était consommée salée et séchée au soleil. Cette production assurait une source de revenu secondaire aux éleveurs (Celestino, 1998). Les animaux utilisés pour la viande étaient en général ceux produisant une quantité de fibre insuffisante ou inaptes au transport de marchandises.
La viande d’alpaga est une viande rouge pauvre en graisse et en cholestérol (Cristofanelli et al., 2004) mais riche en acides gras essentiels Ω3 et Ω6, qui a une teneur en protéines proche de la viande de bœuf (Salvá et al., 2009).
Depuis 2006, des normes européennes d’abatage existent pour les viandes d’alpaga et de lama, ce qui facilite les échanges et les exports (Nations, 2008).
c) Les alpagas d’ornement
L’alpaga est enfin un animal d’agrément détenu par des particuliers. Le nombre d’animaux est alors généralement faible mais lorsqu’il devient plus important, l’appel à des professionnels pour la tonte peut être nécessaire. Le particulier propriétaire de l’alpaga pourra alors vendre la toison obtenue.
B. Importance des atteintes dermatologiques chez l’alpaga
1. Importance économique des atteintes dermatologiques chez l’alpaga
Une étude réalisée au Pérou (Windsor et al., 1992) a évalué l’intérêt de l’utilisation d’une unique injection sous-cutanée préventive d’ivermectine à la dose de 0,2 mg/kg chez des alpagas adultes. La charge parasitaire en poux, en agents de la gale et en œufs d’helminthes a ensuite été comparée entre les 25 animaux traités et les 26 témoins tous les mois pendant 5 mois. Le poids des animaux et de leur laine a également été monitoré.
16
Cet étude a permis de montrer qu’un traitement préventif des parasites internes et externes avec de l’ivermectine entraîne une prise de poids de 3,1 kg chez les mâles et 1,9 kg chez les femelles. Cette augmentation est notamment due à une production plus importante de laine : avec une production de 360 g de plus, le bénéfice net chez les mâles était de 3,54 dollars américains. Il était de 1,36 dollars pour 0,03 kg de laine en plus chez la femelle.
La charge parasitaire en helminthes et en poux a été significativement plus basse pour le groupe traité tout au long de l’étude tant dis que de nouveaux cas de gale ont été observés dans les deux groupes.
2. Principales atteintes dermatologiques
Les alpagas peuvent être atteints de nombreuses affections dermatologiques souvent proches de celles retrouvées chez les autres mammifères, plus particulièrement les ovins. Les parasitoses sont de loin les plus fréquentes avec principalement les gales. La phtiriose, la démodécie (Hill et al., 2008), les tiques ou encore la pulicose sont d’autres exemples de parasitoses externes observables chez les alpagas (Foster et al., 2007).
D’autres affections existent telles des affections fongiques ou bactériennes, des dermatoses d’origine nutritionnelle (carence en zinc notamment (Clauss et al., 2004)), des maladies à médiations immunes ou encore des néoplasies.
Lors d’une enquête auprès des éleveurs de lamas et d’alpagas au Royaume-Uni (D’Alterio et al., 2006), 51% des éleveurs ont jugé connaître des problèmes dermatologiques dans leur troupeau, dont 26,4% liés à des ectoparasites.
En 2005, une étude a montré que 22,5% des alpagas du sud-ouest de l’Angleterre avaient des altérations cutanées (Alterio et al., 2005). Etonnamment, les résultats des raclages cutanés ont montré que la prévalence en chorioptes était plus importante chez les individus sains (55%) que chez les individus avec des lésions cutanées (28%).
17 3. Les gales des alpagas
Les alpagas peuvent être atteints par les gales chorioptique, sarcoptique et psoroptique. Cette dernière est cependant moins courante et donc moins étudiée que les deux premières. Les signes cliniques et la localisation des régions atteintes permettent d’orienter le diagnostic vers un type de gale. Cependant, le diagnostic de certitude se fait par l’observation microscopique des acariens dans le produit de raclage cutané (figure 3). Les alpagas peuvent être atteints par plusieurs types de gale simultanément (Curtis et al., 2001).
Figure 3 : Comparaison morphologique des agents de la gale chez l’alpaga : Chorioptes bovis mâle (en haut à gauche), Sarcoptes scabei femelle gravide (en haut à droite), Psoroptes
18
a) Cycles des agents de la gale
Sarcoptes scabiei réalise l’intégralité de son cycle sur et dans la peau des alpagas en 7
à 14 jours (Folwer, 2010). L’accouplement se fait à la surface de la peau. La femelle creuse alors dans les couches de l’épiderme, s’y enfonce et elle dépose les œufs dans le tunnel ainsi formé (Cheney, Allen, 1989). L’éclosion se fait en 3 à 8 jours puis les larves rejoignent la surface de la peau où elles deviennent des adultes en passant par le stade de nymphe en 4 à 6 jours (Folwer, 2010). La survie de ces acariens dans le milieu extérieur ne peut dépasser 3 semaines (Set Bornstein, Kerstin de Verdier, 2010). L’activité de ce parasite semble maximale en automne et en hiver (Rosychuk, 1989). La transmission entre individus est possible, principalement par contact direct, ou de façon indirecte par l’intermédiaire des couvertures, de la litière ou des accessoires de toilettage contaminés (Rosychuk, 1989). La transmission à d’autres espèces comme le mouton, le cheval voire l’homme a été décrite (Bates et al., 2001).
Les chorioptes et les psoroptes ont un cycle similaire. Tous deux vivent à la surface de la peau et ne creusent pas de tunnels. Les chorioptes se nourissent de débris cutanés tandis que les psoroptes peuvent également ingérer de la lymphe, et des cellules cutanées (Set Bornstein, Kerstin de Verdier, 2010). Le cycle entier se fait sur l’hôte. Les œufs sont pondus à la surface de la peau et éclosent en 3 à 4 jours. Les larves passent ensuite par deux stades nymphaux avant de devenir adultes (Set Bornstein, Kerstin de Verdier, 2010). Pour les psoroptes, la durée du cycle est d’au minimum 12 jours mais peut être retardée de 4 à 5 jours si l’éclosion se fait sous une croûte et de 10 jours si elle a lieu dans le milieu extérieur.
b) Signes cliniques et localisation des lésions
Les localisations de la gale sarcoptique et de la gale chorioptique sont presque identiques. Les chorioptes atteignent les zones les moins poilues à savoir interdigitale, la partie médiale des cuisses et du ventre, la poitrine, les ars, le périnée chez les femelles et le prépuce chez les mâles (Foster et al., 2007). Les espaces interdigitaux, la base de la queue et la partie ventrale de l’abdomen sont, en général, touchés en premier lors de gale chorioptique. Les lésions peuvent s’étendre à l’ensemble du corps, plus précocement pour la gale sarcoptique qui touche rapidement la tête en cas d’atteinte importante (Foster et al., 2007). La gale
19 psoroptique affecte principalement le pavillon des oreilles et le canal auriculaire mais des lésions peuvent être retrouvées sur l’ensemble du corps lors d’atteinte grave.
Les sarcoptes creusant dans l’épiderme sont à l’origine d’hyperhémie, de papules et de pustules, qui forment ensuite des croûtes (Foster et al., 2007). Une alopécie apparaît par la suite (Cheney, Allen, 1989) la peau s’épaissit et se lichénifie lorsque la gale devient chronique (Set Bornstein, Kerstin de Verdier, 2010). Le prurit peut être intense et à l’origine de lésions secondaires. Ces lésions peuvent se surinfecter(Cheney, Allen, 1989). La gale sarcoptique peut conduire à la mort de l’individu (Twomey et al., 2009).
Dans les cas de gale chorioptique, le prurit est en général moins marqué. Les affections peuvent même rester subcliniques (Set Bornstein, Kerstin de Verdier, 2010). Les principaux symptômes sont une alopécie, de la desquamation et des croûtes. Dans 40% des cas, les lésions ne touchent qu’une seule zone du corps, mais l’atteinte de plus de cinq sites simultanément est possible (D’Alterio et al., 2005).
Les pièces buccales des psoroptes s’enfoncent dans l’épiderme pour atteindre la lymphe, ce qui entraîne une réaction inflammatoire locale sous forme de papules ainsi que l’exsudation de sérosités (Folwer, 2010). Ces sérosités une fois desséchées forment ensuite des croûtes. Les alpagas atteints de gale psoroptique développent en général une alopécie et manifestent du prurit des pavillons et des canaux auriculaires. Ces lésions peuvent s’accompagner d’otites avec des squames ou des croûtes d’aspect feuilleté dans le canal auriculaire, souvent accompagnées de surinfections bactériennes (Set Bornstein, Kerstin de Verdier, 2010). Des lésions sur le reste du corps sont possibles, notamment dans les zones de poils denses comme les épaules, le dos, la base de la queue, le périnée, la région axillaire, l’aine, les narines, le tour des yeux, le cou ou les pattes. L’atteinte de ces zones sans atteinte auriculaire est possible (Foster et al., 2007).
4. Difficultés du traitement de la gale chez l’alpaga
a) Pharmacocinétique des principales molécules utilisables
Le profil pharmacocinétique des avermectines chez les camélidés d’Amérique du Sud est différent de celui observé chez les ruminants. Chez le lama, lors d’injections d’ivermectine
20
par voie sous-cutanée à la posologie de 0,2 mg/kg, la concentration plasmatique en ivermectine peut ne pas atteindre le seuil minimum de détection de 2,3 ng/mL (Burkholder et al., 2004) ou atteindre de 3 à 4 ng/mL (Jarvinen et al., 2002). En comparaison, avec les mêmes doses injectées les concentrations atteintes sont de 31,7 ng/mL chez les bovins (Toutain et al., 1997) et de 36,7mg/mL chez les ovins (Moreno et al., 2010). Les concentrations efficaces contre les parasites ne sont donc pas atteintes chez l’alpaga avec les posologies classiquement utilisées dans les autres espèces. La nécessité d’utiliser des posologies plus importantes (0,4 à 0,6 mg/kg) est donc préconisée (Burkholder et al., 2004).
De même, des différences semblables de pharmacocinétique ont été observées avec la doramectine. Lors d’application unique topique à la dose de 0,5 mg/kg chez le lama et l’alpaga, les concentrations obtenues sont trois fois moins importantes que chez les bovins (R. P. Hunter et al., 2004). Une étude similaire a été réalisée avec la moxidectine à la même posologie (Robert P. Hunter et al., 2004). Les concentrations moyennes maximales qui ont été détectées dans le plasma des lamas et des alpagas sont respectivement de 0,713 ng/mL et 0,690 ng/mL. Cette molécule est mal absorbée à travers la peau chez les petits camélidés et les concentrations obtenues sont ainsi dix fois inférieures à celle mesurée chez les ovins (Robert P. Hunter et al., 2004). Une application topique d’éprinomectine à la dose de 0,5 mg/kg ne permet d’atteindre une concentration plasmatique que de 1,83 +/- 1,38 ng/mL chez l’alpaga, ce qui est bien inférieur à ce qui est retrouvé chez la vache avec 43,76 ng/mL (Lau et al., 2007).
Ces observations pharmacologiques permettent d’expliquer, au moins en partie, une moindre efficacité des traitements à base d’avermectines ou de mibémycines, comparée à celle observée chez les bovins ou les ovins.
b) Traitements actuellement utilisés
Pour le traitement de la gale psoroptique et de la gale sarcoptique, l’utilisation de produits efficaces via la circulation systémique est possible et recommandée. En effet, les sarcoptes creusent dans l’épiderme et les chorioptes se nourrissent de lymphe grâce à leurs pièces buccales qui s’enfoncent dans l’épiderme. Au contraire, les chorioptes devront être traités par un traitement de surface car ils restent superficiels.
21 Malgré sa mauvaise diffusion quelle que soit la voie d’administration, de nombreux auteurs préconisent l’utilisation d’ivermectine en injections sous-cutanées à la dose de 0,2 mg/kg, avec une efficacité imparfaite constatée avec les gales et les poux suceurs (Foster et al., 2007). En effet, lors de gale chorioptique, les injections ou des applications topiques répétées avec des produits à base de lactone macrocyclique (avermectines ou milbémycines) peuvent considérablement réduire la charge parasitaire, mais n’éradiquent pas tous les parasites (Foster et al., 2007).
Une étude a montré que l’utilisation d’ivermectine à la posologie de 0,4 mg/kg répétée trois fois à 14 jours d’intervalle ne permet pas toujours d’éradiquer les chorioptes et que la diminution du nombre de parasites n’est que transitoire à 7 jours après la première injection (D’Alterio et al., 2005). Le même phénomène de diminution puis de réaugmentation de la charge parasitaire est observé lors d’administration d’ivermectine par voie sous-cutanée à la posologie de 0,2 mg/kg associée à une application topique d’ivermectine à 0,5% (Jarvinen et al., 2002). Avec ce protocole, la même étude a montré que la concentration sérique maximale est atteinte au bout de 7 jours expliquant la diminution du nombre de Chorioptes à ce moment-là. Ainsi l’administration répétée d’ivermectine à une semaine d’intervalle pourrait s’avérer intéressante.
L’application hebdomadaire pendant un mois d’un produit à base d’éprinomectine (Eprinex pour-on; Merial Animal Health), à la posologie de 500 µg/kg s’est montrée efficace (D’Alterio et al., 2005). L’application a été faite sur la ligne du dos avec plusieurs zones d’application systématiquement. Le nombre d’acariens est alors significativement diminué au bout de 14 jours puis reste bas durant toute la durée du traitement. Certain cas d’éradication des chorioptes est même décrit dans l’étude. Dans la même étude, l’utilisation d’éprinomectine une seule fois, permet de diminuer la charge parasitaire à sept jours mais celle-ci augmente de nouveau dès le quatorzième jour. Il n’y a alors pas de différence significative avec l’injection de 0,4 mg/kg d’ivermectine (Panomec injection; Merial Animal Health) par voie sous-cutanée (D’Alterio et al., 2005).
L’éprinomectine à libération prolongée (Longrange, Mérial) a été étudiée récemment sur un faible nombre d’individus (Pollock et al., 2017). Des injections de 5 mg/kg ont été réalisées chez 6 individus sains et 4 individus atteints de gale chorioptique. La dose habituelle chez les bovins est de 1 mg/kg. Trois injections répétées à deux mois d’intervalle ont permis de maintenir une concentration plasmatique non négligeable chez les individus atteints de
22
gale mais une diminution de l’hématorite et de l’albuminémie a été observée. Il est également important de noter que le raclage d’un individu est resté positif pour les chorioptes en fin d’étude.
L’utilisation de bain dans une solution de souffre à 3% a également été étudiée chez le lama. L’utilisation hebdomadaire pendant trois à quatre semaines a permis une diminution importante du nombre de parasites (Cheney, Allen, 1989).
L’amitraz a été testé avec succès sur des individus porteurs de chorioptes et dont les lésions étaient importantes (Lau et al., 2007). Il s’agit d’une série de seulement trois cas qui n’avaient pas répondu à des applications locales d’éprinomectine et à une injection de doramectine. Une désinfection quotidienne a été réalisée sur les lésions avant de commencer le traitement hebdomadaire avec de l’amitraz (0,25 mg/mL) pendant quatre semaines. Aucune rechute n’a été constatée pendant dix mois.
L’éradication totale du parasite apparaît ainsi difficile quels que soient les produits utilisés et nécessite des traitements fréquents sur des périodes importantes. Le métabolisme particulier des avermectines chez les camélidés d’Amérique du Sud est une explication partielle. Cependant, pour les produits en utilisation topique, le mécanisme est moins clair et pourrait s’expliquer dans la structure de la peau et de la surface cutanée. Les données anatomiques et histologiques sont disponibles dans la littérature, celles sur la composition lipidique de la surface cutanée constituent le sujet d’étude de cette thèse.
C. Particularités histologiques de la peau d’alpaga
1. Généralités sur la peau
La peau est la principale barrière entre le corps et le milieu extérieur. Elle va ainsi prévenir les entrées des micro-organismes mais aussi limiter fortement les pertes en eau. C’est un organe flexible et élastique, permettant ainsi les déformations et ne limitant donc pas le mouvement de l’organisme.
La peau joue aussi de nombreux autres rôles, que ce soit dans la thermorégulation, la perception sensorielle, la participation à la synthèse de vitamine D3 ou encore la fonction sécrétoire avec les glandes sébacées et sudoripares.
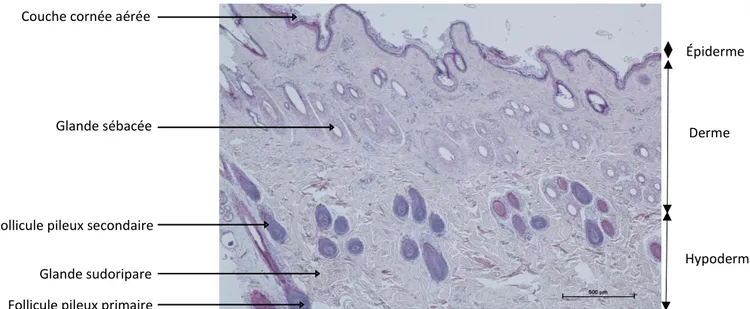
23 La peau des alpagas a la même structure générale que celle des autres mammifères et particulièrement que celle du lama (Fleis, Scott, 2010). Elle est donc constituée de l’épiderme en surface, de la jonction dermo-épidermique, du derme et de l’hypoderme en profondeur (figures 4 et 5). On trouve au sein de ces structures des annexes épidermiques : les follicules pileux, les muscles pilo-érecteurs, les glandes sébacées, les glandes sudoripares (figure 4), la vascularisation et l’innervation.
Figure 4 : Histologie de peau saine prélevée sur le dos d’un alpaga huacaya, en coloration hémalun-éosine (Dermatologie, ENVT)
2. L’épiderme
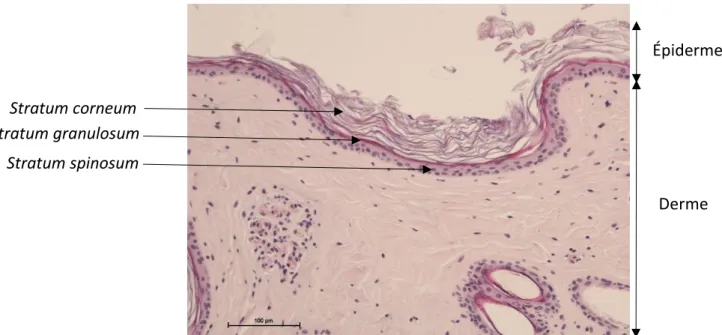
L’épiderme est un épithélium de revêtement stratifié, pavimenteux et orthokératosique. Il dérive de l’ectoderme, feuillet externe des vertébrés. On distingue classiquement quatre types de cellules au sein de l’épiderme : les kératinocytes très majoritaires (environ 80%), les mélanocytes, les cellules immunocompétentes et les cellules de Merkel, ces dernières étant absentes chez l’alpaga (Fleis, Scott, 2010).
La disposition et l’aspect des kératinocytes permet de distinguer 4 couches (figure 5) : la couche basale (stratum basale), la couche épineuse (stratum spinosum), la couche granuleuse (stratum granulosum) et la couche cornée (stratum corneum, compacte puis
Follicule pileux secondaire Glande sébacée Couche cornée aérée
Glande sudoripare Follicule pileux primaire
Épiderme
Derme
24
desquamante). Il n’y a pas de stratum lucidum chez les alpagas, contrairement au lama (Atlee et al., 1997 ; Fleis, Scott, 2010).
Figure 5 : Histologie de l’épiderme de la peau saine du dos d’alpaga en coloration émalun-éosine (Dermatologie, ENVT)
La couche basale est composée des kératinocytes qui sont en contact direct avec la jonction dermo-épidermique. Ils sont attachés à celle-ci. Sur un plan fonctionnel, on distingue trois populations cellulaires : les cellules souches de l’épiderme, les cellules amplificatrices qui se divisent et les cellules post-mitotiques restant en position basale. Elles sont toutes de forme cylindrique avec un cytoplasme et un noyau allongé, le grand axe étant perpendiculaire à la jonction dermo-épidermique.
Dans la couche épineuse, les kératinocytes deviennent polygonaux avec un noyau qui s’arrondit et un cytoplasme plus foncé. Chez l’alpaga cette couche est constituée de 2 ou 3 couches de cellules dans la plupart des parties du corps (Fleis, Scott, 2010).
Dans la couche granuleuse, les kératinocytes s’aplatissent parallèlement à la jonction dermo-épidermique. On peut alors voir l’apparition de granulations basophiles au sein du cytoplasme. Chez l’alpaga, elle est constituée d’une seule couche de cellules et est discontinue (Fleis, Scott, 2010). Elle est plus épaisse uniquement dans l’espace interdigital (2 à 6 couches de cellules), les lèvres (2 à 3 couches) et le paturon (1 à 3 couches) (Fleis, Scott, 2010).
Stratum corneum Stratum granulosum
Stratum spinosum
Épiderme
25 La couche cornée est marquée par la disparition des noyaux des kératinocytes qui deviennent alors des cornéocytes. En profondeur, la couche cornée est compacte, elle devient desquamante à la surface. La conformation chez l’alpaga est celle trouvée classiquement chez les autres mammifères, apparaissant en histologie conventionnelle avec une disposition aérée, dit en « basket waves ». Elle n’est plus compacte que dans l’espace interdigital, les lèvres et les paturons (Fleis, Scott, 2010).
Dans l’épiderme du museau, des lèvres, des joues, du pavillon auriculaire, des paturons et des espaces interdigitaux, il y a de nombreux mélanocytes : un mélanocyte tous les 2 à 10 kératinocytes basaux. Dans ces régions, des grains de mélanine sont présents dans toute l’épaisseur de l’épiderme. Au contraire, dans les autres sites anatomiques testés (Fleis, Scott, 2010), seulement quelques mélanocytes sont présents et les grains de mélanine sont rares.
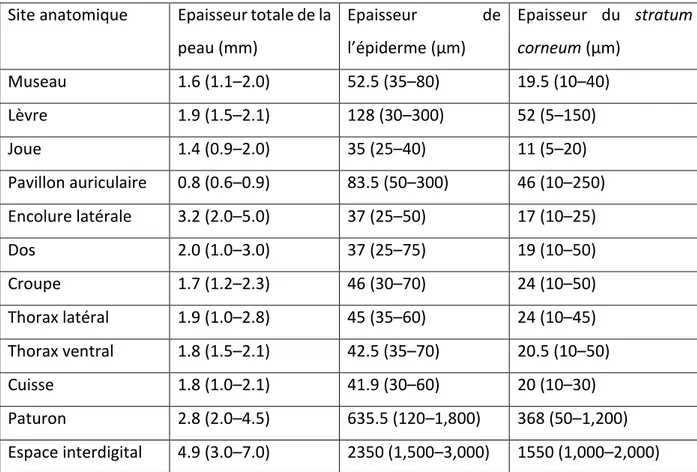
L’épaisseur de l’épiderme et de la couche cornée varie selon le site anatomique chez l’alpaga. L’épaisseur de la peau varie de 0.8 mm à 4.9 mm et celle de l’épiderme de 35 µm à 2350 µm (Fleis, Scott, 2010) (figure 6).
Site anatomique Epaisseur totale de la peau (mm) Epaisseur de l’épiderme (µm) Epaisseur du stratum corneum (µm) Museau 1.6 (1.1–2.0) 52.5 (35–80) 19.5 (10–40) Lèvre 1.9 (1.5–2.1) 128 (30–300) 52 (5–150) Joue 1.4 (0.9–2.0) 35 (25–40) 11 (5–20) Pavillon auriculaire 0.8 (0.6–0.9) 83.5 (50–300) 46 (10–250) Encolure latérale 3.2 (2.0–5.0) 37 (25–50) 17 (10–25) Dos 2.0 (1.0–3.0) 37 (25–75) 19 (10–50) Croupe 1.7 (1.2–2.3) 46 (30–70) 24 (10–50) Thorax latéral 1.9 (1.0–2.8) 45 (35–60) 24 (10–45) Thorax ventral 1.8 (1.5–2.1) 42.5 (35–70) 20.5 (10–50) Cuisse 1.8 (1.0–2.1) 41.9 (30–60) 20 (10–30) Paturon 2.8 (2.0–4.5) 635.5 (120–1,800) 368 (50–1,200) Espace interdigital 4.9 (3.0–7.0) 2350 (1,500–3,000) 1550 (1,000–2,000)
Figure 6 : Tableau de l’épaisseur de la peau, de l’épiderme et du stratum corneum chez l’alpaga d’après (Fleis, Scott, 2010)
26
3. La jonction dermo-épidermique
La jonction dermo-épidermique correspond à la membrane basale sur laquelle repose l’épiderme. Elle est difficile à voir chez les alpagas (Fleis, Scott, 2010).
Elle est normalement constituée de la membrane cytoplasmique des cellules basales de l’épiderme, de la lamina lucida et de la lamina densa. On y trouve aussi des complexes d’ancrage de l’épiderme sur le derme.
4. Le derme et l’hypoderme
Le derme et l’hypoderme sont des tissus conjonctifs sans limite franche entre les deux. Le derme est constitué du derme papillaire et du derme réticulaire plus en profondeur. Le derme papillaire est situé entre les crêtes épidermiques et est constitué d’un tissu conjonctif lâche avec des fibres de collagène fines et isolées. Au contraire, le derme réticulaire est formé d’un tissu conjonctif dense avec des fibres de collagène épaisses et organisées en faisceaux. Les fibres de collagènes sont plus épaisses dans toutes les parties du derme au niveau des espaces interdigitaux (Fleis, Scott, 2010).
L’hypoderme est divisé en lobes eux même subdivisés en lobules graisseux. Entre les lobules, on trouve des septums interlobaires conjonctivo-élastiques qui permettent le passage des vaisseaux et nerfs vers le derme. Les vaisseaux sont d’une taille petite à moyenne et sont présents dans toute l’épaisseur du derme (Fleis, Scott, 2010). Les parois vasculaires sont fines avec un endothélium large. Des érythrocytes sont présents dans la lumière vasculaire. Les cellules mononuclées contenant un cytoplasme éosinophilique sont rares dans la peau de l’alpaga (Fleis, Scott, 2010).
27 5. Le poil et la laine
a) Organisation
Les alpagas ont une peau mature avec une structure des poils semblables à celle de l’adulte vers l’âge de 4 mois dans des conditions environnementales normales (Antonini, 2010).
Figure 7 : Histologie de peau d’alpaga en coupe longitudinale (x400), Badajoz L. et al.,
2009
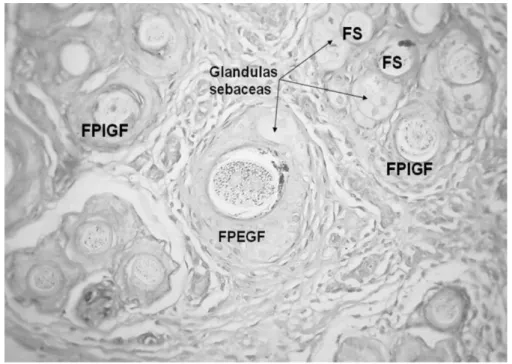
FPIGF= follicule primaire intra groupe folliculaire, FPEGF= follicule primaire extra groupe folliculaire. FS = follicule secondaire, Glandulas sebaceas = glandes sébacées.
Chez l’alpaga, on distingue deux types de groupes folliculaires : les groupes folliculaires complexes et les groupes folliculaires simples (Badajoz L. et al., 2009). Les groupes folliculaires simples sont moins nombreux et se trouvent à la périphérie des groupes folliculaires complexes (figure 7).
Les groupes folliculaires complexes sont composés d’un folliculaire primaire central avec de nombreux follicules secondaires en périphérie (Badajoz L. et al., 2009). Les poils de tous ces follicules émergent par le même orifice à la surface de la peau. Les follicules primaires
28
ont une origine plus profonde dans le derme (figure 8). La délimitation se fait par un tissu conjonctif dense qui s’infiltre entre les follicules pileux.
Figure 8 : Organisation générale des poils chez les mammifères, Grasse, 1967
Dans les groupes folliculaires simples, on ne retrouve que des follicules secondaires qui fusionnent entre eux au niveau de la gaine externe de la racine (Badajoz L. et al., 2009).
Chez l’alpaga, il y a dans 95% des cas une glande sudoripare et moins de quatre glandes sébacées par follicule primaire (Moore et al., 2015).
b) Densité
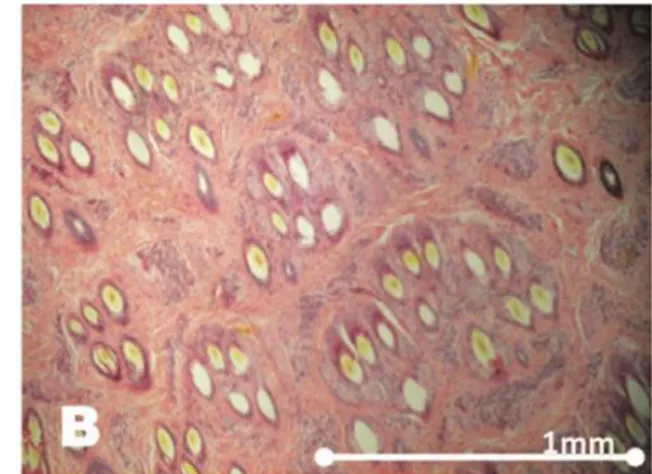
La densité en follicules pileux est inversement corrélée à la taille des follicules pileux (Moore et al., 2015) (figure 9).
29
Figure 9 : observation au même grossissement de la peau chez deux alpagas montrant les différences de taille et de densité des follicules pileux entre les individus :
chez un individu avec une forte densité en follicule pileux (A) et chez un individu avec une plus faible densité (B), Moore et al., 2015
La densité dépend ainsi de l’individu, de l’âge et de la race mais est indépendante du sexe (Antonini et al., 2004). La densité de poils est similaire chez les alpagas huacayas et les alpagas suris. Le maximum de densité est atteint à l’âge de deux mois, diminue puis remonte jusqu’à l’âge de dix mois (figure 10).
Âge (mois) 2 4 6 10
Huacaya 27 18 19 22
Suri 25 21 15 20
Figure 10 : densité en nombre de follicules par mm² chez les alpagas huacayas et suris selon l’âge, d’après, Antonini et al., 2004
D. Les lipides cutanés chez les mammifères
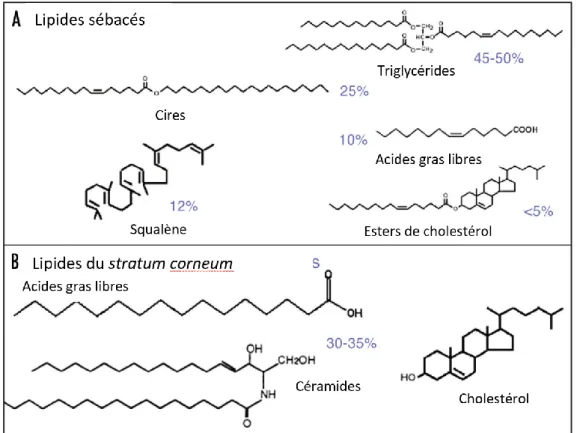
Les lipides de la surface cutané sont issu de de la production des kératinocytes et des glandes sébacées (Pappas, 2009). En quantité, chez l’homme, la production des glandes sébacées, appelé communément sébum, est largement majoritaire. Les lipides issus des kératinocytes resteront majoritairement entre les cellules les plus superficielles et une partie pourra se retrouver mélangée au sébum constituant les lipides de la surface cutanée. La composition de ces deux groupes de lipides est différente (Figure 11) (Pappas, 2009).
30
Figure 11 : Représentation des principaux lipides cutanés chez l’homme et leur répartition chez l’homme (A : lipides sébacés, B : lipides du stratum corneum), d’après
Pappas, 2009
1. Organisation des lipides dans le stratum corneum
a) Le modèle « briques et mortier »
Les lipides situés dans le stratum corneum forment le « mortier » dans le modèle classique en « briques et mortier » de la couche cornée, les cellules constituant les « briques » (Nishifuji, Yoon, 2013). Cet ensemble permet l’homéostase en gardant l’eau et les électrolytes dans l’organisme. Cette structure assure aussi une barrière face aux attaques physiques, chimiques et biologiques.
Les cellules sont allongées grâce aux filaments de kératine maintenus avec de la filaggrine. A cela s’ajoute, la membrane cornifiée des cellules, le tout faisant une structure mécanique solide. Les cellules sont maintenues entre elles par des cornéodesmosomes qui sont dégradés dans la partie la plus superficielle permettant la desquamation.
Diverses enzymes et lipides sont présents dans la partie extracellulaire du stratum
31 longue chaîne (Nishifuji, Yoon, 2013). Les lamelles de lipides extracellulaires sont maintenues grâce aux liaisons covalentes entre la membrane lipidique des cellules et les protéines membranaires. En microscopie électronique, les lipides s’organisent en une bicouche (Marks et al., 2002). Deux types d’organisation de cette bicouche se distinguent, selon que l’alternance de zone sombre et claire qui sont soit régulières ou irrégulières.
Ces lipides forment donc une lamelle lipidique extracellulaire. Ce sont les interactions entre ces différents lipides et avec les cornéocytes qui donnent la structure et la fonctionnalité à cet ensemble.
b) Conséquences sur l’utilisation de traitements topiques
Les propriétés du stratum corneum rendent difficiles le passage des xénobiotiques. Il existe deux voies principales pour le passage des molécules à travers la couche cornée (Herman, Herman, 2015). La voie majoritaire est la voie intercellulaire, les molécules ayant généralement également un passage via la voie intracellulaire (figure 12). La voie intercellulaire se situe entre le réseau dense de cornéocytes, dans le réseau de lipides structurés en bicouches. Les molécules doivent donc passer à travers un passage tortueux mais aussi à travers la succession de domaines lipophiles puis hydrophiles (Marks et al., 2002). La voie intracellulaire, donc à travers les kératinocytes, permet notamment le passage de molécules plus hydrophiles.
La fraction qui passe la peau est généralement très faible. L’utilisation de médicament en percutanée nécessite souvent une amélioration chimique. Les caractéristiques moléculaires généralement nécessaires sont les suivantes (Marks et al., 2002) :
• Petite taille
• Point de fusion bas
• Coefficient de partition octanol-eau d’environ 2 • Solubilité à la fois dans l’eau et dans l’huile
32
Figure 12 : Schéma des voies d’absorption à travers l’épiderme, d’après El Maghraby
et al., 2008
Des excipients peuvent être conçus pour co-diffuser avec le principe actif et ainsi favoriser son incorporation. Ils agissent en général en déstabilisant la structure lipidique du
stratum corneum (Marks et al., 2002).
Une troisième voie dite transcellulaire est possible : c’est le passage des molécules le long des annexes de la peau, c’est-à-dire le long des follicules pileux et le long des canaux excréteurs des glandes (Herman, 2015).
2. Les principales familles de lipides du stratum corneum et de la surface cutanée
a) Origine des lipides
Les précurseurs de lipides de la couche cornée sont des phospholipides, des glucocéramides, des sphingomyélines et des cholestérols. Ils sont formés chez l’homme dans le stratum granulosum et dans le stratum spinosum (Nishifuji, Yoon, 2013), ce dernier n’étant
33 pas présent chez les alpagas (Fleis, Scott, 2010). Ils sont formés dans l’appareil de Golgi et sont libérés lors de la différenciation des kératinocytes. Cette libération se fait par fusion des granules lamellaires de l’appareil de Golgi avec la membrane cellulaire, à la limite entre le
stratum granulosum et le stratum corneum. Ces lipides sont ensuite modifiés et réarrangés
pour former les lamelles lipidiques extracellulaires du stratum corneum.
Les lipides de surface sont principalement sécrétés par les glandes sébacées, qui permettent la synthèse de lipides qui sont pour certains spécifiques à la peau (Pappas, 2009).
(1) Céramides
Les céramides sont des molécules polaires composées d’une base sphingoïde liée à des acides gras par des liaisons amides. Ils sont considérés comme les lipides principaux du
stratum corneum chez l’homme (Nishifuji, Yoon, 2013). Ils ont un rôle prédominant dans la
perméabilité de la barrière de la couche cornée.
Les céramides nouvellement synthétisées sont convertis immédiatement en glucosylcéramides et sphingomyelines dans l’étage suprabasal. Ces constituants sont alors incorporés dans des granules lamellaires puis sécrétés entre le stratum granulosum et le
stratum corneum où ils sont reconvertis en céramides par des enzymes : la
β-glucocerebrosidase et l’amine sphingomyelinase (Nishifuji, Yoon, 2013).
La chromatographie liquide associée à la spectrométrie de masse a permis de distinguer 11 groupes parmi les céramides. Les études réalisées chez l’Homme et chez le chien ont données des résultats similaires (Nishifuji, Yoon, 2013). Chez l’homme, sept de ces groupes correspondent à des céramides retrouvés uniquement dans le stratum corneum.
(2) Acides gras
Les acides gras peuvent être soit libres, soit liés à d’autres molécules : triglycérides, phospholipides, glycocéramides et céramides (Nishifuji, Yoon, 2013). Chez l’homme, l’acide sapienique (C16 :1, Δ6) est le principal acide gras libre de la surface cutané et n’est retrouvé dans aucun autre organe (Pappas, 2009). Certains acides comme l’acide linoléique sont des acides gras essentiels et ne peuvent donc être apportés que par l’alimentation (Pappas, 2009).
34
(3) Cholestérol
Le cholestérol est synthétisé dans les kératinocytes et est métabolisé, au moins en partie, en sulfate de cholestérol. Il est ensuite sécrété dans l’espace extracellulaire lors de la cornéification où il est dégradé de nouveau en cholestérol est alors intégré aux lamelles lipidiques extracellulaires.
(4) Le squalène
Le squalène est un précurseur du lanostérol, qui est lui-même un précurseur du cholestérol. C’est un lipide retrouvé dans de nombreux organes mais son accumulation dans la peau humaine fait figure d’exception. Il jouerait un rôle dans le protection contre les produits de l’oxydation causée par le rayonnement ultra-violet (Pappas, 2009).
(5) Les triglycérides et les cires
Ces lipides sont des lipides neutres, considérés comme des formes réserves pour la peau. Ils jouent un rôle de barrière à la surface de la peau, les cires étant plus résistantes à l’oxydation, à l’hydrolyse et à la chaleur que les autres familles de lipides (Pappas, 2009). Leur présence semble permettre une protection à la fois contre certains agents biologiques et contre une hydratation excessive de la peau.
Les lipides cutanés du stratum corneum et de la surface de la peau jouent ainsi un rôle de barrière cutanée ainsi que dans la diffusion des molécules à la surface de la peau et au travers de celle-ci. La difficulté de traitement des gales chez l’alpaga nous a amenée à étudier les lipides cutanés chez l’alpaga, et à les comparer avec ceux du mouton qui a une toison proche de celle de l’alpaga Huacaya. En effet, l’aspect de la toison du mouton, son utilisation
35 pour la production de laine ainsi que son atteinte fréquente par des gales font du mouton une espèce de comparaison prévilégiée pour notre étude.
DEUXIEME PARTIE : ETUDE EXPERIMENTALE - ANALYSES
DES LIPIDES DE LA SURFACE CUTANEE ET DES POILS CHEZ
LE MOUTON ET L’ALPAGA
37
E. Protocole expérimental
1. Critère d’inclusion des individus
Les animaux sélectionnés pour cette étude appartenaient à des effectifs de taille, de conditions d’élevage et d’hébergement similaires. Les prélèvements étaient programmés avant la tonte, à une période semblable.
2. Prélèvements réalisés
Les prélèvements ont systématiquement été réalisés sur le dos, le flanc et le ventre de tous les animaux (figure 13).
Figure 13 : Lieux de prélèvements des lipides et poils sur les moutons et les alpagas a) lipides de la surface cutanée
Les poils ont été écartés de sorte à visualiser la peau sans la toucher afin de ne pas contaminer le prélèvement. Le prélèvement était réalisé à l’aide d’un coton tige imbibé d’une solution disolvante puis l’extrémité du coton tige était transféré dans un tube Ependorff après avoir été coupé et identifié. Le dissolvant est une solution fournie par le laboratoire SYNELVIA (31, Labège) ; sa composition précise n’est pas connue.
38
Cette technique de prélèvement permet d’obtenir des résultats plus reproductibles qu’avec des raclages cutanés ou qu’avec une séparation de l’épiderme par la chaleur (Angelbeck-Schulze et al., 2013).
b) Lipides de la surface pilaire
La zone de prélèvement était adjacente à celle des lipides de surface. Les poils étaient coupés aux ciseaux au ras de la peau. L’extrémité la plus proche de la peau a alors été coupée à environ 1,5 cm et placée dans un tube sec pour le transport jusqu’au laboratoire .
Tous les prélèvements ont été transportés dans des glacières réfrigérées et conservés au congélateur à -80°C.
Chaque échantillon était identifié de sorte qu’il soit associé à l’animal et à la zone sur laquelle il a été prélevé.
Les prélèvements sur les alpagas ont été réalisés en mai 2016 et ceux sur les moutons ont été fait en juin 2016.
3. Méthode d’analyse
L’analyse des prélèvements a été confiée au laboratoire Synelvia (31, Labège).
Suite à des problèmes sans lien avec l’étude, seuls les échantillons issus du dos ont pu être analysés. Le choix de l’analyse des échantillons du dos porte sur deux aspects distincts. Premièrement il s’agit d’une zone non atteinte par la gale et permettant ainsi d’éviter un biais dû à une peau parasitée. Deuxièmement, la ligne du dos correspond à la zone d’application des produits utilisés en « spot on » ou en « pour on ». La composition lipidique de cette partie du corps permettra ainsi de mieux analyser le devenir des produits ainsi utilisés.
Les échantillons ont été analysés par chromatographie en phase gazeuse couplée à une spectrophotométrie afin d’identifier les différents lipides présents et d’en faire une analyse quantitative. Cette technique d'analyse permet de combiner les performances de la chromatographie en phase gazeuse, pour la séparation des composés d'un échantillon, et de
39 la spectrométrie de masse, pour la détection et l’identification des composés en fonction de leur rapport masse sur charge.
Lors de la chromatographie en phase gazeuse, le mélange est vaporisé à l'entrée d'une colonne, qui contient une substance active solide ou liquide appelée phase stationnaire. Ensuite, il est transporté à travers la colonne à l'aide d'un gaz porteur (ou gaz vecteur). En fonction de l’affinité des molécules avec la phase stationnaire, les composés vont sortir de la colonne à des temps différents, permettant de les séparer. La spectrométrie de masse permet ensuite d’identifier les molécules en fonction de leur rapport masse-charge.
Afin de reconnaître les lipides sur la chromatographie, un témoin a été utilisé pour référence avec des molécules connues. Ainsi, la distinction a pu être faite entre les acides gras (C14 :0, C18 :1, C16 :0 et C18 :1), le squalène, les dérivés de cholestérols, le cholestérol, les stérols, le lanostérol, le lanosténol, les esters de cholestérols et les glycérides.
Pour les lipides des poils, seuls les acides gras ont été recherchés.
La recherche et l’identification des lipides polaires comme les céramides, qui est beaucoup plus complexe et coûteuse, n’a pas été réalisée lors de cette étude.
F. Résultats
1. Animaux inclus dans l’étude
a) Les alpagas
Vingt alpagas huacayas ont été inclus dans cette étude. Tous sont issus de l’effectif d’un particulier qui utilise ces animaux comme animaux d’agrément. Le troupeau concerné avait été atteint d’un épisode de gales sarcoptique et chorioptique. Plusieurs individus étaient morts avant qu’un traitement approprié ne soit mis en place.
(1) Répartition en âge et en sexe
L’âge des alpagas inclus dans l’étude varie de 8 mois à 8 ans avec une moyenne à 4,8 ans (voir annexe 4).
40
Seul deux mâles ont été inclus dans l’étude (10% des individus). Une des femelles était gestante au moment des prélèvements (annexe 4).
(2) Traitements antérieurs
Tous les alpagas inclus dans cette étude ont été atteints en octobre 2015, à des stades plus ou moins avancés, par un épisode de gale sarcoptique associée ou non à une gale chorioptique, confirmées par raclage.
Un protocole associant un traitement topique individuel (shampooing et solution acaricide d’amitraz) hebdomadaire et un traitement systémique bi-mensuel acaricide (ivermectine) a été mis en place sur la totalité des alpagas.
La tonte, initialement prévue, n’a été effectuée que chez deux animaux, en raison de difficultés techniques (peignes des tondeuses rapidement défectueux) et des conditions météorologiques.
Le protocole initial a été adapté en fonction de la disponibilité des propriétaires et de l’équipe intervenante.
Traitement topique réalisé à V1, V1 + 1 semaine, V1 + 2 semaines, V1 + 3 semaines,
V1 + 7 semaines et V1 + 9 semaines :
• shampooing de tous les alpagas (face, membres et abdomen ventral) avec un shampooing à 3% chlorhexidine (Douxo Pyo©),
• rinçage au jet,
• application d’une solution à 0.025% d’amitraz (Ectodex©, 5 mL dilués dans 10 L d’eau tiédie) sans rincage.
Traitement systémique réalisé à V1, V1 + 2 semaines, V1 + 7 semaines et V1 + 9
semaines : ivermectine voie sous-cutanée, 500 μg/kg (Virbamec© solution injectable pour bovins, 1 mL/20 kg). Les prélèvements de l’étude ont été réalisés à l’occasion d’une visite de contrôle le 19/05/2016 soit 4 mois après le dernier traitement.
41 (3) Lésions encore présentes au moment des prélèvements
Bien que l’amélioration clinique soit importante après le traitement, des lésions subsistaient au moment où ont été réalisés les prélèvements. Ces lésions touchaient inégalement les individus. Chaque individu a été évalué selon un score d’intensité lésionnelle classé en « nulle », « faible », « modérée », « moyenne » ou « grave » (voir annexe 3).
Les lésions présentes sur l’ensemble du corps de l’alpaga ont également été relevées ainsi que leur localisation (annexe 5).
Six individus présentaient une intensité lésionnelle considérée « nulle », six considérée comme « faible », trois comme « modéré » et cinq comme « moyenne ». Les lésions les plus souvent répertoriées étaient le squamosis et la lichénification. Des croûtes, de l’érythème, de la séborrhée, des papules inflammatoires ou encore une hyperkératose ont également été observés.
Ces lésions n’atteignaient cependant jamais le dos, lieu de prélèvement des échantillons analysés.
b) Les moutons
Les vingt moutons utilisés dans cette étude sont des moutons de race cheviot appartenant à l’UMR IHAP de l’école nationale vétérinaire de Toulouse. Il s’agissait exclusivement de femelles, toutes âgées de 3 ans et 3 mois au moment des prélèvements (annexe 6).
2. Abondance des lipides de la surface cutanée
La quantité de lipides neutres totaux chez l’alpaga s’est avérée beaucoup plus faible que chez le mouton. En moyenne une quantité 33 fois plus faible est obtenue chez l’alpaga : le ratio entre le prélèvement et l’étalon de la machine est de 0,6 contre 20,02 chez le mouton (figure 14).
42
Figure 14 : Répartition des teneurs totales en lipides à la surface de la peau des moutons et des alpagas en pg/100mg de poils
Pour les alpagas comme pour les moutons, un individu présente des valeurs très supérieures aux autres individus. Aucun facteur d’âge ou de sexe ne permet d’expliquer cette différence.
Cette moindre quantité chez l’alpaga se retrouve pour l’intégralité des marqueurs à l’exception des squalènes et les glycérides (figure 13). Les résultats de la spectrophotométrie de masse des moutons et alpagas séparés est disponible en annexe 1.
Les acides gras saturés C14:0, le lanostérol ainsi que les esters de cholestérols n’ont été retrouvés chez aucun alpaga. Les glycérides n’ont été présents que chez trois alpagas et absents chez tous les moutons.
43
Composés C14:0 C18:1 C16:0 C18:0 Squalène Dérivés de
cholestérol
Moyenne alpagas / 0.0150 0.1480 0.1440 0.0310 0.0740 Moyenne moutons 0.09 0.06 0.59 0.53 0.01 2.43
Comparaison / -73% -75% -73% +520% -97% p value / 6.40E-07 1.37E-04 7.04E-07 3.79E-09 1.63E-08
Composés Cholestérol Stérols Lanostérol Lanosténol Esters de
Cholestérol Glycérides
Moyenne alpagas 0.0890 0.0620 0.0290 / / 0,0074 Moyenne moutons 5.45 0.58 0.67 0.54 4.61 /
Comparaison -98% -89% -96% / / / p value 4.05E-09 3.09E-06 0.00555939 / / /
Figure 15 : Tableau comparatif des moyennes des teneurs lipidiques chez les alpagas et chez les moutons et p value associées
La quantité d’acides gras diminue de l’ordre de 75% chez les alpagas par rapport aux moutons, la diminution est de l’ordre de 90% pour les autres composés. L’acide gras C14:0, le lanostérol et les esters de cholestérols sont présents chez tous les moutons mais absent à la surface cutanée des alpagas.
La surface cutanée de l’alpaga contient 5,2 fois plus de squalène que celle du mouton. La quantité chez l’alpaga reste cependant très faible avec seulement la détection de traces.
Les glycérides n’ont été trouvés que chez trois alpagas en faible quantité. Ils sont absents chez tous les moutons (figure 15 et 16).
En considérant les formes réserves de lipides, à savoir le squalène, les glycérides et les cires, leur quantité est très supérieure chez les moutons.
Les différences observées sont toutes très largement significatives (test de Student, p<0,05).
44
En bilan, chez les alpagas les acides gras saturés sont très largement majoritaires, notamment C16:0 et C18:0 qui représentent environ 50% des lipides neutres totaux détectés. Le squalène et les formes réserves (cires, glycérides et esters de cholestérol) restent faiblement présents. Le cholestérol représente environ 15% des lipides neutres totaux. Le cholestérol et les composés de la même famille comptent pour environ 40% des lipides neutres totaux (figure 14).
Chez le mouton, des acides gras saturés sont présents, notamment C16:0 et C18:0 qui représentent environ 5% des lipides neutres totaux. Le squalène est très faiblement présent. Les formes réserves (cires, glycérides et esters de cholestérol) sont largement majoritaires. Le cholestérol représente environ 25% des lipides neutres totaux, les esters de cholestérol environ 23% et les dérivés du cholestérol environ 12% également. Le cholestérol et les composés de la même famille comptent pour environ 70% des lipides neutres totaux (figure 14).
Composés Alpagas Mouton
C14.0 0% 1% C18:1 2% 0% C16:0 23% 4% C18:0 22% 3% Squalène 5% 0% Dérivés de CT 12% 16% Cholestérol 14% 35% Stérols 10% 4% Lanostérol 5% 4% Lanosténol 0% 3% Esters de CT 0% 30% Glycérides 8% 0%
Figure 16 : tableau comparatif de la répartition moyenne relative des lipides cutanés chez le mouton et l’alpaga
45
Figure 17 : résultats superposés des profils en spectrophotométrie de masse dans les séries des moutons (bleu) et des alpagas (noir)
3. Analyse des acides gras des poils
Figure 18 : profil spectrophotométrique des acides gras des poils du mouton (bleu) et de l’alpaga (noir)
46
Dans les poils, chez l’alpaga comme chez le mouton, les acides gras saturés sont très largement majoritaires. Les seuls acides gras insaturés détectés chez les deux espèces sont les acides oléiques (C18 :1) et linoléiques (C18 :2). Aucun acide polyinsaturé n’est présent.
Les profils en acides gras obtenus montrent que, chez le mouton comme chez l’alpaga, les acides gras saturés à courte chaîne (C16 et C18 :0) sont majoritaires (figure 18). Les quantités observées dans les deux espèces sont par ailleurs très proches avec au total 197 pg/100mg de poils chez le mouton et 200 pg/100mg de poils chez l’alpaga. Les prélèvements chez les moutons ont donné des résultats relativement homogènes contrairement aux alpagas chez qui la variabilité est plus importante (figure 19).
Figure 19 : répartition, moyenne et écart type des teneurs en acides gras totaux sur les poils des moutons et des alpagas
47 Alpagas Moutons C16:0 15% 23% C18:0 33% 24% C20.0 8% 5% C22:0 7% 6% C24.0 14% 15% C26:0 5% 8% C18:1 Ion 55 15% 17% C18:2 4% 2% Somme AGs 100% 100%
Figure 20 : comparaison de la répartition en acide gras moyenne de la laine des alpagas et des moutons
Les répartitions sont très similaires aussi, avec pour différence majeure le rapport C16/C18 :0 (figure 20). Ce ratio est en moyenne de 1 chez le mouton et de 2,3 chez l’alpaga.
Le rapport acides gras saturés sur acides gras insaturés est de 4,5 chez le mouton et de 5,8 chez l’alpaga.
G. Discussion
1. Limites de l’étude
a) Taille et composition des effectifs
La taille des effectifs, bien que limitée à 20 individus par espèce, a semblé être suffisante pour obtenir des différences qui sont significatives et interprétables.
La différence de composition des groupes en termes de sexe et d’âge peut apporter un certain biais aux résultats obtenus. En effet, l’effectif de moutons était exclusivement composé de femelles alors que deux mâles étaient présents dans le groupe alpaga (individus 6 et 7). L’alpaga 5 était une femelle gestante. Les prélèvements issus de ces trois individus révèlent cependant des résultats similaires à ceux obtenus chez les autres animaux.