RÉACTION DE PRINS-PINACOL OXYDATIVE ET SYNTHÈSE ASYMÉTRIQUE DE
LA FORTUCINE
THÈSE
PRÉSENTÉ
E
COMME EXIGENCE
PARTIELLE
DU DOCTORAT EN CHIMIE
PAR
MARC-ANDRÉ BEAULIEU
UNIVERSITÉ DU QUÉBEC
À
MONTRÉAL
Service des bibliothèques
Avertissement
La
diffusion de cette thèse se fait dans le respect des droits de son auteur, qui a signé le
formulaire
Autorisation de reproduire et de diffuser un travail de recherche de cycles
supérieurs (SDU-522
- Rév
.01-2006)
.
Cette autorisation stipule que
«conformément
à
l
'
article 11 du Règlement no 8 des études de cycles supérieurs
,
[l'auteur] concède
à
l
'
Université du Québec
à
Montréal une licence non exclusive d'utilisation et de
publication de la totalité ou d
'
une partie importante de [son] travail de recherche pour
des fins pédagogiques et non commerciales
.
Plus précisément, [l
'
auteur] autorise
l
'
Université du Québec à Montréal à reproduire
,
diffuser, prêter, distribuer ou vendre des
copies
de [son] travail de recherche
à
des fins non commerciales sur quelque support
que ce soit
,
y compris l
'
Internet. Cette licence et cette autorisation n
'
entraînent pas une
renonciation de [la] part [de l'auteur]
à
[ses] droits moraux ni
à
[ses] droits de propriété
intellectuelle
.
Sauf entente contraire
,
[l
'
auteur] conserve la liberté de diffuser et de
Tout d'abord
,
je
souhaite
remercier
le
Pr. Sylvain
Canesi
pour m
avoir accue
illi
dans
son
laboratoire
et
pour m'avoir donné la
chance
de prendre part
à
des projets
aussi ambitieux.
Ses
précieux conseils, que ce
soit au
niveau expérimenta
l
ou théorique, m'ont
grandement aid
é à
m'améliorer
e
n
tant
qu
e scientifique
et
m'
ont
perm
is
d'
atteindre mes
objectifs plus
rapidement.
Son dévouement et
sa
passion
à
l'
égard
de
l
a chimie organique ont été très
inspirants pour moi.
J'aim
erais évidemment
remercier
m
es
collègues
avec
qui j'ai passé beaucoup de temps
au
labo
ratoire
et, dans une moindre mesure bien
sû
r, autour
d
'
une bonne bière. Avec
la
plupart
d'entre eux
,
j
'
ai développé des
liens
d'amitié qui
,
je
l'
espère
,
perdureront.
Ils
sont eux
aussi
responsables
du bon déroulement de mes b·avaux de doctorat.
J'aimerais
aussi
remercier le Pr. Daniel Chapdelaine
et
le
Pr. Sylvain Canesi pour m'avoir
permis de réaliser des
stages
qui
ont été
déterminants dans ma prise de décision de poursuivre
aux études graduées en
chimie organique. Je tiens
éga
lement
à remercier Helmi
Zaghd
ane
pour
m'avoir
formé
à
la paillasse.
De
p
lu
s,
je
voudrais
remercier tous
les
membr
es du corps
professoral
,
en pm1iculie
r le
Pr. Daniel
Chapdela
ine,
le Pr.
Livain Breau
,
le
Pr. René Roy
et
le Pr. Alexandre Gagnon pour avoir déjà
fa
it
pa1tie des membres de mon jury dans
le
cadre
des cours prévus
au
programme. Je tiens
aussi à
remercier tous
les employés
de I
'UQAM
qui
ont facilité
les démarches
adminisb·atives
pour lesquelles j
'avoue être
absolument dépourvu
d
'aptitudes.
Je remercie
aussi
le Pr.
Livain
Breau
et
le
Pr. Huu Van
Tra
pour leur
travail
au
sein
du dépmtement.
Je
souhaiterais
remercier
Alexandre Arnold
pour
ses consei
ls en
RMN,
ainsi
que
Leanne
Oh! und
et
Vladimir Kriuchkov pour
leurs analyses
SMHR.
Enfin,
je tiens
à
remercier ma famille pour
le
ur soutien
financier et moral
,
pour
leur
mn our
et
pour
leur
compréhension.
Il
e
n
va de même pour Marie-Christine,
sans
qui tout cela aurait
été
bien plus diffic
il
e.
TABLE DES MATIÈRES
LISTE DES FIGURES
ET
SCHÉMAS
...
.
...
...
....
...
...
.
...
..
i
v
LISTE DES
ABRÉVIATIONS,
SIGLES
ET ACRONYMES
...
...
... v
RÉSUMÉ ...
...
..
....
.
...
...
...
...
..
..
.
...
..
.
...
..
..
.
...
x
ABSTRACT ...
...
.
...
...
..
..
...
...
....
...
.
...
..
...
.
...
....
..
...
...
.
...
xi
INTRODUCTION ...
..
...
...
.
.
..
...
.
...
....
....
....
..
...
...
...
.... 1
1
. L
'
i
ode hypervalent
en synthèse ...
.
1
2.
Umpolung c
l
assique et
Umpolung aromatique ... 5
CHAPITRE
1
RÉACTION DE PRINS
-PINACOL OXYDA TIVE ...
...
...
..
...
...
1
2
1
.1.
Int
r
oduction ...
.
...
.
...
..
...
.
....
.
...
...
...
12
1.2. "OXIDATIVE PRINS-PINACOL TANDEM PROCESS MEDlA
TED
BY
A
HYPERVALENT IODINEREAGENT: SCOPE
,
LIMITATIONS, AND
APPLICATIONS"
ARTICLE
..
.
...
....
...
.
...
.
.
.
...
...
..
...
...
.
..
..
.
...
..
.
.
...
...
.
...
16
1.3.
Conc
l
us
i
o
n .
...
.
...
.
...
...
...
...
...
....
.
.
.
..
...
.
...
...
...
.
... 29
1.4.
Informations
supplémentaires ...
.
...
.
... 29
CHAPITRE
II
SYNTHÈSE
ASYMÉTRIQUE
DE LA
FORTUCINE
...
..
...
30
2
.1.
Introduct
i
o
n
...
.
...
...
....
..
...
...
.
..
...
..
...
.
...
30
2.2. "ASYMMETRIC SYNTHESIS OF FORTUCINE AND REASS
IGNMENT OF J
TS
ABSOLUTE
CONFIGURATION"
ARTICLE
...
..
... 38
2
.
3.
Conc
l
usion ...
...
...
.
.
..
.
..
.
...
...
.
...
..
...
..
... 43
2.4.
I
nfor
m
ations supp
l
éme
n
ta
ir
es ...
..
...
..
.
..
....
.
..
..
...
....
...
..
....
...
..
.
43
ANNEXE
A
"OXIDATIVE
PRINS-PINACOL
TANDEM
PROCESS MEDIA
TED
BY
A
HYPERVALENT lODINE
REAGENT: SCOPE,
LIMITATIONS
,
AND
APPLJCATIONS"
SUPPORTING INFORMATION. ...
..
...
.
...
.
...
...
...
..
.
.
44
ANNEXEB
"ASYMMETRJC SYNTHESIS
OF
FORTUCINE AND
REASSIGNMENT OF
I
TS
ABSOLUTE
CONFIGURAT
ION"
SUPPORTING
INFORMATION.
...
....
...
14
1
BIBL! OGRA PHIE
....
...
.
...
.
...
.
...
178
Réactif
s
à base d
'
iod
e
h
ypervalent ...
.
...
.
..
...
...
...
...
.
...
.
... 2
2.1 Str
u
ct
ur
es
des
a
l
ca
l
oïdes
de
type
l
ycorines
r
apportées
dan
s
l
a
l
ittérature
...
.
..
.
.... 30
2.2
Résu
l
tat
s
de
s
a
n
a
l
yses
DRX
...
.
...
..
...
.
... 37
SCHÉMA
Exemp
l
es
de
tra
n
sformatio
n
s
utilisant
l
'
iode
h
yperva
l
ent.. ...
.
....
..
...
.
..
...
.
..
...
...
4
2
Umpo
lun
g
de
Seebach et Co rey
.
...
...
....
.
..
.
...
....
.
...
.
...
.
.
..
.
.
...
....
...
...
.
..
...
.
..
.
..
... 5
3
Réaction de
Stetter
...
...
..
.
.
.
..
.
..
.
.
...
...
...
..
..
.
...
.
...
.
...
..
...
...
...
..
.
.
.
...
..
....
.
....
...
..
.
..
.
.
..
.
.... 6
4
Activat
i
on
umpolung au Sml
2en sy
n
thèse ... 6
5
Mécanismes d
'
act
i
vatio
n
umpolung
de phéno
l
s
à
l'
i
ode
h
yperva
l
ent ...
.
... 7
6
Recouvrement
orbita
l
a
ir
e
impossible
l
ors
d
'
une
S
N
2'
.
....
..
.
..
.
...
..
...
...
...
... 8
7
Mécanisme d
'oxy
dation de phénols à
l
'
iod
e
h
yperva
l
ent
par
SET
...
...
...
9
8
Activation
umpolung aromat
iqu
e et
régiosélectivlté
...
.
...
...
...
.
....
.
...
10
1
.1
Réac
t
i
on
de Prin
s
-pinacol
en synthèse
de produit
s
n
at
u
re
l
s ...
.
...
..
.
..
.
.
...
.
..
.
...
...
....
12
1.
2
Réaction
de
Pri
n
s
-pin
aco
l
oxydat
i
ve ...
...
...
13
1.
3 Sy
n
thèses
de
l
a (
-
)
-pl
ate
n
s
im
yci
n
e
de
Nico
l
ao
u
...
...
...
...
.
...
14
1.4 Réaction de Prin
s
-pinacol
oxydative et son app
li
cation à
l
a
sy
nthè
se
de
l
a
(-)
-pl
atensimyci
n
e ....
..
.
.
...
.
.
.
..
.
...
...
....
.
...
.
...
..
.
...
.
....
..
...
...
.
..
....
...
..
.
..
...
.
.
.
.
..
...
...
15
2.1 Cascade
r
adica
l
a
ir
e
propo
sée
par
l
e groupe
de
Zar
d
...
.
...
.
..
.
31
2.2 Ana
l
yse
rétro
sy
nthétique
de
l
a
sy
nthè
se
asymétrique
de
l
a
fortucine
...
.
.
.
.
.
... 32
2
.
3
Méthodologie de Wipfpour
l
a synthèse
de
systèmes azab
ic
yc
liqu
es ...
.
...
.
.. 33
2.4 App
li
cat
i
on
de
l
a méthodo
l
ogie
de Wipf à
l
a synthèse
de
l
a fortucine ..
.
... 34
2.5
D
éca
rbo
xy
l
at
i
on
radical
ai
r
e oxydative
d
'ac
ide
s
am
in
és
N
-
s
ubstitué
s ...
...
..
.
...
...
35
LISTE
DES
ABRÉYIA TI ONS
,
SIGLES ET ACRONYMES
Â
Angstrom
A1.
2
Tens
ions
1
,
2-allyliques
AI
,
3
Tensions 1
,3
-allyliques
Ac
Acétyle
A co-
Ion acétate
Ac
2
0
Anhyd
rid
e acétiqu
e
AcOH
Ac
ide acétique
A
cO Et
Acétate
d
'
éthyle
AgN0
3
Nitrate
d
'
argent
AIBN
Azobisisobuty
ron
itri le
aq.
Aqueux
Ar
Ary
l
e
BF
3
•
0Et
Tri
tl
uorure
de bore
éthérate
Bn
Benzyle
Br
Brome
BuLi
Butyllithium
Bu
3
SnH
hydru
re
de
tributy
létain
Bu'
Te1
t
-butyle
Cal
cd
Calcu
l
é
Cat.
Catalytique
CD
Dichroïsme
cü
·
cula
ire
CDC1
3Chloroforme deutéré
CDJ
1
,
1'-Carbonyldiimidazole
CH
3CN
Acéton
itril
e
CHC
I
3
Chloroforme
Cl
Chlore
cr
Chlorure
co
2
C02
Me
CuCl
2Cu(OAc)2
Cu(OT:f)
DBU
DCC
DCM
DIB
DIBAL-H
DMAP
DMF
DMP
DMSO
DMTSF
dr
ee
en
t
RSE
Et
Et
3N
EtOH
EtOAc
ESI
Et
20
FeS04
H
Dio
xy
de de
carbone
Alcanoate de
méth
y
l
e
Chlo
rur
e de cuivre(II)
Acétate
de
cuivre(II)
T
ritl
uoromét
h
anesu
l
fonate
de
cuivre
1
,
8-diazabicyc
l
o[5.4.0]undéc-7
-
ène
N,N
-Dic
ycl
ohexylcarbodiim
i
de
Dichlorométhane
(Diacétoxy)
i
odobenzène
Hydrure
de Diisobutylaluminium
Dimeth
yl
aminopyr
idin
e
Diméth
yl
formamide
De
ss
-Martin périodinane
Diméthyl
s
ulfox
y
de
Diméth
y
l(méth
y
lthio
)sulfonj
um
tétra tl uoroborate
excès diasté
r
éomér
ique
Diffractométrie des rayon
s
X
É
l
ectrophile
Électron
Excès énantiomérique
É
nantiomère
Résonance
de
spin é
l
ectronique
Ét
hyle
Triéthylamine
Ét
hanol
Acétate
d
'
ét
hy
l
e
Ion
isat
ion
par é
l
ectronébuliseur
Éther
d
ié
th
y
liqu
e
Sulfate ferreux
H
yd
r
ogène
1-IBF
4I-II0
4
H
20
H
z
O
z
HFIP
1-IMPA
HOBt
HRMS
I-ISiEt
3H
z
hu
I
z
IBX
IR
K
z
C0
3
KOH
L
iBH4
Lil
LiOOH
LDA
LN
LRMS
Me
MeM
g
Br
MeNl-IOMe
Me
OH
m-CPBA
M
gS04
MH
z
Na
BJ-1
4
Acide tétrafluoroboriqu
e
Acide
periodique
Eau
Peroxyde d'hy
dro
gè
n
e
H
exa
fl uoroi
so
propanol
He
xa
m
ét
hylpho
s
phor
a
mid
e
1-Iydroxyben
z
otria
z
ole
Sprectrosc
opie de
M
asse
Haute Ré
s
o
l
ution
Triéthylsilane
1-Ieiiz
lumièr
e (ph
otochimie)
Di
iode
ac
id
e 2-iod
oxybenzoïqu
e
Infrarouge
Carbonate
de pota
ss
ium
H
y
drox
y
de de potassium
Boroh
y
drure
de
lithium
Jodur
e
d
e lithium
H
y
dropero
xy
de de
lithium
Dii
so
prop
ylami
dure
d
e li
thium
Naphtal
énide
de
lithium
Sprectroscop
ie de
Ma
sse
Ba
sse
Ré
so
luti
on
Méth
yle
Brom
ure
de méth
ylmagnés
ium
N,O
-Diméth
y
lh
y
dro
xylamine
Métha
nol
Acide
m
é
t
ac
hloroperb
e
n
zo
ïqu
e
Su
lfa
te
de
m
agnés
ium
M
égahe1
1z
Borohyd
rure de so
dium
n-Bu
n-D
ec
n
-h
exa
n
e
Na
2
C
0
3
N
aHC0
3
N
a
i0
4
Na2
S0
4
Na2
S
2
0
3
NHC
NH
4
CI
NS0
2
R
Nu (Nu-)
00
3
Ortho
Ns
-
C
l
p
P
CC
Pd
(
PPh
3
)4
Ph
P
h
i
=
NT
s
PhiO
Phl
(
O
A
c
)
2
P
I
FA
PhSH
P
y
r
R
r
t
RMN
sa
t.
SET
G
r
o
up
e
lin
é
r
a
ir
e b
u
ty
l
e
Gr
o
up
e
li
néa
ir
e
d
éca
n
y
l
e
A
l
ca
n
e
l
in
é
r
a
ir
e
h
exa
n
e
Ca
rb
o
n
a
t
e
d
e so
dium
H
y
dr
ogé
n
oc
arb
o
n
a
t
e de
so
d
iu
m
Pe
r
i
o
d
at
e
de
so
d
ium
S
ulf
a
t
e
d
e so
dium
Thio
s
u
l
fa
t
e
d
e
so
d
i
um
Ca
r
b
è
n
e
h
é
t
é
roc
yc
l
iqu
e az
ot
é
Chlorur
e
d
'
ammonium
Su
l
fon
a
m
ide
N
u
c
l
éop
hil
e
Ortho
O
z
o
n
e
C
h
l
o
rur
e
d
e 2
-n
i
t
r
ob
e
n
zè
n
es
u
l
fon
y
l
e
Para
c
h
l
o
ro
c
h
ro
m
a
t
e
d
e
p
y
rid
i
nium
Té
tr
ak
i
s(
tri ph
é
n
y
l
ph
os
phi n
e )
p
a
l
l
a
di um
(
O
)
Ph
é
n
y
l
e
(N
-
(p
-t
o
l uène
s
u
l
f
o
n
y
l
)
i mi no
)
ph
é
n
y
l
i
o
d i n
a
n
e
i
o
do
s
ob
e
n
zè
n
e
Di
acétoxy
i
o
d
o
b
e
n
zè
n
e
(
DIB
)
B i
s(
trifl u
o
r
acé
t
oxy)
i
o
d
obe
n
zè
n
e
Thi
o
ph
é
n
o
l
P
y
ri
d
in
e
G
r
o
up
e a
l
ky
l
e
Te
mp
é
r
at
ur
e a
mbi
a
nt
e
Réso
n
a
n
ce Magné
tiqu
e Nuc
l
éa
ir
e
S
a
tur
ée
S
m
h
S A
r
S
n
C
1
4SOC
I
2s
/
T
B
AF
T
BDM
SC
I
T
B
S
T
B
S
-O
Tf
t
-Bu
T
FA
T
FE
THF
TIP
S
TI
P
SC
I
TLC
t
p
uv
w
/
w
X
-R
ay
.
7tu
I
o
dur
e
d
e Sa
m
a
rium
(
II
)
S
ub
s
ti
t
uti
o
n nu
c
l
éo
phil
e a
r
o
m
at
iqu
e
C
hl
o
ru
re d
'
éta
in
(
I
V)
C
hl
o
rur
e
d
e t
h
io
n
y
l
e
Hy
br
i
d
a
t
io
n s
p
2F
lu
oru
r
e
d
e tetrab
u
tyla
mm
o
nium
C
hl
o
rur
e
d
e t
e
rt
-b
uty
l
d
im
ét
h
yls
il
y
l
e
T
e
rt
-bu
ty
ldim
é
t
hy
l
s
il
y
l
e
T
r
ifl
u
o
r
o
m
ét
h
a
n
es
ul
fonate
d
e te
r
t
-b
uty
l
d
im
ét
h
y
l
s
il
y
l
e
T
e
rt-buty
le
Ac
id
e t
rifl
u
o
r
oacé
tiqu
e
T
ri fl u
o
r
oé
th
a
n
o
1
Té
tr
ahy
dr
of
ur
a
n
e
T
rii
sop
r
opy
l
s
il
y
l
e
C
hl
o
rur
e de t
rii
s
o
pr
o
p
y
l
s
il
y
l
e
C
hr
o
m
atog
r
a
phj
e s
ur
co
u
c
h
e m
in
ce
Tempé
r
a
tur
e a
m
b
i
a
n
te
Ult
r
av
i
o
l
et
-
Vis
ibl
e
P
ou
r
cen
t
age ma
ss
i
que
Di
ff
r
acto
m
é
t
rie des
r
ayo
n
s
X
O
rbi
ta
l
e
n*
No
m
b
r
e
d
'o
nd
e
Pos
i
t
i
o
n
a
Ac
ti
v
i
té o
ptiqu
e
P
os
i
t
i
o
n
~
ix
Un
n
ouveau
procédé
oxydat
i
f
tandem
de
l
a
r
éact
i
on
de Prins-pinacol
a été
mis
a
u
point.
La
ve
r
s
i
on
umpolung
a
r
o
matiqu
e
de
cette
transformation
a été
déve
l
oppée
à par1ir de phénols
s
impl
es su
i
va
nt un
processus
oxydat
i
f
impliquant
l
'
utilisation
d
'
un r
éact
i
f à
ba
se
d
'
iod
e
h
ype
rv
a
l
e
nt.
Cette
m
ét
hode
a
permis
l
'
é
l
a
b
orat
ion
de
systè
m
es
co
mp
ac
t
s
et
pol
yfo
ncti
o
nnali
sés
de
type s
piro[4
.5]déca
n
y
l
co
nt
e
n
a
nt
des centres quaternaires reliés
à
des
carbones
sp
2à
par1ir de
s
imple
s
phénols peu cher
s
et
rapidement
access
ibl
es
.
Les
limit
es
de
l
a
r
éact
ion
o
nt
été ét
udi
ées e
n utili
sa
n
t
d
es
ph
éno
l
s co
nt
e
n
a
nt de
s a
l
cè
n
es
et
d
es a
l
cynes
plu
s
ou
moin
s e
ncombr
és. La sté
r
éosé
l
ect
ivit
é
d
e
l
a
tr
ar
1
sfo
rmation
a a
u
ss
i
é
t
é ét
udi
ée à
par1ir
de
ph
é
n
o
l
s co
nt
e
n
a
nt
déjà
un
ce
ntr
e asy
m
ét
riqu
e
tertiaire ou
quatern
a
ire
contrôlé.
Enfi
n
,
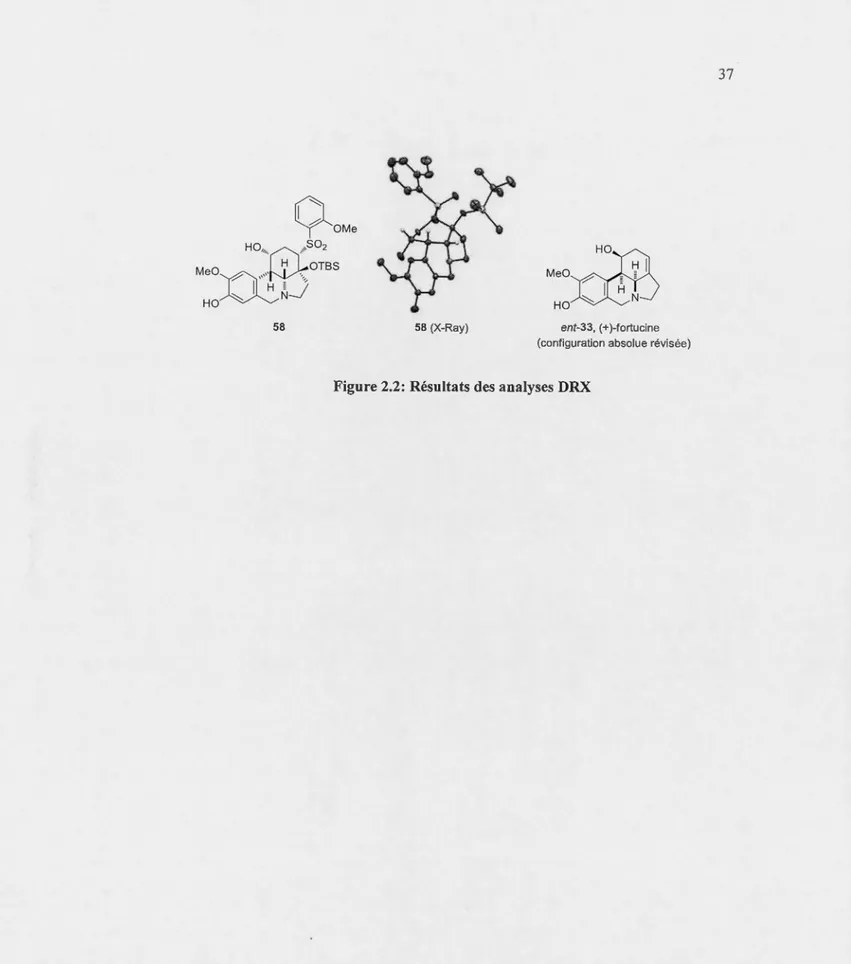
l
'a
pp
lic
at
i
o
n de
ce
procédé en
sy
n
t
h
èse
de
produits
n
a
turel
s
a aussi
é
t
é
démontr
ée
.
E
n
effet,
l
a
synt
h
èse
du
s
qu
e
lett
e
principal
de
l
a (-)
-pl
ate
n
si
m
yc
in
e,
un
a
ntibiotiqu
e
promett
e
ur
contre
l
es
stap
h
y
l
ocoq
u
es
doré
s
multir
és
i
s
tants
,
a été effectuée e
n
a
ppliqu
a
nt
cette
m
ét
hodol
og
ie
. U
n
e
fragmentation de type Schreiber-Fenton
a a
u
ssi été e
mplo
yée
afin
de mettr
e e
n
place
l
e
sq
u
e
l
ette
désiré.
D
a
n
s
l
e but
de démontrer
l
a
versatilité
sy
nth
étiq
u
e assoc
i
ée aux
tr
a
n
sfo
rm
a
tion
s
qu
e
p
e
u
ve
nt
p
e
rm
ett
r
e
l
es
r
éact
i
fs à
b
ase
d
'
iod
e
h
y
p
e
r
va
l
e
nt
,
l
a sy
nth
èse
totale
asy
m
é
trique d
e
l
a
f011ucine
a
été
effectuée
.
Cette
m
o
l
éc
ul
e a
ur
a
it d
es
propri
étés
antivira
le
s
et antitumora
l
es.
La
sy
nth
èse
proposée
m
et à
profit
l
a
m
éthodo
l
og
i
e
de Wipf
en
utilisant
l
e
protocole de
d
ésa
r
o
m
at
i
sat
i
on
oxydante
de
K
i
ta à
partir
d'
un
dérivé
de
l
a L
-
tyrosine. Ce
l
a a
permis
l
a
formation de
façon
h
auteme
n
t
diastéréosélective
,
du
sque
l
ette aza
-bi
cyc
liqu
e
r
equ
i
s
pour
l
a s
uit
e
de
la
synt
h
èse
.
Une
seco
nd
e éta
p
e clé co
n
s
i
ste e
n l
'
é
l
a
b
ora
tion
du
tét
r
acyc
l
e
pyrrolo[d
,e
]ph
é
nanthridin
e
d
e
l
a
mo
l
éc
ul
e c
ibl
e v
i
a
un
e ca
rbopall
a
d
at
ion d
e
t
y
pe H
eck
.
E
n
s
ui
te
,
d
a
n
s
l
e
but d
e
r
e
tir
e
r
l
'
ac
id
e
carboxy
liqu
e
intr
odu
it
en
début
d
e sy
nth
èse
par
l
a
L-tyrosine
pour
co
ntr
ô
l
e
r
l
a
diastéréosélectivité des
étapes subséquentes,
l
e p
r
otoco
l
e
de
B
oto,
Hernandez
et S
u
arez a été
app
liqu
é.
Il
s
'
agit à
nouveau d
'
une méthode
faisant
in
te
r
ven
ir l
a c
himi
e
de
l
'
iode hypervalent.
Enfin,
dans
l
e
but de procéder
à
l
a
migration de
l
a
double
li
aiso
n
,
l
a stratégie
de
Za
rd
a
été
exéc
ut
ée e
n
appliquant
un pr
océdé
de
t
y
p
e
Julia-Lythgoe.
Cette
pr
e
mi
è
r
e sy
nth
èse
asy
m
ét
riqu
e
a
p
e
rm
i
s
de corriger
l
a co
nfi
g
ur
at
ion
a
b
so
lu
e
du produit
naturel.
A
B
S
T
RACT
A n
ove
l
oxi
d
a
ti
ve
Prin
s
-pin
aco
l
t
a
nd
e
m pr
ocess
h
as
b
ee
n de
ve
l
op
e
d.
T
h
e
aroma
ti
c
ri
ng
umpo
l
u
n
g
ve
r
s
i
o
n
of t
h
i
s
tr
ans
f
o
rm
a
ti
o
n h
as
b
ee
n
ac
hi
eve
d fr
o
m
c
h
ea
p
a
nd r
ea
dil
y access
ibl
e
ph
e
n
o
l
s fo
ll
ow
in
g
th
e
ir
ox
id
a
ti
ve ac
ti
va
ti
o
n b
y a
h
y
p
e
rv
a
l
e
nt
i
o
din
e
r
eage
n
t. T
hi
s
m
e
th
o
d
a
ll
ows
th
e effic
i
e
nt
co
n
s
tru
c
ti
o
n
of so
m
e ve
r
y c
omp
a
ct
a
nd hi
g
hl
y
fun
c
tion
a
li
ze
d
scaff
old
s
o
f
s
pir
o
[
4.5
]d
eca
n
y
l
ty
p
e w
hi
c
h b
ea
r
s
qu
a
t
e
rn
a
r
y ce
nt
e
r
s c
onn
ec
t
e
d to
seve
r
a
!
s
p
2car
b
o
n
ce
nt
e
r
s. T
h
e sco
p
e of
thi
s
tr
a
n
sfo
rm
a
ti
o
n h
as
b
ee
n
s
tudi
e
d u
s
in
g
phen
o
l
s c
ontainin
g a
l
k
e
n
es
a
nd
a
lk
y
n
es
m
o
r
e o
r
J
ess
hind
e
r
e
d
.
Th
e ste
r
eos
el
ec
ti
v
i
ty of t
hi
s
tr
a
n
sfo
rm
a
tion b
as a
l
so
b
ee
n
s
tu
d
i
e
d u
s
in
g
ph
e
n
o
l
s t
h
at a
lr
ea
d
y ca
rr
y a co
ntrolled
asy
mm
e
tric
ce
nt
e
r thr
o
u
g
h
a
t
e
r
t
i
a
r
y
o
r a
qu
a
t
e
rn
a
r
y ca
rb
o
n
ce
n
te
r.
Mo
r
eover
,
th
e a
pp
l
i
cat
i
o
n
of
thi
s
pr
ocess
in n
a
tur
a
! pr
od
u
c
t
s
sy
nth
es
i
s
h
as
b
ee
n d
e
m
o
n
s
t
ra
t
ed.
Ind
ee
d
,
th
e fo
rm
a
i
sy
nth
es
i
s of (
-
)
-p
l
ate
n
s
im
yc
in
, a
n
ove
l
class of a
nti
b
i
ot
i
c aga
in
st
mul
t
ir
es
i
s
t
a
n
t
Staphyl
oc
occus au
re
us
,
h
as
b
ee
n
acco
mpli
s
h
e
d u
s
in
g
thi
s
m
et
h
o
d
o
l
ogy. A Sc
hr
e
i
be
r-
Fe
n
to
n
ty
p
e f
r
agme
n
tat
i
o
n b
as a
l
so
b
ee
n
e
mpl
oye
d in
a
rd
e
r t
o
co
n
str
u
c
t
t
h
e des
ir
ed cage co
mp
o
und
.
ln
a
rd
e
r
to s
h
ow t
h
e sy
n
t
h
et
i
c ve
r
sa
tilit
y of
h
ype
r
va
l
e
nt i
o
din
e c
h
e
mi
st
1
y
,
t
h
e fi
r
st
asym
m
et
r
ic
t
o
t
a
l
sy
n
t
h
es
i
s of for
tu
c
in
e
h
as
b
ee
n
ac
hi
eved. T
hi
s
m
o
l
ec
ul
e
h
as a
lr
eady s
h
aw
n
so
m
e a
n
t
i
v
ir
a
l
an
d
a
nti
t
um
o
r
a
l
ac
ti
v
iti
es. T
h
e
h
e
r
e
in pr
o
p
ose
d
sy
n
t
h
es
i
s p
ut
s fo
r
war
d th
e
Wip
fs
m
et
h
o
d
o
l
ogy co
n
ce
rnin
g oxydat
i
ve dea
r
o
m
at
i
zat
i
o
n u
s
in
g K
i
ta
'
s
pr
o
t
oco
l
f
r
o
m
a
L-t
y
r
os
in
e
d
e
ri
vat
i
ve. T
hi
s
a
ll
ows
th
e fo
rm
a
ti
o
n
,
in
a
hi
g
hl
y
di
as
t
e
r
eose
l
ect
i
ve way
,
of
th
e aza
-bi
cyc
li
c syste
m r
e
qui
s
it
e fo
r
t
h
e s
u
bse
qu
e
n
t s
t
e
p
s
.
A seco
nd
key ste
p
co
n
s
i
s
t
s
in th
e
e
l
a
b
o
r
at
i
o
n
of t
h
e
p
y
rr
o
l
o
[
d
,e
]ph
é
n
a
nth
r
idin
e
t
e
tr
a
c
yc
li
c co
r
e of t
h
e
t
a
r
ge
t m
o
l
ec
u
l
e v
i
a a
H
ec
k-
ty
p
e
c
a
rb
o
p
a
ll
adat
i
o
n.
F
urth
e
rm
o
r
e
,
in
a
rd
e
r
to
r
e
m
o
v
e
th
e ca
rb
oxy
li
c ac
id m
o
i
e
t
y
pr
ev
i
ou
s
l
y
in
t
r
o
du
ce
d throu
g
h
L
-
ty
ro
s
i
n
e t
h
a
t h
as co
ntr
o
l
l
e
d th
e
di
as
t
e
r
eose
l
ec
ti
v
i
ty
o
f
th
e
sy
nth
es
i
s
,
a
B
o
to
,
H
e
rn
a
nd
ez a
nd
S
u
a
r
ez's ox
id
a
ti
ve
d
eca
rbo
xy
l
a
tion proto
co
l
h
as
b
ee
n u
se
d
.
On
ce aga
in
,
thi
s
m
e
th
o
d in
vo
l
ves
h
y
p
e
r
va
l
e
n
t
i
o
d
i
n
e c
h
e
mi
st
r
y. F
in
a
ll
y
,
fo
ll
ow
in
g Za
rd
's
s
t
rategy
,
th
e do
ub
l
e
b
o
nd mi
g
r
at
i
o
n h
as
b
ee
n d
o
n
e
thr
o
u
g
h
a
Juli
a
-
ty
p
e
pr
ocess.
In
a
dditi
o
n
,
l. L
'
i
o
d
e
h
y
p
e
r
va
l
e
nt
e
n
s
y
nt
h
èse
E
n
cor
e a
u
jourd
'
h
u
i
,
l
a sy
nth
è
s
e
tota
l
e
d
e
p
r
oduit
s
n
a
tur
e
l
s
et d
e
d
é
r
ivé
s
b
i
o
ac
t
i
f
s
repr
ése
nt
e
un
e
d
es so
l
ution
s a
fin d
e
comb
a
ttr
e
plu
s
ieur
s
ma
l
ad
i
es.
Parmi
l
es
mo
l
éc
u
l
es
c
i
ble
s, ce
t
iaine
s
so
nt
t
r
ès
c
o
mp
act
e
s et
n
e co
ntienn
e
nt pa
s
b
ea
uc
o
u
p d
'
h
é
tér
o
atome
s
. Pow- mettr
e e
n p
l
ac
e c
e
s
a
r
c
hit
ect
ur
es c
omp
l
exes,
l
a c
himie or
ga
niqu
e a
fourn
i
p
l
u
s
ieur
s
outi
l
s
p
e
rm
etta
nt d
e c
r
ée
r
l
e
s
li
e
n
s
c
l
és
qui
co
mp
ose
nt c
es
m
o
l
é
cul
es.
P
ar
mi l
es
m
é
thod
es
c
o
nnu
es,
on r
e
tr
o
uv
e c
ell
es
qui
i
mp
li
quent
l
'
util
i
sa
ti
o
n d
e
m
é
t
a
u
x
lou
r
d
s
com
m
e
l
e p
a
ll
a
dium
,
l
e
mercure
,
l
e
p
l
omb
,
e
tc.
Ce
u
x
-c
i
p
e
u
ve
n
t
ê
tr
e c
oüt
e
u
x
,
to
x
iqu
es
et
n
oc
i
fs
pour
1
'
e
n
v
i
ronn
e
m
e
nt. Yo
i
l
à
pourqu
o
i
p
l
u
s
i
e
ur
s c
h
e
r
c
h
e
ur
s te
ntent d
e
m
e
ttr
e a
u point d
e
nouv
e
ll
e
s
méthodo
l
o
g
i
es
d
e sy
nth
èse
qui
ca
d
r
e
r
a
i
e
n
t
d
ava
nt
age avec
l
e
d
éve
l
o
pp
e
ment durab
l
e.
À
c
e
t
effe
t
,
p
a
r
m
i
l
es a
l
t
e
rn
a
t
i
ves
co
n
n
u
es
,
l
'
u
t
i
l
i
s
a
ti
o
n d
e
r
éac
ti
fs à
b
ase
d
'
i
o
d
e
h
y
per
v
a
l
ent c
o
n
s
t
i
tue une
so
lu
t
i
o
n
v
i
a
bl
e
qu
i
gag
n
e à ê
t
re co
nnu
e
1-2.Mi
s
à
prut l
e
periodat
e
d
e so
dium
(Na
l0
4)o
u l
'
ac
id
e
p
e
riod
i
qu
e
(
H10
4)p
e
r
m
e
tt
a
n
t d
'
e
f
f
e
ctuer d
es
c
li
v
ag
e
s
d
e
dio
i
s
v
i
cin
a
u
x se
l
on
l
a
pr
océ
dure d
e
M
a
l
a
p
r
a
d
e
3,de
s exe
mp
l
es
bi
e
n
c
o
n
nu
s
d
e
r
éac
ti
fs à
b
ase
d
'
i
od
es
h
y
p
e
rv
a
l
e
n
t
s s
ont d
é
j
à
2
Réactifs d'iode hypervalent (VIl) : Réactifs d'iode hypervalent (V) :
r;?
e
® 0=1- 0 Na Il0
l'lo6
0 Il 0=1- 0H Il 0o
,,
OH(
~
'o
0 IBXRéactifs d'iode hypervalent (Ill):
H0,
1-'0Ts H3CÎ (O, I-'Oî(CH3
( )1, 0
6
6
' N,5
,
a
'<::a
O'
'Q
1 ôlodosobenzène Réactif de Koser Phi=NTs DIB
Figure 1: Réactifs à base d'iode
hyp
erva
l
e
nt
DMP
F3Cî (O' I-'OÎ(CF3
0
6
0lô
PIFA
Le
periodinane
d
e
D
ess
Martin
(
DMP
) es
t
très
utili
sé
p
ou
r
oxyde
r
des
a
l
coo
l
s en a
l
dé
h
ydes
o
u
e
n
cé
t
o
n
es so
u
s
des conditions
dou
ces.
L'acide 2-iodoxybenzoïque
(
IB
X)
,
e
nc
o
r
e
plu
s
doux, est
a
u
ss
i
co
ur
a
mment utili
sé
.
P
a
r
exemp
l
e,
en
2
000
,
N
icol
ao
u
a
mi
s
au
p
o
in
t
un
procédé
efficace
permettant
d
e
former
,
e
n un
e étape
,
d
es céto
n
es
a,~-insaturéesà
partir
d
'
a
l
coo
l
s satu
r
és
,
de
céto
n
es et
d
'
a
ld
éhydes en
présence d
'
IBX
4(
Schéma 1
).
De nombreuses
transformat
i
ons
impliquant des réactifs d
'
i
ode
hypervalent
(III) sont aussi venues
outiller
l
es
c
himi
stes
de
sy
nth
èse.
D
a
n
s
l
es a
nn
ées
1
980,
plusieurs
m
ét
hod
es
d
'
a
-
oxygé
n
at
i
o
n
de céto
n
es
ou de
l
e
ur
s
d
é
ri
vés s
il
y
l
és
ont
été
mi
ses a
u point
e
n utili
sa
nt un r
éact
i
f
d
'
iod
e
h
y
p
erva
l
e
nt
tel
qu
e
l
e
r
éact
i
f
d
e Kose
r
ou
l
'
iodo
so
b
e
n
zè
n
e
5• 6.E
n
2005
,
Ochi
a
i
a a
u
ss
i pr
oposé
un proc
é
d
é
cata
l
ytiq
u
e
permettant d'effectuer
d
es a-acétoxy
l
at
i
o
n
s
de
céto
n
es e
n utili
sa
nt
m-CPBA
comme co-oxydant
de
l
'iodobenzène
7.S
'
ajo
ut
ant
à
ces transformat
i
ons
,
l
a c
himi
e
de
l
'
iode
h
y
p
e
r
va
l
e
nt
a auss
i
été e
mpl
oyée
pour
l
a
formation de
li
ens
carbone-cru·bone dans des
réactions
de co
upl
age.
Par
exe
mpl
e, e
n
1989,
Z
hd
a
nkin
propose un procédé permettant le
couplage entre
des
éthers
d'énols
s
il
y
l
és et
différents nucléophiles
carbonés (cyc
l
o
h
exè
n
e
,
a
ll
y
ltriméthyl
s
ilane
,
etc.) en
utilisant
un
comp
l
exe
d'iode
h
yperva
l
ent
hautement
élect
r
op
hil
e
(Ph
iO
/
HB
F4
l
U
n
pr
océ
d
é
d
'
a-a
r
y
l
at
i
o
n
c
hir
a
l
e
de
cyc
l
o
h
exa
n
o
n
es a a
u
ss
i
été
proposé
e
n
2005
pru·
l
e g
r
o
up
e
d
'
Aggarwa
l
9.D
e
plu
s
,
d
es
m
ét
h
o
d
es
d
'
az
iri
dinations
é
n
a
nti
osé
l
ect
i
ves
d
'
o
l
éfines o
n
t été
d
éve
l
o
pp
ées
à
pa
rt
ir
d
e P
hi
=NTs
p
a
r
Eva
n
s e
t J
acobse
n
10' 11.D
es
r
éac
ti
o
n
s
de co
u
p
l
age b
i
a
r
y
liq
ue et des
pr
océdés
r
a
di
ca
la
i
res basés s
ur
l
'
utili
sat
i
o
n d
e
r
éact
i
fs
d
'
i
o
d
e
h
y
p
e
r
va
l
ent o
n
t a
u
ss
i
été a
ppliqu
és e
n
sy
nth
èse
12' 13.E
n
fi
n
,
p
a
rmi
les
n
o
mbr
e
u
x
exe
mp
les
d
é
m
o
ntr
a
n
t
1
'
utilit
é
d
e
t
e
l
s
r
éact
i
fs à
b
ase
d
'
iode
h
y
p
e
r
va
le
n
t
,
l
a
d
ésaro
m
a
ti
sat
i
o
n
oxy
d
ative
des
ph
é
n
o
l
s est
l
'
un
e
d
e ce
ll
es
qui
a
le
plu
s
re
t
e
nu l
'atte
n
tion
d
es c
himi
s
t
es
d
e
sy
n
t
h
èse
.
À
ce
p
r
o
p
os, en
19
8
7,
l
e g
r
o
up
e
d
e
Kita
a
pr
o
p
osé
un pr
océ
d
é
d
'
o
xy
d
a
ti
o
n d
e
ph
é
n
o
l
s e
n pr
ése
n
ce
de
PI
FA
.
Cette
p
rocé
dur
e s
impl
e a
p
e
rmi
s
la fo
rm
a
ti
o
n d
e
d
é
ri
vés
d
e p
-b
e
n
zo
quin
o
n
e et
d
e
s
pir
olac
t
o
n
es,
d
es
int
e
rm
é
di
a
ire
s clés e
n
sy
nth
èse
d
e
nombr
e
ux
produit
s
n
a
tur
e
ls
14.OH 0
6
IBX DMSO, 89%6
0~
0~
Koser OTs Koser. J. Org. Chem. 1982, 47, 2487.Nicolaou. J. Am. Chem. Soc. 2000, 122, 7596.
lodosobenzène,
BF3"0Et MeOH, 78%
Ph
rr
a
/
0 Moriarty. J. Org. Chem. 1987, 52, 150. 0~
m-CPBA, Phi (10 mol%) BF3"0Et, AcOH, H20, 79%~
Ochiai. J. Am. Chem. Soc. 2005, 127, 12244.
OSiMe3
P
h
~
0
PhiO/HBF4 -78·c, 90%C?
n
Ph~
Zhdankin. J. Org. Chem. 1989, 54, 2605.OAc
ID c1e
n
i
n
Cl N N~ Cl 41%, d.r.>20:1, 94%ee
Aggarwal. Angew. Chem. !nt. Ed. 2005, 44, 5516.
Ts
1
N
4
Phi=NTs Phoo•f - - \"•H Evans.
J.
Am. Chem. Soc. 1993, 115, 5328. benzène, 24h, tp 64%, 97%ee PIFA, BF3"0Et DCM,-4o·c, 91% 59%H
O
~
OH PIFA, pyr H C02Ph MeO MeOl
"' ( )
MeOX X J Kita. J. Org. Chem. 1998, 63, 7698Paquette.







![Figure 4: CD spectrum of our enantiopure fortucine sample (0.003 M in MeOH, [8hs5, +2000, 10 scans), showing the opposite Cotton effects compared with reports on natural fortucine (for which [9b 6 = +4000 , (9] 282 = -2000 (c 2.92 •](https://thumb-eu.123doks.com/thumbv2/123doknet/3225619.92288/188.897.15.880.37.1027/figure-spectrum-enantiopure-fortucine-opposite-compared-natural-fortucine.webp)