Ecole Doctorale Biologie-Santé-Biotechnologies
THESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III
Discipline : Biochimie-Biophysique cellulaire Présentée et soutenue
Le mardi 20 Novembre 2007
par
Aurélie BAKER
Titre :
ETUDES, A LA SURFACE DE CELLULES VIVANTES, DES CHANGEMENTS DE COMPARTIMENTATION LATERALE
ET DE CO-LOCALISATION DYNAMIQUE
DU RECEPTEUR CD4 ET DU CO-RECEPTEUR CCR5 DU VIH
Directeurs de thèse :
Fabrice DUMAS André LOPEZ
Sophie CRIBIER (Rapporteur) Quentin SATTENTAU (Rapporteur) Françoise BACHELERIE (Examinateur)
Bernard FRANCES (Examinateur) Marc PARMENTIER (Examinateur)
Ecole Doctorale Biologie-Santé-Biotechnologies
THESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III
Discipline : Biochimie-Biophysique cellulaire Présentée et soutenue
Le mardi 20 Novembre 2007
par
Aurélie BAKER
Titre :
ETUDES, A LA SURFACE DE CELLULES VIVANTES, DES CHANGEMENTS DE COMPARTIMENTATION LATERALE
ET DE CO-LOCALISATION DYNAMIQUE
DU RECEPTEUR CD4 ET DU CO-RECEPTEUR CCR5 DU VIH
Directeurs de thèse :
Fabrice DUMAS André LOPEZ
Sophie CRIBIER (Rapporteur) Quentin SATTENTAU (Rapporteur) Françoise BACHELERIE (Examinateur)
Bernard FRANCES (Examinateur) Marc PARMENTIER (Examinateur)
A Celui à qui rien n’est impossible,
A Cyril que j’aime tant,
A ma famille si précieuse à mon cœur,
Il paraît que toute bonne chose à une fin… et me voilà à la fin de cette chose… de ce
phénomène étrange qu’est la thèse… Il est maintenant l’heure pour moi de clore ce chapitre
de ma vie et ce n’est pas sans émotion… ce coup-ci c’est la vraie fin… c’est l’envol de
l’IPBS… c’est le début d’autre chose…
Ces trois années de thèse ont été chargées de peines, de déprimes et de difficultés mais
ce sont les moments de joie, de complicité et de soutien qui resteront à jamais gravés dans
mon cœur. Ces trois années m’ont apportées beaucoup scientifiquement mais bien plus sur le
plan personnel.
Mais avant de commencer ces remerciements, je voudrais avoir une pensée pour la
mémoire de notre très chère Lolo… les mots sont souvent surfaits et inutiles alors
simplement : Lolo, nous ne t’oublions pas !!
Mes premiers remerciements s’adresseront donc à André. Merci de m’avoir fait
confiance en me proposant cette thèse dans votre équipe. C’est grâce à vous que je peux
maintenant écrire ces lignes. Je voudrais aussi exprimer ma gratitude à Laurence pour son
aide particulièrement lors des derniers mois, lors de la rédaction du papier et de ce manuscrit.
Dans la suite logique, vient Fabrice… mon chef expatrié… je te remercie pour la confiance
que tu m’as accordée durant ces trois années ainsi que pour la grande liberté que tu m’as
laissée, qui m’a permise de mener comme je l’entendais « mes petites affaires » !!
Je voudrais aussi remercier Françoise et Bernard, « les parisiens », pour leurs conseils
précieux et les nombreuses connaissances qu’ils nous font partager. Discuter avec vous est
toujours un plaisir…
Toute ma gratitude se porte aussi vers Serge et Claire sans qui tout serait plus
compliqué et plus difficile. Je vous remercie pour votre aide si efficace, si rapide et si
irremplaçable. Serge, le A3 sans toi n’est plus le A3… merci d’être venu à mon secours si
souvent. Claire, le jour où tu partiras, le monde des cellules se sentira certainement bien
orphelin…
expériences de SPT présentées ici.
Viens ensuite tous les autres membres de l’équipe. Les physiciens : Catherine et ses
craquages à la paillasse devant ses superbes montages, Evert et ses grenouilles en lévitation,
Nicolas qui passe son temps à écrire sur son tableau des trucs que lui seul comprend … et
puis les Biologistes : Gérald et l’interminable papier mu, Aurore en exil dans la plus belle île
du monde et Patrice le petit dernier !!!
Je voudrais ensuite adresser une pensée émue à mon premier chef, alias Arnaud…
merci pour ce stage de maîtrise inoubliable !!! Merci aussi à Jérôme, Cathy, Christine et Véro
pour votre gentillesse qui m’a accompagnée de mes premiers pas dans la recherche à
aujourd’hui. Merci aussi Karima et Alexandre… pour toutes ces discussions, les pauses café
et vos encouragements … merci de m’avoir acceptée dans la très « sélect » famille
Monsarrat !!! Je ne peux pas non plus oublier l’incontournable Malika, sans qui partir en
congrès serait un véritable calvaire ! Avec toi faire des formalités administratives devient un
jeu d’enfant !!!
Et puis bien évidement, le passage dans l’équipe Lopez s’accompagne d’un
enrôlement quasi incontournable à Alpha T. Un merci à tous ceux que j’ai pu y fréquenter et
en à particulier à la superbissime com’Bietch 2007, j’ai cité : Laurent, Patrice, Claire, Bruno
et notre cher président Simon !!... Et puis dans la grande famille alphatienne, merci aussi à
Flavie pour ces pauses café totalement délirantes.
Et maintenant, en essayant de ne pas inonder mon clavier je vais passer à la PhD
team ! Ou presque puisque parmi les petits jeunes, se fondant parfaitement dans le lot se
trouve Chantal. De son vin ou de son rire lequel des deux a les effets les plus apaisants ???
Personne ne peut le dire, ce qui est sûr que c’est qu’elle fut pour nous tous une vraie Maman
toujours prête à nous écouter, à nous conseiller voir à nous psychanalyser. De tout cœur
merci !
Merci aussi à Noëlle, notre révolutionnaire préférée… merci pour tous tes conseils de
pionnières et surtout pour toutes ces soirées et ces restaus où nous avons refait le monde !!
Je me dois aussi de remercier le pacha du groupe, la brute au cœur tendre. Finalement
Laurent, malgré tes airs de méchant « gnap gnap », tu es sensible et attentionné… surtout
humour… ce qui est sûr, c’est que sans toi ces trois ans auraient manqué de saveur et
auraient été beaucoup plus difficiles.
V
oilà déjà 10 mois, qu’une petite fille timide a fait son apparition… une bouffée
d’oxygène dans l’air étouffant de la fin de thèse, une lumière pour illuminer les jours sombres
de déprime… la « p’tite Chloé » ! Merci pour ton soutien et ta gentillesse… tu es une fille
exceptionnelle. Je suis heureuse d’avoir pu faire la connaissance et j’espère bien être invitée à
ton mariage !!!!!!
;-)
Et puis pour finir la PhD team, le meilleur pour la fin… ma grande sœur
scientifique : Aude. Je pense que je n’exagère que très peu si je dis que presque tout ce que j’ai
appris pendant ces trois, je te le dois !!! Une grande partie des félicitations du jury te revient
car c’est de toi que j’ai hérité beaucoup de qualités. Tu es quelqu’un d’exceptionnel et de ne
plus te voir tous les jours me manquera… j’espère de tout cœur que je garderai longtemps
contact avec mon « exacte opposée » !!!
Avant de quitter l’IPBS et de passer à mes amis et à ma famille, je dois m’arrêter
quelques instants pour vous parler de Mariette… nous avons traversé ensemble bien des
tempêtes… depuis les produits d’opérateurs en passant par les évanouissements d’après
AZF et le DEA pour enfin arriver à la thèse et en sortir… l’idée que notre cursus commun
prend fin me traumatise mais avec un peu de chance on arrivera à se faire embaucher au
même endroit !! Dans tous les cas mes études sans toi n’aurais vraiment pas été pareil… et
ces années seront à jamais marquées par notre amitié.
Et puis pour terminer, je voudrais remercier ma famille : mes parents premièrement
qui m’ont permis de réaliser mes études, merci pour tout ce que vous m’avez offert en plus de
votre amour. Merci aussi à l’oreille attentive de ma Maman qui a écouté patiemment tous
mes problèmes de manips sans rien n’y comprendre et en essayant malgré tout de poser
quelques questions…
Bien évidemment merci à celui qui partage ma vie… merci à mon « petit mari » Cyril
qui s’est si bien occupé de moi … qui a fait preuve de tant d’attention et qui a su être là et
me soutenir quand j’en avais le plus besoin.
grande partie de mes études… et à tous mes amis qui m’ont supporté dans tous les sens du
terme surtout pendant les derniers mois de cette thèse. Merci pour votre intérêt pour mes
filles (plus connus sous le nom de cellules). Merci surtout pour vos prières.
Et enfin merci à Celui qui a créé toutes choses et qui règne à jamais.
« Science sans conscience n'est que ruine de l'âme »
François Rabelais
Chapitre I:
Introduction : Le SIDA, les co-récepteurs CD4 et CCR5 au VIH et la
membrane plasmique
I/ Le VIH, agent étiologique du SIDA
3
I-1 Historique et Généralité 3
I-1-1 Découverte 3
I-1-2 Épidémiologie : le statut actuel 4
I-1-3 La pathogenèse virale 5
→La transmission 5
→La primo-infection 5
→La période de latence 6
→L’infection symptomatique 6
→La phase SIDA 7
I-1-4 Tests de dépistage 7
I-1-5 Suivi de l’évolution de la maladie 7
I-1-6 Traitements 8
→ Les inhibiteurs antirétroviraux 9
→ Les nouvelles classes de molécules 9
→ L’immunothérapie 9
I-2 Les acteurs du processus d’infection 10
I-2-1 Découverte des co-récepteurs 10
I-2-2 Le récepteur primaire : CD4 10
→ Structure et Fonctions 10
→ Dimérisation ou oligomérisation 11
I-2-3 Le corécepteur CCR5 12
→ Les chimiokines et les récepteurs aux chimiokines 12 → Les récepteurs couplés aux protéines G ou RCGP 12
→ Le récepteur CCR5 13
→ Homo ou hétéro-oligomérisation 14
→Voies des signalisations 16
→ Interaction avec les arrestines 16
→ Des mutations naturelles qui confèrent l’immunité contre le VIH 17
I-2-4 Le Virus 17
→ Description du virus 17
→ La glycoprotéine de l’enveloppe virale : gp160 ou gp120/gp41 18
II/ Le processus d’infection par le VIH
20
II-1 Les mécanismes d’infection par le VIH 20
II-1-1 Mécanisme de fixation et d’infection 20
II.1.2 L’infection par le VIH, un processus coopératif 21
II-2 La membrane plasmique 23
II-2-1 Découverte et Fonctions 23
→Les constituants saccharidiques 27
II-3 Les domaines membranaires 27
II-3-1 L’évolution de concept de la membrane 27
II-3-2 Les radeaux lipidiques 28
→Concept initial, composition, fonction 28
→« Rafts » et DRM 30
→ « Rafts » et dynamique 30
II-3-3 Le cytosquelette 31
II-3-4 Les agrégats dynamiques 33
II-4 La membrane plasmique essentielle à l’infection par le VIH 35
II.4.1 Confinement des récepteurs à la surface de la membrane 35 II.4.2 Implication des « rafts » dans la compartimentation 36
II.4.3 Le rôle du cytosquelette 38
II.4.4 La signalisation intracellulaire et l’infection 41 II.4.5 Les études dynamiques menées sur les récepteurs au VIH 42
III/ But de cette étude et intérêt par rapport aux données de la littérature
46
Chapitre II:
Les approches utilisées pour l’étude de la diffusion latérale et de
l’organisation membranaires des récepteurs au VIH
I/ Le retour de fluorescence après photoaveuglement ou FRAP
50
I-1 Le principe du Retour de Fluorescence Après Photoaveuglement 50
I-2 Le FRAP à rayon variable ou FRAPrv 51
I-2-1 L’origine du FRAPrv 51
I-2-2 Le principe du FRAPrv 52
I-3 La chaîne de montage du FRAPrv 54
I-4 Acquisition et traitement des données 57
I-4-1 Acquisition 57
→ Conditions d’acquisition 57
→ Critères fondamentaux à respecter 57
I-4-2 Extrapolation du I1 58
I-4-2 Traitement 58
I-5 Limite de résolution et calcul d’incertitude 59
II/ Le suivi de Particule Unique ou Single Particule Tracking ou SPT
60
II-1 Les colloïdes d’or fonctionnalisés comme marqueur des protéines
membranaires 60
II-1-1 Caractéristiques des colloïdes 60
II-1-2 Fonctionnalisation des colloïdes 61
II-2 La chaîne de montage du SPT 62
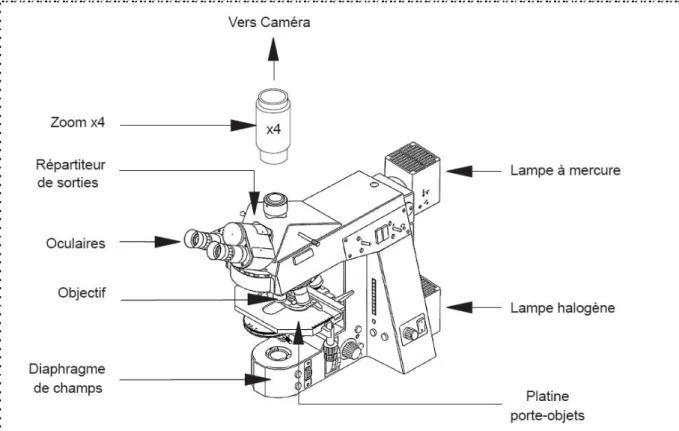
II-2-1 Le microscope 63
II-2-3 Le préprocesseur 66
II-2-4 Le magnétoscope 66
II-2-5 L’acquisition en temps réel 66
→ La ROI 66
→ La détection des particules 67
→ Limites de résolution 67
II-3 Analyse du mode de diffusion 67
II-3-1 Calcul du déplacement quadratique moyen ou MSD 67 II-3-2 Calcul du coefficient de diffusion D1/2 69
II-3-3 Les différents modes de diffusion 69
→ La diffusion aléatoire ou brownienne 69
→La diffusion dirigée 69
→La diffusion confinée 70
→La diffusion confinée dirigée 70
→ La diffusion confinée avec marche 70
II-3-4 Détermination de confinements transitoires 71 → Principe de la détection des zones de confinements selon Saxton et
Simon 71
→ Améliorations apportées dans l’équipe 72
Chapitre III :
Caractérisation des lignées cellulaire et mise au point relative à l’étude
de la diffusion des récepteurs membranaires
I/ Construction et caractérisation des lignées cellulaires
77
I-1 Choix des étiquettes et de leur positionnement 77
I-2 Choix du type cellulaire 78
I-2-1 Les A001, type cellulaire initialement retenu 78
I-2-2 Les HEK293, type cellulaire retenu 79
I-3 Sélection des différentes lignées 79
I-3-1 Les différentes lignées 79
I-3-2 La sélection des différentes lignées 79
I-4 Caractérisation des lignées 81
I-4-1 Expression à la membrane 82
I-4-2 Test d’infection – fonctionnalité des récepteurs 82 I-4-3 Caractérisation biochimique de la membrane 83 I-4-4 Stœchiométrie CD4/CCR5 des lignées doubles stables 85
I-5 Les mycoplasmes 86
II/ Mises au point relative à la diffusion des récepteurs membranaires
88
II-1 Déplétion et mode de coating des cellules 88 II-2 Insertion des lipides et mesure en dynamique 90
II-4 Spécificité de l’accrochage des colloïdes 92
Chapitre IV :
Etude de la diffusion et de la compartimentation membranaire des
récepteurs CD4 et CCR5
II-4 Analyse de la diffusion latérale des récepteurs CD4 et CCR5 par FRAP
99
I-1 Présentation des travaux effectués 99
I-2 Article 99
I-3 Discussion 107
II-4 Analyse de la diffusion latérale des récepteurs CD4 et CCR5 par SPT
110
II-1 Préambule 110
II-2 Les coefficients de diffusion 111
II-3 Les récepteurs CD4 et CCR5 exprimés séparément 112 II-4 Influence de la co-expression de CD4 sur la diffusion latérale de CCR5
114
II-6-1 A l’état basal 114
II-6-2 En présence de CD4 soluble 116
II-6-3 En présence de gp120 119
II-5 Influence de la co-expression de CCR5 sur la diffusion latérale de CD4
122 II-6 Influence de la déstructuration du cytosquelette par la cytochalasine D
124
II-7 Discussion 126
Chapitre V :
Analyses comparatives des données obtenues en FRAP et en SPT,
Conclusions et Perspectives
→ Modèle proposé et perspectives 133
→ Pertinence physiologique d’une telle organisation et implications dans
l’infection 136
Références Bibliographiques
141
Annexes
ADN : acide desoxyribonucléique
ADNc : acide desoxyribonucléique complémentaire d’un ARN messager BSA : Bovin Serum Albumin ou albumine sérique bovine
CCD: Charged Couple Device ou détecteurs à couplage de charge CD4s : CD4 soluble, comprenant les quatre domaines extracellulaires Cyto D: Cytochalasine D
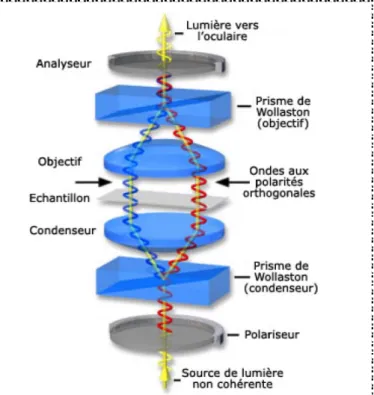
DIC : Differential Interference Contraste ou contraste interférentiel différentiel
DMEM* : DMEM sans rouge de phénol (GIBCO), 10% SVF (GIBCO), 0,5% gentamicine (GIBCO), 10 mM Hepes
DMSO: Diméthyl Sulfoxide
eGFP: enhanced Green Fluorescent Protein
FRAP : Fluorescence Recovery After Photobleaching ou retour de fluorescence après photoaveuglement
FRAPrv: FRAP à rayon variable HBS : Hepes Buffered Saline MβCD : Méthy-β-Cylo-Dextrine
PBS- : tampon phosphate sans calcium et sans magnesium PBS+ : tampon phosphate avec calcium et avec magnesium PhE: phycoérythrine
QSP : quantité suffisante pour
RCPG : Récepteur Couplé au Protéine G
SMT : Single Molecule Tracking ou suivi de molécule unique SPT : Single Particule Tracking ou suivi de particule unique HEK : Human Embryonic Kidney ou cellule embryonnaire de rein DAPI : diamidino-4',6-phénylindol-2 dichlorhydrate
FRET : Förster Resonance Energy Transfert ou transfert d’énergie de fluorescence
Abréviations utilisées en FRAP : D : coefficient de diffusion
Dapp : coefficient de diffusion apparent
Dcorr : coefficient de diffusion corrigé
Dconf : coefficient de diffusion des récepteurs confinés
Dlibre : coefficient de diffusion des récepteurs diffusant à longue distance
DE : Diaphragme d’entrée
DS : Diaphragme de sortie
I∞ : Intensité de fluorescence en fin de retour
I0 : Intensité de fluorescence initiale
I1 : Intensité de fluorescence après photoaveuglement
M: Fraction Mobile
MI: Fraction Immobile
MP: Fraction mobile Permanente
O1 : Opturateur 1 O2 : Opturateur 2
R: rayon de la zone de photodégradation r : rayon des domaines
Chapitre I:
Introduction : Le SIDA, les co-récepteurs CD4
et CCR5 au VIH et la membrane plasmique
I/ Le VIH, agent étiologique du SIDA
I-1 Historique et Généralité
I-1-1 Découverte
Le Syndrome de l'ImmunoDéficience Acquise, plus connu sous son acronyme SIDA, est le nom donné à un ensemble de symptômes (donc qualifié de syndrome) consécutifs à la destruction par le Virus de l'Immunodéficience Humaine (VIH) des cellules du système immunitaire. Il se caractérise par la perte des fonctions immunitaires, entraînant une vulnérabilité des malades à toutes sortes d’infections, telles que la pneumonie, les mycoses et même d’autres affections habituellement anodines.
Le VIH est étroitement lié au Virus de l’Immunodéficience Simien (SIV), virus qui entraîne des maladies semblables au SIDA chez les primates. Il existe plusieurs théories sur l'origine du sida, mais celle communément admise est que le VIH serait une mutation du VIS permettant la transmission à l'Homme (Gao et al. 1999).
Le virus serait apparu initialement en Afrique de l'Ouest, mais il est possible qu’il y ait eu plusieurs sources initiales distinctes. Le premier échantillon recensé du virus VIH fut recueilli en 1959 à Léopoldville (aujourd'hui Kinshasa), dans l’actuelle République démocratique du Congo (Balter 1998). Parmi les premiers malades identifiés, on compte le cas d'un Américain homosexuel en 1969, et d'un marin hétérosexuel norvégien en 1976. À la fin des années 1970, des médecins de New York et de San Francisco s'aperçoivent que nombreux sont leurs clients homosexuels souffrant d'asthénie, de perte de poids et parfois même de forme rare et atypique de cancer (comme le sarcome de Kaposi). L'existence d'un problème sanitaire est avérée en juillet 1981 lorsque le « Center for Disease Control » d'Atlanta relève une fréquence anormalement élevée de sarcomes de Kaposi, en particulier chez des patients homosexuels. L'apparition d'un nouveau virus est évoquée dès 1982 et cette nouvelle affection est désignée AIDS (Acquired ImmunoDeficiency Syndrome) ou SIDA en français.
En 1983, l’équipe du Dr Montagnier de l’Institut Pasteur de Paris isole une particule virale de type C dans des lymphocytes ganglionnaires d’un malade. Ils baptisent le virus LAV pour Lymphadenopathy Associated Virus (Barre-Sinoussi et al. 1983). L’année suivante l’équipe du Dr Gallo du NCI (Etats-Unis), découvre le même virus et le dénomme HTLV-III pour Human T-cell lymphotropic virus type III (Zagury et al. 1984). Ce virus sera par la suite rebaptisé HIV (Human Immonodeficiency Virus) ou VIH.
I-1-2 Épidémiologie : le statut actuel
Depuis l’année 2002, le SIDA est considéré comme une pandémie globale, ne montrant aucun signe de ralentissement. Seules les campagnes d’information sur les comportements à risque, les méthodes de propagation de la maladie et surtout les moyens de protection ont permis aux pays développés d’enrayer la progression, sans toutefois pouvoir la bloquer. Les dernières estimations fournies par le rapport Onusida 2006 (Fig. 1) portent à:
9 38,6 millions, le nombre de personnes séropositives dans le monde fin 2005. 9 4,1 millions, le nombre de personnes nouvellement séropositives en 2005. 9 2,8 millions le nombre de personnes mortes du sida en 2005.
Le pic de l’épidémie semble avoir été atteint dans les années 1990. Depuis on note une stabilisation du taux d'infection, c'est-à-dire du nombre de personnes infectées par rapport à la population globale. Cependant, le nombre de personnes infectées a augmenté, en raison de l'accroissement de la population et de l'accès aux trithérapies (qui prolonge l’espérance de vie). Pour l'essentiel, la rapidité de diffusion du VIH dans les pays en voie de développement est due aux co-infections VIH et virus de l'Herpès. Ce dernier favorise, lors des rapports sexuels, la transmission du VIH, en particulier la transmission hétérosexuelle en rendant les muqueuses génitales davantage perméables aux virus.
Figure 1: Répartition mondiale de l’infection par le VIH. En 2005, 38.6 millions de personnes (33.4 à 46 millions) vivent avec le VIH selon les estimations de l’ONUSIDA
I-1-3 La pathogenèse virale
Les particularités de la pathogenèse du VIH expliquent sa rapide et efficace dissémination à travers le monde. Une des premières raisons est que l’infection initiale n’induit aucun symptôme spécifique et par conséquent, les personnes infectées transmettent le virus sans même le savoir. Les symptômes associés au SIDA n’apparaissent que quand l’équilibre entre le virus et le système immunitaire est rompu par l’accroissement des effets nocifs de ce dernier. L’infection par le VIH comporte deux effets principaux : la détérioration progressive du système immunitaire, rendant l’organisme plus vulnérable aux infections microbiennes et la détérioration du système nerveux, menant à la démence. Ces deux conséquences reflètent l’évolution graduelle de la pathogenèse qui comporte cinq phases : la transmission, la primo-infection, la période de latence, la phase symptomatique et enfin la phase SIDA.
→ La transmission
Depuis la découverte du SIDA, trois modes de transmission principaux ont été observés (Castro et al. 1988; Quinn et al. 1986):
9 par voie sexuelle: mode principal et dont la meilleure protection est le préservatif 9 par voie sanguine: concerne particulièrement les usagers de drogues injectables, les hémophiles, les transfusés et les professionnels de la santé (bien que moins concernés car sensibilisés aux risques)
9 de la mère à l'enfant : peut survenir in utero dans les dernières semaines de la grossesse, au moment de l’accouchement et de l'allaitement
L’efficacité de transmission du virus d’un individu à un autre dépend principalement de la charge virale (> 1 500 virus/ml) et de la présence d’une porte d’entrée permissive (muqueuses: bouche, vagin, col de l’utérus, rectum, colon). Certaines études suggèrent que pour pénétrer dans l’organisme le virus a besoin d’une lésion, d’autre que le virus à la capacité de traverser la barrière épithéliale par transcytose et d’infecter les cellules immunitaires présentes dans les couches internes de l’épithélium (Bobardt et al. 2007). Toutes les cellules infectées empruntent ensuite le système lymphatique et migrent vers les organes lymphoïdes secondaires.
→ La primo-infection
L’infection primaire ou primo-infection correspond à la période située entre la transmission et l’apparition d’une réponse immunitaire spécifique contre le virus. Bien que
certains individus soient asymptomatiques durant cette période, 50 à 90% des gens infectés développent des symptômes non spécifiques ressemblant à la mononucléose ou à la grippe (Vanhems and R. 1997). Ce stade s’étale sur une période de trois à six semaines et se caractérise par une réplication très active du virus (Rosenberg et al. 2000) menant à une infection et à une destruction massive des cellules du système immunitaire. En deux à trois semaines, le virus envahit les organes lymphoïdes secondaires et ces derniers deviennent les principaux sites de production de virus et de destruction des lymphocytes T CD4+.
L’infection primaire induit cependant une réponse immunitaire spécifique contre le virus mettant en jeu les lymphocytes T CD8+ cytotoxiques, T CD4+ et plus tard les lymphocytes B. Cette réaction engendre une remontée du nombre de lymphocytes T CD4+ jusqu’à un taux normal ainsi qu’une diminution de la charge virale sanguine qui devient quasi-indétectable. L’action conjointe des réponses cellulaire et humorale permet de limiter de manière efficace la réplication virale (Weiss 1993) sans pourtant parvenir à l’éradiquer.
→ La période de latence
A l’étape de primo-infection fait suite l’état de latence, caractérisé par l’absence de symptômes et d’infections opportunistes, où des infections latentes perdurent en particulier dans les lymphocytes T CD4+ de type mémoire et les macrophages (Vergis and Mellors 2000). Un équilibre entre le virus et le système immunitaire s’établit alors sans affecter la vie du patient. Il peut durer entre 3 et 10 ans, jusqu’à ce que le virus prenne le dessus sur l’organisme (Buchbinder and Vittinghoff 1999). Pour des raisons encore méconnues, certains individus (1 à 2%) dit, asymptomatiques à long terme, contrôlent l’infection pendant de nombreuses années.
→ L’infection symptomatique
Cette étape ce caractérise par le passage en dessous d’un seuil critique (500/mm3) du nombre de lymphocytes T CD4+(Vergis and Mellors 2000). L’organisme devient alors plus vulnérable et un certain nombre de maladies plus ou moins graves et non spécifiques se déclarent. L’amaigrissement, le gonflement des ganglions, des diarrhées et de la fièvre constituent les symptômes fréquemment rencontrés.
→ La phase SIDA
Le SIDA apparaît au moment de l’effondrement du système immunitaire (déclin des lymphocytes T CD4+) et de l’augmentation de la charge virale. Ce stade, le plus grave de l’infection, se caractérise par le développement de maladies opportunistes (Ioannidis and Wilkinson 2002) quasiment absentes chez les gens immunocompétents. Un état de démence peut aussi apparaître, fruit de la destruction des cellules neuronales engendrée en partie par la production de cytokines et de médiateurs de l’inflammation dans le cerveau. Tous ces problèmes mettent la vie du patient en danger. Sans traitement, le patient survit généralement pendant environ trois ans.
En l’absence de dépistage précoce et donc de traitement, de nombreux patients découvrent leur séropositivité au stade SIDA, à l’occasion de l'apparition d’une maladie opportuniste.
I-1-4 Tests de dépistage
Les tests VIH sont réalisés pour diverses raisons, comme lors de la suspicion d'infection ou bien en cas de prévention pour des personnes travaillant dans des milieux à risque. En vue de lutter contre la transmission par des personnes ignorant leur séropositivité, des pays ont mis en place des possibilités de tests anonymes et gratuits.
Il en existe plusieurs types, les principaux utilisant la détection d'anticorps, d'antigènes ou d'une séquence d'ARN du VIH. En raison des limites inhérentes à tout test biologique, il est nécessaire de réaliser plusieurs tests différents avant que le patient soit déclaré séropositif au VIH. Pour que ce soit le cas, des anticorps dirigés contre les protéines constitutives du virus et contre les protéines internes du virus doivent être détectées.
I-1-5 Suivi de l’évolution de la maladie
Afin de suivre l’évolution de la maladie chez un patient avant ou après mise sous traitement, l’intensité de la réplication virale, appelé charge virale, ainsi que le taux de lymphocyte T CD4+ dans l’organisme sont mesurés (Maggiolo et al. 1999) (Fig. 2).
La charge virale exprimée en nombre de copies d’ARN viral par millilitre de sang, informe sur la réplication du virus. Elle est généralement très élevée durant la primo-infection, diminue lors de la période de latence et remonte graduellement à mesure que l’infection se dirige vers le stade SIDA (Weiss 1993).
Figure 2: Progression schématique de l’infection par le VIH adaptée de Weiss et al, 1993. L’infection par le VIH se caractérise par plusieurs phases. La primo-infection qui dure quelques semaines est suivie d’une phase de latence où un équilibre s’établit entre le virus et l’organisme. Dès lors que cet équilibre est rompu, les premiers symptômes apparaissent et le malade progresse vers la phase SIDA.
Le décompte des lymphocytes T CD4+ indique l’état du système immunitaire et s’exprime en nombre de cellules par millilitre cube de sang. Chez les personnes immunocompétentes, le décompte des cellules T se situe entre 800 et 1 200 cellules par millilitre. Chez les individus séropositifs, un seuil de 500 indique une atteinte au système immunitaire. À des taux encore plus faibles, le patient doit être mis sous traitement afin de contrer l’apparition d’infections opportunistes.
La combinaison des informations données par la charge virale et le nombre de lymphocytes T, permet de déterminer à quel moment démarrer une thérapie anti-rétrovirale.
I-1-6 Traitements
La prise des traitements débute au-delà d’un certain rapport charge virale/taux de CD4 et une fois démarré, le traitement doit être poursuivi à vie, avec une très grande régularité, une pause pouvant conduire à l’apparition de virus « résistants ».
Différents médicaments, visant à combattre le VIH, existent. Ils ciblent différentes étapes de son cycle de vie. Ces composés améliorent l’espérance de vie des malades, mais occasionnent plusieurs effets secondaires. Par ailleurs, ces molécules ne permettent ni de
rétablir complètement le système immunitaire ni d’éradiquer le virus. Ils sont répartis en plusieurs classes:
→ Les inhibiteurs antirétroviraux :
Le premier est décrit en 1985 est correspond à l’azidothymidine ou ATZ (Mitsuya et al. 1985). Les antirétroviraux ont pour cible la protéase du virus ou la transcriptase inverse. Dans le premier cas, l’activité de la protéase est bloquée et les virus produits sont défectueux et incapables d’infecter de nouvelles cellules. Dans le deuxième cas, deux modes d’action sont décrits. Soit, ils s’incorporent dans la chaîne d’ADN en formation lors de la transcription de l’ARN et bloquent l’étape finale du processus (cas des nucléosidiques). Soit ils bloquent la synthèse d’ADN viral en se fixant aux sites actifs de la transcriptase inverse l’empêchant ainsi de fonctionner (cas des non-nucléosidiques).
La combinaison de trois antirétroviraux ou trithérapie permet de limiter l’apparition de résistance virale sans cependant pouvoir les éviter. L’émergence de souches virales résistantes et la toxicité avérée de certaines des molécules administrées ont mené à l’utilisation de nouvelles classes de molécules.
→ Les nouvelles classes de molécules
Ces nouvelles molécules inhibent l’entrée virale ou s’attaque à l’intégrase du virus. Elles sont généralement combinées avec les antirétroviraux. Les inhibiteurs d’entrée agissent sur l’étape de fusion soit en bloquant liaison de CD4 et/ou des co-récepteurs à la gp120 soit en empêchant le repliement de la gp41 (gp 120 et gp41 étant les protéines virales responsables de l’entrée du virus, voir § I-2-4). Une autre classe de molécules, s’attaquant à l’intégrase du virus, empêchent l’intégration de l’ADN viral à l’ADN de la cellule. Cependant, ces molécules induisent aussi l’apparition de nombreuses mutations du virus.
→ L’immunothérapie
C’est une voie actuellement envisagée pour compenser les lacunes de la trithérapie. Elle consiste à utiliser diverses molécules immuno-modulatrices afin de stimuler la réponse cellulaire et humorale anti-VIH et de limiter temporairement la prise d’antirétroviraux. Bien que très intéressante, cette alternative ne donne pas encore de résultats satisfaisants.
En conclusion, à ce jour, aucun traitement ne permet de guérir du SIDA. Ceux existant, permettent juste de contenir l'action du virus avec plus ou moins d'efficacité.
Malheureusement, l’accès aux traitements ne concerne que les pays développés qui peuvent assurer la prise en charge financière de ces thérapies. Dans les pays en développement, plus de 95 % des patients (soit environ 40 millions de personnes) ne bénéficient aujourd'hui d'aucun traitement.
I-2 Les acteurs du processus d’infection
I-2-1 Découvertes des co-récepteurs
Environ un an après la découverte du VIH comme agent étiologique du SIDA, le récepteur CD4, exprimé à la surface des cellules immunitaires, est identifié comme permettant la fixation du virus (Dalgleish et al. 1984 ; Klatzmann et al. 1984; Sattentau and Weiss 1988). Cependant, toutes les cellules CD4 positives ne sont pas compétentes pour l’infection par le VIH (Zaitseva et al. 2003) et l’existence d’un second récepteur est postulée (Dragic et al. 1996; Feng et al. 1996). Il apparaît ainsi que plusieurs récepteurs de la famille des chimiokines ont la capacité de jouer ce rôle, les récepteurs CCR5 et CXCR4 étant les principaux. Il s’est ainsi avéré que lors de l’infection, pour s’attacher à la cellule et y pénétrer, le VIH détournait les fonctions naturelles des récepteurs cellulaires CD4 et CCR5 naturellement exprimées à la surface des monocytes, lymphocytes T et macrophages. Différents types de virus sont identifiés: les souches utilisant CCR5 comme co-récepteur, dites à tropisme R5, et les souches utilisant CXCR4 dites à tropisme X4. Une troisième souche à tropisme R5X4 pouvant utiliser les deux co-récepteurs a aussi été identifiée (Doranz et al. 1996; Simmons et al. 1996). Des études ont montré que la souche X4 n’est présente que dans 50% des cas et qu’elle apparaîtrait lors du déclin de l’immunité dans les dernières phases de la maladie. Ainsi, il semblerait que la primo-infection et les premières phases de d’infection se fassent majoritairement via des virus à tropisme R5 (Rana et al. 1997). Notre étude portant sur les mécanismes d’entrée du virus, nous avons choisi de nous focaliser sur le co-récepteur CCR5.
Avant d’aller plus loin dans la description des processus permettant au virus d’infecter les cellules hôtes, nous allons détailler la structure et la fonction des différents acteurs de l’infection par le VIH.
I-2-2 Le récepteur primaire : CD4 → Structure et Fonction
Le récepteur CD4 (pour Cluster of Differentiation 4) a été identifié pour la première fois en 1977 et nommé initialement T4 (Bowers et al. 1997). Il est exprimé à la surface des
cellules immunitaires et en particulier à la surface des lymphocytes T CD4+, des monocytes et des macrophages (Tourvieille et al. 1986). Ces récepteurs ont un rôle dans les mécanismes de défense car leur ligand naturel est le Complexe Majeur d’Histocompatibilité (ou CMH) de classe II, porté par les cellules présentatrices d’antigènes. Ils interviennent aussi dans l’activation des lymphocytes T par la production de cytokines (Bernhard et al. 2004).
CD4 est une glycoprotéine transmembranaire de la famille 1 de 55 kDa appartenant à la super famille des Immunoglobulines (Lynch et al. 1999). Le récepteur humain mature est constitué de 433 acides aminés comprenant un grand domaine extracellulaire de 371 acides aminés, un segment transmembranaire de 24 acides aminés et une petite région intracellulaire composée de 38 acides aminés (Bowers et al. 1997).
La queue C-terminale, via des interactions non covalentes avec la tyrosine kinase p56lck, permet la régulation l’endocytose du récepteur (Bowers et al. 1997) et ainsi que l’activation de certaines voies « scr kinase dépendante » lors de la réponse immunitaire (Wray et al. 1998). A travers elle, après l’infection, le VIH régulerait et modulerait l’expression à la membrane du récepteur CD4, limitant la réponse immunitaire normale (Bowers et al. 1997).
La partie extracellulaire est composée de quatre domaines (D1 à D4), dont les deux premiers, D1 et D2 sont responsables de l’interaction avec les protéines de CMH ainsi qu’avec la glycoprotéine gp120/gp41 du VIH (Klatzmann et al. 1990). La structure cristallographique des domaines D1 et D2 (Ryu et al. 1990; Wang et al. 1990) ainsi que des domaines D3 et D4 (Brady et al. 1993) a été déterminée à une résolution de 2.3 Å et 2.8 Å, respectivement. De plus, la cristallisation de la partie soluble de CD4 aussi été réalisée (Wu et al. 1997) et a permis de révéler que leur alignement est semblable à celui trouvé dans les immunoglobulines (Lynch et al. 1999). Cependant, en fonction du type cellulaire, le récepteur CD4 présenterait des variabilités de structure dont le VIH tirerait profit pour infecter les cellules hôtes (Matthias et al. 2002).
La délétion de la séquence codant pour les parties transmembranaires et intracellulaires conduit à une molécule totalement hydrophile. Les propriétés de cette protéine, vise à vis l’infection par le VIH, sont similaires à celle de la protéine entière: fixation de gp120/gp41 et déclenchement des changements conformationnels conduisant au processus de fusion (Doranz et al. 1996).
→ Dimérisation ou oligomérisation
Le récepteur CD4 semble avoir la capacité de s’auto-associer en dimère via le domaine D4 (Wu et al. 1997), dimères formant à leur tour des oligomères via le domaine D1 (Li et al.
1998). La présence du récepteur CD4 natif sous forme de monomère et de dimère dans des lymphocytes et des monocytes a été mise en évidence (Lynch et al. 1999; Moldovan et al. 2006; Moldovan et al. 2002) et des analyses en spectrométrie de masse ont permis de révéler que ces formes oligomériques ne sont composées que de CD4 (Lynch et al. 1999). La dimérisation du récepteur CD4 semble être nécessaire pour stabiliser l’interaction avec le CMH de classe II (Sakihama et al. 1995), pour que l’interaction avec l’IL-16 ait lieu, pour l’activation des lymphocytes T (Moldovan et al. 2002) ainsi que dans le développement de la synapse immunologique (Moldovan et al. 2006). De plus, il est apparu que l’activation des cellules augmentait la proportion des formes dimérisées et engendrait l’apparition de forme oligomérisées, mettant à jour une corrélation entre l’activation des cellules et l’oligomérisation des récepteurs (Lynch et al. 1999).
I-2-3 Le co-récepteur CCR5
→ Les chimiokines et les récepteurs aux chimiokines
Les chimiokines sont des molécules de faible masse moléculaire (entre 6 et 15 kDa), appartenant à la famille des cytokines. Elles possèdent des propriétés chimio-attractives, d’où leur nom chimiokines et interviennent principalement dans les neutrophiles, les monocytes, et les lymphocytes. Elles jouent un rôle important dans les mécanismes de défense (Zlotnik and Yoshie 2000) et en particulier dans le contrôle du recrutement des leucocytes, leur activation et leur fonction effectrice, ainsi que dans la modulation de l’immunité adaptative (Rossi and Zlotnik 2000).
Chez l’homme, une quarantaine de chimiokines et une vingtaine de récepteurs aux chimiokines sont décrits (Rossi and Zlotnik 2000; Zlotnik and Yoshie 2000). Les chimiokines ont pour principale caractéristique un motif composé de quatre cystéines engagées dans deux ponts disulfures. La position des deux premières cystéines a permis de classer et de diviser les chimiokines en 4 sous-familles (C, CC, CXC et CX3C) selon le nombre (1 ou 3) d’acide aminée X les séparant (Zlotnik and Yoshie 2000). La plupart des chimiokines appartiennent aux sous-familles CC ou CXC et se lient à des récepteurs appartenant à la grande famille des récepteurs couplés aux protéines G ou RCPG (Rossi and Zlotnik 2000) dont le nom dépend de la chimiokine liée.
→ Les récepteurs couplés aux protéines G ou RCPG
Les RCPG représentent la plus grande famille de molécules de surface impliquées dans la transmission du signal. Ils représenteraient environ 1 % de la totalité du génome
Figure 3: Modèle structural du récepteur CCR5. Modélisations réalisées à partir du modèle de la rhodamine (Palczewski et al. 2000). A gauche, vue parallèle au plan de la membrane. A droite, vue dans le plan de la membrane depuis le côté cytoplasmique. (Paterlini 2002)
humain (Bockaert and Pin 1999). En réponse à la fixation d’un agoniste, ces récepteurs sont activés et peuvent déclencher une cascade de signalisation. Les RCPG sont impliqués dans de nombreux processus et exercent leur fonction biologique par l’intermédiaire de protéines intracellulaires: les protéines G. Les protéines G sont des protéines membranaires périphériques, qui transmettent le signal à une protéine effectrice afin de déclencher une cascade de signalisation. Des protéines d’échaffaudage, dont l’indentification en est au commencement, semblent aussi être impliquées dans la signalisation de ces récepteurs. Les RCPG sont impliqués dans un grand nombre de fonctions biologiques. Le séquençage du génome humain a dévoilé envirion un millier de séquences pouvant correspondre à des RCPG. A l’heure actuelle, deux structures tridimensionnelles à haute résolution existent pour ces récepteurs (Cherezov et al. 2007; Rosenbaum et al. 2007). La structure de la rhodopsine a été déterminée à 2.8Å (Luecke et al. 2001; Palczewski et al. 2000). Malgré ce manque de données structurales sur les RCPG, la comparaison de profils hydropathiques (Trumpp-Kallmeyer et al. 1992) de plusieurs de ces protéines et la structure de la rhodopsine permet d’admettre que la structure des RCPG comprend sept hélices α transmembranires. Ces domaines transmembranires sont reliés par trois boucles extracellulaires et trois boucles intracellulaires. La partie N-terminale de la protéine est orientée vers l’extérieur de la cellule, alors que l’extrémité C-terminale est intracellulaire (Bockaert and Pin 1999).
→ Le récepteur CCR5
Le récepteur CCR5 est composé de 352 acides aminés ce qui correspond à un poids moléculaire d’environ 40 kDa. Il a pour principaux ligands les chimiokines MIP-1α ou CCL3,
MIP-1β ou CCL4 et RANTES ou CCL5 (Zlotnik and Yoshie 2000) qui sont responsables du chimiotactisme des monocytes, des lymphocytes et des éosinophiles. Le fait que ces chimiokines soient capables d’inhiber l’infection par le VIH a permis de mettre en évidence l’implication de CCR5 dans l’infection par le VIH (Doranz et al. 1997; Dragic et al. 1996).
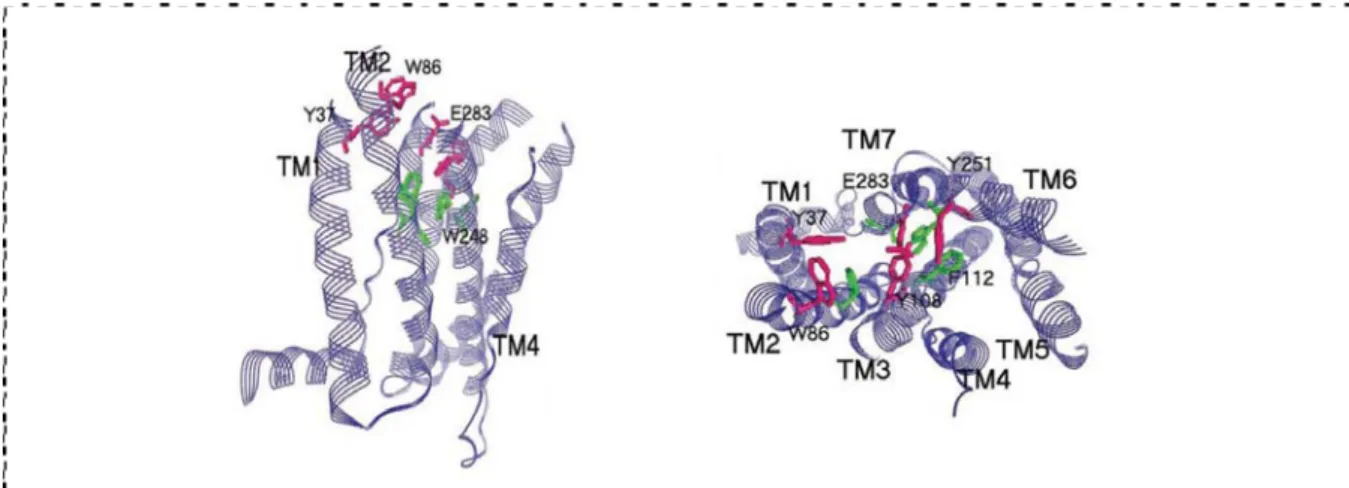
Même si, à l’heure actuelle, aucune structure de CCR5 n’est encore disponible, des modélisations à partir de la structure de la rhodopsine (Fig. 3) permettent d’appréhender l’organisation des domaines transmembranaires (Dragic et al. 2000, Paterlini, 2002 #114; Govaerts et al. 2003).
→ Homo ou hétéro oligomérisation
L’idée initiale selon laquelle, les RCGP fonctionnent à l’état de monomères a été
supplantée par l’émergence du concept de la dimérisation des RCPG. Des travaux récents ont montré que non seulement les RCPG existent sous forme d’homo et d’hétéro-dimère mais qu’en plus ces assemblages oligomériques auraient une importance fonctionnelle (Terrillon and Bouvier 2004, Skrabanek, 2007 #116).
Des études récentes ont montré que les récepteurs CCR5 semblent former des homo- et des hétérodimères. Des résultats contradictoires ont été obtenus quant au fait que ces récepteurs CCR5 forment soit des dimères constitutifs ou alors des structures dynamiques modulées par les agonistes.
Certains groupes suggèrent que la dimérisation de CCR5 se produit en réponse à la liaison du ligand. Les auteurs avancent également que ce processus semble jouer un rôle crucial et initiateur à la signalisation induite pas les chimiokines (Rodriguez-Frade et al. 2001). Dans le cas de CCR5, il a par ailleurs été suggéré que la dimérisation induite par un anticorps et/ou par les chimiokines aurait un effet préventif pour l’infection à VIH (Rodriguez-Frade et al. 2004, Vila-Coro, 2000 #118).
A l’inverse d’autres groupes ont montré que la dimérisation de CCR5 n’est pas liée à la liaison des chimiokines. Des preuves d’une oligomérisation constitutive de CCR5 ont été obtenues en co-immunoprécipitant des récepteurs marqués par différents épitopes, et les résidus formant l’interface de l’oligomérisation ont été identifiés comme étant localisés dans les 58 premiers acides aminés de la région amino-terminale ainsi que dans le premier domaine transmembranaire du récepteur (Benkirane et al. 1997). Un récepteur CCR5 dépourvu de ses 25 premiers acides aminés s’associe avec un récepteur CCR5 sauvage ou avec une chimère humain-souris qui possède le domaine amino-terminal du récepteur humain (Chelli and Alizon 2002). Ces résultats vont dans le sens de l’oligomérisation constitutive indépendante
de l’agoniste qui a été montrée par BRET (Bioluminescence Resonance Energy Transfer). Dans cette étude les auteurs ont montré que le signal de BRET n’était pas augmenté suite à la stimulation par une chimiokine et ont obtenu des preuves que les oligomères de CCR5 se forment très tôt au niveau de la biosynthèse dans le réticulum endoplasmique (Blanpain et al. 2002; Issafras et al. 2002).
Dans la mesure où ces résultats ont été obtenus en surexprimant CCR5 dans des systèmes d’expression hétérologues, d’autres études ont été menées sur des macrophages et des lymphocytes T humains par microscopie électronique. Le but recherché était de déterminer la distribution subcellulaire du récepteur dans les cellules dans lesquelles il est naturellement exprimé pour mettre un terme au débat disant que les oligomérisations observées en système hétérologues dans lesquels le récepteur est surexprimé ne donnent que des résultats artéfactuels (Singer et al. 2001). CCR5, tout comme CXCR4 et CD4, sont préférentiellement localisés dans des microdomaines des microvillosités, et semblent s’associer par paire. De plus, il a été observé un regroupement de CCR5 dans les vésicules de sécrétion du réseau trans72 golgien, ce qui est en accord avec la notion que le récepteur dimérise avant son insertion dans la membrane plasmique. Il semblerait que les résidus Ile52 du TMI et Val150 du TMIV soient impliqués dans la dimérisation de CCR5 (Hernanz-Falcon et al. 2004), mais ces observations sont contestées par un autre groupe (Lemay et al. 2005). Des mutations de ces deux résidus génèrent des récepteurs non fonctionnels qui n’ont plus la capacité de dimériser ou d’induire une signalisation. Des peptides synthétiques contenant ces résidus bloquent les réponses induites par les ligands de CCR5 (Hernanz-Falcon et al. 2004). De tels peptides peuvent être considérés comme une nouvelle classe d’antagonistes parce qu’ils agissent en évitant la formation d’une conformation active du récepteur. La nature hydrophobe de ces peptides facilite considérablement leur pénétration dans la bicouche membranaire et leur orientation dans la membrane est due à la capacité de s’associer à l’hélice alpha. Cette étude montre que la stabilisation d’une conformation inactive du récepteur est une cible thérapeutique potentielle.
Par ailleur, il semblerait que CCR5 ait également la capacité de former des dimères avec d’autres récepteurs de chimiokines comme CCR2. Ces hétérodimères sont plus aptes à induire des réponses biologiques, illustré par le fait que la concentration en chimiokine requise est 10 à 100 fois plus faible. Cette augmentation est due à une synergie de chaque complexe recruté par chaque récepteur de l’hétérodimère (Mellado et al. 2001, El-Asmar, 2005 #124). CCR5 forme également des hétérodimères avec des RCPG n’appartenant pas à la famille des récepteurs de chimiokines. On sait notamment que CCR5 forme des hétérodimères
avec le récepteur des opiacés de type mu dans les cellules du système nerveux central et dans les cellules immunitaires (Chen et al. 2004; Chen et al. 2003).
→ Voies des signalisations
Il est admis de façon générale que les récepteurs de chimiokines sont couplés aux protéines G hétérotrimériques de la famille Gαi/o. Néanmoins, ce modèle simplifié et classique ne permet pas d’expliquer certaines fonctions biologiques des récepteurs de chimiokines. Il est donc communément admis que ce sont à la fois les sous-unités α et le dimère βγ qui interagissent avec les effecteurs. Dans le cas de CCR5, on assiste donc à une inhibition de l’adénylate cyclase via la sous-unité αi, et à une stimulation de la PLC-β par le dimère βγ d’où une diminution d’AMPC et une production d’IP3 avec mobilisation du calcium intracellulaire (Aramori et al. 1997; Zhao et al. 1998). Alors que la migration cellulaire en réponse à la liaison des chimiokines requiert le couplage du récepteur aux protéines G de la famille Gi, le relargage de la sous-unité βγ est à l’origine du chimiotactisme (Neptune and Bourne 1997). De façon simplifiée, sont notamment activées les kinases de type PI3 kinases, ou les GTPases de la famille Rho qui coordonnent la réorganisation du cytosquelette d’actine et la polarisation et la motilité cellulaire (Bacon et al. 1998; Turner et al. 1995), ou encore les kinases FAK et Pyk2 impliquées dans la motilité cellulaire (Bacon et al. 1996; Ganju et al. 1998). Enfin, les ligands de CCR5 activent les trois principaux membres de la famille des MAPkinases (ERK1/2, p38 et SAPK/JNK) qui semblent jouer un rôle critique dans la prolifération des lymphocytes T et dans l’activation transcriptionnelle des gènes codant pour les cytokines (Dairaghi et al. 1998; Del Corno et al. 2001; Kraft et al. 2001; Misse et al. 2001; Wong and Fish 2003).
→ Interaction avec les arrestines
Les β- arrestines jouent un rôle crucial dans tous les mécanismes de régulation des RCPG. Dans le cas de CCR5, la surexpression de mutants fonctionnels ou dominants négatifs d’arrestine influe sur l’endocytose du récepteur (Aramori et al. 1997) et les récepteurs activés par les chimiokines n’internalisent pas dans des fibroblastes de souris déficientes en β-arrestines 1 et 2 (Fraile-Ramos et al. 2003). En plus de leurs rôles classiques dans les processus de régulation du récepteur, les β-arrestines jouent également un rôle dans la transduction du signal et de protéine d’échafaudage. Néanmoins, les β-arrestines ne semblent pas nécessaires à l’activation des différentes voies MAPkinases en réponse à l’activation du récepteur par RANTES (Kraft et al. 2001). Des cellules dans lesquelles l’expression de la
β-arrestine-2 a été supprimée perdent leur capacité à migrer en réponse à la fixation des chimiokines (Fong et al. 2002; Sun et al. 2002). On retrouve un lien similaire entre internalisation du récepteur et chimiotactisme dans des cellules exprimant un récepteur tronqué dans sa partie carboxy-terminale ou dans lequel les sérines constituant les sites putatifs de phosphorylation ont été mutées en alanine (Fan et al. 2001; Roland et al. 2003).
→ Des mutations naturelles qui confèrent l’immunité contre le VIH
Quelques temps après la découverte des co-récepteurs, l’attention s’est portée sur une mutation naturelle du gène de CCR5 rencontrée chez les populations caucasiennes. Les personnes porteuses de cette mutation ne présentent aucun phénotype particulier. Cependant, la mutation intervient sur 32 nucléotides et induit l’apparition d’un codon stop. Il en résulte un récepteur final tronqué Δ-32-CCR5, de 215 acides aminés et les cellules n’expriment alors qu’une forme intracellulaire du récepteur (Rana et al. 1997). Des études ont permis de montrer que les personnes homozygotes pour cette mutation, même exposée au VIH, ne sont pas infectées (Liu et al. 1996). Les personnes hétérozygotes quant à elles ont un délai d’incubation et une période de survie plus longue (Dean et al. 1996; Samson et al. 1996). Chez les populations caucasiennes, la fréquence d’homozygote est faible (1%) par rapport à la fréquence d’hétérozygote (jusqu’à 20%) (Benkirane et al. 1997). La fréquence d’apparition est nulle ou quasi-inexistante en Afrique et dans les pays asiatiques.
I-2-4 Le Virus
→ Description du virus
Le VIH est un rétrovirus du genre des lentivirus qui se caractérise par une longue période d'incubation et par voie de conséquence une évolution lente de la maladie, d'où la racine du nom venant du latin lenti, signifiant lent. Comme tous les lentivirus, le VIH a la capacité de rétrotranscrire ses deux brins d'ARN en ADN viral, qui s’intègre alors dans le génome des cellules infectées. Durant la phase de latence les gènes correspondant au virus ne seront pas exprimés, conférant au virus une invisibilité antigénique, cependant à chaque mitose, ils seront transmis aux cellules descendantes.
Le VIH a un aspect globalement sphérique et un diamètre d’environ 120 nm (Kuznetsov et al. 2003). Il est constitué d’une enveloppe composée des restes de la membrane de la cellule infectée (Wyatt and Sodroski 1998) et tapissée par une matrice protéique, p17 et p24 étant les protéines majoritaires. A l’intérieur de l’enveloppe se trouve la nucléocapside,
de forme icosaédrique, contenant le génome du VIH composé d'un simple brin d'ARN, d’environ 9 kb, en double exemplaire ainsi que les enzymes nécessaires à la réplication du virus (Kuznetsov et al. 2003) (Fig. 4).
Le génome du VIH se compose de trois gènes principaux communs à tous les rétrovirus : gag, pol et env. Le produit de ces gènes est généré sous la forme de précurseurs (polyprotéines). Le gène gag code pour des protéines de structure du virus. Le gène pol contient l’information génétique pour la synthèse des enzymes responsables de la réverse transcription, l’intégration de l’ADN proviral dans le génome de la cellule hôte et la maturation des virus. Le gène env code pour une glycoprotéine (gp120/gp41) responsable de l’attachement du virus sur la cellule et de son entrée (Wilk et al. 2001).
→ La glycoprotéine de l’enveloppe virale : gp160 ou gp120/gp41
Cette hétéro-protéine identifiée en 1984 est composée d’une sous-unité de 120 kDa et d’une sous-unité transmembranaire de 41 kDa (Robey et al. 1985; Sodroski et al. 1984; Veronese et al. 1985). La protéine traduite, gp160, est clivée par la furine en gp120 et gp41 (Hallenberger et al. 1992). Les deux sous-unités restent associées par des interactions faibles, on parle alors de gp120/gp41 (Wyatt and Sodroski 1998).
Cette protéine participe aux étapes précoces de l’infection et aux processus d’entrée dans la cellule hôte, particulièrement étudiés dans ce projet. Elle est organisée en trimère (Kwong et al. 2000; Wyatt and Sodroski 1998 ) et forme des spicules à la surface du virus (Kwong et al. 1998; Sougrat et al. 2007). Les spicules sont ancrées dans la membrane virale
Figure 4: Le Virus de l’ImmunoDéficience Humaine. A gauche : Représentation schématique. A droite : Particules de VIH isolées et observée par AFM (Kuznetsov et al. 2003). ARN viral Réverse Transcriptase Bicouche lipidique Matrice protéique Nucléocapside gp41 gp120 Protéine de l’enveloppe ARN viral Réverse Transcriptase Bicouche lipidique Matrice protéique Nucléocapside gp41 gp120 Protéine de l’enveloppe
par la protéine transmembranaire gp41 alors que la protéine gp120 est exposée à la surface du virus.
La structure tridimensionnelle de la gp120 a été résolue par cristallographie à 2.5 Å de résolution (Kwong et al. 1998). Elle est composée d’un domaine interne et d’un domaine externe reliés par quatre feuillets β antiparallèles (Fig. 5). Dans ces domaines sont localisés cinq domaines conservés (C1-C5) et cinq domaines variables (V1-V5). Les régions les plus importantes pour les processus d’entrée sont V1/V2, V3 et α4 (Briz et al. 2006; Cormier and Dragic 2002), le domaine V3 étant aussi responsable du tropisme viral (Speck et al. 1997). En ce qui concerne la protéine gp41, la partie transmembranaire, rend sa cristallisation plus délicate et souvent seul l’ectodomaine est étudié. Le cœur de la protéine est formé par une triple hélice entrelacée, appelé coiled-coil en anglais (Chan et al. 1997), semblant intervenir lors de la fusion des membranes virales et cellulaires (Weissenhorn et al. 1997).
Interne Externe
Interne Externe
Figure 5 : Structure tridimensionnelle de la protéine gp120/gp41 A : Structure de gp120 (Kwong et al. 1998). B : Structure de gp41 vue de dessus (à gauche) et vue de côté (à droite) (Chan et al. 1997)
II/ Le processus d’infection par le VIH
Chaque étape du processus d’entrée fournit des informations sur le tropisme et la pathogénicité du virus et chaque étape est une réelle ou potentielle cible pour les agents antirétroviraux. La rapide propagation de la maladie, le prix élevé et les nombreux effets secondaires des traitements ainsi que l’émergence de souches résistantes nécessite le développement de nouvelles stratégies d’intervention. L’entrée du virus constitue une cible très intéressante car elle implique l’exposition de sites hautement conservés de la protéine env et dépend des récepteurs membranaires qui peuvent être les cibles de petites molécules inhibitrices. Ainsi, une meilleure connaissance des processus d’entrée du VIH peut aider à élucider les mécanismes qui régissent le tropisme et la pathogénicité du virus. Nous allons dans cette partie détailler certains points influençant le processus d’entrée du virus dans les cellules cibles. De plus, notre étude sera ciblée sur le co-récepteur CCR5 responsable de la primo-infection.
II-1 Les mécanismes d’infection par le VIH
II-1-1 Mécanisme de fixation et d’infection
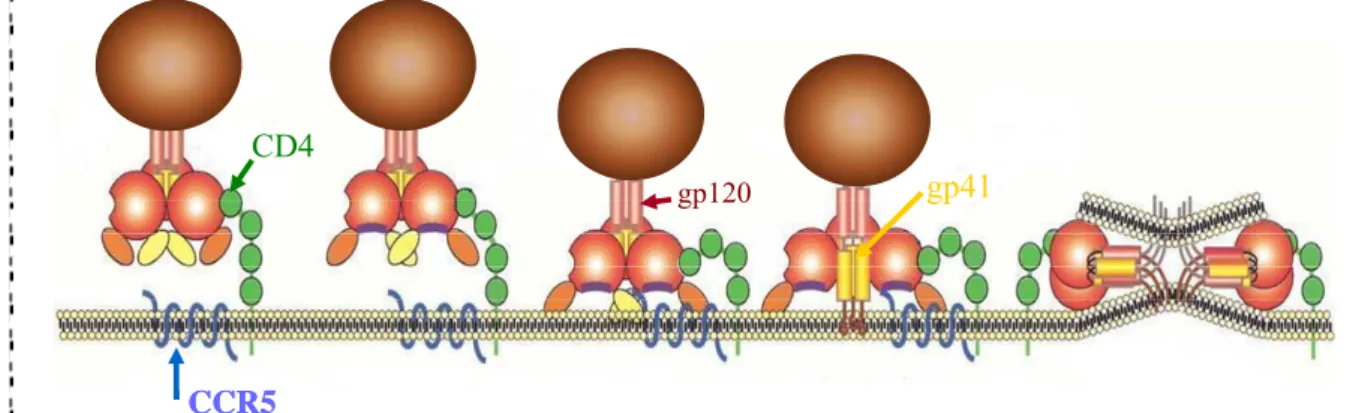
Le processus de fusion est initié par la fixation de la glycoprotéine d’enveloppe env sur le récepteur primaire CD4 (Dalgleish et al. 1984 ; Klatzmann et al. 1984; Sattentau and Weiss 1988). Cette liaison induit un changement conformationnel (Sattentau and Moore 1991) de la sous-unité gp120 permettant la liaison au co-récepteur (Lapham et al. 1996 ; Trkola et al. 1996 ; Wu et al. 1996). Ce changement de conformation conduit à l’exposition d’un domaine hautement conservé, situé au niveau des boucles V1/V2 et V3, impliqué dans la liaison avec le co-récepteur (Rizzuto et al. 1998). La liaison gp120/CCR5 conduit alors à des changements conformationnels drastiques de la sous-unité transmembranaire gp41 induisant l'exposition de la région N-terminale et conduisant à la fusion des membranes virales et cellulaires (Doms 2000 ; Gallo et al. 2003)).
L’insertion dans la membrane de la cellule cible de la partie hydrophobe de la gp41, semble être facilitée par la structure en coiled-coil de cette dernière (Weissenhorn et al. 1997). L'env devient ainsi transitoirement partie intégrante des membranes virales et cellulaires (Doms 2000). Les changements structuraux subis ensuite par la protéine gp41 mettraient en jeu un repliement de celle-ci sur elle-même (Chan and Kim 1998; Weissenhorn et al. 1997), formant un coiled-coil stable de six hélices dans lequel le peptide de fusion et le domaine transmembranaire sont orientés dans le même sens. Cette transition coïnciderait avec la fusion
des membranes virale et cellulaire (Melikyan et al. 2000), qu’elle faciliterait en réduisant la distance entre les membranes (Heuvingh et al. 2004).
II.1.2 L’infection par le VIH, un processus coopératif
Il est ainsi apparu que le processus de l’infection par le VIH est un processus multi-étapes. De nombreuses études se sont alors intéressées à l’organisation spatiale et temporelle des différents partenaires impliqués et ont montré que le processus de fusion était un processus coopératif (Doms 2000).
Basé sur les connaissances acquises pour d’autres virus comme le virus de l’influenza (Markovic et al. 2001), le Semliki Forest virus (Gibbons et al. 2004) ou les baculovirus (Plonsky and Zimmerberg 1996), l’influence de l’oligomérisation des spicules et de l’interaction de plusieurs glycoprotéines d’enveloppe ont été envisagées. Dans le cas du VIH, il a été proposé que chaque trimère d’env a le potentiel de se lier à plusieurs molécules co-réceptrices et co-réceptrices (Hoffman and Doms 1999; Layne et al. 1990) et qu’il faudrait au moins deux trimères d’enveloppe pour que l’infection puisse avoir lieu (Yang et al. 2006). Ainsi, les liaisons multiples entre l’env et CD4 stabiliseraient le complexe et prolongeraient sa durée de vie, augmentant ainsi la probabilité d’une rencontre avec un ou plusieurs co-récepteurs (Singer et al. 2001).
Des études se sont aussi intéressées à l’influence des variations de la densité des récepteurs du VIH à la membrane plasmique montrant qu’elle pouvait être un des paramètres
CD4 CCR5 gp120 gp41 CD4 CCR5 gp120 gp41
Figure 6 : Processus d’infection par le VIH. La liaison gp120/CD4 est la première étape du processus de fusion. Elle conduit à un changement conformationnel de gp120 permettant l’exposition du domaine hautement conservé de liaison à CCR5. La liaison gp120/CCR5 induit ensuite un changement drastique de conformation de gp41 et son insertion dans la membrane cellulaire cible. S’en suit, la fusion des membranes virales et cellulaires et le déversement du contenu viral dans le cytoplasme cellulaire. Adaptée de (Doms 2000)
conditionnant la susceptibilité d’une cible à l’infection par le VIH (Furuta et al. 2006; Kuhmann et al. 2000; Lin et al. 2002; Platt et al. 2005; Platt et al. 1998) mais aussi les fonctions naturelles des récepteurs (Desmetz et al. 2006). De plus, il a été proposé que la coopération de cinq CCR5 soit nécessaire pour que l’infection puisse avoir lieu (Kuhmann et al. 2000).
Très récemment une étude par tomographie a permis d’appréhender la structure 3D de la zone de contact entre le virus et la membrane de la cellule cible (Sougrat et al. 2007). Il est ainsi apparu qu’avant tout contact avec la cellule cible, les spicules composées de trimères d’env sont distribuées à la surface du virus de façon aléatoire et distantes l’une de l’autre d’environ 15 nm. Lors de l’infection, au niveau de la zone de contact entre le virus et la membrane, un réarrangement des spicules du virus est observé. En effet, un regroupement de cinq à sept spicules est observé avant l’interaction avec la membrane de la cellule cible. L’inhibition de ce phénomène par la présence d’anti-CD4 ou de TAK779, connus pour bloquer l’infection, montrent que cette réorganisation a un lien direct avec l’infection (Fig. 7, (Sougrat et al. 2007)).
Ainsi l’infection par le VIH serait conditionnée par l’organisation structurale des spicules et par le nombre et la densité surfacique des récepteurs au niveau de la membrane de la cellule cible. Pour d'autres virus comme le Simian Virus 40 et le Semliki Forest virus les
Figure 7 : Visualisation de la zone de contact entre le virus et la cellule. A : Image obtenue en tomographie électronique montrant le regroupement des spicules du virus lors du contact avec une cellule cible (échelle : 100 nm). B : Représentation 3D de la même région de contact montrant l’enveloppe virale (violet), les spicules (rouge), le cœur du virus (jaune) et la membrane cellulaire (bleu). Tirée de (Sougrat et al. 2007)
processus de fusion et d'entrée seraient déterminés par la concentration de leurs récepteurs dans des domaines définis de la membrane. De la même manière, il est concevable que le recrutement de CD4 et de CCR5 dans des domaines définis de la membrane plasmique des cellules cibles, augmenterait localement la densité surfacique de ces molécules, et ainsi contrôlerait l’efficacité de l’infection par le VIH.
Une approche biochimique par co-immunoprécipitation a permis pour la première fois d’appréhender une association naturelle des récepteurs CD4 et CCR5 à la surface des membranes cellulaires (Xiao et al. 1999). Cette association naturelle a pu être montrée plus récemment, sur cellule vivante par des expériences de FRET (Förster Resonance energy Transfert), approche statique non invasive, menées dans notre équipe (Gaibelet et al. 2006). Ces résultats obtenus en l’absence de toute stimulation (virale ou non), suggèrent une interaction constitutive des récepteurs CD4 et CCR5 à la surface de la membrane plasmique, renforçant l’hypothèse du regroupement de ces récepteurs dans des domaines définis. Il a, de plus, été montré que les propriétés pharmacologiques de CCR5 seul et associé à CD4 sont différentes. La présence de CD4 modulerait la liaison des ligands de CCR5, suggérant un rôle de cette association constitutive dans la réponse immunologique (Staudinger et al. 2003). Ainsi le virus tirerait profit de cette association constitutive pour augmenter son efficacité d’infection. De plus, l’association préférentielle de CD4 avec CCR5 plutôt qu’avec CXCR4 (Xiao et al. 1999) contribuerait à la propagation préférentielle des souches à tropisme R5 (Gaibelet et al. 2006).
L’organisation des récepteurs du VIH, à la surface de la membrane plasmique, semble avoir une influence sur les processus d’infection. La membrane plasmique est une structure très complexe tant dans sa composition que dans son organisation. Avant d’aller plus loin, et de s’intéresser à l’implication de la membrane plasmique dans l’infection ainsi qu’aux études dynamiques menées sur les récepteurs au VIH à la surface de cellules vivantes, il est nécessaire de décrire la membrane plasmique, son environnement, sa composition et ses fonctions.
II-2 La membrane plasmique
II-2-1 Découverte et Fonctions
En 1665 paraît Micrographia, un ouvrage dans lequel son auteur, Robert Hooke, y fait une des premières descriptions d’une cellule, observée à l’aide d’un des tous premiers microscopes. Ce n’est ensuite qu’en 1839 que Schwann propose la première théorie cellulaire