Imagerie TEM/TDM quantitative du
99mTc et du
177Lu
Mémoire
Émilie Odette Gaudin
Maîtrise en physique – physique médicale
Maître ès sciences (M.Sc.)
Québec, Canada
Résumé
Grâce à l’implémentation d’algorithmes de reconstruction 3D dans les systèmes d’imagerie TEM/TDM, une étude quantitative à partir des images reconstruites est possible. La quanti-fication d’images TEM/TDM est nécessaire afin de permettre une étude dosimétrique 3D des patients atteints de tumeurs neuroendocrines traités au 177Lu-octréotate. Cependant, afin de
permettre une quantification précise des images obtenues, plusieurs paramètres du système doivent être déterminés afin d’appliquer les corrections nécessaires. Dans le cadre de cette étude, l’appareil TEM/TDM utilisé est tout d’abord calibré. Pour ce faire, la stabilité tempo-relle, la sensibilité, le temps mort et l’effet de volume partiel de l’appareil sont déterminés pour différents radioisotopes. Par la suite, une étude comparative de deux plateformes de recons-truction est effectuée afin de trouver la technique offrant la plus haute précision quantitative d’images TEM/TDM. La calibration et l’étude des reconstructions de l’appareil TEM/TDM a permis de déterminer la procédure optimale pour l’imagerie quantitative du177Lu et de99mTc
avec une erreur maximale de 3%. Ces résultats pourraient être validés à l’aide de données cliniques.
Table des matières
Table des matières v
Liste des tableaux vii
Liste des figures ix
Liste des abréviations xi
Remerciements xv
1 Introduction 1
1.1 Contexte. . . 1
1.2 Notions théoriques . . . 3
1.2.1 Principes physiques . . . 3
1.2.2 Tomographie d’émission monophotonique (TEM) . . . 7
1.2.3 Caméra gamma . . . 8
1.2.4 Imagerie quantitative . . . 10
1.2.5 Reconstruction tomographique . . . 12
1.3 Description et problématique du projet. . . 17
2 Matériels et méthodes 21 2.1 Système et matériels utilisés . . . 21
2.1.1 Appareil TEM/TDM. . . 21 2.1.2 Mire Jaszczak. . . 22 2.1.3 Calibrateur de dose. . . 22 2.1.4 Chélateur : DTPA . . . 23 2.2 Radionucléides utilisés . . . 24 2.2.1 Technétium 99m . . . 24 2.2.2 Lutétium 177 . . . 24 2.2.3 Cobalt 57 . . . 25
2.2.4 Autres radionucléides utilisés en médecine nucléaire. . . 25
2.3 Stabilité de la sensibilité de l’appareil TEM :57Co . . . 26
2.4 Calibration de l’appareil TEM/TDM . . . 28
2.4.1 Calibration au99mTc . . . 28
2.4.2 Calibration au177Lu . . . 32
2.5 Reconstructions tomographiques . . . 34
2.5.1 Algorithme commercial : Flash3D Syngo MI Siemens . . . 34
2.5.3 Étude comparative : Flash3D et SPEQToR . . . 36
3 Résultats 39 3.1 Stabilité temporelle de la sensibilité de l’appareil : 57Co. . . 39
3.2 Calibration de l’appareil TEM/TDM . . . 41
3.2.1 Calibration au 99mTc . . . 41
3.2.2 Calibration au 177Lu . . . 44
3.3 Reconstructions tomographiques . . . 47
3.3.1 Algorithme commercial : Flash3D Syngo MI Siemens . . . 47
3.3.2 Algorithme de recherche : SPEQToR . . . 50
4 Discussion 55 4.1 Stabilité temporelle de la sensibilité de l’appareil : 57Co. . . 55
4.2 Calibration de l’appareil TEM/TDM . . . 55
4.2.1 Calibration au 99mTc . . . 55
4.2.2 Calibration au 177Lu . . . 56
4.3 Reconstructions tomographiques . . . 57
4.3.1 Algorithme commercial : Flash3D Syngo MI Siemens . . . 57
4.3.2 Algorithme de recherche : SPEQToR . . . 58
4.4 Bilan sur le protocole de quantification . . . 59
Conclusion 61
Bibliographie 63
Liste des tableaux
2.1 Paramètres d’acquisition TDM de l’appareil Symbia TruePoint T6 de Siemens. . . 21
2.2 Paramètres d’acquisition TEM de l’appareil Symbia TruePoint T6 de Siemens. . . 22
2.3 Caractéristiques physiques des radionucléides utilisés.. . . 26
2.4 Six fenêtres d’énergie utilisées pour les acquisitions au 99mTc. . . 29 2.5 Fenêtres d’énergie utilisées pour les acquisitions 177Lu. . . 33 3.1 Sensibilité (cps/MBq) de l’appareil pour les deux caméras et pour les différentes
expériences effectuées : long terme (sur 280 jours), mire (entre des acquisitions à haute activité) et clinique (entre des patients injectés avec différents isotopes). . . 40
3.2 Variation de la sensibilité de l’appareil en fonction de l’angle de la caméra. . . 40
3.3 Sensibilité moyenne (S) et temps mort (τ) obtenus pour les mesures au 99mTc de la mire et du capillaire. Les acquisitions ont été effectuées avec le collimateur LEHR. 41
3.4 Coefficients de recouvrement obtenu pour les acquisitions aux 99mTc avec la mire d’air, d’eau et d’eau et99mTc, en fonction du diamètre des sphères imagées (%). . . 43 3.5 Constantes et écarts-types obtenus lors de la régression des coefficients de
recou-vrement pour les différentes acquisitions avec la mire d’air, d’eau et d’eau et 99mTc. 43 3.6 Sensibilité moyenne (S) et temps mort (τ) obtenu pour les mesures aux177Lu de la
mire et des tubes Eppendorf. Les acquisitions ont été effectuées avec le collimateur MELP.. . . 44
3.7 Coefficients de recouvrement pour les différentes acquisitions au 177Lu en fonction du diamètre des sphères imagées (%). . . 46
3.8 Homogénéité des profils obtenus pour différentes reconstructions. . . 50
3.9 Activité volumique obtenue pour la mire entière pour la quantification en fonction des algorithmes de reconstruction pour le99mTc et le177Lu. . . 51 3.10 Pourcentage d’erreurs moyennes, minimales et maximales pour la quantification
des petits VOI. . . 52
3.11 Homogénéité (%) des profils obtenus pour différentes reconstructions Flash3D et SPEQToR. . . 53
Liste des figures
1.1 Illustration de la portée des rayonnements α, β et γ pour divers matériaux. . . 4
1.2 Illustration des trois interactions majeures entre les rayonnements γ et la matière. 4 1.3 Illustration de l’effet photoélectrique. . . 5
1.4 Illustration de l’effet Compton. . . 6
1.5 Illustration de l’atténuation d’un faisceau de photons dans un milieu absorbant. . . 7
1.6 Illustration d’un appareil TEM/TDM à deux caméras. . . 8
1.7 Illustration des différents types d’événements détectés par la caméra. . . 9
1.8 Effet du temps mort sur les signaux de sortis pour un système paralysable.. . . 10
1.9 Illustration mathématique de l’effet de volume partiel. . . 11
1.10 Illustration de l’effet de volume partiel.. . . 11
1.11 Illustration de rétroprojection simple pour différents angles de la caméra autour de la source. . . 12
1.12 Illustration de rétroprojection filtrée pour différents angles de la caméra autour de la source. . . 13
1.13 Illustration des pixels et des projections utilisés lors des reconstructions itérative. . 14
1.14 Illustration des fenêtres d’énergie pour la correction des photons diffusés en TEW. 16 1.15 Coupes du fantôme imagé avec Symbia T6. Les images ont été reconstruites avec Siemens Flash3D. (A) Artéfact de raie visible. (B) Artéfact d’anneau visible. . . . 18
1.16 Illustration des profils obtenus pour une acquisition fantôme avec une reconstruc-tion (a) OSEM avec RR et avec une reconstrucreconstruc-tion (b) AMAP. . . 19
2.1 Illustration de la mire Jaszczak SPECT Deluxe. . . 22
2.2 Illustration schématisée du support utilisé pour la mesure d’activité dans le cali-brateur de dose. . . 23
2.3 Illustration de l’adhésion des ions métalliques de 177Lu sur le plastique. . . 23
2.4 Schéma de désintégration du 99Mo. . . 24
2.5 Schéma de désintégration du 177Lu. . . 25
2.6 Plaque de 57Co utilisée. . . 27
2.7 Spectre d’énergie des photons incidents lors de l’acquisition TEM d’une mire cy-lindrique uniforme remplie d’eau et de99mTc. . . 29
2.8 Illustration du capillaire utilisé pour simuler un milieu sans atténuation. . . 30
2.9 Position des sphères chaudes dans la mire Jaszczak en fonction de leurs diamètres. 31 2.10 Illustration des images reconstruites de la mire sans activité avec la partie TDM seulement (a) et la partie TEM seulement (b). . . 31
2.11 Illustration du montage utilisé pour l’étude de la sensibilité et du temps mort de l’appareil au177Lu avec les tubes Eppendorf. . . 32
2.13 Illustration du plateau et de la pénombre d’un profil typique. . . 35
2.14 Illustration du GUI de la plateforme de reconstruction SPEQToR. . . 36
2.15 Mire uniforme remplie au177Lu renconstruite avec Flash3D et SPEQToR NoRR. . 37 3.1 Stabilité de la sensibilité de la caméra au57Co en fonction du temps. . . 40 3.2 Taux de comptage observé en fonction du vrai taux de comptage des données sur
tout le spectre pour un appareil paralysable et pour les acquisitions avec la mire de 99mTc. . . 41 3.3 Taux de comptage observé en fonction du vrai taux de comptage des données sur
tout le spectre pour un appareil paralysable et pour les acquisitions avec le capillaire de 99mTc. . . 42 3.4 Illustration des reconstructions obtenues pour les acquisitions avec la mire d’air
(a), d’eau (b) et d’eau et 99mTc (c). . . 42 3.5 Coefficients de recouvrement en fonction du diamètre des sphères pour les trois
acquisitions au 99mTc. . . 43 3.6 Taux de comptage observé en fonction du vrai taux de comptage des données sur
tout le spectre pour un appareil paralysable. Mesures au177Lu avec la mire. . . 44 3.7 Taux de comptage observé en fonction du vrai taux de comptage des données
sur tout le spectre pour un appareil paralysable. Mesures au 177Lu avec les tubes Eppendorf. . . 45
3.8 Coefficients de recouvrement en fonction du diamètre des sphères pour les trois acquisitions au 177Lu.. . . 46 3.9 Coupe transverse, sagittale et coronale d’une mire uniforme de177Lu reconstruite
avec Flash3D. Illustration des artéfacts d’anneaux et de raies obtenus. . . 47
3.10 Comparaison de différents profils pour différentes reconstructions de mire uniforme de 177Lu . . . 48 3.11 Illustration de la mire de177Lu reconstruite en fonction du nombre de sous-ensembles
et d’itérations appliqués : (a) 2 itérations utilisant 4 sous-ensembles, (b) 4 itérations utilisant 8 sous-ensembles et (c) 24 itérations utilisant 8 sous-ensembles. . . 48
3.12 Comparaison de différents profils issus d’une coupe de deux rangées de voxels du diamètre de la mire uniforme de177Lu reconstruite avec Flash3D en faisant varier le nombre d’itérations et de sous-ensembles. . . 49
3.13 Comparaison de différents profils de reconstruction d’une mire uniforme de 177Lu pour la reconstruction selon les standards cliniques et les recommandations de Seret et al.. . . 49
3.14 Différentes reconstructions de la mire uniforme de99mTc. . . 51 3.15 Illustration des profils issus d’une coupe de deux rangées de voxels pour une mire
uniforme de99mTc pour les quatre reconstructions. . . 52 3.16 Illustration des profils issus d’une coupe de deux rangées de voxels pour une mire
de 177Lu uniforme pour les différentes reconstructions. . . 53 3.17 Coefficients de recouvrement en fonction de la taille des sphères obtenus avec
l’ac-quisition au99mTc pour les différentes reconstructions. . . 54 3.18 Coefficients de recouvrement en fonction de la taille des sphères obtenus avec
Liste des abréviations
AAPM American Association of Physicists in Medicine AC correction d’atténuation - Attenuation correction
Bq becquerel
cc centimètre cube
cps coups par seconde
Co cobalt
CR coefficient de recouvrement
EANM European Association of Nuclear Medicine
eV électron-volt
FBP rétroprojection filtrée - Filtered back projection FOV Field of view
γ photon gamma
GUI Graphical User Interface
H homogénéité
HE haute énergie - High Energy
I iode
IAEA International Atomic Energy Agency IC intervalle de confiance
LEHR basse énergie, haute résolution - Low energy high resolution
Lu lutétium
MELP moyenne énergie - Medium energy low penetration MIRD Medical Internal Radiation Dose
µ moyenne mu
NaI(Tl) iodure de sodium dopé au thallium OSEM Ordered subset expectation maximization
PMT tube photomultiplicateur - Photomultiplier tubes RR recouvrement de résolution - Resolution recovery
s seconde
SC correction de diffusé - Scatter correction
SNMMI Society of Nuclear Medicine and Molecular Imaging
τ temps mort tau
Tc technétium
TDM tomodensitomètre
TEM tomographie d’émission monophotonique TEW triple fenêtre d’énergie - Triple energy window TRRP thérapie radionucléique par radiopeptide VOI volume d’intérêt- Volume of interest
Remerciements
Je tiens tout d’abord à remercier Philippe Després et Jean-Mathieu Beauregard pour m’avoir permis d’entrer dans le programme de physique médicale. Cette collaboration, entre imagerie et médecine nucléaire, a dépassé de loin mes espérances. Votre support et vos connaissances m’auront permis d’en apprendre plus que ce que j’aurais pu imaginer. J’aimerais vous remercier pour les opportunités qui m’ont été offertes durant cette maîtrise. Ce projet a permis de m’accomplir comme étudiante et m’aura notamment ouvert les portes pour entrer au doctorat à Sherbrooke en sciences des radiations et imagerie biomédicale. Je tiens aussi à remercier les technologues du département d’imagerie médicale. Votre gentillesse et votre aide m’ont été des plus précieuses lors des moments passés dans le service. Je pense notamment à Murielle, Lucie, Martine et Martine, Nathalie, Nancy, Jessica, Simon, Guillaume, Éric et André. Merci au groupe d’étudiants pour ces deux superbes années, aux cours festifs et aux soirées épiques. Merci de m’avoir intégrée et initiée à la culture québécoise aussi facilement et d’avoir été aussi ouvert d’esprit face à ma culture française. Merci à Olivier de m’avoir aidée dans les coins obscurs de MatLab. Merci à mes amis Sharlie, Marie-Chantal, Jean-François et Ophélie : sans vous, mes journées auraient été bien tristes. Je ne remercierai jamais assez ma boule de m’avoir sauvée du froid hivernal lors de mon arrivée à Québec.
Je tiens tout particulièrement à remercier Pinceau, Catherine, Dave, Phil, Evelyn et François, pour m’avoir accueillie dans votre famille.
Je remercie ma mère Guylaine, mon père Laurent, ma soeur Maud et toute ma famille pour leur soutien de l’autre bout de l’Atlantique. La distance a été difficile, mais je ne me suis jamais sentie aussi entourée par ma famille. Ce mémoire est dédié à mes deux cousins Louis et James, que je vois grandir de loin. Ils sont mes rayons de soleil.
Mes derniers remerciements s’adressent à Charles. Merci de m’avoir supportée, aidée, écoutée et surtout de m’avoir fait autant rire durant ces deux dernières années.
Chapitre 1
Introduction
1.1
Contexte
Selon les statistiques de la Société canadienne du cancer, 191 300 Canadiens seront diagnos-tiqués avec un cancer en 2014, soit environ une personne sur 200 au Canada. Ce type de maladie est responsable de près de 30 % des décès au Canada et correspond à la cause de décès la plus importante après les maladies cardiovasculaires [1]. Afin de détecter ou d’aider à diagnostiquer un cancer, des séances d’imagerie sont de plus en plus requises pour l’obten-tion d’un bon diagnostic. De plus, celles-ci sont utilisées pour observer et suivre l’évolul’obten-tion de la maladie. En fonction de la région à évaluer et de la pathologie suspectée, différentes techniques peuvent être employées telles que l’imagerie par résonance magnétique, l’échogra-phie ou les examens de médecine nucléaire. Plus particulièrement, les examens de médecine nucléaire permettent d’évaluer la structure et le fonctionnement des organes. Contrairement aux images tomodensitométriques (TDM), les images de médecine nucléaire sont davantage fonctionnelles qu’anatomiques. Cependant, grâce au couplage d’appareils à tomographie par émission monophotonique (TEM) ou à tomographie par émission de positons (TEP) à des TDM, il est maintenant possible de faire des examens d’imagerie fonctionnelle avec une haute précision anatomique.
L’objectif commun des différents traitements de cancer, qu’il s’agisse de la chirurgie, de la chimiothérapie, de la radiothérapie externe ou de la curiethérapie, est d’obtenir le meilleur résultat thérapeutique chez un patient tout en limitant les effets secondaires. Cependant, cer-tains types de cancer ne répondent que partiellement aux thérapies standards et un traitement alternatif doit être considéré. Cela est le cas des tumeurs neuroendocrines. De petite taille et généralement localisées dans le système digestif, ces tumeurs touchent près de 12 000 Cana-diens par année [2]. Les personnes atteintes de tumeurs neuroendocrines sont souvent évaluées à l’aide d’une scintigraphie à l’octréotide (Octréoscan) lors d’un examen TEM/TDM [3]. Cou-plé à un radioisotope tel que le 111In, l’octréotide est utilisé pour détecter la présence de
Suite à cet examen, de nombreuses options de traitements s’offrent au patient. Ce cancer pré-sentant des tumeurs de petite taille et très métastatiques, une alternative de traitement est la thérapie radionucléique par radiopeptide (TRRP). Avec la TRRP, le patient suit plusieurs cycles de traitement de radiothérapie interne consistant en l’injection d’un peptide radio-marqué, ayant une forte affinité avec les récepteurs cellulaires des tumeurs neuroendocrines, conjointement à de nombreuses séances d’imagerie TEM/TDM.
Actuellement, au CHU de Québec, les patients suivant un traitement par TRRP reçoivent une activité de 7,4 GBq de177Lu-octréotate (émetteur de rayonnement β−et γ) pour 4 cycles
d’injections espacés sur 8 semaines d’intervalle. Le régime le plus utilisé consiste en des activités injectées empiriques et fixes pour tous les patients. Celui-ci suit les recommandations données par IAEA, EANM et SNMMI [5] ne tient pas compte de la morphologie ou de la physiologie du patient. Cependant, en fonction de la taille, du poids ou bien encore de la captation rénale d’un patient, l’activité administrée peut soit être insuffisante ou soit trop élevée. Or, une quantité d’activité trop élevée peut endommager les organes à risque, comme les reins ou bien la moelle osseuse, alors qu’une activité trop faible peut ne pas être en mesure de traiter le plus efficacement possible le patient. L’activité injectée devrait donc être ajustée afin de protéger les organes à risque tout en maximisant la dose aux tumeurs. Une étude dosimétrique personnalisée au cours du traitement est donc essentielle afin de contrôler la dose aux organes à risque et aux cellules cancéreuses.
Une étude dosimétrique permet non seulement d’évaluer et d’effectuer une corrélation entre l’activité injectée et la dose reçue à un organe, mais aussi de maximiser la dose administrée dans les limites de sécurité. Ainsi, il est possible de protéger les organes à risque et d’optimiser le traitement pour chaque patient. Cette procédure permet aussi de prédire l’impact du trai-tement entre chaque cycle d’injections. La dosimétrie peut être effectuée à partir des images obtenues après le traitement. Ces images comprennent l’information nécessaire à la dosimétrie puisqu’il est alors possible de quantifier l’activité accumulée dans une région. Néanmoins, plu-sieurs paramètres sont à prendre en compte avant de pouvoir quantifier les images : le temps mort (τ), l’effet de volume partiel (PVE), l’atténuation de rayonnement de photons ou encore la diffusion de photons dans le patient.
En plus de la dosimétrie, les intérêts de l’imagerie quantitative sont ses nombreux enjeux diagnostiques, pronostiques et thérapeutiques tels que l’évaluation du grade de la tumeur, le suivi de l’évolution du métabolisme lors de la thérapie et la classification des anomalies détec-tées. Grâce à l’amélioration des techniques d’imagerie et avec l’implémentation d’algorithmes permettant la reconstruction 3D des images TEM avec corrections de rayonnement diffusé et d’atténuation du rayonnement (basée sur l’atténuation mesurée par TDM), la quantification en TEM est possible pour des études cliniques [6].
est effectuée (section 1.2.1). La TEM, l’imagerie quantitative et le principe de reconstruction tomographique sont présentés (sections 1.2.2, 1.2.4 et 1.2.5). Enfin, la problématique et la description du projet sont réalisées en dernière partie (section 1.3).
1.2
Notions théoriques
Cette section présente les notions de physiques nécessaires à la compréhension générale de ce mémoire telles que les différents types de rayonnement, les modes de désintégrations ainsi que la tomographie d’émission monophotonique, la caméra gamma, l’imagerie quantitative et les reconstructions tomographiques.
1.2.1 Principes physiques
Rayonnement β−
Lorsqu’un noyau est instable, celui-ci a une certaine probabilité d’éjecter un électron. Ce processus est appelé désintégration β−. L’équation1.1représente ce type de désintégration.
1
0n → 11p +−10 β + υ (désintégration β−) (1.1)
Les particules 1
0n,11pet υ représentent respectivement neutron, proton et antineutrino.
L’élec-tron est représenté par β−. Dans la gamme d’énergie utilisée en médecine nucléaire (131I :
Emax1 = 0,6 MeV ; 177Lu : Emax = 0,5 MeV) les rayonnements β sont pénétrants dans la
matière avec une portée de quelques millimètres dans les tissus humains (d0,5M eV 2= 1,7 mm ;
d0,6M eV = 2,2 mm) [7].
Rayonnement γ
Lors de la désexcitation d’un noyau, un rayonnement gamma peut être émis (équation 1.2).
A
ZX∗ → AZX + γ (1.2)
Aux énergies utilisées en médecine nucléaire, soit 140 keV pour le 99mTc ou 606 keV pour
l’131I, les rayonnements γ ont un libre parcours moyen de quelques centimètres dans les tissus
humains (µ140keV 3= 6,7 cm ; µ606keV = 11,2 cm) [7,8] et sont capables de traverser le corps
d’un individu. La figure 1.1 illustre la différence de portée pour différents rayonnements et pour divers types de matériaux.
1. Énergie maximale de la particule β. 2. Portée d’une particule chargée.
Aluminium Plomb Papier α β γ
Figure 1.1 – Illustration de la portée des rayonnements α, β et γ pour divers matériaux Les photons interagissent avec la matière par différents processus comme l’effet photoélec-trique, l’effet Compton, la production de paires et la diffusion Rayleigh. Lors de cette étude, les émetteurs gamma utilisés sont le99mTc, 177Lu et57Co. Pour chacun de ces isotopes,
l’éner-gie de désintégration dominante se trouve respectivement à 140 keV, 208 keV et 122 keV. Les milieux d’interaction généralement considérés sont l’air (Zef f4 = 7,64), l’eau (Zef f = 7,42) et
les tissus mous (Zef f = 7,22) [9] et en se basant sur la figure1.2 aux énergies utilisées, seuls
les effets photoélectrique et Compton sont dominants. La diffusion Rayleigh a lieu à basses énergies (≤ 50 keV dans l’eau et les tissus) et pour des Z très grands. De plus, étant un phé-nomène élastique (pas de transfert d’énergie d’un photon sur un atome), celui-ci n’affectera pas les résultats de l’étude [7,10,11].
Figure 1.2 – Illustration des trois interactions majeures entre les rayonnements γ et la matière. Image inspirée de Introduction to Radiological Physics and Radiation Dosimetry [7].
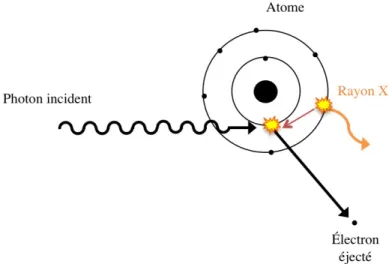
Effet photoélectrique
L’effet photoélectrique est l’absorption d’un photon incident par un électron des couches in-ternes de l’atome (figure 1.3). Cet effet est suivi par l’éjection de cet électron (photoélectron) avec l’énergie du photon incident (E0) moins l’énergie de liaison de l’électron (El)
(équa-tion 1.3).
Epe = E0− El (1.3)
Cet effet crée une vacance entraînant une cascade de rayon X ou d’un électron Auger5. La
probabilité qu’un rayon X soit émis décroit en fonction du numéro atomique Z du milieu absorbant. La probabilité d’absorption photoélectrique par unité de masse est proportionnelle à Z4
E3
0 [7]. L’effet photoélectrique est dominant lorsque les photons de faible énergie interagissent
dans des milieux ayant un Z élevé.
Figure 1.3 – Illustration de l’effet photoélectrique.
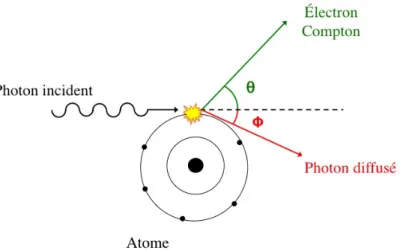
Effet Compton
L’effet Compton a lieu lorsqu’un photon entre en collision avec un électron d’une couche externe d’un atome (figure 1.4). Après la collision, le photon est dévié selon un angle de diffusion θ. Dans ce processus, le photon transfère une partie de son énergie à l’électron qu’il a rencontré (électron de recul). Par conservation des quantités de mouvement et d’énergie, l’énergie du photon diffusé est dépendante de son angle de diffusion θ et se calcule avec l’équation 1.4. Edif = E0 1 + (E0 me)(1 − cosθ) (1.4)
Les paramètres E0, Edif et mereprésentent respectivement l’énergie du photon incident,
l’éner-gie du photon diffusé et la masse de l’électron. L’équation1.5représente l’énergie de l’électron de recul.
Ere= E0− Edif (1.5)
L’effet Compton est le phénomène physique prédominant pour les énergies d’émission γ utilisés en médecine nucléaire dans le corps du patient.
Figure 1.4 – Illustration de l’effet Compton.
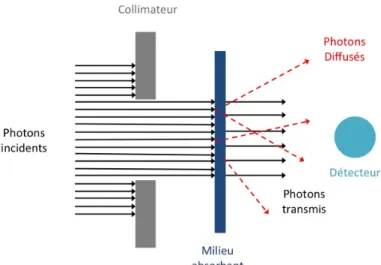
Atténuation des photons
Lorsqu’un photon traverse un milieu absorbant, la section efficace d’interaction dépend de son énergie ainsi que de la composition et de l’épaisseur du milieu qu’il traverse. Lors de cette interaction, le photon est soit complètement absorbé ou sa trajectoire est déviée du détecteur (figure1.5). Dans ces conditions, le nombre de photons transmis à une profondeur x (Nx)
dé-croît de façon exponentielle en fonction du nombre initial de photons (N0,) et de l’atténuation
linéique µ du milieu absorbant [7,12]. L’équation 1.6 est la représentation mathématique de l’atténuation du faisceau de photons. Celle-ci est aussi représentée en terme d’intensité par la loi de Beer-Lambert [13,14] avec l’équation 1.7.
Nx = N0e−µx (1.6)
Les paramètres Ix et I0 correspondent respectivement à l’intensité transmise et l’intensité
incidente. Le rapport Ix
I0, correspondant à la fraction de l’intensité transmise par le milieu
absorbant, est appelé facteur de transmission.
Figure 1.5 – Illustration de l’atténuation d’un faisceau de photons dans un milieu absorbant.
1.2.2 Tomographie d’émission monophotonique (TEM)
La tomographie d’émission monophotonique (TEM) ou Single Photon Emission Computed Tomography (SPECT) a été inventée par David Khul et al. [15] au début des années 1960. Cependant, ce n’est qu’à la fin des années 1980 que cette technique a été implantée en cli-nique [11]. La TEM est une modalité d’imagerie diagnostique dans laquelle la distribution de radionucléides est étudiée en 3D grâce à la détection de photons γ. Les images TEM peuvent être utilisées qualitativement pour interpréter visuellement la fonction physiologique des tissus et des organes, ou quantitativement, pour mesurer les processus chimiques et physiologiques importants en recherche et imagerie [16,17]. En TEM, une ou plusieurs caméras enregistrent le rayonnement gamma émis du patient sous différents angles. Les projections obtenues sont utilisées pour reconstruire une série d’images tomographiques. Les appareils TEM peuvent être couplés à des appareils TDM (Tomodensitométrie) permettant de corégistrer les images issues de chacune de ces modalités. Grâce au TDM, il est possible d’obtenir les informations anato-miques en plus des informations fonctionnelles données par la TEM. La figure 1.6représente un appareil TEM/TDM.
1.2.3 Caméra gamma
Les caméras gamma, aussi connues sous le nom de caméras à scintillation ou caméras An-ger [18], sont les caméras utilisées en TEM. Bien que les appareils à une caméra sont suffisants pour acquérir les données nécessaires pour une image tomographique, les appareils à deux ca-méras sont préférés puisqu’ils permettent d’obtenir deux fois plus de comptes pour un même temps d’acquisition [10].
Figure 1.6 – Illustration d’un appareil TEM/TDM à deux caméras de la compagnie Siemens, Symbia T6 (Siemens, Munich, Allemagne).
Composition
Les principaux composants des caméras gamma sont le collimateur, le cristal, le guide lumineux et les tubes photomultiplicateurs (PMT). Ces éléments sont représentés à la figure1.7.
Collimateur : permet de filtrer les rayonnements γ pour que seuls les rayons parallèles aux lames, ou septa, du collimateur soient détectés. En médecine nucléaire, plusieurs types de collimateur existent avec des septa de différentes épaisseurs en fonction de l’énergie de l’isotope. Plus le rayonnement de l’isotope est énergétique, plus les septa sont épais.
Cristal NaI(Tl) : scintillateur inorganique permettant de transformer les photons in-cidents en photons lumineux (de plus basse énergie). Il s’agit du scintillateur le plus répandu pour la spectroscopie gamma grâce à son haut rendement lumineux et rende-ment quantique [19]. Le choix de l’épaisseur du cristal est basé sur un compromis entre l’efficacité de détection du cristal (proportionnelle à l’épaisseur) et sa résolution spa-tiale intrinsèque (inversement proportionnelle à l’épaisseur). Pour un appareil clinique, la taille typique du cristal est de 60 par 45 cm pour une épaisseur de 9,5 mm.
PMT : détecte les photons lumineux et les transforme en signal électrique. En général, la taille d’un PMT est de 5 cm de diamètre et une caméra gamma peut en contenir entre 30 et 100 [20].
Détection d’événements
La figure 1.7représente les différents types d’événements détectés par une caméra gamma. A : Événement diffusé dans le patient
Interaction produite lorsque le γ émis diffuse dans le patient avant d’atteindre la caméra. À cause de cette diffusion, le γ subit une perte énergétique pouvant entraîner un rejet de l’événement par discrimination en énergie. Si l’événement est accepté, la reconstruction de sa position sur l’image finale sera décalée par rapport à sa position réelle.
B : Événement diffusé dans le cristal
Ce genre d’événement se produit lors que le γ émis interagit par diffusion Compton dans le cristal. Le photon diffusé peut interagir dans le détecteur une deuxième fois, en général par effet photoélectrique, ou le traverser. Dans le premier cas, l’événement peut être accepté et par conséquent, sa position reconstruite sur l’image sera décalée par rapport à sa position réelle.
C : Événement valide
Un événement est dit valide lorsque le rayon γ émis passe au travers des septa du colli-mateur et qu’il interagit dans le cristal par effet photoélectrique.
D : Pénétration septale
Lorsqu’un rayon γ, n’est pas parallèle aux septa du collimateur, celui-ci a une chance de les traverser et de se rendre au cristal. Plus les lames du collimateur sont fines, plus il y a de chance que cet événement se produise.
A B C D Tubes photomultiplicateurs (PMT) Guide lumineux Cristaux NaI(Tl) Collimateur
Patient émettant des rayons γ
1.2.4 Imagerie quantitative
L’imagerie quantitative est une technique permettant de mesurer, en termes absolus, la concen-tration d’activité captée par une structure cible en TEM [21,22]. Celle-ci est notamment utilisée pour le suivi de l’évolution d’une tumeur sous thérapie, par exemple lors d’une thérapie radio-nucléique. Afin d’obtenir une quantification précise, de nombreux paramètres sont à prendre en compte et doivent être corrigés au préalable. L’atténuation des photons dans le corps, les photons diffusés, le temps mort de la caméra et l’effet de volume partiel sont les principaux éléments à corriger [6,22].
Sensibilité
La sensibilité correspond à la capacité de détection de la caméra et d’enregistrement du nombre d’événements émis par une source radioactive [23]. Pour une même activité et pour un même temps d’acquisition, plus la sensibilité de l’appareil est élevée plus il y a d’événements détectés. Dans cette présente étude, la sensibilité est exprimée en compte par seconde par mégabecquerel (cps/MBq).
Temps mort
Le temps mort correspond au temps de traitement nécessaire lors de la détection d’un événe-ment pendant lequel le système ne peut détecter d’autres événeévéne-ments [10]. Celui-ci cause une diminution du nombre d’événements comptabilisés par rapport au nombre qui atteint réelle-ment la caméra. Il est possible de classifier les systèmes de comptage, tels que les caméras gamma, en deux catégories : le système paralysable et le système non paralysable.
Pour un système non paralysable, si des événements se produisent durant le temps mort τ induit par un premier événement, ceux-ci sont simplement ignorés et le temps mort n’est pas réinitialisé. Pour un système paralysable, chaque événement induit son propre temps mort τ. Par conséquent, si un événement se produit durant le temps mort τ induit par un premier événement, il ne sera pas compté, mais le temps mort sera réinitialisé. Ce phénomène est illustré avec la figure 1.8. Il est à noter que la plupart des détecteurs de radiation agissent comme des systèmes paralysables.
Effet de volume partiel
L’effet de volume partiel peut être défini comme la perte d’activité apparente sur une image TEM/TDM dû à la faible résolution spatiale de l’appareil. Ce phénomène est particulièrement prononcé pour des objets de petit volume. Physiquement, cet effet est dû à la fonction de réponse du détecteur qui étale le signal faisant en sorte que l’amplitude du signal de sortie est plus faible que celle du signal d’entrée. Ce concept est illustré par la figure1.9. La conséquence de cet étalement est qu’une partie de l’activité intérieure est détectée à l’extérieur de l’objet et inversement (figure1.10).
Figure 1.9 – Illustration mathématique de l’effet de volume partiel. Soret M., Bacharach S. et Buvat I. Partial Volume Effect in PET Tumor Imaging [24] © Society of Nuclear Medicine and Molecular Imaging, Inc.
Figure 1.10 – Illustration de l’effet de volume partiel. Les différents volumes contiennent la même concentration d’activité. La rangée du milieu illustre le flou induit par le PVE. La rangée du bas représente les profils associés à chaque objet. Cette image a été publiée dans Physics in nuclear medicine [10], Cherry S., Sorenson J. et Phelps M., © Elsevier.
1.2.5 Reconstruction tomographique
Les reconstructions tomographiques servent à estimer la distribution d’activité 3D d’un objet à partir de projections 2D mesurées. À l’heure actuelle, différents types de reconstructions sont commercialisés comme la reconstruction par rétroprojection filtrée ou la reconstruction itérative. Chacune de ces reconstructions présente des avantages comme des inconvénients [16,
25,26].
Reconstruction analytique par rétroprojection : simple et filtrée
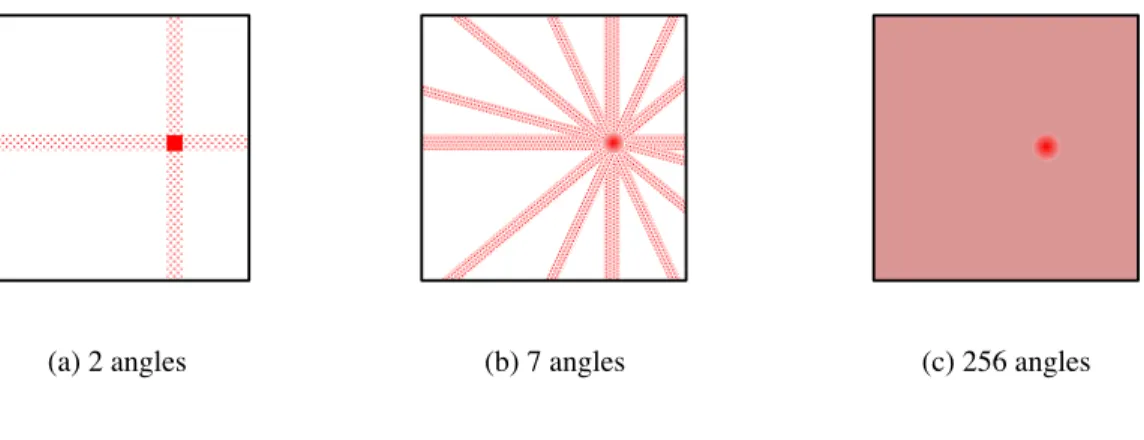
La reconstruction par rétroprojection simple est l’approche la plus simple et la plus directe. Celle-ci est illustrée à l’aide de la figure1.11. La distribution d’activité d’un objet est mesurée pour chaque angle autour de cet objet et est projetée sur une grille d’image 2D (matrice). La taille de cette matrice est généralement de 64 × 64 pixels ou de 128 × 128 pixels. Il est à noter que plus il y a d’angles de projection, meilleure est l’estimation de l’activité. La relation mathématique entre l’approximation de la distribution d’activité réelle d’un objet, f(x,y), et de son estimation, f’(x,y) est définie par la convolution représentée à l’équation1.8.
f0(x, y) = 1
r ⊗ f (x, y) (1.8)
La dégradation de la qualité de l’image reconstruite en fonction de 1
r, avec r = px2+ y2 [16],
est appelée 1
r blurring ou flou radial.
(a) 2 angles (b) 7 angles (c) 256 angles
Figure 1.11 – Illustration de rétroprojection simple pour différents angles de la caméra autour de la source.
La reconstruction par rétroprojection filtrée (FBP) est similaire à la rétroprojection simple, à la différence où la distribution d’activité est modifiée par un filtre avant d’être projetée sur la matrice 2D. Ce filtre sert à supprimer les basses fréquences spatiales et à augmenter les hautes fréquences spatiales. Mathématiquement, l’application du filtre équivaut à une déconvolution
du paramètre 1
r (équation 1.8) et entraîne l’élimination du flou radial. Les étapes nécessaires
pour la rétroprojection filtrée sont illustrées sur la figure 1.12.
L’avantage des reconstructions analytiques est que celles-ci sont rapides, simples d’implémenta-tion et disponibles sur tous les appareils TEM commerciaux. Cependant, celles-ci ne tiennent pas en compte l’atténuation et la diffusion de photons, phénomènes qu’il est nécessaire de corriger pour permettre la quantification d’images.
Figure 1.12 – Illustration de rétroprojection filtrée pour différents angles de la caméra autour de la source. Cette image a été publiée dans Physics in nuclear medicine [10], Cherry S., Sorenson J. et Phelps M., © Elsevier.
Reconstruction itérative
Il y a quelques années, les reconstructions FBP étaient préférées aux reconstructions itératives, puisqu’elles sont rapides, simples d’implémentation et universelles. Cependant, avec l’amélio-ration des performances informatiques (par exemple : rapidité des calculs), les reconstructions itératives sont devenues la référence en médecine nucléaire [27]. Contrairement aux recons-tructions par rétroprojection dites analytiques, les reconsrecons-tructions itératives sont de nature statistique : l’algorithme converge vers une solution optimisée lors de ces calculs. L’objectif de l’algorithme est de déterminer l’intensité des pixels de l’image. Pour cela, une résolution ma-tricielle est effectuée selon l’hypothèse que chaque pixel contribue à chaque raie de projection. Un système d’équations est alors posé avec autant d’inconnues que de pixels. La figure 1.13
et les équations1.9illustrent le système à résoudre pour 4 pixels d’intensité a et 4 projections d’intensité p.
Figure 1.13 – Illustration des pixels et des projections utilisés lors des reconstructions itéra-tive. p1 = m11a1+ m12a2+ m13a3+ m14a4 p2 = m21a1+ m22a2+ m23a3+ m24a4 p3 = m31a1+ m32a2+ m33a3+ m34a4 p4 = m41a1+ m42a2+ m43a3+ m44a4 (1.9)
En somme, le système peut s’écrire plus simplement sous une forme algébrique telle qu’à l’équation1.10.
pj =
X
i
Mi,jai (1.10)
Le paramètre pj correspond à l’intensité mesurée dans la projection j, ai à l’intensité dans le
pixel i et la matrice M représente la probabilité que la radiation émise du pixel i soit détectée dans la projection j. Il est à noter que p et M sont des variables connues et que seul a est à déterminer. Une image de 128 × 128 pixels pour 96 projections donne un système de 12 288 équations (128×96) pour 16 384 inconnues (128×128). Différents algorithmes de résolution de matrices pour la reconstruction existent comme le modèle ART (Algebric Reconstruction Technique) [28], SIRT (Simultaneous Iterative Reconstruction Technique) [29] ou OSEM (Or-dered Subset Expectation Maximisation) [30].
Dans ce mémoire, seule l’approche OSEM sera présentée puisqu’il s’agit du type de reconstruc-tion le plus utilisée en TEM (convergence la plus rapide vers la solureconstruc-tion). Dans cet algorithme, un modèle probabiliste se basant sur la loi de Poisson est utilisé pour déterminer la solution la plus vraisemblable en considérant les données originales [31]. L’équation 1.11représente le modèle en question.
ak+1i = a k i P j Mi,j ×X j Mi,j pj P i Mi,jaki (1.11)
Le paramètre k représente le numéro de l’itération considérée. Avec l’approche OSEM, les projections p sont triées en sous-ensembles (subsets) de données, par exemple, 4 projections utilisant 2 sous-ensembles. Les seuls paramètres à fixer sont le nombre d’itérations et le nombre de sous-ensembles. Généralement, plus il y a d’itérations, meilleure est la résolution spatiale de l’image. Cependant, un trop grand nombre d’itérations reconstruit les hautes fréquences engendrant du bruit sur les images. Un compromis doit être trouvé entre la résolution spatiale et le bruit dans les images reconstruites. De plus, la vitesse de la reconstruction dépend du nombre d’itérations choisi : plus il y a d’itérations plus la reconstruction sera longue. C’est pourquoi les sous-ensembles en OSEM sont de grand intérêt puisqu’ils permettent d’accélérer la vitesse de reconstruction. L’utilisation de sous-ensembles permet de multiplier le nombre d’itérations sans augmenter le temps de calcul [32].
En somme, pour les reconstructions itératives, le processus mathématique derrière l’approche choisie (ART, SIRT, OSEM) est répété autant de fois qu’il y a d’itérations. Il arrive un moment au cours de la reconstruction où l’algorithme peut diverger de la solution optimale (optimisation de la résolution spatiale et du contraste de l’image) [26]. Cela arrive généralement pour les reconstructions avec beaucoup d’itérations et où le bruit devient prédominant.Grâce à leur modèle mathématique, les reconstructions de type itératives sont celles permettant la meilleure approche quantitative [33].
Correction de la diffusion des photons
En TEM, le rayonnement diffusé provoque un mauvais positionnement des photons sur les projections, tel qu’expliqué à la section 1.2.3 (figure 1.7). Ce mauvais positionnement peut induire sur l’image reconstruite un flou radial, une diminution de contraste et des erreurs de quantification. En clinique il est très difficile de s’affranchir du phénomène de diffusion puisque le principal milieu diffusant est le patient lui-même. Plusieurs méthodes de corrections ont été proposées au cours du temps comme l’élimination de photons diffusés pendant l’acquisition ou par soustraction des photons diffusés au pic photoélectrique [34,35].
L’évaluation du rayonnement diffusé pendant l’acquisition est effectuée par fenêtrage spectro-métrique où une fenêtre d’énergie est positionnée, manuellement ou automatiquement, autour du pic photoélectrique. Celle-ci peut être soit symétrique centrée ou asymétrique. L’hypothèse de cette méthode est que tous les événements qui ne sont pas collectés dans cette fenêtre correspondent à du rayonnement diffusé. Cette technique a pour avantage d’être simple,
ce-pendant le rayonnement diffusé n’est pas éliminé de façon complète.
La correction du rayonnement diffusé par soustraction part de l’hypothèse que dans la fenêtre d’énergie correspondant au pic photoélectrique, se trouvent à la fois des photons primaires et diffusés (équation1.12).
Cprim = Ctotal− Cscat (1.12)
Le paramètre Cprim correspond aux photons primaires, Ctotal aux photons collectés dans la
fenêtre d’énergie principale et Cscat aux photons diffusés.
Figure 1.14 – Illustration des fenêtres d’énergie pour la correction des photons diffusés en TEW [36] © [1991] IEEE.
Plusieurs méthodes permettent d’estimer le rayonnement diffusé à partir de cette hypothèse comme la soustraction de Jaszczak [37] ou par fenêtre triple énergie (TEW). Seule la cor-rection TEW sera discutée puisqu’il s’agit de la corcor-rection utilisée lors de cette étude. Cette approche a tout d’abord été introduite en 1991 par Ogawa et al. [36] puis reprise en 1993 par Ichihara et al. [38]. Ogawa et al. proposent d’utiliser trois fenêtres d’énergie : une fenêtre principale centrée au niveau du pic photoélectrique et deux fenêtres chacune aux frontières de la fenêtre principale. En considérant que les événements collectés dans les fenêtres autour du pic photoélectrique ne soient que du rayonnement diffusé, il est alors possible d’estimer le rayonnement diffusé dans la fenêtre principale. Les photons diffusés dans la fenêtre principale sont déterminés par l’équation1.13.
Cscat' ( Clef t Ws +Cright Ws ) ×Wm 2 (1.13)
La variable Ws correspond à la largeur des fenêtres d’énergie autour de la fenêtre principale,
la fenêtre de gauche et Crightaux événements comptabilisés dans la fenêtre de droite, comme
illustré sur la figure 1.14. L’application de ce principe a été démontrée pour les isotopes suivants : 67Ga, 99mTc, 111In, 123I et201Tl [36,38].
1.3
Description et problématique du projet
De nombreux groupes de recherche se sont déjà intéressés à la quantification TEM et no-tamment avec le 99mTc. En 1978, Adam et al. [39] ont étudié le temps mort des caméras à
scintillation à l’aide d’une mire reproduisant le rayonnement diffusé lors des acquisitions car-diaques. En 1995, l’AAPM [40] ont proposé une procédure de tests permettant d’évaluer la performance d’appareils TEM en quantification. Ces tests se résument à l’étude du contraste et de la résolution spatiale de l’appareil. En 2008, Bailey et Willowson [41] ont étudié la pré-cision de la quantification au99mTc pour des études de perfusion pulmonaire. En 2013 Silosky
et al. [42] ont publié sur la performance des nouvelles caméras : des acquisitions sans collima-teur avec des sources de 99mTc ont été effectuées. Enfin, en 2013, Cervo et al. [43] ont étudié
la quantification au 99mTc pour l’étude des ostéomyélites.
De même, le 177Lu-octréotate à déjà fait l’objet de nombreuses études dosimétriques [44–46].
Cependant, peu d’études se sont orientées sur l’imagerie TEM quantitative du177Lu. En 2011,
Beauregard et al. [47] ont étudiés la sensibilité et le temps mort d’un appareil TEM/TDM à partir de sources ponctuelles de 177Lu. Dans cette étude, l’appareil TEM/TDM Symbia T6
de Siemens a été utilisé. Il s’agit du même appareil que celui utilisé lors de la présente étude. Une étude quantitative du177Lu a été jugée nécessaire afin de comparer les résultats obtenus
avec les acquisitions au99mTc. Cependant, aucune étude de mire uniforme sur une large plage
d’activité n’a été répertoriée. Cette étape est fondamentale avant de commencer toute étude quantitative, ou bien avant de se lancer dans l’acquisition d’images plus complexes comme le corps humain, puisque cela permet non seulement d’analyser l’uniformité des images, mais aussi d’étudier l’algorithme de reconstruction intégré à l’appareil.
De plus, comme discuté aux sections 1.2.4, 1.2.4 et 1.2.5, différents phénomènes physiques sont à corriger, afin de quantifier l’activité d’un objet à partir de son image. Le temps mort, le PVE, la correction d’atténuation de photons (AC) et de diffusion de photons (SC) sont les plus grands obstacles à l’imagerie TEM quantitative. Avec l’arrivée d’algorithmes permettant la correction automatique de l’atténuation et de la diffusion du rayonnement, l’imagerie TEM quantitative est désormais possible à partir d’images reconstruites. Pour étudier les algorithmes cliniques actuels, Seret et al. [48], en 2012, ont évalué quatre plateformes de reconstruction intégrées à des appareils TEM/TDM commercialement disponibles, dont la Symbia T6. Pour cela, des acquisitions de mires cylindriques remplies de99mTc ont été effectuées afin d’étudier
sont satisfaisantes, ce groupe a observé que des artéfacts de reconstruction persistent. En effet, des artéfacts de raies et d’anneaux sont visibles sur toutes leurs images reconstruites, comme l’illustre la figure1.15. Les artéfacts de raies apparaissent généralement lors de la transition entre deux milieux d’activités très différentes, e.g. entre une source de99mTc et l’air ambiant
de la salle [49]. Selon la littérature, les artéfacts d’anneaux sont générés par le recouvrement de résolution lors de la reconstruction [50]. Ceux-ci apparaissent lorsque l’algorithme essaie de corriger les petits détails qui ont été perdus à cause de la faible résolution spatiale de la caméra.
Figure 1.15 – Coupes du fantôme imagé avec Symbia T6. Les images ont été reconstruites avec Siemens Flash3D [48]. (A) Artéfact de raie visible. (B) Artéfact d’anneau visible. L’étude de Seret et al. démontre que la reconstruction idéale pour la Symbia T6 est la recons-truction itérative OSEM 2D avec 24 itérations utilisant 8 sous-ensembles sans recouvrement de résolution ou Resolution Recovery (RR). Selon ce groupe, les artéfacts de raies s’estompent en augmentant le nombre d’itérations et les artéfacts d’anneaux disparaissent s’il n’y a pas de RR. Seret et al. ne sont cependant pas les seuls à avoir observé ce genre d’artéfacts. En 2010, Kangasmaa et al. observent eux-mêmes des artéfacts d’anneaux suite à une reconstruction de type OSEM (section1.2.5d’une mire cylindrique de99mTc [50]. D’après eux, la reconstruction
idéale serait une reconstruction probabiliste de type Bayesian AMAP ou Bowsher, disponible sur la plateforme de reconstruction HERMES HybridRecon (HERMES Medical Solutions, Stockholm, Suède). Ce type de reconstruction entraîne un lissage de l’image qui permet de dissiper les artéfacts de raies et d’anneaux, comme l’illustre la figure1.16.
Ce projet a pour but la calibration d’un appareil TEM/TDM pour l’imagerie quantitative ainsi que l’étude de l’impact de la présence du RR sur la quantification d’images TEM/TDM. L’imagerie quantitative est un outil clé pour effectuer une dosimétrie personnalisée lors de différents traitements en thérapie radionucléique. Cependant, la quantification est aujourd’hui limitée par la présence d’artéfacts de raies et d’anneaux créés lors de la reconstruction. Il sera également important d’évaluer l’impact de ces artéfacts d’anneaux et de raies sur la
quan-(a) OSEM RR (b) AMAP
Figure 1.16 – Illustration des profils obtenus pour une acquisition fantôme avec une recons-truction (a) OSEM avec RR et avec une reconsrecons-truction (b) AMAP [50].
tification TEM/TDM du 177Lu et du 99mTc. Pour ce faire, un appareil TEM/TDM (Symbia
TruePoint T6, Siemens) sera préalablement calibré (sensibilité, τ et PVE) et la réponse de différents algorithmes de reconstruction à des acquisitions faites sur des mires de ces isotopes sera évaluée.
Chapitre 2
Matériels et méthodes
Les images TEM/TDM obtenues lors des séances d’imagerie des patients traités au 177
Lu-octréotate contiennent toute l’information nécessaire aux calculs dosimétriques. Néanmoins, avant d’utiliser ces données pour la quantification, il est nécessaire de connaître les facteurs et corrections nécessaires à apporter à l’appareil utilisé. Dans ce chapitre, l’appareil TEM/TDM utilisé ainsi que les isotopes imagés sont détaillés (sections2.1.1et2.2). La stabilité temporelle des caméras est évaluée (section 2.3). L’appareil est calibré pour le 99mTc et le177Lu :
sensi-bilité, temps mort et effet de volume partiel (sections 2.4.1 et 2.4.2). Enfin, la plateforme de reconstruction SPEQToR (University of British Columbia, Vancouver, Canada) est comparée à la plateforme de reconstruction directement intégrée à l’appareil TEM/TDM utilisé afin de déterminer la reconstruction optimale pour l’imagerie quantitative (section 2.5).
2.1
Système et matériels utilisés
2.1.1 Appareil TEM/TDM
Au cours de cette présente étude, les mesures ont été effectuées à l’aide d’un appareil TEM/TDM à deux caméras, le Symbia TruePoint T6 de Siemens (Siemens, Munich, Allemagne). Les pa-ramètres de l’appareil sont résumés dans les tableaux 2.1et2.2.
Tableau 2.1 – Paramètres d’acquisition TDM de l’appareil Symbia TruePoint T6 de Siemens. Temps de rotation 0,8 seconde
Tension 110 kVp
Intensité 20 mA
Tableau 2.2 – Paramètres d’acquisition TEM de l’appareil Symbia TruePoint T6 de Siemens.
Collimateur LEHR, MELP, HE
FOV du détecteur 53,3 × 38,7 cm
Épaisseur NaI 0,953 cm
Nombre de PMT 59
Matrice 128 x 128
Projections 48 par tête sur 360°
Mode Step and shoot
Trajectoire Circulaire
Temps par projection 1-60 secondes Fenêtre d’énergie 6
2.1.2 Mire Jaszczak
Les différentes mesures nécessaires ont été réalisées à l’aide d’une mire Jaszczak Deluxe, illus-trée à la figure2.1, standard en médecine nucléaire et référence de l’AAPM Report of AAPM n°52 et Report of Task Group n°4 [40] pour l’évaluation d’un appareil TEM. Il s’agit d’une mire cylindrique de 21,6 cm de diamètre intérieur pour 18,6 cm de hauteur et 3,2 mm d’épaisseur pouvant contenir jusqu’à un volume de 6,9 L. Un lot de six sphères pleines et de six sphères creuses (sphères amovibles, diamètre : 9,5 mm ; 12,7 mm ; 15,9 mm ; 19,1 mm ; 25,4 mm ; 31,8 mm) sont respectivement disponibles pour l’étude des lésions non radioactives (froides) et radioactives (chaudes).
Figure 2.1 – Illustration de la mire Jaszczak SPECT Deluxe.
2.1.3 Calibrateur de dose
Le calibreur de dose Atomlab400 de Biodex (Biodex, Shirley, États-Unis) a préalablement été calibré pour des sources de 99mTc, 201Tl, 57Co, 137Cs, 131I, 111In, 67Ga, 133Xe, 123I et 99Mo au
National Institute of Standards and Technology (NIST). Il s’agit d’une chambre à ionisation entourée de 0,63 cm de plomb. Un support hexagonal en styromousse a été fabriqué pour mesurer l’activité des sources dans des conditions identiques (figure2.2).
Figure 2.2 – Illustration schématisée du support utilisé pour la mesure d’activité dans le calibrateur de dose.
2.1.4 Chélateur : DTPA
Pour les différentes acquisitions avec la mire cylindrique, un chélateur, le DTPA (acide diéthy-lène triamine penta acétique), a été ajouté dans le milieu. Il a été démontré que pour certains radionucléides, les ions métalliques pouvaient adsorber aux parois en plastique de l’objet, qu’il s’agisse de la seringue d’injection ou de la mire [51–53]. La figure2.3illustre l’effet de l’adhé-sion du radiométal sur le plastique s’il n’y a pas de chélateur. Dans ce cas, il s’agit de 177Lu
dans une bouteille en plastique. L’effet est particulièrement visible au fond de la bouteille puisque celle-ci était stockée en position verticale. Néanmoins, même après mélange et rinçage à l’eau, l’activité restait fixée au fond de la bouteille.
La chélation est un processus essentiel en médecine et notamment pour les traitements par thérapie radionucléique. En effet, en se liant à des métaux comme le177Lu, le chélateur permet
de créer des complexes stables et solubles, pouvant facilement être éliminés par voie urinaire, limitant la toxicité du traitement chez le patient [54–56].
2.2
Radionucléides utilisés
2.2.1 Technétium 99m
Le99mTc, isomère métastable du 99Tc, est émetteur d’un rayonnement γ à 140 keV lors de sa
désexcitation. Avec une décroissance rapide (demi-vie : 6 heures), le 99mTc est idéal pour les
examens TEM/TDM. En effet, les patients peuvent rentrer chez eux quelques heures après l’injection sans émettre de radiation de façon significative. Grâce à sa disponibilité (peu dis-pendieux, rapidement distribué) et à ses propriétés physico-chimiques intéressantes (demi-vie suffisamment longue, photon monochromatique), le 99mTc est le radioisotope le plus utilisé
en imagerie TEM/TDM. Ses principales applications en médecine sont les scintigraphies os-seuses, la recherche de ganglion sentinelle, l’étude de la perfusion pulmonaire ou l’imagerie cardiaque [57]. La figure2.4 représente le schéma de désintégration du99mTc.
Figure 2.4 – Schéma de désintégration du 99Mo.
2.2.2 Lutétium 177
Le177Lu est un émetteur β− d’énergie maximale de 0,5 MeV dont la désintégration conduit à
de l’hafnium 177. Lors de sa désintégration, le produit fille de la désintégration du177Lu peut
se trouver dans un état excité. Pour retrouver un état stable, deux rayonnements γ de moyenne et faible énergies, 208 keV (10,4 %) et 113 keV (6,2 %), peuvent être émis [58–62]. La figure2.5
représente le schéma de désintégration du177Lu. La pénétration maximale des rayonnements
β du 177Lu dans les tissus est de 2 mm, ce qui permet une irradiation optimale des petites
tumeurs [57]. Le 177Lu utilisé dans cette étude vient de la compagnie IDB-Holland
(Baarle-Nassau, Pays-Bas) et est produit par bombardement neutronique du176Lu (équation2.1).
176Lu(n, γ)177Lu (2.1)
Depuis 2012, le 177Lu est le radionucléide utilisé pour le traitement des tumeurs
sont inopérables, le patient est traité à l’aide du177Lu-octréotate par TRRP [5,63–68]. Il a été
montré que ce traitement est plutôt bien toléré par les patients et n’entraîne pas trop d’effets secondaires [3,69].
Figure 2.5 – Schéma de désintégration du177Lu.
2.2.3 Cobalt 57
Le 57Co est généralement utilisé comme source pour les contrôles d’uniformité des caméras à
scintillation [11]. Dans la présente étude, celui-ci a été utilisé afin de mesurer la stabilité de la sensibilité des caméras au cours du temps. La figure2.6représente la plaque de57Co utilisée.
2.2.4 Autres radionucléides utilisés en médecine nucléaire
Iode 131 L’131I est une référence en médecine nucléaire et est généralement utilisé pour le
traitement du cancer de la thyroïde. Celui-ci peut être utilisé comme traitement principal ou après une chirurgie pour éliminer les cellules cancéreuses restantes.
Gallium 67 Le 67Ga est utilisé lors des séances d’imagerie TEM/TDM pour la recherche
Le tableau2.3regroupe les caractéristiques de ces radionucléides.
Tableau 2.3 – Caractéristiques physiques des radionucléides utilisés.
Élément Mode de décroissance Demi-vie Énergie β moyenne [keV] Énergie γ [keV] (Abondance) [%] (Abondance) [%] 57Co CE (100) 271,7 j 122 (86) 136 (11) 67Ga CE 3,26 j 93 (40) 184 (20) 300 (17) 393 (5) 99mTc TI (100) 6,02 h 140 (88) 131I β− 8,02 j 333,8 (7) 637 (7) 606 (90) 365 (82) 177Lu β− 6,65 j 47,7 (12) 113 (6) 111,7 (9) 208 (10) 149,4 (79)
CE : capture électronique ; TI : transformation isomérique.
2.3
Stabilité de la sensibilité de l’appareil TEM :
57Co
Les performances des appareils TEM fluctuent à long terme en raison de la variation de sensibilité des PMT en fonction des conditions environnementales telles que la température ou l’humidité [19]. Avec un appareil stable en fonction du temps, il est possible de comparer des images prises à différents moments sans mettre à jour un facteur de calibration.
Le but de cette section est d’évaluer la stabilité temporelle de l’appareil TEM en se basant sur des protocoles déjà existants [70–72]. Pour vérifier la stabilité de la sensibilité de chacune des caméras de l’appareil, une plaque de 57Co a été utilisée. L’intérêt de cet isotope est sa
demi-vie de 271 jours. Puisque le57Co possède une décroissance radioactive lente, celui-ci est
un candidat de choix pour mesurer la stabilité de la caméra sur une longue durée. La figure
2.6 représente le montage utilisé. Pour chacune des deux caméras de l’appareil TEM, une acquisition statique de 90 secondes est effectuée avec la plaque de57Co directement posée sur
le collimateur.
Le collimateur utilisé avec le57Co est le collimateur à basse énergie LEHR (Low Energy High
Resolution). Le pic photoélectrique est centré à 120 keV avec une largeur de fenêtre de 20%. Quatre séries d’acquisitions ont été effectuées pour mesurer la stabilité de la sensibilité de l’appareil TEM.
Premièrement, la stabilité de l’appareil est évaluée sur le long terme. Pour cela, 71 séries de mesures ont été effectuées sur une période de 280 jours.
Figure 2.6 – Illustration de la plaque de 57Co. Montage utilisé pour les mesures de stabilité de sensibilité de l’appareil TEM/TDM au57Co.
Deuxièmement, la stabilité de l’appareil a été testée entre diverses procédures cliniques uti-lisant différents radioisotopes lors d’une journée clinique. L’intérêt de cette expérience est de mesurer la stabilité de l’appareil en fonction de l’énergie des isotopes ayant été injectés aux patients. Les mesures ont été prises entre différents patients qui ont préalablement été injectés au 99mTc (140 keV, faible énergie, 8 patients),67Ga (185 keV, moyenne énergie, 2 patients) et 131I (365 keV, haute énergie, 1 patient).
Troisièmement, la stabilité de l’appareil a été évaluée entre des acquisitions à haute activité de mire. Quatorze mesures ont été effectuées sur une plage d’activité de 99mTc allant de 30 MBq
à 5 GBq. L’intérêt de cette expérience est d’étudier la stabilité de la sensibilité de l’appareil de basse à très haute activité.
Quatrièmement, des acquisitions en fonction de l’angle d’orientation des caméras ont été effectuées en se basant sur le protocole proposé par Graham et al. dans le rapport 52 de l’AAPM [40]. En présence du champ magnétique externe [73], il a été rapporté que le gain des PMT peut subir variation de l’ordre de 10 % en fonction de l’angle d’orientation de la caméra [40]. Or, lors d’une acquisition TEM, les caméras de l’appareil bougent et tournent autour de l’objet imagé. Il est donc important de contrôler la stabilité de l’appareil en fonction de l’angle de rotation des caméras. Le protocole d’acquisition suivi est le suivant :
1. Utiliser le collimateur LEHR avec le pic photoélectrique centré à 120 keV pour une fenêtre d’analyse de 20%.
2. Placer et fixer la plaque de 57Co directement sur le collimateur.
3. Lancer une acquisition de 5 millions de comptes avec la caméra à 0°.
4. Répéter l’acquisition pour la caméra à 90°, 180°, 270° et 360° avec le temps écoulé lors de l’étape 3.
V ar(%) = M ax tot cts − M in tot cts
M ax tot cts + M in tot cts× 100 (2.2)
6. Analyse : la variation maximale de sensibilité ne doit pas dépasser 0,75%.
2.4
Calibration de l’appareil TEM/TDM
2.4.1 Calibration au 99mTc
Référence en médecine nucléaire, le 99mTc a été utilisé dans cette étude comme point de
comparaison pour les différentes mesures au177Lu.
Sensibilité et temps mort
D’après le guide nº 23 du MIRD [74], un appareil TEM/TDM peut être calibré de deux façons. 1. À l’aide d’acquisitions planaires d’un petit volume.
2. À l’aide d’acquisitions TEM d’un gros volume.
Pour cette étude, la deuxième solution a été utilisée. Les mesures nécessaires à la calibration ont d’abord été effectuées avec un objet atténuant puis avec un objet non atténuant afin d’évaluer l’impact de l’atténuation de photons sur la sensibilité et le temps mort de l’appareil. La mire Jaszczak, présentée dans la section 2.1.2, remplie uniformément d’eau et d’activité, a été utilisée pour représenter l’objet atténuant. Quinze acquisitions de mire uniforme et d’activité de99mTc variant de 25 MBq à 5 GBq ont été effectuées. Le collimateur LEHR a été
utilisé en raison de la faible énergie du99mTc (140 keV). Le mouvement des caméras autour
de l’objet était circulaire et les images ont été enregistrées en mode "arrêt image" ou step and shoot sur 96 projections. Un temps d’acquisition variant de 3 à 60 secondes par projection a été utilisé en fonction de l’activité de l’objet.
La procédure de préparation de la mire uniforme est la suivante. Tout d’abord, la mire doit être remplie d’eau au maximum. Le produit radioactif est inséré dans la mire à l’aide d’une seringue. Il est très important de noter l’activité injectée, l’heure de calibration et l’activité résiduelle du produit. Le couvercle et les bouchons de la mire peuvent être fermés. La bulle d’air résiduelle doit être la plus petite possible. Une fois que la mire est prête et fermée, bien l’agiter afin de mélanger le tout pour ne pas avoir d’accumulation dans un endroit de la mire, par exemple dans un bouchon ou au fond de la mire.
Pour cette partie, les sphères amovibles (section 2.1.2) n’ont pas été insérées dans la mire. Pour stabiliser la mire et pour permettre un recalage plus précis des images TEM et TDM, un support a été utilisé afin d’éviter les mouvements de la mire lors du déplacement de la table de l’appareil.
La figure 2.7représente le spectre d’énergie du99mTc pour une acquisition de mire uniforme.
Les fenêtres d’énergies choisies sont regroupées dans le tableau 2.4. La fenêtre A est la fenêtre principale et correspond au pic photoélectrique où les rayons γ ont complètement été absorbés dans le cristal. Les fenêtres B et C correspondent aux seuils d’énergie utilisés pour la correction de diffusion par TEW (section 1.2.5). Enfin, les événements comptabilisés dans les fenêtres D, E et F correspondent à du rayonnement diffusé.
Figure 2.7 – Spectre d’énergie des photons incidents lors de l’acquisition TEM d’une mire cylindrique uniforme remplie d’eau et de 99mTc.
Tableau 2.4 – Six fenêtres d’énergie utilisées pour les acquisitions au 99mTc.
Fênetre Nom Énergie Limite Limite Largeur
(keV) inférieure (keV) supérieure (keV) (%)
A Pic photoélectrique 140 126 156 20
B Fenêtre TEW basse 112 126 10
C Fenêtre TEW haute 156 170 10
D Diffusé générale 336 170 504 100
E Diffusé générale 75 37 112 100
F Diffusé générale 36 35 37 6
Comme objet non atténuant utilisé dans cette étude, nous avons choisi un capillaire de 1 mm de diamètre et de 10 cm de long contenant 3 mL de99mTc (figure2.8). Celui-ci a directement été
posé au centre de la table à égale distance entre les deux caméras. Quinze acquisitions d’activité décroissante de 99mTc, allant de 1 GBq à 33 MBq, ont été effectuées avec le capillaire.
Celles-ci ont été effectuées tout au long de la décroissance du 99mTc sur une durée de 30 heures,
soit plus de 5 demi-vies de 99mTc. Comme avec les acquisitions de la mire cylindrique, le
collimateur LEHR a été utilisé, le mouvement des caméras autour de l’objet était circulaire et les images ont été enregistrées en mode "arrêt image" (step and shoot) sur 96 projections. Afin
de compenser pour la décroissance du99mTc, le temps d’acquisition a été varié de 0,25 seconde
à 4 secondes par projection pour l’objet de plus forte à plus faible activité.
Figure 2.8 – Illustration du capillaire utilisé pour simuler un milieu sans atténuation.
Les paramètres d’acquisitions TEM/TDM sont regroupés dans les tableaux2.1et2.2. Puisque l’appareil utilisé agit comme un système paralysable (section1.2.4), le temps mort a été calculé à l’aide de l’équation 2.3 [42,75] reliant les événements observés et les événements réels lors d’une acquisition TEM.
Ro= Rte−Rtτ (2.3)
Le paramètre Ro correspond au taux de comptage des événements observés sur tout le spectre,
Rtau taux de comptage des événements réels sur tout le spectre et τ à la constante de temps
mort de l’appareil.
La sensibilité S de l’appareil a été calculée à l’aide d’une régression non linéaire de la fonction Ro = f (X) à partir de l’équation 2.4 [47]. Le logiciel Prism (GraphPad Software Inc.,
États-Unis) a été utilisé pour cette présente étude.
Ro = SXe−SXτ (2.4)
X = A × Ro
Rso (2.5)
La variable Rso correspond au taux de comptage observé sur les données reconstruites. Le
paramètre A correspond à l’activité calibrée. Effet de volume partiel
L’effet de volume partiel est étudié à l’aide de 6 sphères creuses remplies de99mTc à 2,8 MBq/cc
(sphères chaudes : avec un produit radioactif) et placées dans la mire Jaszczak (figure 2.9). Trois acquisitions TEM/TDM sont effectuées avec la mire remplie d’air, d’eau puis d’eau et de 99mTc à faible activité (0,06 MBq/cc). Les images sont analysées directement avec la
2 1 3 4 6 5
Figure 2.9 – Position des sphères chaudes dans la mire Jaszczak en fonction de leurs diamètres (1 : 31,8 mm ; 2 : 25,4 mm ; 3 : 19,1 mm ; 4 : 15,8 mm ; 5 : 12,7 mm ; 6 : 9,9 mm).
Le coefficient de recouvrement est la valeur permettant d’évaluer l’effet de volume partiel et celui-ci est calculé pour chaque sphère à l’aide de l’équation 2.6.
CR = AM(t) AT(t)
. (2.6)
Les paramètres AM et AT correspondent respectivement à l’activité mesurée et à l’activité
injectée dans une sphère. L’activité mesurée est calculée à l’aide de l’équation 2.7. AM =
Csph
S (2.7)
Les variables Csphet S correspondent respectivement au nombre de comptes mesurés dans une
sphère et à la sensibilité obtenue à la section 2.4.1. L’activité injectée correspond à l’activité calibrée et corrigée pour sa décroissance au moment de l’acquisition. Le nombre de comptes des différentes sphères est obtenu en traçant des volumes d’intérêt (VOI) à partir du logiciel d’image Syngo MI, directement intégré à l’appareil. Ceux-ci sont tracés manuellement en se basant sur les contours observés sur les images TDM, comme l’illustre la figure2.10.
(a) Image TDM (b) Image TEM
Figure 2.10 – Illustration des images reconstruites de la mire sans activité avec la partie TDM seulement (a) et la partie TEM seulement (b).


![Figure 1.15 – Coupes du fantôme imagé avec Symbia T6. Les images ont été reconstruites avec Siemens Flash3D [48]](https://thumb-eu.123doks.com/thumbv2/123doknet/6603812.179444/34.918.214.657.318.542/figure-coupes-fantôme-imagé-symbia-images-reconstruites-siemens.webp)
