N° d’ordre : 2940
THESE DE DOCTORAT
Présentée par
Hassan EZ-ZAKI
VALORISATION DE SOUS PRODUITS MARINS DANS
L’ELABORATION DE MORTIERS COMPOSITES A
BASE DE SEDIMENTS ET POUDRES DE
COQUILLAGE
Discipline : Chimie
Spécialité : Chimie du solide
Soutenue le : 21/12/2016 Devant le Jury
Président :
Jilali ARIDE Professeur, Ecole Normale Supérieure, Université Mohammed V,
Rabat
Examinateurs :
Ali BOUKHARI Professeur, Faculté des Sciences, Université Mohammed V, Rabat Mohammed ZRIOUIL Professeur, Faculté des Sciences, Université Mohammed V, Rabat Omar SASSI Professeur, Ecole Normale Supérieure, Université Mohammed V,
Rabat
M’Hamed TAIBI Professeur, Ecole Normale Supérieure, Université Mohammed V,
Rabat
Mohamed CHERKAOUI Professeur, Faculté des Sciences, Université Ibn Tofail, Kenitra Abdeljebbar DIOURI Professeur, Faculté des Sciences, Université Mohammed V, Rabat Siham KAMALI-BERNARD Maitre de conférences, Institut National des Sciences
appliquées, Rennes
UNIVERSITÉ MOHAMMED V
FACULTÉ DES SCIENCES
Rabat
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel: +212 (0) 5 37 77 18 34/35/38, Fax: +212 (0) 5 37 77 42 61, http://www.fsr.ac.ma
Avant propos
Les travaux, dont les résultats sont rassemblés dans ce mémoire, ont été réalisés dans le cadre de l’action intégré Projet HC N° MA/10/236, entre le Laboratoire de Chimie du Solide Appliquée (LCSA) au Département des Sciences de la Chimie à la Faculté des Sciences de Rabat et le Laboratoire de Génie Civil et Génie Mécanique (LGCGM) à l’Institut National des Sciences Appliquées (INSA) de Rennes, sous la codirection des Professeurs Abdeljebbar DIOURI de la faculté des sciences de Rabat et Siham KAMALI-BERNARD de l’INSA de Rennes. Des travaux de microcalorimétrie ont été également réalisés au Laboratoire de Physico-Chimie des Matériaux (LPCM) à l’Ecole Normale Supérieure (ENS) de Takaddoum-Rabat.
Toute ma reconnaissance et mes remerciements s’adressent, tout d’abord à mon Directeur de thèse Mr. Abdeljebbar DIOURI, Professeur à la Faculté des Sciences de Rabat, qui a dirigé mes recherches. Il a toujours porté de l’intérêt à mon travail et a suivi la progression de mes recherches. Il n’a pas cessé de me prodiguer conseils, critiques et jugements indispensables à la progression du mémoire de thèse. Que ce travail soit le témoignage sincère et affectueux de ma profonde gratitude pour ses conseils précieux, sa disponibilité et ses encouragements constants.
De même, Je tiens à remercier Mme. Siham KAMALI-BERNARD, Maître de conférences à l’INSA de Rennes, qui ma bien accueilli et de m’avoir accompagné tout au long de mon séjour au laboratoire le LGCGM. En plus des formations sur les techniques expérimentales, elle a su me faire profiter de ses connaissances et me transmettre la capacité de surmonter les difficultés dans la recherche. Qu’elle trouve ici le témoignage de mon profond respect et ma vive gratitude.
Je présente à Mr. Jilali ARIDE, Professeur de l’enseignement supérieur à l’Ecole Normale Supérieure (ENS) Université Mohammed V Rabat, mes remerciements respectueux de m’avoir honoré en acceptant la présidence du Jury de ma thèse.
Il m’est très agréable d’exprimer une affectueuse et profonde gratitude à Mr. Ali BOUKHARI, Professeur de l’enseignement supérieur à la Faculté des Sciences Université Mohammed V Rabat, pour l’honneur qu’il m’a fait en acceptant d’être rapporteur et membre du Jury.
Je présente ma profonde gratitude à Mr. Omar SASSI, Professeur à l’ENS de Rabat, qui m’a bien accueilli dans son Laboratoire (LPCM). Je lui exprime mes vifs remerciements pour ses précieux conseils, ses critiques instructives et son aide et de m’avoir honoré en acceptant de faire partie du Jury.
Je remercie également Mr. M’Hamed TAIBI, Professeur à l’ENS de Rabat, pour ses conseils, ses encouragements et pour la disponibilité qu’il a toujours montrée à mon égard. De plus, je lui suis très reconnaissant d’avoir accepté de juger ce travail.
Mes remerciements vont également à Mr. Mohammed ZRIOUIL, Professeur de l’enseignement supérieur à la Faculté des Sciences Université Mohammed V Rabat, pour m’avoir fait l’honneur d’être membre du Jury.
Mr. Mohamed CHERKAOUI, Professeur de l’enseignement supérieur à la Faculté des Sciences Université Ibn Tofail Kenitra, a accepté de rapporter et de juger ce travail, je lui exprime ma sincère reconnaissance.
J’adresse mes remerciements les plus respectueux aux professeurs et aux doctorants du Laboratoire de Chimie du Solide appliquée à la Faculté des Sciences de Rabat.
Mes remerciements sont adressés également à Mr. Jean-Yves BROSSAUT, technicien à la section chimie, aux professeurs et aux doctorants du Laboratoire de Génie Civil et Génie Mécanique à l’INSA de Rennes.
En fin, j’adresse mes remerciements à tous ce qui ont participé de près et de loin, à la réalisation de ce travail.
Résumé
La sédimentation au fond des cours d’eau et des ports pose un problème économique et environnemental. En effet, les sédiments peuvent être faiblement ou fortement pollués. Des réglementations de plus en plus strictes à la protection de l’environnement poussent les gestionnaires à trouver des solutions alternatives aux méthodes conventionnelles de mise en dépôt ou d’immersion des sédiments dragués. Les travaux menés dans le cadre de cette thèse portent principalement sur la possibilité de valorisation des sédiments marins en tant que matériau de construction en combinaison avec la poudre de coquille d’huitre afin de formuler des nouveaux ciments composites pouvant être exploités industriellement. Après identification des caractéristiques physico-chimiques des sous-produits bruts, un traitement thermique a été réalisé afin d’éliminer la matière organique et activer les minéraux argileux. Les sous-produits traités ont été ensuite mélangés de sorte à obtenir une composition proche à celle du ciment portland. Ces nouveaux liants ont été remplacés selon des proportions de 8, 16 et 33% en masse dans le ciment CEM I 52,5. Tenant compte des caractéristiques hydrauliques, physiques et mécaniques, la durabilité des nouveaux liants sous l’action de la carbonatation et la diffusion des chlorures ont été également étudiées. Selon la norme EN 197-1, les nouveaux liants pourraient utilisés jusqu’à 16% pour obtenir une classe 52,5 et jusqu’à 33% pour obtenir une classe 42,5. L’introduction des nouveaux liants influence la microstructure de la matrice cimentaire et contribue à l’amélioration des propriétés de transport. Cependant, l’utilisation de ces liants nécessite un temps de cure plus long pour développer au mieux leurs propriétés hydrauliques, mécaniques et de transport.
Abstract
Sedimentation at the bottom of rivers and ports exposes an economic and environmental problem. Strict regulations on environmental protection lead managers to find alternative solutions to conventional methods of stockpiling or immersion of dredged sediments. The work in this thesis focus on the use of combined marine sediments and oyster shell as construction material to make new composite cements that can be used industrially. After identification of the physicochemical characteristics, the raw materials are treated at high temperature to remove all organic compounds and activate clay minerals. The treated materials were then mixed in order to obtain a composition close to that of Portland cement. New blends are selected to replace 8, 16 and 33% by weight of Portland cement CEM I 52.5. Bearing in mind the hydraulic, physical and mechanical characteristics, the durability of new binders under the influence of carbonation and chloride diffusion was also investigated. According to the EN 197-1 standard, new binders could be used up to 16% for 52.5 Class cement and 33% for 42.5 Class cement. The addition of new binders influences on the microstructure of the cement matrix and contributes to improve the transport properties. However, the use of these binders requires a longer curing time for the best hydraulic, mechanical and transport properties.
Sommaire
Avant propos Résumé Abstract Résumé ... 4 Abstract ... 5 Introduction générale ... 17Chapitre I: Revue bibliographique ... 19
I.1 Problématique des sédiments ... 20
I.1.1 Origine et nature des sédiments ... 20
I.1.2 Contamination des sédiments ... 22
I.1.3 Réglementation relative aux sédiments dragués ... 22
I.1.4 Généralités sur les filières de traitement des sédiments ... 25
I.1.4.1 Prétraitement des sédiments ... 25
I.2.4.2 Traitement des sédiments ... 25
I.1.5 Valorisation des sédiments dans le Génie Civil ... 26
I.1.5.1 Valorisation dans le secteur de la briqueterie ... 26
I.1.5.2 Utilisation dans la construction des routes ... 27
I.1.5.3 Utilisation pour la fabrication du clinker ... 27
I.1.5.4 Utilisation dans le mortier ... 29
I.2 Hydratation des ciments Portland ... 29
I.2.1 Le ciment Portland ... 29
I.2.2 Hydratation du ciment Portland ... 30
I.2.3 Facteurs influençant l’hydratation ... 34
I.2.4 Caractéristiques hydrauliques et mécaniques des mortiers ... 39
I.3 Les poudres de coquillage dans les matériaux de construction ... 40
I.4 Durabilité de la matrice cimentaire ... 41
I.4.1 Etude de la carbonatation ... 41
I.4.1.1 Mécanismes réactionnels de la carbonatation des matériaux cimentaires ... 42
I.4.1.2 Conséquences de la carbonatation sur les matériaux cimentaires ... 44
I.4.2 Diffusion des chlorures dans les matériaux cimentaires ... 46
I.5 Conclusion ... 47
Chapitre II : Techniques expérimentales ... 49
II.1.1 Analyse par fluorescence X et diffraction des rayons X ... 50
II.1.2 Teneur résiduelle en chlorure ... 50
II.1.3 Granulométrie laser ... 51
II.1.4 Microscope Electronique à Balayage ... 52
II.1.5 Calorimétrie isotherme ... 54
II.2 Caractérisation physique, mécanique et de durabilité ... 56
II.2.1 Masse volumique apparente et porosité accessible à l’eau ... 56
II.2.2 Mesure de la perméabilité au gaz ... 57
II.2.3 Mesure de la résistance à la compression ... 60
II.2.4 Carbonatation accélérée ... 61
Chapitre III : Caractérisation physico-chimique des sédiments et des poudres de coquillage ... 62
III.1 Origine des matériaux étudiés ... 63
III.2. Caractérisation des matériaux bruts ... 63
III.2.1 Caractérisation physique ... 64
III.2.1.1 Observation au MEB ... 64
III.2.1.2 Teneur en eau ... 65
III.2.1.3 Distribution granulométrique ... 65
III.2.2 Caractérisation chimique et minéralogique ... 68
III.2.2.1 Teneur résiduelle en chlorure libre ... 68
III.2.2.2 Contamination des sédiments ... 68
III.2.2.3 Composition chimique... 68
III.2.2.4 Caractérisation minéralogique ... 69
III.3. Caractérisation des matériaux traités ... 70
III.3.1 Opérations de traitement ... 70
III.3.1.1 Lavage des sédiments marins ... 70
III.3.1.2 Traitement par voie thermique ... 71
III.3.2 Caractérisation physique ... 72
III.3.2.1 Perte de masse ... 72
III.3.2.2 Observation macroscopique ... 72
III.3.2.3 Observation microscopique ... 73
III.3.2.4 Distribution granulométrique ... 73
III.3.3 Caractérisation minéralogique par DRX ... 74
III.4 Conclusion ... 77
IV.1 Introduction ... 80
IV.2 Elaboration des ciments composites à base des sédiments et poudres de coquillage ... 80
IV.2.1 Composition chimique des matériaux de départ ... 81
IV.2.2 Composition et nomenclature des divers mélanges ... 81
IV.3 Caractérisation des pâtes cimentaires ... 83
IV.3.1 Formulation des pâtes... 83
IV.3.2 Calorimétrie isotherme des pâtes ... 83
IV.3.2.1 Pâtes à base de la poudre OS et un seul sédiment ... 84
IV.3.2.2 Pâtes à base de la poudre OS et deux sédiments ... 86
IV.3.2.3 Effet du sédiment sur la réactivité hydraulique du liant ... 88
IV.4 Caractérisation des mortiers normalisés ... 92
IV.4.1 Formulation des mortiers... 92
IV.4.1.1 Composition ... 92
IV.4.1.2 Gâchage ... 92
IV.4.1.3 Cure ... 94
IV.4.2 Résistance à la compression des éprouvettes prismatiques ... 95
IV.4.3 Masse volumique apparente et porosité accessible à l’eau ... 97
IV.4.4 Perméabilité apparente au gaz ... 98
IV.5 Conclusion ... 100
Chapitre V : Etude de la durabilité des ciments composites élaborés ... 101
V.1 Introduction ... 102
V.1.1 Durabilité des bétons ... 102
V.1.2 Structure de la pâte cimentaire ... 102
V.1.3 Microstructure de la matrice cimentaire ... 104
V.2 Microstructure des pâtes composites élaborés ... 105
V.2.1 Observation et analyse des mélanges OL650 ... 106
V.2.2 Observation et analyse des mélanges OM650 ... 109
V.2.3 Observation et analyse des mélanges OLM650 ... 112
V.2.4 Observation et analyse des mélanges OLM850 ... 116
V.2.5 conclusion ... 122
V.3 Etude de la carbonatation accélérée ... 123
V.3.1 Mode opératoire ... 123
V.3.2 Résultats et discussion ... 124
V.4 Essais de diffusion des chlorures ... 129
V.4.1 Objectif de l’étude ... 129
V.4.2 Pâtes de ciment à base des sous-produits traités ... 129
V.4.3 Mortiers cylindriques ... 130
V.4.4 Résultats et discussion ... 131
V.4.4.1 Profondeur de la pénétration ... 131
V.4.4.2 Profil de la concentration des chlorures ... 134
V.4.5 Conclusion ... 140
Conclusion générale ... 141
Références bibliographiques ... 145
Annexe 1 : Etalonnage du microcalorimètre ... 156
Annexe 2 : Calcul de la perméabilité apparente ... 157
Annexe 3 : Calcul de Bogue ... 159
Annexe 4: Analyses semi-quantitatives des éléments ... 160
11
Liste des figures
Figure I.1. 1 : Degré de décontamination en fonction de la granulométrie du matériau [2] ... 20
Figure I.1. 2 : Mesure de la chaleur d’hydratation des ciments [18] ... 28
Figure I.1. 3 : Résistance à la compression des ciments [18] ... 28
Figure I.2. 1 : Présentation schématique de l’hydratation du C3S [26] ... 32
Figure I.2. 2 : Présentation schématique de l’hydratation du C3A avec le gypse [26] ... 33
Figure I.2. 3 : Hydratation des phases de clinker dans une pâte de ciment de type I [28] ... 34
Figure I.2. 4 : Suivi de la température de l’hydratation d’un béton à base de différents types de ciment [29] ... 35
Figure I.2. 5 : Taux d’hydratation affecté par la finesse du ciment [29] ... 36
Figure I.2. 6 : Effet du rapport E/C sur l’évolution de la chaleur [32] ... 37
Figure I.2. 7 : Effet de la température de durcissement sur hydratation [35] ... 38
Figure I.4. 1 : Diagramme de prédominance des espèces carbonatées en fonction du pH [63] ... 42
Figure I.4. 2 : Mécanisme de carbonatation de Ca(OH)2 ... 43
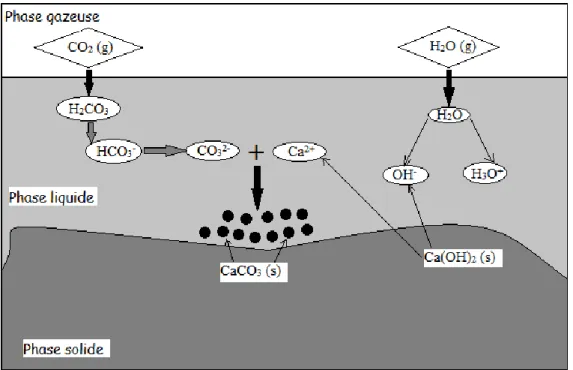
Figure I.4. 3 : Mécanisme réactionnel de carbonatation des C-S-H selon Dunster [64] ... 44
Figure I.4. 4 : Schéma du modèle de la double couche de Stern [86] ... 47
Figure II.1. 1 : Diagramme ternaire de la classification des sédiments en fonction de leur texture [91] ... 52
Figure II.1. 2 : Radiations émises lors de l’interaction entre le faisceau d’électrons et l’échantillon ... 53
Figure II.1. 3 : Coupe verticale du microcalorimètre ... 55
Figure II.2. 1 : Différents paramètres influençant la perméabilité [95] ... 57
Figure II.2. 2 : (a) schématisation de la cellule de la perméabilité [96], (b) Présentation de l’effet du gaz de confinement sur l’échantillon à travers la membrane [95] ... 58
Figure II.2. 3 : Stabilisation de l’écoulement de gaz dans un béton [99] ... 60
Figure III.2. 1 : Granulométrie du sédiment L ... 66
Figure III.2. 2 : Granulométrie du sédiment M ... 66
Figure III.2. 3 : Granulométrie de la poudre OS (Mo : matières organiques) ... 67
Figure III.2. 4 : Diffractogramme du sédiment L ... 69
Figure III.2. 5 : Diffractogramme du sédiment M ... 70
Figure III.2. 6 : Diffractogramme de la poudre OS ... 70
Figure III.3. 1 : Granulométrie des sous-produits traités ... 74
Figure III.3. 2 : Diffractogrammes du sédiment L traité ... 75
Figure III.3. 3 : Diffractogrammes du sédiment M traité ... 76
Figure III.3. 4 : Diffractogrammes de la poudre OS traité ... 77
Figure IV.3. 1 : Courbes isothermes du liant à base de mélange OL650 ... 84
Figure IV.3. 2 : Courbes isothermes du liant à base de mélange OM650 ... 84
Figure IV.3. 3 : Courbes isothermes du liant à base de mélange OLM650 ... 86
12
Figure IV.3. 5 : Courbes isothermes du clinker Portland avec le sédiment L brut ... 89
Figure IV.3. 6 : Courbes isothermes du clinker Portland avec le sédiment L traité à 650°C ... 89
Figure IV.3. 7 : Courbes isothermes du ciment Portland avec le sédiment L brut ... 90
Figure IV.3. 8 : Courbes isothermes du ciment Portland avec le sédiment L traité à 650°C ... 90
Figure IV.4. 1 : Evolution de la résistance à la compression des éprouvettes en fonction de la teneur de l’ajout après 28 jours de cure dans l’eau ... 96
Figure IV.4. 2 : Evolution de la résistance en compression entre 2 et 28 jours de cure dans l’eau ... 97
Figure IV.4. 3 : L’accroissement relatif de la résistance en compression entre 2 et 28 jours de cure dans l’eau ... 97
Figure IV.4. 4 : Masse volumique apparente des éprouvettes après 28 jours de cure dans l’eau ... 98
Figure IV.4. 5 : Porosité accessible à l’eau des éprouvettes après 28 jours de cure dans l’eau ... 98
Figure IV.4. 6 : Perméabilité apparente des éprouvettes après 28 jours de cure dans l’eau ... 99
Figure V.1. 1 : Représentation schématique de la pâte de ciment hydratée [119] ... 103
Figure V.1. 2 : Echelle de la taille des solides et des pores dans la pâte de ciment hydraté [121] ... 104
Figure V.2. 1 : Spectres EDS de la pâte C8OL650 ... 107
Figure V.2. 2 : Spectres EDS de la pâte C16OL650 ... 108
Figure V.2. 3 : Spectres EDS de la pâte C33OL650 ... 109
Figure V.2. 4 : Spectres EDS de la pâte C8OM650 ... 110
Figure V.2. 5 : Spectres EDS de la pâte C16OM650 ... 111
Figure V.2. 6 : Spectres EDS de la pâte C33OM650 ... 112
Figure V.2. 7 : Spectres EDS de la pâte C8OLM650 ... 113
Figure V.2. 8 : Spectres EDS de la pâte C16OLM650 ... 115
Figure V.2. 9 : Spectres EDS de la pâte C33OLM650 ... 116
Figure V.2. 10 : Spectres EDS de la pâte C8OLM850 ... 117
Figure V.2. 11 : Spectres EDS de la pâte C16OLM850 ... 118
Figure V.2. 12 : Spectres EDS de la pâte C33OLM850 ... 120
Figure V.3. 1 : Evolution de la pénétration du CO2 à 7 jours et 30 jours ... 126
Figure V.3. 2 : Profondeur de pénétration du CO2 à 30 jours ... 127
Figure V.4. 1 : Immersion de l’éprouvette dans la solution de NaCl ... 130
Figure V.4. 2 : Illustration d’obtention des tranches en fonction de l’épaisseur pour le dosage des chlorures ... 131
Figure V.4. 3 : Profils de chlorures libres et totaux dans le cas du mortier ROL650 (à 260 jours) .... 135
Figure V.4. 4 : Profils de chlorures libres et totaux dans le cas du mortier ROM650 (à 260 jours) ... 135
Figure V.4. 5 : Profils de chlorures libres et totaux dans le cas du mortier ROLM650 (à 260 jours) . 136 Figure V.4. 6 : Profils de chlorures libres et totaux dans le cas du mortier ROLM850 (à 260 jours) . 136 Figure V.4. 7 : Profils de chlorures fixés dans le cas du mortier ROL650 (à 260 jours) ... 137
Figure V.4. 8 : Profils de chlorures fixés dans le cas du mortier ROM650 (à 260 jours) ... 138
Figure V.4. 9 : Profils de chlorures fixés dans le cas du mortier ROLM650 (à 260 jours) ... 138
13
Liste des tableaux
Tableau I.1. 1 : Classement granulométrique des sédiments ... 20
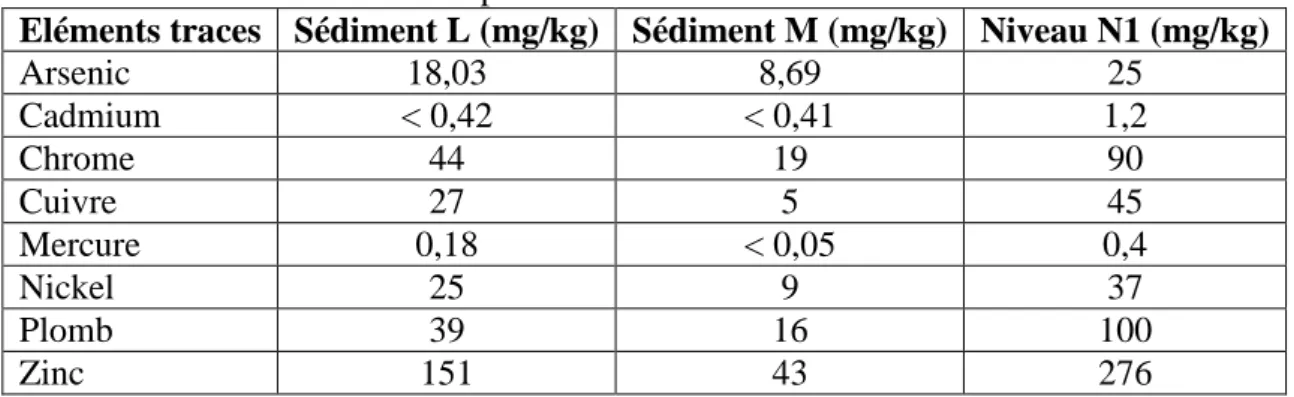
Tableau I.1. 2 : Niveau de référence pour les éléments traces (mg/kg sédiment sec sur la fraction < 2mm) ... 24
Tableau I.1. 3 : Niveau de référence pour les polychlorobiphényles (mg/kg sédiment sec sur la fraction < 2mm) ... 24
Tableau I.2. 1 : Composition minéralogique moyenne d’un clinker (% massique) [24] ... 30
Tableau III.2. 1 : Teneur en eau des sous produits bruts ... 65
Tableau III.2. 2 : Tableau récapitulatif de la distribution de taille des sédiments L et M ... 67
Tableau III.2. 3 : Teneur en chlorure libre dans les matériaux étudiés ... 68
Tableau III.2. 4 : Concentrations totales en éléments traces des sédiments L et M en comparaison avec le niveau N1... 68
Tableau III.2. 5 : Composition chimique des matériaux bruts ... 69
Tableau III.3. 1 : Teneur en chlorure libre des sédiments L et M avant et après le lavage ... 71
Tableau III.3. 2 : Perte de masse des sous-produits traités ... 72
Tableau III.3. 3 : Tableau récapitulatif de la distribution de taille des sous-produits traités ... 74
Tableau IV.2. 1 : Composition massique en éléments des matériaux de départ ... 81
Tableau IV.2. 2: Composition et nomenclature des mélanges des matériaux de départ ... 82
Tableau IV.2. 3 : Tableau récapitulatif des mélanges obtenus ... 82
Tableau IV.3. 1 : Composition des pâtes pour la calorimétrie isotherme... 83
Tableau IV.3. 2 : Récapitulatif des valeurs de chaleur calorifiques et temporelles de l’hydratation des échantillons avec un seul sédiment... 85
Tableau IV.3. 3 : Récapitulatif des valeurs de chaleur calorifiques et temporelles de l’hydratation des échantillons avec deux sédiments ... 88
Tableau IV.3. 4 : Caractéristiques chimiques du clinker Portland ... 89
Tableau IV.3. 5 : Récapitulatif des valeurs de chaleur calorifiques et temporelles de l’hydratation du clinker portland avec le sédiment L brut et traité à 650°C ... 90
Tableau IV.3. 6 : Récapitulatif des valeurs de chaleur calorifiques et temporelles de l’hydratation du ciment portland avec le sédiment L brut et traité à 650°C ... 91
Tableau IV.4. 1 : Composition des mortiers pour 3 éprouvettes cylindriques Ø4×h6 cm ... 93
Tableau IV.4. 2 : Composition des mortiers pour 3 éprouvettes prismatiques 4×4×16 cm ... 93
Tableau V.2. 1 : Rapport molaire des phases C-S-H présentes dans les échantillons étudiés ... 120
Tableau V.3. 1 : Résultats de la profondeur de carbonatation accélérée ... 127
Tableau V.4. 1 : Profondeur de pénétration des ions chlorures dans le cas des pâtes exposées à une température de 40°C ... 132
14
Tableau V.4. 2 : Profondeur de pénétration des ions chlorures dans le cas des mortiers émergés
pendant 260 jours ... 132 Tableau V.4. 3 : Coefficient de diffusion apparent des ions chlorures à 40°C... 133 Tableau V.4. 4 : Coefficient de diffusion apparent des ions chlorures après 260 jours d’immersion . 134
15
Liste des photos
Photo II.1. 1 : Appareil pour le dosage des chlorures libres ... 51
Photo II.1. 2 : Photo du dispositif JEOL JSM 6301F ... 52
Photo II.1. 3 : Microscope électronique à balayage couplé à une analyse dispersive en énergie (EDS) ... 54
Photo II.2. 1 : Le dispositif expérimental pour la détermination de la masse volumique et la porosité accessible à l’eau ... 56
Photo II.2. 2 : Débitmètre lié à la cellule de la perméabilité ... 59
Photo II.2. 3 : Dispositifs expérimentaux pour les essais (a) de flexion et (b) de compression ... 61
Photo III.2. 1 : (a) Morphologie des grains du sédiment L, (b) Agrandissement de la surface des boulettes [51] ... 64
Photo III.2. 2 : (a) Morphologie des grains du sédiment M, (b) Agrandissement de la surface des boulettes [51] ... 64
Photo III.2. 3 : (a) Morphologie des grains de la poudre OS, (b) Agrandissement de la surface des aiguilles ... 65
Photo III.3. 1 : Observation visuelle des sous-produits traités ... 72
Photo III.3. 2 : Morphologie des grains traités ... 73
Photo IV.4. 1 : Confection des éprouvettes dans (a) des moules cylindriques et (b) des moules prismatiques... 94
Photo IV.4. 2 : Conservation des éprouvettes dans un bac d’eau conditionnée à 20 ± 2 °C ... 94
Photo V.2. 1 : Observation au MEB de la pâte C8OL650... 106
Photo V.2. 2 : Observation au MEB de la pâte C16OL650... 108
Photo V.2. 3 : Observation au MEB de la pâte C33OL650... 109
Photo V.2. 4 : Observation au MEB de la pâte C8OM650 ... 110
Photo V.2. 5 : Observation au MEB de la pâte C16OM650 ... 111
Photo V.2. 6 : Observation au MEB de la pâte C33OM650 ... 112
Photo V.2. 7 : Observation au MEB de la pâte C8OLM650 ... 113
Photo V.2. 8 : Observation au MEB de la pâte C16OLM650 ... 114
Photo V.2. 9 : Observation au MEB de la pâte C33OLM650 ... 115
Photo V.2. 10 : Observation au MEB de la pâte C8OLM850 ... 116
Photo V.2. 11 : Observation au MEB de la pâte C16OLM850 ... 118
Photo V.2. 12 : Observation au MEB de la pâte C33OLM850 ... 119
Photo V.3. 1 : (a) Eprouvettes recouvertes de l’aluminium adhésif (b) Conservation des échantillons dans l’incubateur de carbonatation accélérée ... 123
Photo V.3. 2 : Révélation des zones saines et des zones carbonatées après pulvérisation de phénolphtaléine sur des échantillons avec 8 % de liants ... 124
Photo V.3. 3 : Révélation des zones saines et des zones carbonatées après pulvérisation de phénolphtaléine sur des échantillons avec 16 % de liants ... 125
16
Photo V.3. 4 : Révélation des zones saines et des zones carbonatées après pulvérisation de
phénolphtaléine sur des échantillons avec 33 % de liants ... 126 Photo V.4. 1 : Coupure des échantillons à l’aide d’une scie circulaire d’une épaisseur de 3 mm ... 131
17
Introduction
La croissance de la consommation du ciment continue à augmenter d’une manière exponentielle proportionnellement au développement mondial. En effet, la production d’une tonne de ciment nécessite environ 4200 kJ d’énergie à cause de la température élevée requise pour la fabrication et génère environ une tonne de CO2 ainsi que d’autres gaz responsables du
réchauffement climatique (SO2, NOx,..). Les études sur des matériaux naturels moins couteux
et respectueux de l’environnement sont devenues une préoccupation majeure pour surmonter les difficultés rencontrées au cours de la croissance urbaine et principalement liées à la production du ciment. Parmi les matériaux qui peuvent êtres utilisés dans le secteur du génie civil on trouve les matériaux sédimentaires. La sédimentation des matériaux issus de l’érosion des roches et des sols est un processus naturel ayant lieu dans les ports, les estuaires et les rivières. Ce phénomène génère un grand problème, aussi bien au niveau économique qu’au niveau environnemental. Les gestionnaires sont orientés vers les opérations de dragage afin d’assurer l’exploitation des infrastructures portuaires. Le volume énorme des sédiments dragués pose la question du devenir de leur gestion globale. L’élimination ou l’utilisation des sédiments pollués font l’objet de réglementations de plus en plus strictes. Toutefois, il existe à ce jour très peu de filières de traitement et de valorisation de ces matériaux contaminés. Les sédiments sont généralement des matériaux fins riches en minéraux et peuvent représenter une source de matières premières dans divers domaines en génie civil. La valorisation des sédiments porte sur leur application en techniques routières, en remblais ou en sous-couches de routes. Très peu de travaux porte sur leur valorisation dans les matériaux de construction. La valorisation des sédiments marins dans les matériaux de construction représente, par conséquent, un intérêt de point de vue économique et technique. Néanmoins, cette valorisation pose un certain nombre de problématiques liées à la composition chimique et minéralogique ainsi que les mécanismes d’interactions entre les phases minéraux, organiques et les polluants. Ces matériaux possèdent de fortes teneurs en chlorures, en sulfures et en matières organiques ce qui nuit à leur compatibilité physico-chimique avec les ciments.
Le travail de cette thèse s’inscrit dans le cadre de la thématique globale du laboratoire de Chimie du Solide Appliquée de la Faculté des Sciences de Rabat et du laboratoire de Génie Civil et Génie Mécanique de l’Institut National des Sciences Appliquées de Rennes, pour développer une nouvelle voie de valorisation des sédiments dragués en tant que matériau de construction.
Ce mémoire est structuré en cinq chapitres.
Le premier chapitre présente une étude bibliographique et traite la problématique de la sédimentation et les difficultés liées aux grandes quantités mises en jeu. Nous avons insisté sur la nature et les modes d’élimination actuels des sédiments. Un rappel des processus d’hydratation des ciments est aussi mentionné.
Le deuxième chapitre est consacré aux techniques mises en œuvre pour caractériser les matériaux de départ et la matrice cimentaire étudiée.
18
La caractérisation physico-chimique qui fait l’objet du troisième chapitre, permettera une détermination de la composition chimique des matériaux ainsi que leurs teneurs en polluants. L’analyse minéralogique a été réalisée en utilisant la diffraction des rayons X. La détermination de la teneur en eau, la granulométrie et la microscopie font partie de la caractérisation. Les sous-produits sont soumis à un traitement afin d’éliminer la forte teneur en chlorures et la matière organique qui empêchent la bonne hydratation du ciment. Cette partie du mémoire permet d’établir les identifications nécessaires afin de dresser le rôle des sous-produits sélectionnés pour l’application recherchée à savoir la fabrication des liants hydrauliques.
Dans le quatrième chapitre, les sous-produits traités sont mélangés de sorte à obtenir des proportions théoriquement similaires au ciment Portland. L’idée est innover des ciments composites à base des sous-produits étudiés afin de comparer leurs comportements avec un ciment ordinaire CEM I.
Enfin, le cinquième chapitre est consacré à l’étude de la durabilité de nouveaux ciments composites. Les essais de carbonatation et de diffusion des chlorures permettent de quantifier la durabilité du matériau dans un environnement agressif. Les essais de durabilité sont généralement très lents et demandent une longue durée, c’est pour cette raison que nous avons utilisé des essais accélérés.
19
20
I.1 Problématique des sédiments
I.1.1 Origine et nature des sédiments
Les sédiments sont définis comme des dépôts continentaux ou marins constitués de particules qui proviennent de l’érosion des roches et des sols qui sont transportés sous l’effet d’action climatiques (vent, marée) ou d’action humaines (travaux d’aménagements) et qui se déposent dans les ports, les estuaires, les rivières, les fleuves. La sédimentation dépend principalement de la force du courant et de l’environnement géologique. Elle est favorisée dans les zones où le courant est faible. Elle est moins développée lorsque le courant est fort. On distingue deux types de sédiments selon leurs origines [1] :
Les sédiments d’origine endogène qui proviennent du bassin de sédimentation comme
les débris de macrophytes (plantes aquatiques, microphytes, les fragments des cadavres d’animaux).
Les sédiments d’origine exogène sont issus du ruissellement des fleuves, des effluents
ou de l’atmosphère. Cet apport peut être d’origine naturelle (érosion de sols, décomposition de la matière végétales), ou anthropique (apports de matière en suspension, de matière organique, de nutriments ou micro-polluants qui provient des rejets agricoles, industriels et domestiques).
La répartition de taille des grains dépend de la condition topographique, les grosses particules se trouvent en amont tandis que les plus fines se présentent en aval. Le tableau (I.1.1) détaille le classement granulométrique des sédiments utilisé en géologie.
Tableau I.1. 1 : Classement granulométrique des sédiments
Taille Dénomination > 20 cm Blocs 2 cm à 20 cm Galets et cailloux 2 mm à 2 cm Graviers 63 µm à 2 mm Sables 2 µm à 63 µm Limons
< 2 µm Vases, boues argileuses
L’analyse granulométrique et la connaissance de la répartition des contaminants en fonction de la distribution granulométrique permettent de donner un aperçu sur le degré possible de la décontamination des sédiments. La figure (I.1.1) montre que dans le cas des contaminants inorganiques, la décontamination dépend de la granulométrie du matériau.
21
Selon Gosselin [2], la caractérisation des sédiments du port de Hambourg a démontré que la fraction grossière de ces sédiments comportait une contamination pratiquement nulle alors que la fraction fine (argile et limon) contenait presque la totalité de la contamination.
La composition minérale des sédiments est propre à son environnement et aux sources de leur provenance. Les blocs, les cailloux, les graviers et les sables sont des sédiments terrigènes c'est-à-dire issus de l’érosion des sols ; leur nature chimique dépend principalement des terrains érodés. Les sables sont essentiellement quartzeux (silice SiO2) ou silicatés (mica,
feldspath), souvent accompagnés de minéraux lourds (amphibles, grenats, disthène…) dont la nature dépend des formations érodées. On trouve également des sables calcaires. Enfin, les particules les plus fines, limons, boues et vases sont souvent composées de minéraux argileux d’origine terrigène, et aussi des squelettes d’organismes d’origine endogène [1].
La proportion de matière organique dans la matière sèche des sédiments varie entre 90% dans le cas de la tourbe, et 2% pour les sables de rivière. L’origine de cette matière organique est très diverse, il s’agit soit de débris végétaux, soit des micro-organismes, ou encore de colloïdes humiques. La composition de ces matières est généralement identique. En général, la proportion de matière organique est de l’ordre de 2 à 10% pour les sédiments des cours d’eau et elle est constituée à 60% de composés humiques [1]. Les substances humiques constituent une famille de macromolécules organiques d’origine naturelle qui proviennent de l’évolution des matières organiques fraiches sous des processus chimiques et enzymatiques. Elles peuvent constituer entre 85 et 90% de la fraction organique totale du sol [3]. Selon la solubilité en fonction du pH, on peut différencier trois fractions dans les substances humiques :
Les acides fulviques solubles dans les acides et les bases. Ils peuvent constituer jusqu’à 85% du carbone organique total [4].
L’humine insoluble dans les acides et les bases.
Les acides humiques insolubles dans les acides mais solubles en milieu alcalin.
Les substances humiques se regroupent avec les particules minérales des sédiments pour former des associations organo-minérales et modifient considérablement les caractéristiques géotechniques du sol.
La teneur en eau dans la vase représente une fraction importante généralement plus de 50 % de son volume [5]. En général, on peut distinguer quatre catégories [6] :
L’eau libre : n’est pas liée à la matrice solide. Elle peut circuler librement entre les particules. Elle s’élimine facilement par une simple décantation ou un séchage.
L’eau capillaire : c’est la quantité d’eau liée aux fines par des forces de capillarité qui créent entre les grains des forces d’attraction. Elle occupe les pores interconnectés très fins (quelques microns).
L’eau colloïdale : c’est la partie d’eau qui réagit avec les différents éléments présents dans le sol pour former des hydrates.
22
L’eau intercellulaire est liée chimiquement à la surface des particules et constitue un film autour d’elles. Elle n’est séparable de la matrice solide que par des moyens thermiques.
I.1.2 Contamination des sédiments
Selon G. Schneider [1], la contamination a commencé à la fin du vingtième siècle. Cette nuisance provient principalement des rejets industriels et urbains. En général, on peut les classer en trois groupes :
Les éléments nutritifs : Il s’agit essentiellement du phosphore et des composés azotés comme l’ammoniaque qui proviennent des effluents agricoles et industriels, des rejets d’eau usées urbains, ainsi que des émissions dues au brûlages des combustibles et aux véhicules automobiles.
Les métaux lourds : qui se retrouvent souvent à l’état de traces pouvant provenir en partie de l’altération de la roche mère du sous-sol. Cependant la plupart du temps leur origine est liée à l’activité humaine (stockage de déchets industriels et urbains, pratiques agricoles, des industries métallurgiques) [7]. Une fois dépassé un seuil de tolérance, les métaux sont considérés comme toxiques. Ils sont alors incompatibles avec les phénomènes vitaux et certains d’entre eux ont des propriétés cancérigènes et mutagènes. Les principaux métaux lourds sont le cadmium, le chrome, le cuivre, le plomb, le mercure, le nickel, le sélénium, l’arsenic et d’autres éléments spécifiques au passé industriels [1]. Ils peuvent être fixés sur les particules minérales et les matières organiques des sédiments et ils sont en général en équilibre avec l’eau interstitielle. Cependant, la moindre perturbation de l’environnement peut remobiliser ces métaux.
Les micro-polluants organiques : Ce sont des produits actifs organiques susceptibles d’avoir une action toxique à des concentrations infimes. Ils sont souvent solubles ou absorbés sur les matières en suspension et sont constitués dans la plupart des cas des HAP (hydrocarbures polycycliques aromatiques), PCB (poly-chloro-biphényls), solvants chlorés, pesticides.
I.1.3 Réglementation relative aux sédiments dragués
L’immersion des sédiments, qui est la solution traditionnelle et la plus répandue, est dirigée par textes de dispositions juridiques internationales. On peut citer la convention de Londres, la convention d’Oslo, la convention de Paris et la convention OSPAR.
Convention de Londres
La convention de Londres du 29 décembre 1972 est la plus connue lorsque l’on aborde le problème de la gestion des sédiments contaminés. Elle concerne la prévention de la pollution des mers résultant de l’immersion de déchets. Entrée en vigueur en 1975, elle a pour objectif d’engager le contrôle effectif de toutes les sources de pollution des mers. Elle décrit les procédures d’évaluation du caractère des opérations de dragage et d’immersion en pleine mer,
23
et propose des alternatives de stockage. Cependant, elle ne couvre pas les émissions de déchets à partir des sources côtières, de l’exploration et de l’exploitation des ressources minérales. Elle ne s’applique pas strictement lorsqu’il s’agit de sauvegarder des vies humaines ou de sécurité des navires.
Convention d’Oslo
Elle a été signée le 15 février 1972 et entrée en vigueur le 6 avril 1974. Elle avait constituée une étape importante de la prise en conscience du danger causé par la pollution des mers. Elle interdit, d’une part, l’immersion de plusieurs substances toxiques (mercure, cadmium, plastiques et des matériaux synthétiques persistants) et les substances possédant un effet cancérigène. D’autre part, elle identifie des substances (arsenic, plomb, cuivre, zinc, cyanure, fluorure, pesticide, conteneur, ferraille, goudron) dont l’immersion nécessite un permis accordé par une autorité compétente.
Convention de Paris
La convention de Paris du 4 juin 1974 concerne la prévention de la pollution due aux rejets des substances d’origines tellurique effectués sur le littoral, dans les fleuves ou à partir de plates-formes pétrolières ou gazières. Entrée en vigueur le 6 mai 1978, elle a pour objectif d’arrêter le rejet des substances telles que les composés organohalogénés, le mercure, le cadmium, les huiles et hydrocarbures persistants, et de limiter sévèrement le rejet des composés organiques du phosphore, le phosphore élémentaire, les huiles et hydrocarbures non persistants, l’arsenic, le chrome, le cuivre, le plomb, le zinc et les dérivés de ces éléments.
Convention OSPAR
Le 22 septembre 1992, les commissions d’Oslo et de Paris ont adopté en une convention appelée « OSPAR ». Entrée en vigueur le 25 mars 1998 pour la protection du milieu marin de l’Atlantique du Nord-est [8]. Son but est de prévenir et prendre des mesures pour la protection de la zone maritime contre les risques pour la santé de l’homme et contre la nuisance des ressources biologiques et aux écosystèmes marins.
La réglementation française en termes de gestion de l’immersion des sédiments dragués est définie selon l’arrêté du 14 juin 2000. Elle détermine le seuil de références N1 et N2 (dites seuil de GEODE : le Groupe d’Etude et d’Observation sur les Dragages et l’Environnement) pour les éléments traces et les PCBs (poly-chloro-biphényls) (Tableau I.1.2 et Tableau I.1.3).
24
Tableau I.1. 2 : Niveau de référence pour les éléments traces (mg/kg sédiment sec sur la fraction < 2mm)
Eléments traces Niveau N1 Niveau N2
Arsenic 25 50 Cadmium 1,2 2,4 Chrome 90 180 Cuivre 45 90 Mercure 0,4 0,8 Nickel 34 74 Plomb 100 200 Zinc 276 552
Tableau I.1. 3 : Niveau de référence pour les polychlorobiphényles (mg/kg sédiment sec sur la fraction < 2mm) PCB Niveau N1 Niveau N2 PCB totaux 0,50 1,00 PCB congénère 28 0,025 0,05 PCB congénère 52 0,025 0,05 PCB congénère 101 0,05 0,10 PCB congénère 118 0,025 0,05 PCB congénère 138 0,05 0,10 PCB congénère 153 0,05 0,10 PCB congénère 180 0,025 0,05
Si les teneurs des éléments en présence sont au-dessous du niveau N1, l’impact potentiel est en principe jugé comme neutre voire négligeable, les teneurs étant « normales » ou comparables au bruit de fond environnemental.
Si les teneurs sont comprises entre les niveaux N1 et N2, une investigation complémentaire peut s’avérer nécessaire en fonction du projet considéré et du degré de dépassement du niveau N1. Ainsi une mesure dépassant légèrement le niveau N1 sur seulement un ou quelques échantillons analysés, ne nécessite pas de complément sauf raison particulière (par exemple toxicité de l’élément considéré : Cd, Hg…). De façon général, l’investigation complémentaire doit être proportionnelle à l’importance de l’opération envisagée.
Si les teneurs sont au-delà du niveau N2, une investigation complémentaire est généralement nécessaire car des indices notables laissent présager un impact potentiel de l’opération ; de ce fait, une étude spécifique portant sur la sensibilité du milieu aux substances concernées, avec au moins un test d’écotoxicité globale du sédiment devra être menée avec une évaluation de l’impact prévisible sur le milieu.
En revanche, sur la base de ces critères, les sédiments sont classés selon leur niveau de toxicité et la méthode de traitement correspondante est choisie pour les immerger ou les valoriser dans divers secteurs. Nous nous intéresserons principalement aux valorisations des sédiments dans le secteur du Génie civil.
25
I.1.4 Généralités sur les filières de traitement des sédiments
Comme il est défini précédemment, les sédiments marins sont plus ou moins fins avec des teneurs en eaux éventuellement importantes. En général, la contamination est concentrée dans la fraction fine des sédiments. Ainsi, l’opération de prétraitement est une préoccupation qui permet de réduire le volume de sédiments à traiter.
I.1.4.1 Prétraitement des sédiments
La séparation des phases solide-liquide permet de réduire les volumes à traiter en éliminant jusqu’à 50% de l’eau interstitielle contenue dans les sédiments. Il existe plusieurs techniques tels que l’évaporation, la décantation par boudins géotextiles, la centrifugation et la filtration à presse ou à bande passante. Les techniques de tri granulométrique tel que le cyclonage, la coagulation/floculation, la séparation magnétique, la gravimétrie et la flottation permettent de séparer les sables des fines qui concentrent les métaux lourds via la capacité d’adsorption des sédiments.
I.2.4.2 Traitement des sédiments a) Traitements biologiques
Ils consistent à utiliser la capacité de certains micro-organismes à dégrader les substances organiques ou oxyder les sulfures métalliques. Il s’agit d’intégrer des bactéries ou des champignons dans la matrice à traiter, en considération des conditions du milieu (température, oxygène, pH, teneur en carbone), pour favoriser les procédés biologiques de biodégradation. L’activité bactérienne permet soit de minéraliser les substances organiques soit d’oxyder les sulfures métalliques en sulfates solubles et conduira par la suite à la mobilisation des métaux lourds dans la solution [9].
b) Traitements physico-chimique
Ce type de traitement s’appuie sur des interactions physico-chimiques entre une solution extractante et les polluants pour détruire, transformer ou immobiliser les polluants. Deux procédés sont valables pour extraire les polluants inorganiques soit l’extraction par lixiviation ou l’extraction par complexation.
L’extraction par lixiviation consiste à attaquer la phase porteuse des polluants par une solution lixiviante acide (HCl, H2SO4, HNO3) ou basique (Na2CO3, NaOH) qui induira la mise en
solution sous forme ionique des polluants. Après la séparation solide-liquide, la solution polluée subit généralement un traitement d’épuration par précipitation.
L’extraction par complexation consiste à introduire dans les sédiments contaminés, des agents chimiques ayant de fortes propriétés complexantes vis-à-vis des polluants inorganiques comme l’EDTA (acide éthylène diamine tétra-acétique), le NTA (acide nitrilotriacétique) et l’acétate d’ammonium.
26
Les polluants organiques peuvent être extraits par une mise en solution des sédiments via un solvant dans lequel les polluants sont solubles. Après extraction des contaminants organiques, les solvants pollués sont éliminés.
c) Procédé Novosol
Ce procédé de traitement se divise en trois étapes. La première étape, appelée phosphatation, consiste à ajouter 2 à 3.5% d’acide phosphorique (H3PO4) aux sédiments bruts. Cet ajout
produit un phénomène de moussage qui accélère le processus de séchage (environ 50%). Cette étape permet de piéger les métaux lourds par des apatites de phosphates qui sont cristallisés en présence du calcium contenu naturellement dans les sédiments. Après phosphatation, les sédiments sont séchés par stockage en bandes de séchage avec une homogénéisation régulière. Enfin, les sédiments phosphatés sont calcinés à une température T ≥ 650°C qui permet d’éliminer les matières organiques et de stabiliser les phosphates métalliques formés lors de la phosphatation. L’efficacité de ce traitement dépend des propriétés des apatites à fixer durablement les métaux lourds.
I.1.5 Valorisation des sédiments dans le Génie Civil
Depuis quelques années, l’utilisation des sédiments dans le Génie Civil est de plus en plus étudiée. La composition principale des sédiments (sable, argile et calcaire) permet d’avoir un potentiel de valorisation très variable conformément à leur pourcentage qui varie selon l’origine du sédiment. L’application est souvent envisagée dans des matériaux comme les briques, les routes, les granulats, le clinker et le béton. Cependant, la valorisation ne concerne généralement que les sédiments non contaminés.
I.1.5.1 Valorisation dans le secteur de la briqueterie
La fabrication des briques d’argile naturelle émet beaucoup d’oxyde de soufre dans le gaz d’échappement lors de la cuisson [10]. Harmer et al ont publié que les briques substituées par des sédiments marins n’ont aucun impact sur l’environnement en limitant la concentration de l’oxyde de soufre dans les gaz d’échappement. D’autres études ont montré que la fabrication des briques à base des sédiments marins est réalisable. La confection des briques avec 40% de sédiments présente des performances mécaniques analogues aux briques de référence [11]. Une étude est effectuée sur des briques totalement confectionnée à partir des sédiments avec différents taux d’humidité et d’autres avec un rapport de sédiment/argile naturelle égal à 1/1. Les propriétés mécaniques des briques à 100% de sédiment ont été trouvées conformes à la norme ASTM C 62 pour la construction des briques [12]. A une température de 1000°C, la cuisson des briques à 100% de sédiment dépasse la valeur minimale de la norme ASTM C62 [13]. Parmi les briques cuites à 950°C, seules les briques à 1/1 sédiment-argile naturelle et les briques à un faible taux d’humidité ont des résistances à la compression qui sont conformes à la norme de la fabrication des briques ASTM C62.
27
I.1.5.2 Utilisation dans la construction des routes
Les sédiments ont des caractéristiques qui peuvent encourager leurs utilisations en construction des routes. Des essais ont été réalisés pour déterminer le potentiel de l’utilisation. Les résultats montrent qu’il y a une amélioration des caractéristiques physiques et mécaniques avec utilisation des sédiments [14]. Le mélange du laitier avec les sédiments à montré une meilleure solution en terme d’exigence mécanique, environnemental et économique.
Kamali et al [15] ont examiné des matériaux à base des sédiments non-contaminés avec du sable dragué, sable naturel et du ciment Portland. Des mélanges sont réalisés avec le ciment de type CEM I et le ciment de type CEM II qui contient du laitier et du calcaire pour caractériser la résistance mécanique du matériau. Les résultats expérimentaux ont montré que les mélanges sont classés dans la limite des classes S2-S3 selon le guide d’application des normes pour le réseau routier national [16], qui est suffisante pour envisager leur utilisation. Conformément aux normes, les sédiments et les sables dragués peuvent être utilisés avec succès comme nouveaux matériaux pour la construction des fondations et des couches de base des routes. L’utilisation des sédiments avec 6% de ciment CEM II présente plusieurs avantages, parmi eux une bonne ouvrabilité et sont économiquement rentables.
I.1.5.3 Utilisation pour la fabrication du clinker
Du point de vue technique, il est possible de fabriquer du clinker à partir des sédiments en tenant compte de leur composition chimique. Ainsi on trouve dans la littérature des recherches qui ont montré expérimentalement la facilité de cette voie.
Au niveau du laboratoire, Dalton et al. [17] ont remplacé une partie (1.49, 6.63 et 12.3%) de la matière première par un sédiment contaminé pour fabriquer du clinker et le comparer avec un clinker Portland ordinaire. Les échantillons sont calcinés à 1450°C et refroidis puis broyés en poudre fine. L’analyse quantitative par diffraction des rayons X montre une composition plus riche en alite dans le clinker industriel que dans celui du laboratoire. Ceci est expliqué par le lent refroidissement observé au laboratoire qui permet à l’alite de se décomposer en bélite et CaO (entre 1250°C et 110°C).
Aouad et al. [18] ont examiné une formulation de clinker à base de sédiment fluvial pollué. L’analyse chimique du sédiment a montré un manque d’oxyde de calcium qui n’est pas suffisant pour la production du clinker. Pour corriger ce manque, ils ont ajouté 1.103 kg de CaCO3, 0.01 kg de Fe2O3 et 0.015 kg de Al2O3 à 0.391 kg du sédiment pollué pour produire 1
kg de clinker. Après calcination à 1450°C pendant 45 min, le mélange a été refroidi à 1350°C (15°C/min) et trempé à la température ambiante pour simuler le processus industriel et empêcher la décomposition de l’alite. Le gypse pure a été broyé (<60µm) avec le clinker pour produire le ciment à base de sédiments pollués. Des mesures de quantité de chaleur lors de l’hydratation du ciment synthétisé et le ciment Portland ordinaire sont effectués (figure I.1.2).
28
Figure I.1. 2 : Mesure de la chaleur d’hydratation des ciments [18]
Les taux de dégagement de chaleur sont similaires pour les deux types de ciment avec un décalage de cinq heures qui est peut-être causé par les différences de la finesse, sachant que la finesse Blaine est d’environ 13% plus élevé pour le ciment synthétisé.
Au jeune âge, les résultats ont montré que la résistance à la compression du ciment fabriqué à partir du sédiment pollué est équivalente à celle obtenue avec le ciment Portland ordinaire, et plus élevé (20% environ) à 56 jours (figure I.1.3). Ce résultat est expliqué par la forte réactivité des silicates dans le ciment fabriqué à partir des sédiments par rapport au ciment commercial.
29
I.1.5.4 Utilisation dans le mortier
Rosière et al. [19] ont étudié l’effet du remplacement des fillers calcaire et des agrégats par un sédiment traité. Les mortiers ont montré une activité significative du sédiment avec le ciment, cette activité est directement liée à la distribution de la taille des particules de sédiment. Un coefficient d’activité plus élevé est observé pour les poudres fines de sédiment. A l’échelle microscopique, il est confirmé que les sédiments ont un effet positif sur l’hydratation.
D’autres études ont été menées par Dang et al. [20] sur l’utilisation des sédiments traités thermiquement (650°C et 850°C) pour la conception de nouveaux ciments à base de sédiments marins. Ils ont substitué le ciment Portland CEM I par les sédiments traités avec différentes proportions (8%, 16% et 33%). Les résultats ont montré que le traitement thermique à 650°C est plus intéressant que celui à 850°C en termes d’économie, d’énergie et de performances mécaniques. La perméabilité au gaz des mortiers à base de sédiments calcinés augmente légèrement avec l’ajout du sédiment. Cependant, pour une teneur élevée (33% en masse) de sédiment calciné à 650°C, la perméabilité du mortier est inferieure à celle du mortier ordinaire. Cette diminution de la perméabilité est expliquée par la présence des pores moins connectés au sein du matériau bien que la porosité apparente est plus élevée. Il est observé aussi que les propriétés mécaniques diminuent avec le taux d’ajout du sédiment dans le mortier. Toutefois, le développement de la résistance à la compression des mortiers augmente avec le temps (entre 28 jours et 150 jours). Les résultats ont montré que tous les mortiers substitués par les sédiments calcinés présentent des valeurs de la résistance relative plus élevées que ceux du mortier ordinaire.
Par ailleurs, une étude expérimentale a été faite par Agostini et al. [21] montre sur des mortiers avec des sédiments traités comme substituant de sable (0, 33, 66 et 100% en volume). Deux conditions de durcissement sont utilisées. L’immersion dans l’eau qui est favorable à l’hydratation du ciment et le durcissement dans l’air. Quelle que soit les conditions de durcissement, la porosité augmente énormément avec la quantité de sédiment ajouté, tandis que la densité apparente diminue linéairement. Néanmoins, jusqu’à 33% de substitution, la résistance à la compression et la perméabilité apparente au gaz sont améliorés par rapport au mortier de référence. Des observations microscopiques montrent la formation d’une couche dense à l’interface des grains de sable/pâte de ciment et sédiment traité/pâte de ciment. Cette couche a une stœchiométrie complexe avec des atomes semblables à ceux du sédiment. Ainsi, des microfissures sont propagées à travers la pâte de ciment et le sédiment. Selon ces résultats, la couche inter-faciale plus dense a montré une grande résistance mécanique et une perméabilité inferieure.
I.2 Hydratation des ciments Portland
I.2.1 Le ciment Portland
Le ciment est un liant hydraulique constitué d’une poudre minérale fine qui forme avec l’eau une pâte durcissante dans le temps et présente des résistances aux chocs mécaniques et à l’action de l’eau. Le ciment le plus connu est le « ciment Portland ». Il existe plusieurs types
30
de ciment qui répondent à des applications bien spécifiques. Ils sont classés en fonction de leur composition ou en fonction de leur résistance mécanique [22]. En fonction de la nature des constituants, on trouve cinq grands types de ciment qui sont couramment employés. L’industrie cimentière indique le ciment par l’abréviation CEM et le type de ciment par un chiffre romain.
CEM I Ciment Portland (95 à 100% de clinker)
CEM II Ciment Portland composé (65 à 94% de clinker) CEM III Ciment de haut fourneau (5 à 64% de clinker) CEM IV Ciment pouzzolanique (45 à 89% de clinker)
CEM V Ciment aux laitiers et aux cendres (20 à 64% de clinker)
Le clinker, constitution principal du ciment Portland, est obtenu par mélange d’environ 75% du calcaire et 25% d’argile. Le mélange homogène, appelé « cru » ou « farine » dans l’industrie cimentaire, est cuit à 1450°C qui va subir un ensemble des réactions physico-chimiques appelées Clinkérisation. Le clinker obtenu est composé de quatre constituants majeurs (alite, bélite, célite et ferrite) ainsi que quelques espèces mineures telles que la chaux libre, MgO et des sulfates alcalins [23]. La teneur de ces phases minérales est présentée dans le tableau (I.2.1).
Tableau I.2. 1 : Composition minéralogique moyenne d’un clinker (% massique) [24]
Nom Formule Proportion
Alite – silicate tricalcique (C3S) (CaO)3.SiO2 50 à 70 %
Bélite – silicate bicalcique (C2S) (CaO)2.SiO2 15 à 30 %
Célite – aluminate tricalcique (C3A) (CaO)3.Al2O3 5 à 10 %
Ferrite – ferroaluminate tétracalcique (C4AF) (CaO)4Al2O3Fe2O3 5 à 15 %
Le clinker se présente sous forme des granules de 2 à 3 cm qui sont broyés avec le gypse CaSO4.2H2O (3 à 5%). Le gypse agit comme un régulateur de prise pour obtenir le ciment
Portland. L’industrie cimentière a introduit une nomenclature sténographique qui permet de simplifier l’écriture des formules et des équations chimiques de transformation. Les notations les plus fréquemment employées sont : C=CaO ; S=SiO2 ; A=Al2O3 ; F=Fe2O3 ; H=H2O ;
Š=SO3.
I.2.2 Hydratation du ciment Portland
Les quatre phases majoritaires du ciment sont divisées en deux familles : les silicates (C3S et
C2S) et les aluminates (C3A et C4AF). L’hydratation des constituants de la même famille
conduit à des produits identiques. Cependant, la différence de la cinétique de ces réactions conduit à l’évolution des propriétés mécaniques de la pâte de ciment à l’échelle macroscopique. Le mécanisme le plus pertinent est décrit par Le Chatelier [25]. Il s’agit d’un mécanisme de dissolution-précipitation : quand l’eau entre en contact avec le ciment, les constituants anhydres vont progressivement passer en solution jusqu’à la sursaturation. Ils vont causer la précipitation d’hydrates qui sont moins solubles que les réactifs anhydres. Pour cela, la concentration des espèces en solution va diminuer et donc permettre de nouveau le
31
passage en solution des constituants anhydres. Ce phénomène se répète ainsi jusqu’à l’hydratation totale.
a) Hydratation des silicates
Dès le gâchage, le C3S se dissout superficiellement en libérant des ions calcium Ca2+,
hydroxydes OH- et silicates H2SiO42- selon l’équation (I.2.1) :
2Ca3SiO5 + 6H2O → 6Ca2+ + 8OH- + 2H2SiO42- Eq (I.2.1)
La solution devient rapidement saturée par rapport au silicate de calcium hydraté C-S-H qui se précipite selon l’équation (I.2.2) :
3Ca2+ + 2OH- + 2H2SiO42- + 2H2O → Ca3H2Si2O7(OH)2 + 3H2O Eq (I.2.2)
Les C-S-H sont des composés non stœchiométriques, dont le rapport C/S est compris entre 1,5 et 1,8. Cette stœchiométrie dépend de la concentration des ions calcium et silicate et du pH de la solution. Elle évolue au cours du temps et varie en fonction de la température, du rapport eau/ciment (E/C), des conditions de cure, de la composition du ciment et de la quantité d’impuretés présentes dans les constituants anhydres.
Durant cette étape, la teneur en ions calcium atteint un maximum rapidement dont la précipitation du C-S-H continue lentement selon l’équation (I.2.3) [26]:
2Ca3SiO5 + 7H2O → Ca2H4Si2O7(OH)2 + 4Ca2+ +8OH- Eq (I.2.3)
Quand la concentration des ions Ca2+ et OH- devient critique (pH=12,8), la précipitation de la Potlandite (CH) commence à se produire selon l’équation (I.2.4) :
Ca2+ + 2OH- → Ca(OH)2 Eq (I.2.4)
On peut résumer le mécanisme de l’hydratation de C3S par l’équation (I.2.5) :
2(CaO)3.SiO2 + 6H2O → 3CaO.2SiO2.3H2O + 3Ca(OH)2 Eq (I.2.5)
2C3S + 6H → 3CSH + 3CH
L’évolution de ces équations d’hydratation s’accompagne par un dégagement de chaleur, la figure (I.2.1) présente le suivi de flux thermique et la concentration des ions calcium Ca2+ au cours du temps lors de l’hydratation de C3S.
32
Figure I.2. 1 : Présentation schématique de l’hydratation du C3S [26]
Les mécanismes d’hydratation de C2S sont relativement similaires à ceux détaillés
précédemment pour le C3S. Cependant, son hydratation est généralement plus lente et la
teneur en Portlandite est plus faible selon l’équation (I.2.6) :
2(CaO)2.SiO2 + 4H2O → 3CaO.2SiO2.3H2O + Ca(OH)2 Eq (I.2.6)
2C2S + 4H → 3CSH + CH
b) Hydratation des aluminates
L’aluminate tricalcique est une phase extrêmement réactive en présence de l’eau et présente une prise presque instantanée « fausse prise ». Les premiers hydrates formés sont généralement décrits comme C4AH19 ; C4AH13 ; C2AH8 [27] qui sont des hydrates
thermodynamiquement instables et évoluent en hydrates C3AH6 plus stables à une vitesse qui
dépend fortement de la température, du rapport E/C et de la taille des grains. L’hydratation du C3A est représentée par les équations bilans suivantes :
2C3A + 27H → C2AH8 + C4AH19 → 2C3AH6 + 15H Eq (I.2.7)
Ou 2C3A + 21H → C2AH8 + C4AH13 → 2C3AH6 + 9H Eq (I.2.8)
Ce comportement de prise n’est pas souhaitable dans le béton, une période d’ouvrabilité est nécessaire pour permettre au béton une mise en place convenable. Pour cette raison une source de sulfates de calcium CaSO4.2H2O est ajoutée au clinker afin de contrôler
l’hydratation des phases aluminates. Au contact de l’eau, une partie de gypse et le C3A sont
dissous en libérant des ions calcium Ca2+, aluminates AlO2-, hydroxydes OH- et sulfates SO4
2-selon l’équation (I.2.9) :
33
La solution est rapidement saturée par rapport aux hydrates d’où les ions se combinent en formant l’ettringite (AFt : trisulfoaluminate de calcium hydraté) jusqu’à l’épuisement du gypse.
6Ca2+ + 2AlO2- + 3SO42- + 4OH- + 30H2O → [Ca3Al(OH)6]2(SO)3.26H2O Eq (I.2.10)
Soit l’équation globale :
(CaO)3.Al2O3 + 3(CaSO4.2H2O) + 26H2O → (CaO)3.Al2O3.(CaSO4)3.32H2O Eq (I.2.11)
C3A + 3CŠH2 + 26H → C6AŠ3H32
La formation d’ettringite consomme trois moles de sulfate de calcium par mole de C3A. Or,
dans la majorité des cas, le C3A est en excès par rapport aux sulfates. La solution s’appauvrit
alors en ions sulfate et devient sous saturée par rapport à l’ettringite. Cette dernière va alors se dissoudre partiellement en libérant des ions sulfates pour former avec le C3A résiduel une
phase de type AFm, le monosulfoaluminate tétracalcique selon l’équation (I.2.12) :
4Ca2+ + 2AlO2- + SO42- + 4OH- + 19H2O → [Ca2Al(OH)6]2(SO4).15H2O Eq (I.2.12)
Soit l’équation globale:
2(CaO)3.Al2O3 + (CaO)3.Al2O3.(CaSO4)3.32H2O + 4H2O → 3(CaO)3.Al2O3.CaSO4.12H2O
2C3A + C6AŠ3H32 + 4H → 3C4AŠH12 Eq (I.2.13)
La figure (I.2.2) résume la chronologie de l’hydratation de C3A avec le gypse.
34
I.2.3 Facteurs influençant l’hydratation
Le taux et la quantité de la chaleur libérée lors de l’hydratation dépondent largement du type de ciment, la composition chimique et les propriétés physiques du ciment, le rapport eau/ciment et les matériaux cimentaires supplémentaires.
a) Composition chimique du ciment
La composition chimique du ciment influe beaucoup sur la cinétique de son hydratation car chaque composant réagit de façon différente et possède une cinétique distincte. L’ordre du taux d’hydratation des composants du clinker au cours des premiers jours est : C3A > C3S >
C4AF > C2S, comme le montre la figure (I.2.3).
Figure I.2. 3 : Hydratation des phases de clinker dans une pâte de ciment de type I [28]
b) Types de ciment
Les types de ciment Portland, classés selon leur composition chimique et leur finesse, ont également une influence sur la cinétique de l’hydratation comme le montre la figure (I.2.4) qui présente les taux de production de la chaleur pour différents types de ciment dans des conditions adiabatiques.
35
Figure I.2. 4 : Suivi de la température de l’hydratation d’un béton à base de différents types de ciment [29]
c) Quantité de sulfate
Une petite quantité de gypse est utilisée pour contrôler la réaction immédiate de C3A.
L’hydratation du ciment avec un excès ou manque de sulfate expose une fausse prise. Il est nécessaire de considérer une propre quantité de sulfate qui varie avec la composition et la finesse du ciment. Il est montré que l’augmentation de SO3 réduit la quantité de chaleur
libérée lors de l’hydratation immédiate du ciment à cause de la faible solubilité des aluminates dans une solution chaux-gypse [30].
d) La finesse du ciment
La surface spécifique des poudres de ciment à une grande influence sur l’hydratation. Plus la distribution des tailles de grains est fine, plus l’hydratation est rapide et la chaleur d’hydratation est importante [31]. L’hydratation s’effectue sur la surface des particules de ciment qui permet un contact avec l’eau. Une grande finesse exige la dissolution d’une large surface dont résulte une accélération de la réaction entre le ciment et l’eau. La figure (I.2.5) montre comment la finesse influe sur le taux d’hydratation d’un ciment. Une grande finesse augmente le taux de chaleur libérée à un âge précoce, mais ne peut pas influencer sur la quantité de chaleur totale développée après plusieurs semaines.
36
Figure I.2. 5 : Taux d’hydratation affecté par la finesse du ciment [29]
e) Rapport Eau/Ciment (E/C)
Pour un matériau à faible rapport E/C, les grains de ciments sont initialement très proches. L’influence de la quantité d’eau se traduit par un manque d’espace disponible entre les grains de ciment pour former les nouveaux hydrates. En revanche, si l’eau existe suffisamment dans le ciment, l’hydratation va progresser en continu et l’espace disponible dans la pâte sera complètement rempli.
![Figure I.2. 3 : Hydratation des phases de clinker dans une pâte de ciment de type I [28]](https://thumb-eu.123doks.com/thumbv2/123doknet/2194410.11832/34.892.141.749.392.794/figure-hydratation-phases-clinker-dans-pate-ciment-type.webp)
![Figure I.4. 1 : Diagramme de prédominance des espèces carbonatées en fonction du pH [63]](https://thumb-eu.123doks.com/thumbv2/123doknet/2194410.11832/42.892.153.752.680.1035/figure-diagramme-predominance-especes-carbonatees-fonction-ph.webp)
![Figure I.4. 3 : Mécanisme réactionnel de carbonatation des C-S-H selon Dunster [64] d) Carbonatation d’autres hydrates à bases d’aluminates](https://thumb-eu.123doks.com/thumbv2/123doknet/2194410.11832/44.892.154.737.262.569/figure-mecanisme-reactionnel-carbonatation-dunster-carbonatation-hydrates-aluminates.webp)
![Figure I.4. 4 : Schéma du modèle de la double couche de Stern [86]](https://thumb-eu.123doks.com/thumbv2/123doknet/2194410.11832/47.892.118.776.171.398/figure-i-schema-du-modele-double-couche-stern.webp)
![Figure II.1. 1 : Diagramme ternaire de la classification des sédiments en fonction de leur texture [91]](https://thumb-eu.123doks.com/thumbv2/123doknet/2194410.11832/52.892.225.665.103.479/figure-ii-diagramme-ternaire-classification-sediments-fonction-texture.webp)

![Figure II.2. 3 : Stabilisation de l’écoulement de gaz dans un béton [99]](https://thumb-eu.123doks.com/thumbv2/123doknet/2194410.11832/60.892.222.672.107.407/figure-ii-stabilisation-l-ecoulement-gaz-beton.webp)