UNIVERSITE MOHAMMED V DE RABAT FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 - 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION :
Doyen
Professeur Mohamed ADNAOUI
Vice-Doyen chargé des Affaires Académiques et estudiantines Professeur Brahim LEKEHAL
Vice-Doyen chargé de la Recherche et de la Coopération
Professeur Toufiq DAKKA
Vice-Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général
1 - ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS :
Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif Pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENSAID Younes Pathologie Chirurgicale
Janvier, Février et Décembre 1987
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AZZOUZI Abderrahim Anesthésie Réanimation- Doyen de FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale
Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZAD Rachid
Gynécologie Obstétrique Méd. Chef Maternité des
Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie- Dir. du Centre National PV Rabat
Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir. du CEDOC +
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid
Endocrinologie et Maladies Métaboliques Doyen de la
FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale – Directeur du CHIS-Rabat
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie Directeur Hôpital My Ismail Meknès
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie Obstétrique
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BAIDADA Abdelaziz Gynécologie Obstétrique
Pr. BARGACH Samir Gynécologie Obstétrique
Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation
Pr. EL MESNAOUI Abbes Chirurgie Générale
Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie Inspecteur du Service de Santé des FAR Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie
Pr. BOULANOUAR Abdelkrim Ophtalmologie
Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie DirecteurHôp.Mil. d’Instruction Med V Rabat Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TOUFIQ Jallal Psychiatrie Directeur Hôp.Ar-razi Salé
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. BENOMAR ALI Neurologie Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. BENKIRANE Majid* Hématologie
Janvier 2000
Pr. ABID Ahmed* Pneumo-phtisiologie
Pr. AIT OUAMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Directeur Hôp. My Youssef Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale
Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation
Pr. TACHINANTE Rajae Anesthésie-Réanimation
Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie - Directeur Hôp.Cheikh Zaid
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Pr.ZOHAIR ABDELLAH * ORL
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie - Directeur Hôp. d’EnfantsRabat
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique
Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique
Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie - Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique
Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie
Pr. BERNOUSSI Zakiya Anatomie Pathologique
Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL Fellous Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. KRIOUILE Yamina Pédiatrie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumo-phtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre * Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique
Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. EL HAMZAOUI Sakina * Microbiologie
Pr. HAJJI Leila Cardiologie(mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
Pr. ZERAIDI Najia Gynécologie Obstétrique
AVRIL 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire.
Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique
Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Décembre 2006
Pr SAIR Khalid Chirurgie générale Dir. Hôp.Av.Marrakech
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi * Chirurgie cardio vasculaire
Pr. AMHAJJI Larbi * Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed * Anesthésie réanimation Directeur ERSSM
Pr. BALOUCH Lhousaine * Biochimie-chimie
Pr. BENZIANE Hamid * Pharmacie clinique
Pr. BOUTIMZINE Nourdine Ophtalmologie
Pr. CHERKAOUI Naoual * Pharmacie galénique
Pr. EHIRCHIOU Abdelkader * Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire
Pr. EL ABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid * Radiothérapie
Pr. ICHOU Mohamed * Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar * Anesthésie réanimation
Pr. LOUZI Lhoussain * Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed * Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad * Virologie
Pr. OUZZIF Ez zohra * Biochimie-chimie
Pr. RABHI Monsef * Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine * Microbiologie
Pr. SIFAT Hassan * Radiothérapie
Pr. TABERKANET Mustafa * Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour * Traumatologie-orthopédie
Pr. TOUATI Zakia Cardiologie Décembre 2008
Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali * Médecine interne
Pr. AGADR Aomar * Pédiatrie
Pr. AIT ALI Abdelmounaim * Chirurgie Générale
Pr. AIT BENHADDOU El Hachmia Neurologie
Pr. AKHADDAR Ali * Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie Directeur Hôp.des Spécialités
Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae * Biochimie-chimie
Pr. BOUI Mohammed * Dermatologie
Pr. BOUNAIM Ahmed * Chirurgie Générale
Pr. BOUSSOUGA Mostapha * Traumatologie-orthopédie
Pr. CHTATA Hassan Toufik * Chirurgie Vasculaire Périphérique
Pr. DOGHMI Kamal * Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale
Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid * Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal * Chimie Thérapeutique
Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-Phtisiologie Octobre 2010
Pr. AMEZIANE Taoufiq* Médecine Interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine Aéronautique
Pr. DAMI Abdellah* Biochimie- Chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie Pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie Plastique et Réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro-Entérologie
Pr. LAMALMI Najat Anatomie Pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie Générale
Pr. NAZIH Mouna* Hématologie
Pr. ZOUAIDIA Fouad Anatomie Pathologique
Décembre 2010
Pr.ZNATI Kaoutar Anatomie Pathologique
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie pédiatrique
Pr. ABOUELALAA Khalil * Anesthésie Réanimation
Pr. BENCHEBBA Driss * Traumatologie-orthopédie
Pr. DRISSI Mohamed * Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale
Pr. EL KHATTABI Abdessadek * Médecine Interne
Pr. EL OUAZZANI Hanane * Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie Pathologique
Pr. MEHSSANI Jamal * Psychiatrie
Pr. RAISSOUNI Maha * Cardiologie
* Enseignants Militaires Février 2013
Pr.AHID Samir Pharmacologie
Pr.AIT EL CADI Mina Toxicologie
Pr.AMRANI HANCHI Laila Gastro-Entérologie
Pr.AMOR Mourad Anesthésie Réanimation
Pr.AWAB Almahdi Anesthésie Réanimation
Pr.BELAYACHI Jihane Réanimation Médicale
Pr.BENCHEKROUN Laila Biochimie-Chimie
Pr.BENKIRANE Souad Hématologie
Pr.BENNANA Ahmed* Informatique Pharmaceutique
Pr.BENSGHIR Mustapha * Anesthésie Réanimation
Pr.BENYAHIA Mohammed * Néphrologie
Pr.BOUATIA Mustapha Chimie Analytique et Bromatologie
Pr.BOUABID Ahmed Salim* Traumatologie orthopédie
Pr BOUTARBOUCH Mahjouba Anatomie
Pr.CHAIB Ali * Cardiologie
Pr.DENDANE Tarek Réanimation Médicale
Pr.DINI Nouzha * Pédiatrie
Pr.ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr.ECH-CHERIF EL KETTANI Najwa Radiologie
Pr.EL FATEMI NIZARE Neuro-chirurgie
Pr.EL GUERROUJ Hasnae Médecine Nucléaire
Pr.EL HARTI Jaouad Chimie Thérapeutique
Pr.EL JAOUDI Rachid * Toxicologie
Pr.EL KABABRI Maria Pédiatrie
Pr.EL KHANNOUSSI Basma Anatomie Pathologique
Pr.EL KHLOUFI Samir Anatomie
Pr.EL KORAICHI Alae Anesthésie Réanimation
Pr.EN-NOUALI Hassane * Radiologie
Pr.ERRGUIG Laila Physiologie
Pr.FIKRI Meryem Radiologie
Pr.GHFIR Imade Médecine Nucléaire
Pr.IMANE Zineb Pédiatrie
Pr.IRAQI Hind Endocrinologie et maladies métaboliques
Pr.KABBAJ Hakima Microbiologie
Pr.KADIRI Mohamed * Psychiatrie
Pr.MAAMAR Mouna Fatima Zahra Médecine Interne
Pr.MEDDAH Bouchra Pharmacologie
Pr.MELHAOUI Adyl Neuro-chirurgie
Pr.MRABTI Hind Oncologie Médicale
Pr.NEJJARI Rachid Pharmacognosie
Pr.OUBEJJA Houda Chirugie Pédiatrique
Pr.OUKABLI Mohamed * Anatomie Pathologique
Pr.RAHALI Younes Pharmacie Galénique
Pr.RATBI Ilham Génétique
Pr.RAHMANI Mounia Neurologie
Pr.REDA Karim * Ophtalmologie
Pr.REGRAGUI Wafa Neurologie
Pr.RKAIN Hanan Physiologie
PROFESSEURS AGREGES :
DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale
Pr. BEKKALI Hicham * Anesthésie-Réanimation
Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale
Pr. BOUABDELLAH Mounya Biochimie-Chimie
Pr.ROUAS Lamiaa Anatomie Pathologique
Pr.ROUIBAA Fedoua * Gastro-Entérologie
Pr SALIHOUN Mouna Gastro-Entérologie
Pr.SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr.SEDDIK Hassan * Gastro-Entérologie
Pr.ZERHOUNI Hicham Chirurgie Pédiatrique
Pr.ZINE Ali* Traumatologie Orthopédie
AVRIL 2013
Pr.EL KHATIB MOHAMED KARIM * Stomatologie et Chirurgie Maxillo-faciale MAI 2013
Pr.BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique
Pr.BENCHAKROUN Mohammed * Traumatologie- Orthopédie
Pr.BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
Pr. JANANE Abdellah * Urologie
Pr. JEAIDI Anass * Hématologie Biologique
Pr. KOUACH Jaouad* Génycologie-Obstétrique
Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie
Pr. OULAHYANE Rachid* Chirurgie Pédiatrique
Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SABRY Mohamed* Cardiologie
Pr. SEKKACH Youssef* Médecine Interne
Pr. TAZI MOUKHA Zakia Génécologie-Obstétrique
AVRIL 2014
Pr. BOUCHRIK Mourad* Parasitologie
Pr. DERRAJI Soufiane* Pharmacie Clinique
Pr. DOBLALI Taoufik* Microbiologie
Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation
Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique
Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI NEZHA Anesthésie-Réanimation
Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg.
AOUT 2015
Pr. MEZIANE Meryem Dermatologie
Pr. TAHRI Latifa Rhumatologie
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale
Pr. EL ASRI Fouad* Ophtalmologie
Pr. ERRAMI Noureddine* O.R.L
Pr. NITASSI Sophia O.R.L
JUIN 2017
Pr. ABI Rachid* Microbiologie
Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg.
Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale
Pr. OURAINI Saloua* O.R.L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg.
Pr. ZRARA Abdelhamid* Immunologie
2 - ENSEIGNANTS-CHERCHEURS SCIENTIFIQUES
PROFESSEURS/Prs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie-chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr .BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques
Pr. CHAHED OUAZZANI Lalla Chadia Biochimie-chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah
Je dédie cette thèse à
A Allah
Tout puissant
Qui m’a inspiré
Qui m’a guidé dans le bon chemin
Je vous dois ce que je suis devenue
Louanges et remerciements
Pour votre clémence et miséricorde
A ceux qui me sont les plus chers
A ceux qui ont toujours cru en moi
A ceux qui m’ont toujours encouragée
À
FEU SA MAJESTÉ LE ROI
HASSAN II
À
SA MAJESTÉ LE ROI
MOHAMED VI
Chef Suprême et Chef d’Etat-Major Général
des Forces Armées Royales
Roi du MAROC et garant de son intégrité territoriale
À
SON ALTESSE ROYALE
LE PRINCE HÉRITIER
MOULAY EL HASSAN
À
SON ALTESSE ROYALE
LE PRINCE MOULAY RACHID
À
A
Monsieur le Général de Corps d’Armée
Abdelfattah LOUARAK
Inspecteur Général des FAR et Commandant de la Zone Sud
En témoignage de notre grand respect
A
Monsieur le Médecin Général de Brigade
Abdelhamid HDA
Professeur de Cardiologie.
Inspecteur du Service de Santé des Forces Armées Royales.
En témoignage de notre grand respect,
Et notre profonde considération
A
Monsieur le Médecin Colonel Major
EL MEHDI ZBIR
Professeur de Cardiologie
Directeur de l’HMIMV ŔRabat.
En témoignage de notre grand respect
Et notre profonde considération
A
Monsieur le Médecin Colonel Major
Abdelouahed BAITE
Professeur d’Anesthésie Réanimation
Directeur de l’E.R.S.S.M
En témoignage de notre grand respect
Et notre profonde considération
.
A
Monsieur le Médecin Colonel Major
Mohammed Abbar
Professeur d’urologie
Directeur de l’HMMI-Meknès.
En témoignant de notre grand respect
Et notre profonde considération
A
Monsieur le Médecin Colonel Major
Khalid SAIR
Professeur de chirurgie viscérale
Directeur de l’Hôpital Militaire Avicenne de Marrakech
En témoignant de notre grand respect
Et notre profonde considération
A
Monsieur le Médecin Colonel
RADOUAN ZAHNOUN
Commandant du groupement formation et instruction
ERSSM
En témoignant de notre grand respect
Et notre profonde considération
C’est avec beaucoup de fierté, d’accomplissement, et de soulagement
que je dépose cette thèse qui vient marquer la fin d’un long parcours
universitaire, et qui signe par le fait même le passage de mon rôle
d’étudiant à celui de professionnelle, ce qui représente une étape très
importante dans ma vie. C’est avec honneur que je porterai mon titre
de
À Ma grand-mère Rokaya
Je te remercie pour tes prières pour moi et pour ton soutien. Que ton âme
repose en paix, que dieu t’accorde sa miséricorde et t’accueille dans son vaste
paradis.
A MON CHER ONCLE AHMED
Mon conseiller, et ami fidèle, qui m’a assisté dans les moments difficiles et m’a
pris doucement par la main pour traverser ensemble des épreuves pénibles….
Je te suis très reconnaissant, et je ne te remercierai jamais assez pour ton
amabilité, ta générosité, ton aide précieuse.
A tous les membres de ma famille, petits et grands
Veuillez trouver dans ce modeste travail l’expression de mon
affection
À mes chèrs amis
Khalid Errouane ,Youssef Moutaouakil , Mouad Hmidane
,Yassine Ez-zaouy , Salah Eddine Ajeamoum, Anass Erroufi
,Hamza Bouras, Soufiane Kadiri ,Oussama Raqiq ,Ayoub
Essad , Abdelouahab Erraji, Hamid Laatiris Issam Erraoui,
Mustapha Chriqui, , Radia Mounir ,Rachida Gaougaou,
Khadija Lechheb , Hajar Zhar , Zineb, Amal Haour et Hind
Fakir.
Je ne peux trouver les mots justes et sincères pour vous exprimer mon affection
et mes pensées, vous êtes pour moi des frères et sœurs et des amis sur qui je
peux compter.
En témoignage de l’amitié qui nous uni et des souvenirs de tous les moments
que nous avons passés ensemble, je vous dédie ce travail et je vous souhaite
A MON TRES CHER PERE MOHAMED
De tous les pères, tu es le meilleur. Tu as été toujours un exemple pour moi par
tes qualités humaines, et ta persévérance. En témoignage d’années de
sacrifices, de sollicitudes, d’encouragement et de prières. Pourriez-vous
trouver dans ce travail le fruit de toutes vos peines et de vos efforts. En ce
jour, j'espère réaliser l'un de tes rêves. Aucune dédicace ne saurait exprimer mes
respects, ma reconnaissance et mon profond amour.
A MA TRES CHERE MERE AICHA
Source inépuisable de tendresse, de patience et de sacrifice. Ta prière et ta
Bénédiction m'ont été d'un grand secours tout au long de ma vie. Quoique je
puisse dire et écrire, je ne pourrais exprimer ma grande affection et ma
profonde reconnaissance. J'espère ne jamais te décevoir, ni trahir ta confiance
et tes sacrifices. Puisse Dieu tout puissant, te préserver et t'accorder santé,
longue vie et Bonheur.
A MES CHERS ET ADORABLE SŒURS
YOUSSRA l’aimable ma confidente et ma fidèle compagnante dans les
moments les plus délicats de cette vie mystérieuse.
Et SARA Ma Sœur que j’aime profondément. En témoignage de mon
affection fraternelle, de ma profonde tendresse et reconnaissance, je vous
souhaite une vie pleine de bonheur et de succès et que Dieu, le tout puissant,
vous protége et vous garde.
À Youness MOUTYA,Yassine ATBIB, Hamza EL
FADIL,et ma Tante KALTOUM:
Vous avez toujours fait preuve d’attachement, de sincérité, et de considération
envers ma personne. Je voudrais pouvoir vous apporter ici la chaleur de mon
affection et de mon amour.
Votre aide, votre générosité extrême, votre soutien, étaient pour moi une
source de
courage, de conscience et de patience. Puisse Dieu, le tout puissant, vous
combler de santé, de bonheur et vous procurer longue vie.
A tous les professeurs auprès de qui j’ai eu l’honneur
d’apprendre. A tous ceux qui ont participé de loin ou de près à
la réalisation de ce travail
A tous mes enseignants
A tous ceux qui ont contribué de près ou de loin à l'élaboration de ce
travail,
A tous ceux qui m'ont dispensée le savoir,
A tous ceux et celles qui me sont chers Et que j’ai involontairement
omis de Citer
A notre Président de Jury,
Mr.Abdelah DAMI
Professeur de Biochimie
à la Faculté de Médecine et de Pharmacie de Rabat
C'est pour nous un grand honneur de vous avoir à la présidence de ce jury
malgré vos multiples responsabilités. Nous avons pour votre sérieux et votre
richesse d’enseignement et d’encadrement. Veuillez trouver, chèr maître, dans
ce modeste travail, l’expression de notre très haute considération et notre
profonde gratitude.
A notre Maître et Rapporteur de thèse
Mr.Azlarab MASRAR
Professeur d’Hématologie biologique à la Faculté de Médecine
de Pharmacie de Rabat
Vous m’avez fait le grand honneur d’accepter de me diriger dans ce travail
avec bienveillance et rigueur. Votre attachement au travail bien fait est l’objet
de ma considération. Votre amabilité, Votre dynamisme, votre dévouement
pour le travail et votre compétence ont suscité mon admiration. Vous n’avez
jamais lésiné ni sur votre temps ni sur votre savoir tout au long de ce travail.
Je garde un excellent souvenir de la qualité de l’enseignement que vous nous
avez prodigué. J’espère être digne de la confiance que vous avez placée en moi
en me guidant dans la vie personnelle, professionnelle et dans l’élaboration et
la mise au point de cette thèse. Qu’il me soit permis, Monsieur, de vous
exprimer ma profonde gratitude et mes sincères remerciements. Merci pour
votre gentillesse et votre totale disponibilité.
A notre Maître et Membre du jury,
Mme.Mona NAZIH
Professeur D’Hématologie
à la Faculté de Médecine et de Pharmacie de Rabat
C’est pour nous un honneur et un grand privilège de vous avoir dans
notre jury de thèse.
Merci pour la simplicité que vous avez témoigné en acceptant de siéger
parmi notre jury de thèse. Veuillez trouver dans ce travail, l’expression de
notre gratitude et de notre grande estime
A notre Maître et Membre du jury,
Mme.Souad BENKIRANE
Professeur d’Hématologie
A la Faculté de Médecine et de Pharmacie de Rabat
Vous nous avez reçus avec beaucoup d’amabilité, nous en avons été touchés.
C’est pour nous un grand honneur de vous avoir dans notre Jury pour
juger notre travail.
Veuillez recevoir l’expression de ma reconnaissance et de mon respect.
Liste des
illustrations
LISTE DES ABREVIATIONS UTILISEES
AC : Anti corps
ADN : Acide Désoxyribonucléique ADP : Adénosine-Diphosphate ATIII : Antithrombine III ATP : Adénosine triphosphate
CIVD : Coagulation Intravasculaire Disséminée
FGA : Gène codant pour la chaine gamma du fibrinogène FGB : Gene codant pour la chaine beta du fibrinogène FT : Facteur Tissulaire
FVIIIC : Facteur VIII coagulant
FvW :RCo : Cofacteur de la Ristocétine du Facteur von Willebrand FvW : Facteur de von Willebrand
FvW:CB : Liaison du Facteur Von Willebrand au collagène FvW:FVIIIB : Liaison du Facteur Von Willebrand au facteur VIII GP : Glycoprotéine
Hb : Hémoglobine
HBc : Anticorps de l’hépatite B HBs : Antigène de l’hépatite B
HMW : High molecular weight
INR : International Normalized Ratio KDa : Kilo Dalton
LMW : Low molecular weight MMW : Medium molecular weight
PAI-1 : Inhibiteur de l’activateur du Plasminogène de Type 1 PAP : Plasmine-2 antiplasmine
PDF : Produits de Dégradation de la Fibrine PFC : Plasma Frais Congelé
PK : Prékallicréine PM : Poids Moléculaire
RER : Réticulum endoplasmique rugueux
TCA : Temps de Céphaline Activée TP : Taux de Prothrombine
t-PA : Activateur tissulaire du plasminogène TQ : Temps de Quick
TR : Temps de Reptilase TS : Temps de Saignement TT : Temps de Thrombine VHC : Virus de l’hépatite C VWF : Facteur Von Willebrand
LISTE DES FIGURES
Figure 1 : Structure du fibrinogène selon Hall et Slayter en 1959 ... 4 Figure 2 : Différents fragments du fibrinogène ... 6 Figure 3 : Mécanisme de la synthèse de plasmine ainsi son intervention dans la
transformation de la fibrine en PDF ... 7
Figure 4 : Organisation du locus du fibrinogène ... 10 Figure 5 :Voies intrinsèques et extrinsèques de la coagulation et conversion du fibrinogène en
fibrine via la thrombine ... 11
Figure 6 : Schéma de l'interaction du fibrinogène (Facteur I) avec son récepteur plaquettaire
(GP IIb/IIIa) ... 13
Figure 7 : Schéma réactionnel de l'interaction du fibrinogène avec son récepteur plaquettaire.
... 13
Figure 8 : Voies intrinsèques et extrinsèques de la coagulation. ... 22 Figure 9 : Localisation du FGA dans le bras long du chromosome 4 position 28 ... 28 Figure 10 : Arbre généalogique d’une famille avec plusieurs membres atteints. ... 28 Figure 11 : Mécanisme moléculaire à l’origine de la mutation de 11kb sur FGA ... 30 Figure 12 : Représentation schématique des gènes FGA, FGB et GGF montrant les
mutations entraînant l’afibrinogénémie congénitale ... 31
Figure 13 : Orientation biologique pour le diagnostic d’un saignement récidivant chez
l’enfant ... 40
LISTE DES TABLEAUX
Tableau I : Etude japonaise sur 14 cas d’afibrinogénémie montrant l’âge du diagnostic, la
consanguinité, et la présence de maladie hémorragique au sein de leur famille ... 25
TABLE DES MATIERES
INTRODUCTION ... 1 I- Rappel sur le Fibrinogène ... 3 II- Aspect Moléculaire du fibrinogène ... 4
1- Modèle structural ... 4 2- Variabilité moléculaire ... 7
III- Biosynthèse du Fibrinogène ... 9
1- Les gènes codent pour le fibrinogène ... 9 2- Mécanisme d'assemblage des 3 chaînes du fibrinogène ... 10 3- Régulation de la biosynthèse du fibrinogène ... 10 4- Fonctions et interactions du fibrinogène ... 11 4.1- Formation de la fibrine ... 11 4.2- Rôle du fibrinogène dans l’agrégation plaquettaire ... 12 4.3- Interaction du fibrinogène avec d'autres cellules et protéines ... 15 4.3.1- Interaction avec les facteurs du système fibrinolytique ... 15 4.3.2- Interaction avec les cellules endothéliales ... 15 4.3.3- Interaction avec les bactéries ... 15 4.4- Rôle du fibrinogène dans l’hémorhéologie ... 16
LES ANOMALIES LIÉES AU FIBRINOGÉNE ... 17 I- Les anomalies acquises ... 18
1- La coagulation intra-vasculaire disséminée ... 18 2- Les fibrinolyses primitives ... 18 3- Les maladies hépatiques ... 18
II- Les anomalies congénitales sauf l’afibrinogénémie ... 19
1- L’hypofibrinogénémie ... 19 2- La dysfibrinogénémie ... 19
L’AFIBRINOGÉNÉMIE CONGÉNITALE... 21 I- Epidémiologie ... 24
1- Fréquence ... 24 2- Morbidité et mortalité ... 24 3- Age ... 24 4- Sexe ... 26
II- Génétique ... 27 III- Aspects cliniques ... 33
1- Hémorragie cutané ... 33 2- Hémorragie cérébrale ... 34 3- Hémorragie intraoculaire ... 34 4- Hémorragie des muqueuses ... 35 5- Hémorragie intra-thoracique ... 35 6- Hémorragie intra-abdominale ... 35 7- Hémorragie intra-articulaires ou hémarthroses ... 36 8- Les Atteintes squelettiques ... 36 9- Symptômes thromboemboliques ... 36 10- Symptômes en cours de grossesse ... 37
IV- Aspects biologiques ... 39 V- Diagnostic biologique ... 40
1- Diagnostic positif ... 40 2- Diagnostic différentiel ... 42
VI- Aspects et perspectives thérapeutiques ... 43
1- Le sang total ... 43 2- Plasma frais congelé ... 43 3- Cryoprécipités ... 44 4- Concentrés de fibrinogène ... 44 4.1- Obtention du fibrinogène ... 45 4.1.1- Présentation du médicament ... 47 4.1.2- Informations thérapeutiques ... 47 4.1.2.1- Indications thérapeutiques ... 47 4.1.2.2- Posologie et mode d’administration ... 47
4.1.2.2.1- Posologie ... 47 4.1.2.2.2- Mode d’administration ... 48 4.1.2.3- Contre-indications ... 49 4.1.2.4- Mises en gardes spéciales et précautions particulières d’emploi ... 49 4.1.2.5- Interactions médicamenteuses ... 51 4.1.2.6- Grossesse et allaitement ... 51 4.1.2.7- Effets sur l’aptitude à conduire des véhicules et à utiliser des machines ... 51 4.1.2.8- Effets indésirables ... 51 4.1.2.9- Surdosage ... 52 4.1.3- Informations pharmacologiques ... 52 4.1.3.1- Propriétés pharmacodynamiques ... 52 4.1.3.2- Propriétés pharmacocinétiques ... 52 4.1.3.3- Données de sécurité précliniques ... 52 4.1.4- Informations pharmaceutiques ... 53 4.1.4.1- Liste des excipients ... 53 4.1.4.2- Incompatibilités ... 53 4.1.4.3- Durée de conservation ... 53 4.1.4.4- Précautions particulières de conservation ... 54 4.1.4.5- Instructions concernant l’utilisation, la manipulation et l’élimination ... 54
CONCLUSION ... 56 RÉSUMÉS ... 58 RÉFÉRENCES BIBLIOGRAPHIQUES ... 62
1
2
L’afibrinogénémie congénitale est une maladie héréditaire très rare. Sa prévalence est de 1/1000000 et sa transmission se fait selon le mode autosomique récessif. Environ 150 familles ont été rapportées à travers le monde depuis la première observation publiée par deux médecins allemands Rabe et Salomon en 1920.
Cette maladie est due à un défaut au niveau du gène responsable de la synthèse du fibrinogène ou facteur I, à savoir le facteur de la coagulation qui est une protéine plasmatique synthétisée par les cellules hépatiques, et qui se transforme en fibrine lors de la coagulation, participant ainsi à l’hémostase.
Cette pathologie est caractérisée par des manifestations hémorragiques et son traitement repose sur la substitution par du fibrinogène.
Elle peut se révéler au stade néonatal par une hémorragie de gravité variable à la chute du cordon ombilical.
Si son diagnostic est facilement évoqué devant un sang incoagulable et un fibrinogène indosable, sa prise en charge est difficile se basant essentiellement sur l’administration du fibrinogène.
L’Objectif du travail :
Une partie importante de notre étude concerne le fibrinogène et ses différents mécanismes qui interviennent pour assure l’hémostase, ceci en vue d’établir une base rationnelle de notre compréhension de sa pathologie et de ses fondements biologiques, génétiques et thérapeutique.
3
I- Rappel sur le Fibrinogène
Le fibrinogène est une glycoprotéine complexe de 340 kDal, composée de trois polypeptides
alpha, bêta et gamma. Ces polypeptides sont synthétisés essentiellement par l’hépatocyte et
assemblés à l’intérieur de la cellule dans une molécule de structure hexamèrique par la formation de nombreux ponts disulfures entre les trois chaînes [1]
Le fibrinogène est une grosse glycoprotéine. Il s’agit de la troisième protéine la plus répandue dans le plasma, avec une concentration de 1,4 - 4 mg/ml. C’est une molécule multifonctionnelle douée de nombreuses activités biologiques dont les plus importantes sont, sans doute, celles qui lui confèrent un rôle essentiel dans le processus général de l'hémostase.
La conversion du fibrinogène en fibrine, qui est en fait la conclusion de la cascade de la coagulation plasmatique, ainsi que son rôle de cofacteur dans l'agrégation plaquettaire, lui valent cette place prépondérante au centre de l'hémostase.
Les diverses fonctions du fibrinogène sont étroitement liées à sa structure, et outre les sites de la molécule impliqués dans la fibrinoformation sensibles à l'action de la thrombine, et ceux impliqués dans l'agrégation plaquettaire, la structure du fibrinogène constitue le support d'importantes interactions avec d'autres cellules, protéines et molécules, élargissant ainsi et rendant encore plus complexe son rôle physiologique. [1]
4
II- Aspect Moléculaire du fibrinogène
1- Modèle structural
Sa structure à la fois globulaire et fibrillaire est bien décrite. En effet les méthodes de diffraction des rayons X en 1943 et d’hydrodynamique (mesure de la mobilité électrophorétique, des coefficients de sédimentation et de diffusion) en 1949 – 1957, ont fait émerger une structure d’ellipsoïde allongé : la molécule de fibrinogène est formée de trois domaines alignés, le domaine central E est un peu plus petit (5 nm de diamètre) que les deux distaux D (6 nm de diamètre), la longueur totale de la molécule est de 47,5 nm. Les trois domaines sont reliés entre eux par deux super-hélices révélées par diffraction. La masse molaire de la molécule est de 330 - 340 kDa. Les recherches en microscopie électronique réalisées par Hall et Slayter, sur des molécules de fibrinogène déshydratées, s’accordent avec le modèle précédent. [2,3]
Depuis sa formulation en 1959, le modèle original de Hall et Slayter a été à l'origine d'une recherche très féconde basée sur les diverses techniques de microscopie électronique et également sur des techniques physico-chimiques et immunochimiques. [4]
5
Ces études ont, pour leur grande majorité, confirme la conformation trinodulaire de la molécule du fibrinogène, qui jouit actuellement d'un large consensus. D'autant plus que ce modèle trinodulaire de Hall et Slayter épouse bien les différentes données et propriétés du fibrinogène, à savoir la structure en domaine, la sensibilité à l'action de la plasmine, la polymérisation en fibrine et les autres données structurales et fonctionnelles.
En 1964, trois chaînes peptidiques différentes, α, β, γ, de masse molaire comprise entre 48 et 70 kDa, sont isolées par électrophorèse. La masse molaire de ces chaînes suggère que le fibrinogène est un dimère composé de trois paires de chaînes regroupées en deux super-hélices.
La fragmentation enzymatique du fibrinogène par la plasmine et par le bromure de cyanogène en 1959 - 1971 apporte la preuve de cette structure trinodulaire en montrant un produit de dégradation intermédiaire asymétrique : le fragment Y (composé d’un domaine D encore attaché à un domaine E). [5,6,7]
Attaque du fibrinogène par la plasmine :
La plasmine, ainsi que d'autres enzymes protéolytiques (ex. trypsine) ont été utilisées pour étudier la structure du Fibrinogène.
La plasmine est une sérine-protéase qui attaque le fibrinogène au niveau de plusieurs liaisons arginine et lysine. Les sites d'action de la plasmine, tout comme la structure des différents produits de dégradation du fibrinogène (PDF) par la plasmine sont actuellement bien connus.
Les premiers fragments issus de cette attaque et les plus importants de taille sont les PDF X (PM 240 kDa) et Y (PM 150 kDa). X ne diffère du fibrinogène que par l'extrémité C-terminale des chaînes Aα, conserve encore la structure trinodulaire.
D et E, PDF tardifs, sont plus petits (D: 80-100 kDa et E: 50-60 kDa). Ils correspondent respectivement, en gros, aux domaines distal et central du fibrinogène. [8] (Figure 1)
6
7
Figure 3 : Mécanisme de la synthèse de plasmine ainsi son intervention dans la transformation de la fibrine en PDF[10]
2- Variabilité moléculaire
Le fibrinogène montre une grande hétérogénéité ou variabilité moléculaire. Trois principales espèces de fibrinogène ont été isolées et caractérisées dans le plasma normal. Elles sont classées selon leur poids moléculaire : HMW (High Molecular Weight Fibrinogen : 340kDA) MMW (Medium MW: 305kDa) et LMW (Low MW 270kDa) [11]
Cette différence de PM est causée par une variation de l'extrémité C-terminale des chaînes Aa du fibrinogène.
La fraction HMW contient des chaînes Aα intactes. La perte de la partie C-terminale d'une des deux chaînes Aα engendre le MMW.
Tandis que sa rupture au niveau des deux chaînes Aα génère le LMW.
D'autre part on a montré que MMW provient de la dégradation de HMW mais le mécanisme ainsi que les facteurs responsables de cette protéolyse restent inconnus. [12]
8
HMW, MMW et LMW représentent respectivement 70%, 26% et 4% du fibrinogène total. Leurs coagulabilités respectives sont : 90%, 92% et 80%.
Le fibrinogène humain est également hétérogène quant à la taille des chaînes. En effet, il existe deux populations circulantes de chaînes : A et B Différentes par la structure de la séquence C-terminale. Dans la chaîne A, les résidus 407-411 sont remplacés par une séquence de 20 acides aminés (Mosesson et al 1987). A est présente dans plus de 93% des molécules du fibrinogène [13, 14]
Il existe en plus une micro-hétérogénéité par polymorphisme génétique, et des variant normaux du fibrinogène peuvent ainsi être signalés chez certains individus de la population.
7 sites acides aminés sont supposés être polymorphiques dans la molécule du Fibrinogène, [15]
9
III- Biosynthèse du Fibrinogène
Le fibrinogène est synthétisé par les cellules parenchymateuses du foie. Environ 1,5 g de fibrinogène sont produits par jour. Le fibrinogène est une des protéines les plus abondantes dans le plasma, ses taux sont 2-4 g/1, sa demi-vie 4-5 jours. Le mégacaryocyte, précurseur des plaquettes sanguines, peut également synthétiser le fibrinogène. Les étapes qui conduisent à la synthèse et à l'assemblage de la molécule ont été partiellement étudiées.
1- Les gènes codent pour le fibrinogène
Les gènes responsables de la synthèse du fibrinogène sont situés sur le tiers distal du bras long du chromosome 4, et il y a une copie unique pour chacun des 3 gènes des 3 chaînes polypeptidiques, ces dernières étant synthétisées séparément.
La molécule, principalement synthétisée par les hépatocytes, est un hexamère constitué de deux copies de trois chaînes polypeptidiques, Aα, Bβ et γ (Figure 4), chacune codée par un gène distinct, FGA, FGB et FGG, respectivement [16]. Les trois gènes se situent dans une région d’approximativement 50 kb sur le chromosome 4 (Figure 4). L’assemblage des chaînes se déroule de manière séquentielle dans le réticulum endoplasmique, avec la formation de complexes intermédiaires (Aαγ) ou (Bβγ), l’ajout d’une troisième chaîne (Bβ ou Aα, respectivement), et la dimérisation des trimères pour former l’hexamère (AαBβγ)2.
Celui-ci est ensuite transporté vers l’appareil de Golgi où il subit de nombreuses modifications post-traductionnelles, telles que phosphorylation, hydroxylation, etc[17].
Les chaînes Bβ et γ présentent à leur extrémité carboxy-terminale un domaine globulaire homologue (βC et γC, respectivement), conservé dans diverses protéines (telles que les angioprotéines) chez plusieurs espèces animales. Ces domaines homologues, composés d’environ 250 acides aminés, sont connus sous le nom de FReD
10
L'organisation du locus des gènes du fibrinogène est schématisée dans la Figure 4.
Figure 4 : Organisation du locus du fibrinogène [9]
Ce schéma résume l'ensemble des informations obtenues à ce jour, chez l'homme. Les gènes codant pour chaque chaine peptidique sont organisés selon une orientation γ-α-ß sur une portion réduite du chromosome 4. Des séquences promotrices ont été identifiées pour les gènes et ß. Des séquences homologuessont également présentées aux positions -334,- 392 et - 1 65 des gènes γ, α et ß respectivement.
2- Mécanisme d'assemblage des 3 chaînes du fibrinogène
Les 3 chaînes polypeptidiques, synthétisées séparément, sont assemblées dans le Réticulum Endoplasmique Rugueux (RER) en structure dimérique : le fibrinogène.
Les modalités d'assemblage ne sont pas encore connues. Un modèle qui a été proposé récemment prévoit que le point de départ est constitué par les chaînes Bß encore incomplètes et attachées aux polysomes. Les chaînes Aα et γ préformées se combinent indépendamment aux chaînes Bß en cours de formation.
Les complexes ainsi formés Bß - Aγ et Bß –γ passent au réticulum endoplasmique pour s'associer à d'autres chaînes Aα et γ, conduisant à la formation ultérieure de la structure dimérique du fibrinogène. On conçoit bien dans ce modèle que le facteur limitant dans la biosynthèse du fibrinogène est la chaîne Bß. [18]
3- Régulation de la biosynthèse du fibrinogène
La biosynthèse du fibrinogène peut être stimulée par la défibrination, par certaines hormones et analogues (Dexamethasone) et également lors de la réaction de la phase aigue. Une voie de feed-back est contrôlée par l'Hépatocyte Stimulating Factor (HSF) qui est également responsable de l'augmentation des taux des autres protéines de la phase aigue.
11
Les produits de dégradation du fibrinogène / Fibrine (PDF), essentiellement D et E, constituent un stimulus important de cette biosynthèse. [19, 20, 21]
La biosynthèse du fibrinogène peut être perturbée dans certaines atteintes hépatiques chroniques ou aigues mais également lors des anomalies héréditaires:
· Anomalies quantitatives du fibrinogène qui peuvent affecter le contrôle génétique de cette biosynthèse : hypofibrinogénémie et afibrinogénémie congénitale
· Anomalie qualitative : dysfibrinogénémie
4- Fonctions et interactions du fibrinogène
La structure ainsi que la conformation de la molécule du fibrinogène constituent le support et la base des nombreuses et importantes activités physiologiques de la protéine.
4.1- Formation de la fibrine
La conversion du fibrinogène, protéine soluble, en fibrine, polymère insoluble, est de loin la fonction la plus importante et la conclusion d'une cascade d'événements et de réactions faisant intervenir au moins deux voies et de nombreuses enzymes et facteurs, C'est la coagulation plasmatique Figure 5.
Figure 5 :Voies intrinsèques et extrinsèques de la coagulation et conversion du fibrinogène en fibrine via la thrombine[10]
12
4.2- Rôle du fibrinogène dans l’agrégation plaquettaire
L’interaction du fibrinogène avec les plaquettes sanguines est un autre aspect important de son rôle dans l'hémostase.
Les plaquettes sanguines jouent un rôle fondamental dans l'hémostase et particulièrement à la phase primaire.
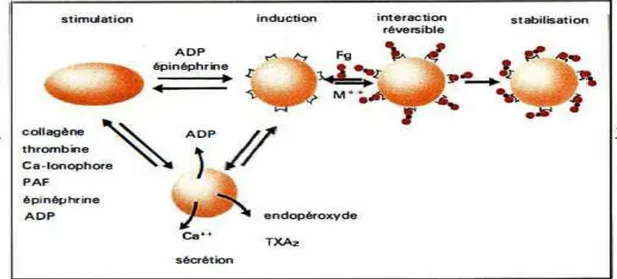
L'hémostase primaire regroupe l'ensemble des événements et réactions qui concourent à la formation du clou hémostatique au niveau du site de la lésion vasculaire. Elle nécessite l'adhésion des plaquettes circulantes aux structures sous-endothéliales, suivie de leur activation et de la libération du contenu de leurs granules et finalement leur agrégation. Les plaquettes sanguines peuvent agréger en réponse à une grande variété de stimuli dont les plus importants sont : ADP, collagène, thrombine, acide arachidonique, épinephrine....
L'agrégation plaquettaire est un phénomène actif qui nécessite la présence de cations divalents : Ca++ et Mg+. Le rôle du fibrinogène dans l'agrégation plaquettaire a suscité beaucoup d'intérêt de la part des chercheurs dans ce domaine.
En effet les études sur le mécanisme de l'agrégation plaquettaire ont permis de montrer le rôle important et essentiel du fibrinogène dans la réaction plaquettaire.
Ainsi, on a pu constater un défaut d'agrégation des plaquettes de sujets afibrinogénémiques. L'addition de fibrinogène purifié restaure l'agréabilité plaquettaire.
De leur côté Peerschke et al (1980) ont montré une contre relation entre l'agrégation plaquettaire et la liaison du fibrinogène avec les plaquettes. Ils ont en outre confirmé la nature spécifique et saturable de l'interaction fibrinogène-plaquettes sanguines.
Cette interaction est rendue possible grâce à la présence de sites spécifiques du fibrinogène au niveau de la membrane plaquettaire.
13
Figure 6 : Schéma de l'interaction du fibrinogène (Facteur I) avec son récepteur plaquettaire (GP IIb/IIIa)[10]
Figure 7 : Schéma réactionnel de l'interaction du fibrinogène avec son récepteur plaquettaire. [9]
La nature précise de ces sites a également été étudiée : On a donc pu montrer que les plaquettes thrombasthéniques montrent une diminution marquée de la liaison avec le fibrinogène, se traduisant par un défaut d'agrégation après stimulation par l'ADP.
14
Ces auteurs ont suggéré que ces plaquettes thrombasthéniques, qu'on sait par ailleurs déficitaires en complexes glycoprotéiques GP IIb/IIIa, présentent un défaut au niveau des sites de liaison avec le fibrinogène.
Il a été montré, enfin, que le complexe GP IIb/IIIa qu'ils ont purifié, contient le récepteur plaquettaire du Fibrinogène.
Les récepteurs plaquettaires du fibrinogène ne sontpas disponibles sous conditions physiologiques normales.
Le complexe GP IIb / IIIa n'est, en fait, assemblé que lors de l'activation des plaquettes sanguines circulantes par l'ADP et autres stimuli de l'agrégation plaquettaire.
Quant aux sites d'Interaction avec les plaquettes au niveau de la molécule du fibrinogène, ils sont situés principalement au niveau du décapeptide γ400 - γ411, mais aussi au niveau de la séquence Arg - Gly- Asp de la chaîne α.
Un compartiment séparé du fibrinogène existe normalement dans les granules α des plaquettes sanguines. Ce fibrinogène plaquettaire est libéré lors de l'activation plaquettaire induite par la thrombine ou le collagène. Il a été montré que le fibrinogène plaquettaire purifié supporte aussi efficacement l'agrégation plaquettaire que le fibrinogène plasmatique.
Plusieurs autres protéines adhésives partagent, à des degrés variables, avec le fibrinogène, ses propriétés d'adhésion aux plaquettes. Ainsi le complexe GP IIb/IIIa lie, à côté du fibrinogène, le facteur de Willebrand (VWF), la fibronectine et la thrombospondine.
Ces observations suggèrent un rôle pour ces protéines dans l'agrégation Plaquettaire d'autant plus qu'il a été montré que l'agrégation des plaquettes peut avoir lieu, et ce malgré l'absence totale du fibrinogène plasmatique et plaquettaire, particulièrement celle induite par la thrombine. Une étude menée en (1986) a confirmé ces observations. Ces auteurs sont par ailleurs démontré que l'agrégation résiduelle observée chez trois sujets afibrinogénémiques est dépendante de l'interaction du VWF avec le même complexe GP IIb/IIIa récepteur du fibrinogène. [22]
15
4.3- Interaction du fibrinogène avec d'autres cellules et protéines
A côté de sa double fonction dans l'hémostase, comme substrat de la thrombine et cofacteur de l'agrégation plaquettaire, le fibrinogène montre des Interactions avec d'autres protéines et cellules avec d'importantes conséquences biologiques.
4.3.1- Interaction avec les facteurs du système fibrinolytique
Le fibrinogène et la fibrine lient le plasminogène, précurseur de la plasmine, et également l'activateur tissulaire du plasminogène (tPA), probablement pour assurer, d'une part une fibrinolyse limitée au site de dépôt du caillot, et d'autre part en raison de l'inactivation rapide de la plasmine par l'inhibiteur circulant alpha-2-antiplasmine.
Les sites concernés par l'interaction avec le plasminogène sont appelés sites de fixation de lysine.
4.3.2- Interaction avec les cellules endothéliales
Les cellules endothéliales forment une surface vasculaire non thrombogène. Lors de la lésion vasculaire la fibrine s'accumule au niveau du site de rupture de cette tunique et sa masse assure l'occlusion du défaut pariétal.
Il a été montré que le fibrinogène se lie de façon spécifique à la cellule endothéliale, de même qu'il induit sa migration en culture. Et on a suggéré que le mode de liaison entre le fibrinogène et la cellule endothéliale serait comparable à celui entre fibrinogène et plaquettes sanguines : Un complexe glycoprotéique de la cellule endothéliale homologue du complexe GP IIb/IIIa des plaquettes sanguines, ainsi que la séquence C-terminale de la chaîne γ du fibrinogène seraient impliqués dans cette interaction. [23]
4.3.3- Interaction avec les bactéries
Le fibrinogène a la particularité unique parmi les autres protéines plasmatiques d'agglutiner (clump) certaines souches de staphylocoques aureus. [24]
Particularité, par ailleurs mise à profit pour le dosage du fibrinogène, des monomères de fibrine ou encore de certains PDF (X et Y) dans les staphylo clumping tests.
D'autre part le fibrinogène joue un rôle important comme cofacteur de l'interaction des plaquettes avec le staphylocoque aureus.
16
Il a été observé une agrégation plaquettaire irréversible en réponse à ce microorganisme qui est régulièrement piégé à l'intérieur des agrégats plaquettaires. [24, 25, 26]
Ce phénomène est sensiblement diminué chez des sujets afibrinogénémiques.
4.4- Rôle du fibrinogène dans l’hémorhéologie
Le sang est un liquide non Newtonien. Il présente deux phases, cellulaire et plasmatique.
Le fibrinogène joue un rôle prépondérant dans la rhéologie du sang. Il influence de façon directe la viscosité du plasma qui est fonction du taux du fibrinogène. [27]
Le fibrinogène marque également la phase cellulaire du sang, les études ont montré que le fibrinogène s'adsorbe à la membrane des hématies et qu'il joue un rôle important dans la formation des rouleaux (réseaux tridimensionnels d'agrégats des hématies).
Ce phénomène affecte à son tour les caractéristiques rhéologiques du sang et présente un intérêt majeur dans le test de la vitesse de sédimentation (VS). Le fibrinogène jouit donc d'une importance particulière dans les anomalies hémo-rhéologiques, anomalies le plus souvent associées aux maladies cardiovasculaires. [28]
17
LES ANOMALIES
LIÉES AU
18
I- Les anomalies acquises
1- La coagulation intra-vasculaire disséminée (CIVD)
L’activation de la coagulation, par des lésions de l’endothélium vasculaire mettant à nu la membrane basale des vaisseaux ou par une libération de facteur tissulaire dans la circulation, aboutit à la formation de thrombine qui dépasse les possibilités d’inhibition par les antithrombines physiologiques.
Il en résulte une induction anarchique de la coagulation avec formation de micro-thromboses disséminées entrainant une augmentation de la consommation des facteurs de la coagulation et des plaquettes ainsi qu’une fibrinolyse réactionnelle et un syndrome hémorragique grave.
2- Les fibrinolyses primitives
La fibrinolyse est souvent secondaire à une CIVD mais cependant elle peut être primitive au cours des insuffisances hépatiques, au cours d’interventions chirurgicales ou de lésions traumatiques.
3- Les maladies hépatiques
Le déficit en fibrinogène est dû à une insuffisance hépatocellulaire. Ce déficit est d’autant plus profond que l’insuffisance hépatique est sévère.
![Figure 1 : Structure du fibrinogène selon Hall et Slayter en 1959 [4]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061719.698969/56.892.115.793.611.866/figure-structure-du-fibrinogène-selon-hall-et-slayter.webp)
![Figure 2 : Différents fragments du fibrinogène [9]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061719.698969/58.892.137.734.121.653/figure-fragments-fibrinogène.webp)
![Figure 3 : Mécanisme de la synthèse de plasmine ainsi son intervention dans la transformation de la fibrine en PDF[10]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061719.698969/59.892.116.780.107.531/figure-mécanisme-synthèse-plasmine-intervention-transformation-fibrine-pdf.webp)
![Figure 4 : Organisation du locus du fibrinogène [9]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061719.698969/62.892.115.786.150.301/figure-organisation-locus-fibrinogène.webp)
![Figure 5 :Voies intrinsèques et extrinsèques de la coagulation et conversion du fibrinogène en fibrine via la thrombine[10]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061719.698969/63.892.113.788.635.973/figure-intrinsèques-extrinsèques-coagulation-conversion-fibrinogène-fibrine-thrombine.webp)

![Tableau I : Etude japonaise sur 14 cas d’afibrinogénémie montrant l’âge du diagnostic, la consanguinité, et la présence de maladie hémorragique au sein de leur famille [56]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061719.698969/77.892.191.716.171.593/tableau-japonaise-afibrinogénémie-montrant-diagnostic-consanguinité-présence-hémorragique.webp)
![Figure 9 : Localisation du FGA dans le bras long du chromosome 4 position 28[37]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061719.698969/80.892.115.778.134.359/figure-localisation-fga-bras-long-chromosome-position.webp)
![Figure 11 : Mécanisme moléculaire à l’origine de la mutation de 11kb sur FGA [43]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061719.698969/82.892.152.753.118.457/figure-mécanisme-moléculaire-l-origine-mutation-kb-fga.webp)