31
UNIVERSITE MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH
1974 – 1981 : Professeur Bachir LAZRAK
1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI
2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI
ADMINISTRATION :
Doyen : Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines
Professeur Mohammed AHALLAT
Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général : Mr. Mohamed KARRA
1- ENSEIGNANTS-CHERCHEURS MEDECINS
ET
PHARMACIENS
PROFESSEURS :
Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENSAID Younes Pathologie Chirurgicale
Janvier, Février et Décembre 1987
Pr. CHAHED OUAZZANI Houria Gastro-Entérologie
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
Décembre 1988
Pr. BENHAMAMOUCH Mohamed Najib Chirurgie Pédiatrique
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. CHAD Bouziane Pathologie Chirurgicale
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie Janvier et Novembre 1990
Pr. CHKOFF Rachid Pathologie Chirurgicale
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. MANSOURI Fatima Anatomie-Pathologique
Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AL HAMANY Zaîtounia Anatomie-Pathologique
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale
Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique
Pr. CHABRAOUI Layachi Biochimie et Chimie
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie – Dir. du Centre National PV
Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir du CEDOC
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale V.D Aff. Acad. et Estud
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. BOUJIDA Mohamed Najib Radiologie
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. DEHAYNI Mohamed* Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques
Doyen de la FMPA
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HADRI Larbi* Médecine Interne
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. JELTHI Ahmed Anatomie Pathologique
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BELAIDI Halima Neurologie
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHAMI Ilham Radiologie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. JALIL Abdelouahed Chirurgie Générale
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BAIDADA Abdelaziz Gynécologie Obstétrique
Pr. BARGACH Samir Gynécologie Obstétrique
Pr. CHAARI Jilali* Médecine Interne
Pr. DIMOU M’barek* Anesthésie Réanimation
Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation
Pr. EL MESNAOUI Abbes Chirurgie Générale
Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie - Directeur HMI Med V
Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie
Pr. BOULANOUAR Abdelkrim Ophtalmologie
Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUADGHIRI Mohamed Traumatologie-Orthopédie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. HAIMEUR Charki* Anesthésie Réanimation
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TAOUFIQ Jallal Psychiatrie
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. AFIFI RAJAA Gastro-Entérologie
Pr. BENOMAR ALI Neurologie – Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
Pr. KHATOURI ALI* Cardiologie
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie
Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie
Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale
Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. ISMAILI Hassane* Traumatologie Orthopédie- Dir. Hop. Av. Marr.
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Inspecteur du SSM
Pr. TACHINANTE Rajae Anesthésie-Réanimation
Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie Directeur Hop. Chekikh Zaied
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MAHASSINI Najat Anatomie Pathologique
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie Directeur. Hop.d’Enfants
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique
Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique
Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique
Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie
Pr. BERNOUSSI Zakiya Anatomie Pathologique
Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. LAGHMARI Mina Ophtalmologie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique
Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. BERNOUSSI Abdelghani Ophtalmologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. NIAMANE Radouane* Rhumatologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
Pr. ZERAIDI Najia Gynécologie Obstétrique
Décembre 2005 Pr. CHANI Mohamed Anesthésie Réanimation Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique
Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire
Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation Directeur ERSM
Pr. BALOUCH Lhousaine* Biochimie-chimie
Pr. BENZIANE Hamid* Pharmacie clinique
Pr. BOUTIMZINE Nourdine Ophtalmologie
Pr. CHARKAOUI Naoual* Pharmacie galénique
Pr. EHIRCHIOU Abdelkader* Chirurgie générale
Pr. ELABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation
Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRABET Mustapha* Médecine préventive santé publique et hygiène
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-chimie
Pr. RABHI Monsef* Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2007
Pr. DOUHAL ABDERRAHMAN Ophtalmologie
Décembre 2008
Pr ZOUBIR Mohamed* Anesthésie Réanimation
Pr TAHIRI My El Hassan* Chirurgie Générale
Pr. ABOUZAHIR Ali* Médecine interne
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale
Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie
Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie
Pr. BOUI Mohammed* Dermatologie
Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique
Pr. CHAKOUR Mohammed * Hématologie biologique
Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique
Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale
Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. L’KASSIMI Hachemi* Microbiologie Directeur Hôpital My Ismail
Pr. LAMSAOURI Jamal* Chimie Thérapeutique
Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie
PROFESSEURS AGREGES :
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. BOUAITY Brahim* ORL
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique
Pr. DAMI Abdellah* Biochimie chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice
Pr. ERRABIH Ikram Gastro entérologie
Pr. LAMALMI Najat Anatomie pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie générale
Pr. NAZIH Mouna* Hématologie biologique
Pr. ZOUAIDIA Fouad Anatomie pathologique
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique
Pr. ABOUELALAA Khalil* Anesthésie Réanimation
Pr. BELAIZI Mohamed* Psychiatrie
Pr. BENCHEBBA Driss* Traumatologie Orthopédique
Pr. DRISSI Mohamed* Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek* Médecine Interne
Pr. EL OUAZZANI Hanane* Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOUR Mourad Anesthésie Réanimation
Pr. AWAB Almahdi Anesthésie Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale
Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie biologique
Pr. BENNANA Ahmed* Informatique Pharmaceutique
0.
Pr. BENSGHIR Mustapha* Anesthésie Réanimation
Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire
Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation
Pr. EN-NOUALI Hassane* Radiologie
Pr. ERRGUIG Laila Physiologie
Pr. FIKRI Meryim Radiologie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. NEJJARI Rachid Pharmacognosie
Pr. OUBEJJA Houda Chirurgie Pédiatrique
Pr. OUKABLI Mohamed* Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua* Gastro-Entérologie
Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale
Pr. GHOUNDALE Omar* Urologie
Pr. ZYANI Mohammad* Médecine Interne
MARS 2014
ACHIR ABDELLAH Chirurgie Thoracique
BENCHAKROUN MOHAMMED Traumatologie- Orthopédie
BOUCHIKH MOHAMMED Chirurgie Thoracique
EL KABBAJ DRISS Néphrologie
EL MACHTANI IDRISSI SAMIRA Biochimie-Chimie
HARDIZI HOUYAM Histologie- Embryologie-Cytogénétique
HASSANI AMALE Pédiatrie
HERRAK LAILA Pneumologie
JANANE ABDELLA TIF Urologie
JEAIDI ANASS Hématologie Biologique
KOUACH JAOUAD Génécologie-Obstétrique
LEMNOUER ABDELHAY Microbiologie
MAKRAM SANAA Pharmacologie
OULAHYANE RACHID Chirurgie Pédiatrique
RHISSASSI MOHAMED JMFAR CCV
SABRY MOHAMED Cardiologie
SEKKACH YOUSSEF Médecine Interne
TAZL MOUKBA. :LA.KLA. Génécologie-Obstétrique
*
Enseignants MilitairesDECEMBRE 2014
ABILKACEM RACHID' Pédiatrie
AIT BOUGHIMA FADILA Médecine Légale
BEKKALI HICHAM Anesthésie-Réanimation
BENAZZOU SALMA Chirurgie Maxillo-Faciale
BOUABDELLAH MOUNYA Biochimie-Chimie
BOUCHRIK MOURAD Parasitologie
DERRAJI SOUFIANE Pharmacie Clinique
DOBLALI TAOUFIK Microbiologie
EL AYOUBI EL IDRISSI ALI Anatomie
EL GHADBANE ABDEDAIM HATIM Anesthésie-Réanimation
EL MARJANY MOHAMMED Radiothérapie
FE]JAL NAWFAL Chirurgie Réparatrice et Plastique
JAHIDI MOHAMED O.R.L
LAKHAL ZOUHAIR Cardiologie
OUDGHIRI NEZHA Anesthésie-Réanimation
Rami Mohamed Chirurgie Pédiatrique
SABIR MARIA Psychiatrie
SBAI IDRISSI KARIM Médecine préventive, santé publique et Hyg.
AOUT 2015
Meziane meryem Dermatologie
Tahri latifa Rhumatologie
JANVIER 2016
BENKABBOU AMINE Chirurgie Générale
EL ASRI FOUAD Ophtalmologie
ERRAMI NOUREDDINE O.R.L
NITASSI SOPHIA O.R.L
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques
Pr. BOURJOUANE Mohamed Microbiologie
Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. DRAOUI Mustapha Chimie Analytique
Pr. EL GUESSABI Lahcen Pharmacognosie
Pr. ETTAIB Abdelkader Zootechnie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. HAMZAOUI Laila Biophysique
Pr. HMAMOUCHI Mohamed Chimie Organique
Pr. IBRAHIMI Azeddine Biologie moléculaire
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Pr. ZELLOU Amina Chimie Organique
Mise à jour le 14/12/2016 par le
Louange A Dieu Le Clément, le Tout
Miséricordieux
« Gloire à Toi ! Nous n’avons de savoir que ce que tu nous as appris. Certes
c’est Toi l’Omniscient, le Sage »
: Sourate 2, Verset 32 (Saint Coran).
J’aimerais, avant tout propos, exprimer ma reconnaissance à l’Eternel mon
Dieu, Le Tout Puissant, pour ce que je suis car aucune vraie réussite n’est
possible sans Lui. Qu’il me soit permis ici de Lui rendre témoignage pour les
merveilles qu’il ne cesse d’accomplir dans ma vie, sa miséricorde et ses grâces
qu’IL ne cesse de me prodiguer.
Louange et Gloire à Dieu, le Tout Puissant, qui nous a permis de mener à
bien ce modeste travail.
Je dédie ce modeste travail à :
A mes très chers parents :
Salah MAKTANE et Habiba AIT ALI
Aucun hommage ne pourrait être à la hauteur de l’amour dont vous ne
cessez de me combler.
Merci de
m’ avoir permis de faire des études longues, et d’avoir cru en moi.
Que ce travail vous soit un
gage de remerciements.
A l’homme de ma vie
mon exemple éternel, mon soutien moral et source de joie et de bonheur,
celui qui s’est toujours sacrifié pour me voir réussir, à toi mon père :
Tu as su guider mes pas depuis mon jeune âge , tu as toujours été présent
pour moi , tu m’as toujours écoutée et su me conseiller, tu as toujours été
pour moi la source de sagesse .
Le plus beau cadeau que je puisse te faire, est de te rendre fier, j’espère
qu’aujourd’hui tu es fier de la personne que je suis .
A la lumière de mes jours, la source de mes efforts, la flamme de mon cœur,
ma vie et mon bonheur ;
maman que j’adore
.Merci pour tout l’amoure et toute la tendresse que tu m’as apportés et que
tu continues à me donner.
J’admire ta tolérance, ton humilité, ta sensibilité et ta force de caractère.
Merci pour
ton soutien indéfectible dans mes études. Je t’aime très fort .
Que Dieu tout puissant vous protège et me donne l’occasion de prendre soin
de vous et de vous rendre heureux comme vous l’avez toujours fait pour
A mon oncle Said MAKTANE :
Vous avez toujours été là pour moi , avec votre présence, vos conseils
précieux, vos encouragements.
Que Dieu tout puissant vous protège .
Je tiens à vous exprimer tout mon respect et mon amour.
Soyez assurés de ma reconnaissance sincère .
Que ce travail soit le témoignage de la profondeur de mes sentiments et ma
gratitude
Amon cher époux Adel ELMOTAKI
Aucune dédicace ne pourrait exprimer mon amour et mon attachement à toi.
Depuis que je t’ai connu, tu n'as cessé de me soutenir et de m'épauler. Tu me
voulais toujours la meilleure.
Ton amour ne m'a procuré que confiance et stabilité.
Tu étais toujours à mes cotés, Je te remercie de ne m'avoir jamais déçu.
Aucun mot ne pourrait exprimer ma gratitude, mon amour et mon respect.
Je remercie le bon dieu qui a croisé nos chemins.
Puisse le bon dieu nous procure santé et longue vie.
A mes sœurs Zakia, Souad et Ikram et mon petit frère Younes MAKTANE
Je vous remercie pour ces années qu’on a partagées ensembles, ces rires , ces
joies , ces disputes , ces prises de têtes.
Je vous remercie pour ces beaux moments qui ont marqué ma vie
Je vous souhaite une longue vie, que Dieu vous protège et
vous procure santé, joie et réussite dans vos carrières.
Mes chères (Ichrak, Ihssane, Kaouthar, Meryem, Sara,
Fatima Zehra et Safae)
Vous constituez pour moi la bande restreinté de mes fidèles amies avec
qui j’ai partagé tout le bonheur qui restera gravi dans ma mémoire et je
A mes chères amies
Merci pour votre présence inconditionnelle à chaque moment de ma vie,
votre soutien sans faille et votre amour. Vos encouragements répétés durant
toute cette grande et longue aventure m’ont permis de l’accomplir
entièrement.
A toute ma famille,
Que ce travail soit le témoignage de mon respect
avec mes souhaits
de bonheur pour vous tous. Que dieu vous procure
santé, bonheur et succès
A tous ceux qui n’ont pas été cités
Sachez que vous n’êtes pas moins que les autres l’erreur est humaine.
Trouver ici toute ma reconnaissance.
À TOUTES LES PERSONNES QUI ONT PARTICIPÉ
A L’ÉLABORATION DE CE TRAVAIL À TOUS
A Notre Maitre et président du jury,
Madame Yamna KRIOUILE
Professeur de pédiatrie
Nous sommes très honorés de vous avoir comme
président du jury de notre thèse.
Votre accueil, votre gentillesse et votre assistance
m’ont beaucoup touché.
Veuillez, monsieur le professeur, trouver dans ce travail
l’expression de notre sincère considération
A notre maître et Rapporteur de thèse
Mr Le Professeur Layachi CHABRAOUI
Professeur de Biochimie
C’est un immense honneur pour moi d’avoir pu travailler
à vos côtés et bénéficier de votre expérience.
Votre accueil, votre sympathie et votre disponibilité malgré vos multiples
charges professionnelles m’ont profondément touché.
Veuillez accepter Monsieur, l’expression de ma profonde reconnaissance et
ma grande estime
A notre maître et juge de thèse
Madame Le Professeur Sanae BOUHSAIN
Professeur de Biochimie
Je tiens à vous exprimer ici mes sincères remerciements pour l’honneur que
vous me faites en acceptant de juger ce modeste travail.
La richesse de votre savoir, votre esprit de synthèse et votre ardeur ont
toujours suscité l’admiration de vos étudiants
Veuillez trouver, dans ce travail, le témoignage de ma haute considération
et de mon profond respect.
A notre maître et juge de thèse
Madame le Professeur Leila BENCHAKROUN
Professeur Agrégée de Biochimie
Je vous remercie pour votre patience, amabilité, gentillesse et votre
compréhension.
En témoignage de mon admiration pour vos qualités humaines et
professionnelles
Veuillez trouvez dans ce travail, l’expression de ma haute considération et
de mon profond respect.
LISTE
Liste des abréviations
ACMG : American College of Medical Genetics and Genomics ADN : Acide DésoxyriboNucléique
ADP : Adénosine DiPhosphate
ANSM : Agence Nationale de Sécurité du Médicament AUG : Codon de la Méthionine
BTD : Nom du gène qui code pour la biotinidase CHU : Centre hospitalier universitaire
DB : Déficit en biotiniase
EC : La Commission des enzymes (Enzyme Commission number), c’est une classification numérique des enzymes
H4K12BIO : Histone 4, 12éme lysine, biotine HCS : Holocarboxylase synthétase
hSMVT : Le transporteur de multivitamines sodium-dépendantes humaines
IgG : Immunoglobuline G
Kd : Kilo dalton
Km : Constante de Michaelis
Ng : Nano grame
nM : Nano mole
OMIM : Online Mendelian Inheritance in Man
Pb : Paire de base
T3 : Triiodothyronine
T4 : Thyroxine
LISTE
Liste des figures
Figure 1. Hydrolysation de la biocytine par la biotinidase pour libérer la biotine et permettre son recyclage. ...5 Figure 2. La structure chimique de la biotine ...7 Figure 3. Biotinylation des carboxylases. ...8 Figure 4. Le cycle de la biotine. ...9 Figure 5. Acétyl-CoA carboxylase 1 et acétyl-CoA carboxylase 2 ... 11 Figure 6 . Pyruvate carboxylase et acétyl-CoA carboxylase 1... 12 Figure 7. Carboxylases biotine-dépendant dans le métabolisme des acides aminés à chaîne ramifiée, des acides gras à chaîne impaire et du cholestérol. ... 13 Figure 8. Propionyl-CoA Carboxylase biotine dépendant dans le métabolisme de la méthionine et de la thréonine ... 14 Figure 9. Modèle de l'effet de la biotinylation sur la conformation du nucléosome. ... 16 Figure 10. Emplacement cytogénétique: 3p25.1. Localisation moléculaire: paires de bases 15 601 352 à 15 653 709 sur le chromosome 3. ... 18 Figure 11. La structure du gène de la biotinidase humaine BTD. ... 18 Figure 12. Schéma de la protéine biotinidase, basé sur l'ADNc ... 20 Figure 13. Les symptômes observés chez les patients non traités atteints du déficit en biotinidase... 24 Figure 14. Les symptômes observés chez un enfant indien de 3 ans.. ... 25 Figure 15. a, b. Tomodensitométrie (TDM) du cerveau d’un patient avec déficit en biotinidase... 32 Figure 16. Principe de dosage de l’activité de biotinidase par fluorescence dans les kits utilisant l’inducteur DELFIA116.. ... 50 Figure 17. Comparaison du nombre de maladies dépistées dans chacun des pays Européens entre 2004, 2007 et 2010., , ... 63
Liste des tableaux
Tableau I. Concentrations de quelques acides aminés et acides organiques dans le plasma et l'urine avant et après la supplémentation en biotine. ... 31 Tableau II. Apports nutritionnels conseillés en biotine selon l’âge. ... 34 Tableau III. La teneur de quelques aliments en biotine . ... 36 Tableau IV. Les gammes de référence pour l'activité de la biotinidase chez les différentes catégories d’individus.. ... 47
Liste des annexes
Annexe I – Carte de prélèvement française
Annexe II– Criteres pour un depistage neonatal systematique Annexe III - Tableaux des scores de L’ACMG
INTRODUCTION ...1 PARTIE I : BIOTINE ET DÉFICIT EN BIOTINIDASE ...3 CARACTERISTIQUES BIOCHIMIQUES ...4 1. La biotinidase ...5 2. La biotine ...7 2.1. Fonctions de la biotine ...7 2.1.1. La biotinylation ...7 2.1.2. Cofacteur enzymatique ... 10 2.1.3. Régulation de la structure de la chromatine et de l'expression des gènes ... 15 CARACTÉRISTIQUES MOLÉCULAIRES ... 17 1. La description du gène BTD ... 18 2. Les mutations pathogènes ... 19 L’ASPECT CLINIQUE ... 22 ÉPIDÉMIOLOGIE ... 27 TRAITEMENT ... 29 1. La supplémentation en biotine ... 30 2. Les sources de la biotine ... 34 2.1. Sources alimentaires ... 35 2.2. Synthèse bactérienne ... 36 2.3. Suppléments ... 37 3. Toxicité ... 37 4. Interactions ... 38
4.1. Les interactions alimentaires ... 38 4.2. Les interactions médicamenteuses ... 38 4.3. L’interférence de la biotine sur les immunodosages ... 39 PARTIE II : DIAGNOSTIC BIOCHIMIQUE ... 40 1. Dépistage néonatal... 41 2. Méthodes utilisées au laboratoire ... 42 3. Identification des patients par les tests enzymatiques ... 44 4. Exigences pré-analytiques ... 44 4.1. Type des échantillons ... 44 4.2. Volumes des échantillons ... 45 4.3. Conditions de transport, de manipulation et de stockage des échantillons ... 45 5. Méthodes de validation des résultats ... 46 5.1. Calibration et quantification ... 46 5.2. Gammes de référence ... 46 5.3. Personnel de laboratoire ... 48 6. Mesure de l’activité Biotinidase ... 48 6.1 Techniques colorimétriques ... 48 6.2 Techniques fluorimétriques ... 49 6.3 Autres méthodes analytiques ... 51 7. Exigences post-analytique ... 51 7.1. Interprétation des résultats ... 51 7.2. Diagnostic différentiel ... 54 7.3. Pièges et limites ... 55
7.3.1. La sensibilité... 55 7.3.2. La stabilité ... 55 7.3.3. Conditions pouvant provoquer une activité plasmatique de biotinidase faussement faible ... 56 7.3.4. Conditions pouvant provoquer une activité plasmatique faussement élevée de la biotinidase ... 56 7.4. Compte-rendu ou rapports ... 57 8. L’étude moléculaire ... 58 DISCUSSION ... 60 CONCLUSION ... 66 RESUMES ... 68 ANNEXES ... 72 BIBLIOGRAPHIE ... 81
1
2
Le déficit en biotinidase (DB, OMIM: 253260), également connue sous le nom de déficit multiple en carboxylases à début tardif, est une maladie rare autosomique récessif héréditaire du recyclage de la biotine, découverte en 19811. Le trouble est dû à des mutations pathogènes du gène BTD responsables d’une activité absente ou réduite de la biotinidase, Il existe plus de 150 mutations connues du gène BTD à l'origine d'un déficit en biotinidase2.
La biotinidase (EC 3.5.1.12) est une enzyme cytosolique qui libère la biotine libre de la biocytine pendant la dégradation protéolytique des holocarboxylases et d'autres protéines biotinylées3.
La biotine est une vitamine essentielle qui sert de coenzyme pour cinq carboxylases (propionyl-COA carboxylase, 3-méthylcrotonyl-COA carboxylase, pyruvate carboxylase et acétyl-COA carboxylases 1 et 2) chez l'homme. Ces enzymes jouent un rôle clé dans la néoglucogenèse, le catabolisme des acides aminés à chaîne ramifiée et la synthèse des acides gras, et soulignent l'importance de la biotine dans l'homéostasie métabolique4, 5. Les anomalies de ces voies causent plusieurs troubles, notamment convulsions, retard mental, hypotonie, troubles cutanés, ataxie, perte auditive, des problèmes oculaires et des anomalies biochimiques pouvant conduire au coma et à la mort6, 7. La thérapie à la biotine est un traitement efficace avant l’apparition des symptômes.
Le déficit est détecté par le dépistage systématique des nouveau-nés, s'il est disponible. Sinon, le diagnostic repose sur les signes cliniques et il est confirmé par la mise en évidence de la faible activité sérique de la biotinidase8. Le séquençage du gène de la biotinidase est une méthode supplémentaire utilisée pour détecter les mutations en cause et confirmer le déficit.
Plusieurs programmes de dépistage néonatal aux États-Unis et dans de nombreux autres pays du monde incluent le déficit en biotinidase dans leur panel. Au Maroc il y a un programme de dépistage néonatal débutant. Celui-ci ne concerne que l’hypothyroïdie congénitale. Il est donc nécessaire de définir et de normaliser les approches de laboratoire pour le test de biotinidase enzymatique, et de caractériser les variables qui peuvent influencer la performance des tests et l'interprétation des résultats. Notre travail est une initiation à la démarche diagnostique de cette pathologie encore méconnue dans notre pays.
3
PARTIE I :
BIOTINE ET DÉFICIT
EN BIOTINIDASE
4
CARACTERISTIQUES
BIOCHIMIQUES
5
1. La biotinidase
La biotinidase (EC 3.5.1.12) est une glycoprotéine de 76 kDa, détectable dans plusieurs tissus, y compris le sérum, les leucocytes, les fibroblastes et le foie9.
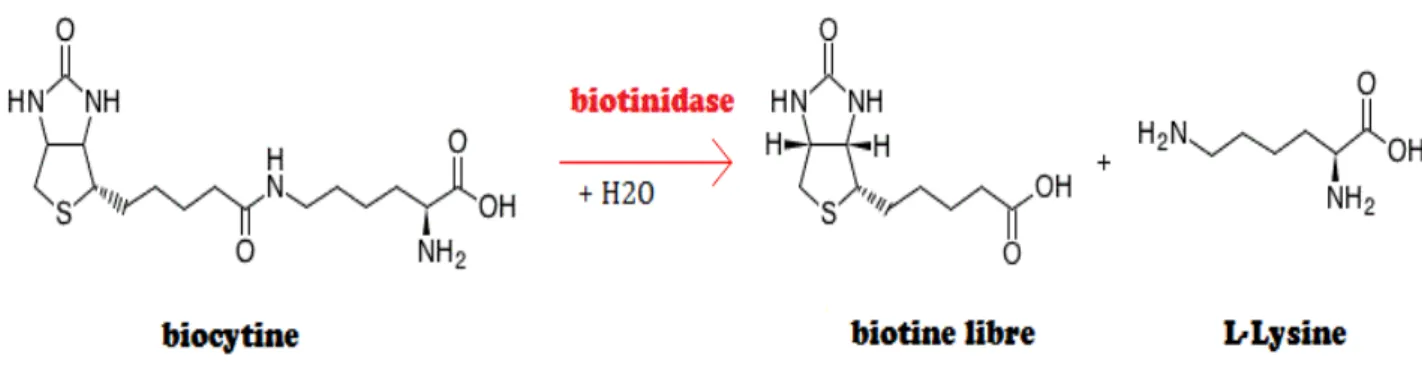
Dans le corps humain, la biotine est un cofacteur vital pour plusieurs carboxylases, où elle est attachée au groupe ε-amino d'un résidu de lysine10, 11. Pour libérer cette biotine, , la biotinidase ou biotine-amide amidohydrolase hydrolyse naturellement la biocytine (ε-N-biotinyllysine) en biotine et en lysine (Figure 1)10, 12. L'enzyme monomère sert non seulement à recycler la biotine pour une utilisation renouvelée, mais aussi à rendre biodisponible la biotine liée aux protéines dans les aliments12, Les premières études ont montré que le déficit en biotinidase entraîne une grande excrétion rénale de la biotine et de la biocytine et suggère que la biotinidase pourrait agir comme une navette pour la biotine dans l’organisme13. Son rôle en tant que protéine liant la biotine a également été suggéré par les grandes quantités de biotinidase présentes dans le sérum (environ 25 nM). Cette concentration est au moins 12 fois supérieure à la concentration totale de biotine libre et liée dans le sérum (environ 2 nM)14.
Figure 1. Hydrolysation de la biocytine par la biotinidase pour libérer la biotine
6
Le déficit en biotinidase provoque ainsi une déficience en carboxylase multiple, qui, pour sa part, entraîne un retard de développement important parce que l’organisme n'a plus la biotine libre nécessaire pour reconstituer son besoin en holocarboxylase, un traitement efficace est facilement accompli en administrant des doses quotidiennes de biotine libre11(voir traitement ci-dessous).
La biotinidase est omniprésente dans tout le corps humain. Son activité spécifique est la plus élevée dans le sérum (5.80 ± 0.89 nmol min-1 mL-1)15, suivie par d'autres organes, y compris le foie, où l'enzyme est produite.
Alors que la biotinidase était considérée comme assez spécifique pour la biocytine12, des preuves ont montré que ce n'est pas le cas16. Ainsi, elle peut également hydrolyser d'autres conjugués biotine amide ou ester, tels que l'ester méthylique17 ou le conjugué avec le p-aminobenzoate, qui constitue la base d'un test d'activité colorimétrique12, 13.
La biotinidase agit principalement sur la biocytine ou de petits oligopeptides portant de la biotine in vivo, puisque son activité diminue rapidement avec l'augmentation de la longueur du peptide; elle est finalement incapable de couper la biotine des holocarboxylases10. Cependant, d'autres études ont montré que l'enzyme est capable d'agir sur des protéines intactes, telles que les IgG biotinylées18 et les histones19, et fonctionne comme une biotinyl transférase capable de biotinyler des protéines spécifiques ou de petites molécules accepteurs20 qui à leur tour ont probablement des fonctions physiologiques. L'étude de ces nouvelles fonctions de la biotinidase devrait permettre de mieux comprendre son rôle dans le métabolisme de la biotine, dans le déficit en biotinidase et comme paradigme pour comprendre le métabolisme des autres vitamines.
7
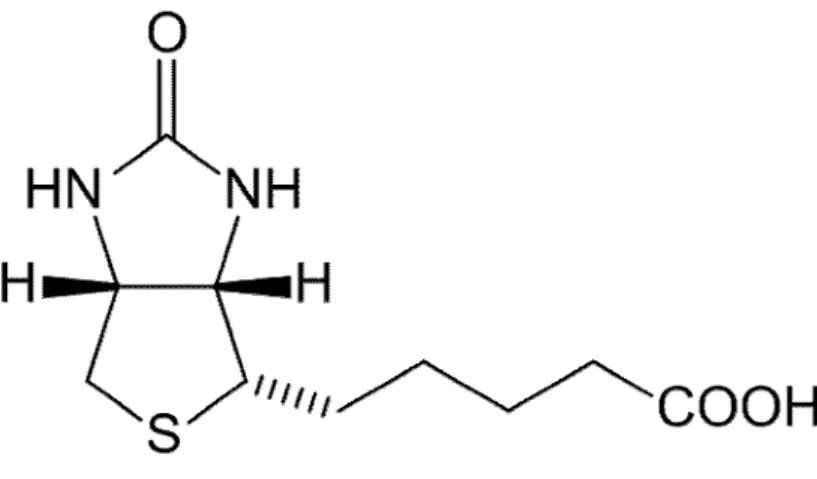
2. La biotine
Figure 2. La structure chimique de la biotine
La biotine généralement classée comme vitamine B-complexe, appelée souvent B8 en France et vitamine H, et vitamine B7 dans de nombreux pays, notamment en Allemagne et dans les pays anglo-saxons, est un micronutriment hydrosoluble constitué d’un noyau imidazoline et d’un cycle tétrahydrothiophène porteur d’une chaîne latérale à cinq atomes de carbone.
Après sa découverte en 1927, 40 années de recherches supplémentaires ont été nécessaires pour établir sans équivoque la biotine en tant que vitamine21.
2.1.
Fonctions de la biotine
2.1.1.
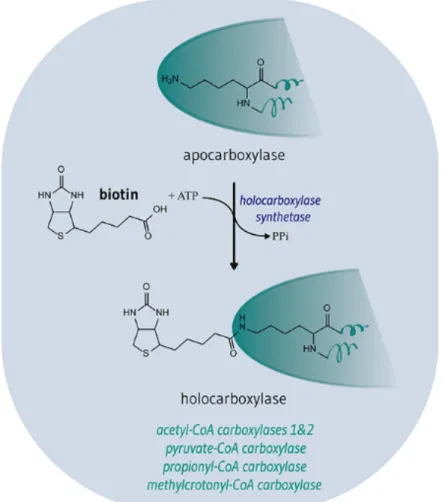
La biotinylation :
La biotine fonctionne comme un cofacteur lié de manière covalente requis pour l'activité biologique des cinq carboxylases biotine-dépendantes connues (voir ci-dessous). La liaison covalente de la biotine à l'apocarboxylase (c'est-à-dire une carboxylase catalytiquement inactive) est catalysée par l'enzyme holocarboxylase synthétase (HCS). Le terme "biotinylation" désigne l'addition covalente de biotine à des molécules quelconques, y compris des apocarboxylases et des histones. HCS catalyse la biotinylation post-traductionnelle du groupe amino epsilon d'un résidu de lysine au site actif de chaque
8
apocarboxylase, convertissant l'apocarboxylase inactive en une holocarboxylase complètement active (Figure 3).
Figure 3. Biotinylation des carboxylases22. Cinq carboxylases exigent la biotine pour leurs activités biologiques: acétyl-CoA carboxylase 1 et 2, pyruvate-CoA carboxylase, propionyl-CoA carboxylase,
3-méthylcrotonyl-CoA carboxylase. CoA, coenzyme A ; ATP, adénosine triphosphate ; PPi, pyrophosphate inorganique.
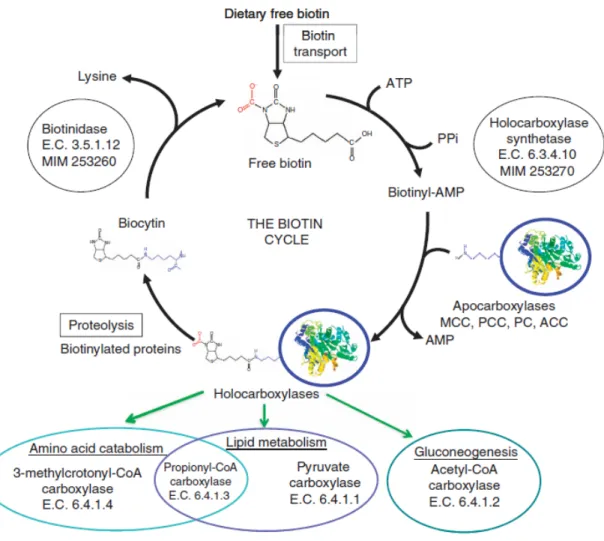
Des résidus de lysine particuliers dans la queue N-terminale d'histones spécifiques, peuvent également être biotinylés23. La biotinidase catalyse la libération de la biotine à partir des histones biotinylées et des produits peptidiques de la dégradation protéolytique des holocarboxylases ce qui la rend disponible pour une autre réutilisation (voir le cycle de biotine, figure 4).
9
Figure 4. Le cycle de la biotine24. La biotine libre, dont la principale source est le régime alimentaire, est activement transportée à travers la membrane intestinale et la barrière hémato-encéphalique. Cette
réserve de biotine libre fournit de la biotine aux diverses apocarboxylases (pyruvate carboxylase, acétyl-CoA carboxylase1 et 2, propionyl-CoA carboxylase et bêta-méthylcrotonyl-CoA carboxylase).
L'holocarboxylase synthétase transforme les apocarboxylases en holocarboxylases actives en liant de manière covalente la biotine à leurs sites actifs. Ces carboxylases sont importantes pour la néoglucogenèse, la synthèse des acides gras et le catabolisme de plusieurs acides aminés à chaîne ramifiée. Finalement, les holocarboxylases sont dégradées de manière protéolytique en biocytine ou en petits biotinyl-peptides. Ces composés sont en outre clivés par la biotinidase pour produire de la lysine
et de la biotine libre, qui réintègre le réservoir de biotine libre, recyclant ainsi la vitamine. ACC, acétyl-CoA carboxylase; AMP, adénosine monophosphate; ATP, adénosine triphosphate; CoA ,coenzyme A ; MCC, 3-méthylcrotonyl carboxylase; PC, pyruvate carboxylase; PCC,
10
2.1.2.
Cofacteur enzymatique :
Cinq carboxylases catalysent des réactions métaboliques essentielles:
Deux enzymes intracytoplasmiques ; l’acétyl-CoA carboxylase 1 et 2, et 3 enzymes intramitochondriales ; la pyruvate carboxylase, la propionyl-CoA carboxylase et la méthylcrotonyl-CoA carboxylase.
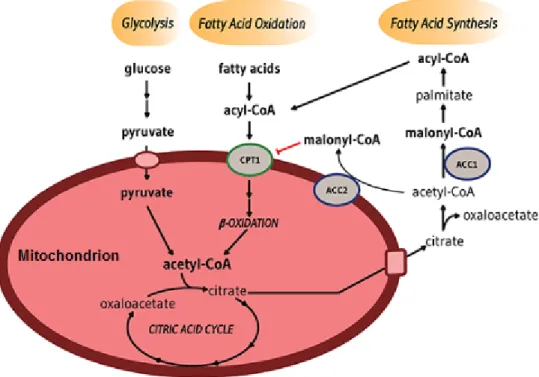
• L'acétyl-Coenzyme A (CoA) carboxylase 1 (ACC1) et l'acétyl-CoA carboxylase 2 (ACC2) catalysent la conversion de l'acétyl-CoA en malonyl-CoA en utilisant le bicarbonate et l'ATP; Le malonyl CoA générée via ACC1 est un substrat limitant la vitesse de synthèse des acides gras dans le cytosol, et le malonyl CoA généré via ACC2 inhibe CPT1, une enzyme membranaire mitochondriale externe importante dans l'oxydation des acides gras (Figure 5). ACC1 est trouvée dans tous les tissus et est particulièrement active dans les tissus lipogéniques (c'est-à-dire, le foie, le tissu adipeux blanc et la glande mammaire), le cœur et les îlots pancréatiques. ACC2 est particulièrement abondante dans le muscle squelettique et le coeur25.
11
Figure 5. Acétyl-CoA carboxylase 1 et acétyl-CoA carboxylase 222. Dans le cytosol des cellules du foie, les acides gras sont convertis en acyl-CoA, et le glucose subit une glycolyse qui produit du pyruvate. Acyl-CoA est transporté dans les mitochondries via le transport médié par CPT1 et subit une
β-oxydation qui génère de l'acétyl-CoA. De plus, le pyruvate est converti en acétyl-CoA dans les mitochondries et l'acétyl-CoA est condensé avec l'oxaloacétate pour former du citrate. Ce dernier peut
être exporté vers le cytosol et clivé en oxaloacétate et en acétyl-CoA. L'acétyl-CoA est utilisée pour générer le malonyl-CoA dans une réaction catalysée par l'acétyl-CoA carboxylase 1 (ACC1) en présence de la biotine, d'ATP et de bicarbonate. Le malonyl-CoA est un substrat essentiel pour la biosynthèse des acides gras et des triglycérides, des phospholipides et des lipoprotéines. Le malonyl-CoA est également un régulateur de la β-oxydation des acides gras. En effet, la malonyl-malonyl-CoA générée à partir de l'acétyl-CoA par l'acétyl-CoA carboxylase 2 (ACC2), en présence de la biotine, localisée à la membrane mitochondriale externe, diminue la β-oxydation des acides gras dans les mitochondries
en inhibant le CPT1. ACC1, acétyl-coenzyme A carboxylase 1; ACC2, acétyl-coenzyme A carboxylase 2; CoA, coenzyme A; CPT1, carnitine / palmitoyl-transférase 1
12
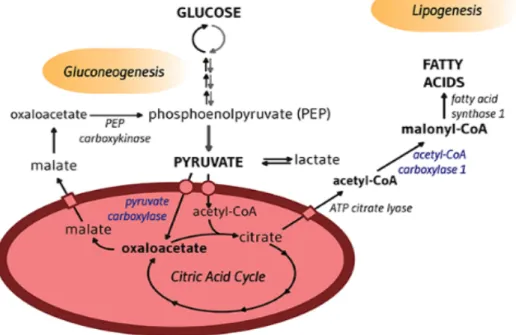
• La pyruvate carboxylase est une enzyme clé dans la néoglucogenèse - la formation de glucose à partir d'autres sources que les hydrates de carbone, tels que le pyruvate, le lactate, le glycérol et les acides aminés glycogéniques. La pyruvate carboxylase liée à la biotine catalyse l'incorporation de bicarbonate en présence d’ATP dans le pyruvate, produisant de l'oxaloacétate; par conséquent, la pyruvate carboxylase est anaplérotique pour le cycle de l'acide citrique (figure 6). L'oxaloacétate peut ensuite être converti en phosphoénolpyruvate et éventuellement en glucose.
Figure 6 . Pyruvate carboxylase et acétyl-CoA carboxylase 122. La pyruvate carboxylase biotine dépendante fournit le cycle de l'acide citrique avec l'oxaloacétate en catalysant la conversion du pyruvate en oxaloacétate en utilisant du bicarbonate et de l'ATP. Dans le foie, l'oxaloacétate peut être utilisé comme précurseur de la néoglucogenèse. Il est d'abord converti en phosphoénolpyruvate (PEP)
par la PEP carboxykinase puis en glucose par la voie inverse de la glycolyse. Dans le cycle de l'acide citrique, l'oxaloacétate peut également être condensé avec l'acétyl-CoA pour produire du citrate, qui peut être exporté à partir des mitochondries. Dans le foie, le tissu adipeux et le muscle squelettique, le
citrate est clivé en oxaloacétate et en acétyl-CoA dans le cytosol. L'acétyl-CoA est converti en malonyl-CoA par une autre enzyme biotine dépendante, l'acétyl-CoA carboxylase 1. Le malonyl-CoA
13
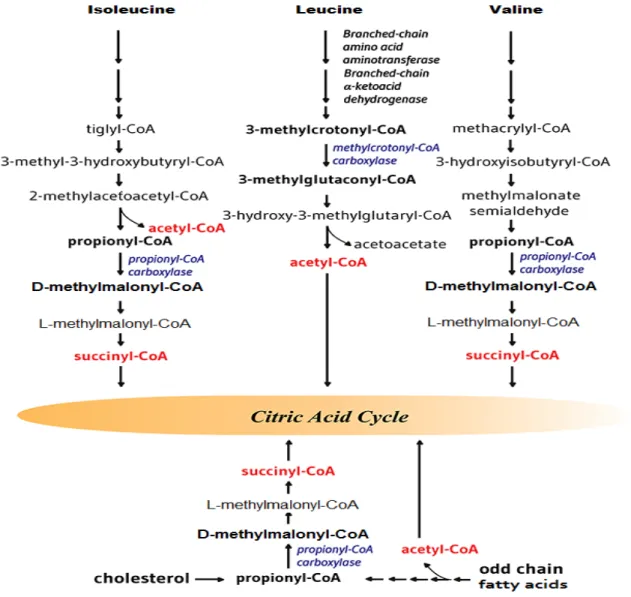
• La méthylcrotonyl-CoA carboxylase catalyse une étape essentielle dans le catabolisme de la leucine, un acide aminé à chaîne ramifiée essentiel. Cette enzyme biotine dépendante catalyse la transformation de méthylcrotonyl-CoA en 3-méthylglutaconyl-CoA (figure 7).
Figure 7. Carboxylases biotine-dépendant dans le métabolisme des acides aminés à chaîne ramifiée,
des acides gras à chaîne impaire et du cholestérol22. Deux enzymes biotine-dépendant, à savoir la propionyl-CoA carboxylase et la méthylcrotonyl-CoA carboxylase, sont nécessaires dans le métabolisme des acides aminés à chaîne ramifiée (leucine, valine et isoleucine), l'oxydation des acides
gras à chaîne impaire et la dégradation du cholestérol. Les voies métaboliques génèrent de l'acétyl-CoA et du succinyl-l'acétyl-CoA, qui entrent ensuite dans le cycle de krebs.
14
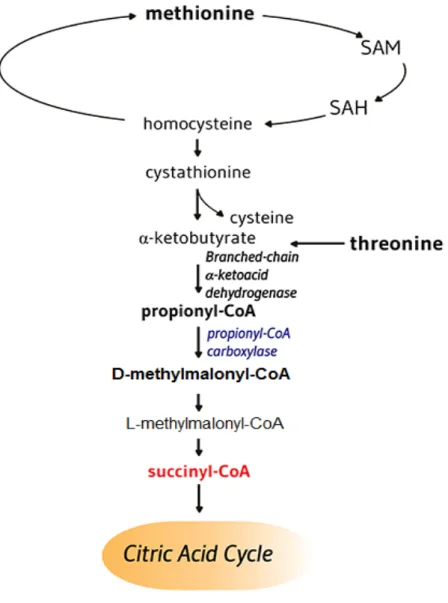
• Propionyl-CoA carboxylase produit D-methylmalonyl-CoA à partir de propionyl-CoA, un sous-produit de la β-oxydation des acides gras avec un nombre impair d'atomes de carbone (figure 7). La conversion du propionyl-CoA en D-methylmalonyl-CoA est également nécessaire dans les voies cataboliques de deux acides aminés à chaîne ramifiée (isoleucine et valine), la méthionine, la thréonine et la chaîne latérale du cholestérol (figure 7 et 8).
Figure 8. Propionyl-CoA Carboxylase biotine dépendant dans le métabolisme de la méthionine et de
la thréonine22. La propionyl-CoA carboxylase convertit le propionyl-CoA en D-methylmalonyl-CoA dans le métabolisme de la méthionine et de la thréonine. CoA, coenzyme A; SAH,
15
En cas de manque en biotine la fonction de ces carboxylases est bloquée ce qui est à l’origine de l’accumulation des acides pyruvique, propionique et méthylcrotonique.
2.1.3.
Régulation de la structure de la chromatine et de l'expression
des gènes
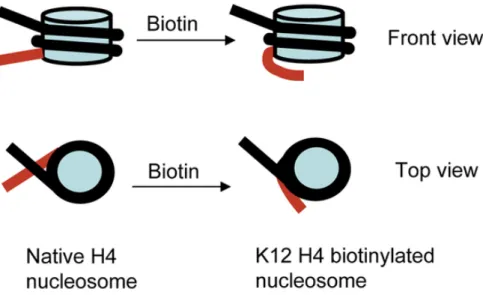
Dans les noyaux eucaryotes, l'ADN est emballé dans des structures compactes pour former des nucléosomes - unités fondamentales de la chromatine. Chaque nucléosome est composé de 147 paires de bases d'ADN enroulées autour de huit histones (histones appariées: H2A, H2B, H3 et H4). Une autre histone, appelée linker H1, est située à la surface externe de chaque nucléosome et sert d'ancrage pour fixer l'ADN autour du noyau de l'histone. L'emballage compact de la chromatine doit être assoupli de temps en temps pour permettre aux processus biologiques, tels que la réplication de l'ADN et la transcription, de se produire. Les modifications chimiques de l'ADN et des histones affectent le repliement de la chromatine, augmentant ou réduisant l'accessibilité de l'ADN aux facteurs impliqués dans les processus mentionnés ci-dessus. Avec la méthylation de l'ADN, un certain nombre de modifications chimiques dans la queue N-terminale des histones du noyau modifient leur charge électrique et leur structure, modifiant ainsi la conformation de la chromatine et l'activité transcriptionnelle des gènes.
Les diverses modifications des queues d'histone, y compris l'acétylation, la méthylation, la phosphorylation, l'ubiquitination, la SUMOylation (pour Small Ubiquitin-like MOdifier), l'ADP-ribosylation, la carbonylation, la désamination, l'hydroxylation et la biotinylation, ont des fonctions régulatrices différentes. Plusieurs sites de biotinylation ont été identifiés dans les histones H2A, H3 et H426. Parmi eux, la biotinylation de l'histone H4 à la lysine (K) 12 (noté H4K12bio) semble enrichie en hétérochromatine, une chromatine fortement condensée. Il a été montré sans ambiguïté que la biotinylation de l'histone H4 à K12 conduit à une augmentation statistiquement significative de la longueur de l'ADN enroulé autour de l'octamère de l'histone. Cette modification de la structure nucléosomique est représentée schématiquement sur la figure 9. Comparée à la longueur de 147 pb de l'ADN enroulé autour des nucléosomes formés avec H4 non-biotinylé, la biotinylation en position 12 augmente la longueur de l'ADN enroulé à une moyenne de 167 pb, ce qui correspond à l'ajout de près de 0,2 tour nucléosomique27.
16
Figure 9. L'effet de la biotinylation sur la conformation du nucléosome27. Vue de profil et d’en haut. Le segment du bras d'ADN qui subit l'enroulement supplémentaire est représenté en rouge.
Une telle augmentation substantielle de la longueur de l'ADN enroulé devrait conduire à une stabilité élevée des nucléosomes et est congruente avec les études fonctionnelles démontrant un rôle pour la biotinylation des histones dans la répression transcriptionnelle.
De plus, les marques de biotinylation co-localisent avec des marques de répression de gènes bien connues comme la lysine 9 méthylée dans l'histone H3 (H3K9me) dans la chromatine transcriptionnellement compétente28. Dans ce cas, l’H4K12bio peut être trouvé sur le promoteur du gène SLC5A6 qui code pour le transporteur médiant l'absorption de la biotine dans les cellules, le transporteur de multivitamines sodium-dépendant humain (hSMVT). Lorsque la biotine est abondante, la holocarboxylase synthétase peut biotinyler les histones H4 dans le promoteur SLC5A6, ce qui interrompt la synthèse du hSMVT et réduit l'absorption de la biotine. Inversement, dans les cellules pauvres en biotine, les marques de biotinylation dans le promoteur SLC5A6 sont éliminées de telle sorte que l'expression génique peut se produire, permettant la synthèse de hSMVT et augmentant ainsi l'absorption de la biotine29.
17
CARACTÉRISTIQUES
MOLÉCULAIRES
18
1. La description du gène BTD
La biotinidase est une enzyme monomère comprenant 543 résidus d'acides aminés, dont 41 acides aminés d'un peptide signal potentiel30,31. Elle est codée par un seul gène (BTD) isolé et
séquencé en 1994 par Cole et ses collègues de travail, situé sur le chromosome 3p25.
Figure 10. Emplacement cytogénétique: 3p25.1. Localisation moléculaire: paires de bases 15 601 352
à 15 653 709 sur le chromosome 3 (Homo sapiens Annotation Release 108, GRCh38.p7)32.
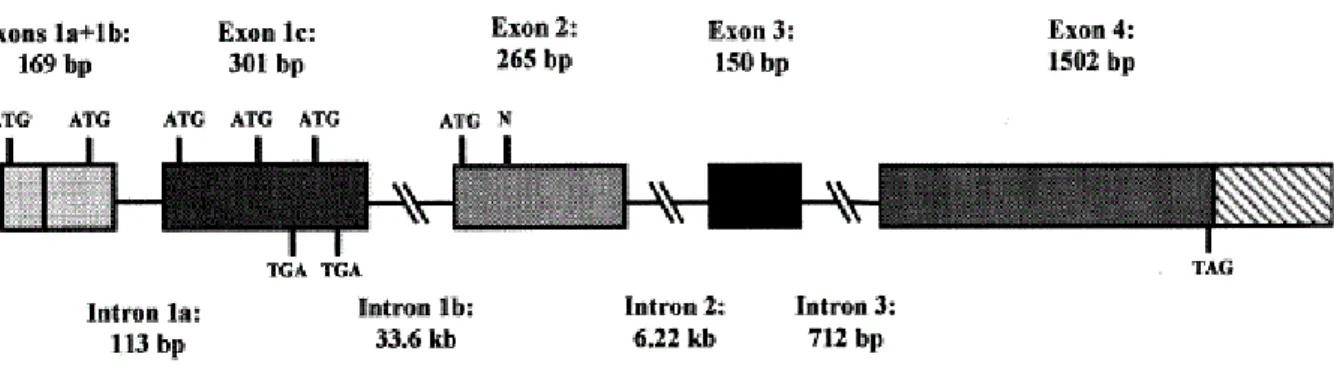
Le gène mesure au moins 23 kilobases et contient quatre exons, numérotés de 1 à 4, avec des tailles de 79, 265, 150 et 1502 bp, respectivement, et trois introns (figure 11), reflétant une organisation structurelle simple qui facilite le séquençage du gène pour génotyper les patients33.
Figure 11. La structure du gène de la biotinidase humaine BTD. Les quatre exons sont représentés par
des cases ombrées. Les TGA et ATG sont des codons d'arrêt. N représente la localisation du peptide N-terminal de la forme mature sécrétée de la biotinidase humaine34.
19
Il existe deux codons AUG d'initiation de la traduction, un dans l'exon 1 et l'autre dans l'exon 2, ce dernier contient la méthionine N-terminale de l’enzyme mature33. Les séquences en amont de l’exon 1 et 2 contiennent des éléments promoteurs compatibles avec l'expression omniprésente de la biotinidase. La présence d'un intron entre les deux codons d'initiation possibles pourrait permettre un épissage alternatif, augmentant la possibilité d'une expression spécifique au tissu de différents transcrits de BTD. À l'appui de cette idée, une séquence consensus pour le facteur de transcription spécifique du foie HNF-5 est présente à la position du nucléotide - 352, bien que son signification physiologique soit inconnue.
L’exon 4 est le plus grand exon et contient le site actif de l'enzyme35, 36, là où la plupart des mutations ont été trouvées37.
2. Les mutations pathogènes
Trois bases de données de variantes de biotinidase accessibles au public sont en ligne: o la base de données Leiden Open Variation Database
(https://databases.lovd.nl/shared/genes/BTD )
o ClinVar (https://www.ncbi.nlm.nih.gov/clinvar/?term=BTD%5Bgene%5D)
o "Biotinidase Deficiency and BTD", hébergé par les laboratoires ARUP (http://www.arup.utah.edu/database/BTD/BTD_display.php)
Plus de 200 variantes de biotinidase sont enregistrées dans la base de données ARUP, ces variantes peuvent être caractérisées comme des mutations s’il est démontré que le nouveau variant entraîne une réduction marquée de l'activité biotinidase, plus de 150 étant classées comme pathogènes; les changements faux-sens sont les plus répondus et comprennent 145 des 204 variantes énumérés38, 39. Quatre variantes pathogènes communes causent un déficit profond en biotinidase40. Parmi les enfants identifiés en raison de symptômes cliniques, les deux mutations les plus fréquemment rapportées sont une délétion de sept bases / insertion de trois bases (c .98_104delinsTCC)/G98:d7i3 dans l'exon 2 qui conduit à un codon d'arrêt prématuré (Figure 12. B), survenant dans au moins un allèle chez environ 50% des individus, et p.Arg538Cys dans l'exon 4, survenant au moins une fois chez
20
30% des enfants symptomatiques41, 42. Chacune de ces variantes conduit à l'absence complète de protéine biotinidase.
D'autres mutations relativement courantes découvertes par le dépistage des nouveau-nés sont p.Gln456His, associée à un déficit profond, et p.Asp444His, une substitution qui réduit l'activité enzymatique d'environ 50% 43, 44. La variante p.Asp444His en trans avec une variante pathogène BTD sévère est associé à une déficience partielle en biotinidase, tandis qu'en cis avec p.Ala171Thr (c'est-à-dire en tant que double mutant p. [(Ala171Thr); (Asp444His)]), aboutit à un allèle profondément déficitaire en biotinidase45, cette double mutation [A171T; D444H] (Figure 12. A) est le deuxième allèle le plus fréquent chez les enfants de dépistage néonatal, survenant chez 17,3% des allèles40.
Figure 12. Schéma de la protéine biotinidase, basé sur l'ADNc 40, montrant la localisation de chaque mutation. A, Mutations trouvées seulement chez les enfants ayant un déficit en biotinidase profond
identifié par les programmes de dépistage néonatal aux États-Unis. B, Mutations trouvées chez les enfants identifiés à la fois cliniquement et par le dépistage néonatal. C, Mutations trouvées seulement
chez les enfants symptomatiques. Les flèches dans le cadre représentent les deux codons d'initiation. La ligne verticale en gras indique l'emplacement de l'extrémité N-terminale de l'enzyme mature. De fines lignes verticales délimitent des régions de résidus codées par les exons 1-4. Les emplacements des résidus de cystéine sont indiqués par un "C" gras, et les six sites de glycosylation N-liés sont notés
21
Le séquençage du gène BTD peut être ciblé sur les variantes pathogènes les plus courantes ou analysés de manière exhaustive par séquençage direct et inverse des exons et des régions introniques adjacentes. Le séquençage complet du gène BTD est plus commun pour confirmer le statut et sera probablement utilisé davantage à mesure que le coût des tests diminue.
Une carte de gènes publiée dans European Journal of Human Genetics propose des considérations sur les tests moléculaires46, 47. Initialement, la plupart des enfants symptomatiques présentant un déficit en biotinidase avaient 3% de l'activité moyenne de la biotinidase sérique d'individus normaux48. Trois écarts-types au-dessus de cette moyenne, correspondant à 10% de l'activité normale moyenne, ont été pris comme seuil en dessous duquel les individus étaient considérés comme ayant une déficience profonde en biotinidase.
Après l'introduction du dépistage néonatal de la déficience en biotinidase en Etats Unis, Pays-Bas, Canada et bien dans d’autre pays, il a été déterminé que Dans un grand nombre de cas, le phénotype correspond bien aux mutations trouvées, et que pratiquement la majorité des enfants avaient la mutation p.Asp444His dans l'un de leurs allèles, avec l'enzyme aberrante résultante contribuant à environ 50% de l'activité normale49. Cette variante, associée à une variante de la déficience profonde de l'autre allèle, conduit à 10-30% de l'activité biotinidase normale moyenne50. Ces enfants sont considérés comme présentant un déficit partiel en biotinidase.
En fin de compte, La plupart des cas «profonds» présentaient deux mutations sévères, la plupart des cas «partiels» présentaient au moins une légère mutation et les nouveau-nés «normaux» une mutation ou aucune, en d'autres termes, ils étaient porteurs ou juste «normaux». Certains nouveau-nés «normaux» ont eu une ou deux mutations bénignes51.
22
23
La présentation clinique initiale et l'expression ultime du déficit en biotinidase profond sont très variables, même au sein de la même famille52. Les symptômes chez les patients non traités apparaissent généralement entre 2 et 5 mois, mais peuvent ne pas être évidents qu’après plusieurs années53.
Plus de 70% des enfants cliniquement confirmés manifestent des convulsions, une hypotonie, une éruption cutanée ou une alopécie à un certain moment avant d’être diagnostiqués et traités. Environ la moitié des enfants souffrent d'ataxie, retard de développement, conjonctivite et problèmes visuels, y compris l'atrophie optique 53. Plus des trois quarts des enfants symptomatiques développent une perte auditive54 (Figures 13 et 14). La perte auditive, les anomalies visuelles et les retards de développement semblent être irréversibles une fois qu'ils surviennent, même après traitement à la biotine55.
24