ةيبعشلا ةيطارقوميدلا ةيرئازجلا ةيروهمجلا يملعلا ثحبلا و يلاعلا ميلعتلا ةرازو
République Algérienne Démocratique et populaire
Ministère de l’Enseignement Superieur et de la Recherche Scientifique يحي نب قيدصلا دوحه تعهاج
-لجيج
Université Mohammed Seddik Ben Yahia- Jijel
Faculté des Sciences de la Nature et de la Vie ةايحلا و تعيبطلا مولع تيلك تيذغتلا مولع و تيقيبطتلا ايجولويبوركيولا نسق Département de Microbiologie Appliquée et
des Sciences Alimentaires
Mémoire De fin D’études
En vue de l’obtention du diplÔme:
Master Académique en BiologieOption : Microorganisme et Pathogénécité
Thème
Comparaison de l’effet antibactérien de l’extrait
n-butanolique et des produits purs isolés de la
plante endémique Stachys circinnata I’Her.
Membres de jury : Présenté par :
Président : Mr Rahmoune Y. Melle Salem Ahlem Examinatrice : Mme Benhamada W. Melle Filali Sabrina
Encadreur : Dr Laggoune S.
Année universitaire : 2016-2017
Sommaire
Remerciements Dédicaces
Liste des figures Liste des abréviations Liste des tableaux
Introduction ……… 1
Partie Bibliographique Chapitre I : Généralités sur Stachys circinnata I’Her. I.1. Introduction……… 3
I.2. Aspect botanique ………... 3
I.3. Distribution géographique ………. 3
I.4. Taxonomie ………. 3
I.5. Utilisation en médecine traditionnelle ………... 4
I.6. Étude chimique ……….. 4
I.6.1. Composition en métabolites secondaires ……… 4
I.6.1.1. Les flavonoïdes………. 4
I.6.1.2. Les terpènes………. 6
I.6.1.3. Les phénylpropanoïdes ……… 7
Chapitre II : Etude descriptive des bactéries étudiées II.1. Généralités sur les bactéries ………. 8
II.1.1. Historique ……….. 8
II.1.2. Définition ……….. 8
II.1.3. Description des souches étudiées………... 8
II.1.3.1. Bactéries à Gram négatif………. 8
II.1.3.2. Bactéries à Gram positif……….. 10
Partie expérimentale Chapitre III : Matériel et méthodes III.1. Matériel ………... 12
III.1.1. Matériel végétal ……….. 12
III.1.2. Matériel bactériologique ………... 12
III.1.3. Milieux de culture ………... 12
III.2. Méthodes………... 13
III.2.1. Préparation de l’extrait n-butanolique de Stachys circinnata l’Her ……… 13
III.2.2. Identification des souches bactériennes ………... 14
III.2.2.2. Examen microscopique………... 14
III.2.2.3. Tests biochimiques ………. 14
III.2.3. Evaluation de l’activité antibactérienne………. 16
III.2.3.1. Repiquage des souches bactériennes………. 16
III.2.3.2. Préparation de l’inoculum……….. 16
III.2.3.3. Préparation des dilutions ………... 17
III.2.3.4. Test de sensibilité des bactéries………. 18
III.2.3.5. Détermination de la CMI………... 18
Chapitre IV : Résultats et discussions IV.1. Résultats ……….. 20
IV.1.1. Résultats de l’extraction ………... 20
IV.1.2. Identification macroscopique des souches………. 20
IV.1.3. Identification microscopique des souches……….. 21
IV.2. Evaluation de l’activité antibactérienne……… 23
IV.2.1. Résultats du test de sensibilité……….. 23
IV.2.2. Détermination de la concentration minimale inhibitrice………... 26
IV.3. Discussion ... 29 Conclusion……….. 32 Glossaire Références bibliographiques Annexes
Remerciement
Nous remercions tout d’abord ALLAH le tout puissant de nous avoir donné
la santé, la patience, la puissance et la volonté pour réaliser ce travail.
Nous tenons particulièrement à remercier notre promotrice, Dr Laggoune
Souheila pour avoir accepté la charge d’être rapporteur de ce mémoire, nous la
remercions pour sa disponibilité, ses pertinents conseils et de nous avoir guidé
durant la préparation de notre mémoire de Master. Qu’elle trouve ici
l’expression de notre reconnaissance et de notre respect.
Nos vifs remerciements pour les membres de jury à commencer par
Mr Rahmoune, qui nous a fait l’honneur de présider notre jury. Qu’il trouve ici
l’expression de notre profond respect.
A M
meBenhamada, d’avoir accepté d’examiner ce modeste travail et de lui
attribuer des remarques et des corrections très intéressantes.
Un merci collectif à tous les enseignants qui nous ont suivis tout au long de
note formation.
Un grand merci à tous ceux qui ont rendu l’ambiance si agréable au sein de
notre promotion nous les avons remercié pour les excellents moments passés
ensemble.
À ceux et à celles qui nous ont aidés d’une façon ou d’une autre, de près ou
de loin dans notre travail, nous les remercions du fond du cœur.
Dédicace
Je dédie ce travail avant tout :
♥ A ma mère, mon rayon de soleil ♥
♥A mon père l’être le plus cher ♥
♥ A mes frères et sœurs mon unique trésor ♥
♥ A mes ami(e)s…….♥
♥A mon encadreur : Dr Laggoune S. ♥
Dédicace
Je tiens à dédier ce modeste travail :
A mon cher papa ♥ Mohammed ♥ école de mon enfance, qui a été
mon ombre durant toutes les années d’études et a mis à ma disposition
tous les moyens nécessaires pour que je réussisse, et qui a veillé tout
au long de ma vie à m’encourager, à me donner de l’aide et à me
protéger.
A ma chère maman ♥ Hassina ♥ qui m’a donné la vie, le symbole
de tendresse, qui s’est sacrifiée pour mon bonheur et ma réussite, quoi
que je fasse, je ne pourrais te rendre ce que tu as fait pour moi.
A mes chères sœurs Asma, Wided et ses petits, Ibtissem et Loubna qui
m’ont soutenu par leur précieux encouragements.
A mon cher frère Amine.
A tous mes amies, mes collègues de promotion.
A mon encadreur Dr Laggoune Souheila.
Liste des figures
N° de la figure Titre de la figure N° de la page Figure I.1 Photographie de S. circinnata I’Her.
3
Figure I.2 Squelette de base des flavonoïdes
4
Figure I.3 Squelette de base des terpènes (Isoprène)7
Figure I.4 Structure de phénylpropanoïde exemplede l’acide coumarique
7
Figure III.a La plante séchée
12
Figure III.b La plante fraiche12
Figure III.2 Les étapes de l’extraction n-butanoliquede l’espèce S. circinnata I’Her.
13
Liste des abréviations
Abréviation
Désignation
AcOEt Acétate d’éthyle ADH Arginine Décarboxylase ADN Acide désoxyribonucléique
ATCC American Type Culture Collection
CMI Concentration Minimale Inhibitrice LDC Lysine Décarboxylase
MeOH Méthanol n-BuOH n-butanol
ODC Ornithine Décarboxylase ONPG Ortho-nithrophényl-B-galactoside ORL Oto-rhino-laryngologie PH Potentiel hydrogène RM Rouge de Méthylène SM Solution mère UFC Unité Formant Colonie VP Vogos Proskauer
Liste des tableaux
N° du tableau Titre du tableau N°de la page Tableau I.1 Structure chimique de différentes classes de
flavonoïde
5
Tableau III.1 Les dilutions de la solution mère 19 Tableau IV.1 L’aspect macroscopique des souches 20 Tableau IV.2 L’aspect microscopique des souches 21
Tableau IV.3 Résultats des tests biochimiques. 22 Tableau IV.4 Zones d’inhibitions en mm en présence du
verbascoside.
23
TableauIV.5 Zones d’inhibitions en mm en présence de l’isorhamnetine-3-O-β-glucoside.
24
Tableau IV.6 Zones d’inhibitions en mm en présence de l’extrait n-butanolique de S. circinnata I’Her.
25
Tableau IV.7 CMI en (µg/ml) du verbescoside 26 Tableau IV.8 CMI en (µg/ml) de
l’isorhamnetine-3-O-β-glucoside
27 Tableau IV.9 CMI en (µg/ml) de l’extrait n-butanolique de
S. circinnata I’Her.
Introduction
1
De nombreuses maladies contractées par l’homme sont liées à des infections bactériennes. Pour y remédier, l’on a recours aux antibiotiques prescrits par la médecine conventionnelle qui peine à contrer les infections bactériennes (Ouattara, 2016).
Actuellement, l’essor de la résistance microbienne aux antibiotiques a conduit les chercheurs à mener des investigations afin de puiser dans le règne végétal des remèdes naturels efficaces pour faire face à diverses pathologies (Ouattara, 2016).
Face à ces nombreux obstacles que présente l’utilisation des antibactériens disponibles, il est indispensable de chercher de nouvelles substances antibactériennes efficaces et à large spectre d’action. Une des stratégies pour cette recherche consiste à explorer les plantes utilisées en médecine traditionnelle (El -Haci et al., 2012).
Donc, la phytothérapie a permis de répondre aux inffections survenues quotidiennes, elle propose des remèdes naturels et bien acceptés par l’organisme, associée souvent aux traitements classiques, elle connait de nos jours un nouveau exceptionnel, spécialement dans le traitement des maladies chroniques, comme l’asthme ou l’arthrite. De plus, les effets secondaires induits par les médicaments inquiètent les utilisateurs, qui se tournent vers des soins moins agressifs pour l’organisme (Iserin et al., 2001).
De ce fait plus de 120 composés provenant de plantes sont aujourd'hui utilisés en médecine moderne, près de 75% d'entre eux sont utilisés selon leur usage traditionnel, l'action de la phytothérapie sur l'organisme dépend de la composition des plantes, beaucoup de plantes sont très connues pour leurs grandes potentialités métaboliques des substances dites secondaires. Ces composés sont synthétisées dans les différentes parties de la plante (feuilles, tiges, racines) qui ont des intérêts multiples mis à profit dans l’industrie (alimentation, cosmétologie..), l’industrie pharmaceutique et l’industrie agroalimentaire. Parmi ces composés les métabolites secondaires qui se sont surtout illustrés dans le domaine thérapeutique (Basli et al., 2012).
Un exemple de ces plantes Stachys circinnata I’Her. du genre Stachys qui est largement utilisée en thérapie traditionnelle pour ses propriétés antibactériennes, antioxidantes et anti inflammatoires (Laggoune, 2011).
Notre étude a pour objectif d’évaluer l’activité antibactérienne de l’extrait n-butanolique de Stachys circinnata I’Her. et la comparaison avec l’activité des produits purs isolés de ce dernier.
Pour cela nous avons fixé les objectifs suivants: Extraction de l’extrait n-butanolique. Identification des souches bactériennes.
Test de sensibilité des souches étudiées sur milieu solide. Détermination des CMIs.
Introduction
2
De ce fait, notre travail sera réparti en deux parties, initié par une revue bibliographique où nous apportons des données sur la plante étudiées, des généralités sur l’activité antibactérienne et les souches testées.
La seconde partie rapporte une étude expérimentale qui résume toutes les étapes utilisées pour l’élaboration de ce travail, les résultats obtenus et leur discussion, en terminant avec une conclusion.
Chapitre I. Généralités sur Stachys circinnata I’Her.
3
I.1. Introduction
Du grec Stachys signifie « épi » en référence à la forme de l’inflorescence (Rivolier, 1977) ; ce genre est le plus grand de la famille des Lamiaceae, 14 espèces sont répandues en Algérie, dont 4 sont endémiques (Quezel et Santa, 1963).
I.2. Aspect botanique
Selon Quezel et Santa, 1963 Stachys circinnata I’Her. est une herbe faisant partie de la famille des Lamiacées caractérisée par des feuilles épaisses plus au moins réticulées gaufrées, revêtues de poils courts, épis florifères très danse dans le haut et disjoints dans le bas. Les corolles sont d’un beau rose à anneau de poils incomplet (Figure I.1).
Figure I.1. Photographie de S. circinnata I’Her. (Laggoune, 2011). I.3. Distribution géographique
S. circinnata I’Her. est une plante endémique, elle se répartie bien dans toute l’Algérie et beaucoup plus dans les montagnes (Quezel et santa, 1963).
I.4. Taxonomie
La classification dans la systématique botanique est la suivante (Judd et al., 2002; Guignard, 2001) :
Embranchement : Spermatophytae Sous-embranchement : Angiospermae Classe : Dicotylédonae
Sous Classe : Asteropsidae Ordre : Lamiale
Famille : Lamiaceae Genre : Stachys
Chapitre I. Généralités sur Stachys circinnata I’Her.
4
I.5. Utilisation en médecine traditionnelle
Depuis des siècles, les plantes de ce genre sont appliquées dans la médecine traditionnelle pour traiter les tumeurs génitales, la sclérose de la rate, des ulcères, des toux, ainsi que des maladies inflammatoires (Zargari, 1999).
I.6. Étude chimique
Des études menées sur le genre Stachys ont montré sa richesse en métabolites secondaires dont les plus abondants sont : les flavonoïdes, les terpénoïdes et les phénylpropanoïdes (Laggoune, 2011).
I.6.1. Composition en métabolites secondaires
Les métabolites secondaires sont des molécules organiques complexes synthétisées dans une partie de la plante et stockées dans une autre; ils sont connus par leur rôle majeur dans la protection des végétaux contre les infections bactériennes, les insectes, et une réponse aux contraintes des phytopathogènes et herbivores… etc
On en distingue trois classes : les terpénoïdes, les alcaloïdes et les substances phénoliques (Raven et al., 2007).
I.6.1.1. Flavonoïdes
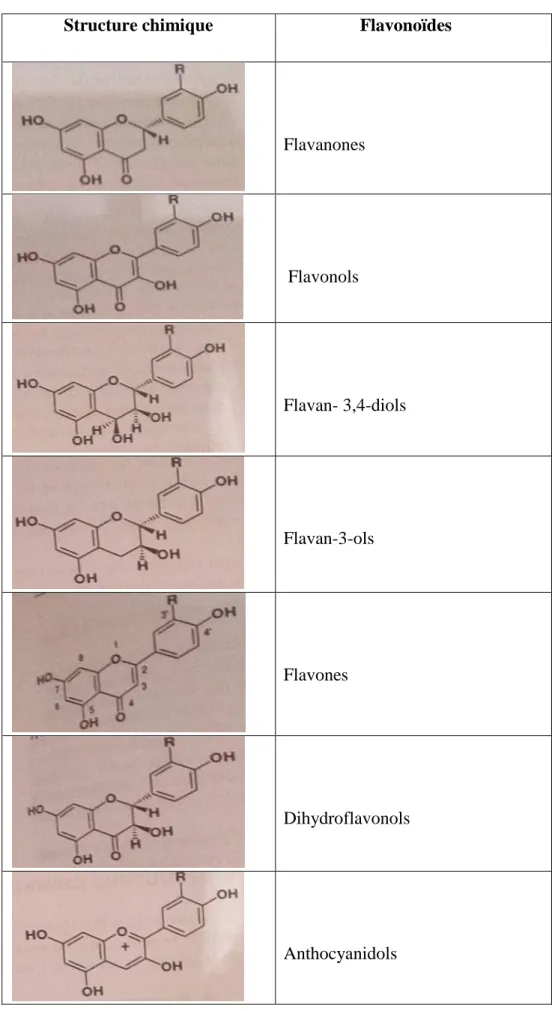
Les flavonoïdes constituent le plus grand groupe de composés phénoliques chez les plantes (Raven et al., 2007), ce sont des pigments hydrosolubles responsables de certaines
colorations des fleurs, des fruits et parfois des feuilles (Bruneton, 1999) ; la famille des flavonoïdes se divise en plusieurs classes dérivées de la flavane : les flavones, les flavonols, les flavanones, les isoflavones, les flavanes-3-oles, les anthocyanides, les chalcones, les aurones et les tanins (Richter, 1993), Les flavonoïdes ont un squelette de base commun de 15 atomes de carbones constitué de deux unités aromatiques (Hopkins, 2003) (Figure I.2).
Figure I.2. Squelette de base des flavonoïdes (Richter, 1993).
Les flavonoïdes isolées du genre Stachys sont des flavonoïdes glycosylées qui contiennent des hétérosides tels que : les quercétine, apigénine….qui sont des molécules glycosylées (Laggoune, 2011) représentées ci-dessous (Tableau I.1).
Chapitre I. Généralités sur Stachys circinnata I’Her.
5
Tableau I.1 : Structure chimique de différentes classes de flavonoïdes (Bruneton, 1999).
Structure chimique Flavonoïdes
- Flavanones - Flavonols - Flavan- 3,4-diols - Flavan-3-ols - Flavones - Dihydroflavonols - Anthocyanidols
Chapitre I. Généralités sur Stachys circinnata I’Her.
6 - Aurones
- Chalcones
a. L’activité antibactérienne des flavonoïdes
Les flavonoïdes agissent comme bactéricides et bactériostatiques en endommageant la membrane cytoplasmique, en inhibant le métabolisme énergétique et la synthèse d'acides nucléiques contre différents microorganismes (Asif et al., 2015).
En citant comme exemple : celui de la quercétine qui agit sur l’ADN gyrase d’Escherichia coli (Prasanna et al., 2009).
D’autres résultats ont montré le mécanisme antibactérien des flavonoïdes dans la détérioration de la membrane d’E. coli (Mengying et al., 2014).
Un effet antibactérien important vis-à-vis Pseudomonas aeruginosa ATCC 27853, Staphylococcus aureus et Escherichia coli 1554 (Boutlelis et al., 2012).
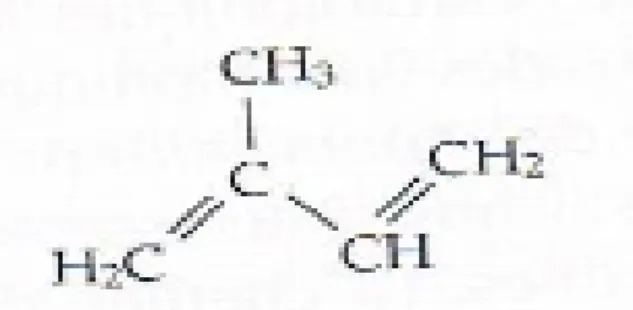
I.6.1.2. Les terpènes
Les terpènes (= Terpénoïdes) sont des substances généralement lipophiles qui sont formés par la polymérisation des simples unités à cinq atomes de carbone appelées isoprène. La très grande majorité des terpènes sont spécifiques du règne végétal.
Les composés terpénoïdes constituent un groupe de molécule très différent tant d’un point de vue structurel que fonctionnel, ils sont distingués dans des différentes classes selon le nombre d’unités isopréniques qu’ils contiennent ; de ce fait on trouve:
Les monoterpènes, les sesquiterpènes, les diterpènes, les sesterpènes, les triterpènes et les tétraterpènes (Hopkins, 2003).
a. L’activité antibactérienne des terpènes
Ces derniers ont de fortes propriétés antimicrobiennes, ils inhibent la croissance bactérienne et ils sont étudiés pour leur utilisation dans la prévention et le traitement des infections en tant que désinfectant potentiel (Thormar, 2010).
Des études ont montré que les terpénoïdes ont d’excellentes activités antibactériennes contre diverses bactéries (Kouchadé et al., 2017) (Figure I.3).
Chapitre I. Généralités sur Stachys circinnata I’Her.
7
Figure I.3 : Squelette de base des terpènes (Isoprène) (Raven et al., 2007). I.6.1.3. Les phénylpropanoïdes
Les phénylpropanoïdes sont des composés aromatiques constitués d’une chaîne latérale de propyle attachée avec le cycle de benzène, appartiennent souvent à la phénylalanine possédant tout le même squelette carboné issu de cet acide aminé (Satyajit et Lutfun, 2007). La majorité des phénylpropanoïdes sont des dérivés d’un squelette carboné à 15 carbones (Douglas, 1996).
Une grande diversité caractérise ce métabolite secondaire spécifique du règne végétal particulièrement les plantes supérieures, et plusieurs se rencontrent dans les huiles essentielles (Guignard, 2001).
a. Activité antibactérienne des phénylpropanoïdes
Les phénylpropanoïdes sont impliquées dans des fonctions diverses telles que la protection contre les agents biotiques et ils ont une activité antibactérienne importante vis-à-vis des enterobacteriaceae (Hahlbrock et Scheel, 1989) (FigureI.4).
Figure I.4 : Structure de phénylpropanoïde exemple de l’acide coumarique (Satyajit et Lutfun, 2007).
Chapitre II. Etude descriptive des bactéries étudiées
8
II.1. Généralités sur les bactéries II.1.1. Historique
Entre 1674 et 1687 "Van Leeuwenhoek" découvre et décrit le monde microbien « Animalicules » grâce à un microscope rudimentaire (loupe) qu’il avait fabriqué.
En 1866 "Haeckel" crée le terme protiste pour désigner, entre le monde animal et le monde végétal, les êtres unicellulaires et les êtres pluricellulaires sans tissus différenciés (Delarras, 2014).
En 1870 la bactériologie a pris son essor grâce aux travaux de "Luis Pasteur" et "Robert Koch". De nombreuses bactéries pathogènes ont été découvert par la suite (Delarras, 2014). L’avancée de la microbiologie aurait été impossible si les biologistes avaient dȗ se contenter de simples loupes ; mais l’invention de microscope électronique en 1931 était une révolution pour la science qui fut qualifiée de fantastique ! (Baudet, 2015).
II.1.2. Définition
Les bactéries sont des micro-organismes unicellulaires classées parmi les procaryotes, ce qui les distinguent des autres organismes unicellulaires classés parmi les eucaryotes (champignons, algues, protozoaires) (Nauciel et Vildé, 2005) c’est que leur ADN n’est jamais séparé du cytoplasme par une enveloppe (Maillet, 2006).
Elles sont divisées en bactéries proprement dites (Bacteria) et bactéries primitives (Archaea). On peut les voir au microscope optique, à l’état frais ou après coloration. Leur forme peut être sphérique (cocci), en bâtonnet (bacilles), incurvée (vibrions) ou spiralée (spirochètes). Les détails de leur structure ne sont visibles qu’en microscopie électronique (Nauciel et Vildé, 2005).
II.1.3. Description des souches étudiées II.1.3.1. Bactéries à Gram négatif
Les bactéries à Gram négatif apparaissent rose-rouge sous microscope optique (Robert, 1984). Il n'y a qu'une seule ou plus de deux couches de peptidoglycane qui ne représentent que 5 à 20 % des constituants de la paroi bactérienne.
La paroi des bactéries à Gram négatif s'organise en trois grandes parties (de l'intérieur vers l'extérieur) : la membrane interne, l’espace périplasmique (périplasme) et la membrane externe qui contient du lipopolysaccharide (Beveridge, 1999).
a. Escherichia coli
Définition
E. coli est un bacille à gram négatif, qui fait partie de la flore microbienne aérobie anaérobie facultative de tube digestif de l’homme et de nombreux animaux, il est de forme non sporulée, de type anaérobie facultatif, généralement mobile grâce aux flagelles, sa longueur varie de 2 à 6μm, alors que sa largeur est de 1.1 à 1.5μm (Steven et al., 2004).
Chapitre II. Etude descriptive des bactéries étudiées
9 Habitat
L’habitat naturel de l’espèce est l’intestin des vertébrés. E. coli est donc l’une des espèces les plus fréquemment rencontrées et prédominante en pathologie humaine intestinale et extra-intestinale (Kaper et al., 2004). Leur présence dans l’environnement est signe d’une contamination fécale de l’eau (Savageau, 1983).
Pouvoir pathogène
Les souches virulentes sont responsables des infections spontanées des voies digestives ou urinaires ou bien encore des méningites néo-natales chez l’homme ou certaines espèces animales (Patrick et al., 1988).
En fonction du syndrome provoqué et du mécanisme pathogénitique les collibacilles responsables d’entérites sont subdivisés en au moins quatre catégories (Maklu, 1994) :
E.coli enterotoxinogènes ETEC diarrhée des voyageurs
E.coli enteropathogènes EPEC gastro-entérite aigue des nourrissons
E.coli entero-invasif EIEC colite invasive
E.coli entérohémorrhagiques colite hémorrhagique ;
Syndrome hémolytique-urémique
b. Pseudomonas aeruginosa
Définiton
P. aeruginosa est un bacille long et fin à Gram négatif, de 1.5- 3μm de long et 0.5 -0.8μm de large, non sporulé, généralement mobile grâce à un ou plusieurs flagelles polaires anciennement il est appelé bacile pyocianique du fait de sa capacité à donner un pus de couleur bleu-vert (Palleroni, 2008).
Habitat
Sur le plan écologique, P. aeruginosa est répandu dans les habitats naturels et peut être isolé de multiples niches environnementales, telles que l'eau, le sol, les plantes, les animaux et les humains (Goldberg et Pier, 2000). Il est également un agent clinique important, car il s'agit d'un Pathogène opportuniste qui cause un large éventail de maladies aiguës et chroniques des plantes, des animaux et très largement, des humains (Chugani et Greenberg, 2007).
Pouvoir pathogène
C'est l'un des principaux agents pathogènes nosocomiaux qui attribuent au pourcentage élevé de mortalité des patients et la morbidité. Il existe plusieurs rapports de détectection des souches multi-résistantes de P. aeruginosa à partir de sols hospitaliers, rails de lit, éviers et des mains du personnel médical (Altoparlak et al., 2005).
Les infections pseudomonadales des voies urinaires sont pour la plupart hospitalisées et apparaissent généralement après le cathétérisme, l'instrumentation ou la chirurgie. Il est également responsable d'infections différentes, à la fois aiguë et chronique. Il infecte couramment les voies respiratoires des patients immunodéprimés et les personnes atteintes de la maladie de la fibrose kystique (FC) (Bicanic et Eykyn, 2002).
Chapitre II. Etude descriptive des bactéries étudiées
10
c. Klebsiella pneumoniae
Définition
Klebsiella est un bacille Gram négatif, immobile et capsulé, c’est une bactérie ubiquitaire présente dans le tube digestif et dans l'appareil respiratoire des hommes et des animaux en tant que bactérie commensale (Lawior et al., 2005).
Habitat
K. pneumoniae est une espèce pathogène opportuniste. Elle est fréquemment rencontrée dans la nature : eaux de surface, du sol, du bois et des végétaux (El Fertas-Aissani et al., 2012). Elle est présente dans le tube digestif de l’homme et des animaux, et elle est commensale des voies respiratoires (Joly et Reynaud, 2002).
Pouvoir pathogène
Elle est responsable d'infections respiratoires (pneumonies, abcès pulmonaires, pleurésies), intestinales et urinaires. Elle a un effet cytotoxique sur les épithéliums des voies aériennes et peut être responsable d'infections nosocomiales (Cano, 2009).
d. Proteus mirabilis
Définition
Les bactéries appartenant à cette espèce ont une morphologie de petits bacilles à Gram négatif, généralement très mobiles, polymorphes, mesurant de 0.4 à 0.8 μm de diamètre sur 1.0μm à 80μm de longueur (Belas, 1996).
Habitat
Elle est largement répondue dans l’environnement naturel, y compris l’eau polluée, le sol et le fumier, on les rencontre aussi dans la viande putride, des abcès. Elles sont pour la plupart des habitants des voies urinaires de l'homme. Elles sont impliquées dans la décomposition de la matière organique d’origine animale. Par conséquent, elles sont souvent isolées des matières fécales humaines et animales (Kelley et al., 2009).
Pouvoir pathogène
Cette bactérie cause de la cystite et la pyélonéphrite aiguë mais la production de calculs urinaires, est une caractéristique de l'infection par cet organisme (Cover et al., 2001). Sur le plan des infections des voies respiratoires surtout en milieu hospitalier peut provoquer une infection ORL et des pneumopathies (Maryse et Danielle, 2004).
II.1.3.2. Bactéries à Gram positif
Les bactéries à Gram positif apparaissent bleu-violet sous microscope optique (Robert, 1984). Il y a de nombreuses couches de peptidoglycane qui représentent jusqu'à 90 % des constituants de la paroi bactérienne. Celle-ci contient aussi l'acides teichoïques associés étroitement au peptidoglycane. Certains acides lipoteichoïques sont placés transversalement et s'enfoncent jusqu'à la membrane cytoplasmique. En général il n'y a pas ou peu de protéines dans la paroi des bactéries à Gram positif (Beveridge, 1999).
Chapitre II. Etude descriptive des bactéries étudiées
11
a. Staphylococcus saprophyticus Définition
C’est une cocci à Gram positif, de forme sphérique, lisse et brillante. Elles sont regroupées en diplocoques ou en petits amas. Ce type de bactéries sont immobiles, asporulées, habituellement sans capsules (Kloos et Bannerman, 1999).
Habitat
Le réservoir principal de S. saprophyticus est le tractus gastro-intestinal, et il colonise également la peau et la muqueuse du tractus génito-urinaire.
Pouvoir pathogène
S. saprophyticus provoque également des infections urinaires, les complications comprennent les calculs rénaux et la pyélonéphrite, chez les hommes la prostatite, l'urétrite et l’épididymite. Les infections chez les sites autres que les voies urinaires sont rares, mais S. saprophyticus a été Impliqué dans la septicémie et l'endocardite (Raz et al., 2005).
Chapitre III. Matériel et méthodes
12
III.1. Matériel
III.1.1. Matériel végétal
La plante a été récoltée de "Djebel El-ouahch", ville de Constantine (Algérie) en mois de mai, elle a été identifiée par le Professeur Gérard De Bélair (faculté des sciences,
Université Badji-Mokhtar, Annaba). La partie aérienne (feuilles, tiges, fleurs) a ensuite été séchée à l’abri de la lumière du soleil, puis broyée en poudre pour qu’elle soit prête à l’utilisation (Laggoune, 2011). Figure III. (a), Figure III. (b).
Figure III. (a) : La plante séchée Figure III. (b) : La plante fraiche
III.1.2. Matériel bactériologique
Les souches bactériennes ont été fournies par le laboratoire d’analyse « Bekioua» et l’hôpital de Jijel « Mohammed Seddik Ben Yahia ».
Staphylococcus saprophyticus. Klebsiella pneumoniae. Proteus mirabilis.
Pseudomonas aeruginosa. Escherichia coli.
III.1.3. Milieux de culture Gélose Chapman. Gélose Héktoen. Gélose nutritive. Gélose Muller-Hinton. Bouillon nutritif.
Eau physiologique stérile. Eau distillée stérile.
Chapitre III. Matériel et méthodes
13
III.2. Méthodes
III.2.1. Préparation de l’extrait n-butanolique de Stachys circinnata l’Her.
La préparation de l’extrait n-butanolique de Stachys circinnata I’Her. a été éffectuée selon la méthode de (Laggoune et al., 2011) qui est illustrée dans la (figure III.1).
La figure N° III.1 montre les différentes étapes d’extraction de l’extrait n-butanolique de l’espèce S. circinnata I’Her.
Matière végétale
Macération à froid pendant 3 x 24h dans un mélange MeOH/H2O 70 :30 (v/v)
Filtration
Extrait hydrométhanolique
Concentration sous vide (T= 45°C) Dilution avec de H2O
Filtration Filtrat
Extraction par de l’éther de pétrole (x3) Décantation
Séparation
Phase aqueuse phase organique
Concentration
Phase organique Extrait éther de pétrole Concentration phase aqueuse
Extraction par AcOEt Décantation
Séparation Extrait dichlorométhane
Phase aqueuse phase organique Extraction par n-BuOH
concentration
(T= 30°C) Phase aqueuse phase organique
Extrait AcOEt Concentration
Extrait n-butanol
FigureIII.1. Les étapes de l’extraction n-butanolique de l’éspèce S. circinnata I’Her. (Laggoune et al., 2011).
Chapitre III. Matériel et méthodes
14
III.2.2. Identification des souches bactériennes
Les souches bactériennes étudiées ont été pré identifiées au laboratoire d’analyse, mais nous avons effectué une autre identification dans le but de confirmation.
Après repiquage sur des milieux solides sélectifs (Chapman pour S. aureus, Héktoen pour les souches restantes) et incubation 24h à 37°C, l’identification se base sur des caractères morphologiques et biochimiques suivantes (Tabak et bensoltane, 2012) :
III.2.2.1. Examen macroscopique : La morphologie des colonies et leur dimension sont étudiées à partir des cultures obtenues sur les milieux sélectifs de chaque souche.
III.2.2.2. Examen microscopique : Il a été effectué sur un frotti bactérien, préparé à partir des colonies suspectes en cultures pures, puis fixé et coloré par la méthode de Gram.
* Coloration de Gram
- On recouvre le frotti avec du violet de Gentiane ; on laisse agir 1mn ; on rince à l'eau distillée ;
- On verse du Lugol et on le laisse agir pendant 1 mn ;
- On décolore à l'alcool à 95°, entre 15 et 30 secondes ; on rince à l'eau distillée ; - On fixe avec de la fuchsine pendant 10 à 30 secondes ; on rince à l'eau distillée ; - On sèche au-dessus de la flamme d'un bec Bunsen ;
- Observation au microscope optique à l'objectif x 100 à immersion, les Gram+ se colorent en violet tandis que les Gram- apparaissent colorés en rose (Delarras, 2014).
III.2.2.3. Tests biochimiques a. Type respiratoire
1. Test de catalase
Pour mettre en évidence cette enzyme, une partie de la colonie suspecte est diluée dans une goutte d’eau oxygénée sur une lame stérile. Le dégagement de bulles de gaz indique la présence de la catalase (Tabak et bensoltane, 2012).
2. Nitrate réductase
Le bouillon nitrate est ensemencé avec la bactérie à étudier et ensuite incubé à 37°C pendant 18h.
Après incubation, 3 gouttes d’une solution d’acide sulfanilique, puis 3 gouttes d’alpha naphtylamine sont ajoutées à la surface du milieu.
*Lecture
- Le virage du milieu en rouge indique la présence de nitrite. Alors la bactérie possède une nitrate réductase.
- si le milieu reste inchangé : on ajoute alors de la poudre de zink qui joue le même rôle que la nitrate réductase vis-à-vis des nitrates.
Une coloration rouge indique un résultat nitrate réductase négatif, on a eu donc une transformation des nitrates en nitrites par le zink, et la bactérie ne possédait pas cette enzyme (Denis et al., 2007).
Chapitre III. Matériel et méthodes
15
b. Métabolisme glucidique 1. Milieu mannitol-mobilité
C’est une gélose molle conditionnée en tubes qui permet d’étudier la fermentation du mannitol et la mobilité des bactéries. L’ensemencement a été réalisé par piqûre centrale jusqu’au fond des tubes à l’aide d’une pipette Pasteur et incubé à 37°C pendant 18 à 24h. *Lecture
La fermentation du mannitol se matérialise par un virage du milieu au jaune. Les bactéries mobiles diffusent à partir de la ligne d’ensemencement, créant un trouble dans le milieu alors que les bactéries immobiles poussent uniquement le long de la strie d’ensemencement (Gerhardt et al., 1994).
2. Test du milieu TSI (Triple Sugar Iron)
Pour mettre en évidence la fermentation des trois sucres (lactose, glucose et saccharose). On ensemence le culot par piqure profonde et la pente par une strie médiane, puis incuber 24h à 37°C (Tabak et bensoltane, 2012).
*Lecture
Lactose positif : une coloration jaune de la pente. Glucose positif : une coloration jaune du culot.
Saccharose positif : une coloration jaune de la zone intermédiaire.
Ainsi qu’un noircissement de la zone joignant le culot et la pente, indiquant la production d’H2S, et apparition de gaz par libération des bulles dans la gélose (Delarras, 2007).
3. Citrate de Simmons
Le milieu Citrate de Simmons est utilisé pour l’identification des bacilles Gram négatif. Il permet de rechercher l’utilisation de citrate comme seul source de carbone. Seules les bactéries possédant un citrate- perméase capable de se développer sur ce milieu.
On ensemence par des stries longitudinales le long de la pente à l’aide de la pipette pasteur puis on met à l'étuve 24 heures à 37°C.
* Lecture
L’utilisation du citrate de Simmons se traduit par un virage de couleur du vert au bleu qui
signifie qu’il y a eu une alcalinisation du milieu, donc on dit : Citrate-positive. Absence de culture bactérienne [Milieu inchangé (vert)] : elles sont dites Citrate-négative.
(Marchal et al., 1991). 4. VP/RM :
On met quelques colonies dans le tube contenant le milieu Clark et Lubs, l’incubation à 37°C dans l’étuve pendant 24 heures. Après l’incubation, on divise le milieu dans deux tubes stériles :
-Tube 1 : on ajoute quelques gouttes de rouge de méthyle. -Tube 2 : on ajoute quelques gouttes de VP1 .On attend quelques secondes et on rajoute deux ou trois gouttes de VP2 et on met les deux tubes dans une position inclinée pour bien observer le virage.
Chapitre III. Matériel et méthodes
16
*Lecture
- Si le milieu reste acide et donne une teinte rouge. Ces bacteries sont RM+.
- L’obtention d’une coloration rouge indique une réaction VP+ (Marchal et al., 1991). 5. ONPG
On prépare une suspension danse d’une culture bactérienne à étudier dans un tube à essai stérile contenant 0.5ml d’eau distillée, puis on ajoute avec une pince flambée mais refroidie un disque ONPG. On incube au bain-marie à 37°C pendant 30 minutes.
*Lecture
- Si la couleur du produit devient jaune, la bactérie possède la ß-galactosidase. Donc elle est ONPG+.
- S’il n’ya pas de coloration. On dit que la bactérie ne possède pas la ß-galactosidase. Donc elle est ONPG - (Denis et al., 2007).
c. Métabolisme protéique
1. Recherche des décarboxylases (LDC, ODC, ADH)
Le test est réalisé avec le milieu Moeller avec des colonies bien agitées et réparties dans 4 tubes à hémolyse différents :
- Le premier tube constitue le témoin. Il contient essentiellement du glucose en petite quantité et du pourpre de bromocrésol comme indicateur de pH.
- Les trois autres tubes contiennent en plus du milieu témoins, un des trois acides aminés suivants : Arginine, Lysine ou Ornithine.
La réaction s’effectue en deux temps. Lorsque le glucose est fermenté, il y’a un virage au jaune du bromocréysol pourpre, lorsque l’acide aminé décarboxylé, il y a une ré-alcalisation du milieu qui vire au violet après 18h à 37°C, un milieu violet trouble correspond à une réaction positive (Denis et al., 2007).
III.2.3. Evaluation de l’activité antibactérienne
Ce travail vise à montrer la présence ou l’absence d’une activité antibactérienne de l’extrait n-butanolique et les deux produits purs isolés à partir de cet extrait, en réalisant un test de sensibilité par la méthode de diffusion sur milieu gélosé, pour déterminer le diamètre d’inhibition et la concentration minimale inhibitrice.
III.2.3.1. Repiquage des souches bactériennes
Avant les tests de l’activité antibactérienne, les différentes souches bactériennes ont été repiquées sur milieux gélosés appropriés par la méthode des stries, puis incubés à l’étuve 37°C pendant 24h afin d’obtenir une culture fraîche et des colonies isolées (Moroh et al., 2008).
NB : Le repiquage des souches se fait après chaque semaine. III.2.3.2. Préparation de l’inoculum
Pour préparer l’inoculum, 3 à 5 colonies similaires bien isolées de chaque souche étudiée sont prélevées à l’aide d’une anse en platine puis déchargées dans de l’eau physiologique stérile. La suspension bactérienne est ensuite homogénéisée à l’aide d’un vortex et sa turbidité est ajustée à 0,5 Mc Farland, soit une densité optique égale à 0.08 à 0.1, lue à une longueur d’onde de 620 nm correspondant à 108 UFC/ml (Fertout et al., 2016).
Chapitre III. Matériel et méthodes
17
III.2.3.3. Préparation des dilutions
Les dilutions sont préparées en solubilisant 50mg de l’extrait n-butanolique et les produits purs dans 10ml de l’eau distillée, la solution ainsi obtenue est la solution mère, à partir de laquelle nous avons réalisé les dilutions.
NB : les dilutions utilisées pour le test de sensibilité sont les mêmes pour la CMI. Les dilutions sont représentées dans le (tableau III.1).
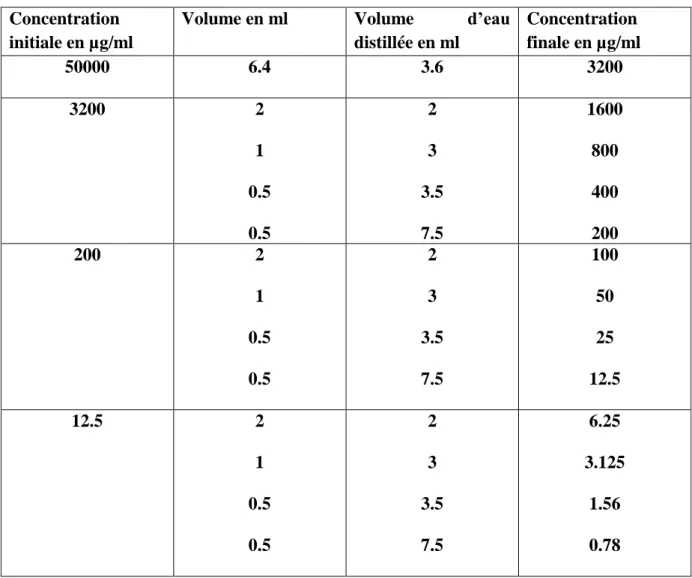
Tableau III.1 : Les dilutions de la solution mère (Carbonnelle et al., 1987., Courvalin et al., 1988).
Concentration initiale en µg/ml
Volume en ml Volume d’eau
distillée en ml Concentration finale en µg/ml 50000 6.4 3.6 3200 3200 2 1 0.5 0.5 2 3 3.5 7.5 1600 800 400 200 200 2 1 0.5 0.5 2 3 3.5 7.5 100 50 25 12.5 12.5 2 1 0.5 0.5 2 3 3.5 7.5 6.25 3.125 1.56 0.78
Chapitre III. Matériel et méthodes
18
III.2.3.4. Test de sensibilité des bactéries vis-à-vis l’extrait n-butanolique et les deux produits purs
Le test de la sensibilité des bactéries est réalisé par la méthode de diffusion en milieu gélosé, encore appelée méthode des disques dont le principe est inspiré de l’antibiogramme (Chebaibi et al., 2011).
a. Préparation des disques
Nous avons utilisé le papier Wathman N°3 coupé en disques de 6mm de diamètre, qui sont placés dans l’autoclave pendant 20 min à 120°C pour leur stérilisation (Mehani et Segni, 2014).
b. Ensemencement
La gélose Muller-Hinton est versée dans les boites de Pétri stériles, après refroidissement l’inoculum de chaque souche préparé est étalé régulièrement sur toute la surface des boites (Prajapati et Raol, 2014) ; les disques stériles sont déposés sur la gélose ensemencée à l’aide
d’une pince stérile, puis ils sont remplis de 20μl de différentes dilutions de l’extrait n-butanolique et les deux produits purs (Chebaibi et al., 2011).
c. Incubation
Les boîtes sont ensuite incubées à 37 °C pendant 18 à 24 heures (Chebaibi et al., 2011). d. Lecture
Pour chaque disque on mesure le diamètre des zones d’inhibitions (Mehani et Segni, 2014). Les tests sont répétés afin de calculer une moyenne et un écart type (Parajapati et
Raol, 2014).
III.2.3.5. Détermination de la CMI a. définition
La Concentration Minimale Inhibitrice (CMI) de façon générale est la plus faible concentration d’antimicrobien capable d’inhiber toute croissance visible après un temps d’incubation de 18 à 24 heures (Moroh et al., 2008).
b. Procédés
1. Préparation des dilutions de la solution mère de l’extrait n-butanolique et des deux produits purs
Même dilutions que le test de sensibilité, voir (tableau III.1). 2. Préparation de l’inoculum
Nous avons préparé des suspensions bactériennes de densité de 108 UFC/ ml, pour chaque souche à étudier avec incubation de 18 heure à 37°C (Moroh et al., 2008).
L’inoculum se fait après repiquage de 0.1ml (Bacille à Gram négatif) et 0.3ml pour les Staphylocoques et P. aeruginosa de la culture de 18h préparée d’avance, dans 10ml de bouillon nutritif (Carbonelle et al., 1987; Courvalin et al., 1988).
L’incubation se fait à l’étuve 37°C pendant 3 à 5 heures pour avoir une pré culture. Ensuite, on prend 1ml de chaque bouillon et on le fait distribuer sur d’autres bouillons de 10ml (Moroh et al., 2008).
Chapitre III. Matériel et méthodes
19
3. Préparation des boîtes
A partir de la gamme des dilutions de chaque extrait préparé, on prend 2ml afin de les distribuer dans les boîtes de Pétri (du plus concentré vers le moins concentré). On ajoute la gélose Muller-Hinton maintenue en surfusion à 45°C, après on fait homogénéiser les boites et on les laisse se solidifier à température ambiante (Bonnet et al., 2013).
4. Ensemencement
L’ensemencement en stries se fait à l’aide d’une pipette pasteur, on incube les boites à 37°C pendant 18 heures (Bonnet et al., 2013).
5. Lecture
Les concentrations minimales inhibitrices correspondent à la concentration la plus faible du produit (extrait n-butanolique et les produits purs testés) pour laquelle aucune croissance bactérienne n’est observée (Fertout et al., 2016).
Chapitre IV. Résultats et discussion
20
IV.1. Résultats
IV.1.1. Résultats de l’extraction
Les produits purs isolés de l’extrait n-butanolique de la plante ont été séparés et purifiés par séparation chromatographique, leurs structures ont été établies par les méthodes d’analyses spectroscopiques.
Les résultats ont montré la richesse de S. circinnata I’Her. en métabolites secondaires ce qui a permis l’isolation d’une quinzaine de produits purs (Laggoune et al., 2016).
Nous avons testé l’activité de deux produits purs de l’extrait n-butanolique qui sont : - Un phénylpropanoïde : verbascoside.
- Un flavonoïde : isorhamnetine-3-O-β-glucoside. IV.1.2. Identification macroscopique des souches
La forme, la taille et la pigmentation des colonies ont été déterminées après croissance sur milieu Héktoen et Chapman après une incubation de 24 h à 37°C.
L’aspect macroscopique des souches est représenté dans le tableau ci-dessous (Tableau IV. 1) :
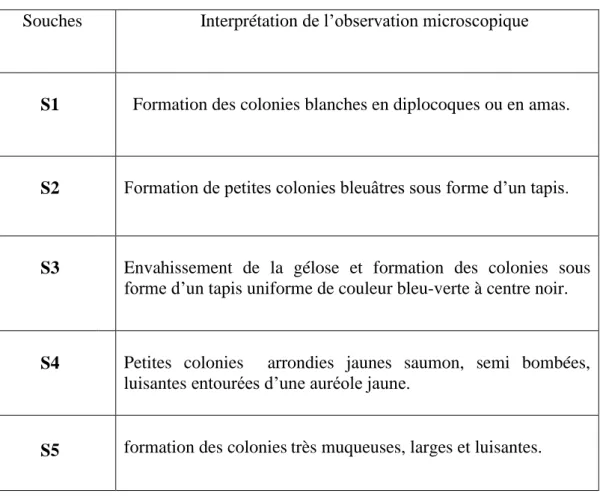
Tableau IV.1 : L’aspect macroscopique des souches.
Souches Interprétation de l’observation microscopique
S1
Formation des colonies blanches en diplocoques ou en amas.
S2 Formation de petites colonies bleuâtres sous forme d’un tapis.
S3
Envahissement de la gélose et formation des colonies sous forme d’un tapis uniforme de couleur bleu-verte à centre noir.
S4
Petites colonies arrondies jaunes saumon, semi bombées, luisantes entourées d’une auréole jaune.
S5 formation des coloniestrès muqueuses, larges et luisantes.
Chapitre IV. Résultats et discussion
21
VI.1.3. Identification microscopique
La morphologie, l’arrangement cellulaire et le type de Gram de l’isolat sont déterminés sur des cultures jeunes par la technique de coloration de Gram.
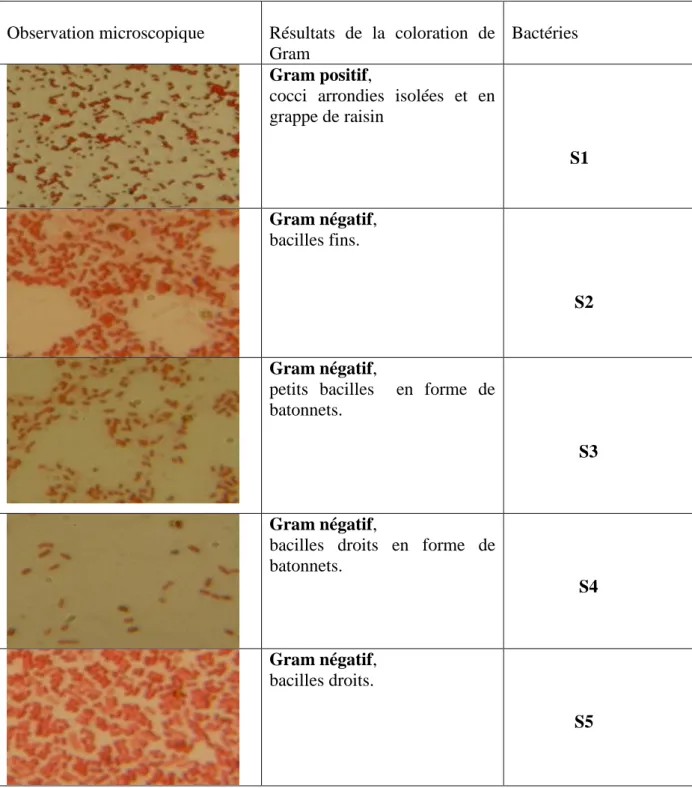
L’aspect microscopique des souches et la coloration de Gram sont représentés dans le (tableau IV.2) :
Tableau IV.2 : L’aspect microscopique des souches.
Observation microscopique Résultats de la coloration de Gram
Bactéries Gram positif,
cocci arrondies isolées et en
grappe de raisin S1 Gram négatif, bacilles fins. S2 Gram négatif,
petits bacilles en forme de batonnets.
S3
Gram négatif,
bacilles droits en forme de batonnets. S4 Gram négatif, bacilles droits. S5
Chapitre IV. Résultats et discussion
22
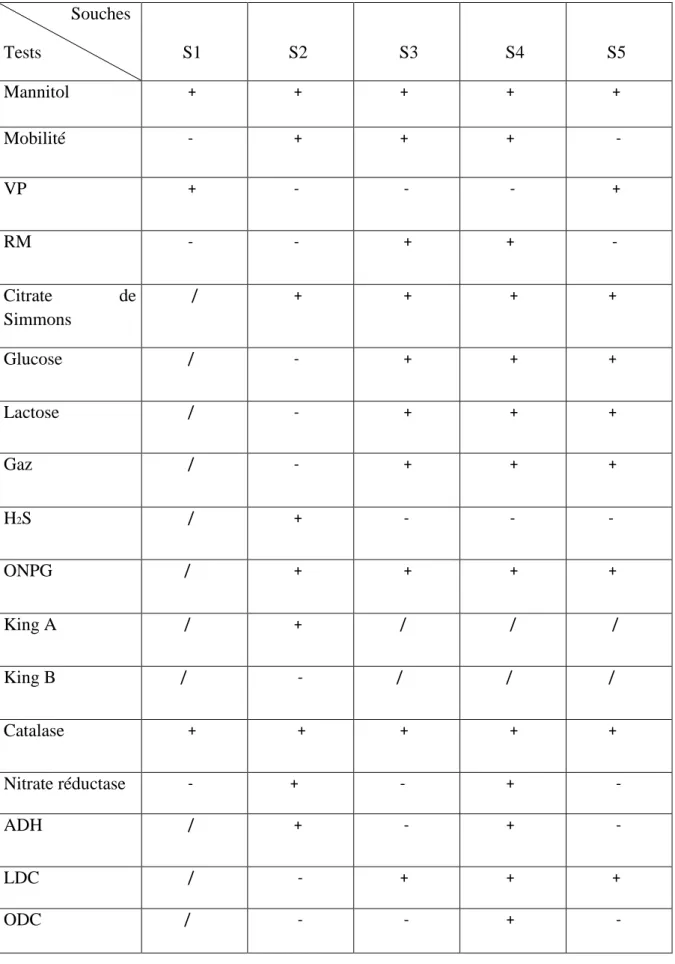
Les résultats du type respiratoire, métabolisme protéique et métabolisme glucidique des souches testées sont résumés dans le (tableau IV.3).
Tableau IV.3 : Résultats des tests biochimiques Souches Tests S1 S2 S3 S4 S5 Mannitol + + + + + Mobilité - + + + - VP + - - - + RM - - + + - Citrate de Simmons / + + + + Glucose / - + + + Lactose / - + + + Gaz / - + + + H2S / + - - - ONPG / + + + + King A / + / / / King B / - / / / Catalase + + + + + Nitrate réductase - + - + - ADH / + - + - LDC / - + + + ODC / - - + -
Chapitre IV. Résultats et discussion
23
D’après les résultats et selon le Bergey’s manual on a confirmé que nos souches sont : S1 Staphylococcus saprophyticus
S2 Pseudomonas aeruginosa
S3 Proteus mirabilis
S4 Escherichia coli
S5 Klebsiella pneumoniae
IV.2. Evaluation de l’activité antibactérienne IV.2..1. Résultats du test de sensibilité
L’activité antibactérienne de l’extrait n-butanolique et des deux produits purs (l’isorhamnetine-3-O-β-glucoside et le verbescoside) de S. circinnata I’Her. a été évaluée après 24h d’incubation à 37°C, par la mesure des zones d’inhibition à l’aide d’une règle, les valeurs indiquées sont les moyennes de deux mesures.
Les diamètres des zones d’inhibition des bactéries testées sont mesurés et résumés dans les tableaux (IV.4, IV.5 et IV.6).
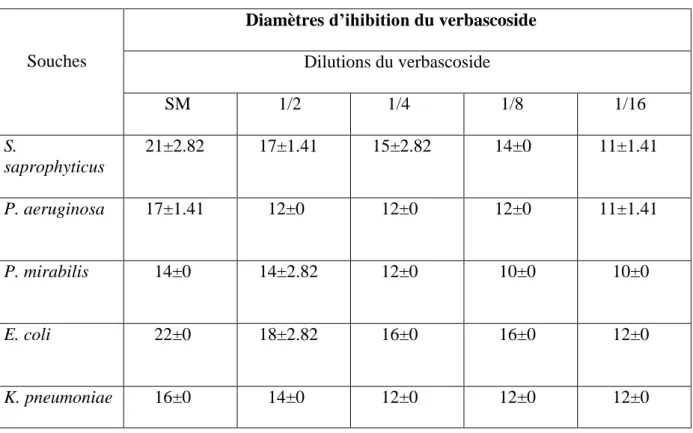
Tableau III.4. Zones d’inhibition en mm en présence du verbescoside.
Souches
Diamètres d’ihibition du verbascoside Dilutions du verbascoside SM 1/2 1/4 1/8 1/16 S. saprophyticus 21±2.82 17±1.41 15±2.82 14±0 11±1.41 P. aeruginosa 17±1.41 12±0 12±0 12±0 11±1.41 P. mirabilis 14±0 14±2.82 12±0 10±0 10±0 E. coli 22±0 18±2.82 16±0 16±0 12±0 K. pneumoniae 16±0 14±0 12±0 12±0 12±0
Chapitre IV. Résultats et discussion
24
Nous estimons d’après le (tableau III.4) que l’activité antibactérienne du produit pur verbascoside de S. circinnata I’Her sur les différentes souches à différentes concentrations. Nous remarquons que l’effet inhibiteur du verbascoside augmente progressivement avec les concentrations du produit, où on observe une hétérogénéité dans les diamètres des zones. Ces résultats montrent un effet remarquable sur S. saprophyticus avec un diamètre qui varie de (11±1.41) mm à (11±2.82) mm et sur E. coli avec un diamètre maximal qui varie de (12±0) mm à (22±0) mm.
Suivie par K. pneumoniae, P. aeuroginosa et P. mirabilis avec des diamètres qui varient respectivement de (12±0) mm à (16±0) mm, (11±1.41) mm à (17±1.41) mm et (10±0) mm à (14±0) mm.
Tableau III.5. Zones d’inhibition en mm en présence de l’isorhamnetine-3-O-β-glucoside.
Souches
Diamètres de zones d’inhibition en (mm) Dilutions de l’isorhamnetine-3-O-β-glucoside. SM 1/2 1/4 1/8 1/16 S. saprophyticus 16 ± 0 15 ± 1.41 13±1.41 11 ±1.41 11 ±0 P. aeruginosa 12±0 11±1.41 11±1.41 9±1.41 9±0 P. mirabilis 15±1.41 14±0 12±0 12 ±0 12±0 E. coli 17±1.41 15±1.41 14 ±2.82 14±2.82 12± 0 K. pneumoniae 14±2.82 12± 0 11± 1.41 10 ±0 10±0
D’après le (tableau IV. 5) on remarque que l’inhibition de la croissance des cinq souches testées par l’isorhamnetine-3-O-β-glucoside diminue proportionnellement avec l’abaissement de la concentration.
Où on enregistre un effet inhibiteur important sur E. coli avec un diamètre qui varie de (12±1.41) mm à (17± 1.41) mm ainsi que S. saprophyticus avec un diamètre de (11 ± 0) mm à (16 ±0) mm.
Suivie par P. mirabilis et K.pneumoniae, avec des diamètres qui varient respectivement de (12±1.41) mm à (15±1.41) mm et de (10±2.82) mm à (14±2.82) mm.
Chapitre IV. Résultats et discussion
25
En dernier, un diamètre relativement faible qui varie de (9±0) mm à (10±0) mm pour P. aeruginosa.
Tableau III.6. Zones d’inhibition en mm en présence de l’extrait n-butanolique de S.circinnata I’Her.
Souches
Diamètres d’ihibition de l’extrait n-butanolique Dilutions de l’extrait SM 1/2 1/4 1/8 1/16 S. saprophyticus 20±0 14±0 14±0 14±0 12±0 P. aeruginosa 12±0 12±0 12±0 10±0 8±0 E. coli 12±0 12±0 10±0 10±0 10±0 K. pneumoniae 10±0 10±0 10±0 8±0 -
Les résultats mentionnés dans le tableau ci-dessus indiquent que l’extrait n-butanolique testé a un effet inhibiteur faible sur la croissance des bactéries avec des diamètres qui varient de (8±0) mm à (12±0) mm pour P. aeruginosa.
De (10±0) mm à (12±0) mm pour E.coli, et de (8±0) mm à (10±0) mm pour K. pneumoniae avec absence d’activité à la dilution 1/16. Cependant l’extrait n-butanolique excerce l’effet le plus important sur S.saprophyticus avec un diamètre de (12±0) mm à (20±0) mm.
Chapitre IV. Résultats et discussion
26
V.2.2. Détermination de la concentration minimale inhibitrice
Les CMI de verbascoside et de l'isorhamnetine-3-O-β-glucoside et de l'extrait n-butanolique sont représentés respectivement dans les tableaux IV. 7, IV. 8, IV. 9
TableauIV. 7 : CMI en (µg/ml) du verbescoside.
Souches bactériennes CMI en (µg/ml)
S. saprophyticus 25
P. aeruginosa 100
P. mirabilis 100
E. coli 100
K. pneumoniae 100
Selon le (tableau IV.7), le verbescoside de S. circinnata I’Her. a montré une activité sur les souches bactériennes testées.
- Une CMI à : 100µg/ml pour toutes les souches (P. aeruginosa, P. mirabilis,
E. coli et K. pneumoniae) à l’exception de S. saprophyticus, avec une CMI à : 25µg/ml, qui représente le germe le plus sensible.
Chapitre IV. Résultats et discussion
27
Tableau IV.8 : CMI en (µg/ml) de l’isorhamnetine-3-O-β-glucoside.
Souches bactériennes CMI en (µg/ml) S. saprophyticus 100 P. aeruginosa 100 P. mirabilis 100 E. coli 100 K. pneumoniae 100
D’après le (tableau IV.8), l’isorhamnetine-3-O-β-glucoside a montré aussi une activité sur toutes les souches téstées avec une CMI à : 100µg/ml.
Tableau IV.9 : CMI en (µg/ml) de l’extrait n-butanolique de S. circinnata I’Her.
Souches bactériennes CMI en (µg/ml)
S. saprophyticus 320
P. aeruginosa 640
E. coli 640
K. pneumoniae > 2560
Selon le (tableau IV.9), l’extrait n-butanolique de S. circinnata I’Her. montre une activité faible sur E. coli et P. aeruginosa :
Chapitre IV. Résultats et discussion
28 - Une CMI à : 640µg/ml.
Une activité très faible ou inactif sur K. pneumoniae : - Une CMI à : > 2560µg/ml.
Enfin une activité modérée sur P. saprophyticus : - Une CMI à : 320µg/ml.
NB :
- Pour chaque souche testée la CMI est déterminée deux fois pour nous assurer que les résultats sont reproductibles.
Chapitre IV. Résultats et discussion
29 IV.2. Discussion
Nous avons réalisé un test de sensibilité et déterminé la CMI de l’extrait n-butanolique et les deux produits purs : verbascoside et l’isorhamnetine-3-O-β-glucoside isolés de S.circinnata I’Her, vis-à-vis des cinq souches bactériennes.
L’étude de l’activité antibactérienne de l’extrait n-butanolique donne des diamètres qui varient d’une souche à une autre, une valeur de diamètre important est enregistrée chez S. saprophyticus avec une CMI de 320µg/ml, pour le reste des souches testées aucune différence dans les diamètres de zones d’inhibitions, nous constatons une action inhibitrice moyenne à faible avec un diamètre de 12mm pour E. coli et P. aeruginosa, 10mm pour K. pneumoniae au dessous duquel un extrait est considéré inactif selon ( Biyiti et al., 2004).
(Athemena et al., 2010) a montré que l’extrait n-butanolique du cumin s’est avéré inactif sur E. coli et K. pneumoniae et autres souches testées ce qui est compatible avec nos résultats obtenus.
Cela est en accord aussi avec ce que rapporte la littérature, l’extrait méthanolique de S. lavendulifona a montré un effet inhibiteur meilleur contre les Gram (+), et un effet modéré contre (E. coli, k. pneumoniae…..) (Shahnama et al., 2015), l’extrait méthanolique de S. byzantina , S. inflata et S. laxa a montré également une bonne activité antibactérienne contre les Gram (+) ( S. aureus) que les autres bactéries Gram (-) (E. coli, K. pneumoniae, P. aeruginosa…) (Saeedi et al., 2008).
Cette variation observée dans les diamètres de zones d’inhibitions peut être due à la différence dans la composition en molécules bioactives dans l’extrait ou à leur mécanisme d’action sur les bactéries, ce qui est indiqué par (Oshomoh et al., 2015).
(Basli et al., 2012) a montré également que les bactéries Gram (+) sont plus sensibles que les bactéries Gram (-) pour la fraction n-butanolique testée.
La sensibilité de S. saprophyticus peut s’expliquer probablement par la sensibilité des bactéries Gram (+) aux changements environnementaux externes, tels que la température, la nature de l’extrait, le pH et aussi à l’absence de la membrane externe (Athemena et al., 2010).
En outre, il a été démontré que l’activité antibactérienne des substances actives d’origine végétale dépend de la nature des bactéries Gram (+) ou Gram (-), Par ailleurs, la paroi des bactéries Gram (+) est riche en acide teicoique tandis que chez les souches Gram (-), elle est surtout assemblée en lipopolysaccharides (LPS), la membrane extérieure de ces dernières constitue une barrière de perméabilité efficace. Le LPS, grâce à ses charges négatives de surface, empêche la diffusion des molécules hydrophobes, et les protéines excluent le passage des molécules hydrophiles de poids moléculaire élevé. Alors que les bactéries Gram (+) sont moins protégées contre les agents antibactériens (Basli et al., 2012).
D’après les résultats obtenus de l’activité du verbascoside, il apparait qu’il exerce une action inhibitrice sur toutes les souches testées et que cette action augmente avec l’augmentation de la concentration du produit.
Chapitre IV. Résultats et discussion
30
Des études ont montré une grande activité antibactérienne sur de diverses souches Gram (+) : S. aureus, S. epidermidis ainsi que des souches Gram (-) : K. pneumoniae, P. mirabilis, P. aeruginosa (Rigano et al., 2007). Ce qui est en rapport avec nos résultats.
(Nazemiyeh et al., 2008) a prouvé le grand effet inhibiteur du verbascoside sur cinq souche de S. aureus, avec des CMIs qui varient de (64 à 128) µg/ml, ce qui confirme la sensibilité des staphylocoques au verbascoside, cela est en accord avec notre résultat obtenu sur la sensibilité de S. saprophyticus avec une CMI de 25µg/ml.
D’autres recherches ont montré ainsi l’activité importante du verbascoside sur E. coli et d’autres bactéries cliniques (Tripoli et al., 2005).
Le mode d’action des verbascosides et des phénylpropanoïdes en général est mal connu mais le mode d’action évalué par (Guillermo et al., 1999) montre l’effet létal du verbascoside sur S. aureus qui affecte la synthèse des protéines et inhibe l’incorporation de la leucine.
En dernier d’après nos résultats obtenus, l’isorhamnetine-3-O-β-glucoside testé est doté aussi d’une activité antibactérienne, cela est traduit par les diamètres de zones d’inhibitions atteignant les 17 et 16mm pour E. coli et S. saprophyticcus et qui varient de 15 à 12mm pour les autres souches. Les études de (Gomah, 2013) ont révélé que les bactéries Gram (+) ont été plus sensibles à l’isorhamnetine que les bactéries Gram (-) cette différence peut être attribué à la paroi des Gram (+) constituée d’une seule couche tandis que la paroi des Gram (-) est d’une structure complexe et multi-couches.
Dans un autre contexte, (Bello et al., 2011) montre que plusieurs flavonoïdes y compris la quercétine, le Kaempferol, l’isorhamnetine et leurs dérivés possèdent également une activité contre une large éventail de microorganismes surtout E. coli, K. pneumoniae et P. aerugenosa. Cela semble avoir une nette corrélation avec nos résultats.
Il a été démontré que les flavonoïdes glucosides ou ceux qui contiennent des groupes hydroxylés libres sont classés comme agents actifs antimicrobiens, la présence de groupe (s) hydroxyle (s) dans les composés pourrait influencer leurs efficacité en se liant au site actif des enzymes avec une formation des liaisons hydrogènes avec ces derniers en modifiant leur métabolisme d’une part, d’autre part, leur activité est due à leur capacité de se complexer avec des proteines extracellulaires et solubles, le glutamate et le phosphate provenant des bactéries, en causant des perturbations au niveau du peptidoglycane et en altérant la perméabilité de la membrane bactérienne, cela confirme également la sensibilité des bactéries Gram (+) à l’isorhamnetine-3-O-β-glucoside (Gomah, 2013). En comparant les résultats obtenus de l’activité antibactérienne de l’extrait n-butanolique et les deux produits purs, il apparait nettement que ces derniers exercent un effet inhibiteur plus prononcé à celui de l’extrait n-butanolique.
D’après certaines études similaires, les extraits ayant une CMI inférieur à 100μg/ml ont une bonne activité antibactérienne, entre 100 et 500μg/ml, on parlera d’une activité antibactérienne modérée, entre 500 et 1000μg/ml, l’activité antibactérienne est dite faible et enfin l’extrait est considéré
Chapitre IV. Résultats et discussion
31
comme inactif pour une CMI de plus de 1000μg/ml. En tenant compte de cette classification, notre étude confirme la bonne activité du verbascoside (CMI=100µg/ml et 25µg/ml) et l’isorhamnetine-3-O-β-glucoside (CMI=100µg/ml), alors que l’extrait n-butanolique a été considéré en tant qu’un extrait modéré à faible (CMI=320µg/ml et 640µg/ml) et inactif pour K. pneumoniae (CMI=2560µg/ml).
Dans la littérature, il a été indiqué que l’activité antimicrobienne est due à la constitution chimique de l’extrait, l’extrait n-butanolique qui est pourtant riche en flavonoïdes a montré un faible effet cela est probablement due qu’un composant bioactif peut modifier ses propriétés en présence d’autres composés dans un extrait. Cela aussi peut être expliqué par le caractère autant qualitatif que quantitatif des composés présents dans l’extrait (Basli, 2012).
Selon (Iserin et al., 2001) le fractionnement donne des extraits moins efficaces, et parfois qui n’ont aucune activité. En plus, ce qui a été suggéré par (Hao et al., 2010) que certains effets synergiques ou antagonistes devraient se produire dans un extrait ou une fraction qui doivent d’être clarifiés, peut justifier ce que l’on a obtenu sur la faible activité de l’extrait n-butanolique.
Tous les résultats des études mentionnées précédemment sur l’activité antibactérienne de l’extrait et des deux produits purs renforcent également ce que nous avons obtenu comme résultats.