ﺎﻨﺘﻤﻠﻋ ﺎﻣ ﻻﺇ ﺎﻨﻟ ﻢﻠﻋ ﻻ ﻚﻧﺎﺤﺒﺳ
ﻢﻴﻜﳊﺍ ﻢﻴﻠﻌﻟﺍ ﺖﻧﺃ ﻚﻧﺇ
ﺔﻳﻵﺍ :ﺓﺮﻘﺒﻟﺍ ﺓﺭﻮﺳ
31
UNIVERSITE MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ
1969 – 1974 : Professeur Abdellatif BERBICH
1974 – 1981 : Professeur Bachir LAZRAK
1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI
2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI
ADMINISTRATION :
Doyen : Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines
Professeur Mohammed AHALLAT
Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général : Mr. Mohamed KARRA
1- ENSEIGNANTS-CHERCHEURS MEDECINS
ET
PHARMACIENS
PROFESSEURS : Décembre 1984Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENSAID Younes Pathologie Chirurgicale
Janvier, Février et Décembre 1987
Pr. YAHYAOUI Mohamed Neurologie
Décembre 1988
Pr. BENHAMAMOUCH Mohamed Najib Chirurgie Pédiatrique
Pr. DAFIRI Rachida Radiologie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. CHAD Bouziane Pathologie Chirurgicale
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. CHKOFF Rachid Pathologie Chirurgicale
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. MANSOURI Fatima Anatomie-Pathologique
Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AL HAMANY Zaîtounia Anatomie-Pathologique
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale
Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique
Pr. CHABRAOUI Layachi Biochimie et Chimie
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie – Dir. du Centre National PV
Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir du
CEDOC
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale V.D Aff. Acad. et Estud
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. BOUJIDA Mohamed Najib Radiologie
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. DEHAYNI Mohamed* Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Doyen de la
FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HADRI Larbi* Médecine Interne
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. JELTHI Ahmed Anatomie Pathologique
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BELAIDI Halima Neurologie
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique
Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHAMI Ilham Radiologie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. JALIL Abdelouahed Chirurgie Générale
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BAIDADA Abdelaziz Gynécologie Obstétrique
Pr. BARGACH Samir Gynécologie Obstétrique
Pr. CHAARI Jilali* Médecine Interne
Pr. DIMOU M’barek* Anesthésie Réanimation
Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation
Pr. EL MESNAOUI Abbes Chirurgie Générale
Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie - Directeur HMI Med V
Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie
Pr. BOULANOUAR Abdelkrim Ophtalmologie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUADGHIRI Mohamed Traumatologie-Orthopédie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. HAIMEUR Charki* Anesthésie Réanimation
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TAOUFIQ Jallal Psychiatrie
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. AFIFI RAJAA Gastro-Entérologie
Pr. BENOMAR ALI Neurologie – Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
Pr. KHATOURI ALI* Cardiologie
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie
Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie
Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale
Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. ISMAILI Hassane* Traumatologie Orthopédie- Dir. Hop. Av. Marr.
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Inspecteur du SSM
Pr. TACHINANTE Rajae Anesthésie-Réanimation
Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. MAHASSINI Najat Anatomie Pathologique
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie Directeur. Hop.d’Enfants
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique
Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique
Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique
Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie
Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. LAGHMARI Mina Ophtalmologie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. BERNOUSSI Abdelghani Ophtalmologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. NIAMANE Radouane* Rhumatologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
Pr. ZERAIDI Najia Gynécologie Obstétrique
Décembre 2005
Pr. CHANI Mohamed Anesthésie Réanimation
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire
Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique
Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Octobre 2007
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire
Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation Directeur ERSM
Pr. BALOUCH Lhousaine* Biochimie-chimie
Pr. BENZIANE Hamid* Pharmacie clinique
Pr. BOUTIMZINE Nourdine Ophtalmologie
Pr. CHARKAOUI Naoual* Pharmacie galénique
Pr. EHIRCHIOU Abdelkader* Chirurgie générale
Pr. ELABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation
Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologique
Pr. MRABET Mustapha* Médecine préventive santé publique et hygiène
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-chimie
Pr. RABHI Monsef* Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2007
Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale
Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie
Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie
Pr. BOUI Mohammed* Dermatologie
Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique
Pr. CHAKOUR Mohammed * Hématologie biologique
Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique
Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale
Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. L’KASSIMI Hachemi* Microbiologie Directeur Hôpital My Ismail
Pr. LAMSAOURI Jamal* Chimie Thérapeutique
Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie
PROFESSEURS AGREGES :
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. BOUAITY Brahim* ORL
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique
Pr. DAMI Abdellah* Biochimie chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. ERRABIH Ikram Gastro entérologie
Pr. LAMALMI Najat Anatomie pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie générale
Pr. NAZIH Mouna* Hématologie
Pr. ZOUAIDIA Fouad Anatomie pathologique
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique
Pr. ABOUELALAA Khalil* Anesthésie Réanimation
Pr. BELAIZI Mohamed* Psychiatrie
Pr. BENCHEBBA Driss* Traumatologie Orthopédique
Pr. DRISSI Mohamed* Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale
Pr. EL KHATTABI Abdessadek* Médecine Interne
Pr. EL OUAZZANI Hanane* Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOUR Mourad Anesthésie Réanimation
Pr. AWAB Almahdi Anesthésie Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale
Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie
Pr. BENNANA Ahmed* Informatique Pharmaceutique
0.
Pr. BENSGHIR Mustapha* Anesthésie Réanimation
Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation
Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation
Pr. EN-NOUALI Hassane* Radiologie
Pr. ERRGUIG Laila Physiologie
Pr. FIKRI Meryim Radiologie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. NEJJARI Rachid Pharmacognosie
Pr. OUBEJJA Houda Chirurgie Pédiatrique
Pr. OUKABLI Mohamed* Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua* Gastro-Entérologie
Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale
Pr. GHOUNDALE Omar* Urologie
Pr. ZYANI Mohammad* Médecine Interne
MARS 2014
ACHIR ABDELLAH Chirurgie Thoracique
BOUCHIKH MOHAMMED Chirurgie Thoracique
EL KABBAJ DRISS Néphrologie
EL MACHTANI IDRISSI SAMIRA Biochimie-Chimie
HARDIZI HOUYAM Histologie- Embryologie-Cytogénétique
HASSANI AMALE Pédiatrie
HERRAK LAILA Pneumologie
JANANE ABDELLA TIF Urologie
JEAIDI ANASS Hématologie Biologique
KOUACH JAOUAD Génécologie-Obstétrique
LEMNOUER ABDELHAY Microbiologie
MAKRAM SANAA Pharmacologie
OULAHYANE RACHID Chirurgie Pédiatrique
RHISSASSI MOHAMED JMFAR CCV
SABRY MOHAMED Cardiologie
SEKKACH YOUSSEF Médecine Interne
TAZL MOUKBA. :LA.KLA. Génécologie-Obstétrique
*Enseignants Militaires
DECEMBRE 2014
ABILKACEM RACHID' Pédiatrie
AIT BOUGHIMA FADILA Médecine Légale
BEKKALI HICHAM Anesthésie-Réanimation
BENAZZOU SALMA Chirurgie Maxillo-Faciale
BOUABDELLAH MOUNYA Biochimie-Chimie
BOUCHRIK MOURAD Parasitologie
DERRAJI SOUFIANE Pharmacie Clinique
DOBLALI TAOUFIK Microbiologie
EL AYOUBI EL IDRISSI ALI Anatomie
EL GHADBANE ABDEDAIM HATIM Anesthésie-Réanimation
EL MARJANY MOHAMMED Radiothérapie
FE]JAL NAWFAL Chirurgie Réparatrice et Plastique
JAHIDI MOHAMED O.R.L
LAKHAL ZOUHAIR Cardiologie
OUDGHIRI NEZHA Anesthésie-Réanimation
Rami Mohamed Chirurgie Pédiatrique
SABIR MARIA Psychiatrie
SBAI IDRISSI KARIM Médecine préventive, santé publique et Hyg.
Tahri latifa Rhumatologie
JANVIER 2016
BENKABBOU AMINE Chirurgie Générale
EL ASRI FOUAD Ophtalmologie
ERRAMI NOUREDDINE O.R.L
NITASSI SOPHIA O.R.L
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques
Pr. BOURJOUANE Mohamed Microbiologie
Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. DRAOUI Mustapha Chimie Analytique
Pr. EL GUESSABI Lahcen Pharmacognosie
Pr. ETTAIB Abdelkader Zootechnie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. HAMZAOUI Laila Biophysique
Pr. HMAMOUCHI Mohamed Chimie Organique
Pr. IBRAHIMI Azeddine Biologie moléculaire
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Pr. ZELLOU Amina Chimie Organique
Mise à jour le 14/12/2016 par le
A ma très chère mère :
Zahira Belbaraka
Une femme exceptionnelle, femme au grand cœur, femme pleine
de grâce, femme forte et qui peut tout, la plus douce et la plus
aimante des mères et quelle chance que tu sois mienne.
Comme le soleil qui ne s’arrête jamais de briller Tu m’as comblé
avec ta tendresse et ton affection tout au long de mon parcours.
Maman chérie, toi qui a œuvré pour ma réussite, de par ton amour,
ton soutien, tous les sacrifices consentis et tes précieux conseils,
pour toute ton assistance et ta présence dans ma vie, reçois à
travers ce travail aussi modeste soit-il, l'expression de mes
sentiments et de mon éternelle gratitude.
Puisse Dieu te procurer longue vie, santé et bonheur afin que je
puisse te rendre un minimum de ce que je te dois.
A la mémoire de mon père :
Mohamed Bouja
Je n’aurais pas le plaisir de partager cet événement
avec toi, mais tu demeureras dans mon cœur et à jamais.
J’espère que je serais à la hauteur des valeurs
que tu as semées en moi.
Aucune dédicace ne serait exprimer mon amour éternel
et mon chagrin en exposant cette thèse en votre absence.
Ni la mort ni le temps vous ferons oublier.
Que Dieu, le miséricordieux, vous accueille
A la mémoire de mon grand-père
Mhmed Belbaraka
A ma grande mère Ghita Khairat
Pour votre amour, vos prières et vos encouragements
qui m’ont été d’un grand soutien au cours de ce long parcours.
Je suis sûre que vous êtes fières de moi aujourd’hui
Vous êtes pour moi une source inépuisable de sagesse.
A mes frères : Khalil et Oussama
Je vous dédie ce travail en témoignage
de mon amour et mon attachement.
Vous avez toujours été près de moi, et toujours
offert beaucoup de tendresse et d’affection et toujours
épaulée pendant mon parcours estudiantin.
Puisse nos fraternels liens se pérenniser et consolider encore.
Je ne pourrais d’aucune manière exprimer ma profonde
affection et mon immense gratitude pour votre aide et votre
A ma tante et mon oncle :
Najah Belbaraka et
Nourdine Nesnassi
Vous qui m’avez toujours soutenu et encouragé.
Je vous remercie énormément pour votre hospitalité et votre
générosité durant toutes ces années, grâce à vous
je me suis senti pratiquement chez moi.
Voila le jour que vous avez attendu plus impatiemment
que moi et sera l’occasion de partager une joie
avec votre complicité habituelle.
A mes meilleures amies :
Noussaiba, Dounia et Oumaima
Vous êtes la définition même de l’amitié, vous êtes toujours
là pour moi. Une présence chaleureuse, bienveillante,
qui sait me faire du bien. Vous me connaissez mieux
que quiconque et c'est réciproque.
A l'instar des bons souvenirs, les véritables amis deviennent
de plus en plus précieux avec le temps.
Je suis si heureuse que vous faites partie de ma vie.
A Manal, Sara, Hasna, Mounir etAnass
A ma grande famille
A notre maitre et président du jury
Monsieur le professeur Yahya Cherrah
Professeur de Pharmacologie
Grande a été notre joie et profonde notre gratitude lorsque
vous avez accepté de présider le jury de notre thèse en
mettant votre confiance en notre travail.
Nous sommes très sensibles au grand honneur que vous
nous faites.
Nous vous présentons tout notre respect devant vos
compétences professionnelles, vos qualités humaines et
votre disponibilité.
Veuillez agréer, cher maître, l’expression de notre vive
reconnaissance, notre profond respect et notre
A notre maitre et rapporteur de thèse
Monsieur le professeur Abdelaziz Bouklouse
Professeur en applications pharmaceutique
Je vous suis infiniment reconnaissante pour votre
investissement dans ce travail.
Je vous remercie pour la confiance que vous m’avez
témoignée en m’attribuant ce sujet de thèse, pour votre
disponibilité, votre patience et vos conseils qui m'ont été
extrêmement précieux tout au long de ce travail.
Vous m’avez toujours réservé un bon accueil malgré
vos obligations professionnelles. Je suis très heureuse
de pouvoir exprimer ma profonde gratitude
pour tous les efforts que vous avez déployés
A notre maitre et juge de thèse
Monsieur le professeur Abdelkader Laatiris
Professeur de pharmacie galénique
Nous sommes très honorés de vous avoir
parmi ce jury de thèse.
Puisse ce travail témoigner de ma reconnaissance
et de l’estime que je porte à votre personne.
Veuillez croire à nos sincères remerciements.
A notre maitre et juge de thèse
Monsieur le professeur Mustapha Bouatia
Professeur de chimie analytique
Vous avez accepté de juger ce travail avec
une spontanéité et une simplicité émouvante.
C’est pour nous un grand honneur de vous voir siéger
parmi le jury de cette thèse.
Nous tenons à vous exprimer nos sincères
remerciements et profond respect.
Liste
LISTE DES ABREVIATIONS :
AMDEC : Analyse des modes de défaillance, de leurs effets et de leur
criticité
ANOVA : Analyse de variance
AQBD : La qualité par conception analytique
ASTM : American society for testing and material
ATP : Profile cible analytique
BBD : Plan de BOX Behnken
BPF : Bonne pratique de fabrication
CAPA : Action corrective / Action préventive
CCD : Plan central composite
CI : Intervalle de confiance
CMA : Attribut critique de matériel
CNQ : Cout de non qualité
COQ : Cout de la qualité
CPP : Paramètre critique de procédé
CQA : Attribut critique de qualité
CTD : Document technique commun
DAD : Détecteur à barrettes de diode
DDL : Degré de liberté
DF : fonction de désirabilité
DM : Matrice de Doehlert
DOE : Plan d’expériences
EFPIA
:
Fédération
européenne
des
associations
des
industries
pharmaceutiques
EP : Pharmacopée européenne
EMA : Agence européenne des médicaments
FMEA : Mode de défaillance et analyse des effets
GMP : Bonne pratique de fabrication
HPLC : Chromatographie liquide haute performance
ICH : Conférence internationale d’harmonisation
IR : Infrarouge
ISO : Organisation international de normalisation
MND : Métronidazole
MODR : Zone de conception opérationnelle de la méthode
MP : Matière première
MRP : Méthodologie de résolution de problèmes
MSA : Analyse des systèmes de mesure
NOR : Zone opérationnelle normale
OFAT : Un seul facteur à la fois
OOC : Hors contrôle
OOS : Hors de spécification
OOT : Hors tendance
PA : Principe actif
PAT : Technologie analytique de procédé
PHRMA : Fabricants et chercheurs pharmaceutiques d’Amérique
PM : Phase mobile
QRM : Management du risque qualité
QTPP : Profile de qualité cible du produit
RA : Evaluation du risque
R&D : Recherche et développement
SST : Test d'aptitude du système
USP : Pharmacopée américaine
UV : Ultra violet
VTF : Facteur d’inflation de la variance
WHO : Organisation mondiale de la santé
Liste
Listes des figures
Figure 1 : schéma du processus général de gestion de risque qualité selon l’ICH
Q9 ... 9
Figure 2 : Schéma illustrant un système de qualité pharmaceutique selon l’ICH
Q10 ... 11
Figure 3 : relation entre les GMP et les ICH Q8, Q9, Q10 ... 12
Figure 4 : modèle de diagramme d’Ishikawa ... 18
Figure 5 : interaction entre la gestion du risque qualité et le quality by design 19
Figure 6 : représentation de l’espace de connaissance, de l’espace de conception
et de l’espace de fonctionnement normale ... 20
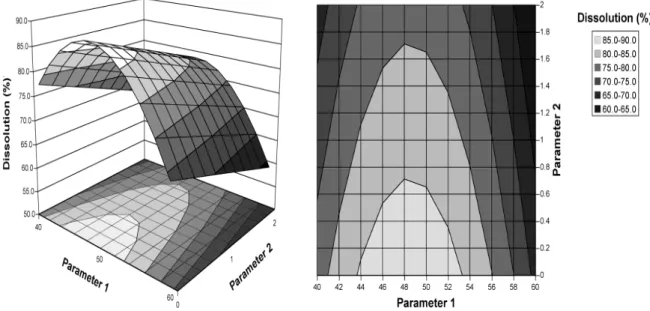
Figure 7 : pourcentage de dissolution d’un comprimé en fonction des
paramètres 1 et 2 ... 21
Figure 8 : l’approche linéaire et non linéaire ... 22
Figure 9 : représentation des valeurs acceptables du taux de dissolution et du
taux de friabilité en fonction des paramètres 1 et 2 ... 23
Figure 10 : design space de paramètres influençant plusieurs CQA ... 23
Figure 11 : les différents niveau de la stratégie de contrôle (Lawrence, Amidon
et al. 2014)... 25
Figure 12 : stratégie de contrôle, espace de conception et PAT ... 26
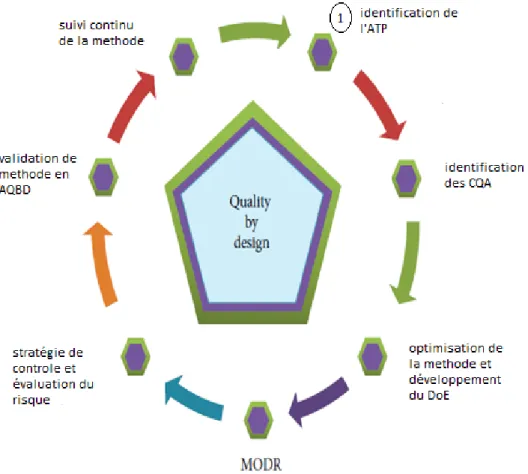
Figure 13 : les outils et le cycle de vie de l’AQbD... 29
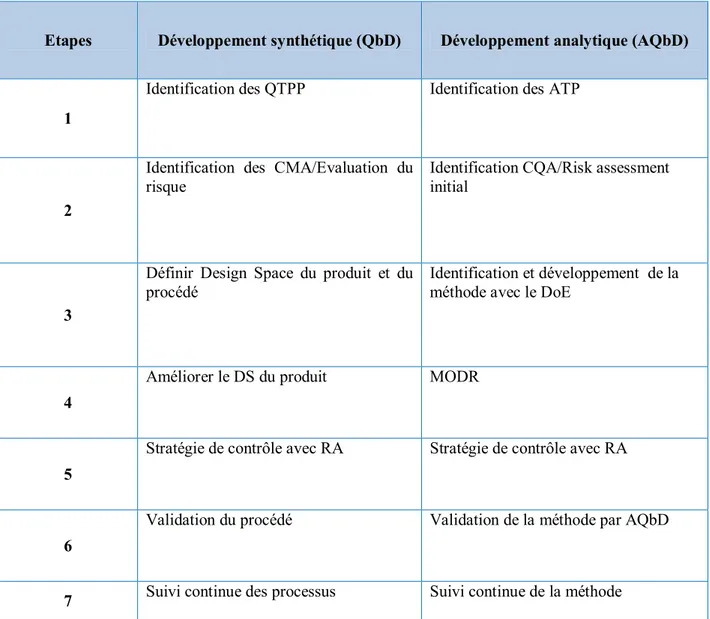
Figure 14 : Développement synthétique de l’API et l’approche AQbD. ... 31
Figure 15 : mise en œuvre de l’AQBD ... 34
Figure 17 : les activités liées à la construction de l'espace des connaissances .. 36
Figure 18: Facteurs impliqués dans la définition efficace de l’ATP ... 38
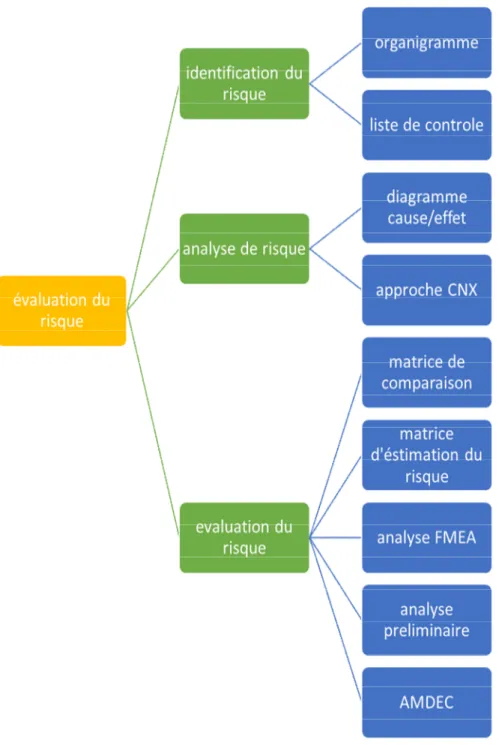
Figure 19 : Une séquence des étapes impliquées dans l'évaluation des risques et
les différents outils impliqués dans le processus comme mentionné
dans les lignes directrices de l’ICH Q9. ... 41
Figure 20 : fishbone pour l’identification du risque ... 43
Figure 21: le modèle général d’un processus ou d’un système. ... 44
Figure 22 : le MODR et le NOR dans l’espace de connaissance ... 46
Figure 23 : Répartition des entreprises interrogées selon qu'ils ont mis en œuvre
la qualité d'analyse par la conception (AQbD) et leur taille ... 55
Figure 24 Les plans d’expériences optimisent les trois parties encadrées du
processus d’acquisition des connaissances. ... 61
Figure 25(a) : Un cube qui se compose du point central et des points médians
des bords ... 65
Figure 25(b) : Une figure de trois dessins factoriels 2
2entrelacés et un point
central, ... 65
Figure 26: Désirabilité (di) d’une réponse Yi pour un facteur considéré ri... 70
Figure 27 : structure chimique de la spiramycine... 74
Figure 28 : structure chimique du métronidazole ... 74
Figure 29 : Corrélation entre la résolution et le pourcentage de la phase mobile
... 83
Figure 30 : Corrélation entre la résolution et le pH ... 84
Figure 31 : Corrélation entre la résolution et le Débit ... 84
Figure 32 : Corrélation entre le temps de rétention et le pourcentage la phase
Figure 34 : Corrélation entre le temps de rétention et le débit ... 86
Figure 35 : Corrélation entre la résolution obsérvé et celle prédite ... 90
Figure 36 : Corrélation entre le temps de rétention obsérvé et celui prédit ... 94
Figure 37: profiles d’interaction entre les CQA et les CMA (résolution) ... 95
Figure 38: profiles d’interaction entre les CQA et les CMA (temps de rétention)
... 96
Figure 39 : courbe d’Iso-réponse de la résolution en fonction des CMA ... 97
Figure 40 : courbe d’Iso-réponse du temps de rétention en fonction des CMA 98
La figure 41 : variation de la fonction de désirabilité en fonction des CQA et
CMA ... 101
Figure 42 : représentation graphique du MODR ... 99
Figure 43 : Chromatogramme après optimisation. ... 102
Figure 44 : profil d’exactitude pour la métronidazole avec un modèle de
régression y=ax+b (pour λ=5% et β =80% ... 104
Figure 45 : profil d’exactitude pour la spiramycine avec un modèle de
Liste des tableaux
Tableau I : liste des lignes directrices réglementaires ou d'autres activités liées
au QbD ... 14
Tableau II : Outils QbD pour le développement synthétique et le
développement analytique ... 32
Tableau III : Type de caractéristiques de performance de la méthode selon USP
et ICH Q2(R1) ... 39
Tableau IV : Sélection des outils du DoE en AQbD ... 45
Tableau V : Comparaison entre la méthode analytique traditionnelle, QbD et
AQbD ... 54
Tableau VI : Mise en œuvre du concept AQbD au cours du processus de
développement de médicament ... 57
Tableau VII : Type de méthodes auxquels les concepts de l'AQbD ont été
appliqués ... 58
Tableau VIII : Niveaux de facteurs codés pour un plan BOX BEHNKEN d'un
système à trois facteurs ... 66
Tableau IX: Niveaux de facteurs codés pour les BBD pour l'optimisation à cinq
facteurs ... 67
Tableau X: Comparaison de l'efficacité du CCD, BBD et du DM ... 68
Tableau XI: Conditions chromatographiques du dosage simultané de
Spiramycine et du Métronidazole ... 76
Tableau XII: Le profile analytique cible pour une méthode HPLC de dosage de
SPR et MND ... 77
Tableau XIII: Résultats du criblage préliminaire ... 79
Tableau XIV: Domaine expérimentale ... 79
Tableau XV: Plan d'expérience selon le BBD ... 80
Tableau XVI: Les expériences réalisé selon le BBD en facteurs réels ... 81
Tableau XVII: Solutions relatives au MND ET SPR ... 82
Tableau XVIII: Corrélations entres les CQA et CMP ... 87
Tableau XIX : estimation des coefficients du modèle quadratique pour la
résolution ... 88
Tableau XX classification des coefficients selon leur effet ... 88
Tableau XXI : Résultats de l'analyse de variance du modèle quadratique ... 89
Tableau XXII: le manque d'ajustement du modèle ... 90
Tableau XXIII : estimation des coefficients du modèle quadratique pour la
résolution ... 92
Tableau XXIV: classification des coefficients selon leur effet ... 92
Tableau XXV: résultats de l'analyse de variance du modèle quadratique pour le
temps de rétention ... 93
Tableau XXVI : Résultats du manque d'ajustement ... 94
Tableau XXVII: détermination des coefficients du modèle d’étalonnage pour
chaque série ... 103
Tableau XXVIII: récapitulatif des résultats de justesse, fidélité et exactitude 105
Tableau XXIX: récapitulatif des résultats de justesse, fidélité et exactitude .. 105
Tables des matières
INTRODUCTION GENERALE : ...1
Revue de littérature ...4 CHPITRE I: LA QUALITE PAR LA CONCEPTION:...5
I.1 INTRODUCTION ...5 I.2 LES RECOMMANDATIONS DE L’ICH ET LA FDA: ...7 I.2.1 La FDA: ...7 I.2.2 ICH Q8 (R2) : « développement pharmaceutique » ...7 I.2.3 ICH Q9 : « gestion de risque de la qualité » ...8 I.2.4 ICH Q10 : « Pharmaceutical Quality system » ... 10 I.3 Histoire/Aspects réglementaires :... 12 I.4 Les éléments du QbD pharmaceutique : ... 15 I.4.1 QTPP : ... 15 I.4.2 CQA : ... 16 I.4.3 Les attributs de matériels (MA) et les paramètres du procédé(PP) : ... 16 I.4.4 L’évaluation du risque (RA) :... 18 I.4.5 L’espace de conception (DS) : ... 20 I.4.6 Stratégie de Contrôle :... 24 I.4.7 Amélioration continue : ... 27
CHPITRE II LA QUALITE PAR LA CONCEPTION POUR LES METHODES
ANALYTIQUES : ... 28
II.1 INTRODUCTION : ... 28 II.2 IMPLÉMENTATION DE L’AQBD : ... 34 II.2.1 Création de l’espace de connaissance : ... 35 II.2.2 Profile analytique cible (ATP) : ... 37 II.2.3 Les caractéristiques de performance de la méthode analytique: ... 39 II.2.4 Évaluation du risque: ... 40
II.2.8 AQbD et la Validation analytique: ... 47 II.2.9 Evaluation continue : ... 48
II.3 COMMENT METTRE EN ŒUVRE L’AQBD DANS LA PRATIQUE
ACTUELLE : ... 48 II.4 AVANTAGES, LIMITES ET APPLICATIONS DE L’AQBD : ... 49 II.4.1 Les défis: ... 49 II.4.2 Avantages : ... 50 II.4.3 Facteurs empêchant la mise en œuvre de l'AQbD : ... 51
II.5 COMPARAISON ENTRE L’APPROCHE TRADITIONNELLE ET LES
APPROCHES DE QBD : ... 52
II.6 ÉVALUATION DES PROGRÈS DE LA QUALITÉ PAR CONCEPTION
ANALYTIQUE ... 55 II.6.1 Implémentation : ... 55 II.6.2 Détails techniques et défis avec la mise en œuvre ... 56
CHPITRE III PLANS D’EXPERIENCES ET OPTIMISATION ... 59
III.1 INTRODUCTION : ... 59 III.1.1 Processus d’acquisition des connaissances : ... 60 III.1.2 Choix de la méthode d’expérimentation:... 62 III.1.3 Analyse des résultats: ... 62 III.1.4 Acquisition progressive de la connaissance: ... 62 III.2 MODÉLISATION : ... 62 III.3 OPTIMISATION : ... 63 III.4 BOX-BEHNKEN COMME OUTIL D'OPTIMISATION MULTIVARIÉE : ... 65 III.5 OPTIMISATION SIMULTANÉE DE PLUSIEURS RÉPONSES (FONCTION DE DÉSIRABILITÉ) : ... 69
PARTIE EXPERIMENTALE ... 72 CHPITRE IV Partie expérimentale et traitement de donnés: ... 73
IV.1 INTRODUCTION : ... 73 IV.2 MATÉRIELS ET MÉTHODES : ... 75
IV.2.2 : Définir l’ATP et les CQA ... 76 IV.2.3 Préparation des solutions : ... 78 IV.2.4 Études de dépistage des facteurs (factors sreening): ... 78 IV.2.5 Domaine expérimentale et sélection des repenses : ... 79 IV.2.6 Optimisation de la méthode analytique en se basant sur les principes
du QbD : ... 80 IV.2.7 Analyse des données d'optimisation basée sur QbD: ... 81 IV.2.8 Validation analytique de la méthode: ... 82 i. Préparation de standard de calibration: ... 82 ii.Standard de validation: ... 82 IV.3 RÉSULTATS : ... 83 IV.3.1 Les résultats de l’optimisation: ... 83 i.Analyse descriptive : ... 83 ii.Optimisation par le plan de Box-Behnken (Résolution): ... 87 a) Estimation des coefficients du modèle quadratique ... 87 b) Validation du modèle : ... 89 iii.Optimisation par le plan de Box-Behnken (Temps de rétention): ... 91 a) Estimation des coefficients du modèle quadratique ... 91 b) Validation du modèle : ... 93 IV.3.2 Les graphiques des interactions : ... 95 IV.3.3 Les courbes d’Iso-réponses : ... 97 IV.3.4 Création du MODR: ... 99 IV.3.5 La fonction de désirabilité ... 100 IV.3.6 Résultats de la validation : ... 103 IV.4 DISCUSSION : ... 106 IV.5 CONCLUSION : ... 108
CHPITRE V CONCLUSION GENERALE :... 110 RESUME ... 111 ANNEXES ... 115
Introduction
générale :
Une petite révolution culturelle est en cours dans le développement pharmaceutique , encouragées par les autorités réglementaires, les entreprises pharmaceutique se concentrent de plus en plus sur la qualité par la mise en œuvre d'outils scientifiques tels que QbD (Quality by Design) et PAT (Process Analytical Technology) (1).
Le concept de qualité par la conception (QbD) a été récemment adopté pour le développement de procédés pharmaceutiques pour assurer une qualité de produit prédéfinie (2-4). À la fois logique et complexe, le QbD vise à mieux connaitre les caractéristiques du produit et du procédé de fabrication en les explorant aux limites et en identifiant les paramètres critiques. La finalité est d’atteindre la qualité requise du produit, non pas par une valeur cible, mais par une plage de valeur dénommée Design Space (DS) : espace multifactoriel dans lequel les paramètres de production peuvent varier sans altérer la qualité du produit final.
La démonstration d'une meilleure compréhension des sciences pharmaceutiques et de production peut créer la base d'une approche réglementaire flexible. Cette flexibilité par rapport aux autorités réglementaires est un des nombreux bénéfices qu’octroie l’application du QbD. En effet, on peut noter que cette méthodologie augmente les connaissances scientifiques vis-à-vis du produit et de son procédé de production et permet un meilleur contrôle de la qualité du produit tout au long de son cycle de vie et une maitrise accrue des coûts de développement et de production. Ainsi, le quality by design tend vers un système de développement pharmaceutique plus efficace et plus robuste.
Selon le système de qualité pharmaceutique (lignes directrices de l'ICH Q10) (5), les méthodes analytiques sont des éléments clés de la stratégie de contrôle des processus (6-8). Ainsi, la mise en œuvre du QbD analytique (AQBD) dans le processus de fabrication en tant que stratégie de contrôle garantira des performances et une qualité de produit prédéterminées. Cela comprend les paramètres et les attributs liés aux composants des substances médicamenteuses et des composants des produits pharmaceutiques, y compris l'installation,
L'accent mis sur son application aux méthodes analytiques a récemment augmenté, en faisant l’objet de plusieurs publications et présentations (9-17).
Le cadre d’AQbD initialement proposé décrivait un objectif visant à fournir des méthodes analytiques robustes et bien comprises pour un contrôle efficace des processus de livraison de produits pharmaceutiques de haute qualité, bien caractérisés et contrôlés ainsi qu'une flexibilité réglementaire pour gérer adéquatement les méthodes analytiques tout au long du cycle de vie du produit.
Donc La dépendance du développement et de la fabrication pharmaceutiques à l'égard des données analytiques robustes, intensifie de plus en plus le besoin de l’AQbD dans le développement analytique de méthode.
L’objectif de ce document est de réaliser une optimisation selon les principes de l’AQBD pour une méthode de dosage simultané de la Spiramicyne et le métronidazole par RPHPLC couplé à un détecteur à barrettes de diode.
CHPITRE I : LA QUALITE PAR LA CONCEPTION:
I.1
INTRODUCTION
La qualité est l'une des critères fondamentaux en plus de la sécurité et l'efficacité pour toute entité d'être qualifié et approuvé comme un médicament. Pour assurer la cohérence des performances des produits et des systèmes pharmaceutiques, l'accent a récemment été mis sur la construction et la conception de la «qualité» plutôt que de simplement la tester. Cette philosophie constitue la base du QbD.
Le conseil international d'harmonisation des exigences techniques pour l'enregistrement des médicaments à usage humain (ICH) et selon l’ICH Q8 (R2) (3) décrit le QbD comme
«une approche systématique du développement pharmaceutique qui commence par des objectifs prédéfinis et insiste sur la compréhension et le contrôle des produits et des processus, basés sur une saine gestion des risques scientifiques et qualitatifs».
La qualité par la conception (QbD) est un concept développé pour la première fois par le pionnier de la qualité Dr. Joseph M. Juran (18), qui estime que la qualité doit être conçue en un produit et que la plupart des crises et des problèmes de qualité se rapportent à la façon dont le produit a été conçu en premier lieu.
L'administration américaine des denrées alimentaires et des médicaments (FDA) encourage les approches fondées sur le risque et l'adoption des principes QbD dans le développement, la fabrication et la réglementation de produits pharmaceutiques. L'accent de cette organisation sur le QbD a commencé avec la reconnaissance que l'augmentation des tests n'améliore pas nécessairement la qualité des produits, et que La qualité doit y être intégrée.
Au fil des ans, le QbD pharmaceutique a évolué avec la publication d'ICH Q8 (développement pharmaceutique), ICH Q9 (Quality Risk Management) et ICH Q10 (Pharmaceutical Quality System) (3, 5, 19). Ces documents fournissent des orientations de haut niveau en ce qui concerne la définition et la portée de
QbD comme elle s'applique à
l'industrie pharmaceutique.
Les buts de QbD pharmaceutique peuvent inclure ce qui suit:
1. Obtenir des spécifications de qualité des produits qui soient fondées sur la performance clinique,
2. Augmenter la capacité du processus et réduire la variabilité et les défauts du produit en améliorant la conception, la compréhension et le contrôle des produits et des procédés,
3. Accroître l'efficacité du développement et de la fabrication des produits,
4. Améliorer l'analyse des causes profondes et la gestion des changements après approbation.
En vertu de QbD, ces objectifs peuvent souvent être atteints en reliant la qualité du produit aux performances cliniques souhaitées, puis en concevant une formulation robuste et un processus de fabrication pour offrir uniformément la qualité de produit souhaitée.
I.2
LES RECOMMANDATIONS DE L’ICH ET LA FDA:
I.2.1 La FDA:
En 2002, la FDA lance une nouvelle initiative pour améliorer et moderniser les règlements de qualité pharmaceutique pour les médicaments humains. Les objectifs principaux sont :
d’encourager l'adoption de nouvelles avancées technologiques par l'industrie pharmaceutique,
de faciliter la mise en œuvre des systèmes de qualité,
d’encourager la mise en place d’une gestion de risque, à la fois pour l'industrie et les organismes régulateurs, sur des domaines critiques.
Le résultat final de cette initiative est un rapport publié en septembre 2004 intitulé : «
Pharmaceutical cGMPs for the 21st Century – A Risk-Based Approach » (2). Afin de
standardiser la Qualité et de promouvoir l’harmonisation de ses règlements, l’autorité règlementaire de l’ICH crée, en 2003, des groupes de travail pour développer un système de qualité pharmaceutique. Ce système est basé sur une approche scientifique et un management du risque qualité. Ainsi sont publiées, à partir de 2004, les recommandations de l’ICH Q8, Q9 et Q10 centrées sur le développement pharmaceutique, la mise en œuvre de la gestion des risques qualité et l'amélioration continue.
I.2.2 ICH Q8 (R2) : « développement pharmaceutique » (3)
Avant 2004, l’union européen et les Etats-Unis avaient leurs propres directives par rapport à la section 3.2.P (concernant les produits pharmaceutiques finis) du module qualité du document technique commun (CTD : format de dossier servant à la soumission des demandes d'autorisation de mise sur le marché) se rapportant au développement pharmaceutique, par conséquent des différences significatives ont eu lieu, et principalement au niveau des informations dans le dossier d’enregistrement. La mise en place de cette nouvelle guideline a permit une évaluation beaucoup plus simple, cadré et pertinente des
éléments critique du dossier. En effet l’ICH Q8 a conduit à une meilleure compréhension de la stratégie développé par l’industriel.
L’ICH Q8 (2) décline deux parties complémentaires :
La première partie décrit le contenu suggéré de la section 3.2.P8 (20) d’une soumission réglementaire au format CTD. Cette section fournit les connaissances acquises, par l’application d’approches scientifiques, au cours du développement d’un produit et de son procédé de fabrication. Le degré de flexibilité réglementaire est basé sur le niveau de connaissance scientifique appropriée fournie.
La seconde partie de cette recommandation apporte de nouvelles précisions sur la façon de mettre en pratique les principaux concepts de l’ICH Q8, notamment par l’application du Quality by Design.
I.2.3 ICH Q9 : « gestion de risque de la qualité » (21)
Déjà intégré dans le fonctionnement de nombreuses industries aéronautiques, nucléaires, etc. l’ICH Q9, publié en 2005, se concentre sur la maitrise du risque qualité dans l’industrie pharmaceutique. La recommandation ICH Q9 fournit des directives sur une approche systématique de la gestion du risque qualité, facilitant le respect des BPF et autres exigences en matière de qualité. Les deux principes de base de cette gestion du risque qualité sont les suivants :
l’évaluation du risque qualité doit être basée sur des connaissances scientifiques, le niveau d’effort, de formalité et de documentation doit être proportionnel au
niveau de risque.
La gestion du risque qualité est un processus systématique qui a pour but de coordonner, faciliter et améliorer les décisions scientifiques prises en tenant compte du risque tout au long de la vie du produit.
Le processus proposé dans la directive (figure 1) se compose de 4 étapes : estimation du risque (Risk Assessment)
contrôle du risque (Risk Control)
la communication du risque (Risk Communication) la revue du rique (Risk Review)
gestion du risque s’effectue sur la base des outils comme : diagramme de Pareto, approche processus, AMDEC, MRP, métrologie, QQOCQP, audit qualité, revue de direction, COQ, 5M, brainstorming, manuel qualité, système documentaire, indicateurs, tableaux de bord, vote pondéré, matrice de compatibilité, contrôle par échantillonnage, plans d'expériences… Certains sont nécessaires pour un pilotage efficace de l'entreprise, d'autres pour résoudre ou prévenir un problème, valider la conception d'un produit, vérifier la fiabilité d'un processus, suivre la qualité d'une fabrication, identifier les causes d'un dysfonctionnement …
I.2.4 ICH Q10 : « Pharmaceutical Quality system » (5)
La recommandation ICH Q10 décrit un modèle de système de gestion de la qualité efficace, destiné à l’industrie pharmaceutique et connu sous le nom de système de qualité pharmaceutique. Ce système, basé sur les concepts qualité des normes ISO version 2015, inclut les réglementations des BPF (bonnes pratiques de fabrication) et complète les recommandations ICH Q8 et Q9. Ainsi l’ICH Q10 définit la conception d’un processus de qualité prenant en compte les différentes étapes du cycle de vie d’un produit. La compréhension et l’application de ce document permet de lier étroitement les activités de développement et de production pharmaceutique et d’augmenter l’innovation et l’amélioration continue de la qualité d’un produit.
L’ICH Q10 décrit un modèle de système de qualité pharmaceutique ( PQS) dont l’objectif est de présenter un produit de qualité, d’établir et de maintenir le contrôle de cette qualité et de faciliter l’amélioration continue.
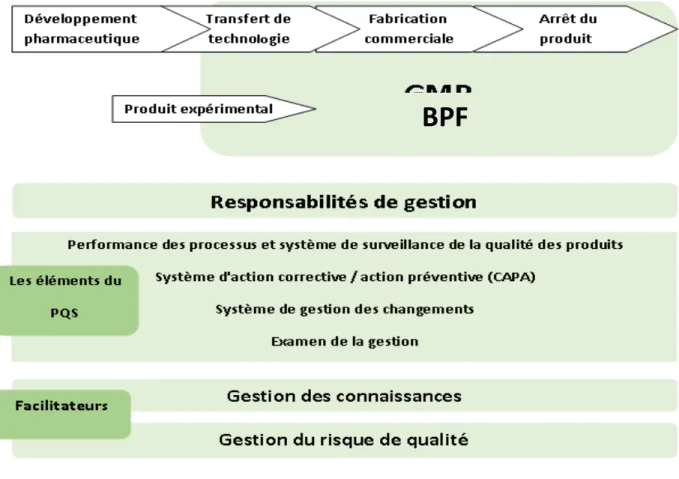
Le présent diagramme (figure 2) illustre les principales caractéristiques du modèle du système de qualité pharmaceutique de la directive Q10 de l'ICH. Le système de qualité pharmaceutique couvre le cycle de vie complet d'un produit comme l'illustre la partie supérieure du diagramme. Le diagramme montre également que les BPF régionales s'appliquent à la fabrication de produits expérimentaux.
Apres il illustre l'importance des responsabilités de gestion, à toutes les étapes du cycle de vie du produit. Ensuite il énumère les éléments du système de qualité pharmaceutique qui servent de principaux piliers dans le cadre du modèle. Ces éléments doivent être appliqués de façon appropriée et proportionnelle à chaque étape du cycle de vie.
L'ensemble de barres horizontales dans la partie inférieure représente les outils habilitants : gestion des connaissances et gestion des risques liés à la qualité qui sont
Figure 2 : Schéma illustrant un système de qualité pharmaceutique selon l’ICH Q10
1) Relation entre les BPF et les ICH Q8, Q9, Q10 :
La complémentarité des données contenues dans les guides BPF et ICH (Figure 3) permet, par une compréhension globale et une application ciblée et adaptée, à chaque entreprise de :
réduire les risques et les coûts opérationnels,
stimuler l’innovation et l’amélioration permanente,optimiser le processus de gestion des changements,
introduire des approches réglementaires flexibles.
BPF
Figure 3 : relation entre les GMP et les ICH Q8, Q9, Q10
I.3
Histoire/Aspects réglementaires :
Bien qu'il ait été considéré comme un nouveau paradigme dans l'industrie pharmaceutique, le QbD n'est pas récent. Dans les années 1950, les premières pensées de fenêtres opérationnelles, actuellement espace de conception (Design Space), ont apparus. Joseph M.Juran (18) a créé le QbD comme un terme dans les années 1970 et l'a popularisé dans les années 1990 avec plusieurs publications. Les agences de réglementation mondiales et l'industrie ont essayé de comprendre et de mettre en œuvre l'approche QbD du processus de fabrication, pendant près d'une décennie.
L'industrie pharmaceutique semble en retard, mais aussi avec les 30-40 années d'expérience sur le terrain, en effet, l'apprentissage et la mise en œuvre des phases peuvent être effectuées plus rapidement que d'autres industries (22).
Approach (2), dans le but de moderniser la réglementation de la fabrication et de la qualité des produits pharmaceutiques. Ce changement de paradigme de la qualité pharmaceutique est mis en évidence dans la «Technologie d'analyse des procédés (PAT) de la FDA: Directive pour l'industrie - Un cadre pour le développement pharmaceutique innovateur, la fabrication et l'assurance de la qualité».
Par ailleurs, les ICH Q9 (19), Q10 (5), Q8 (R2) (3) ont été publiés respectivement en, 2005, 2008 et 2009. Le QbD a été introduit pour la première fois dans le processus d'examen de la chimie, de la fabrication et des contrôles en 2004, à la suite des BPF du XXIe siècle (23).
En 2010, le Groupe de travail sur la mise en œuvre de la qualité de l'ICH a publié Q8 / Q9 / Q10 Questions & Réponses (R4) afin de préciser certains détails sur l'espace de conception, les essais en temps réel et la stratégie de contrôle [1].
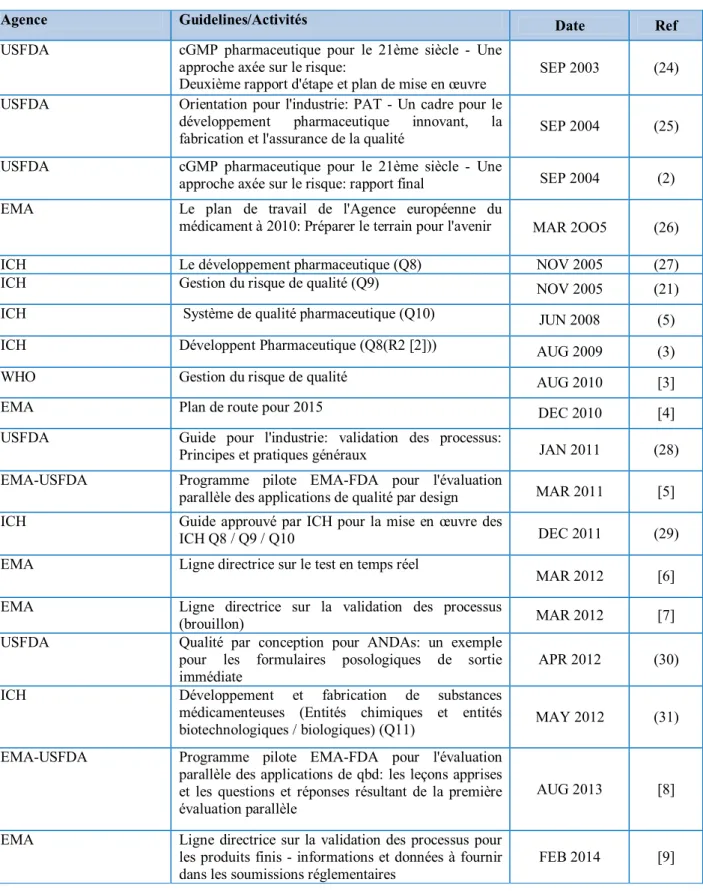
Le domaine du QbD pharmaceutique connait actuellement de nombreuses publications et guidelines réglementaires, qui sont énumérés dans le tableau I,
Il inclut également d'autres activités liées au QbD menées par divers autres organismes qui s'engagent à améliorer ou à réglementer la qualité des produits pharmaceutiques.
Tableau I : liste des lignes directrices réglementaires ou d'autres activités liées au QbD
Agence Guidelines/Activités Date Ref
USFDA cGMP pharmaceutique pour le 21ème siècle - Une approche axée sur le risque:
Deuxième rapport d'étape et plan de mise en œuvre
SEP 2003 (24) USFDA Orientation pour l'industrie: PAT - Un cadre pour le
développement pharmaceutique innovant, la
fabrication et l'assurance de la qualité SEP 2004 (25) USFDA cGMP pharmaceutique pour le 21ème siècle - Une
approche axée sur le risque: rapport final SEP 2004 (2) EMA Le plan de travail de l'Agence européenne du
médicament à 2010: Préparer le terrain pour l'avenir MAR 2OO5 (26) ICH Le développement pharmaceutique (Q8) NOV 2005 (27) ICH Gestion du risque de qualité (Q9) NOV 2005 (21) ICH Système de qualité pharmaceutique (Q10) JUN 2008 (5) ICH Développent Pharmaceutique (Q8(R2 [2])) AUG 2009 (3) WHO Gestion du risque de qualité AUG 2010 [3] EMA Plan de route pour 2015 DEC 2010 [4] USFDA Guide pour l'industrie: validation des processus:
Principes et pratiques généraux JAN 2011 (28) EMA-USFDA Programme pilote EMA-FDA pour l'évaluation
parallèle des applications de qualité par design MAR 2011 [5] ICH Guide approuvé par ICH pour la mise en œuvre des
ICH Q8 / Q9 / Q10 DEC 2011 (29) EMA Ligne directrice sur le test en temps réel
MAR 2012 [6] EMA Ligne directrice sur la validation des processus
(brouillon) MAR 2012 [7] USFDA Qualité par conception pour ANDAs: un exemple
pour les formulaires posologiques de sortie immédiate
APR 2012 (30) ICH Développement et fabrication de substances
médicamenteuses (Entités chimiques et entités
biotechnologiques / biologiques) (Q11) MAY 2012 (31) EMA-USFDA Programme pilote EMA-FDA pour l'évaluation
parallèle des applications de qbd: les leçons apprises
I.4
Les éléments du QbD pharmaceutique :
Dans l’approche de QbD pharmaceutique pour le développement d’un produit, un candidat identifie les caractéristiques qui sont critiques à la qualité du pont de vue du patient, les traduit en attributs de qualité critiques (CQA), et établit une relation entre les variables de formulation/fabrication et les CQA affin de délivrer de façon régulière un produit médicamenteux avec ces tels CQA pour le patient.
Le QbD se compose des éléments suivants (32) :
- Profile de qualité cible du produit (QTPP) qui identifie les attributs critiques de la qualité (CQA) du produit médicamenteux
- La conception et la compréhension des produits, y compris l'identification des attributs critiques de matériels (CMA)
- Conception et compréhension des processus, y compris l'identification des paramètres critiques du processus (CPP) et une compréhension approfondie des principes de mise à l'échelle, reliant les CMA et les CPP aux CQA
- Une stratégie de contrôle qui comprend des spécifications pour la ou les substances médicamenteuse, excipients et produits médicamenteux ainsi que des contrôles pour chaque étape du procédé de fabrication
- Capacité du processus et l’amélioration continue
I.4.1 QTPP :
Le QTPP, tel que défini par l’ICH Q8, est « un résumé prospectif des
caractéristiques qualités du produit qui doivent idéalement être satisfaites pour assurer la qualité souhaitée au regard de la sûreté et de l’efficacité du produit administré (3) ».
Etabli sur la base du profile cible du produit (TPP), dont l’objet est de décrire les objectifs cliniques et thérapeutiques du produit administré, le QTPP résume les éléments essentiels en relation avec l’efficacité et la sûreté du produit, permettant ainsi d’adapter le développement de la substance active et de la formulation galénique à la complexité et la spécificité du produit-cible.
Le QTPP représente la carte d’identité qualitative et quantitative du produit, par exemple : la forme pharmaceutique, le mode d’administration, le dosage, le type de conditionnement, etc. Ce document, qui peut être réalisé sous la forme d’un tableau (Annexe 1)est complété au fur et à mesure du développement.
Il semble évident qu'un nouveau produit devrait être adéquatement défini avant le début de tout travail de développement. Cependant, au fil des ans, la valeur de la prédéfinition des caractéristiques cibles du produit médicamenteux est souvent sous-estimée. Par conséquent, l'absence d'un QTPP bien défini a entraîné un gaspillage de temps et de ressources précieuses. Un article récent de Raw et al. (33) Illustre l'importance de définir le QTPP correct avant d'effectuer un quelconque développement.
I.4.2 CQA :
Les CQA sont définis par l’ICH Q8 comme une « propriété physique, chimique,
biologique ou microbiologique, ou caractéristique qui devrait être dans une limite appropriée, une gamme, ou une distribution pour assurer la qualité désirée du produit »(3).
Les caractéristiques de qualité d'un médicament peuvent inclure l'identité, l'essai, l'uniformité du contenu, les produits de dégradation, les solvants résiduels, la libération ou la dissolution du médicament, la teneur en humidité, les limites microbiennes et les attributs organoleptiques tels que la couleur, la forme, la taille, l'odeur, friabilité. Ces attributs peuvent être critiques ou non critiques. La gravité d'un attribut est principalement basée sur la gravité du préjudice pour le patient si le produit tombe en dehors de la limite acceptable pour cet attribut
I.4.3 Les attributs de matériels (MA) et les paramètres du procédé(PP) :
Un attribut critique de matériel (CMA) est une propriété physique, chimique, biologique ou microbiologique ou caractéristique d'un matériau d'entrée qui devrait se trouver dans une limite, une étendue ou une distribution appropriée pour assurer la qualité souhaitée de cette