FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.BIO/2017
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences Biologiques
Spécialité : Eau, Santé et Environnent
Présenté par :
CHABANECHAOUCHE Hanane
CHABANECHAOUCHE Sabrina
Thème
Etude de l’effet de pesticides et le pouvoir de
bioaccumulation chez les escargots dans la région de Bouira
Soutenu le :
28/ 06/ 2017Devant le jury composé de :
Nom et Prénom Grade
Mr Lebdiri Farid M.A.B Univ. de Bouira Président
Mm Chouih Siham M.A.A. Univ. de Bouira Promoteur
Dr Zouggaghe Fatah M.C.A Univ. de Bouira Examinateur
A dieu, le tout puissant de nous avoir donné la santé et la volonté d’entamer et de Terminer ce mémoire.
Avant de commencer la présentation de ce travail, je profite de l’occasion Pour remercier toutes les personnes qui ont contribué de près ou de loin
À la réalisation de ce projet de fin d’études.
Tout d’abord, ce travail ne serait pas aussi riche et n’aurait pas Pu avoir le jour
Sans l’aide et l’encadrement de Mme CHOUIH on la remercie pour la qualité de son
Encadrement exceptionnel, pour sa patience, sa rigueur et sa disponibilité durant
Notre préparation de ce mémoire.
Notre remercions Mr Lebdiri et Dr Zouggaghe pour leur présence et leur contribution à la valorisation de notre travail en faisant partie de notre jury
Notre remerciement s’adresse également à tous nos professeurs pour leurs générosités et la grande patience dont ils ont su faire preuve malgré leurs
charges académiques et professionnelles
C’est avec un grand plaisir que nous adressons nos sincères remerciements à l’égard de tout le personnel de l’institut de la formation professionnel de Lakhdaria ainsi que le personnel du laboratoire d’histologie de faculté de
médecine de Béjaia
Je remercie très chaleureusement Professeur CHIBANE Mohamed, toujours disponibles pour un coup de main. Sa sympathie, son aide et son attention nous
tiennent cordialement. Merci infiniment.
Je voudrais aussi remercier l’ensemble du personnel du laboratoire de notre faculté pour leur aide et surtout pour tous les bons moments passés en leur
Dédicace
Je dédie ce travail à:
Ma mère, qui a œuvré pour notre réussite, de par son amour,
son soutien, tous les sacrifices consentis et ses précieux
conseils, pour toute son assistance et sa présence dans notre vie,
reçois à travers ce travail, aussi modeste soit-il, l'expression de
nos sentiments et de notre éternelle gratitude.
Mon père, qui peut être fier en trouvant ici le résultat de
longues années de sacrifices et de privations pour nous aider à
avancer dans la vie.
Puisse Dieu faire en sorte que ce travail porte son fruit ; Merci
pour les valeurs nobles, l'éducation et le soutient permanent
venu de vous deux.
Nos sœurs qui n'ont cessé d'être pour nous des exemples de
persévérance, de courage et de générosité
Nos amies Himlat Iman, Hamidi Amira et Aoudi Ibtihel
représentes pour nous le symbole de la bonté par excellence, la
source de tendresse et l’exemple du dévouement qui n’a pas
cessé de nous encourager et d’avancer.
Liste de tableaux
Introduction………...1
Chapitre I : Description de l’indicateur biologique I. Définition du concept de bio-indication ... 3
I.1. Principales espèces bio-indicatrices ... 3
I.2. Les type de bio-indicateurs ... 4
I.3. Les différents niveaux de réponse des bio-indicateurs ... 4
II. Biologie de l’escargot ... 6
II.1.Présentation de taxon bio-indicatrice ... 6
II.2. Systématique ... 6
II.3. Description de l’escargot ... II.4. Déplacement ... 7
II.5. Longévité ... 8
II.6. Cycle biologique de l’escargot ... 8
II.6.1. La ponte ... 9
II.6.2.Incubation, éclosion ... 10
III. Ecologie de l’escargot ... 10
III.1.Habitat ... 10
III.1.Intérêt écologique important ... 10
III.2.Degré de sensibilité aux polluants ... 10
III.3.Processus d’accumulation ... 12
IV. Rythme de vie ... 13
IV.1.Activité saisonnière ... 13
IV.1.1.Hibernation ... 13
IV.1.2.Estivation ... 13
IV.2.Activité journalière ... 13
V. Régime alimentaire ... 14
VI. Formes de pollution affectant l’escargot………....15
VI.1. Pollution du sol……….………..15
VI.2. Pollution atmosphérique………….……….………...16
Chapitre II: matériel et méthode VII. Introduction……….……….…...16
VIII.2. Caractéristiques climatiques…..………17
IX. Présentation de la station d’étude………..………..19
IX.2. Présentation du site d’échantillonnage………..19
IX.2.1. Choix de site………..………...20
IX.2.2. Période adéquate….………….………...20
X.1.3. Ramassage des mollusques……….………..20
X.1.3.1. La recherche à vue……….………...…20
X.1.3.2. Création d’abris……….……….…...21
X.1.3.3. Piège attractif……..………..22
XI. Au laboratoire…..……….……….…22
XI.1.Matériel utilisé………...22
XI.2.Choix des traitements chimiques…...………...23
XI.3. Conditions d’élevage……..……….…….…24
XI.4. Mode de traitement……….………..24
XII. Préparation et sacrifice des escargots……….………...26
XII.1. Période de jeun………..…….……...26
XII.2.Congélation………...………..………….…26
XII.3. La dissection………...26
XIII. Réalisation des coupes histologique……..…….………...27
Chapitre III : Résultats……….…..35
Chapitre IV: Discussion………….………...44
Conclusion………...……….... 48
Nombre de figure
Titre Page
Figure n°01 Les différents niveaux de réponse des bio-indicateurs 5
Figure n°02 Photos d’un escargot prise pendant le ramassage 6
Figure n°03 Schéma de l’anatomie externe et interne de l’escargot 8
Figure n°04 Ondes de contraction sur la face ventrale des pieds d'escargots 7
Figure n°05 L’accouplement de deux partenaires d’escargots 9
Figure n°06 Schéma d’un escargot en position de ponte 10
Figure n°07 Transferts des polluants dans un écosystème terrestre 12
Figure n°08 Escargot en hibernation avec son épiphragme 14
Figure n°09 Escargot en estivation 14
Figure n°10 Localisation de site d’échantillonnage à Lakhdaria 18
Figure n°11 Diagramme ombro-thermique de BAGNOULS et GAUSSEN 19
Figure n°12 Les différentes catégories d’escargots prisent directement pendant le ramassage
22
Figure n°13 Des escargots récoltés au-dessous d’une planche de bois 22
Figure n°14 Des escargots récoltés à l’aide d’un piège attractif 23
Figure n°15 Escargots élevées au laboratoire 25
Figure n°16 Exposition des escargots à la nourriture contaminée 26
Figure n°17 Coupure de la coquille et fixation d’escargot dans la boite de pétri 27
Figure n°18 Isolement de poumon et d’hépatopancréas de l’escargot 28
déshydratation
Figure n°21 Station d’enrobage de type Leica 30
Figure n°22 Réalisation des blocs de paraffine contenant les tissus 31
Figure n°23 Moules métalliques déposés sur la plaque réfrigérante 32
Figure n°24 Ruban fin de coupes réalisé par un Microtome 32
Figure n°25 Etalement des coupes dans un bain-marie chauffé sur plaque chauffante
33
Figure n°26 Coloration des lames 34
Figure n°27 Coupes colorées et montées pour être observer au microscope optique 34
Figure n°28 Changement de comportement des escargots traités par apport aux escargots témoins
34
Figure n°29 Perte de poids escargots traité en différenciant avec celle de témoins 35
Figure n°30 Exemple d’un escargot mort durant l‘exposition 36
Figure n°31 Evolution du pourcentage de mortalité des escargots témoins et traités durant 28 jours jours de traitement
38
Figure n°32 Observations au microscope optique de coupes transversales d’une partie de l’hépatopancréas d’un escargot témoin (G×40)
38
Figure n°33 Observations au microscope optique de coupes transversales d’une partie de l’hépatopancréas des escargots traités (G×40)
39
Figure n°34 Observations au microscope optique de coupes transversales d’une partie de l’hépatopancréas des escargots agricoles (G×40)
40
Figure n°35 Observations au microscope optique de coupes transversales d’une partie de l’hépatopancréas des escargots traités (G×40)
partie des poumons des escargots témoins (G×40)
Figure n°37 Observations au microscope optique de coupes transversales d’une partie des poumons des escargots agricoles (G×40
43
Figure n°38 Observations au microscope optique de coupes transversales d’une partie de poumon des escargots traités (G×40)
Tableaux Titres de tableaux Pages Tableau n° I Situation climatique de la wilaya de bouira 2006 /2016 19 Tableau n° II Répartition des concentrations selon le type de traitement 25 Tableau n° III Mortalité des escargots adultes durant 28 jours de traitement 37
1 Introduction
Depuis une cinquantaine d’années, les phénomènes de pollution ont pris une importance de plus en plus grande sur les plans environnementaux, sanitaires, économiques et politiques. Dans l’environnement, les pollutions entraînent des perturbations au niveau des êtres vivants (faune et flore) et au niveau des compartiments abiotiques fondamentaux (eau, sol, atmosphère) des milieux (Mathias, 2011). A l’heure actuelle, on a besoin d’outils capables d’apprécier de manière aussi globale qu’intégrée l’impact des polluants dans le souci d’améliorer les connaissances sur leurs transferts et leur comportement dans tous les compartiments de l’environnement.
Dans ce sens, vient la recherche d’outils de bio-surveillance des effets des polluants émis dans l’eau, le sol, l’atmosphère. Le recours aux organismes vivants présente l’intérêt de les observer avec une vision plus écologique intégrant l’ensemble des facteurs environnementaux grâce à des organismes sentinelles (bio-indication) (Grand, 2011).
Dans cette optique, les mollusques gastéropodes terrestres pulmonés, sont considérés comme les indicateurs les plus privilégiés dans ce domaine, en raison de leur sédentarité dans les sols et de leur régime herbivore, ainsi, ils sont aisément contaminés par les divers polluants présents dans leur milieu et leur alimentation ; d’autre part, ils présentent des caractéristiques physiologiques, biologiques et écologiques variées, permettant de comparer l’influence de ces différents paramètres sur leurs réponses à la contamination de l’environnement d’où l’intérêt de leurs utilisations comme organismes test pour refléter l’état du milieu dans lequel ils vivent (Zaafour, 2014 et Benguedouar, 2016).
Dans ce contexte, les objectifs de ce travail sont la mise en évidence des capacités des gastéropodes terrestres à s’adapter à un stress chimique, pour cela nous nous proposons, dans un premier lieu, d’étudier les effets des différents traitements choisis sur le comportement des escargots à travers une étude physiologique (comportement, poids, mortalité….) ainsi que ses réactions internes via une étude histologiques pour deux organes : poumon et hépatopancréas, afin de compléter la panoplie des paramètres physiologiques sur des sujets prélevés au niveau de la région de Lakhdaira à Bouirra.
2 Pour y répondre, ce manuscrit est organisé en cinq grandes parties :
Le premier chapitre est consacré pour la description de l’indicateur biologique utilisé dans notre travail.
Le deuxième chapitre est consacré pour le matériel et les méthodes utilisé durant notre travail.
Le troisième chapitre est consacré pour la présentation des principaux résultats obtenus.
Le quatrième chapitre est consacré à l’interprétation des principaux résultats. Enfin, une conclusion générale de notre travail.
3 I. Définition du concept de bio-indication
Pendant de nombreuses années, les méthodes d’évaluations de la qualité des écosystèmes terrestres, reposaient presque exclusivement sur des mesures de paramètres chimiques de milieu. Ces méthodes traditionnelles, ne permettent pas toujours de connaître leur impact sur le milieu vivant (Grand et al., 2012). Cependant, le recours aux indicateurs biologiques constitue un processus d’évaluation plus complète et plus informative, puisqu’ils permettent d’évaluer les impacts de ces différentes perturbations sur la faune et la flore qu’ils abritent (Benoit Chabot, 2014).
La bio-indication désigne l'évaluation de la qualité des milieux, en se basant sur les caractéristiques des communautés qui y vivent (Reyjol et al., 2013), ce sont les bio-indicateurs, qui peuvent être un individu, une partie d’individu ou même une communauté d’individus (De Vaufleury & Gimbert, 2009), pertinents pour déterminer qualitativement et quantitativement l’état de l’environnement (Druart, 2011).
La tâche d’un bio-indicateur est davantage de mettre en évidence les effets physiologiques affectant les organismes sous l’influence de conditions environnementales stressantes, que de mesurer directement les concentrations des différents polluants impliqués, ainsi qu’à identifier les changements qui surviennent dans l’environnement, à la présence de la pollution (Benoit Chabot, 2014).
I.1. Principales espèces bio-indicatrices
À ce jour, plusieurs indicateurs biologiques ont été développés, dans le but d’évaluation de la qualité des écosystèmes (Bélanger, 2009). Par conséquent, il est primordial de choisir avec précaution le ou les bio-indicateurs qui seront utilisés (Kerckhove, 2012).
Plusieurs caractéristiques contribuent à faire de certaines espèces de meilleurs indicateurs que d’autres :idéalement un bon indicateur doit d’être fiable quant à sa capacité à détecter les différents stress environnementaux, apte à différencier les stress d’origine anthropique de ceux émanant du milieu naturel, pour permettre la comparaison des données et des résultats (Bélanger, 2009).
1)- Les mousses et les lichens sont utilisés comme des bio-indicateurs et bio-intégrateurs performants dans la détection de la pollution atmosphérique (Bélanger, 2009).
2)- Les annélides oligochètes sont utilisés comme bio-indicateurs de pollution des sols par les métaux lourds ou les composés organiques de synthèse (Le Bras, 2007).
4 3)- Les microarthropodes tels que les acariens et collemboles sont utilisés comme indicateurs de pollution de l’air et de sols (Penel et al., 2005).
4)- Les escargots sont également utilisés pour la bio-indication de la qualité des sols, des végétaux et de l’air (De Vaufleury et al., 2009).
I.2. Les types de bio-indicateurs
Il existe différentes catégories de bio-indicateurs, elles sont déterminées en fonction du rôle du bio-indicateur, c’est-à-dire de la tâche pour laquelle il sont employés (Kerckhove, 2012). Parmi les bio-indicateurs, deux catégories sont distinguées :
Bio-indicateur d’accumulation: organisme qui accumule une ou plusieurs substances issues de son environnement, permettant ainsi d’identifier la nature et/ou concentration des polluants assimilés (Benoit Chabot, 2014).
Bio-indicateur d'effet : organisme qui permet de révéler des effets spécifiques ou non lors de l'exposition à une ou plusieurs substances issues de son environnement ou à d’autres stress anthropiques ou naturels et la réponse mesurée étant en général proportionnelle à la dose assimilée (Bispo et al., 2009).
Les organismes bio-indicateurs d’effets doivent être sensibles à de faibles perturbations de l’environnement, tandis que, les organismes indicateurs de bioaccumulation doivent tolérer les contaminants à de fortes concentrations (Druart, 2011).
I.3. Les différents niveaux de réponse des bio-indicateurs
Le changement (réponse) de l’écosystème peut-être observable et/ou mesurable au niveau des individus, des communautés et des populations, dans une échelle spatiale et/ou temporelle bien définie (Sanchez, 2007).
5 La figure suivante présente les réponses des bio-indicateurs à différentes niveaux :
6 II. Biologie de l’escargot
II.1. Présentation du taxon
L’escargot est une espèce ubiquiste qui s'adapte à des milieux, des sols et des climats variés (Benguedouar, 2016), qui se distingue par à corps mou et non segmenté complètement dépourvu d’appendices articulés, sa masse viscérale présente une torsion de 180° par rapport au pied (Larba, 2014) d’où une asymétrie de certains de ces organes : un seul rein, poumon, et une seul oreillette cardiaque (Smida &Toualbia, 2016).
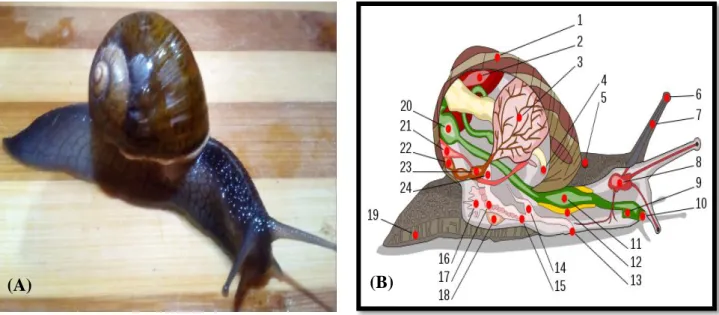
Figure n°02 : Photos d’un escargot prise pendant le ramassage. II.2. Systématique
Selon Bonnet & Vrillon (1990) in (Lalmi & Lazreg, 2016) sa position systématique est la suivante :
Règne : Animalia
Embranchement : Mollusca
Classe : Gastéropoda
Sous –classe : Pulmonés
7 II.3. Description de l’escargot
L’escargot comprend en gros deux parties, le corps et la coquille (Zaafour, 2014).
Le corps : se distingue par un corps mou, visqueux en raison de la présence du mucus, il est constitué de trois parties : une tête, un pied et une masse viscérale enroulé (Labra, 2014).
La tête : comporte une bouche munie d’une mâchoire cornée et d’une radula, qui s’ouvre vers le bas (Anonyme, 2004). Les organes des sens constitués de deux paires de tentacules rétractables : deux tentacules oculaires (postérieures sont dirigés vers le haut) portant un œil simple, et deux tentacules tactiles (antérieurs qui sont dirigés vers le bas), et un organe olfactif, (épithélium) qui sont dirigés vers le haut (Pirame, 2003).
Le pied : est musculeux, large et plat (Douafer, 2015). Dont la face inférieure en contact avec le sol, forme une sole de reptation et lorsque l’escargot se déplace, elle laisse une trace brillante formée de mucus (Anonyme, 2004). Le pied occupe presque toute la surface ventrale comme la tête, n'est pas clairement démarquée du reste du corps (Cobbinah et al., 2008).
La masse viscérale : dont la plus grande partie contenue dans la coquille s’appelle-le tortillon (Pol, 2006). Elle est richement vascularisée, contenant presque tous les organes vitaux: poumon, glande digestive, cœur, rein et une partie de l’appareil génital qui se prolonge jusqu’a le pied (Baurand, 2014).
La coquille : est un squelette externe secrété par la face dorsale et le bord libre du manteau (Douafer, 2015), de forme globuleuse et spiralée (Dahirel, 2014), qui s’enroule autour d’un axe appelé la columelle (Stiévenart et al., 1990). Elle est composée de :
- Une partie organique : trame protéique, représentant 1 à 2% de la coquille (Pirame, 2003).
- Une partie minérale : carbonate de calcium sous forme de calcite et d’aragonite représentant 98% de la coquille (Djadouri & Ben Dahra, 2014).
Les orifices impairs : très visibles sur le corps de l’escargot et se dénombrent en quatre (Zaafour, 2014) :
1. Orifice génital situé en arrière du tentacule oculaire droit. 2. Orifice respiratoire situé sur le côté droit du bourrelet palléal. 3. Orifice anal situé à proximité de l’orifice respiratoire.
8 4. Orifice urinaire situé à proximité de l’anus qu’est généralement indétectable en raison de sa petite taille (Douafer, 2010).
(A) Anatomie externe de l’escargot (B) Anatomie interne de l’escargot Légende : 1 : Coquille. 2 : Foie. 3 : Poumon. 4 : Anus. 5 : Pore respiratoire. 6 : œil. 7 : Tentacule. 8 :
Cerveau.9 : Conduit salivaire. 10 : Bouche. 11 : Panse. 12 : Glande salivaire. 13 : Orifice génital. 14 : Pénis.
15 : Vagin. 16 : Glande muqueuse. 17 : Oviducte. 18 : Sac de dards. 19 : Pied. 20 : Estomac. 21 : Rein. 22 :
Manteau. 23 : Cœur. 24 : Canal déférent.
II.4. Déplacement
L'escargot rampe, il se déplace seulement vers l'avant sur un pied qu’est un gigantesque muscle. Celui-ci se contracte et s'allonge alternativement (Baurand, 2014). La mucus sécrété par l'escargot lui permet à la fois d'avancer plus facilement en glissant sur les obstacles et de se fixer même verticalement sur certains (Pol, 2006).
(A) (B)
Figure n°04 : Ondes de contraction sur la face ventrale despieds d'escargots (Pol, 2001).
9 II.5. Longévité
La durée de vie des escargots varie selon les espèces, elle est bien plus longue et va de dix à quinze ans pour la plupart de ces espèces. Certains escargots ont vécu plus de trente ans (Smida &Toualbia, 2016). La mort d’un escargot dans la nature, est souvent due à des prédateurs ou à des parasites (Zaafour, 2014).
II.6. Cycle biologique de l’escargot
Les escargots se reproduisent de mai à septembre ; généralement deux pontes ont lieu, l'une au printemps et l'autre au début de l'automne (Boukhallout & Touati, 2016).
La reproduction des escargots est sexuée et nécessite un accouplement, bien que ces animaux soient hermaphrodites (Douafer, 2015). C'est-à-dire, il possède à la fois des lignées germinales mâles et femelles (Stiévenart et al., 1990), et les deux partenaires agissent simultanément comme mâle et comme femelle, ainsi le mâle va harponner la femelle avec son dard calcaire afin de favoriser la survie des millions de spermatozoïdes transmis (Djadouri & Ben Dahra, 2014).
L’accouplement est nocturne, dure de quatre à douze heures de nuit, lors duquel les escargots échangent réciproquement des spermatozoïdes (Dahirel, 2014), ceux-ci peuvent être conservés plusieurs mois ou plusieurs années avant d’être utilisés pour fertiliser les ovaires (Stiévenart et al., 1990).
Figure n°05: L’accouplement de deux partenaires d’escargots (Pol, 2006)
10 II.6.1. La ponte
Environ deux à trois semaines après l’accouplement, 80 à 130 œufs sont pondus dans des trous creusés de 4 à 5 cm de profondeur dans un sol humide puis recouverts de terre (Dahirel, 2014). La durée entre l'accouplement et la ponte varie en fonction des conditions du milieu, car l'accouplement débute lorsqu'il y a au moins dix (10) heures de lumière par jour (Lalmi & Lazreg, 2016).
II.6.2. Incubation, éclosion
La durée de l’incubation et de l’éclosion est comprise entre 12 à 25 jours (Djadouri & Ben Dahra, 2014). Dès les premiers jours d’incubation, l’embryon élabore une coquille protéique au cours de son développement, elle se calcifié en automne, il éclos par rupture de la membrane externe de l’œuf qu’il consomme (Douafer, 2010).
Le jeune escargot atteint sa maturité dès le mois de juin suivant, leur maturation dépend de la concentration du calcaire dans le milieu, la lumière, l’hygrométrie et la température, qui joue un rôle important dans le déterminisme de la reproduction (Douafer, 2015).
Figure n°06 : Escargot en position de ponte (Zaafour, 2014). Figure n°06: escargot en position de ponte (Zoufour, 2014).
Figure n°06: escargot en position de ponte (Zoufour, 2014). Figure n°06: escargot en position de ponte (Zoufour, 2014).
Figure n°06: escargot en position de ponte (Zoufour, 2014).
11 III. Ecologie de l’escargot
III.1. Habitat
Le sol est une donnée essentielle de l’habitat des escargots à condition que le sol soit humide, frais, meubles, non acides et fissurés, qui s'égouttent facilement et qu’il ait une forte teneur en calcium et en eau (Cobbinah et al., 2008 et Anonyme, 2004). Pour cela, on le retrouve dans les bois, les rochers, et aussi dans les zones cultivées (Pauget, 2012).
En dehors de ces périodes humides, ils s’abritent sous la végétation naturelle ou sous des matériaux aussi sous l’ombrage. Il préfère ramper non seulement sur le tapis végétal, mais aussi sur les arbres et les parois verticales (Stiévenart et al., 1990).
III.1. Intérêt écologique important
Les escargots occupent une situation privilégiée à l’interface sol-plante-atmosphère (Gimbert, 2006), ce sont des éléments importants des chaînes alimentaires (Zaafour, 2014). Leurs importances se résument dans les points suivants :
Ils représentent une biomasse significative au sein de la communauté des invertébrés du sol (De Vaufleury et al., 2009).
Le taxon est présent, abondant et facilement identifiable (Bouaricha, 2013).
Ils contribuent au transfert de la matière et de l’énergie depuis les producteurs vers les niveaux trophiques supérieurs (Zaafour, 2014).
Ils contribuent au transfert des polluants du sol et/ou des plantes aux prédateurs (Smida &Toualbia, 2016).
Ils participent également à la décomposition des plantes et des feuilles mortes, et ils contribuent ainsi à la formation de l’humus et au maintien de la qualité du sol (Belhaouchet, 2013).
Malheureusement, Dans les cultures, les escargots peuvent faire des dégâts (Blonde et al.,), ce sont des ravageurs à diverses cultures car ils s’aliment non seulement de matière végétale en décomposition, mais aussi de plantes vivantes (Zaafour, 2014).
12 III.2. Degré de sensibilité aux polluants
L'escargot est très sensible à la pollution: il accumule dans la chair ou la coquille certains polluants ou toxiques présents dans leur biotope (De Vaufleury et al., 2012), qui peut dérégler leur système chrono-biologique et perturber les phases d'hibernation et d’estivation (Zaafour, 2014).
En effet, par leur place au sein de l’écosystème terrestre, les escargots sont capables d’intégrer des sources multiples de contamination (De Vaufleury et al., 2009), par diverses voies : digestifs, respiratoire et/ou cutanée (Baurand, 2014), qui dépendant principalement de l’écologie de l’organisme considéré (Rocca, 2004).
Digestive par ingestion de nourriture, plante et/ou sol (Gimbert, 2006).
Cutanée par diffusion des polluants à partir de l’épithélium du pied (De Vaufleury et al., 2009).
Respiratoire par inhalation de gaz et/ou de particules en suspension dans l’atmosphère (Baurand, 2014).
13 III.3. Processus d’accumulation
Le processus de bioaccumulation chez les escargots dépend de l’élément considéré, de sa concentration dans l’environnement mais aussi aux interactions entre le milieu et l’élément considéré qui conditionne sa biodisponibilité aux escargots (Rocca, 2004 et Gimbert, 2006).
Les polluants après leur assimilation par les escargots sont distribués vers certains comportements intracellulaires l’organisme (Benguedouar, 2016).
L’accumulation à l’intérieur de ces animaux est le résultat net des processus d’assimilation/ absorption, distribution, et de stockage (Rocca, 2004 et Gimbert, 2006).
Ces organismes présentent des capacités de régulation de leurs concentrations internes en contaminant, en éliminant les contaminants absorbés notamment par excrétion ce qui permet de maintenir de faibles concentration dans leurs tissus. D’autres, stockent les contaminants dans leurs tissus sous des formes toxicologiques inertes. Ce stockage constitue un mécanisme de tolérance qui peut permettre aux organismes de survivre dans des environnements contaminés (Fritsch, 2010).
IV. Rythme de vie
Lorsqu'un facteur du milieu est défavorable (sécheresse en été, ou froid pendant l'hiver), la vitesse de la croissance devient très faible ou s'annule (Anonyme, 2004). Ces gastéropodes se caractérisent par deux cycles d’activités : activités journalières et activités saisonnières (Djadouri & Ben Dahra, 2014).
IV.1. Activité saisonnière
L’escargot est un poïkilotherme, puisqu’il s’adapte aux variations saisonnières thermiques, On réglant la température de son corps, qui sont marqués par deux états physiologiques importantes : (Douafer, 2015).
IV.1.1. Hibernation
Elle se caractérise par un ralentissement du métabolisme et intervient lors des basses températures hivernales: l’hibernation (Pirame, 2003).
Autrement dit, tout le long de l’hiver, l’escargot se retire dans des endroits écartés et il recroqueville au fond de sa coquille, donc il entre en léthargie, en secrétant une bave qui se dessèche et obture ainsi l’ouverture de la coquille par des disques minces (Damerdji and Benyoucef, 2006). Nommé, épiphragme : est un bouchon de mucus, plus ou moins imprégné de calcaire, qui durcit en séchant (Zoufour, 2014). C’est une période de repos et de jeûne
14 prolongé pendant laquelle l’escargot doit aborder le maximum de réserves ( Djadouri & Ben Dahra, 2014).
Figure n°08 : Escargot en hibernation avec son épiphragme (Zaafour, 2014). IV.1.2. Estivation
En été (climat chaud et sec), l’escargot présente également une période de vie demi-ralentie, appelée : estivation (Anonyme, 2004). L’animal se présente complètement rétracté à l’intérieur de sa coquille, ainsi un mucus solidifié est secrété devant l’ouverture de sa coquille (Fortier, 1999 et Djadouri & Ben Dahra, 2014).
L’estivation est donc un état de résistance ponctuel qui disparaît lorsque les conditions climatiques redeviennent favorables (Pirame, 2003).
Figure n°09 : Escargot en estivation (Pol, 2006).
Selon Douafer (2010), les conditions climatiques seront favorables entre le printemps et l’automne cette période se caractérise par une reprise des fonctions vitales de l’animal : l’activité locomotrice, l’alimentation, le déclenchement de la croissance des jeunes et la reproduction des adultes, donc, les escargots redeviennent actifs après la rupture de l’epiphragme (Pirame, 2003).
15 IV.2. Activité journalière
L'escargot présente un rythme d'activité journalière étroitement liée à la photopériode (Le Guhennec, 1986). Cette activité peut être inhibé par les conditions hygrométriques et thermiques défavorables (Douafer, 2015), dans les conditions optimales (Température et hygrométrie), l’escargot sort de sa coquille et devient actif dès la tombée de la nuit jusqu’au lever du jour (Djadouri & Ben Dahra, 2014). Il en profite de la fraicheur de la nuit pour chercher de la nourriture (Labra, 2014).
la phase de l’inactivité relative à une durée inférieure à 18 heure, durant cette phase l’escargot est au repos et ne manifeste que peu d’activité locomotrice, sexuelle ou nutritionnelle (Smida & Toualbia, 2016).
V. Régime alimentaire
L’escargot s’alimente grâce à une langue dentée nommée radula (Pirame, 2003). C’est un animal phytophage appréciant toutes sortes de végétaux présentent dans la nature, et la
nourriture varie selon l’espèce depuis les feuilles et les fruits jusqu'à tubercules et aux racine (Anonyme, 2004 et Zaafour, 2014).
Son régime alimentaire n’est pas spécialisé et l’escargot s’adapte en fonction des plantes qui colonisent le milieu, il est surtout composé de feuilles telles que l’aubergine, luffa, centrosema, chou et laitue. Mais il apprécie aussi les fruits et les légumes telles que poire, figue, tomate, concombre, fraise, orange, courgettes et carotte (Pol, 2006 et Druart, 2011).
Les préférences alimentaires de ces espèces semblent varier ave l’âge et la taille de celle-ci (Mandangi, 2010), les jeunes escargots préfèrent les feuilles et les pousses tendres et mangent environ deux fois plus que les escargots adultes. A mesure qu’ils vieillissent, les escargots consomment plus de détritus : feuilles détachées, fruits pourris et humus (Cobbinah et al., 2008).
VI. Formes de pollution affectant l’escargot
L'escargot vit au contact de la terre, des plantes, puisqu'il est herbivore, et de l'air puisque c'est un organisme pulmoné, ce qui lui permet d’intégré des sources multiples de contamination : sol, atmosphère, et végétaux (Gimbert, 2006 ; De Vaufleury et al., 2012 et Pihan, 2001).
Cet animal est donc constamment menacé par différents types de dégradation en relation avec leur vieillissement naturel et les différentes interventions humaines d’où on peut citer : (Coste and Itard, 2006).
16 VI.1. Pollution du sol
La pollution du sol est définie comme étant un processus de dégradation de la qualité de sol, qui perturbe une plusieurs ou toutes les fonctions essentielles du sol, cela entraîne une réduction plus ou moins forte de la capacité des terres à contribuer aux besoins de la vie des espèces qu’ils abritent (Brabant et al., 1996).
L’état de sol peut-être perturbé par :
Les phénomènes de dépôts et de lessivage, peuvent être à l’origine de modifications significatives de la teneur des sols en certains éléments initialement présentes dans le sol (Daniau et al., 2009).
La mise en décharge des déchets solides, sans aucun traitement préalable et sans aucune protection des sous-sols des sites de décharges (Nhari et al., 2014).
La destruction du sol par les constructions urbaines, industrielles, touristiques, routières
(Lemière et al., 2001).
VI.2. Pollution atmosphérique
La pollution de l'air est un type de pollution défini par une altération de la pureté de l'air, par une ou plusieurs substances ou particules présentes à des concentrations différentes et durant des temps suffisants pour créer un effet toxique ou écotoxique (Boussouara, 2010).
Différentes sources majeur de cette forme de pollution dont on peut citer :
Les tempêtes de poussières engendrent des grandes quantités des particules sont aussi, source naturelle de pollution de l'air (Boussouara, 2010).
La pollution par les déchets ménagers est engendrée essentiellement par l'incinération des ordures et par le déplacement avec l’air des odeurs provenant des déchets accumulés pour une longue durée (Belfarhi, 2011).
17 VII. Introduction
L’étude de la réponse biologique des organismes vivants aux divers polluants, présente dans l’environnement, constitue un outil de diagnostic qui peut jouer de système d’alarme d’une contamination. Nous avons choisi un matériel biologique : escargot connu comme un indicateur écologique efficace et susceptible de fournir une réponse précoce sur la toxicité et/ou l’adaptation des escargots après une exposition à des conditions contrôlées. Pour y répondre, nous nous sommes fixés plusieurs objectifs opérationnels principaux :
1. Faire un échantillonnage adéquat au niveau de l’institut national de la formation professionnelle-Lahkdaira des escargots adultes.
2. Elever les escargots échantillonnés au laboratoire sous conditions contrôlées puis les traiter par trois types de pesticides (aceplan, methonate et glyphosate) durant 28 jours. 3. Contrôler les aspects physiologiques : comportement et morphologie chez les escargots
traités (poids frais des escargots, mortalité…) par rapport aux témoins.
4. Evaluer les atteints tissulaires altérations tissulaires au niveau de l’hépatopancréas et le poumon par la réalisation d’un examen histologiques.
18 VIII. Présentation de la région d’étude
VIII.1. Situation géographique
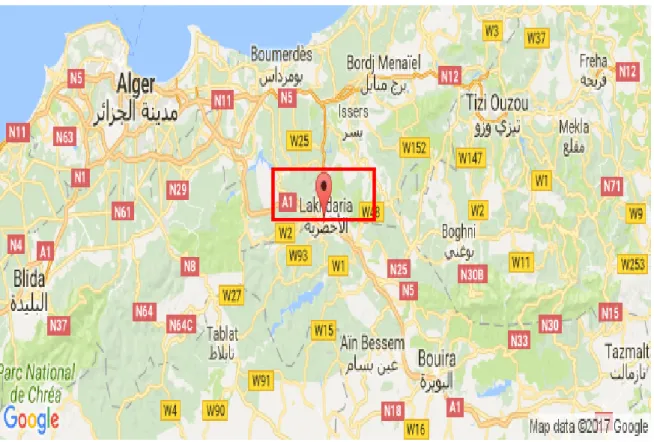
La région de Lakhdaria se trouve à 33km au nord-ouest du chef-lieu de la wilaya Bouira
et à 74 km au sud-est d’Alger. La ville est entourée de montagnes dont la plus haute est « Lalla mousaade ».
Figure n°10 : Localisation de site d’échantillonnage au niveau de Lakhdaria (Anonyme, 2016).
19 VIII.2. Caractéristiques climatiques
La région de Lakhdaria qui se situe dans la plaine de la wilaya de Bouira est caractérisée par un climat méditerranéen avec un hiver doux et pluvieux et un été chaud et sec.
Le relevé climatologique de la décennie de 2006 à 2016 permet à partir des valeurs des températures moyennes et des précipitations d’établir un diagramme ombrothermique de BAGNOULS et GAUSSEN de la région ce dernier met en évidence une période sèche s’étalant du mois de Mai jusqu’au mois de Septembre et qui reflète une température extrême de l’ordre de 28.2°C le mois de Juillet, avec un minimum de pluie durent le mois de Juin.
Tableau n°I : Situation climatique de la wilaya de bouira 2006 /2016 (Anonyme, 2016).
Moine Janv Fevr Mars Avri Mai Juin Juil Aout Sept Octo Nove Dece Températures 9.0 9.0 11.6 15.3 19.0 23.7 28.2 27.9 23.6 19.6 13.3 9.6 Précipitions 62.5 81.1 90.0 54.8 44.6 12.7 3.2 9.3 41.9 40.6 60.1 57.1
Figure n°11 : Diagramme ombro-thermique de BAGNOULS et GAUSSEN (Anonyme, 2016)
20 IX. Présentation de la station d’étude
Pour la réalisation de notre thème de recherche, nous avons procédé à l’échantillonnage de gastéropodes terrestres (escargots, toutes espèces confondues) au niveau de l’institut national de la formation professionnelle à Lahkdaria.
L’institut national de la formation professionnelle (INSFP), spécialisé dans l’agriculture, est un centre d’excellence en agriculture qui a été construit pour former dans les filières lait, apiculture, céréaliculture, maraîchage, arboriculture, élevage et oléiculture.
La création de ce centre s’inscrit dans une démarche ayant pour objectif de faire de lui une "référence de formation" offrant une attraction aux jeunes, ainsi que pour favoriser l’émergence de porteurs de projets de créations d’entreprises et de moderniser les formations à travers l’utilisation de technologies nouvelles. Elle vise aussi à donner la possibilité aux agriculteurs de la région de bénéficier de perfectionnements et de formations.
IX.2. Présentation du site d’échantillonnage IX.2.1. Choix de site
Pour récolter avec succès des escargots, il est important de garder toujours en mémoire leurs exigences de vie préférées. Les sites choisis pour réaliser ce travail, repose sur ces conditions de vie.
On a réalisé ce travail sur une parcelle de nature argilo-limoneuse, ainsi on a choisis deux types de milieux : milieu naturel et milieu agricole. D’où le milieu naturel n'a pas été transformé, ou altéré de manière permanente, ni à long terme par les activités anthropiques, tandis que le milieu agricole se caractérise par l’utilisation des produits phytosanitaires, ce qui induit à la richesse du sol en matières organiques, ce sont des éléments très bénéfiques à la croissance et au développement des escargots.
IX.2.2. Choix du taxon
Le choix préférentiel de ces espèces est principalement lié à certains critères, dont on peut citer :
Ils occupent un maillon des réseaux trophiques qui contribue au transfert des polluants du sol et/ou des plantes aux prédateurs ( Benguedouar, 2016).
Présente une taille rendant possible la récolte et l’étude de ses différents tissus et de leurs composantes (Druart, 2011).
Ils présentent des réponses physiologiques (inhibition de croissance, reproduction et mortalité) et biochimiques quand ils sont exposés aux contaminants (Bouaricha, 2013).
21
Bio-accumulateurs de divers polluants, ce qui lui permet de toléré des fortes contaminations de l’environnement (Benoit Chabot, 2014 et Gimbert, 2006).
Forte longévité sont préférables parce qu’elles permettent un échantillonnage sur plusieurs classes d’âge (Benguedouar, 2016).
Capacités d’adaptation à des biotopes, des sols, des climats variés, et sa facilité d’élevages (Gimbert, 2006 et Pauget, 2012).
IX.2.3. Période adéquate
Il a été effectué durant toute la période d'activité des escargots, mais la période la plus courante pour les ramassés sera en été après la tombé de pluie, il faut tenir en compte des périodes de reproduction des escargots qui dépendent de la région dans laquelle ils se trouvent. Le ramassage des escargots dans la zone d’étude, est réalisé jaque jour au moins du mars, à la tombée du jour ou au petit matin pour que l'air soit encore humide et que l'escargot sorte de sa coquille.
IX.2.4. Ramassage des mollusques
Les méthodes utilisées pour l’étude des escargots sont nombreuses et le choix de celles-ci dépendent de la problématique posée et l’objectif visé, car il n’existe pas des méthodes de récolte qui sont applicables à toutes les situations.
Dans certains cas, le ramassage doit être assuré par de vrais professionnels, notamment en milieu rural, qui connaissent bien les coins et les caches hivernales où viennent s’abriter les escargots.
IX.2.4.1. La recherche à vue
Les espèces visibles à l’œil nu sont en général recherchées dans tous les micro-milieux humides qui pouvant servir d’abri pendant la journée : pierres, branches mortes, litière, base des plante, et sont ramassées directement à la main.
La recherche à vue est accessible à tous et ne nécessite pas de matériel. Elle est intéressante pour dresser rapidement une première liste d’espèces dans ce milieu avant qu’il ne fasse l’objet d’un échantillonnage poussé.
22
IX.2.4.2. Création d’abris
Après une période d’activité, ces organismes cherchent un endroit humide et tempéré pour se réfugier pendant la journée, le piégeage de celle-ci repose donc sur ce comportement, il est possible donc de placer des abris artificiels qui conservent l’humidité sur le sol, par temps frais, des planches de bois feront l’affaire.
On doit laisser la planche toute une nuit, et la soulever le matin afin de trouver notre hôte, il faut renouveler l’opération pendant quelques jours, cela permet d’agrandir la chance de trouver plus d’espèces. A la fin, les mollusques, n’ont plus qu’à être récoltées en soulevant les planches de bois.
Figure n°12 : Les différentes catégories d’escargots prisent directement pendant le ramassage (Personnelle, 2017).
23 IX.2.4.3. Piège attractif
On a récolté les mollusques terrestres, on réalisant des petits tas, qui contiennent un appât spécialement formulé pour les attirés : salade, tomates écrasées, fanes de carottes. Ces pièges sont répartis de manière aléatoire dans le site d’étude, à la tombée de la nuit les escargots sont attirés par l'odeur de ces produits, ils sortent de leurs abris pour chercher la nourriture, ainsi, ils seront relevés le soir ou au petit matin car c’est à ces moments qu’on y trouve le plus d’individus.
X. Au laboratoire
Après avoir récolté tout le matériel biologique par l’utilisation des différentes méthodes de ramassage, les escargots ramassés seront transférés au laboratoire dans des boites en plastiques étiquetées pour séparer les différents échantillons récoltés.
X.1. Matériel utilisé
Un récipient en plastique remplie de ¼ du sol (argile). Pulvérisateur à main.
Nourriture : salade. Réfrigérateur, Boites de pétri.
24 Pince et ciseau.
Balance. Epingle. Etuve à 60°C.
X.2. Choix des traitements chimiques
Dans cette étude les produits chimiques utilisés comme source de contamination sont sous forme de préparation commerciale (pesticide).
Les pesticides sont couramment appelés produits phytosanitaires, Il s'agit généralement d’un produit chimique organique ou minéral destiné à lutter contre les organismes indésirables. Ces produits regroupent des composés organiques et inorganiques à action plus ou moins spécifiques, tel que : les insecticides contre les insectes, les herbicides contre les mauvaises herbes et enfin fongicides contre les champignons (Noumeur, 2008).
Les herbicides représentent la classe économiquement et quantitativement les plus importantes, ils persistants dans les sols plus que les insecticides et les fongicides et génèrent des produits de dégradation stables. Une fois dans l’environnement, les pesticides se transforment en un grand nombre de sous-produits issus de la dégradation de la molécule mère, communément définis comme métabolites ou résidus (Noumeur, 2008).
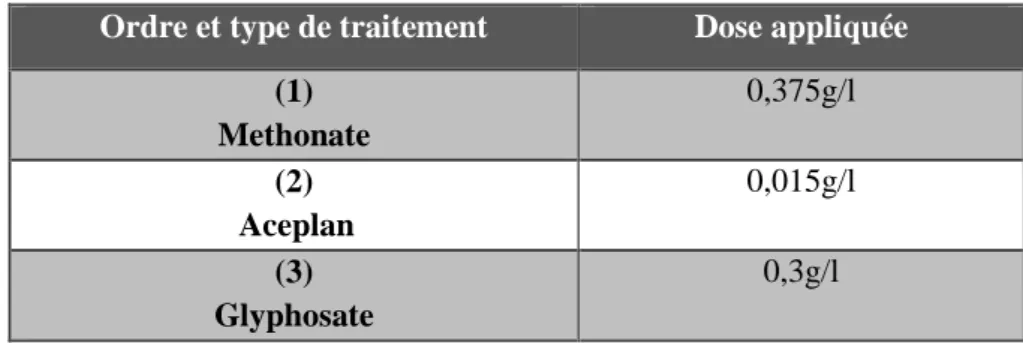
Les produits qu’o a utilisés sont :
1. Methonate : est un insecticide systématique à base deméthomyl 25% WP, appartient à la famille des carbamates. Il agit par contact et par ingestion sur plusieurs types d’insectes et acariens, il est doué d’un effet de choc puissant (15 minutes).
2. Aceplan : est un insecticide systémique à base d’acétamipride 20% SP appartient à la famille des néonicotinoïdes. Il agit par contact et ingestion sur la plupart des pucerons, mineuses des agrumes et sur un grand nombre d’autres ravageurs des cultures.
3. Glyphosate : est un désherbant polyvalent foliaire systémique, c’est-à-dire un herbicide non sélectif, dont la substance active glyphosate est un dérivé de la glycine, appliqué aux feuilles des plantes pour tuer les plantes à feuilles larges et les graminées.
25 X.3. Conditions d’élevage
Notre étude a été réalisée sur 85 escargots, sont des adultes avec un poids moyen est de 7 à 15g, proviennent d’une population d’originaire de la région de Lakhdaria à Bouira.
Pour mener des essais au laboratoire sous conditions contrôlées, il est nécessaire de construire un abri pour les escargots. Ils sont donc répartis dans un récipient en plastique transparent bien aéré où ils peuvent vivre convenablement, le fond est recouvert avec une couche d’argile expansée sur environ 2cm d’épaisseur.
Dix jours avant le début de traitement, les escargots sont remis en activité dans des conditions d’environnement optimales suivantes : photopériode de 18h, de lumière/24h, température 20 ± 2°C, il est important d’entretenir les escargots à heures fixes et de façon régulière afin qu'ils s'habituent à un rythme d'activité et de nourriture.
X.4. Mode de traitement
L’intoxication des escargots a été effectuée en laboratoire durant 28 jours dans les mêmes conditions environnementales que celles décrites pour l’élevage. Elle se fait par voie digestive par ingestion de nourriture contaminée et par inhalation des contaminants atmosphérique, ces deux voies de toxicités sont réalisées à l’aide d’une solution pulvérisée. Les traitements ont été effectués du 27 avril à 24 mai et sont expliqués dans le tableau suivant :
26 Tableau n°II : Répartition des concentrations selon le type de traitement.
Le nettoyage des boîtes (ramassage des fèces, nettoyage des parois à l’aide d’un papier absorbant humidifié) a été effectué à intervalles réguliers 3 fois par semaine (lundi, mercredi et vendredi) jusqu’à la fin de l'expérimentation et la nourriture contaminée est renouvelée à chaque nettoyage.
Durant la période de traitement, chaque jour on a noté l’effet du traitement sur les escargots (mortalité, changement de comportement, mouvement, poids….).
Dans un autre récipient, des escargots sont élevés au laboratoire et sont considérés comme un état de référence, qui permet de montrer la présence ou l’absence des polluants après leurs transferts durant le temps d'exposition, provenant de la même aire géographique.
Une autre partie des escargots échantillonnés provient d’un terrain (15 individus) sont conservés directement jusqu’à l’analyse et autre 30 escargots sont considérés comme témoins.
Ordre et type de traitement Dose appliquée
(1) Methonate 0,375g/l (2) Aceplan 0,015g/l (3) Glyphosate 0,3g/l
27 XI. Préparation et sacrifice des escargots
XI.1. Période de jeun
A l’issue de l’exposition, les individus sont placés dans des boites plastiques et mis à jeun pendant 48 heures afin que le contenu de leur tube digestif soit vide, et d’éviter d’éventuelles interférences entre les contaminants présents dans l’aliment ingéré et les quantités de contaminants réellement accumulées dans les tissus.
XI.2.Congélation
Après la période de jeun, les escargots sont pesés puis sacrifie par congélation dans des boites en plastique à –25°C, car ces animaux se détruisent facilement à des températures ambiantes et pour éviter aussi la dégradation des protéines.
XI.3. La dissection
Avant la dissection, les escargots conservées sont décongèles dans un étuve à 60°C pendant 30 minute.
Dans une boite de pétri, on fixe la face ventrale de l’escargot au fond de la boite en l’épinglant très antérieurement et postérieurement dans le pied.
On a découpé latéralement le dessus de la coquille par petits morceaux et on les a enlevés délicatement avec une pince en évitant de crever le manteau et le poumon situé en dessous.
28 Progressivement le poumon apparait dans sa totalité avec la veine pulmonaire relie l’oreillette en mettant en évidence sur le dessus, le cœur, le rein, l’hépatopancréas et l’appareil génital.
Le poumon et l’hépatopancréas sont délicatement isolés des autres organes puis déposés dans une boite de pétri.
Hépatopancréas
Poumon
XII. Réalisation des coupes histologique
Les coupes destinées à l’observation en microscopie optique et leurs préparations suivent généralement le même protocole : fixation, inclusion, coupe, coloration et montage. Toutes ces étapes ont été réalisées au laboratoire d’histologie au niveau de faculté de médecine à l’université Abderrahmane Mira Bejaia.
1. Fixation
La fixation des organes est indispensable pour conserver la morphologie cellulaire, car elle consiste à immobiliser (tuer) les cellules, en les conservant le plus possible dans un état proche du vital.
Les organes prélevés (poumon et hépatopancréas) sont mis dans des cassettes numérotées et plongés immédiatement dans un récipient muni d’un couvercle hermétique contenant une solution de fixateur (formol à 10 %) pendant 48H. Cette fixation s’oppose au durcissement des tissus ainsi qu’aux distorsions, rétractions et protège contre d’éventuelles attaques bactériennes.
29
2. Déshydratation
Les tissue contient des grandes quantités d’eau en intra et extracellulaire, cette eau doit être enlevées et remplacés par la paraffine, c’est le principe de l’automate.
L’automate de type Lieca, permet donc la déshydratation et l’infiltration des tissus biologiques de façon automatique. L’appareil est constitué de 12 bains : 8 bains sont remplis avec des solutions d’alcool à teneur croissante (100 à 110%), deux bains avec de xylène et deux autres bains avec la paraffine.
Les cassettes histologique préparées sont placés dans un panier (capacité : 80 cassettes) qui est successivement transféré automatiquement d’un bain à l’autre comme suite :
La déshydratation : s’effectue dans les bains d’alcools afin de préserver la structure morphologique des tissus.
L’éclaircissement : est une étape intermédiaire d’élimination d’agent déshydratant dans les bains de xylène qui servent à remplacer l’alcool dans les tissus afin que celui-ci soit miscelui-cible avec la paraffine.
L’infiltration : dans les bains de paraffine pour solidifier le tissu.
Le cycle dure environ 11heure : 45 minutes pour chaque bain de l’éthanol et 30 minute pour les bains de paraffine et de xylène.
30 3. Enrobage des tissus et réalisation des blocs
L’étape de l’enrobage consiste à faire pénétrer aussi intimement que possible dans les tissus une substance homogène solidifiable qu’est la paraffine dans une station d’enrobage.
(A) Compartiment réchauffé pour les moules métallique ; (B) Distributeur de
paraffine liquide ; (C) Console pour la programmation de l’appareil (temps, température) ; (D) Bains tempéré de paraffine pour maintenir les échantillons ; (E) Surface de refroidissement ; (F) Surface de travail tempéré.
Figure N°21 : Station d’enrobage de type Leica. (C) (F) (D) (B) (E) (A)
Figure n°20 : Un panier de cassette histologique est placé dans l’automate de déshydratation
Figure n°21 : Station d’enrobagetype Leica
(Personnelle, 2017).
31 Pour réaliser les blocs de paraffines à l’aide de cet appareil plusieurs démarches ont étés faites :
A la sortie de l’automate de déshydratation, les cassettes contenant les prélèvements déshydratés sont imprégnés de paraffine chaude (70°C) dans la station d’enrobage.
Les pièces imprégnées de paraffine, sont ensuite incluent dans des moules métallique rempli de paraffine chauffée.
Les moules contenant les tissus sont placés doucement sur la surface refoidie pour fixer l’echantillon au centre.
La partie supérieure de la cassette avec l’identification du tissu sont placés sur les moules et le niveau de paraffine complété jusqu’à couvrir le fond grillé.
Les moules sont ensuite passés sur la surface froid pour 30 minute pour faire durcir la paraffine.
Les images suivantes montrent les étapes d’enrobage d’échantillons des tissus à l’aide de cet appareil :
1)- Préparation des moules en le remplissant de paraffine liquide.
2)- Inclusion des tissus aux moules métalliques.
3)- Remplissage complet des cassettes avec l’identification des tissus par la paraffine liquide.
Figure n°22 : Réalisation des blocs de paraffine contenant les tissus
4)- Collage des cassettes sur les moules métalliques.
32 4. Refroidissement
Les moules sont ensuite refroidissait sur une plaque réfrigérante environ 5-10 minute pour être facilement démoulé.Le refroidissement de cette paraffine amène sa solidification en un bloc prêt à être coupé.
5. Coupe des blocs en paraffine
Les coupes sont réalisées à l’aide d’un microtome « Leica ». On commence d’abord par le dégrossissement, dans le but de faire ressortir au même niveau les fragments tissulaires inclus en enlevant la paraffine et les sections sont effectuées à 20 µm d’épaisseur.
Lors de la réalisation des coupes, celle-ci s'attachent les unes aux autres pour former un ruban fin qui sont alors prêtes pour être étalé.
Figure n°23 : Moules métalliques déposés sur la plaque réfrigérante
33 5. Etalement des coupes
L’étalement se fait dans un bain-marie dont la température de l’eau doit être de 10° au-dessous du point de fusion de la paraffine. On plonge ensuite, sous chaque coupe tissulaire une lame de verre numérotée, que l’on soulève hors de l’eau, afin de récolter à sa surface la coupe tissulaire. Les lames recouvertes de la coupe tissulaire sont placé dans des porte-lames et ensuit séchées dans un étuve à 70°C pendant une nuit pour les déparaffinées.
6. Coloration et montage
Les tissus présentés dans notre lame ne sont pas spontanément colorés ce qui rend les observations difficiles si pour quoi l’utilisation d’une coloration est nécessaire.
Cependant, pour que l'on puisse utiliser une coloration, la paraffine doit être éliminée. On procède donc au déparaffinage et comme les colorants sont en solution aqueuse, les coupes doivent d’abord subir une réhydratation.
La coloration des lames a été effectuée manuellement selon un protocole standard : Déparaffinage : dans deux bains de xylène : le premier sur une plaque chauffante pendant
30 min et le deuxième sans plaque chauffante pendant 10 min. Réhydratation : dans un bain d’alcool pendant 10 min.
Coloration : par l’hématoxyline haris pour la coloration des noyaux en violet pendant 5 min et avec l’éosine pour la coloration le cytoplasme en rose pendant 3 min (un rinçage à l’eau courante après chaque coloration).
Déshydratation : dans deux passages d’alcool et deux passages de xylène. Figure N°25 : Etalement des coupes dans un bain-marie chauffé sur
34 Après avoir subi une déshydratation, les coupes colorées sont montées entre lame et lamelle avec quelques gouttes de baume du Canada ou Eukit, elle est appliquée de façon à recouvre l'ensemble de la coupe. La préparation microscopique est alors prête pour
l'observation.
Figure n°26 : Coloration des lames
Figure n°27 : Coupes colorées et montées pour être observer au microscope optique
35 XIII. Résultat
XIII.1. Mesures des paramètres physiologiques
Plusieurs paramètres ont été collectés chez la totalité des individus témoins et examinés durant la période de traitement, à savoir :
XIII.1.1. Comportement
Au cours de l’exposition aux différents traitements, les escargots traités ont montrés une série de symptômes. Le premier symptôme est la perte chimio-réception, de sorte que les escargots sont faiblement attirés par la nourriture comparé aux escargots témoins, de sorte que la consommation de la nourriture contaminée diminuait d’une façon dose-dépendante.
Les escargots passent la plupart de leur temps au sommet des boîtes sans montrer aucune activité locomotrice et nutritionnelle après la deuxième semaine d'exposition.
En revanche, les escargots traités reprennent sont activités après quelque jours d’exposition (période de repos) avec une activité presque similaire à celle des escargots témoins qui font leurs activités (nourriture, locomotion) d’une manière naturelle.
(A) (B)
Légende : (A) fixation des escargots traités au sommet des boites ; (B) Activité locomotrice et
nutritionnel naturelle chez les escargots témoins.
Figure n°28 : Changement de comportement des escargots traités par apport aux escargots témoins.
36 XIII.1.2. Poids frais des escargots (tissus mous + coquille)
Dans notre étude, nous avons notés qu’après la période de traitement le poids moyen des escargots sous l’effet des pesticides à diminuer par rapport au poids frais moyen des escargots témoins.
Le premier traitement ne semble avoir aucun effet sur le poids des escargots traités, en revanche à partir de deuxième traitement remarque une variation de la masse des escargots par apport au poids initial des escargots témoins sans même les pesés.
XIII.1.3. Mortalité
Le contrôle de la vitalité des individus testés au cours des essais est effectué au moment des renouvellements de nourriture, de chaque traitement. La mort d'un individu est généralement facile à déterminer : le pied flasque et jaunâtre est le plus souvent sorti de la coquille, une odeur nauséabonde que dégage l'escargot, cela permet de conclure à la mort de l'individu.
Légende : (A) Escargot témoins ; (B) Escargot après traitement aux pesticides.
Figure n°30 : Exemple d’un escargot mort durant l‘exposition.
ur
(A) (B)
Figure n°29 : Perte de poids d’un escargot traité en différenciant avec celle de témoins.
37 Durant l’expérience, la mortalité des escargots traités était faible, avec seulement 5 individus sur 40 escargots adultes, ce qui représente 12.5%. Par contre chez les escargots témoins la mortalité est presque nulle avec seulement 2 individus sur 30 escargots témoins, ce qui représente 6.6%.
Le nombre de mortalité des escargots témoins et testés par rapport au nombre initial est présenté dans le tableau suivant :
Tableau n° III : Mortalité des escargots adultes durant 28 jours de traitement. Début de l’expérience 1ère Traitement (Methonate) 2èmeTraitement (Aceplan) 3ème Traitement (Glyphosate) Mortalité totale Témoins 0 0 2 0 2 Traités 0 0 2 3
L’analyse à montre une différence entre la mortalité des escargots témoins et des escargots traités : 5 5 5 6,66% 12,50% 0,00% 2,00% 4,00% 6,00% 8,00% 10,00% 12,00% 14,00% témoin traité Pou rc e n tage d e s i n d iv id u e s m o rts Mortalité totale Ttémoin traité
Figure n°31 : Evolution du pourcentage de mortalité des escargots témoins et traités durant 28jours jours de traitement.
38 XIV. Mesure des paramètres histologiques
Pour rendre visible les atteintes tissulaires au niveau de l’hépatopancréas et le poumon, un microscope de type LIECA MC170 HD équipé d’une caméra qui permettre la prise d’images avec un logiciel d’imagerie numérique.
XIV.1. Aspect de l’hépatopancréas des escargots témoins
Une section histologique de l’hépatopancréas du groupe témoin est illustrée dans la figure 32. Cette coupe montre que le tissu de la glande digestive est constitué essentiellement par la juxtaposition de nombreux tubules digestifs de différentes formes et tailles, séparés par l’espace inter tubulaire, constitué de vaisseaux hémolymphatiques et d’hémocytes. La lumière des tubules est bordée par un épithélium simple associant plusieurs types cellulaires. Les cellules qui le composent présentent des morphologies diverses mais révèlent trois types cellulaires principales :
Des cellules digestives (CD) produisant des enzymes digestives déversées dans la lumière des tubules et responsables de la digestion extracellulaire des substances nutritives, des cellules excrétoires, (CE) réalisant la phagocytose des particules alimentaires de la lumière des
Légende : L : Lumière de l’acini ; CC : Cellule à Calcium ; CD : Cellule digestive ; CE : Cellule Excrétrice.
Figure n°32 :Observations au microscope optique de coupes transversales d’une partie de l’hépatopancréas d’un escargot témoin (G×40).
39 tubules et responsables de la digestion intracellulaire et des cellules à calcium (CC) permettant le renouvellement des autres types cellulaire.
XIV.2. Aspect de l’hépatopancréas escargots proviennent d’un terrain agricole
L’examen histologique de l’hépatopancréas des escargots provient d’un terrain agricole, a mis en évidence un élargissement de la lumière de l’acini accompagnés de quelques foyers de nécrose avec un léger aspect inflammatoire, nous remarquons également la présence de quelques débris cellulaires.
Figure n°33 :Observations au microscope optique de coupes transversales d’une partie de l’hépatopancréas des escargots agricoles (G×40).
Légende : (A) Escargot témoin ; (B), (C), (D) : Escargots de type agricoles.
L : Lumière de l’acini ; CC : Cellule à Calcium ; CD : Cellule digestive ; CE : Cellule
40 XIV. 3. Aspect de l’hépatopancréas escargots après 28 jours d’exposition aux pesticides
Après 28 jours de traitement, l’examen histologique de l’hépatopancréas des escargots traités met en évidence des altérations en réponse à tous les traitements qui se manifestent : un élargissement de la lumière basale, accompagnés de disparition des cellules digestives et une diminution de l’épaisseur de l'épithélium confirme le phénomène de nécros, aussi une forte hypertrophie cellulaire.
Figure n°34 :Observations au microscope optique de coupes transversales d’une partie de l’hépatopancréas des escargots traités (G×40).
Légende : (A) Escargot témoin ; (B), (C), (D) : Escargots traités.
L : Lumière de l’acini ; CC : Cellule à Calcium ; CD : Cellule digestive ; CE : Cellule
excrétrice ; AI : Aspect inflammatoire ; N : Nécrose ; DC : Débris cellulaire ; : Hypertrophie cellulaire.