HAL Id: tel-01351435
https://tel.archives-ouvertes.fr/tel-01351435 Submitted on 3 Aug 2016
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Substitution nucléophile en série méthacrylique.
Cycloaddition dipolaire 1,3 de divers azides organiques
aux oléfines obtenues
Jacques BourgoisTo cite this version:
Jacques Bourgois. Substitution nucléophile en série méthacrylique. Cycloaddition dipolaire 1,3 de divers azides organiques aux oléfines obtenues. Génie des procédés. Université de Rennes 1, 1975. Français. �NNT : 1975REN1S007�. �tel-01351435�
THESE
présentée devantL'UNIVERSITE DE RENNES U. E, R. Structure et Propriétés de la Matière
pour obtenir
Le Titre de Docteur-Ingénieur Spécialité: Chimie Organique
par
Jacques BOURGOIS
Substitution nucléophile en série méthacrylique.
Cycloaddition dipolaire 1.3 de divers azides organiques aux oléfines obtenues.
Soutenue le 4 Février 1975 devant la Commission d'Examen
M!V1. A. FOUCAUD R' CARRIfl J.L. PIERRE F. TEXIER
(
Président ExaminateursTHESE
présentée devant
L'UNIVERSITÉ DE RENNES
U, B. R. Structure et Propriétés de la Matière
pour. obtenir
Le Titre de Docteur-Ingénieur Spécialité : Chimie Organique
par
Jacques BOURGOIS
Substitution nucléophile en série méthacrylique. Cycloaddition dipolaire 1,3 de divers azides organiques
aux oléfines obtenues.
Soutenue le 4 Févrièr 1975 devant la Commission d'Examen
MM. A. FOUCAUD R' CARRIE J.1. PIERRE F. TEXIER
(
Président ExaminateursUNIVERSITE DE RENNES U.E.R. SCIENCES ET PHILOSOPHIE
Doyens Honoraires M. MILON Y. M. TREHIN R. M. SCHMITT M. M. LE MOAL H. M. MARTIN Y. M. BOCLE J. ftmfesseua' Honoraires M. FREYMANN R. M. HAGENE P. M. ROHMER R. M. TREHIN R. M. SALMON - LEGAGNEUR F. M. des ABBAYES H. M. MILON Y.
Mallres de Conférences Honoraires
M. GRILLET L. M. LECR ECQ A. Mathématiaues Professeurs M. GUERINDON Jean M. METIVIER Michel M. GIORGIUTTI Italo M. TOUGERON Jean-Claude M. MIGNOT Alain M. HOUDEBINE Jean M. KEANE Michaël M. BOULAYE Guy M. VACHER Michel M. VIGNERON Léopold M. LE BOT Jean physique
Mme ROBIN née SALOMOND M. ROB 1 N Stéphane M. LE MONTAGNER Serge M. MEVEL Jean-Yves M. MEINNEL Jean M. REGENSTREIF Edouard M. BRUN Pierre M. LE ROUX Emile M. DUBOST Gérard M. ARQUES Pierre-Yves M. HAEUSLER Claude M. NUSIMOVICI Michel
,/
Mallres de Conférences & Chargés de Cours
M. BERTHELOT Pierre M. BREEN Lawrence M. CAMUS Jacques M. CONZE Pierre M. FERRAND Daniel M. GUIVARC'H Yves M. LE GOUPI L Jean M. LERMAN Israël M. NEDELEC Jean-Claude M. TRILLING Laurent M. VE RJUS Jean-Pierre M. GUIDINI J. M. DECAMPS E.A. .' f
M. VENE Jean M. lE MOAl Henri M. lEVAS E. M. PELTIER Daniel M. PRIGENT J. M. FOUCAUD André M. lANG Jean M. CARRIE R. M. GUERlllOT Claude-Roger M. KERFANTO Michel (E.N.S.C.R.) M. DABARD René M. GRANDJEAN Daniel M. LUCAS Jacques M. MARTIN Guy M. JOUAN Pierre M. DUVAL Jacques M. COGNE Jean Melle DURAND Suzanne M. BOlllOT Gilbert M. RICHARD Gaston M. MAillET Pierre M. RAZET Pierre M. FOlLlOT Roger M. AllEGRET Paul M. MANIEY Jacques M. JOLY Jean-Marie M. lEFEUVRE J.C. M. VillERET Serge M. ClAUSTR ES Georges Melle GOAS Gabrielle Melle GOAS Marie Mme lEMOINE Cécile
M. ORTIGUES Edmond Chimie Biologiaue Géologie Zoologje Botanique Philosophie M. TAllEC André M. HAMEURT J��Marie M. lARD EUX Hubert
M. CAllEC Jean-Jacques
M. TOUFFET Jean
M. JACQUES Francis M. BEYSSADE Jean-Marie
A Monsieur le Professeur R. CARRIE
Témoignage de ma
En témoignage de ma vive reconnaissance
A ma mère
A ma chère michèle
Ce travail a été effectué au Laboratoire de Syilthèses'Organiques de la Faculté des Sciences d'Oran,sous la direction de Monsieur F.TEXIER.
Qu'il me soit permis d'exprimer aux autorités algériennes et en parti culier à Monsieur H. LAZREG Recteur de l'Université d 'Oran,et t10nsieur A. MESLI Doyen de la Faculté des Sciences,mes remerciements pour l'accueil qu'ils m'ont réservé au sein de leur Université.
,
J'exprime ma profonde gratitude à Monsieur le Professeur R. CARRIE qui après m'avoir accepté comme élève et n'ayant cessé de m'aider et de me conseiller tout au long de ce travai1,a accepté de participer au jury.
Que Monsieur F. TEXIER,Haître de Conférences à la Faculté des Sciences d'Oran,veuille bien trouver ici l'expression de ma profonde et sincère reconnais sance pour les conseils,les encouragements et la bienveillance qu'il m'a toujours témoignés.
Je suis particulièrement reconnaissant il Monsi�, ur le Professeur A.FOUCAUD de l'Université de Rennes,d'avoir accepté de présider la commission d'examen.
Je remercie vivement le Docteur J.L.PIERP� de l'Université de Grenoble de s'être intéréssé à ce travail et de l'honneur qu'il me fait en participant au jury.
Ces remerciements e'adressent également à Monsieur F.TONNARD,pour sa col laboration très fructueuse à une partie de ce travail.
J'associe à ces remerciements les chercheurs et le personnel technique des laboratoires de Rennes et d'Oran qui m'ont toujours fait bénéficier de leur amitié et de leur aide ';fficace.
TABLE DES mATIEREs
INTRODUCTION GENERA LE
PREMIERE PARTIE
°
° °
SUBSTITUTION NUCLEOPHILE EN SERIE METHACRYLIQUE
INTRODUCTION
CHAPITRE 1
SYNTHE SE ET STEREOCHIMIE DE DIVERSES ENAMINES DE LA SERIE METHACRYLIQUE
Partie théorigue
1- Obtention et caractsrisation des esters et nitriles
�
aminométhacryliques. 1 1 3 4 7 8
11- Quelques remarques sur la synthèse des énamines 1Q et 11 12
111- Stéréochimie des énamines 1Q et 11 1�
1°) Cas des énamines � et 112 14
2°) Cas des énamines 1Q et des autres énamines 11 15
3°) Remarque sur la conformation du groupement 17
aminé de 10 et 11
IV- Isomérisation des énamines lQ et 11 18
V- Hydrolyse des énamines 1Q et 11 19
VI- Densités électroniques des énamines 1Q et 11 20
Partie expérimentale
1- Mesures physiques 21
11- Préparation des produits de départ. 21
1°)
�,�
dibromométhacrylonitrile et méthacrylate de 212°)
�
bromométhacrylonitrile 4a3°)
0
bromométhacrylate de méthyle .i9.111- Préparation des énamines 1Q et 11
2 2 2 3 2 3 2 4 24 24 24 24
1 °) Méthode générale de préparation 20) Enamines 1Q et 11 obtenues
I V- Produits d'hydrolyse des énamines 10 et 1 1
1°) Obtention des aldéhydes 1 5
2°) 2,4 dinitrophénylhydrazones .1.§.
CHAPITRE I I
SUBST ITUTION EN SERIE METHA CRYLIQUE P AR DES NUCLEO
PHI LES DIVERS
Partie théorigue
2 8
l. Synthèse d'éthers et de thioéthers vinyliques 2 8
1 °) Synthèse et caractérisation des éthers et thio- 2 9
éthers vinyliques
2°) Remarques concernant la synthèse de 11 et 1 8 2 9
3°) Stéréochimie des composés 12 et � 31
4°) Densités électroniques des éthers 1 7 3 2
II. Substitution à l'aide de l'ion azoture 3 2
1 °) Synthèse des vinylazides 3 2
2°) Addition de 2 0 à l'acétylène dioarboxylate de 33
méthyle
III. Substitution à l'aide des phosphines 34
Partie expérimentale •
••
1. Synthèse des étners et thioéthers vinyliques 11 et 1li 36
1 °) Synthèse des thioéthers vinylique� � et � 36
2°} Synthèse des éthers �inyliques 1 7 36
30) Synthèse des éthers vinyliques 1 8 36
1I- Synthèse des azides vinyliques lQ 38
111-1°) Obtentio� des azides 2 0 3 8
2°) Obtention Synthèse du sel 1 ° ) ObteMtion 2°) Hydrolyse 01 du de du de triazole 22 phosphonium 23 sel 23 23 38 3 8 3 8 �9
III DEUXIEME PARTIE
REACTIVITE DES OLEFINES VIS A VIS DES AZIDES
ORGANI-QUES. DECOMPOSITION DES TRIAZOLINES OBTENUES. 40
INTRODUCTION 41
CHAPITRE 1
SYNTHESE D'AMINO-5, CYANO ( OU CARBOMETHOXY )-4
TRIAZOLINES 44
Parti e théorique
A- Rappel des travaux ant�rieurs relatifs à l'addition des
azi des organiques aux ol�fines. 44
B- Addition d'azides organiques aux �namines 10 et 11 45
1- Synthèse des triazolines 45
11- Stéréospécifioité de la réaotion 51
l1I- Stéréoséleotivité et orientation de l'addition 53
1°) Stéréoséleotivité 53
2°) PreuVe de l'orientation
a- cas où Y=CN
b- cas où Y=COOCH3
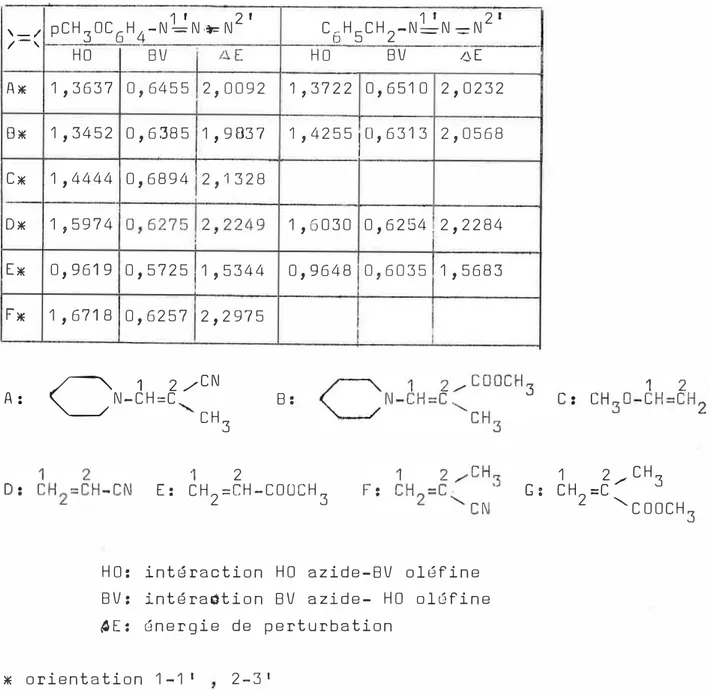
IV- Etude cin�tique de la cycloaddition 1°) Résultats antérieurs 2°) Mesures oinétiques a- choix de la méthode b- discussion de la méthode 53 53 55 55 55 56 57 57 c- mesures quantitatives 58
V- Essai d'interprétation théorique 64
1°) Rappels sur la théorie des perturbations 64 2°) Problèmes de l'orientat ion 68
8- travaux antéri eurs 68
b- calculs des orbi tales frontières 70
des azides organiques et des oléfines utilisés
c- orientation de la cycloaddition par 74
le calcul des perturbations
d- prévisions théoriques conoernant le 79
. 3°) Essai d'interprétation théorique de la
ré-activité 81
a- Bssais d'interprétation à l'aide des
orbitales frontières 81
b- essais d'interprétation à l'aide du
calcul de l'énergie des perturbations. 86
Partie expérimentale
1� Synthèse des azides organiques 95
II- Synthèse des triazolines 95
I11- Spectre de masse de 34b 98
IV- Etude cinétique de la cycloaddition des azides aux
018-fine 1 0d et 1 1 c. 9 8
CHA P I TRE I I
THERMOLYSE ET PHOTOLYSE DES A MINO-5 , C YA NO ( OU
CAR-B OMETHOXY )-4 TR1AZOL I NES 1 02
Partie théorigue
A- Résultats antérieurs
1 °) Obtention d'aziridines, d'azométhines et d'éna
mines.
2°) Obtention de triazoles
1 02
1 0 2 1 03
3°) Obtention de dérivés diazoïques 1 04
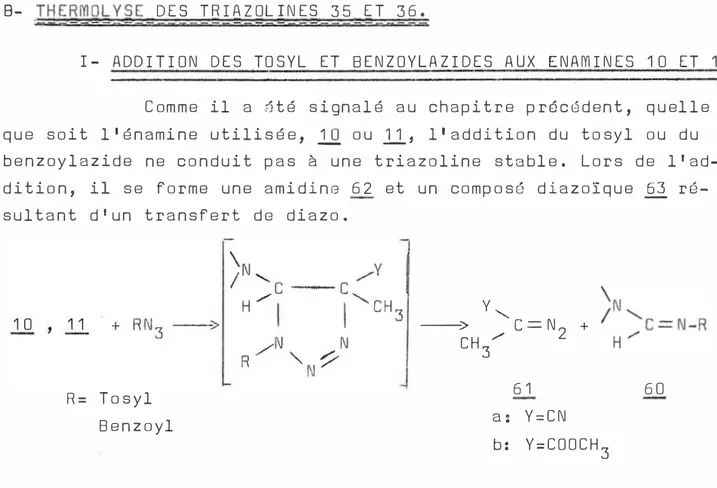
4°) Cas particulier du tosylazide 1 05
B- Thermolyse des triazolines 12 et � 106
1- Addition des tosyl et benzoylazidss aux énamines
1 0 et 1 1 1 06
1I- Thermolyse des triazolines 12 et 36 1 07
1 0) Cas où Y=COOCH3: réaction de transfert de
diazo. 1 08
2°) Cas où Y=CN: réversibilité de la cycloaddi-tion dipolaire 1 , 3
a- thermolyse à 1 1 0°C
1 1 0 1 1 0 b- la réversibilité est-elle stéréospscifique1 1 1
c- équilibre de la cycloaddition 1 1 1
Partie eMp�rimentale
1- Synthèse des ami dines 60 et des diazocomposés É!
II· Synthèse de la pyrazolénine É1
I11- Thermolyse des triazolines 35 et 36 10) Thermolyse v 116 116 117 11 ; 20) Préparation du triazole 1Q 117
IV- Photolyse des triazolines 35 et 36 117
10) Obtention des ami des 1l 117
20) Obtention des pyrrolines �-l§ et du pyrrole 11 117
o o o CONCLUSION 119 BIBLIOGRAPHI E ANN EX E o o o o o 0
,-Energies et coeffioients des orbitales Il de divers
oléfines et azides organiques.
120
Les c�mposés éthyléniques 1 substitués à la fois par un groupement électrodonneur Nu et par un groupement électroattrac teur Y ont été relativement peu étudiés en ce qui concerne leurs réactions de cycloaddition. \ /Y Nu = N- I RO- I RS- , . . . (R 1 ) ( Nu)C==C 1 "R 2 Y = COOR 1 CN , COR , • • • 1 (Z,E)
Ces oléfines peuvent se comporter a priori comme des com posés du type acrylique, ou bien comme des énamines ( Nu = �N -),
ou des éthers vinyliques ( Nu = RO). En outre lorsque R2 est dif
férent de H , ces composés 1 sont des réactifs de choix pour tenter d'obtenir des hétérocycles tels que des aminoaziridines activées, composés inconnus lorsque nous avons entrepris notre étude.
Les recherches que nous avons conduites ont été effectuées en série méthacrylique ( R 1 = H , R 2 = CH3 ), dans le but de pré
ciser l'influence des substituants sur la réactivité des composés
1 vis à vis des azides organiques. En outre, lorsque Nu =
;
N - , laprésence du méthyle en � du groupement activant Y permet d'obtenir des triazolines 2 stables.
\ N-CH- C(CH 3 )(Y) 1
1
1
N N R / "N4' 2 32
Laur d�composition a été étudiée, mettant en évidence les diverses
possibilités de rupture de l'hétérocycle suivant la nature de R, de Y et du mode de dégradation ( thermique ou photochimique) • Les
aminoaziridines l sont obtenues lorsque la décomposition est ef fectuée photochimiquement.
La plupart des composés 1 ( R1= H , R2= CH3 ) utilisés au cours de ce travail ne sont pas décrits dans la littérature, et nous les avons préparés par substitution nucléophile du
�
bromo méthacrylate de méthyle ou du0
bromométhacry10nitrile selon la réaction schématique suivante:Nu- + 8rCH=C(CH 3)(Y) 4 y = eN ; ----'�NuCH=C(CH3)(y) + 8r-5 \ N- , RO- , RS /
La réaction suit obligatoirement le mécanisme de substitution nu cléophile directe ( addition-élimination) (1). La substitut�on
nucléophile en série méthacrylique n'ayant fait l'objet que d'une étude fragmentaire (2), nous l'avons étendue à divers nucléophiles tels que N3- et �3P.
Notre exposé est divisé en deux parties: la première traite de la synthèse et de la stéréochimie des oléfines 2. L'étude de la réactivité, vis à vis des azides organiques, des énamines, éthers
ou thioéthers vinyliques synthétisés précédemmen�, ainsi que la décomposition des triazolines obtenues font l'objet de la seconde partie.
PREIYlIERE PA R T I E
4
I NTRODUCT I ON
La substitution nucléophile d'un halogène porté par un car bone vinylique est généralement difficile. La réaction est facilitée par un substituant électroattracteur activant Y sur l'oléfine �.
6 7
X ::: F , Cl , Br y = CN , COOR , COR , • • •
L'étude du mécanisme de cette réaction a fait l'objet de travaux récents ( 1 , 3, 4) et en résumé trois schémas réactionnels
peuvent être distingués:
a- Elimination- Addition faisant intervenir un inter médiaire acétylénique. Dans ce cas, le nucléophile Nu- agit sur le substrat au niveau de l'hydrogène en
r
de l'halogène (5).... C=C /Y
X/' ... H
+ Nu ---'> -C ==C-Y + NuH + X ---;> 7 b- Elimination-A ddition faisant intervenir un
inter-médiaire allénique. Ce mécanisme est surtout caractéristique de la série crotonique, en effet le nucléophile Nu- agit sur l'hydrogène
1 en
�
de l'halogène (6) . c:/ CH3,,- (h./y C=C X/' '' + ----.,�CH = C = C ./ y 2 " + NuH + X- -> lAddition-Elimination où le nucléophile agit direo tement sur le carbone porteur de l'halogène avec un intermédiaire carbanionique. + Nu -) Nu y l 'Y'" � C- C l "-X 8 --� 7 + X
Dans ce cas la réaction est expliquée à l'aide du schéma suivant
(1 ) : inversion �
H
\t X ktB
�
H
Y_
2_H
"--J
Y
Ce schéma indique des chemins réa�tionnels différents selon la vitesse relative des différents processus: rétention de configu ration, équilibre ou racémisation, et inversion de configuration. Expérimentalement, la substitution nucléophile d'un halogène por té par un atome de carbone vinylique s'effectue, dans la plupart
des cas, avec une rétention de configuration de l'ordre de 95%.
Dans quelques oas il est possible d'avoir une racémisation par tielle ou tota�e, mais jamais de véritable inversion de configu ration. Outre la conservation de la stéréochimie, cette réaction est caractérisée par une réactivité comparable des deux substrats
Z et E et par l'absence d'effet isotopique dans le produit de sub stitution lorsque la réaction est effectuée dans un solvant deuté rié , lorsque l'oléfine halogénée possède un atome dihydrogène
viny-6
lique.
La conservation de la stéréochimie, problème le plus intéres sant de ce mécanisme, est expliquée de la manière suivante dans la li ttérature ( 1 ): Nu
ch
R3-@
-R2 / 0 ""-' X _ R1 8 8 '" ... ;::. Nu R3�
-x
0�'
R1 2 81 rotation de Nu R2�
J0-06)�
X R .Lll rotation R1 3 de ) 600 :> 1200 rétention de configu ration inversion de configu rationAu cours de la rotation de 600 de l'atome de carbone portant les
radicaux R2 et R3 autour de la liaison C-C, R2 et R1 sont en po
sition éclipsée, tandis qu'au cours de la rotation de 1200 R2 et
Nu ainsi que R3 et X se trouvent en position éclipsée. La forma
tion du rotamère � nécessiterait moins d'énergie que celle du
rotamère � ; le rotamère 8 l se formerait donc plus facilement
que le rotamère � et par là même la rétention de configuration
est observée.
La substitution nucléophile en série méthacrylique suit obli gatoirement le schéma c. Elle n'a fait l'objet que d'une étude frag
mentaire (2) et nous l'avons étendue à divers nucléophiles.
Cette partie est divisée en deux chapitre� Le premier traite
de la synthèse et de la stéréochimie de diverses énamines 2' Le se
cond est consacré à l'étude de la substitution nucléophile en série méthacrylique à l'aide de divers nucléophiles: alcoolates, thiolates ,
azoture, phosphines, • • • permettant la synthèse de diverses oléfines,
CHAPITRE 1
SYNTHESE ET STEREOCHIMIE D E QUELQUES ESTERS ET NITRILES
o
A MIN O METHA CRYLIQUESP A RTIE THEORIQUE
Introduction
La littérature signale de nombreuses méthodes de synthèse d'énamines ( 7) , parmi lesquelles la plus importante est la conden sation d'un dérivé carbonylé avec une amine secondaire. Récemment la réaction de substitution nucléophile d'un halogène porté par un
atome de carbone éthylénique a été étudiée (1, 2, 3, 4) et il a été
montré que la réaction est facilitée par la présence d'un groupe ment éleotroattraoteur activant. De ce fait, elle oonstitue une mé
thode de synthèse élégante d'énamines substituées en
0
par une fonotian ester ou nitrile.
Comme nous l'avons signalé précédemment, nous nous sommes intéressés à la série méthacrylique et cette méthode de préparation nous a semblé la mieux adaptée.
Nous examinerons 'dans ce chapitre la synthèse et l'étude sté
réochimique de divers esters et nitriles
�
aminométhacryliques. L'8
1- OBTENTION ET CA R A CTERI SATION D E S ESTERS ET N I TR I LES
�
AmINOmET H A CRY L I, QUE S •
Les énamines 1Q et 1 1 sont préparées selon le schéma réac
tionnel suivant:
base
-_-=...::��--.;�
B r C H 2 ,-, C B r ( CH 3 ) (y ) 9a: Y=CN ; 2Q: Y=C OOCH3
\
It + 2 N-H
/
4a: Y=CN ; iQ: Y=COOCH3
\
---> /N-C H=C(CH3)(Y)
10: Y=C N 11: Y=COOCH3
La déshydrohalogénation do � et de 2Q se fait respective
ment à l'aide de la triéthylamine en solution benzénique et du mé thylate de sodium en solution alcoolique. Les caractéristiques phy
siques des composés ± et 2 figurent dans la partie expérimentale.
L'addition d'amines aliphatiques primaires ou secondaires
aux composés
�
bromés 4, à température ambiante, et dans divers solvants ( benzène, alcool éthyliquo, acétonitrile) , conduit aux éna
mines 1Q et 11. Par contre, la substitution de l'halogène n'a pas
été observée dans 10 benzène ( aussi bien à température ambiante
qu'à l'ébUllition) par action de l'aniline ou de l'imidazole sub
stitué ou non sur les mêmes dérivés ±. Certaines énamines 1Q et 1 1
sont préparées directement par addition de l'amine au dérivé diha
logéné �. Dans tous les cas , seules les énamines 1Q et 11 sont ob
tenues. Sauf lorsque l'énamine solide peut être séparée du mélange
réactionnel par filtration, les produits 1Q et 11 sont purifiés par
distillation fractionnée sous pression réduite, ce qui entraine un�
isomérisation Z�E des produits.
I l convient de noter qu'un excés d'amine ne conduit pas au produit de biaddition analogue à celui observé dans quelques cas de
substitutio� par les alcoolates (3).
/ 4 + 3 H -N \ , / ----'-:;> 1 0 - ou 1 1 � + H - N \
�
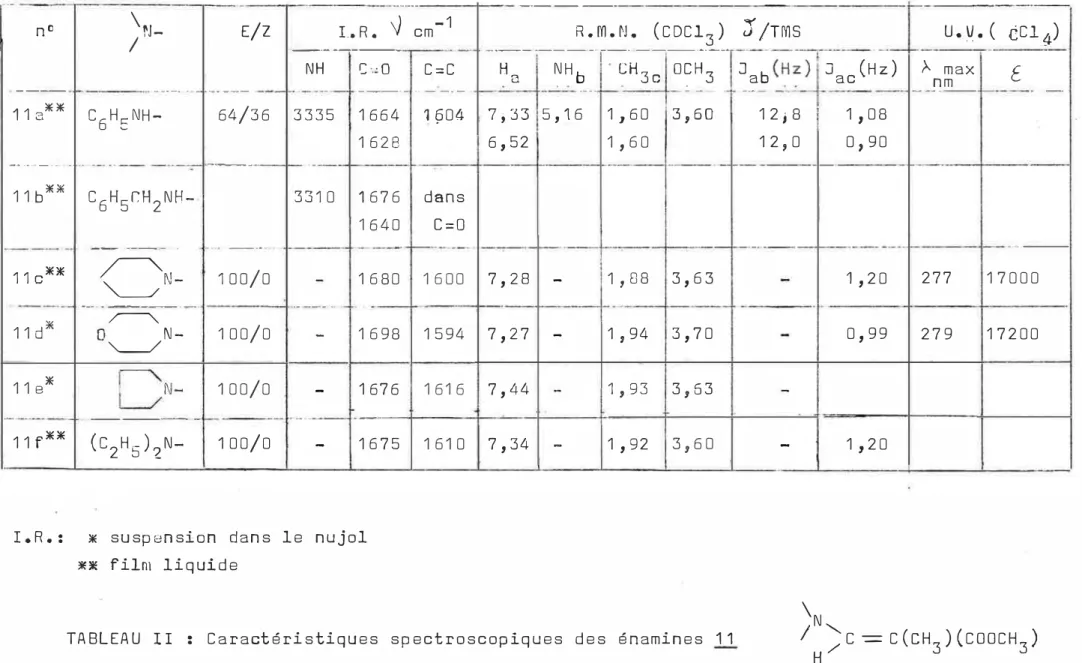
\N-CH--CH(CH3)(Y) 1 1 N /" "L e s caractéri stiques spectroscop iq u e s d e s énamin e s 1Q et 11
sont rassemblées dan s l e s tableaux 1 et I I. Eh I nfra-Rouge , ces
com-p o s é s com-p résentent des bande s d ' absorcom-ption caractéristiques corres
p on dant r e sp e cti vem e nt à
fonction e ster conjuguée entre 1 60 0 et 1 660 cm-1
-1
la fonction nitril e vers 21 00 cm , à la
vers 1 6 50 cm-1 et à l a double l iai son
�
C=c�
L es sp ectres de R.m. N . , outre l e s si gnaux
attribuabl es au radi cal aminé se comp osent de deux ou troi s séries de p i c s :
- u n signal corresp ondant au group ement méthyle , couplé à lon
gue d i stance avec un p roton vi nyliqu e , vers 1 , 8 0 ppm .
- un singul et corresp ondant au mét h yl e de l a fonction e ster vers 3 , 6 0 ppm pour l e s énamin e s 1 1 .
- un signal dO au proton vinylique couplé à longue di stance
avec u n group ement mét h yl e entre 6 , 0 0 et 7 , 00 ppm .
L e déplacement chimique d u p roton vin ylique des énamines e st caractéristique du degré de recouvrement de l a paire d ' él ectrons libres de l ' atome d ' azote et d e l a doubl e liaison; plus ce recou vremen t est imp ortan t , p l u s le p roton résone à champ èl evé ( 8 ) . P o u r l e s énamines n e p o ssédant pas de group ement e ster ou nitrile
en
r
le dépl acement chimique du proton vinylique décroit en fonctionde l a nat u re de l ' amine selon l ' ordre ( 8 ) :
cl H (ppm ) ( amine ) : p yrrol idine > morp holine� p ip é ridine
Dan s l e cas des énamines 1 0 et 11, ce classement est égal ement res
p ecté .
P l u s le p roton vinylique résone à champ él evé, plus la fo rme ion
immonium 1 2 est favori sée p ar rapport à la forme énamine 1Q ou 1 1 .
\ l\J... /"y 1 C=:-C H /" "CH 1 0 ou 1 1 3 1 2
Enfin l e s sp ectre s Ul tra-Vi olet p résentent une lar ge bande
vers 280 nm att ribuable à une transition�-
V*
avec u n coefficientd ' exti nction voisin de 1 70 0 0 . No rmal ement , les énamin e s p résentent
une bande vers 230:: 1 0 nm . (E= 5000 à 900 0 ) (8a ). Dans le cas
nO
/ �t\J- E/Z I.R. \Jcm
-1 R.m.N. (CDC13 ,j /Tms) u. v . ('CC14) 10a
lIE 1ob* 1oc** 1 0d"l01�
1
1100*!
-1of* 1og* -. -. tBu�JH-C6H11NH-1
C6H5CH2NH-
CN-��
N---C
N - (C2H5)2N-VNHI
JCN 100/0 3325 2180 100/0 3305 2175 11/89 3405 21 BD 3330 [/100 - 2178 0/100 - 2177 0/100 - 2170 10/90 - 2175I.R.: *
suspension dans
le nujol**
film liquide
Ic=c
Ha
'NHb
CH3cJab(Hz)
1660 6,74 4,30 1 ,56 13,8 1640 6,74 4,401
1,62 13,2 6,56 1 ,64 1 1642 6,64 4,95 1 ,56 12,8 6,501
1 ,63 1618 6,47 - 1 ,78 -6,23 - 1 ,78 -1628 6;42 - ,1 ; 82-1
1 ,82 6,24 - -1624 6,65 - 1 ; 77 -6,55 - 1,77 -1623 6,41 - 1 ,79 -6,26 - 1,88-TABLEA U l
Caractéristiques spectroscopiques des énamines
10J (Hz)
ac
max
E nm 1 ,08 273 17300 0,96 272 17500 0,90 1 ,08 0,99 1,08 0,90 0,90 278 17000 '\ IN '-c = C (CH3) (CN) ./'H
a - -� o---11 a** ---� .. _-_. -11
bl!O�
---11 c** ---11d* 11 8 * -_._---11f** / 1- . --._ .. - - C6HSNH-._ - ---_._ - C6H5r:H2NH---_ . ��I � "---- --� -_._ -0,,---/N-1
�
N - (C2HS)2N--- --64/36 -- -- -100/0 100/0 100/0 f--100/0 --- - -NH C;',;O C=C .-- --- -_.-. -3335 1664 1Çi04 1628 -3310 1676 dans 1640 C=O ----r--- -- 1680 1600 ._-_ . -- 1698 1594 - 1676 1616 -_ ._- -- 1675 1610 ----I. R .: * susp8nsion dans le nujol
** film liquide ---·1--- ---:1----.- -H CI NHb ' CH3 c OCH3 J b a
(H
�
J ac (Hz) . . . - --' : - -- ---- -'. ' --- -7,33 5,16 1,60 3,60 12,8 1,08 6,52 1 ,60 --_._-- - --7,28 - 1 ,88 3,63 . - - -7,27 - 1 ,94 3,70 7,44 - 1 ,93 3,63 7,34 - 1 ,92 3,60 -- --12,0 ---- -_._- -- . \N 0,90 -- -1,20 0,99 1,20 , ->- max E. nm - - ---_. ---- --277 17000 279 17200TABLEAU II : Caractéristiques spectroscopiques des énamines 11 /
"c
� C(CH3) (COOCH3)H/
� -""
présence de la fonction nitrile ou ester ayant un e ffet bathochrome. Cette longueur d'onde est à rapprocher de la transitionTt-lÎ* des diénamines vers 291 nm. aV8C un coe fficient d'extinction de 23000 environ.
rr- QUELQUES REMARQUES SUR L A SYNTHESE DES ENA MrNES 1 0 ET 1 1
L'examen des tableau�VI et VII concernant la synthèse des énamines 1Q et 11 montre que la substitution suit l'ordre do réac
tivité suivant:
quelle que soit la fonction Y. Cet ordre correspond à la nucléophilie des amines qui est différente de leur basicité comme cela a été vé. rifié à de nombreuses reprises (9).
Le tableau II I indique l'influence du solvant dans les réac tions de substitution nucléophile. Nous prendrons comme référence
la réactivité dans le benzène. I l apparait clairement que l'acétoni trile accélère nettement la réaction , alors que l'emploi de l'étha nol comme solvant,ne modifie pas sensiblement la vitesse réaction nelle.
L'augmentation de la vitesse est en accord avec les résultats de la littérature (10 ) , car les solvants dipolaires aprotiques accroissent en général la vitesse des réactions de substitution nucléophile. En e ffet, en accord avec les théories de Hughes et I ngold, ces solvants augmentent la vitesse d'une réaction ayant un état de transition
faisant apparaitre des charges ioniques ou concentrant dans un faiblo volume des charges déjà existantes.
La formation de l'intermédiairo 8 généralement admis dans les réac
tions de substitution nucléophile directe nécessite le passage par un complexe activé II d�ns lequel il y a une séparation de charges différentes. Ceci entraine une augmentation de la vitesse
réaction-nelle dans les solvants plus polaires , la solvatation étant plus importante et par là même l'énergie d'activation moins élevée. L'
1 3
TA BLEA U III : Effet de sol vant dans l e s réaotions de substi
tution nucl éophile direote *
4 H - NI solvant T oc durée rendement %
- \ ( j ours ) 4a C 6H1 1 NH C6 H 6 22 1 0 traoes -2 22 53 2 CH3C N 2 2 1 0 2 0 2 2 53 52 4a C 6H5CH 2NH 2 C6H 6 22 3 2 25 -CH3C N 2 2 3 0 29 C 6H6 80 1 3 0 .� CH3C N 82 1 3 5 4a tBuNH 2 C6H 6 22 60 0 -CH 3C N 2 2 4 0 0 C6 H6 80 60 0 CH3CN 82 4 3 2 82 1 4 50 4b C 6H 1 1 NH 2 C 6H 6 22 1 0 0 -22 53 2 CH3C N 2 2 1 0 0 22 53 37 4b C 6H 5CH 2NH 2 C6H 6 22 3 0 0 CH3C N 2 2 3 0 2 C 6H 6 8 0 1 2 0 CH3CN 82 1 2 5 4 b tBuNH 2 C6 H 6 22 6 0 0 8 0 5 0 CH3CN 22 60 0 2 2 1 20 traces 82 5 0
* : C e s différentes réactions ont été effeotuées à d e s conoentra
éthanol, solvant plus polaire que le benzène , n'a pratiquement pas d'effet sur la vitesse de la réaction. En effet, s'il peut solvater
efficaoement le complexe 11, il diminue également la nucléophilie
de l'amine en la solvatant spécifiquement par liaison hydrogène. Ces deux effets contraires se compensent donc dons notre cas.
Nous remarquons aussi que la série où Y est une fonction ni
trile est plus réactive que la série où Y est uno fonction ester.
Cette particularité est en accord aV8C les travaux de Rappoport et
coll. dans une série homologue ( 4) .
'\ N-H 1 + y CIC ( R ) ==C/ 'y -�--> \ /Y IN - C (R)::::tC 'y
Les mesures cinétiques e ffectuées par ces auteurs montrent que le dérivé dinitrile ( Y = CN ) est cent fois plus réactif que le dérivé
diester ( Y = C O O C2H5 ). En outre , ces travaux montrent que l'en
tropie d'activation .S* est largement négative, ce qui est normal puisque une solvatation croissante lors du processus d'activation prov�q�e une augmentation du degré d'ordre.
1 11- STEREOCHImiE DES ENAmINES 1 0 ET 1 1 .
La stéréochimie des énamines 1 0 et 1 1 a été attribuée à l'
aide de l'Infra-Rouge et de la R.m.N., les caractéristiques spec
troscopiques de ces composés figurent aux tableaux 1 et II.
1°) Cas des énomines 110 et 11b
La spectroscopie infra-rouge permet d'attribuer la
structure Z ou E aux énamines 1 1a et 11 b. La fréquence � C=O de l'
isomère Z est abaissée du fait de la chélation de la fonction ester.
H ... ...CH3 a C =C c R-N
/
'c
-OCH "H O� 3 b -z Eque le p roton H dG l ' i somè re E. 08 p l u s , la constante de coupla
I a
ge allylique+JHaHc est plus él evée p o u r l ' i somè re E , ce q ui e st en
acoord avec l e s ré sultats de la littérature . ( 1 1 ) .
2 0 ) C a s des énamines 1 0 et de s autres énamines 1 1 .
Dans c e s cas , il n ' exi sta p a s de p o ssibilité de chéla
tion et la sp ectrosoopie I . R. ost insuff i sante p o u r détorminer la
configuration de l ' oléfine . L ' attribution de la stéréochimie e st of
fectuée à l ' ai d e de la R.m�N. selon l e s critè res suivant s:
* l e p roton Ha en cis du groupement électroattracteur
z E
y e st plus déblind6 que lorsqu ' il est en tran s , comme cela a été
d émont ro p ou r les énamines � et 1 1 b ( 1 2 ) .
* c et t e observation 8st invers8e en ce qui concerne les
p rotons H c du group ement méthyle vinyliqu e .
* la con stante do oouplage al lylique 4JH a_Hc d e s dérivas
E e st sup é rieure à c elle de s dérivés Z ( 1 1 ) .
Dan s l e cas aD un seul i somère e st obt enu , cette méthode ni
est plus applicable et la métho d e Gmp i riquG de Pascual ( 1 3 ) s ' est montre e inefficace p our ré soudre ce p ro blème, comme cela a été mon tré p o ur d ' autres compo sés ( 1 3 , 1 4) .
A titre d ' ex emple, nous avons reporta ci-de ssous les déplaoements
ohimiques des p rotons vinyliqu e s des énamines 1Q et 1 1 calculés à
l ' aide de la formul e de Pasoual ( 1 3 ) et quelques dépl acement s chi miques exp érimentaux.
�
H :: 5, 2 8 +L
Tableau IV déplacements chimiques de 1 0 et 1 1.
- SH
calc. .--
---1--SH
exp. 1 0Z 1 DE 11 Z 11 E 6,29 6 ,46 6 , 27 6 ,83 6 , 5 6,-6, 74,-6
, 52!?-:-;;----1 6Ces valeurs sont largement différentos , néanmoins l'ordre relatif est correct . Un proton vinylique de l'isomère Z résone à un champ plus fort que le proton correspondant de l'isomère E. Cependant lorsqu'un seul isomère est obtenu dans la synthèse , la comparaison du SH calculé et du JH expérimental ne permet pas d'attribuer la
stéréochimie de l'énamine .
Au regard des tableaux l et II, nous pouvons remarquer que l'
isomère E semble être le composé le plus stable thermodynamiquement lorsque Y=CODCH3 , quelle que soit l'amine utilisée, tandis que lors que Y=CN, l'isomère E est prépondérant si le nucléophile est ,une amine primaire , l'isomère Z si le nucléophilo est une amine secon daire. Ces résultats peuvent s'expliquer en examinant les modèles moléculaires. La molécule devant tendre vers la planeité pour avoir
une délocalisation maximale des électrons, il est clair que l'encom brement stérique dé croit selon les séquences suivantes, en admettant en première approximation que l'atome d'azote conserve son hybrida tion quel que soit le
(
ou les)
substituant •1 0 : énamine secondaire E > énamino secondaire Z
t'inamine tertiaire Z > énamine tertiaire E
1 1 : Gnamine secondaire Z > énamine secondaire E
dn8mine tertiaire Z » énamine tertiaire E
Un autre résultat expérimental nous laisse penser que dans la série des énamines 11 ( Y=CDOCH3 ) , le produit obtenu préférentielle ment lors de la substitution nucléophile est l'isomère E. En effet , en examinant le déplacement chimique des diffdrents protons vinyli ques des énamines 11, nous pouvons dire que pour toutes les énamines
lis, 11& et � le même isomère E ou Z est obtenu puisque, comme nous l'avons signalé procodemment , le déplacement chimique du pro ton vinylique dépend de la nature de l'amine, et l'ordre suivant
e st observé :
pyrrolidine ) morpholine N p ip é ridine
En étendant ce cla s sement et en le comparant à celui des énamines
lQ, nous p ouvons conclure que l ' énamine 11 obtenue p ure est l ' i so mère E . 10 amine O-N H � eN >Q-NH > [ )N) CJ i somè r e E E z z E amine i somè r e E E E z Z Z li amine i somÈlre x E x x x z
De p l u s , l ' obtention de couple d ' i somères Z , E 11 , pa r i somé ri sation thermique , p ermet de confirmer c ette stéréochimie , comme nous le verrons dans le p rochain parag rap he .
3�) Remarque sur la conformation du groupement aminé de 1 0 ou 11.
L e s énamines 10a, .90, E. et .1JJ!, .90 p o s sè dent un atome d '
hydrogène H b et la con stante de couplage J HaH b voisine de 13 H z
indique q u e ces énamines doivent exister p référentiel l ement sous l a conformation s trans , par anal o gi e avec l e s constantes de cou
plage des p rotons du formamid e � ( 1 5).
s t rans H c'N-C a ... H H"""'" b �O 14 JH aH b JH a H c s cis = 13 H z = 2, 1 H z
1 8
IV- IsomERI SATION DES ENA m I N ES 1 0 ET 1 1 .
La substitution nucléophile directe est caractorisé e par une rét ention de configuration ( 1 ) . Gardner ot C oll . ( 2 ) ont m ontré que la substitution nucl é ophile du
0
bromométhacrylonitrile se fait avec95% d e rétention . L e s tabl oaux 1 e t I I montrent que l a géométrie de
l ' halo génure vinylique n ' e st pas resp ectée. C ep endan t , ces ré sultats ne sont pas forcément en désaccord avec la stéréospécificité de la réaction p uisque les énami nes s ' i somé risent facilement et les p ro duits obtenu s sont l e s p roduits thermodynamiques .
Plusieurs mécani smes sont po ssibl e s pdur expliquer l ' i soméri sation d e s énamines secondaires ( 1 6 , 1 7 , 1 8 ) :
- addition élimination RNH ./ H 'C==C H./ 'V R NH + R N H 2 .� -., H -'c -C H V RNH 2 R N H ./ V --�, "C =-C "'" H/ 'H - élimination addition RNH 2 + H-C=C-V
- réaction intramol é culai re : équilibre imine-énamine
R-N�C " -CH 2V
H/
L o rsque l ' atome d ' azote ne p o rte pas d ' atome d ' h yd rogè n e , il a été montré que l'i som�risation pouvait se fai re selon un é quil ibre énamin e- ion immonium ( 1 7 , 1 9 ).
\
IN... / V --_ .... ).. C� C
0::-/' ...
Dans la série méthacrylique, tous l e s mécanismes cités s ont p os si bl e s
à l'ut>:'Copnion de l ' élimination-ad dition qui impliq ue l'existence d ' un
atome d ' h yd ro gène en
0
du groupement aminé .d o u b le t l i b r e d e l ' az ot e ave c la d o u b l e l iai s o n sera i m p o rtant , pl u s l a p o s s i b i l ité d ' i s o m é r i sati o n sera g ra n de p u i s q ue l a f o rm a i o n i m m o n i um 1l sera fav o r i s ée .
P o u r p r o u ve r la stéré o c h i m ie de s é nam i ne s o bte n u e s p u r e s , i l a é t é n é c e s saire , c o mme n o u s l ' av o n s v u , d ' e f fe ctuer d e s i s o m é r i sa ti o n s therm i q ue s . L e s r é s u l tats d e ce s i s o m é ri sati on s f i g u re n t au tabl e a u V . .... - - _ ... _ - - - - I s o m é r i sati o n t he rm i q u e de s é nam i ne 8 1Q e t 1 1 T a bl e a u V : ,
1
n O r j 1 0 b 1 0 c1
1 0 e 1Qf.1
1 1 d - 1 -1 1 E / Z 1 0 0 / 0 1 0 0/ô1
0/1 0 0 0/1 0 01
1 0 0 / 0 t h e rm . 1 . . t o c 1 4 0 - 1 4 5 1 2 0 - 1 4 0 6 2 9 0 - 9 2 6 2 d u r é e 5 j . 5 j . , p m m 5 3 7 6 0 5 7 6 0 . _ ---- -- .. _----_ .. � .. ---E/ Z 7 8 / 2 2 5 3 / 4 7 2 2 /7 8 1 4 / 8 6 7 2 / 2 8 i s o m . 1D ' ap rè s l e s val e urs d e s d é p lace m e nts c h i m i q ue s d u p r o t o n v i n yl i q u e , 1 0 c d o it ê tre p l u s fac i l e à i s o m éri se r q ue 1 0 b , de m ê me � par r ap p o rt à 1 0f. Dan s le tableau p ré c é de nt n o u s c o n s tat o n s
b i e n q ue lQs s ' i s o m é ri se à u ne te m p é rat u re i n f é r ie u r e à 1 0 b . Dan s l e cas d e � e t de 1 0 f la c o n c l u s i o n e st i de nti q u e : 1 0e s ' i s o m é ri se à 6 2 ° C al o r s q ue ce t rai te m e nt e s t i n e f f i co ce p o u r 1 0 f . v - H Y DR O L Y SE D E S E N A m I N E S 1 0 ET 1 1 . L ' h y d r o l y s e d e s é nami n e s c o n d u i t à d e s p r o d u i t s d i f f é re n t s se l o n l a nat u re de l ' ao i de uti l i s é ( 2 0 ) .
A v e c u n aci d e f a i b l e l a réaoti o n o o n d u i t à u n al o o o l am i n é . Par
c o ntre ave c un ac i de f o r t , ol le o o n d u i t à un al d é h y d e par un m é o a n i sme d é m o nt r é dan s l e oas d ' é nam i n e s d e l a s é r i e o r o t o n i q u e ( 2 1 ) .
L ' h y d r o l y se d e s é n a m i ne s lQ e t 11 e st i mm é d i a te e t o o n d u i t
à u n al d é h y de e ste r o u n itri le 12, o a racté r i s é p a r i n f ra - r o u g e et p a r sa 2 , 4 d i n it r o p h é n y l h y d raz o ne 12.
2 , 4DNP 1 5 a : Y=CN b : Y=C OOCH 3 N02 2 0
D
/CH3 • D2 N-O
-�
-N=CH-CH " y li a : Y=CN b : Y=C OOC H3Les caractéristiques sp ectro scopiques d e s h yd razones 12 figurent au
tableau V I .
I��!���_�� : Caractori stiques spectroscopiques d e s hydrazones 1 6 n O � NH 1 6a 3200 --ill 3290 , I o R . (n u j ol) o C=N 2240 -J c =o
i
JC=N . -! 1 7 36 1 1 6 1 5 1 61 6 R . IYl . N . (CDCL � ) CH3 C H_�
N=CH 1 NH 1 , 62 3 , 8 3j
7 , 7 0 2 , 23 1 , (� 8 3 , 551
7 , 6 8 -1 1 1 tV I DENSITES EL ECTRONIQ UES DES ENAIYl I N ES 1 0 ET 1 1 .
OCH3
-3 , 80
C omme nou s l e verrons dans la p rochaine parti e , nous avons calculé l e s coefficients et l e s énergie s d e s orbital es d e s énamine8
1Q et 11. Nous donnons ici les densités él ectroniques d e diffé rents
atomes d e ces énamine s , elles sont en accord avec celles calr,blées par l a méthode de Hückel LCA O pour des oléfines anal o gues ( 23 ) .
1 0 3 , 50 3 , 90 CH 3 00C ", c / CH 3
Il
4 , 20 C 3 , 77 H / "NI \ 5 , 21 11PART I E EXP E R I m ENTAL E
1 - mESURES PHYSIQ UES
l e s indice s d e réfraction ont été m e su r e s au ré fractomètre d e l�bbe (Karl Kolb ) thermo stati sé à 2 2 ° C . Les m e sures sont effec
tUBes p ou r la raie D du sodium .
L ' e nr egistrement d e s spect res ultra-violet est effectué à l '
aide d ' un sp ectrop h o tomètre P srkin Elmer modèle 402. les comp osés sont en solution dan s l e tét rachl o rure d e carbone pour sp ectropho
t ométrie U . V . , à d e s concent rations d e l ' ordre d e 1 0-2 mole par
litre .
l e s sp ectres infra- rouge sont enregistrés à l ' aide d bs spec
trophotomètrœ P erkin Elme r modèle 225 ou 257 .
L ' enregi strement d e s sp ectres d e R . m . N . a été réal i sé à l r
aide d e s appareil s JNm 4H 1 00 et mH 1 00 (JEOlCO) à 1 00 mH z •
. I I - P REPA RAT I ON DES PRODU I T S DE DEPART.
l e méthacrylonitrile et l e méthacryl at e d e méthyle sont des
p roduits commerciaux ain si que toutes l e s amines utili sées au cours d e ce t ravail .
1 ° ) �, 0 di bromométh acrylate d e méthyl e et méthacryl onitrile 9
Une solution de brome ( 1 mole) dans 1 00 cm3 d e tétra�
chl o rure d e carbone e st aj outée l e ntement à temp érature ambiante à
l ' oléfine ( 1 mole) dissoute dans 200 cm3 d e CC14 • La vitesse d ' ad ditio n d e b rome doit être réglos de façon à éviter tout échauffement
d e la solution. A la fin d e l ' addition du brom e , l e solvant est é va
2 2
9a E 3mm = 57-58 ° C , n
�
2 = 1 , 5230 , Rdt :: 8 8% ( Litt . ( 2 ) : 49%) I . R . ( film liquide ) * : V C =N : 2240 cm-1R . m . N . ( CDC13 , J/Tm S ) * : CH3 =2 , 1 8ppm , C H 2= système AB centré
9b E3mm = 5 8 ° C , nD = 1 , 5 064 , R d t = 89% à 3 , 94ppm , JA B = 1 1 H z 2 2 I . R . ( film liquide ) : � C ::O : 1 7t� 0
R . m . N . ; C H3 ::2 , 04 , OC H3 ::3 , 86 , CH2 = systèmo A B centr� à 4, OU , JAB= 1 0 H z
\',)
2 ° ) \ bromomothacryl onitrile 4a
Une solution de unD mol e do triéthylamine dan s 200 Qm3 de benzène est additionnée au déri vé d i br omé � ( 1 mol e ) d i s sous dans 2 0 0 cm3 de benzène . La solution o bt enue est abandonnée à
temp é rature ambiante environ dix heures . La r�action est terminée en p o rt ant l a solution b en zénique à l ' ébullition troi s heures sup
plémentaires . Après filt ration du sel et é vap oration du solvant , un liquide noi râtre est obtenu . I l est p urifié p ar di stillation sous
pression réduite .
4a E5mm = 3 8-41 ° C , n
�
2 = 1 , 4967 , R d t = 7 0% , E/Z = 55/4 5 I . R . ( film liquide ) :V C =C : 1 590-1 605 , �C �N : 221 0R . m . N . : H = 7 , 1 9 ( E ) , 6 , 88 ( Z ) ; CH 3 =2 , 0 0 ; 4J = 1 , 3 H z
Litt . ( 2 ) : E20mm= 50-7 0 0 C , Rdt=71% , E/Z =3/5
L e rapp ort E/Z a été o bt enu ap rè s d o sage R . m . N . et dosage
par chromato grap hie on p hase v a p e u r réalisée sur col cnneQ F1 1 0%,
C hrom o W 80%, l ongueur : 1 , 5 m , temp érature du four : 1 1 5 ° C , temp é
rature de l ' i njecteu r : 1 80 0 C , temp urature du détecteur : 1 7 0 0 C , d é bit N2� 30 cm�Jmn , 'dobit H 2 = 2 5 cm3/mn . .. T emp s d o ru"tention :
48 E : 61 s , .1.3. Z : 94s , 9 a : 1 52 s
L e p ourcentage en produit dibromé 9 a reste i n féri eur à 5% .
* : Dans la suite de l ' exp o sé , tous l es déplacements chimiques sont
exp rimés en ppm et déterminés par rapp o rt au TffiS p ri s comme référence intern e , sauf indication cont raire. Les fréquences infra- rouge sont
- 1
3 0 )
(?
bromométhacryl ate d e méthyl e 4bUne solution de 20g de méthylate de sodium dans
200 cm3 de méthanol est ajoutée lentement à une solution d e une
d emi mole de 9b dissous dans 1 00 cm3 de méthanol . Il 8e produit presque immédiatement un précipité d e bromure d e sodium . Le mélan ge est abandonné d o u ze heures à température ambiante et le méthanol
e s t chaes é sous pression réduit e . Le résidu est étendu d ' eau et
ép uisé à l ' éther. L e s solutions éthérées sont rassemblées et séchées
sur sulfate de sodium anhydre . Après Filtration et évaporation de l � éther, l e p roduit � brut est di stillé sous p re s sion réduite . I l ost bon de conservor C 8 p ro duit en p résence d e trac8s d ' hydroquinone .
4 b E5mm= 4 2 ° C * , n
�
2= 1 , 4874 , R dt= 90% , E/Z= 1 00/0l • R . ( f i l m l i q ui d e ) : \) C = C : 1 61 2 ,
\)
C = 0 : 1 7 2 0 -1 7 t� 4R . IYl . N . (CDC13 ) : H ( E ) =7 , 6 0 , CH3 =1 , 96 , 4J =1 , 2 H z
C . P . V . m�m 8 s con ditions que 4a
temp s de rétention : 7 7 s
1 70 s p our 9 b ( m o i n s d e 5%)
* : ce compo s é doit �tre p u rifi6 sous p ression rolati vement
fai bl e , en effet, en l ' absence d ' h ydroquinone et sous une pre ssion de 35 mm de mercure nou s avons obse rvé une p ol yméri sation trè s ra pide et trè s fortement exothermique qui a produit une exp l o sion de l ' app areillage à di still er .
III - P réparation des énamines 1 0 et 1 1 .
1 ° ) lYléthode gé nérale de préparation .
Une solution de 2/1 0 de mole d ' amine dans 3 0 cm3 de
solvant est ajoutée l e ntement à 1 /1 0 d e mole de d é rivé � \ bromé 4
dissous dan s 20 cm3 de s ol vant . L a solution résul tante �st al ors
abandonnée à temp é rature ambiante . L ' avancement de la réaction est
contr�!é p ar pe see du sel qui p récipite . Lorsque la formati on de sel n ' évolue plus dans le t omp s , l e solvant est distillé sous p res sion réduite . Lorsque l ' énami ne n ' est pas sol id e , le résidu h uileux obtenu e st distillé sous p r e s sion réduite . Si l ' énamine 8 st sol i d e
à temp érature ambiante , ell o o st recristallisoe dans d e l ' éthanol
à 95% .
L o rsque l 8 s synthè ses sont e ffect u é e s à la temp ératu re de l '
24
Si le dérivé bromé est l e dérivé
� , r
dibrom é , un mode opéra toire identique est util i sû , mais dans ce cas il convient de p ren dre 3/1 0 de mole d ' amine p o u r e ffectuer à la fois la dé shydro halogénation et la substitution nucléophil e . Il e st p ré fé rable d ' ajou ter les amines secondaires D U substrat très lentement car la déshy
drohalogénation ost trè s rapide et trè s exothermique .
2 ° ) Enamines1 0 et 1 1 o btenues .
Los caractéri st i q u es p hysiques d e s é namines .1.Q. e t 11
ainsi quo l e s modes op ératoi r e s empl oyés sont résumés dan s l e s ta bl eaux V I I et V I I I . L e s anal y s e s centé simal e s fi gurent au tableau I X .
IW ;' - P R ODUITS D ' H YDR OLYSE DES ENAM I N E S 1 0 ET 1 1
1 ° ) O btontion des aldéhyde s 1 5
3
Une solution d ' acide sulfurique N ( 20 cm ) est
ajou-tée à 5 g d ' énamine lQ o u 11. La solution acide o btenue est épuisée à l ' éthe r . L e s solutions éthérées sont ra s sembl é e s , neutral i sées et
séchées s u r su lfate de sod ium anhydre . A p rè s é vapo ration de l ' éther l ' huile obtenuo est caract érisée à l ' aide de l ' infra-rouge .
--JC=0 : 1 73 6
2 ° ) 2 , 4 dinitrophényl hydrazones 1 �
L a solut ion sul furique p ré cédente e s t remplacée par une s olution alcoolique acido d o 2 , 4 di-Ritrophénylhydrazine
( 2 50 cm3 d ' al cool éth yliq u o , 20 cm3 d ' acide sulfu rique concentré , 4g de 2 , 4 di-nitrophénylhydrazino , 1 3 0 cm3 d ' eau ) . Les h ydrazones correspondant e s p récipitent immédiatement . A p rè s fil tration et recristal l i sation dan s l ' éthanol à 95%, l e s comp o sé s 1 6 a et .J..É..Q. sont obtenu s purs .
1 6a F=1 31 ° C , Rdt=7 8% anal y s e C1 0H9 N5 04 C N 0 cal e . % 45 , 62 26 , 6 1 24 , 33 t r . % 45 , 7 6 26 , 3 2 24 , 40 1 6 b F=7 6 0 c , Rdt=83% anal yse C1 1 H 1 2N4 06 C N 0 cal e . % 0 4 t� , 5 9 1 8 , 92 32 , 43 t r . % 44 , 7 0 1 B , 78 3 2 , 47
T A B L E A U V I I
Constantes p h y siques des é nami nes 1 0
tJ
rOdUit sol v,ant durée rendement FO C [ E/Z nD 22de jours ( brut ) o C/mm R . IYl . N .
départ 1 Oa
1
4a1
CH 3CN1
7 01
67 6 81
1
1 0 0/01
1 0b 9a EtOH 7 2 7 2 6 0 1 40-1 45/5 7 8/22 4a CH3C N 3 El 6 0 98 1 00/0 1 0c 9a C6H6 55 5 3 3L� · 1 20-1 40/3 53/47 48 CH3CN 60 80 1 0 0/0 1 0dl
4a 1 C6H61
21
1 001
1
1 28/51
1 1 /891
1 , 53 57 1 1 Oe1
L�a1
C6H61
451
971
6 01
1
0/1 001
1 0 f 4a C 6H 6 5 90-92/5 1 4/861
1 , 5380 4a C 6H6 5 22 0/1 0 01
1 091
431
C6H61
4 01
451
1
1 00/51
1 0/901
1 , 53052 6
T A B L E A U V I I I
Co nstantes p h ysiques d e s énamines 1 1
R é f Produit solvant durée rendement F O C ,- E/Z 22
c.. nD
de jOUI'8 ( brut )
oC/mm
R . IYl . N .départ 1 1 a 9 b EtOH 30 65 1 00-1 40/2 64/36 1 , 5220 4 b C6 H 6 62 82 1 3 0-1 40/5 1 , 5220 1 1 b 4b C6 H 6 6 0 7 6 1 1 c 4 b C6H 6 1 0 7 0
1
1 55/3 1 00/0 1 , 5363 1 1 d 4b C6 H6 (�O 951
5 8 1 0 0/0 9 b C6H 6 45 50 57 1 00-1 20/2 1 00/0 1 1 0 (�b C6H 6 6 01
78 21 1 1 5-1 2 0/2 1 00/0 1 , 53 56 1 1 1fi
4 b1
C6H61
6 01
451
1 00/51
1 0/90 1 , 5047 1T A B L EA U I X
A naly s e �lément8ire d e s énamin e s 1 0 e t 1 1
\ N -/ Y 1 tBuNH C N C 6 H 1 1 N H C N C 6 H 5C H 2N H C N
e
N e N � O"--.../N C Ne
N C N C 6 H1 1 N H r: 0 0CH 3 C6 H 5 C H 2 NH C OO C H 3e
N C O O CH 3 � o ,,---/N C O O C H 3e
N C O O C H ? J ( C 2H 5 ) 2 N C O O C H 3 Formule brut o C fJH 1 l�N 2 C 1 0H 1 6N 2 C 1 1 H 1 2N 2 C 9H 1 4N 2 C 8H 1 2 N 2 O C 8H 1 2 N 2 C 1 1 H 1 9 N 02 C 1 2 H1 5 N 02 C 1 0H1 7 N 0 2 C g H 1 5 N 03 C 9H 1 5 N 02 C 9H 1 7 N 0 2 1 Cd 1 ;0r-1 c�üe ' l
t r . 1 6 9 , 5 6 6 9 , 29 7 3 , 1 7 7 2 , 5 3 76 , 7 4 7 6 , 43 7 2 , 00 7 2 , 0 3 6 3 , 1 5 6 2 , 62 7 0 , 5 8 7 0 , 5 3 67 , 0 0 6 6 , 6 6 7 0 , 24 6 5 , 5 7 65 , 6 3 5 8 , 3 8 5 8 , 1 4 6 3 , 9 0 6 3 , 6 0 6 3 , 1 6 6 3 , 32 11
1
c a l e . 2 0 , 1 lf 1 7 , 07 1 6 , 27 1 8 , 6 6 1 8 , 42 2 0 , 5 8 7 , 1 0 6 , 82 7 , 65 7 , 5 6 8 , 2 8 8 , 1 9i
, N/� 1 0% t r .I C81C' 1
t r • 1 1 9 , 7 8 - -1 6 , 7 9 - -1 6 , -1 0 - -1 8 , 85 - -1 8 , 46 1 0 , 6 2 1 0 , 92 2 0 , 46 - -6 , 82 1 6 , 2lf 1 5- ,, 6 1 8 , 01 1 7 , 4 8 1 7 , 80 7 , 68 25 , 94 2 5 , 91 8 , 00 1 8 , 93 1 9 , 23 8 , 0 1 1 8 , 7 1 1 8 , 4528
C HA P I T R E I I
S UB ST ITUT I ON N UCLEOPH I LE EN SER I E M ETHA CRYL I Q U E
P A R DES NUCLEOP H I L ES DI V ERS
PARTI E TH EOR I Q U E
A fin de généraliser l ' éturle des réactions d e substi t ution nucloophil e en série mothacryliq u e , nous avo n s utilisé divers nu clé ophil e8 tel s que les alcool a t e s , l e s thiolat e s , l e 8 p h o sp hines et les azoture s condui sant resp ectivement aux éthers , thioéthers vinylique s , s e15 d e phosphonium et azides vinylique s .
1- SYNTH ESE D ' ETH E R S ET D E TH I O ETHERS V I N YL I Q UES .
L e s éthers ou thioéthers vinyliqu e s , comme les énamine s ) ont été utilisés dans les réactions dipolaires 1 , 3 et sont cla ssés dans l a catégorie des ol é fines riches en élect rons ( 24 ) . Dan s le cadre général de l ' addition des azides organiq ues sur les oléfines ac tivées par un group ement électroattract eur et par un group ement élec trodonneur , nous nous sommes p roposés de p réparer quel q u e s éthers
et thioéthers vinyliques en util i sant les dérivés
�
bromés � décrit s au chap i t re p récédent .1 ° ) Synth� se et caract�risation dos éthers et thio�thers vinyligue s .
L es éthers ou thioéthers vinyliquos 1 7 et 1Q sont p ré parés selon le schéma réactionnel suivan t :
CH Br == ----R O ( S ) ---�---> /y FW ( S ) CH := C ' CH 3 11 y = CN 1 8 y = COOCH3
L e s n ucl é op hil e s sont , soit un alcoolate d e sodium, soit un mélange thiol-amine .
L ' examen d e s sp ectres d e RmN des p roduits bruts d e la réac tion montre que seuls l e 8 p roduits d e substitutio n sont o btenus , même dans l e cas o ù l e rapport subst rat/ba se est supérieur à un .
L e s caractéristiques sp ectro scopiques des comp o s ô s 12 et 1 8 figurent au tabl eau X . L e s sp ect res infra-rouge et RmN p r�sentent des caractéristiques anal o gues à ceux des énamines 1 0 et 1 1 à sa voi r : en infra-rou g e une bande d ' absorption du groupement carbon yl e ou du groupement nit ril e ; en R m N I G S sp ectres sont caractérisés par des signaux dus au p ro t o n vinylique , au group ement mé thyl e vi nylique et au squelette d u nucl é ophil e .
2° ) �emarguès concernant la synthèse d e 17 et 1 8 .
L e s comp o s�s -1 7 et 1 8 ont tous 6té p u rifiés par dis-._. t illation sous p ression réduite ce qui a entrainé une isomérisa tion Z/E . De ce fai t , une fois de plus, nous n ' avons p u mettre en évidence la rétention de configuration d e la réact ion d e substitu tion n ucléop hile directe o bservée par Gardner et Coll . en série méthacrylique ( 2 ) . ( I l faut noter que la rétention de configura tion n ' a pas été o b se rv�e non plus sur l e s p roduits brut s réaction nel s , l e s p roduits ayant pu s ' isomé riser entre la synthè se et la sp ectrograp hie RmN ) .
I l e st à noter que lorsque l ' éthanol est utilisé c omme sol
vant , il se p roduit une transestéri fication et l e s comp osés 1 8 Z et E correspo ndants sont o btenus en mél ange avec 1 9 .
3 0
T A B L E A U X
Caractéri stiques sp ectro scop iques de 1 7 et 1 8
R O ( S )
1 ---rl---
---I
i
I: R . 1 R . m . N . 1 y � C N ou : �C =C1
HI
l,
CH3Il
CH3 0 li Jab ( H z )l
1
yi c o 1 1 r---r---�---�---�i---�'-6--,6-1-+--1-,-7-6-+---4 I '�
1 76 CH3 0 CN� '� :
1
6 , 7 1 1 1 , 73 - 1 , 5 E 1 7 b CN 2200 1 7 c CN 224 0 1 1 7d CN 2206!
T 6 , 32 1 650 6 , 6 2 1 6 60 1 * 1 1 , 8 {�1
1 , 84 1 , 9 0 1 � 84 - 1 , 2 - 1 , 5-
i
1 , 3 - 1 , 51
1 5 85 1 6 , 901
1 , 92 -1
1 , 3 z 1 E ! z E1
1 7 , 0 8 . 1 , 88 - , 1 ,5 ----�---+---r---�----+---�----�--�I---.---I 1 7 , 26 1 , 98 3 , 64 1 , 5 1 8b** C H 0 2 5 COOCH3 ! 1 73 8 1 64 8 , 1 7 , 50 1 , 98i
7 , 24 1 7 1 01
1 65 0 7 , 40 , 1 1 7 021
1 6 21 7 , 22 1 1 , 98 ! j 1 7 1 {� , 1 i 1 1 71 01
1 7 , 44 1 61 0 , 7 , 5 0 1 1 585 7 , 6 8 1 , 98 2 , 001
1 1 , 95* signal dans l e massif benzénique
** : trans8stéri fication partielle o u totale
3 , 64 1 , 5 i
T
!j
1
3 , 60 1 1 , 6 3 , 60 1 , 6 z E z E z E4b + RD 1 8 + ROCH ==
1 9
C omme dan s l e cas des énami n e s , nous avons constaté que la s é r i e où Y est une fonction nit rile est p l u s réactive que la série où y Bsi une f onction este r . Nous avons de même co nstaté q u ' un sol
vant ap rotiquG accélère fortement la réaction . En effet , l a réaction de l ' ion thiophénate aVGC 4a ost instantanés dan s l ' acétonitrile al ors que dans l ' éthanol , utilisa comme solvant , la réacti o n n ' at teint q u ' un rendsment de 7 0% ap rès deux moi s . Co résul tat ne p eut s ' expliquer que par une augmentat ion de la nucl o ophilie d e R S- dans
u n sol vant non p rotique ( car l e nucléophile est charg é , et du fait
de la disp er�ion de charge dans le complexo 1 3 bis nous d evrions avoir une diminution d e la réactivité dans co sol vant dipolaire ) .
Fl O , (�) -y , "" ,y B r - C -=-:...: C f "'CH H 3 1 3 bis
3 0 ) Stéréochimie des compo sés 17 et 1 8 .
La sté réochimie des éthers et thi08thers vinyl iques 11
et 1 8 a été déterminéo p a r RMN selon le8 mêmes critè res q u e p our l e s
é namines 1 0 et 1 1 �
- l e proton en cis du groupement él sct roatt racteur Y est plus déblindé que l o rsqu ' il e st en tran s .
- cette observation est inversée o n c e qui concerne l e s p rotons d u groupement mét hyl o vinylique .
- la constante de couplage all ylique des i somè res E est
sup é rieure à celle dos isomères Z .
La formulo empiriquo de Pascual ( 1 3 ) n ' ost pos app l icable aux oléfines 1 7 et 1 8 comme nous p o u vons le voir dans l e tabl eau
3 2
Tabl eau X I : D�placements chimiques des protons vinyliqu e s
de 1 7 et 1 8 . 1 7 l 1 7 E 1 8l 1 B E < u H calc . 6 , 7 8 6 , 95 6 , 76 7 , 3 2
1
H exp . 6 , 6 1 6 , 7 1 7 , 25 7 , 40 4 ° ) Densité électronigueL e s densités électroniques calculées selon la méthode I NDO s o n t les suivantes p ou r les ol é fines 1 7 et 1 8 .
6 , 25 C H3 0 H \ / C 3 , 74 Il C 4 , 1 5 / � C H3 C O OC H3 6 , 25 C H3 0 H \ / C 3 , 7 7 1/ C 4 , 07 / "-C N CH] I I - S UB ST I TUTI ON A L ' A I DE DE L ' I ON AlOTUR E .
La substitution nucléophile Got une méthode de synthè se des vinylazides ( 25 ) . En général , une rétention de configuration mar quée est o bservée dans cette réacti o n , ce qui e st un indice p our dire que la réaction suit u n mécani sme de substi tution n u cl é op hil e dire cte .
1 ° ) Syn t h è s e d e s vinylazides.
L e s vinylazi des 1Q sont obtenus par action de l ' azo
ture de sodium sur les dérivés
�
halogénés 4, à la temp ératureambiante .
H "
---?» C ::= C (CH] ) ( Y ) + NaBr N 3 /"
20a : Y=CN
A p rè s différents es sais de sol vants ( éther , méthanol aqueux ,
m é t h an o l aqueux basiq u e , D . m . F . ) nous avons choisi le mélange
éra-3 éra-3
ble , bi en que la r6acti on s o i t relativement l e n t e p ui squ e l e nu cl éophile est solvaté dans ce solvant p ratique . Des essais de syn thèse réali s é s à la temp é rature de l ' é bullition de ce solvant con
duisent à des mélanges goudronneux qui n ' ont p a s été identifios .
L e s caracté ristiqu8 s des vinylazides 2 0 sont les s uivante s : 2 D a : 1 . R • ( film l i q u i de ): J C =N : 2 2 1 8 , 'V C = C : 1 6 1 6 ,
�
N 3 : 2 1 1 8R . M . N . ( C DC 13 ) : H ,: : 6 , 9 0 -7 , 1 5 , CH3 : 2 , 0 3 - 1 , 82 2 0 b : F= 64 ° C
I . R . ( nujol ) : \I c =o : 1 7 1 8 , -J C = C : 1 63 0 , \) N 3 : 2 1 1 0
R • rn • N . ( C 0 C 13 ) : H \= : 7 , 4 5 , C H 3 : 1 , 7 7 , C H 3 0 : 3 , 7 3 , J ab : 1 1 4 H z
La p hotolyse de c e s azides ne conduit p a s aux azirines 2 1
mais à des p olymè res non identifiés .
� Y
2 0 --)"*(--� H - C --- C ./ CH3
'\
N/
'y
2 1
2 ° ) A ddition de 2 0 à l ' acétylène dicarboxylate de méthyle .
Les azides o rgani Ques s ' additionnent aisément à 1 1 acé
t ylène dicarboxylate d e méthyle pour conduire au triazole corres
p o ndant ( 2 6 ) . L ' azide 2 0 b additionné à c e m�me dipolarophile p e r
met l a synthè se du vinyl-1 -triazole 2. 2 .
2 0 b + C H 3 0 0 C - C - C - C O O C H " � J :> H 'C N N / "" -Y Il C C H O OC / ""- C H 3 3 �J 2 2
34
Les caractéri stiq ues sp ectroscopiques du triazole 22 sont les sui van t es :
I . R . ( nujol ) :
�
C :::C : 1 56 0 , � C =O : 1 741R . M . N . ( CDC13 ) : H : 8 , 1 6 , CH3 : 2 , 22 , C H3 0 : 3 , 88-4 , 00-4 , 04 Jàb = 2 H z
1 1 I - SUB ST I T UT I ON A L ' A I DE DES PHOSPH I N E S .
L ' un e des méthodes d e synthèse d e s sel s de phosp h onium est
l a s u bstitution d ' un hal o gè n e par une p h o sphine ( 27 ) . L e sel de
phosphonium Il est obtenu par addition de la trip hénylphosphine sur l e dérivé
�
b romé 4a en sol uti on benzénique à l ' ébulliti on .----... :>
23
L e s caract éristiques spectro scopiques de 23 sont les suivantes :
I . R . ( nujol ) :
�
C N : 2220 , --.J C =C : 1 6 04R . M . N . ( 02 0 ' TMS ext ) : H : 6 , 1 1 - 6 , 39 , CH 3 : 4 , 74 , Jab=5 , 1 Hz , J p H= 27 H z .
L e sel d e p h o sphonium corresp ondant à � ( Y=COOCH3 ) n ' a pas été obt enu dans c e s conditions . Contrairement aux travaux de P attenden et Coll . ( 2 8 ) les produits de d épart ne sont pas récup é r é s , mais une gomme élastique partiellement soluble dans l ' eau , donnant une sol ution acide , est o btenue . La même observation a été e ff ectuée en addition nant la t ributylp h o sp hine aux dérivés 4 dan s les mêmes conditions .
L ' action d ' un e base ( NaOH 0 , 01 N ) sur Il conduit à l ' oxyde d e p h o sphine et au méthacrylonit ril e , identifiés par compa rai son avec des échantillens authentiques ( CP V , RmN , I R ) .
L ' h ydrolyse p eut s ' expl iquer s elon deux mécanismes différent s : - h yd rol yse d i recte d u s el d e p h o sphoni um comme Wil son et C oll . l ' ont déjà obssrvée ( 29 ) .
- p a s s a g e p a r u n a l l y l i d è n e p h o s p h u r a n n 8 24 ( 3 0 ) :
e N "
2 3 + O H- -� C � C == p ( C6H 5 ) 7 + H2 0
CH 3 ./ J