MINISTEREDEL’ENSEIGNEMENTSUPERIEURETDELARECHERCHESCIENTIFIQUE
U
NIVERSITED
JILLALIL
IABES DES
IDIB
ELA
BBESF
ACULTE DES SCIENCES DE LA NATURE ET DE LA VIED
EPARTEMENT DEB
IOLOGIEL
ABORATOIRE DE MICROBIOLOGIE MOLECULAIRE PROTEOMICS ET SANTET
HESEPrésentée par
M
meBENMAMMAR née KHODJA Badra
E
N VUE DE L’
OBTENTIONDU DIPLOME DE
D
OCTORAT3
èmeC
YCLESpécialité : Sciences Biologiques
Option : Microbiologie Moléculaire et Protéomics
Thème
Soutenu le :
Devant le Jury composé de :
Président :
Mr. BENALI Mohammed (Professeur, Université de Sidi Bel Abbès).
Examinateurs :
Mr. ABBOUNI Bouziane (Professeur, Université de Sidi Bel Abbès). Mr. BELABID Lakhdar (Professeur, Université de Mascara).
Directeur de thèse :
Mr. BENINE Mohamed El Amine (MCA, Université de Sidi Bel Abbès).
Année universitaire 2017/2018
Caractérisation phénotypique et moléculaire des souches de
bactéries lactiques productrice de bactériocine.
Dédicaces
Je dédie ce modeste travail à tous ceux que j'aime :
A celui a qui je dois mon amour pour la science, mon très cher père Kada Farid. Tu as
toujours su me motiver, Tu es un pilier solide et incontournable pour ma personne et mon
parcours, que Dieu te donne santé et longue vie.
A la prunelle de mes yeux, celle qui a les clefs du paradis, a toi tendre Maman que ce
travail soit pour toi le témoignage de mon infinie reconnaissance pour ton aide précieuse et
toutes ces années de compréhension. Sans toi que serais- je ?
A mon beau père et ma belle mère
A mes très chères frères :Abdelkader, Abdelhadi, Mohamed et Ahmed
A mes belle soeurs: Samia, Hafida, Chaima , Mariem et Tinhinen
A mes beaux freres: Brahim, et Dahim
A tous mes amis, et surtouts : Fatima, Wafae, Amina et Aicha.
Le plus Grand merci Dédicace à une personne Chére à mon cœur mon marie ″ Hamza″
qui m’a supporté et d’avoir été très compréhensible
La cerise sur le gateau C’est la personne qui a donné un sens à ma vie et qui illumine de
tous sont éclat ma vie ma petite et très chére fille Ritadj
A tout ceux que j'apprécie énormément, et qui contribuent à Nous rendre la vie plus agréable.
Merci à tous.
Remerciements
Avant tout je remercie tout d’abord Allah de m'avoir donné le courage, la force, la santé, et la patience pour pouvoir accomplir ce travail.
Toutes les expressions de l’estime et de gratitude du monde sont insuffisantes pour exprimer mes remerciements à mes parents qui m’ont accompagné durant tout mon cursus d’étude. Je tiens à exprimer toute mes gratitudes et remerciements à mon encadreur Dr BENINE Mohamed Lamine. Qu’il trouve ici l’expression de ma profonde reconnaissance pour m’avoir accordé sa confiance et guidé dans mon travail, ces précieux conseils, sa disponibilité et sa gentillesse à notre égard ont contribué au bon déroulement de ce travail de recherche, mais aussi et surtout pour sa qualité humaine.
Je tiens à exprimer ma très grande considération et ma vive reconnaissance au Pr ABBOUNI Bouziane, pour son aide, ces compétences et ces conseils judicieux. Mes vifs remercîments sont adressés aux membres du jury Messieurs le président Pr. BENALI Mohamed. (Université Djillali Liabes, SBA), Pr .ABBOUNI Bouziane.
(Université Djillali Liabès, SBA) et. Pr. BELABID Lakhdar (Université de Mascara) qui me font un grand honneur d’évaluer ce travail.
Un grand merci à, Mr. Dr. KERKOUD Mohamed pour leur précieuse aide et ses conseils pour la réalisation de la partie moléculaire.
Je n’oublie pas de remercier particulièrement Mme SAFER Khadija Professeur à l’université
d’Oran qui m’a beaucoup aidé, encouragé, dans des moments très délicats.
J’adresse mes remerciements à tous les ingénieurs du laboratoire de microbiologie et biotoxicologie et en particulier Monsieur : SELIOUNI Mostapha, Mme MERASI Ferdous et
MmeHaddad Fatima de leurs aides précieuse.
Un grand merci pour toutes les mamans qui ont accepté de contribuer à cette étude, en me permettant les prélèvements échantillonnales de leur lait maternel.
L’intégration de nouvelles souches lactiques provenant de différents écosystèmes est actuellement utilisée pour l’augmentation de la durée de bioconservation des aliments. Outre, l’activité probiotique de certaines bactéries lactiques est exploitée dans la production des aliments à caractères préventif et thérapeutiques.
L’objectif de ce présent travail est l’isolement et caractérisation de bactéries lactiques productrices de bactériocine du lait maternel, l’optimisation de certain facteurs tels que le pH, la température d’incubation impliquées dans la production de la bactériocine. L’isolement des bactéries lactiques productrices de bactériocine est effectué à partir d’échantillons prélevés du lait maternel. Le criblage primaire des souches lactiques à partir de lait maternel, sur un milieu de culture gélosé a permis l’isolement de 28 souche lactique. Le criblage secondaire des bactéries isolées du lait maternel a permis la sélection de 13 souches lactique antagoniste ont été identifiées sur les plans physiologique et biochimique.
L’étude des interactions a révélé un pouvoir inhibiteur de quatre souches sélectionnées fortement inhibitrices vis-à-vis de Staphylococcus aureus UT 602, S.aureus CECT 86T, S.aureus ATCC 25923, S.aureus ATCC 43300 et E. coli ATCC 25922. L’effet antagonique a été évalué par des techniques de diffusion sur gélose (méthode de double gélose, méthodes des puits). L’amplification du fragment d’ADN codant la régions 16S ARN des quatre souches lactiques, sélectionnés hautement antagoniste et leur séquencage ont révélé leur appartenance aux espèces suivants : LbL15 :Enterococcus faecium, LbC11 : Enterococcus faecium, LbC3 : Lactobacillus brevis, LbL4 : Lactobacillus sakei. En soustrayant l’effet du pH, du H2O2 l’inhibition reviendrait à des facteurs antimicrobiens de nature protéique
(bactériocine) comme il a été révélé avec Lactobacillus brevis (LbC3). L’optimisation de la production de la bactériocine sur milieu MRS est rendue meilleure à un pH de 6 et à une température de 30°C. La cinétique de croissance d’E.coli ATCC25922 en présence et en absence de la bactériocine produite par L.brevis (LbC3) a montré que la biomasse bactérienne a diminué progressivement après l’ajout des bactériocines. Les résultats des tests technologiques de cette souche sont satisfaisants pour une utilisation industrielle car elle possède une activité protéolytique et un bon pouvoir acidifiant. L’antibiotype de la souche LbC3 montre 50% de sensibilité vis-à-vis des antibiotiques tests.
L’étude des interactions inhibitrices de la souche LbC3 à l’égard de bactéries pathogènes envisagera leur utilisation à des fins technologiques.
The integration of new lactic acid bacteria strains isolated from diverse ecosystems is now used to increase the biopreservation of dairy products. Moreover, probiotic activity of lactic acid bacteria is exploiting in the fact to produce functional foods.
The aim of this study is the isolation and identification of lactic bacteria strains that produce bactériocin from breast milk, optimization of bactériocin and bactériocin production.
The primary screening of lactic acid strains from breast milk on an agar culture medium allowed to isolate 28 lactic strain. The secondary screening of bacteria isolated from breast milk allowed the selection of 13 antagonistic lactic acid bacteria were identified by physiological and biochemical methods. The study of the interactions revealed that four selected highly inhibitory strains capable of inhibiting the growth of Staphylococcus aureus UT 602, S. aureus CECT 86T, S. aureus ATCC 25923, S. aureus ATCC 43300 and E. coli ATCC 25922. The Antagonistic effect was evaluated by diffusion techniques on agar (double agar method, well methods).
The amplification and sequencing of the fragment DNA coding 16S RNA regions of the 4 isolates selected highly antagonist was performed and revealed their belonging to the strains: LbL15 :Enterococcus faecium, LbC11 : Enterococcus faecium, LbC3 : Lactobacillus brevis, LbL4 : Lactobacillus sakei. By eliminating the effect of pH, H2O2 from the antimicrobial factors, the inhibiting agent of Lactobacillus brevis (LbC3) was determined as a substance of proteinous nature (bactériocin). The optimization bactériocin LbC3 production was made in a MRS différent concentration de pH. The best diffusion of this bacteriocin in an agar at pH equal to 6 and a temperature of 30°C, allowed a better evaluation of its inhibitory effect. The study of bacterial growth of E.coli ATCC 25922 in the absence and in the presence of the supernatant L.brevis (LbC3) indicated a considerable biomass reduction accompanied with unbalanced growth after adding of the supernatant. The results of technological tests of the strain are satisfactory for industrial use: possesses proteolytic activity and showed a good acidifying power. LbC3 strain behavior was evaluated with 10 antibiotics and had shown sensitivity to 50% of them.
The study of the inhibitory interactions of the LbC3 strain with regard to pathogenic bacteria will consider their use for technological purposes.
ﺔﻤﺟﺎﻨﻟا ﺐﯿﻠﺤﻟا ﺎﯾﺮﯿﺘﻜﺑ ﻦﻣ ةﺪﯾﺪﺠﻟا فﺎﻨﺻﻷا ﻦﻋ ﺔﻟﺎطﻺﻟ ﻞﻐﺘﺴﺗ ﺎﻤﻛ ﺔﯿﺋﺎﻗو ضاﺮﻏﻹ ﻞﻤﻌﺘﺴﺗ ﺔﻔﻠﺘﺨﻣ طﺎﺳوأ ﺪﻣ ﻦﻣ ة .ﺔﯿﺋاﺬﻐﻟا داﻮﻤﻟا ﺔﯿﺣﻼﺻ ﻌﻟا اﺬھ ﻦﻣ فﺪﮭﻟا لﺰﻋ ﻮھ ﻞﻤ ﺎﯾﺮﯿﺘﻜﺑ ﺪﯾﺪﺤﺗو ﻦﺒﻠﻟا ﺾﻤﺣ ا ﺔﯨﺋﺎﯾﺰﯿﻔﻟا ﻞﻣاﻮﻌﻟا ﺔﺳارد ,مﻻا ﺐﯿﻠﺣ ﻦﻣ ﻦﯿﺳﻮﯾﺮﯿﺘﻜﺒﻠﻟ ﺔﺠﺘﻨﻤﻟ ,ةراﺮﺤﻟا ﺔﺟرد ) ﻦﯿﺳﻮﯾﺮﺘﻜﺒﻟا جﺎﺘﻧا ﻲﻓ ةﺮﺛﺆﻤﻟا ( ﻰﻨﯿﺟورﺪﯿﮭﻟا ﻢﻗﺮﻟا . لﺰﻋ ﻢﺗ 28 ﺾﻤﺣ ﺎﯾﺮﯿﺘﻜﺑ ﻦﻣ ﻦﺒﻠﻟا مﻻا ﺐﯿﻠﺣ و . يﺮﯿﺘﻜﺒﻟا دﺎﻀﺘﻟا ﻰﻠﻋ ﺎﮭﺗرﺪﻗ رﺎﺒﺘﺧا ﻢﺗ ﺪﻗ تﺮﻔﺳا ﻲﺘﻟاو ﺪﯾﺪﺤﺗ ﻦﻋ 13 ﺔﻟﻼﺳ ﻞﯿﻠﺤﺗ رﺎﺒﺘﺧا ﻢﺗو ﻦﺒﻠﻟا ﺾﻤﺣ ﻦﻣ ﺎﮭﺗﺎﯾﻮھ قﺮﻄﻟا لﻼﺧ ﺔﯿﺟﻮﻟﻮﯿﺴﻔﻟا ﺔﯿﺋﺎﯿﻤﯿﻛ ﻮﯿﺒﻟاو . ﻒﺸﻜﺗ تﻼﻋﺎﻔﺘﻟا ﺔﺳارد نأ ﻊﺑرأ ﻮﻤﻧ ﻊﻨﻣ ﻰﻠﻋ ةردﺎﻗ ﺔﯾﻮﻗ تﺎﻄﺒﺜﻣ ةرﺎﺘﺨﻣ تﻻﻼﺳ S. aureus CECT 86T
S. aureus UT 602, , S. aureus ATCC 25923, S. aureus ATCC 43300 et E. coli ATCC 25922 . ﺐﯿﻟﺎﺳﻷا لﻼﺧ ﻦﻣ ىﺮﺧأ ةﺮﻣ ﺎﮭﺘﯾﻮھ ﻦﻣ ﺪﻛﺄﺘﻟا ﻢﺗ تﻻﻼﺴﻟا هﺬھ ﺾﻤﺤﻠﻟ ﺔﯿﺋﺰﺠﻟا يوﻮﻨﻟا ﻰﻣوزﻮﺑﺮﻟا S 16 :ﻲﻟﺎﺘﻟﺎﻛ
LbL15 :Enterococcus faecium, LbC11 : Enterococcus faecium, LbC3 : Lactobacillus brevis, LbL4 : Lactobacillus sakei
و ﺔﺿﻮﻤﺤﻟا ﺮﯿﺛﺄﺗ دﺎﻌﺑإ لﻼﺧ ﻦﻣ 2 O 2 H ةدﺎﺑﻻا ﻞﻣﺎﻋ ﺪﯾﺪﺤﺗ ﻢﺗ ﺎﯾﺮﯿﺘﻜﺒﻠﻟ ةدﺎﻀﻤﻟا ﻞﻣاﻮﻌﻟا ﻦﻋ (LbC3) Lactobacillus brevis ﺔﯿﻌﯿﺒط ةدﺎﻤﻛ ﮫﻨﯿﺗوﺮﺑ ﻦﯿﺳﻮﯾﺮﯿﺘﻜﺒﻟا) ﻢﺗ .( ل ﻦﯿﺳﻮﯾﺮﺘﻜﺒﻟا جﺎﺘﻧا ﻦﯿﺴﺤﺗ LbC3 ﻂﺳﻮﻟا ﻲﻓ ﻲﺋاﺬﻐﻟا MRS ﮫﻟ ﻂﺳو ﻲﻓ جﺎﺘﻧﻹا اﺬھ .ﺔﺿﻮﻤﺤﻟا ﺔﺟرد ﺮﯿﯿﻐﺘﺑ pH يوﺎﺴﯾ 6 ةراﺮﺤﻟا ﺔﺟردو 30 ﻢﯿﯿﻘﺘﺑ ﺢﻤﺳ ﺔﯾﻮﺌﻣ ﺔﺟرد ﻞﻀﻓأ .ﺎﮭﻟﻮﻌﻔﻤﻟ ﻮﻤﻨﻟا ﺔﯿﻛﺮﺣ E.coli ATCC25922 ﺎﮭﺠﺘﻨﺗ ﻰﺘﻟا ﻦﯿﺳﻮﯾﺮﯿﺘﻜﺒﻟا دﻮﺟو مﺪﻋ وأ دﻮﺟو ﻲﻓ L.brevis ، ﻦﯿﺳﻮﯾﺮﯿﺘﻜﺒﻟا ﺔﻓﺎﺿإ ﺪﻌﺑ ﺎﯿﺠﯾرﺪﺗ ﺖﻀﻔﺨﻧا ﺔﯾﺮﯿﺘﻜﺒﻟا ﺔﯾﻮﯿﺤﻟا ﺔﻠﺘﻜﻟا نأ تﺮﮭظأ ﺔﻟﻼﺴﻟا هﺬﮭﻟ ﺔﯿﺟﻮﻟﻮﻨﻜﺘﻟا تارﺎﺒﺘﺧﻻا ﺞﺋﺎﺘﻧ . ماﺪﺨﺘﺳﻼﻟ ﺔﯿﺿﺮﻣ ﻲھ :ﻲﻋﺎﻨﺼﻟا ﻰﻨﯿﺗوﺮﺒﻟا ﻞﯿﻠﺤﺘﻟا ﻲﻓ ﺔﻄﯿﺸﻧ ﺔﯿﺻﺎﺧ ﮫﯾﺪﻟ .ﻲﻀﻤﺤﻟاو ﺔﻟﻼﺴﻟا نأ ﺎﻤﻛ LbC3 كﻮﻠﺳ ﺎﮭﻟ ﺪﺿ ﻒﻠﺘﺨﻣ 10 يﻮﯿﺣ دﺎﻀﻣ ﻲھو ل ﺔﺳﺎﺴﺣ 50 % ﺔﯾﻮﯿﺤﻟا تادﺎﻀﻤﻟا ﻦﻣ .ﺔﻠﻤﻌﺘﺴﻤﻟا ﺔﻟﻼﺴﻟ ﺔﻄﺒﺜﻤﻟا تﻼﻋﺎﻔﺘﻟا ﺔﺳارد LbC3 ﯿﻓ ضاﺮﻏﻷ ﺎﮭﻣاﺪﺨﺘﺳا ﻲﻓ ﺮﻈﻨﺗ فﻮﺳ ضاﺮﻣﻸﻟ ﺔﺒﺒﺴﻤﻟا ﺎﯾﺮﺘﻜﺒﻟﺎﺑ ﻖﻠﻌﺘﯾ ﺎﻤ ﺔﯿﺟﻮﻟﻮﻨﻜﺗ . تﺎﻤﻠﻜﻟا :ﺔﯿﺣﺎﺘﻔﻤﻟا ،لﺰﻋ ﺐﯿﻠﺣ .ﻦﯿﺳﻮﯾﺮﯿﺘﻜﺒﻟا ،ﻦﺒﻠﻟا ﺾﻤﺣ ﺎﯾﺮﯿﺘﻜﺑ ،مﻻا
Liste des tableaux Liste des figures Liste des abréviations
Introduction générale……… 01
Synthèse bibliographique 1- Lait maternel ………. ………. 03
1-1 Généralité……… 03
1-2 La composition du lait maternel……….…… 03
1-2-1 Les protéines ………. 04
1-2-2 Les caséines ……….. 04
1-2-3 Les protéines solubles ……… 04
1-2-4 Les lipides ……….. 04
1-2-5 Les glucides ………... 05
1-2-6 Azotes et sels minéraux ………. 05
1-3 Microbiote du lait maternel ……… 05
1-4 Les bactéries lactiques……….... 06
1-4-1 Définition………...……….……. 06
1-4-2 Propriété générales……….……….……. 06
1-4-3 Classification ……. ……… 07
1-4-4 Principaux genre des bactéries lactique………... 09
1-4-4-1 Lactobacillus………….………... 09 1-4-4-2 Lactococcus……….. 10 1-4-4-3 Enterococcus……….... 11 1-4-4-4 Pediococcus……….. 11 1-4-4-5 Streptococcus………... 11 1-4-4-6 Bifidobacterium……… 12
1-5 Effet probiotique et propriétés antimicrobiennes des bactéries lactiques…….. 12
1-5-1 Les acides organique………. 12
1-5-2 Le peroxyde d’hydrogéne………. 12
1-5-6 Les bactériocines……….……… 13
1-6 Bactériocines des bactéries lactiques……… 14
1-6-1 Historiques et définition………...………... 14
1-6-2 Classification ……….. 14
1-6-2-1 Classe I : Les Lantibiotiques ……….. 14
1-6-2-2 Classe II : Non-Lantibiotiques ….……… 16
1-6-2-3 Classe III : Les Bactériolysines….……… 16
1-6-2-4 Classe IV ……….…… 16
1-6-3 Production des bactériocines……….……... 16
1-6-4 Mécanismes d’action des bactériocines………... 16
1-6-5 Spectre d’activité du bactériocines..……… 17
1-6-6 Le conditionnement des bactériocines………. 19
1-6-7 Domaine d’application des bactériocines……… 19
1-6-7-1 Domaine alimentaire………... 20
1-6-7-2 Domaines de la médecine humain………..…… 20
1-6-7-3 Domaines agricoles………... 20
1-7 identification des bactéries par la biologie moléculaire………... 21
1-7-1 Méthode basées sur la PCR……… 21
1-7-2 Amplification de régions consensus et séquençages……….. 22
1-7-2-1 Principe ……… 22
1-7-2-2 Protocole générale………... 22
Matériels et méthodes 2-1 Prélèvement du lait maternel ……… 23
2-2 Isolement et purification des isolats………... 23
2-3 Purification des isolats de bactéries lactiques……… 23
2-4 Conservation des isolats………. 23
2-5 Caractérisation morphologique……….. 24
2-5-1 Examen macroscopique des colonies………...……… ... 24
2-5-2 Examen microscopique ……….. 24
2-5-2-1 Observation à l’état frais……… 24
2-5-3-2 Croissance à différente température……….……… 25
2-5-3-3 Croissance à différent pH………..………..…….. 25
2-5-3-4 Culture sur milieu hypersalé……….... 25
2-5-3-5 Recherche de type fermentaire……….……… 25
2-5-3-6 Test d’hémolyse ……….. 26
2-5-4 Identification de l’espèce par galerie API50 CH……… 26
2-6 Etude des interactions bactériennes………... 26
2-6-1 La méthode directe (spot agar test)……… 26
2-6-2 La méthode indirecte (well diffusion assay)……….. 26
2-6-3 Localisation de la substance inhibitrice………. 27
2-6-4 Mise en évidence de la nature de l’agent inhibiteur……….. 27
2-6-4-1 Inhibition due au peroxyde d’hydrogène………. 27
2-6-4-2 Inhibition due à la production d’acide organique………. 27
2-6-4-3 Recherche de substance inhibitrice de nature protéique……….. 27
2-6-5 Optimisation de la production de bactériocine……….. 27
2-6-5-1 Effet de la température d’incubation……… 27
2-6-5-2 Effet du pH………..……… 28
2-7 Mode d’action des bactériocines……….. 28
2-8 Caractérisation technologique …..……….……….. 28
2-8-1 Pouvoir acidifiant ……….………. 28
2-8-2 Pouvoir protéolytique………..………... 28
2-8-3 Pouvoir lipolytique……… 38
2-8-4 Etude de l’antibiorésistance……… 29
2-8-5 Cinétique de la croissance (production de biomasse)……… 29
2-9 Identification génotypique………...………. 29
2-9-1 Extractions de L’ADN………... 29
2-9-2 Amplification de L’ADN par PCR……… 30
2-9-3 Electrophorèse sur gel d’agarose……….………….. 31
2-9-3-1 Préparation du gel ………... 31
2-9-3-2 Dépôt des échantillons (produits d’amplification)……….. 31
Résultats et discutions
3-1 Échantillonnage………..……….………….. 33
3-1-1 Chois des isolats………..……….………... 35
3-2 Caractérisation phénotypique des isolats………...……… 35
3-2-1Caractérisation macroscopique ………... 35
3-2-2 Caractérisation microscopique……… 35
3-2-3- Test biochimique et physiologique……… 38
3-2-4 Le type fermentaire………..……….. 39
3-3 Identification par galerie api 50CH………..………. 40
3-4 Criblage des souches antagonistiques……… 42
3-4-1 Localisation de la substance inhibitrice……….. 45
3-4-2 Mise en évidence de la nature de l’agent inhibiteur……….. 46
3-4-2-1 Inhibition due à la production d’acide organique………. 47
3-4-2-2 Inhibition due au peroxyde d’hydrogène………. 47
3-4-3 Recherche de la substance inhibitrice de nature protéique………. 48
3-4-4 Optimisation de la production de bactériocine………... 48
3-4-4-1 Effet de la température d’incubation………... 49
3-4-4-2 L’effet du pH………. 50
3-5 Mode d’action des bactériocines……… 51
3-6 Caractérisation technologique des isolats de bactéries ………. 52
3-6-1 Pouvoir acidifiant……….……….. 52
3-6-2 Pouvoir proteolytique………..……... 54
3-6-3 Pouvoir lipolytique………. 56
3-7 Détermination des profils de sensibilité aux antibiotiques... 57
3-8 Cinétique de la croissance (Production de biomasse)………... 60
3-9- Identification genotypique...…... 60
Conclusion et perspective ………. 66
Référence bibliographique………. 68
Annexe Annexe1 : Composition de milieu de culture et tampon……….. 81
Tableau 1 : Composition moyenne du colostrum (en gpour100ml) (Rotten, 1991). 3
Tableau 2 : Composition moyenne du lait maternel (%). 4
Tableau 3 : Taxonomie et les clés de différentiation des bactéries lactiques (Holzapfel et
al., 2001).
8
Tableau 4 : Classification des bactériocines (papagianni, 2003). 15
Tableau 5 : Bactériocine produite par des bactéries probiotiques (Gillor, 2008). 18
Tableau 6 Volumes des composants de la solution mixte utilisée pour l’amplification
d’ADNr 16s.
31
Tableau 7 : Origine des prélèvements du lait maternel. 34
Tableau 8 : Illustration des critères morphologique et microscopique des bactéries
lactiques isolées du lait maternel. 37
Tableau 9 : Présentation des caractères physiologiques des souches lactiques isolées,
sélectionnées antagonistes.
38
Tableau 10 : Type fermentaire des souches lactiques isolées, sélectionnées antagonistes. 39
Tableau 11 : Présentation des caractéristiques biochimiques des souches isolées
sélectionnées antagonistes, lors de l’utilisation de la galerie Api 50CHL.
41
Tableau 12 : L’étude de l’activité antibactérienne des souches lactiques par la méthode
directe.
44
Tableau 13 : L’étude de l’activité antibactérienne du culot des bactéries lactiques par
mesure du diamètre de la zone d’inhibition (mm). 45
Tableau 14 : L’étude de l’activité antibactériennes de surnageant des bactéries lactiques
par mesure de la moyenne des diamètres de la zone d’inhibition (mm).
46
Tableau 15 : Activité protéolytique et lipolytiques des bactéries lactiques étudiées. 55
Tableau 16 : Résultats de la résistance et la sensibilité aux antibiotiques des bactéries
lactiques étudiées.
Tableau 18 : Présentation d’un complet génome de la souche sélectionné antagoniste
LbC11.
63
Tableau 19 : Présentation d’une séquence partielle d’ADN de la souche productrice de
la bactériocine LbC3.
64
Tableau20 : Présentation d’une séquence partielle d’ADN de la souche sélectionné
antagoniste LbL4.
Figure 1 : Arbre phylogénétique des bactéries lactiques (Holzapfel et al., 2001). 9
Figure 2 : Mécanisme d’action des bactériocines. 17
Figure 3 : Vue d’ensemble des applications potentielles des bactériocines (De Vuyst et
Leroy, 2007).
19
Figure 4 : Conservation de longue durée des bactéries lactiques purifiées (Saidi et al.,
2002).
24
Figure 5 : Les types de lait maternel. 33
Figure 6 : Illustration des modes d’accouchement des femmes allaitante. 33
Figure 7 : Répartition d’âge des femmes Allaitant. 34
Figure 8 : Aspect macroscopique des bactéries lactiques, isolées du lait maternel,
inoculées sur milieu MRS incubée à une température de 37°C pendant 48h. 36
Figure 9 : Coloration de Gram et l’observation microscopique des souches isolées,
sélectionnés lactiques (Gx100).
36
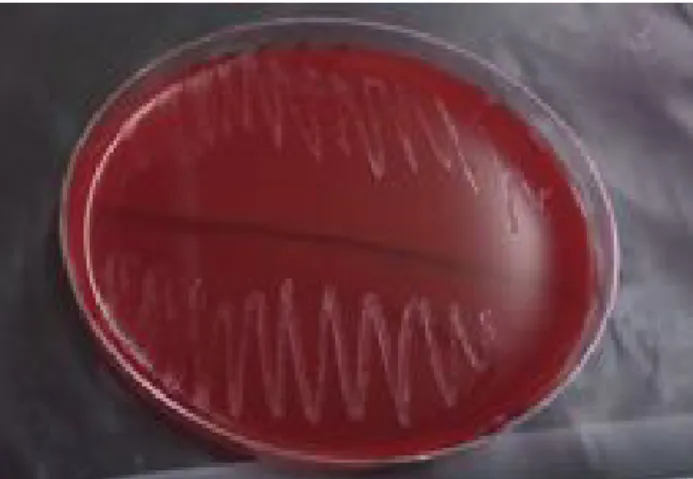
Figure 10 : Test d’hémolyse négatif des souches lactiques isolées du lait maternel. 39
Figure 11 : Photo illustrative du test de recherche du type fermentaire des bactéries
lactiques, (milieu de culture de MRS glucosé, mini d’une cloche de Durham). 40
Figure 12 : L’activité antagoniste des souches isolées, sélectionnées lactiques vis-à-vis
certaines souches pathogènes.
42
Figure 13 : Pourcentage des bactéries lactiques, isolées a partir de lait maternel inoculées
sur milieu de culture MRS, présentant une activité antagoniste vis-à-vis de Staphylococcus aureus UT 602.
43
Figure 14 : Pourcentage des bactéries lactiques, isolées a partir de lait maternel inoculées
sur milieu de culture MRS, présentant une activité antagoniste vis-à-vis Staphylococcus aureus ATCC 43300.
43
Figure 15 : Pourcentage des bactéries lactiques, isolées a partir de lait maternel inoculées
sur milieu de culture MRS, présentant une activité antagoniste vis-à-vis E. coli ATCC 25922.
Figure 17 : Prévalence de la substance inhibitrice produite par les bactéries lactiques
isolées du lait maternel.
47
Figure 18 : Zones d'inhibitions formées par le surnageant de LbC3 quel que soit le temps
thermique à1 00°C.
48
Figure 19 : L’effet de la température d’incubation sur la production de la bactériocine. 49
Figure 20 : Effet du pH sur l’activité antagoniste de L.brevis (LbC3) vis-à-vis E.coli
ATCC25922.
50
Figure 21 : Cinétique de croissance d’Escherichia coli ATCC25922 en présence et en
absence de surnagent de L. brevis (LbC3).
51
Figure 22 : Variation de pH des souches isolées faiblement acidifiées. 52
Figure 23 : Variation de pH des souches isolées moyennement acidifiées. 53
Figure 24 : Variation de pH des souches isolées fortement acidifiées. 54
Figure 25 : Recherche d’activité proteolytique des bactéries lactiques isolées
sélectionnés antagonistes sur milieu PCA.
54
Figure 26 : Teste d’activité lipolytique des bactéries lactiques isolées séléctionnées
antagonistes.
56
Figure 27 : Quelques résultats du test de l’étude de la sensibilité des souches isolées
sélectionnés antagonistesaux antibiotiques.
56
Figure 28 : Pourcentage de la résistance de chaque souche isolée sélectionné antagoniste
vis à vis les dix antibiotiques.
58
Figure 29 : Comportement des souches isolées sélectionnés antagoniste vis-à-vis de
chaque antibiotique testé.
59
Figure 30 : Cinétique de croissance par les souches sélectionnés antagonistes A : LbC3 ;
B : LbL4.
60
Figure 31 : Cinétique de croissance par les souches sélectionnés antagonistes C :
LbL15 ; D :LbL11.
60
Figure 32 : Electrophorèse sur gel d’Agarose à 1.2% : d’un fragment de 1500pb amplifié
par les amorces universelles.
61
E Escherichia
En Enterococcus Faecuim
L Lactobacillus
LbC Bactérie lactique du colostrum
LbL Bactérie lactique du lait maternel
Lc Lactococcus
S Staphylococcus
Sp Especes non précise
Ssp Sous espèce
ADN Acide Désoxyribonucléique
ARNr Acide Ribonucléique Ribosomique
ATCC Americain Type Culture Collection
dNTP Desoxynucléotides
DO Densité Optique
EDTA Acide Ethylene Diamine Tetra Acétique
G+C Guanine+Cytosine
GRAS Generally Regarded As Safe
MRS Man Rogosa et sharp
Pb Paire de base
PCR Polymerase Chain Réaction
TBE Tris borate- EDTA
TES Tris EDTA-Saccharose
UFC Unité formant Colonie
1
INTRODUCTION
Les bactéries lactiques ont été, depuis longtemps, un outil de conservation et de transformation des aliments, en dépit de l’ignorance de ces potentiels technologiques. Elles étaient présentes dans de nombreux écosystèmes microbiens, car elles ont la particularité de prédominer dans des environnements assez riches tels que le lait et ces dérivés, les végétaux et dans les cavités humaines et les cavités animales.
Les aliments constituent un environnement, dans lequel plusieurs bactéries peuvent cohabiter. Certains de ces microorganismes provoquent seulement des altérations des produits alimentaires alors que d’autres, comme listeria, causent des maladies aux consommateurs. D’où l’importance de les éliminer. Les antibiotiques présentent depuis quelques décennies un excellent moyen pour faire barrage à tous ces microorganismes nocifs. Cependant, ils présentent le grand danger de l’apparition de multirésistances chez ces derniers (Benmouna, 2012).
La présence des bactéries lactiques dans différents écosystèmes, peut assurer, d’une part, le bon déroulement des étapes de production d’un aliment fermenté, ses qualités organoleptiques, et d’autres part, sa conservation naturelle (ou bioconservation), en réduisant ou éliminant l’addition des conservateurs chimiques et en les remplaçant par d’autres qui sont naturels (O’Sulvan, 2003).
La bioconservation des aliments, est due aux pouvoirs antagonistes des bactéries lactiques. En effet, elles ont la particularité de synthétiser des substances inhibitrices, principalement les acides organiques (acide lactique et acide acétique), le peroxyde d’hydrogéne (H2O2) et les bactériocines. Ces dernières ont fait l’objet de nombreuses études
(Deegan et al., 2006).
Ces dernières années, l’intérêt de l’emploi de la bactériocine et ou tout autre bactéries lactiques productrices de substances inhibitrices pour des applications de bio-conservation a suscité beaucoup de recherches (Schillinger et Lucke, 1989 ; Budde et al., 2003 ; Jacobsen
et al., 2003 ; Vermeiren et al., 2004 ; Guessas, 2007).
A notre connaissance, les bactéries lactiques trouvées dans le lait maternel restent peut décrite dans la littérature (jara et al., 2011); à cet effet, elles peuvent constituer une niche écologique riche et importante pour le criblage des souches lactiques productrice de bactériocine avec de nouvelles propriétés technologiques. Parmi les principales caractéristiques souhaitées pour l’utilisation industrielle d’une souche dans la bioconservation sa capacité de produire des substances inhibitrices. Cependant d’autres propriétés peuvent affecter les critères technologiques ou présenter des risques pour les consommateurs tels l’antibiorésistance (Guiraud et Rosec, 2004). C’est pourquoi le critère « antibiorésistance » est l’un des critères d’évaluation de l’innocuité des souches d’intérêt technologique utilisées comme ferment.
2 Les objectifs tracés pour la réalisation de ce présent travail sont :
L’isolement d’une large gamme de souches de bactéries lactiques productrice de bactériocines à partir du lait maternel de la région ouest Algérien.
La mise en évidence de l’activité antagoniste des souches de bactéries lactiques vis -à- vis de certain souche pathogène.
L’optimisation de certain facteurs tels que le pH, la température d’incubation impliquées dans la production de la bactériocine.
L’identification des souches isolées sélectionnés antagoniste par l’utilisation de la galerie Api 50CH et l’amplification du fragment d’ADN codant la région conservée de ARN 16S.
Evaluation de l’antibiorésistance des souches sélectionnées antagonistes.
3
1 Lait maternel 1.1 Généralité
Le lait maternel est produit par les cellules sécrétrices des glandes mammaires des mammifères. Il est riche en protéine et en glucides (Vilain, 2010). Il agit comme un moyen de transport de nombreuses substances essentielles de la mère à l'enfant. Chez l’être humain, C'est une émulsion complexe qui fournitures non seulement les nutriments et l'énergie nécessaires pour les facteurs de croissance et de développement de l'enfant, mais aussi qui aident à la protection microbiologique, en réglementant le mécanismes de défense, et accélérer la maturation postnatale du système digestif (Jara et al., 2011).
1.2 La composition du lait maternel
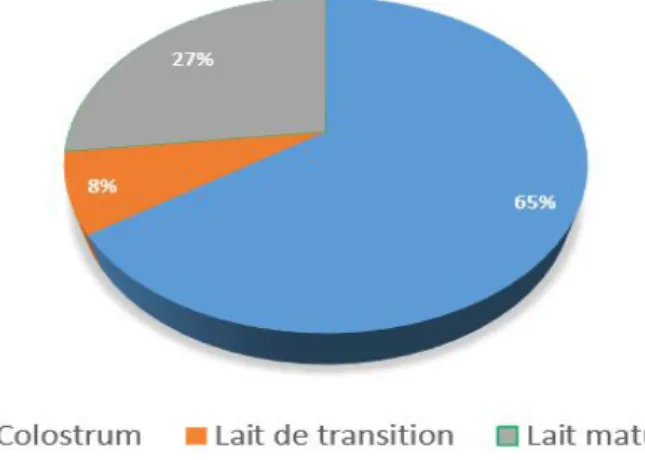
La composition du lait maternel varie selon le nombre de jours post-partum, le moment de la journée, la phase de la tétée et l’état nutritionnel de la mère. Des variations interindividuelles sont également enregistrées. Les trois types de lait que l’on retrouve en post-partum sont le colostrum (1 à 7 jours), le lait de transition (7 à 13 jours) et le lait mature (14 jours et plus) (Lawrence et Lawrence, 1999).
Tableau 1 : Composition moyenne du colostrum (en g pour 100ml) (Rotten, 1991).
Le Tableau 1 présente les variations dans la composition du lait (colostrum) durant les trois jours du post partum relativement à la concentration en glucides, en lipides et en protéines ; en fonction du nombre de jours post-partum. Pendant les premiers jours de vie de l’enfant, le lait maternel (colostrum) est en moyenne plus enrichie en protéines, plus faible en lipides et plus glucidique que les autres types de lait (lait de transition, lait mature).
Dans les jours qui suivent, la concentration en protéines diminue progressivement alors que la concentration en lipide et en lactose augmente graduellement. Le volume de lait excrété de même que la concentration en lipides peuvent varier d’un sein à l’autre et d’un moment de la journée à l’autre).
Parmi les autres facteurs associés aux changements dans la teneur en lipides totaux du lait humain, on retrouve : l’âge gestationnel de l’enfant à la naissance, la diète, les infections et les désordres métaboliques, la parité, l’adiposité maternelle, le stade de la tétée et le sevrage La composition du lait est corrélée à la quantité de lait consommée par l’enfant et de la régularité des tétées (Lawrence et Lawrence, 1999).
Durée Eau Glucide Protéine Lipide Sels minéraux
J1 84,5 2,8 9,8 2,6 0,4
J2 86,5 3,5 7,5 2,2 0,4
4 La composition du lait maternel varie au cours de la période totale d’allaitement, du colostrum au lait mature.
Tableau 2 : Composition moyenne du lait maternel (%).
1.2.1 Les protéines
La teneur en protéines du lait de femme, comprise entre 0.8 et 1.2 gr pour 100ml, est nettement inférieure à celle des autres mammifères. Néanmoins, elle est parfaitement adaptée aux besoins du nourrisson en raison d'une excellente absorption et d'une parfaite adéquation du profil de ses acides aminés. Les protéines sont constituées essentiellement par les caséines et les protéines solubles. (Hamosh, 2000).
1.2.2 Les caséines
Elles sont présentes à un faible taux dans le lait maternel (40%, contre 80 % pour le lait de vache), de ce fait la coagulation du lait de femme est plus fine, ce qui permet une vidange gastrique plus rapide.
La dégradation des caséines libère des peptides à activité biologique (type opioïde ou anti-infectieuse) ou encore des fractions glycopeptidiques stimulant la croissance des bifidobactéries dans le tube digestif du nourrisson (Ricour et al., 1993).
1.2.3 Les protéines solubles
Ce sont les protéines qui ne précipitent pas avec les caséines, elles se composent essentiellement :
o Des immunoglobulines et des lysozymes, intervenants majoritairement dans les défenses immunitaires du nourrisson.
o De la lactotransferrine, qui est une protéine de transport spécifique pour le fer, pour lequel elle possède une très forte avidité. Ainsi le fer maternel présent à un taux plus faible que dans les préparations industrielles est grâce à cette protéine, capté de manière optimale par le nourrisson. La lactotransferrine, chélatant le fer indispensable a l’expréssion de la virulence des souches pathogenes (Jia et al.,
2001). 1.2.4 Les lipides
La teneur en lipides du lait maternel est proche du lait de vache (3.5gr pour 100 ml). La supériorité du lait maternel réside encore dans une meilleure adaptation pour le nourrisson.
Le coefficient d'absorption des lipides issus du lait maternel dans le tube digestif du nourrisson est de 80 % les 1ers jours contre 60 % avec le lait de vache et, à 3 mois il est de
Eau Glucide Protéine Lipide Na K Cl Ca
Lait
5 95 % contre 80 % avec le lait de vache. Ceci est dû à la présence d'une lipase spécifique aux capacités physiologiques du nourrisson. Elle est mise en activité par interaction avec les sels biliaires du tube digestif du nouveau-né et elle est spécifique à la structure des triglycérides du lait maternel.
Le lait maternel apporte par ailleurs des acides gras essentiels intervenant dans la maturation cérébrale et rétinienne du nouveau-né, ainsi que du cholestérol intervenant dans la structure des membranes et comme précurseur hormonal notamment (Owen et al., 2002).
1.2.5 Les glucides
Le lait de femme est plus riche en glucides que le lait de vache (7.5gr contre 4.5gr pour 100 ml). Alors que le lait de vache ne comporte que du lactose, chez celui de la femme 15 % des glucides sont des oligosaccharides. Ces derniers sont formés de cinq sucres élémentaires (glucose, galactose, N-acétylglucosamine,fucose, acide sialique), de structure ramifiée, ils sont au nombres de plus de 130 (Gnoth et al., 2000).
Ces sucres ont démontré leur rôle dans la mise en place de l’écosystème bactérien colique et dans la protection des infections digestives et extra digestives en intervenant sur le système immunitaire (Kunz et al., 2000).
1.2.6 Azote et sels minéraux
Le lait maternel a une teneur faible en azote et en sels minéraux par rapport au lait de vache ce qui permet une moindre charge osmolaire rénale (80 mg par litre contre 230 mg dans le lait de vache ou 170mg dans une préparation pour nourrisson). En découle une meilleure adaptation en cas de pertes hydriques excessives chez le nourrisson, comme c'est là en cas de fièvre ou de diarrhées. (Benhammadi, 2009).
1.3 Microbiote du lait maternel
Le lait maternel demeure spécial par sa richesse par plusieurs groupes bactériens (103 -105 ufc/ml) prédominés par les Staphylococcus, les Streptococcus, les Micrococcus, les
Lactobacillus, les Enterococcus, les Lactococcus et les Bifidobacterium. Son apport favorise la prédominance de bifidobactéries et de lactobacilles dans la flore intestinale de l’enfant
(Jara et al., 2011) et des groupe des bactéries lactiques. L’origine de ces bactéries est
probiotiques (Perez et al., 2007).
Les espèces les plus souvent isolées dans le lait maternel sont Staph. epidermidis, Staph. aureus, Strep. mitis, Strep. salivarius, L.salivarius, L. fermentum, L. gasseri, L. rhamnosus, B. breve et B. bifidum. Des études récentes sont parvenues à mettre en lumière jusqu’à 700 espèces différentes de bactéries. (Cabrera et al., 2012).
Tout ne peut pas se résumer à cela, il existe aussi des différences considérables entre la composition du microbiote de la peau et celle du lait maternel « Dans les échantillons de lait de la mère, nous avons trouvé des espèces de bactéries qui ne sont pas présentes sur le sein de la mère (Fernández, 2013). De plus, les bifidobactéries qui font partie du microbiote du lait sont anaérobies. Ce facteur, à lui seul, fait de la peau ou de la bouche un environnement
6 peu favorable pour ce type de bactéries. Ces découvertes désignent plutôt les intestins maternels comme la source d'au moins certaines bactéries du lait maternel.
Le mécanisme exact par lequel les bactéries traversent l’épithélium intestinal, contournent le système immunitaire pour atteindre les glandes mammaires, reste encore mal défini à ce jour (Martin, 2004).
Le lait maternel contient plusieurs types de bactéries qui peuvent être considérées comme des probiotiques, ce qui signifie que ces bactéries exercent des effets infectieux, anti-inflammatoires et métaboliques sur le bébé. Des chercheurs ont porté une attention particulière sur l'asthme et la dermatite atopique. Les bactéries du lait maternel pourraient améliorer voire même empêcher ces troubles. « Ce qui rend ces microbes particulièrement attirants comparés aux autres bactéries, c'est qu'ils sont d'origine humaine et qu'ils sont bien tolérés même par des organismes particulièrement sensibles comme ceux des bébés. Les bactéries du lait maternel sont adaptées de manière unique pour résider dans les intestins humains et pour avec une interaction avec nous dès notre naissance, et d'autres scientifiques s’intéressent à une autre maladie, la mastite. Ce trouble affecte jusqu'à un tiers des mères qui allaitent. Il est souvent résistant à une thérapie par antibiotiques et constitue la raison principale pour laquelle les mères arrêtent d'allaiter.
Certaines souches bactériennes du lait maternel (des lactobacilles comme L.salivarius, L. gasseri et L. fermentum) peuvent agir comme des probiotiques pour la mastite. Les études ont montré que les troubles des femmes qui ont ingéré ces bactéries pendant une période d'au moins trois semaines se sont beaucoup améliorés, Les bactéries probiotiques ingérées colonisent la glande mammaire par le chemin entéro-mammaire et une fois qu'elles ont atteint leur destination, elles réduisent les bactéries causant la mastite (staphylococci et streptococci) (Jiménez et al., 2013).
1.4 Les bactéries lactiques 1.4.1 Définition
Le groupe des bactéries lactiques défini pour la 1ère fois par Orla Jensen (1919), présente
un groupe hétérogène de microorganismes produisant de l’acide lactique comme produit principal du métabolisme. Elles colonisent de nombreux produits alimentaires comme les produits laitiers, les viandes, les végétaux et les céréales et font parties de la flore gastro- intestinale et vaginale humaine ou animale. Elles sont impliquées dans un grand nombre de fermentations spontanées de produits alimentaires (Pfeiler et Klaenhammer, 2007). Les bactéries lactiques sont bien tolérées par les animaux et l'homme ayant le statut GRAS ‘Generally Recognized As Safe’ (Adams., 1988).
1.4.2 Propriété générales
Les bactéries lactiques sont des bactéries a Gram positif, immobiles, asporulées, catalase et oxydase négative, nitrate réductase négative, anaérobies ou aérotolérantes, se présentant sous formes de coques ou de bacilles qui ont moins de 55 mol % du contenu G+ C dans leur
7 ADN (à l'exception de Bifidobacterium). En outre, elles ne liquéfient pas la gélatine, ne produisent pas d'indole, ni d’hydrogène sulfureux (Caplice et Fitzgerald, 1999).
Les bactéries lactiques sont généralement mésophiles ; certaines sont psychrotolérantes ou thermotolérantes elles se développent majoritairement à pH 4,0-4,5 et certaines sont encore actives à pH 9,6 ou pH 3,2. Elles ont des tolérances très variables vis à vis du sel. Enfin, les bactéries lactiques possèdent de faibles activités protéolytiques et lipolytiques et ont une exigence marquée en acide aminés, dérivés de base puriques et pyrimidiques et vitamines B (Caplice et Fitzgerald, 1999).
Toutes les bactéries lactiques ont un métabolisme fermentaire strictement saccharolytique qui, en utilisant les glucides, elles peuvent produire soit de l‘acide lactique exclusivement (bactéries homolactiques strictes), soit de l‘acide lactique et de l‘acide acétique (bactéries hétérolactiques facultatives), soit de l‘acide lactique, de l‘acide acétique ou de l‘éthanol et du CO2 (bactéries hétérolactiques strictes) (Vandamme et al., 1996).
1.4.3 Classification
La systématique est en évolution permanente. Il n'y a jamais eu de règles unanimement reconnue sur la façon dont deux bactéries différentes devraient être phénotypiquement classées. La littérature scientifique suit généralement les recommandations des comités de taxonomie qui opèrent sous les auspices de l'union internationale de sociétés microbiologiques (Sneath, 2001).
La première classification des bactéries lactiques a été établie en 1919 par
Orla- Jensen. Elle est basée sur les caractéristiques observables telles que les propriétés
morphologiques, biochimiques et physiologiques. Les marqueurs chimiotaxonomiques, comme la composition des acides gras et les constituants de la membrane cellulaire, ont été également utilisés pour la classification (Tableau 3).
Les bactéries lactiques appartiennent à la lignée des firmicutes, à la classe des bacilli, et à l'ordre des lactobacilles. D’après Ludwig et al. (2008), les bactéries lactiques sont divisées en trois familles :
Famille des Lactobacillaceae comportant les Lactobacillus, Paralactobacillus et Pediococcus.
Famille des Leuconostocaceae contenant les Leuconostoc, Oenococcus et Weissella. Famille des Streptococcaceae comprenant les Streptococcus, Lactococcus et Lactovum.
8
Tableau 3 : Taxonomie et les clés de différentiation des bactéries lactiques (Holzapfel et al., 2001).
Genre Forme Catalase Réduction nitrate Fermentation Genre types
Betabacteruim bacille - - Hétérofermentaire Lactobacillus
Thermobacterium bacille - - Homofermentaire Lactobacillus
Streptobacteruim bacille - - hétérofermentaire Homo et Lactobacillus
Carnobacterium
Streptococcus coque - - Homofermentaire
Streptococcus Enterococcus Lactococcus Vagococcus
Betacoccus coque - - Hétérofermetaire
Leuconostoc Oenococcus
Weissell
Micobacteruim bacille + + Homofermentaire Brochothrix
Tetracoccus coque +1 + homofermentaire Pediococcu
Tetragenococcus
La classification actuelle des bactéries lactiques fait apparaitre douze genres : Aerococcus, Carnobacteruim, Enterococcus, Lactococcus, Lactobacillus, Leuconostoc, Pediococcus, Oenococcus, Streptococcus, Tetragenococcus, Vagococcus, Weissella. (Stiles
et Holzapfel, 1997).
Sur la base des données de séquençage de 16S et 23S de l‘ADNr, les bactéries Gram positives forment deux embranchements. Un embranchement composé de bactéries Gram positives avec un pourcentage G + C inférieur à 50% (Clostridium) et un autre formé de bactéries ayant une teneur en G + C supérieure à 50% (Actinomycétes) (Holzapfel et al.,
2001 et Gevers, 2002). Les bactéries lactiques typiques ont une teneur en G + C inférieure
à 50% alors que le genre Bifidobacterium qui, d'un point de vue physiologique, fait partie des bactéries lactiques, appartient à la branche des Actinomycètes qui comprend aussi Propionibacterium et Brevibacterium (Vandamme et al., 1996) (Figure 1).
1 sont généralement catalase négative mais quelque souches produisent une pseudo-catalase qui résulte des
9
Figure 1 : Arbre phylogénétique des bactéries lactiques (Holzapfel et al., 2001).
La barre indique une divergence de séquence estimée de 10%. Les bactéries à base G+C (en haut) sont phylogénétiquement éloignées des bactéries à haut G+C sqs(en bas). Sont soulignés en rouge les genres pour lesquels la séquence d’au moins un génome est disponible, en vert ceux pour lesquels au moins un génome est en cours de séquençage.
1.4.4 Principaux genres des bactéries lactiques 1.4.4.1 Lactobacillus
Les lactobacilles sont des bactéries à Gram positif, microaérophiles se trouvant couramment dans une grande diversité environnementale, y compris les environnements laitiers riches en éléments nutritifs, les habitats microbiennes d’hôtes tels que les muqueuses humaines, ainsi que les niches écologiques naturels tels que les plantes et le sol. Le genre Lactobacillus appartient au phylum Firmicutes, la classe des Bacilli, et l’ordre des Lactobacillales (Barrangou et al., 2012).
La multiplicité des niches écologiques de lactobacilles se refléte dans la diversité et phylogénie hétérogène du genre. Le genre comprend plus de cent espèces différentes, parmi d’autres beaucoup d’entre eux sont caractérisé biologiquement, technologiquement et commercialement tels que : L. acidophilus, L. casei, L delbruekii susp. Bulgaricus, L. plantrum, L. rhamnosus et L.sarivaruis (Kleerebezem et Vaughan, 2009).
10 Les lactobacilles forment une partie de la microflore naturelle des animaux hôtes et occupent diverses niches à l’intérieur de l’hôte, tels que le tractus gastro-intestinale, le tractus urogénitale, la cavité buccale, et de la peau. Les lactobacilles sont présents dans les produits laitiers et sont particulièrement abondants dans les produits laitiers fermentés. En outre, les lactobacilles sont naturellement présents dans les plantes et le sol. L. plantarum a été signalée à être naturellement dominante survenant espèces bactériennes dans les légumes comme le chou et la laitue (Yang et al., 2010). Sa température optimale de croissance est le plus souvent comprise entre 30 et 40°C. L’écart de pH pour la croissance se situe entre 3 et 8. En générale, elles tolèrent l’oxygène mais se développent bien dans des conditions anaérobies. Elles produisent de l’acide lactique en tant que principale produit de fermentation à partir de sucre.
Les lactobacilles ont des propriétés assez importantes, commençant par l’activité protéolytique pour couvrir ces besoins de croissance. Les systèmes protéolytiques contribuent aux changement biochimiques se produisant au cours de la maturation des divers produits alimentaires laitiers et non laitiers fermentés, conduisant à la production de peptides bioactifs avec des effets immunologiques et sur la santé (Matar et al., 2001). Ils sont également responsables des propriétés organoleptiques des produits finis. Les propriétés fonctionnelles (corps, texture, fondre et extensibles). L’activité protéolytique des souches de L.plantarum peut avoir un rôle dans la préservation de la formation de toxine de Clostridium botulinum dans aliments réfrigérés (Skinner et al.,1999). La lipolyse aussi est éventuellement essentielle dans l’affinage du fromage, des acides gras libres sont en outre convertis en cétones méthyliques, des lactones, des thioesters… etc., contribuent, en plus des acides gras libres, de flaveur du produit fini. Les lipases / estérases des bactéries lactiques semblent être exclusivement intracellulaires (Castillo et al., 1999 ; Chich et al., 1997), avec l’activité remarquable la plus élevée chez L. delberckii subsplactis et L. acidophilus
(El-Soda et al., 1986). Il se trouve qu’un large éventail de souches de Lactobacillus est
couramment utilisé comme probiotiques en raison de leur fonction favorables à la santé inhérentes ont été proposées (Barrangou et al., 2012).
1.4.4.2 Lactococcus
Le genre Lactococcus comprent sept espéces (Batt, 2000). Morphologiquement les lactoquoques sont des coques à Gram positif de 0,5-1,5 µm, formant des chaines courtes. Elles sont mésophiles, capables de fermenter les hexoses par voie homofermentaire, produisant de l’acide lactique L (+), et ont des exigences complexes pour sa croissance
(Kim, 2014 ; Wright, 2012).
Les Lactocoques ont été isolés à partir des végétaux (Cai et al., 2010 ; Carr et al 2002), du lait, ou à partir d’autre sources animales, y compris l’intestin humain (Kubota et al.,
2010).
La bactériocine découverte en 1927, nommée «Nisine» produite par Lc. Lactis est utilisée de Facon courante comme additif alimentaire (E234) pour la conservation de certain aliment, dont celle de la viande. Elle est par ailleurs la seul bactériocine pouvant légalement être utilisée comme agent de conservation.
11
1.4.4.3 Enterococcus
Les entérocoques sont des cocci ovoïdes à Gram positif se présentant isolées, en paires, en chaines courtes ou elles peuvent être disposées en groupes en particulier si la morphologie des cellules est étudiée à partir des cultures cultivées sur un support solide. Les cellules sont souvent allongées dans la direction de la chaine.
Les entérocoques peuvent jouer un rôle bénéfique dans la maturation et le développement de l’arôme de certains produits alimentaires traditionnellement fermentés tels que les fromages et la charcuterie. Elles sont également utilisés comme probiotiques humains, pour traiter les maladies diarrhéiques causées par des pathogènes d’origine alimentaire (Svec et
Franz, 2014).
1.4.4.4 Pediococcus
Les pédiocoques sont des bactéries à Gram positif, oxydase-négatives et catalase négative. Elles sont immobiles, se révèlent autant que cellules sphériques d’une taille uniforme et se disposent comme tétrades par autre division perpendiculaire en deux directions (Gunther et Blanc, 1961).
Les espèces P. acidilactici, P. pentosaceus, P. parvulus et P. inopinatus sont des cultures starters importants dans la production de plusieurs produits à travers le monde (Franz et al.,
2014). P. pentasaceus peut jouer un rôle dans la fermentation et la maturation du fromage (Callon et al., 2004). Un certain nombre de bactériocines (pediocines) a été décrit pour P.
acidilactici, P. pentosaceus (Todorov et Dichs, 2005).
1.4.4.5 Streptococcus
Les membres du genre Streptococcus sont Gram positif, catalase négative, anaérobie facultatif ont la forme sphérique ou ovoïde, moins de 2µm de diamètre et un faible contenu en G +C. Les streptocoques ne sont pas mobiles et ne forment pas de spores. La température optimale de croissance est habituellement d’environ 37°C, mais des températures de croissance minimale et maximale peuvent varier entre les espèces. Beaucoup d’entre elles sont commensales de l’homme et les animaux, et certaines sont hautement pathogènes
(Whiley et Hardie, 2009). 1.4.4.6 Bifidobacterium
Les bifidobactéries sont des bacilles à gram positif, non mobiles, ne produisent pas du gaz et ne forme pas de spores. Elles sont des anaérobies mais quelques espèces tolérant l’O2
dans la présence ou non du CO2. Ces dernières sont dépourvues de la catalase, le contenu en
G +C est de 61% (Mattarelli et Biavati, 2014).
Les bifodobactéries sont des bactéries commensales de l’homme, elles sont également retrouvées chez les animaux (Biavati et al., 2000). Les conditions optimales de croissance des bifidobactéries d’origines humaine se situent à des températures comprises entre 37°C et 41°C, et des valeurs de pH entre 6,5 et 7 (Hadadji, 2007). A l’heure actuelle les
12 bifidobactéries sont les fameuses bactéries utilisées autant que probiotiques, à travers divers produits comme par exemple : les laits fermentés, des fromages….etc.
1.5 Effet probiotiques et propriétés antimicrobiennes des bactéries lactiques
Les probiotiques ont été définis comme des organismes vivants qui, après ingestion en certaines qualités, exercent des effets bénéfiques pour la santé (Crittenden et al., 2005) ; allant au-delà des vertus nutritives inhérentes de base (Schaafma, 1996). Ils doivent remplir les conditions suivantes : être non pathogène et non toxiques bien entendu, exercer un « effet bénéfique » sur l’hôte, contenir un nombre élevé de cellules viables, posséder une survie élevée dans le tractus gastro-intestinal, exercer un effet métabolique pendant le transit intestinal, rester viable pendant le stockage et l’utilisation, en fin avoir de bonnes propriétés gustatives (Tamime et al., 1995). Les propriétés antimicrobiennes des bactéries lactiques peuvent être associées à de nombreux éléments. Elles résultent de l'effet combiné de différents facteurs biologiques provenant de leurs activités métaboliques.
Selon Ishibashi et Yamazaki (2001), les bactéries lactiques sont de plus en plus utilisées en alimentation humaine et animale pour leurs effets probiotiques. Parmi ces effets on peut citer :
Les bactéries lactiques exercent un effet inhibiteur sur le développement et la synthèse de toxines par autres microorganismes pathogènes ;
Les bactéries lactiques possèdent des propriétés antitumorales qui pourraient être due à l’inactivation ou l’inhibition des composés carcinogènes dans le tractus gastro-intestinal ; la réduction des activités enzymatiques des bactéries intestinales telle que la β-glucuronidase, l’azoréductase et la nitroréductase ;
La prévention et traitement des diarrhées dues aux infections gastro-intestinales.
Les probiotiques sont encore impliqué dans la réduction du cholestérol (Saavedra, 2001). En effet, les bactéries lactiques produisent de nombreux métabolites aux propriétés antimicrobiennes classé en deux catégories : composée a petite masse moléculaire (LMM= low molécular compound) tels que les acides organiques, le peroxyde d'hydrogène, diacétyl, le dioxyde de carbone, et des composées a grand masse moléculaire (HMM : high masse molécular compound) tel que les bactériocines (ammor et al., 2006).
1.5.1 Les acides organiques
Les acides organiques sont produits par les bactéries lactiques au cours de processus de fermentation alimentaires. Leur effets antimicrobiens sont bien connus à l’heure actuelle
(Tou et al., 2006). Ces acides, sous leur forme dissociée ou non dissocié, agissent au niveau
de la membrane et en inhibant les systèmes membranaires de transport actif (Annan Prah
et Agyeman, 1997). L’activité antimicrobienne d’un acide organique dépend de sa nature
(acide fort, acide faible). L’acide acétique, par exemple, est plus inhibiteur que l’acide lactique ; il inhibe les levures, les moisissures et les bactéries (Blom et Mortvedt, 1991).
13
1.5.2 Le peroxyde d’hydrogène
Les bactéries lactiques sont dépourvues de catalases catalysant la décomposition du peroxyde d'hydrogène (H2O2) en eau et en oxygène (Condon, 1987). Le peroxyde d’oxygène
peut s’accumuler et être inhibiteur de différents microorganismes par l’oxydation des lipides membranaires et la destruction des structures des protéines cellulaires (Zalan et al., 2005).
1.5.3 Le dioxyde de carbone
Les bactéries lactiques hétérofermentaire synthétisent du dioxyde de carbone (CO2)
Comme métabolite secondaire. Son accumulation dans le milieu extérieur crée une anaérobiose qui peut être toxique pour les microorganismes aérobies présents dans l’aliment. Toutefois, le dioxyde de carbones peut aussi, à faible concentration, stimuler la croissance de certaines bactéries (Dobrogosz, 1990).
1.5.4 Le diacétyl
Le diacétyl est un produit du métabolisme du citrate qui est responsable de l’arôme « beure » des produits laitiers. Le diacétyl a des propriétés antimicrobiennes qui sont dirigées contre les levures, les bactéries Gram-négatif et les bactéries Gram-positif non lactiques, ces dernières y sont néanmoins moins sensibles (El Ziney et al., 1998).
1.5.5 La reutérine
La reutérine (ou 3-hydroxypropionaldehyde) est une substance antimicrobienne qui est produite comme métabolite intermédiaire pendant la fermentation anaérobie du glycérol par certaines espèces de Lactobacillus ainsi que par d’autres genres bactériens non lactiques tels que Bacillus, Klebsiella, Citrobacter, Enterobacter et Clostridium (El-Ziney et al., 1998). Elle a un large spectre d’activité. Elle a une action contre les bactéries (Gram-positif ou Gram-négatif), les champignons et les protozoaires. Elle interfère avec la réplication de l’ADN. Elle a des applications aussi bien dans le domaine médical que dans le domaine alimentaire (Vollenweider, 2000).
1.5.6 Les bactériocines
Certains ferments sont capables de produire des bactériocines ; ces molécules sont particulièrement intéressantes pour l’élaboration de produits à partir de lait cru donc susceptibles de contenir des micro-organismes indésirables voire pathogènes (Cintas et al.,
2001). Les consommateurs sont directement concernés par la présence d’additifs chimiques
dans leurs aliments. En conséquence, ils sont attirés par des produits alimentaires frais et sans ajout d’agents de conservation chimiques. Les bactériocines produites par les bactéries lactiques, peuvent être considéré comme des conservateurs naturels ou biopréservateurs qui accomplissent ces exigences. La conservation bio fait référence à l’usage de microorganismes antagonistes ou leurs produits métaboliques inhibent ou détruisent des microorganismes indésirables dans les aliments, afin d’augmenter la sécurité alimentaire et prolonger la durée de vie de conservation (Schillinger et al., 1996).
14
1.6 Bactériocines des bactéries lactiques 1.6.1 Historique et définition
En 1925, Gratia appelait «colicines", des substances antimicrobiennes sécrétées par E. coli et actives contre E. coli V. En 1928, Rogers a rapporté pour la première fois une substance antimicrobienne produite par Lactococcus lactis ssp. lactis autre que les acides organiques et le peroxyde d'hydrogène. Cette substance a été identifiée plus tard par Hirsch
(1951), qui a démontré sa nature protéique et l'a nommée "nisine". En 1953, Jacob et ces
collaborateurs proposèrent le terme plus général de ‹‹ bactériocine ›› à ces substances. Différentes définitions des bactériocines a été données au cour du temps La définition qui reste la plus largement acceptée est celle de (Klaenhammer, 1988) qui définit les bactériocines comme des protéines, ou complexes de protéines, avec une activité bactéricide contre des espèces proches de la souche productrice.
Les bactériocines sont des peptides extracellulaires, thermostables, synthétisés par voie ribosomique doués d’une activité bactéricide ou bactériostatique contre les espèces proches (spectre étroit) ou d’autre genres (spectre large) et à laquelle la cellule productrice dispose d’un mécanisme d’immunité spécifique (Cotter et al., 2005).
1.6.2 Classification
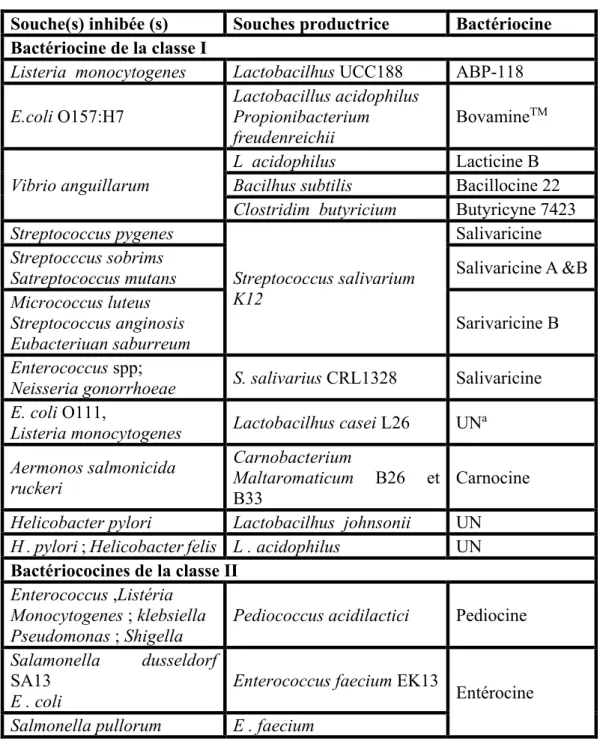
Les bactériocines produites par les bactéries lactiques sont réparties en quatre classes, comme proposé par (Klaenhammer, 1993). Nous donnons en Tableau 4 la classification proposée par (Papagianni ,2003).
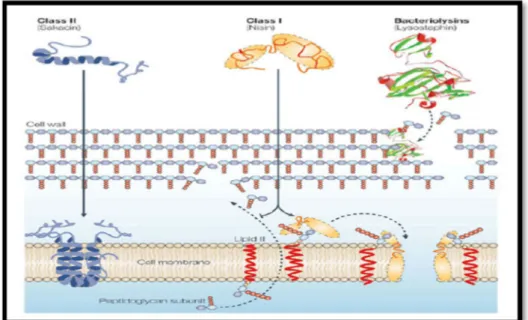
1.6.2.1 Classe I : les lantibiotiques
Les lantibiotiques sont des peptides de taille inférieure à 5 kDa, stables à la chaleur et qui contiennent des acides aminés inhabituels soufrés formés post-traductionnellement, comme la lanthionine, la β-méthyl lanthionine, la déhydrobutyrine et la déhydroalanine. Les lantibiotiques peuvent être divisés en deux type ; sous classe Ia : qui comprend des peptides cationiques hydrophobes allongés contenant jusqu'à 34 acides aminés ; sous classe Ib : qui comprend les peptides globulaires chargés négativement ou sans charge nette et contenant jusqu'à 19 acides aminés (McAuliffe et al., 2001).
15
Tableau 4 : Classification des bactériocines (Papagianni, 2003).
1.6.2.2 Classe II : non-lantibiotiques
Ce sont des peptides de taille inférieure à 10 kDa, stables à la chaleur, ne contenant pas d'acides aminés modifiés. Leur point isolélectrique varie entre 8 et 10. Cette dernière est subdivisée en trois sous-classes ; sous-classe IIa Ces bactériocines contiennent entre 27 et 48 acides aminés et ont toutes une partie N-terminale hydrophobe contenant la séquence consensus YGNGV ainsi qu'un pont disulfure et une partie C-terminale moins conservée, hydrophobe ou amphiphile qui détermine la spécificité d'action. Elles ont toutes une activité contre Listeria monocytogenes. Certaines bactériocines de cette sous-classe contiennent également un deuxième pont disulfure dans leur domaine C-terminale qui semble être important dans la stabilisation de la structure tertiaire. Il semble par ailleurs qu'il leur conférerait une meilleure activité antimicrobienne, une meilleure résistance à l'exposition à des hautes températures et un spectre d'action plus large (Richard et al., 2006); sous-classe
IIb: Elle comprend les bactériocines ayant besoin de deux peptides pour avoir une activité.
Deux types de bactériocines de classe IIb peuvent être distingués : le type E (Enhancing) où la fonction d'un des deux peptides est d'augmenter l'activité de l'autre et le type S
Classe Caractéristiques
Classe I
Lantibiotique
Peptides ribosomiquement synthétisés, post traductionnellement modifies contiennes des acides aminées inhabituels : lanthionines et β-méthyle lanthionine.
Masse moléculaire : 2-5KDa
Sous classe A: molécules allongées , flexibles. Sous classe B :molecules globulaires sans charge nette ou chargées negative.
Classe II
Non lantibiotique
Peptide stable à la chaleur, formés exclusivement avec des acides aminés non modifies.
Synthétisés sous forme d’un pré peptide inactive clivé a la partie N-terminale pour donnés la forme active.
Masse moléculaire :<10KDa.
Sous classe IIa : pediocine like peptide, peptide simple contient la séquence YGNGVN terminal nommé aussi (Listeria active peptide).
Sous classe IIb : bactériocines a deux peptides. Sous classe IIc : autre bactériocines.
Classe III
Bactériolysines
Protéines thermolabiles Masse moléculaire > 30KDa