HAL Id: dumas-01906347
https://dumas.ccsd.cnrs.fr/dumas-01906347
Submitted on 26 Oct 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Prescription de neuroleptiques dans les troubles du
comportement du sujet dément : évaluation des
pratiques professionnelles en institution
Barbara Boyaux
To cite this version:
Barbara Boyaux. Prescription de neuroleptiques dans les troubles du comportement du sujet dément : évaluation des pratiques professionnelles en institution. Sciences pharmaceutiques. 2018. �dumas-01906347�
HAL Id: dumas-01906347
https://dumas.ccsd.cnrs.fr/dumas-01906347
Submitted on 26 Oct 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Prescription de neuroleptiques dans les troubles du
comportement du sujet dément : évaluation des
pratiques professionnelles en institution
Barbara Boyaux
To cite this version:
Barbara Boyaux. Prescription de neuroleptiques dans les troubles du comportement du sujet dément : évaluation des pratiques professionnelles en institution. Sciences pharmaceutiques. 2018. <dumas-01906347>
Université de Bordeaux
U.F.R. DES SCIENCES PHARMACEUTIQUES
Année 2018 N° 85
MEMOIRE du DIPLOME D’ETUDES SPECIALISEES de
PHARMACIE HOSPITALIERE
Tenant lieu de Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN PHARMACIE
Présentée et soutenue publiquementPar Barbara BOYAUX Née le 26 Août 1991 à Saint-Lô
Le 14 septembre 2018 à Bordeaux
PRESCRIPTION DE NEUROLEPTIQUES DANS LES TROUBLES DU
COMPORTEMENT DU SUJET DEMENT : EVALUATION DES PRATIQUES
PROFESSIONNELLES EN INSTITUTION
Directeur de thèse
Dr Laurent FARAGGI
Jury
Dr Marie-Claude SAUX Professeur émérite, Université de Bordeaux Président Dr Laurent FARAGGI Pharmacien PH, CSMR de Podensac Directeur Dr Philippe CESTAC Pharmacien MCU-PH, CHU de Toulouse Juge Dr Amina CHIALI Médecin Gériatre PH, CSMR de Podensac Juge Dr Gildas LEPORT Médecin généraliste, CSMR de Podensac Juge M. Laurent OULES Ingénieur qualité, CSMR de Podensac Juge
2
REMERCIEMENTS
A mon président du Jury,
Madame le Docteur Marie-Claude SAUX
Professeur émérite de l’université de Bordeaux, Pharmacie.
Pour l’honneur que vous me faites de présider cette thèse.
Veuillez trouver ici l’expression de mon respect et de ma sincère reconnaissance.
A mon directeur de Thèse,
Monsieur le Docteur Laurent FARAGGI,
Pharmacien Praticien Hospitalier, Centre de Soins – Maison de Retraite de Podensac.
Pour avoir accepté de diriger et de juger cette thèse. Merci pour cette année enrichissante au CSMR et pour m’avoir permis de mener à bien ce projet.
Aux membres du Jury :
Monsieur le Docteur Philippe CESTAC,
Maître de Conférences Universitaire – Praticien Hospitalier, CHU de Toulouse.
Pour l’honneur que vous me faites de juger cette thèse. Mais aussi pour vos enseignements dans le cadre du DU «Optimisation de la prise en charge médicamenteuse du patient âgé» qui ont participé à me faire aimer la gériatrie. Veuillez trouver ici mes sincères remerciements.
Madame le Docteur Amina CHIALI
Médecin Gériatre, Centre de Soins – Maison de Retraite de Podensac.
Monsieur le Docteur Gildas LE PORT
Médecin Généraliste, Centre de Soins – Maison de Retraite de Podensac.
Monsieur Laurent OULES,
Ingénieur qualité, Centre de Soins – Maison de Retraite de Podensac.
Pour l’honneur que vous me faites d’avoir accepté de faire partie du jury de cette thèse. Je vous remercie également pour votre disponibilité et votre gentillesse au cours de nos nombreuses collaborations durant mon stage au sein du CSMR de Podensac. Merci pour votre investissement dans ce projet.
3
A toute l’équipe du CSMR de Podensac pour m’avoir accueillie et permis de réaliser ma thèse. Plus particulièrement, un grand merci à la psychologue Cristina pour nos collaborations. Sans oublier mes préparatrices en pharmacie préférées : Armelle (pour que tu ne m’oublies pas Popine ;)), Emmanuelle (ma Ginette, « ouais c’est ça, ouais ») et Guylaine (« et…voilà ») pour cette super année à vos côtés. Aussi bien professionnellement que personnellement, vous aurez toujours une place particulière dans mon cœur.
A ma Mamounet,
Sans qui je ne serais jamais arrivée là. La femme la plus forte que je connaisse, la meilleure maman que l’on puisse imaginer avoir. Merci pour ton soutien durant toutes ces années d’études, merci pour tout. Je t’aime.
A mon Papounet,
Si comme tu l’as écrit, tu me vois de là-haut, ce travail est aussi pour et grâce à toi. Si tu savais à quel point je t’aime. Tu me manques…
A ma Tata,
Parce que tout a commencé par nos leçons d’école, je n’oublierai jamais ces moments précieux de mon enfance. Ma Tatounet au grand cœur ♥
A mon oncle,
Merci pour ton soutien et ton aide dans les moments difficiles. A Guillaume,
Une rencontre inattendue et salvatrice. A la fois mon meilleur ami et mon âme sœur. Merci pour ton soutien. Je t’aime mon chéri.
A mes amis de toujours,
Cindy, Claire et Mathieu. Parce que c’est la même amitié qui nous lie depuis le bac à sable, parce que c’est rare et précieux, mais ça n’a pas de prix. Je vous adore.
A Laure,
Nos années d’études mémorables, notre grain de folie, Buddha Club, Jojo, Meuhmeuh et Cie… On l’a fait ma Boubou !!
4
A toutes les belles rencontres de mes années d’internat, et plus particulièrement :
A Margaux, ma « co-loque », mon amie… Merci d’avoir toujours été là.
A Marie et Adrien (M. et Mme Claviers !), c’est un vrai bonheur de vous voir évoluer. Déjà hâte de voir les premiers pas de Paul !! Merci de me faire partager votre belle histoire, merci pour votre soutien.
A Marion, pour ces 6 mois de colocation riches en fous rires, nourriture, shopping… Un vrai régal ☺
Aux supers co-internes :
Aux « Distri girls » Bérangère, Emilie et Gabie pour notre tournée des restos bordelais, nos weekends à la mer et bien plus encore ☺
A Thomas pour tous les festins, les pauses Irish, les balades sur le bassin (et ses huîtres !), le réveillon dans les sous-sols du CHU et j’en passe ! (vitamine C… ?)
A Flora pour ces beaux moments que tu m’as fait partager, ta sincérité et ta générosité. Sans oublier ma « sister » Chacha, Aasfa KHAN et Aurélie !
A l’ensemble du personnel des PUI du CHU de Bordeaux, de Charles Perrens et de Libourne, pour avoir fait de ces quatre années une merveilleuse expérience, en particulier :
L’équipe de la PUI du CH Charles Perrens : Emmanuelle, Anne-Laure et Justine, pour tout ce que vous m’avez transmis, un excellent semestre dans une belle équipe.
L’équipe de l’URC de Pellegrin : M. S & Béné, pour un semestre mémorable et riche en fous-rires !
L’équipe du SSR1 de Xavier Arnozan : Dr Foucaud et Dr Jenn, pour nos collaborations médecins/pharmaciens enrichissantes et votre accueil au sein du service. Sans oublier mes supers externes en pharmacie qui ont supporté mes dernières semaines pré-thèse : Alexiane, Célia et Inès.
5
TABLE DES MATIERES
REMERCIEMENTS ... 2
TABLE DES MATIERES ... 5
ABREVIATIONS ... 7
LISTE DES TABLEAUX ... 9
LISTE DES FIGURES... 10
LISTE DES ANNEXES ... 11
INTRODUCTION ... 12
PARTIE 1 : Démence et place des neuroleptiques dans la prise en charge des troubles comportementaux ... 14
I) Démence ... 14
a) Définition ... 14
b) Types de démence1 ... 15
c) Epidémiologie ... 19
d) Conséquences sociales et économiques ... 21
II) Prise en charge des troubles comportementaux chez le sujet dément ... 22
a) Généralités ... 22
b) Prise en charge ... 23
III) Place des neuroleptiques ... 30
a) Pharmacologie ... 30
b) Effets délétères des neuroleptiques ... 36
c) Recommandations de traitement ... 46
PARTIE 2 : EPP Prescription des neuroleptiques chez le sujet dément ... 49
I) Contexte au CSMR de Podensac... 49
a) Présentation de l’établissement... 49
b) Naissance du projet ... 49
II) Objectifs... 50
III) Définition de la méthode et construction des outils d’évaluation ... 51
a) Schéma chronologique de la réalisation de l’EPP ... 51
b) Constitution du groupe de travail et choix de la méthode ... 51
6
d) Elaboration de la grille d’audit ... 52
IV) Mise en œuvre de l’EPP ... 53
a) Premier tour d’audit ... 53
b) Présentation des résultats et mise en place des actions d’amélioration ... 63
c) Deuxième tour d’audit ... 64
d) Réévaluation des traitements « non conformes » suite au premier tour ... 70
PARTIE 3 : Discussion de la mise en œuvre de l’EPP et perspectives ... 71
I) Discussion de la mise en œuvre de l’EPP ... 71
a) Choix de la méthode ... 71
b) Inclusion des patients ... 72
c) Modalités de réalisation de l’EPP ... 73
II) Perspectives ... 74
a) Restitution des résultats du second tour et mise en place d’un indicateur de suivi ... 74
b) Ouverture de l’UHR ... 76
c) Poursuite des actions d’amélioration ... 78
CONCLUSION ... 84
ANNEXES ... 86
BIBLIOGRAPHIE ... 111
7
ABREVIATIONS
Abs. : Absence
AFSSAPS : Agence Française de Sécurité Sanitaire des Produits de Santé AMI : Alerte et Maîtrise de la Iatrogénie
AMM : Autorisation de Mise sur le Marché APA : Activité Physique Adaptée
APA : American Psychiatric Association APP : Protéine Amyloïde
AVC : Accident Vasculaire Cérébral BPRS: Brief Psychiatric Rating Scale
CATIE-AD : Clinical Antipsychotic Trials of Intervention Effectiveness Alzheimer’s disease study
CDS: Centre De Soins
CGIC : Clinical Global Impression of Change ChAT : Choline AcétylTransférase
CHU : Centre Hospitalier Universitaire
CME : Commission Médicale d’Etablissement
COMEDIMS : Comité des MEDicaments et des DIspositifs Médicaux Stériles CPK : Créatine PhosphoKinases
CSMR : Centre de Soins et Maison de Retraite
DCM : Dementia Care Mapping (modélisation des soins de la démence)
EHPAD : Etablissement d’Hébergement pour les Personnes Agées Dépendantes EMA : Agence Européenne des Médicaments
EPP : Evaluation des Pratiques Professionnelles EuroCoDe : European Collaboration on Dementia
Eurodem : European community concerted action on the epidemiology and prevention of dementia group
FDA : Food and Drug Administration GIR : Groupe Iso-Ressource
HAS : Haute Autorité de Santé HR : Hazard Ratio
8 IPC : Indicateurs de Pratique Clinique
ISRS : Inhibiteurs Sélectifs de la Recapture de la Sérotonine IDE : Infirmière Diplômée d’Etat
MMSE : Mini Mental State Examination NA : Non Applicable
NAP : Neuroleptique à Action Prolongée
NICE : National Institute for Health and Clinical Excellence NPI : Inventaire Neuro-Psychiatrique
OMS : Organisation Mondiale de la Santé OR : Odds Ratio
PAQ : Plan d’Amélioration de la Qualité
PAQUID : Personnes âgées Aquitaine ou QUID des personnes âgées PASA : Pôle d’Activités et de Soins Adaptés
PCC : Person-Centred Care (soins centrés sur la personne) PIB : Produit Intérieur Brut
PMSA : Prescription Médicamenteuse chez le Sujet Agé PSEN1 : gène Préséniline 1
PSEN2 : gène Préséniline 2
RCP : Résumé des Caractéristiques du Produit RDC : Rez-De-Chaussée
SPCD : Symptômes PsychoComportementaux de la Démence Sd. : Syndrome
SIDA : Syndrome de l’Immunodéficience Humaine Acquise SMR : Service Médical Rendu
UE : Union Européenne
UHR : Unité d’Hébergement Renforcé USLD : Unité de Soins de Longue Durée VIH : Virus de l’Immunodéficience Humaine
9
LISTE DES TABLEAUX
Tableau 1. Nombre estimé de personnes atteintes de la maladie d'Alzheimer et des maladies
apparentées en Europe en 2008 ... 19
Tableau 2. Projection du nombre de personnes atteintes de la maladie d'Alzheimer ou de maladies apparentées à l'horizon 2030 en Europe ... 20
Tableau 3. Coût de la maladie d'Alzheimer et des maladies apparentées en Europe en 2008 ... 21
Tableau 4. Types de symptômes dits « productifs » ... 22
Tableau 5. Répartition des sujets déments par unités de soins ... 54
Tableau 6. Résultats obtenus pour le premier et le second tour d'audit ... 69
Tableau 7. Réévaluation des 20 patients aux traitements non conformes aux recommandations suite au premier tour de l’audit ... 70
10
LISTE DES FIGURES
Figure 1. Arbre décisionnel du traitement des troubles du comportement perturbateurs51 ... 24
Figure 2. Règles de prescription des psychotropes ... 28
Figure 3. Structure chimique des neuroleptiques70 ... 32
Figure 4. Classification clinique des neuroleptiques selon un axe vertical en quatre groupes70 ... 33
Figure 5. Exemple du modèle en étoile de Bobon ... 34
Figure 6. Estimateur de Kaplan-Meier de la probabilité de survie (décès hors cancer) : halopéridol vs rispéridone81 ... 40
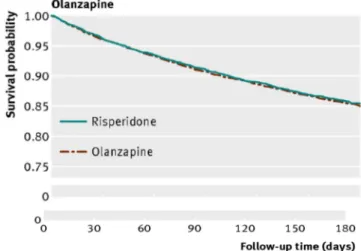
Figure 7. Estimateur de Kaplan-Meier de la probabilité de survie (décès hors cancer) : olanzapine vs rispéridone81 ... 40
Figure 8. Estimateur de Kaplan-Meier de la probabilité de survie (décès hors cancer) : quétiapine vs rispéridone81 ... 41
Figure 9. Hazard Ratios (HR) des morts toutes causes hors cancer selon les doses de différents neuroleptiques (groupe à petite dose de chaque molécule comme référence)81 ... 41
Figure 10. Composition du groupe de travail de l'EPP ... 51
Figure 11. Composition du binôme d'évaluation ... 53
Figure 12. Répartition des âges des patients ... 54
Figure 13. Réalisation d’un diagnostic approfondi du type de démence... 55
Figure 14. Types de démence ... 55
Figure 15. Mentions non considérées comme diagnostic approfondi ... 56
Figure 16. Causes recherchées lors des 10 enquêtes étiologiques ... 56
Figure 17. Utilisation d’outils d’évaluation (NPI) ... 57
Figure 18. Interventions non médicamenteuses ... 57
Figure 19. Instauration de neuroleptique uniquement en cas de trouble du comportement sévère .. 58
Figure 20. Traitements par neuroleptique en cours ... 59
Figure 21. Molécules prescrites selon la présence de troubles du comportement ou non ... 60
Figure 22. Association à d’autres psychotropes ... 61
Figure 23. Justification au sein des dossiers si non-respect des recommandations ... 62
Figure 24. Types de démence – second tour d’audit ... 66
Figure 25. Traitements par neuroleptique en cours – second tour d’audit ... 68
Figure 26. Indicateur d'alerte IPC AMI n°1 ... 75
11
LISTE DES ANNEXES
Annexe 1. Formulaire d’évaluation NPI - HAS ... 86
Annexe 2. NPI dans l’écran de saisie standardisée au sein du logiciel médical au CSMR de Podensac 86 Annexe 3. Échelle d’agitation de Cohen-Mansfield (CMAI - Cohen-Mansfield Agitation ... 87
Annexe 4. Diagramme de Gantt ... 88
Annexe 5. Grille du premier tour d'audit ... 89
Annexe 6. Annexe explicative de la grille d’audit (2 pages) ... 90
Annexe 7. MMSE ... 92
Annexe 8. Courrier/Tableau récapitulatif des dossiers à réévaluer par médecin et par service ... 93
Annexe 9. Plan d'actions d'amélioration Version 1 ... 94
Annexe 10. Plan d’actions d’amélioration mis à jour 06/10/17 ... 95
Annexe 11. Livret d'informations : Prise en charge des troubles du comportement du sujet dément 96 Annexe 12. Procédure de prise en charge des troubles du comportement chez le sujet dément (en cours de validation) ... 103
12
INTRODUCTION
La démence touche aujourd’hui 50 millions de personnes dans le monde.1 Devant le nombre croissant de sujets atteints, la démence a été considérée par l’Organisation Mondiale de la Santé (OMS) comme une priorité de santé publique, notamment avec la publication en 2012 du rapport Dementia: a public health priority [La démence: une priorité de santé publique].2 En mai 2017, l'Assemblée mondiale de la Santé a par ailleurs approuvé le Plan mondial
d’action de santé publique contre la démence 2017-2025.
Au niveau national, le plan Alzheimer mis en œuvre de 2008 à 20123 a été prolongé par le plan maladies neurodégénératives 2014-2019.4 Au sein de la mesure 66 de ce dernier, on retrouve la volonté de la France d’assurer son implication dans l’initiative internationale «Global action against dementia ».
Chez ces sujets atteints de démence type Alzheimer ou apparentée, les troubles psychologiques et comportementaux sont une complication fréquente, survenant chez plus de 80% des patients en Etablissement d’Hébergement pour les Personnes Agées Dépendantes (EHPAD).56
Agitation, cris, hallucinations… Ces symptômes sont à l’origine de souffrances pour le patient, mais également pour les soignants, faisant ainsi de la prévention et de la prise en charge des troubles comportementaux un enjeu majeur.
Recommandées en première intention par l’ensemble des autorités sanitaires et sociétés savantes, les approches non pharmacologiques doivent être privilégiées avant la mise en place d’un traitement médicamenteux. Il a toutefois été estimé dans un rapport demandé par le département de la santé au Royaume-Uni en 2009 que des neuroleptiques étaient prescrits chez 25% des patients déments. Or, parmi eux, seulement 20% tireraient bénéfice de ce traitement et 1% des décès seraient en lien direct avec les effets indésirables de ces médicaments.7
Le rapport bénéfices-risques est en effet souvent peu favorable au regard des effets indésirables particulièrement préjudiciables chez le sujet âgés : chute, sédation excessive, confusion… De plus, de nombreuses études ont démontré une augmentation de la mortalité et du risque d’accidents cardio-vasculaires chez les sujets déments.8 9 1011 12 1314 1516 17 18 1920 Selon la Haute Autorité de Santé (HAS), si l’on souhaite synthétiser la balance bénéfice risque de l’utilisation des neuroleptiques, les données montrent que si l’on traitait 1000 personnes ayant des troubles du comportement avec un antipsychotique atypique pendant 12
13
semaines, on observerait une diminution des troubles du comportement chez seulement 91 à 200 patients, 10 décès supplémentaires, 18 accidents vasculaires cérébraux dont la moitié seraient sévères et des troubles de la marche chez 58 à 94 patients. Une étude canadienne basée sur près de 1,4 millions d’habitants de plus de 65 ans de la province d’Ontario a notamment montré une augmentation du coût total lié à l’utilisation d’antipsychotiques entre 1993 et 2002 de 749% (de 3,7 million de dollars en 1993 à 31,4 millions de dollars en 2002; p < 0.01). Les antipsychotiques atypiques, indisponibles en 1993, représentaient alors 82,5% des antipsychotiques dispensés en 2002 pour 95,2% des coûts.21 On observe ainsi une surprescription délétère de neuroleptiques dans les troubles du comportement dits « productifs » qui, en dépit d’une efficacité modeste, génère une iatrogénie et un coût importants.
Dans le cadre du plan Alzheimer mis en œuvre de 2008 à 20123, la prévention chez le malade Alzheimer de la iatrogénèse liée aux neuroleptiques a ainsi été retenue comme prioritaire. Une mesure spécifique à ce thème « Améliorer le bon usage du médicament dans la maladie d’Alzheimer » y a été consacrée. La HAS pilote cette mesure 15 en raison des travaux développés sur l’amélioration de la Prescription Médicamenteuse chez le Sujet Agé (PMSA). Le programme spécifique développé comprend l’élaboration de recommandations de bonne pratique ainsi qu’un indicateur d’alerte iatrogénique couplé à des programmes d’amélioration. Afin de vérifier la conformité de nos pratiques à ces recommandations, plus spécifiquement celles de prise en charge des troubles du comportement chez le sujet dément, nous avons entrepris de mener une Evaluation des Pratiques Professionnelles (EPP) sur ce thème. Initiée à la volonté du corps médical au cours de l’année 2017, cette démarche qualité s’inscrit particulièrement dans le Projet d’établissement 2016-2020 du Centre de Soins et Maison de Retraite (CSMR) de Podensac avec notamment l’ouverture prévue d’une Unité d’Hébergement Renforcée (UHR) de 14 lits au cours de l’année 2018.
14
PARTIE 1 : Démence et place des neuroleptiques
dans la prise en charge des troubles
comportementaux
Dans cette partie, nous définirons la démence et ses conséquences, puis nous développerons la prise en charge des troubles comportementaux chez le sujet dément et plus particulièrement la place des neuroleptiques.
I)
Démence
a)
Définition
D’après la définition de l’OMS1, la démence est un syndrome, généralement chronique ou évolutif, dans lequel on observe une altération de la fonction cognitive (capacité d’effectuer des opérations de pensée), plus importante que celle que l’on pourrait attendre du vieillissement normal. Elle affecte la mémoire, le raisonnement, l’orientation, la compréhension, le calcul, la capacité d’apprentissage, le langage et le jugement. La conscience n’est pas touchée. Une détérioration du contrôle émotionnel, du comportement social ou de la motivation accompagne souvent, et parfois précède, les troubles de la fonction cognitive.
L’évolution de la maladie peut être divisée en 3 étapes, comme suit :
Stade initial - léger : ce stade passe souvent inaperçu. Les symptômes courants sont
notamment :
• avoir tendance à oublier
• perdre la conscience du temps
• se perdre dans des endroits familiers
Stade intermédiaire - modéré : signes et symptômes se précisent et deviennent plus
visibles. Le malade peut par exemple :
• oublier les événements récents et le nom des gens
• se perdre à la maison
15
• nécessiter de l’aide pour les soins d’hygiène personnelle
• présenter des changements de comportement, par exemple errer ou répéter les mêmes questions
Dernier stade - avancé : dépendance et inactivité deviennent presque totales. Les
symptômes sont notamment :
• perdre conscience du temps et du lieu
• avoir de la difficulté à reconnaître les proches et les amis
• nécessiter une aide accrue pour les soins d’hygiène personnelle
• avoir de la difficulté à marcher
• présenter des changements de comportement, le patient pouvant aller jusqu’à l’agression
b)
Types de démence
1La démence est causée par un ensemble de maladies et de traumatismes qui affectent principalement ou dans une moindre mesure le cerveau. On retrouve principalement la maladie d’Alzheimer (60-70 % des cas) et la démence vasculaire (10%).22 Les frontières entre les différentes formes de démence ne sont pas nettes et les formes mixtes sont fréquentes (20%). On retrouve également la démence à corps de Lewy et la démence fronto-temporale. Selon la HAS23, il est recommandé de faire le diagnostic étiologique de la démence, dont dépendent la prise en charge, l’information du patient et de la famille, le pronostic et le traitement, ainsi qu’une éventuelle recherche de maladie familiale.
1) Maladie d’Alzheimer
Découverte en 1906 par Aloïs Alzheimer, la physiopathologie de la maladie d’Alzheimer n’est toutefois pas encore complètement élucidée. En résumé, on retrouve actuellement concernant les mécanismes pathologiques :
• Une atrophie cérébrale avec perte de 8 à 10 % du poids du cerveau tous les 10 ans contre 2% chez des sujets sains.24 Elle touche principalement le cortex cérébral et certaines régions subcorticales et s'accompagne d'une dilatation des ventricules cérébraux et des sillons corticaux.
16
• Une dégénérescence neurofibrillaire par accumulation intraneuronale de fibrilles composées de protéines Tau anormales hyperphosporylées ne pouvant plus assurer leur rôle physiologique de stabilisation des microtubules. Les neurofibrilles compriment le neurone et provoquent une mort neuronale par apoptose.
• Des plaques séniles ou amyloïdes correspondant à des dépôts extracellulaires de forme sphérique composés de peptide amyloïde β principalement localisés dans le néocortex et l'hippocampe. La présence de plaques amyloïdes entraîne un dysfonctionnement des neurones environnants, puis la mort neuronale par apoptose ou par nécrose.
• Un déficit cholinergique avec une activité de l’enzyme de synthèse de l’acétylcholine, la choline acétyltransférase (ChAT), qui est anormalement basse dans le cerveau des patients atteints de la maladie d’Alzheimer, surtout dans les régions affectées par la maladie comme l’hippocampe et le cortex cérébral. De plus, lors de l’atrophie cérébrale, il a été noté que la perte neuronale affectait plus particulièrement le système cholinergique.
Par ailleurs, il a été démontré que 0,1 % des cas étaient des formes génétiques familiales à transmission autosomale dominante qui se déclenchent habituellement vers 65 ans.25 La majorité d’entre elles peut être attribuée à une mutation sur un des trois gènes suivant26 :
- le gène précurseur de la protéine amyloïde (APP), situé sur le chromosome 21 - le gène Préséniline 1 (PSEN1) situé sur le chromosome 14
- le gène Préséniline 2 (PSEN2) situé sur le chromosome 1
Il existe notamment pour les formes sporadiques des facteurs de risque génétiques dont le mieux décrit est la possession de l'allèle ε4 du gène de l'apolipoprotéine E.2728
2) Démence vasculaire
Les démences vasculaires regroupent l’ensemble des états démentiels secondaires à des lésions cérébrovasculaires tels les AVC multiples ou unique dans une zone fonctionnelle stratégique, les leucoencéphalopathies artériolaires, les hématomes cérébraux ou exceptionnellement une hypoperfusion chronique. Les formes pures sont rares chez le sujet âgé, on retrouve fréquemment des formes mixtes associant le plus souvent une composante neurodégénérative.
17 3) Démence à corps de Lewy
Ce type de démence partage des caractéristiques avec la maladie de Parkinson et la maladie d'Alzheimer. Elle se manifeste en effet par des troubles cognitifs d'évolution progressive et fluctuante, associés à des hallucinations visuelles et à un syndrome extrapyramidal. D’un point de vue anatomopathologique, on retrouve des inclusions cytoplasmiques de protéines alpha-synucléine, les corps de Lewy, dans tout le cerveau.
4) Démence fronto-temporale
Ce quatrième type de démence se caractérise par une dégénérescence et une atrophie des lobes frontaux du cerveau.
5) Autres types de démences
Moins fréquentes, on peut toutefois distinguer d’autres types de démences :
- Démence liée à une pathologie cancéreuse avec ou sans métastases cérébrales - Démence liée à un éthylisme chronique, dite de type Korsakoff
- Démence liée à la maladie de Parkinson : maladie neuro-dégénérative caractérisée par la destruction spécifique des neurones à dopamine de la substance noire du cerveau. - Démence liée à une maladie inflammatoire :
o Sclérose en plaques : maladie auto-immune ciblant les cellules chargées de synthétiser la gaine de myéline qui entoure les axones dans le système nerveux central.
o Vascularites, ou vasculites : groupe de maladies caractérisé par une inflammation et une nécrose des parois des artères et veines de tout calibre quelle qu'en soit la localisation.
o Lupus érythémateux disséminé : maladie systémique auto-immune chronique, de la famille des connectivites.
o Syndrome de Gougerot-Sjögren : dit syndrome sec, maladie auto-immune systémique caractérisée par une attaque des glandes exocrines, en particulier lacrymales et salivaires entrainant une sécheresse des yeux et de la bouche. o Sarcoïdose : maladie inflammatoire systémique atteignant préférentiellement
18
manifeste par la présence d'amas de cellules inflammatoires nommés granulomes.
o Maladie de Behçet : vascularite systémique atteignant les jeunes adultes et s'exprimant essentiellement par des symptômes cutanés, muqueux, articulaires et ophtalmologiques.
o Encéphalomyélite auto-immune non vasculaire - Démence liée à une maladie infectieuse :
o Maladie de Creutzfeldt-Jakob, ou encéphalopathie spongiforme subaiguë : encéphalopathie à prion.
o Démence liée au Virus de l’Immunodéficience Humaine (VIH)
o Syphilis : maladie sexuellement transmissible due à la bactérie Treponema
pallidum.
o Maladie de Whipple : maladie infectieuse chronique rare due à la bactérie
Tropheryma whipplei. Elle se manifeste classiquement par une triade composée de douleurs articulaires, syndrome de malabsorption (diarrhée chronique et perte de poids) et une fièvre prolongée inexpliquée.
o Encéphalite herpétique et autres encéphalites virales o Méningites chroniques
o Leucoencéphalopathie multifocale progressive : infection opportuniste liée à la réactivation d’un polyomavirus, le virus JC, lors d’une immunodépression profonde (SIDA, maladie de Hodgkin, leucémies…). Il s’agit d’une affection démyélinisante affectant la substance blanche du cerveau.
o Panencéphalite sclérosante subaiguë, ou maladie de Van Bogaert : myélite atypique survenant chez l’enfant, secondaire à une infection par le virus de la rougeole, un morbillivirus de la famille des Paramyxoviridae. Elle est caractérisée par une démence rapidement progressive évoluant en quelques mois vers la cachexie et la mort.
- Démence d’origine métabolique : o Déficit en vitamine B12 o Maladie thyroïdienne o Maladie parathyroïdienne
19
c)
Epidémiologie
Les estimations sur le nombre de démences et de cas de maladie d'Alzheimer sont difficiles puisqu'il n'existe pas d'indicateur sanitaire fiable, ni de registre permettant un recensement exhaustif et pérenne des cas. Cela peut s’expliquer par la difficulté à diagnostiquer cette maladie, aucun marqueur de la maladie, même très indirect, n'étant actuellement disponible. Ainsi, l'étude PAQUID (Personnes âgées Aquitaine ou QUID des personnes âgées)29, à partir de cas recherchés systématiquement dans le cadre d’une enquête en population générale, a montré que seule une démence sur deux est diagnostiquée, tous stades confondus. Plus particulièrement, aux stades légers de la maladie, seul un cas sur trois est connu par le patient ou son médecin.
Cette étude PAQUID est une étude de cohorte menée en population générale depuis 1989 en Gironde et Dordogne chez des sujets âgés de plus de 65 ans. La prévalence des démences retrouvée en 1989 chez les plus de 75 ans était de 7,7 %.29 Ces chiffres ont été revus à la hausse à l'occasion du suivi à 10 ans de cette cohorte30 avec une prévalence en 1999 estimée à 17,8 % pour ces sujets de plus de 75 ans, 13,2 % pour les hommes et 20,5 % pour les femmes. L’étude a notamment démontré que la prévalence augmente très nettement avec l'âge et est beaucoup plus marquée en institution où plus de deux tiers des sujets sont déments.
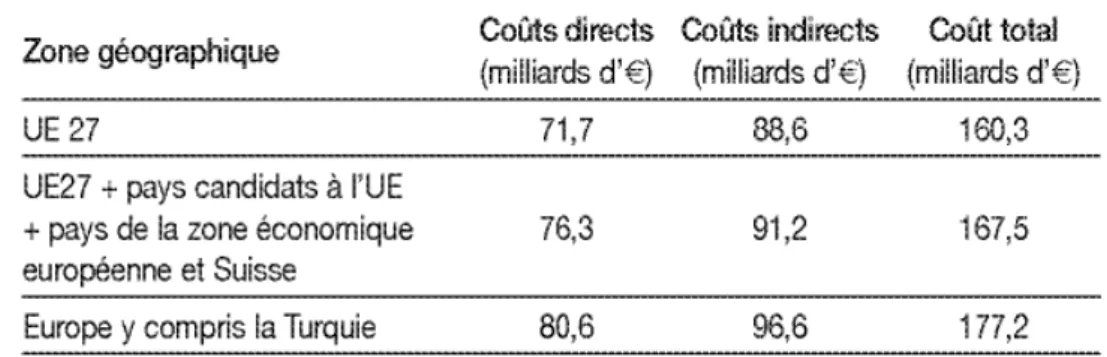
Au niveau européen, une méta-analyse issue du projet EuroCoDe31 (European Collaboration on Dementia) financé par la Commission européenne a estimé qu’il y avait environ 7,2 millions de personnes atteintes de la maladie d’Alzheimer ou d’une maladie apparentée dans les 27 pays membres de l’Union Européenne (UE) en 2008.
Tableau 1. Nombre estimé de personnes atteintes de la maladie d'Alzheimer et des maladies apparentées en Europe en 2008
D’autres sources concernant la prévalence en Europe existent.32 33 Ainsi, d’après les données du groupe Eurodem (European community concerted action on the epidemiology and prevention of dementia group), le taux de prévalence des démences chez les sujets de plus de
20
65 ans est estimé à 6,4 %.22 Selon ces différentes études publiées entre 1991 et 2005, la prévalence de la maladie d’Alzheimer et des maladies apparentées, pour la zone UE 27, varie de 5,27 à 6,39 millions de personnes.
Enfin, au niveau mondial, selon l’OMS1, la démence touche aujourd’hui 50 millions de personnes, dont près de 60% vivent dans un pays à revenu faible ou intermédiaire. Chaque année, on dénombre près de 10 millions de nouveaux cas. L’OMS estime dans l’ensemble de la population qu’entre 5 et 8% des personnes âgées de 60 ans et plus sont atteintes de démence à un moment donné. Quant au nombre total de personnes atteintes de démence dans le monde, il devrait, selon les dernières estimations, atteindre 82 millions en 2030 et 152 millions d'ici 2050. Cette hausse serait en grande partie due à l’augmentation du nombre de cas de démence dans les pays à revenu faible ou intermédiaire ainsi qu’au vieillissement de la population. Mais plusieurs études suggèrent la possibilité d’une tendance à un déclin de ces cas de démence depuis une dizaine d’années.34 35 36 37 38 39 40 41 La plupart d’entre elles sont des études de prévalence, certaines rapportent l’incidence.35 36 41 Cette baisse de l’incidence des démences pourrait être en partie expliquée par une meilleure prise en charge de certains facteurs (cardiovasculaires, activité physique, régime alimentaire, niveau d’éducation) considérés comme facteurs de risque de maladie d’Alzheimer.42 Certaines études ne suggèrent toutefois pas de changement, voire une augmentation des cas.4344
La figure ci-dessous issue du projet EuroCoDe31 montre que le nombre de personnes atteintes de la maladie d’Alzheimer et de maladies apparentées en Europe devrait s’accroître d’environ 40 %, passant d’environ 10 millions en 2005 à 14 millions en 2030.
Tableau 2. Projection du nombre de personnes atteintes de la maladie d'Alzheimer ou de maladies apparentées à l'horizon 2030 en Europe
21
d) Conséquences sociales et économiques
La démence est l’une des causes principales de handicap et de dépendance parmi les personnes âgées dans le monde. Elle a également des conséquences sociales et économiques importantes, que ce soit en termes de coûts médicaux directs (hospitalisation, consultations…), de dépenses sociales directes ou de frais engagés pour les soins informels. Il est important de souligner que le coût de l’aide informelle à des personnes atteintes de la maladie d’Alzheimer est difficile à estimer. Par conséquent, ce dernier varie considérablement, allant de 36 % à 85 % des coûts totaux selon les études.45 Bien que la disponibilité des aidants familiaux puisse réduire le besoin d’aide professionnelle, l’activité d’aide induit une perte de temps (et donc un coût) que les aidants auraient pu utiliser pour travailler ou pour des activités de loisir. Lorsque la maladie progresse, les aidants peuvent finir par s’isoler de leur réseau social, l’activité d’aide devenant alors une occupation à plein temps46. Les conséquences sur les aidants sont importantes : anxiété, dépression, impact sur leur santé physique…47484950
En 2015, le coût sociétal total de la démence dans le monde était estimé à 818 milliards de dollars (US), soit 1,1% du produit intérieur brut (PIB) mondial.1
Au niveau européen, le groupe socio-économie du projet EuroCoDe a construit un modèle économique des coûts de la maladie.31 Le coût total de la maladie d’Alzheimer ou d’une maladie apparentée en Europe (UE 27) a ainsi été estimé à 160,3 milliards d’euros en 2008 soit 1,3% du produit intérieur brut 2008 de l’UE 27.
Tableau 3. Coût de la maladie d'Alzheimer et des maladies apparentées en Europe en 2008
Par ailleurs, pour la France, le coût total par personne atteinte de la maladie d’Alzheimer a été estimé à 25 119 € par an (dont 9 914 euros de coûts directs et 15 206 € de coûts indirects).
22
II) Prise en charge des troubles comportementaux chez le
sujet dément
a)
Généralités
1) Description des symptômes51
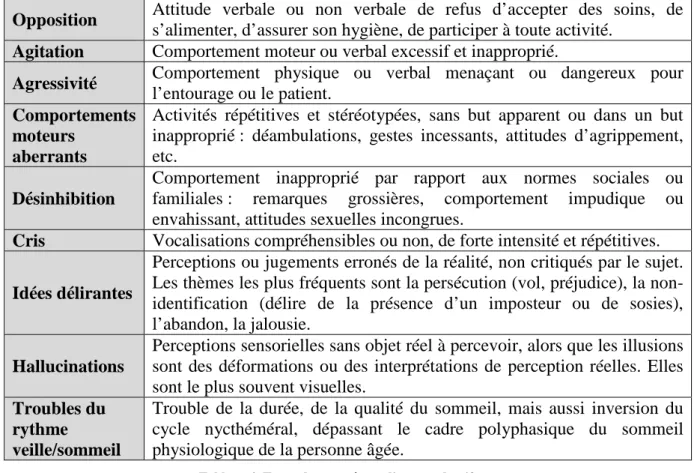
Les troubles du comportement à prendre en charge sont définis comme des comportements, des attitudes ou expressions dérangeants, perturbateurs ou dangereux pour la personne ou pour autrui. Ils peuvent correspondre à différents types de symptômes dits « productifs », regroupés et définis dans le tableau ci-dessous :
Opposition Attitude verbale ou non verbale de refus d’accepter des soins, de
s’alimenter, d’assurer son hygiène, de participer à toute activité.
Agitation Comportement moteur ou verbal excessif et inapproprié.
Agressivité Comportement physique ou verbal menaçant ou dangereux pour
l’entourage ou le patient.
Comportements moteurs
aberrants
Activités répétitives et stéréotypées, sans but apparent ou dans un but inapproprié : déambulations, gestes incessants, attitudes d’agrippement, etc.
Désinhibition
Comportement inapproprié par rapport aux normes sociales ou familiales : remarques grossières, comportement impudique ou envahissant, attitudes sexuelles incongrues.
Cris Vocalisations compréhensibles ou non, de forte intensité et répétitives.
Idées délirantes
Perceptions ou jugements erronés de la réalité, non critiqués par le sujet. Les thèmes les plus fréquents sont la persécution (vol, préjudice), la non-identification (délire de la présence d’un imposteur ou de sosies), l’abandon, la jalousie.
Hallucinations
Perceptions sensorielles sans objet réel à percevoir, alors que les illusions sont des déformations ou des interprétations de perception réelles. Elles sont le plus souvent visuelles.
Troubles du rythme
veille/sommeil
Trouble de la durée, de la qualité du sommeil, mais aussi inversion du cycle nycthéméral, dépassant le cadre polyphasique du sommeil physiologique de la personne âgée.
Tableau 4. Types de symptômes dits « productifs »
Les troubles dits « non productifs » (dépression, apathie, repli sur soi) ne sont donc pas traités dans les recommandations de prise en charge, bien qu’ils puissent mettre en danger le patient.
2) Prévalence et conséquences
Les troubles psychologiques et comportementaux sont une complication fréquente de la maladie d’Alzheimer ou apparentée. En effet, environ 800 000 personnes sont atteintes de démence au Royaume-Uni et approximativement 80% vont, au cours de leur maladie,
23
expérimenter des troubles du comportement.52 53 Leur survenue est souvent peu prévisible, ils sont variables dans le temps, et sont fréquemment associés entre eux. Chez les patients atteints de démence modérée à sévère vivant en maison de retraite, la prévalence de l’agitation et de l’agressivité a été rapportée comme étant supérieure à 50%.54 Les idées délirantes et
hallucinations ont quant à elles été retrouvées chez 30 à 50% des patients atteints de la maladie d’Alzheimer.55 Il est estimé qu’un tiers des patients ont des symptômes d’intensité jugée sévère.56 Par ailleurs, la prévalence des différents Symptômes Psycho Comportementaux de la Démence (SPCD) est variable selon le type de démence. Les symptômes psychotiques sont ainsi très fréquents dans la démence à corps de Lewy, dont ils font évoquer le diagnostic. Les comportements impulsifs et la désinhibition sont quant à eux plus fréquents dans les démences fronto-temporales.5758
Tous ces symptômes sont à l’origine de souffrances pour le patient mais également pour le soignant et l’aidant (détresse, épuisement, risque de maltraitance, etc.).59 60 De plus, les troubles du comportement contribuent considérablement à la morbidité de la maladie.55 566162 Il s’agit d’un facteur important contribuant à la perte d’autonomie dans les activités de la vie quotidienne et accentuant le risque de dépendance, pouvant ainsi compromettre la sécurité du patient ou favoriser son institutionnalisation.636465
Ainsi, les conséquences des troubles psychologiques et comportementaux sur la personne mais aussi sur les équipes soignantes et les aidants font de leur prévention et de leur prise en charge un enjeu majeur.
b)
Prise en charge
Dans le cadre du Plan Alzheimer 2008-20123, la HAS a élaboré en mai 2009 des Recommandations de Bonnes Pratiques Professionnelles51 concernant la prise en charge des troubles du comportement perturbateurs au cours de la maladie d’Alzheimer et maladies apparentées. Ces recommandations s’intègrent dans la mesure 15 « Amélioration du bon usage du médicament », et répondent plus particulièrement à la sous-mesure « Elaboration de recommandations de pratique clinique sur les modalités de sédation des troubles du comportement ».
Dans cette partie, nous reprendrons le plan élaboré au sein de ces recommandations afin de suivre la démarche de prise en charge : démarche diagnostique dans un premier temps, suivie des interventions non médicamenteuses puis médicamenteuses.
24
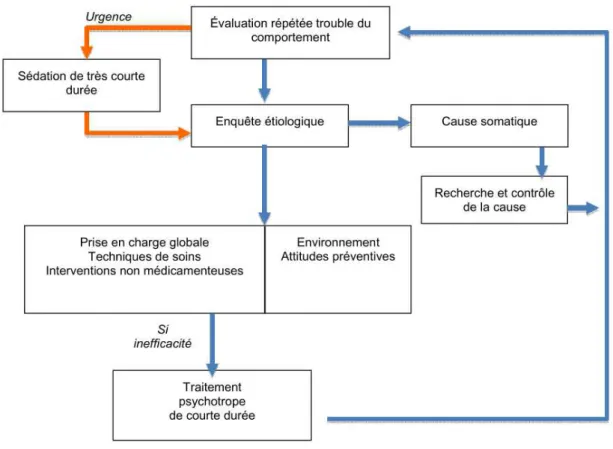
La stratégie globale de prise en charge à adopter lors de la survenue de troubles du comportement est résumée par l’arbre décisionnel présenté ci-après.
Figure 1. Arbre décisionnel du traitement des troubles du comportement perturbateurs51
1) Démarche diagnostique
Lors de la survenue de troubles du comportement, une évaluation structurée et personnalisée est recommandée. Elle comprend une évaluation clinique ainsi qu’une enquête étiologique devant être répétées à différents moments de la prise en charge si le trouble persiste.
(i) Evaluation clinique Elle comprend :
• L’appréciation du degré d’urgence, de dangerosité ou de risque fonctionnel à court terme pour le patient ou pour autrui
• L’examen clinique du patient
• L’interrogatoire du patient et de l’entourage (aidants, professionnels, etc.) : ancienneté et caractéristiques du trouble, signes d’alerte éventuels, circonstances de survenue
• L’utilisation d’outils d’évaluation :
25
Le NPI permet de recueillir des informations sur la présence de troubles du comportement chez des patients souffrant de démence. Il s’agit d’un inventaire de 12 symptômes (10 domaines comportementaux et 2 variables neurovégétatives) parmi les plus fréquents au cours de la maladie d’Alzheimer et maladies apparentées permettant d’évaluer leur fréquence (F) et gravité (G) ainsi que leur retentissement sur l’aidant, le professionnel ou les autres résidents. La fréquence F est ainsi cotée sur une échelle croissante allant de 1 à 4, et la gravité G est cotée sur une échelle croissante allant de 1 à 3. Le score de chaque symptôme est obtenu en multipliant le score F avec le score G et le score global est la somme de ces scores. Par la suite, le retentissement est évalué par les soignants, aidants et/ou l’entourage en se demandant à quel point le trouble est perturbateur pour eux : de 0 (pas du tout) à 5 (très sévèrement perturbateur). Le score de retentissement sur les activités professionnelles n’est pas pris en compte dans le score total mais peut être calculé séparément.
Trois versions existent : NPI et NPI-Réduit renseigné par l’aidant ou un professionnel à domicile ; NPI-ES destiné aux équipes soignantes en établissement pouvant être utilisé par un évaluateur externe qui va s’entretenir avec un membre de l’équipe ou directement par un membre de l’équipe soignante.
o Echelle d’agitation de Cohen-Mansfield (CMAI Cohen Mansfield Agitation Inventory) pouvant être utilisée en complément du NPI en cas d’agressivité physique, de déambulations et/ou de cris (Annexe 3). Différents types d’agitation (physique, verbale…) sont côtés avec plusieurs items pour lesquels le soignant ou l’aidant doit évaluer la fréquence de survenue sur les 7 jours précédents : de jamais (1) à plusieurs fois par heure (7). Le score maximal de cette échelle est de 203. Plus le score est élevé, plus l'agitation est intense.
(ii) Enquête étiologique L’enquête à mener doit comprendre :
• La recherche d’une cause somatique : douleur mal contrôlée, fécalome, globe vésical, infection, déshydratation etc.
• La recherche d’une cause psychiatrique : épisode dépressif ou anxieux, décompensation d’une maladie psychiatrique préexistante.
• La recherche de facteurs iatrogènes : réactions paradoxales aux benzodiazépines ou délirium sous anticholinergiques par exemple.
• L’identification des facteurs prédisposants : o Types de troubles cognitifs prédominants
26
o Comorbidités/Décompensation des pathologies chroniques o Déficits sensoriels, auditifs et visuels
o Contraintes environnementales
o Attitude et capacité de communication des soignants et aidants
• La recherche de facteurs déclenchants ou de décompensation : o Evènements récents
o Changement d’organisation de la prise en charge ou du lieu de vie o Modifications de l’environnement ou des intervenants
o Situations de conflit interpersonnel ou de contraintes vécues
• L’identification des facteurs de personnalité, caractère, et histoire de vie
2) Techniques de soins et interventions non médicamenteuses
(i) Techniques de soins
L’utilisation des techniques de soins est recommandée en première intention. Elles nécessitent un personnel formé aux attitudes de communication et de soins appropriées aux troubles du comportement.
Exemples d’attitudes de communication :
• éviter les différentes sources de distraction lors de la communication avec le patient
• savoir attirer son attention
• utiliser des phrases courtes
• éviter de transmettre plusieurs messages à la fois
• utiliser des gestes pour faciliter la transmission du message
• préférer les questions fermées
• laisser le temps au patient pour qu’il puisse s’exprimer
• ne pas hausser la voix
• inclure la personne dans la conversation
• ne pas obliger le patient à faire ce qu’il n’a pas envie de faire, changer de sujet et réessayer plus tard
Exemples d’attitudes de soins :
• éviter de faire à la place du patient ce qu’il est encore capable de faire, stimuler les capacités restantes
27
• laisser au patient la possibilité de faire ses choix
• préserver l’intimité pour les soins et l’hygiène personnelle
• laisser faire les comportements qui ne dérangent pas s’ils ne sont pas dangereux
• proposer une activité ou des alternatives qui ont une signification lorsqu’il existe certains troubles : proposer une activité répétitive comme plier le linge pour une déambulation, d’écouter de la musique ou regarder l’album photo personnel pour une agitation, etc.
(ii) Interventions non médicamenteuses
Ces interventions s’intègrent dans la prise en charge thérapeutique globale. D’un point de vue préventif, des activités comme la stimulation cognitive, un suivi psychologique, l’orthophonie, l’activité physique adaptée (APA), la psychomotricité, l’ergothérapie, la luminothérapie peuvent être proposées. La musicothérapie, l’aromathérapie, la relaxation ou la prise en charge psychologique peuvent, quant à elles, être utiles lors de la survenue d’un trouble du comportement. Pratiquées par un personnel formé, ces interventions peuvent être proposées à titre individuel ou collectif.
(iii) Avis spécialisé, contention physique et hospitalisation
En cas de comportement difficile à gérer ou à risque de danger pour le patient ou autrui, il est recommandé de demander l’avis d’un professionnel spécialisé : psychiatre, neurologue, gériatre, psychologue.
Les mesures de contention physique doivent quant à elles rester exceptionnelles, à réserver en cas d’échec de toutes les autres mesures lors d’un danger élevé et à réévaluer quotidiennement.
Enfin, il est recommandé d’hospitaliser le patient quand les troubles constatés ne peuvent pas être pris en charge de façon rapidement sécurisante dans le lieu où il se trouve.
3) Interventions médicamenteuses
Nous nous intéresserons dans cette partie aux traitements par psychotropes. Toutefois, la place des neuroleptiques sera plus particulièrement détaillée en partie III.
La HAS ne recommande un traitement par psychotrope que lorsque les techniques de soins appropriées sont d’efficacité insuffisante ou quand la sévérité des troubles du patient le met en danger, altère son fonctionnement, ou représente une menace ou une source importante de
28
souffrance pour son entourage. Ainsi, il n’est pas recommandé d’instaurer un traitement par psychotrope si les symptômes sont d’origine iatrogène ou somatique, ni en première intention et sans évaluation préalable en cas d’opposition, de cris, ou de déambulations.
Par ailleurs, il est important de noter que les psychotropes n’ont pas d’effet préventif sur la survenue des troubles du comportement.
Des règles de prescription générales applicables à l’ensemble des psychotropes sont présentées dans la figure ci-dessous :
Revoir les prescriptions régulièrement et considérer les prises continues ou
itératives comme potentiellement inutiles ou nocives
Documenter les cibles symptomatiques choisies et les impacts attendus avant
d’instaurer le traitement
Choisir un produit en fonction des symptômes cibles et du risque d’effets secondaires
Privilégier la monothérapie
Démarrer à de petites doses, en augmentant prudemment par paliers, et maintenir le traitement à la dose efficace la mieux tolérée
Prescrire pour la plus courte durée possible, à l’exception des antidépresseurs Choisir la forme galénique en fonction de l’acceptabilité du patient. La voie d’administration privilégiée doit être per os. Le recours à une forme injectable ne doit être décidé qu’en cas de nécessité de traitement urgent d’un trouble et d’un risque majeur immédiat pour la sécurité, lorsque la voie per os n’est pas possible et lorsque la voie parentérale a été démontrée plus rapidement efficace
Réévaluer fréquemment les signes car les fluctuations sont caractéristiques des
troubles du comportement. Une évaluation au début et à la fin prévue du traitement peut conduire à mal apprécier les troubles comportementaux
Ne modifier si possible qu’un seul traitement à la fois, si de nombreux produits sont utilisés et se révèlent non efficaces
Règles de prescription applicables à l’ensemble des
psychotropes
29
Hormis les antipsychotiques, 4 autres classes de psychotropes ont été décrites dans les recommandations de la HAS : antidépresseurs, anxiolytiques, hypnotiques, et thymorégulateurs.
(i) Les antidépresseurs
Des symptômes dépressifs sont fréquents au cours de la maladie d’Alzheimer. Dans la majorité des cas, ils sont provisoires et fluctuent en intensité d’un jour à l’autre. Néanmoins, la permanence de ces derniers pendant plusieurs semaines doit conduire à des stratégies antidépressives spécifiques.
Les antidépresseurs sont ainsi recommandés en cas de troubles du comportement associés à des épisodes dépressifs caractérisés : instabilité émotionnelle, anxiété, impulsivité, agitation ou idées délirantes.
Conformément aux recommandations de prise en charge chez le sujet âgé67, la prescription s’orientera préférentiellement vers des molécules de la classe des Inhibiteurs Sélectifs de la Recapture de la Sérotonine (ISRS). L’efficacité peut être jugée cliniquement après 6 à 12 semaines de traitement à posologie efficace avant d’envisager une modification.
(ii) Les anxiolytiques
La prescription d’anxiolytiques doit être limitée aux situations de crise ou de courte durée. Selon les recommandations68, un contrat pré-thérapeutique devrait être passé avec le patient afin de ne pas excéder 8 à 12 semaines de traitement.
Il est important de noter qu’à un stade plus évolué de la maladie, l’anxiété prend volontiers des formes plus trompeuses comme des appels à l’aide réitérés, des cris, des déambulations soudaines ou des tentatives de fugue. Plus fréquemment, les malades « somatisent », se plaignant de symptômes corporels, digestifs, urinaires, douloureux, diffus ou localisés.
L’utilisation de molécules de la classe des benzodiazépines, à demi-vie courte et sans métabolite actif (lorazépam, oxazépam) est recommandée.
Lors de leur prescription, il est particulièrement important de prendre en compte les risques associés à ces produits : sédation, agitation paradoxale, accentuation des troubles mnésiques, chute, et syndrome de sevrage en cas d’arrêt brutal.
30 (iii) Les hypnotiques
Une hyper-somnolence dans la journée peut contraster avec un sommeil fragmenté par de multiples réveils nocturnes. De même une agitation anxieuse le soir se traduit par ce que l’on appelle le syndrome du soleil couchant, moment particulier de la journée où le soleil disparaît et où la nuit s’installe et vient réactiver des peurs infantiles, une angoisse de la solitude, de l’abandon, de la mort. Aux stades évolués, la maladie entraîne une désorganisation de l’architecture du sommeil voire une inversion complète du rythme veille-sommeil. Lors de troubles du sommeil, l’utilisation des hypnotiques doit être de courte durée et privilégier les molécules à courte durée d’action (zolpidem, zopiclone).
Par ailleurs, il existe un risque d’hallucinations hypnagogiques (état de conscience particulier intermédiaire entre celui de la veille et celui du sommeil qui a lieu durant la première phase du sommeil : l'endormissement) ou diurnes à prendre en compte chez les patients traités par zolpidem.
(iv) Les thymorégulateurs
Malgré une utilisation croissante de cette classe de médicaments en pratique courante dans les troubles du comportement du patient dément, il n’existe pour le moment pas de recommandations de prescription des thymorégulateurs dans cette indication en raison de données insuffisantes.69
III)
Place des neuroleptiques
Les neuroleptiques, encore appelés antipsychotiques, sont des médicaments psychotropes. Le terme neuroleptique a été proposé en 1955. D’origine grecque, il signifie littéralement « qui prend le nerf ». Les premiers essais thérapeutiques de ces médicaments dans les psychoses aux États-Unis et au Canada datent de 1953.70
a)
Pharmacologie
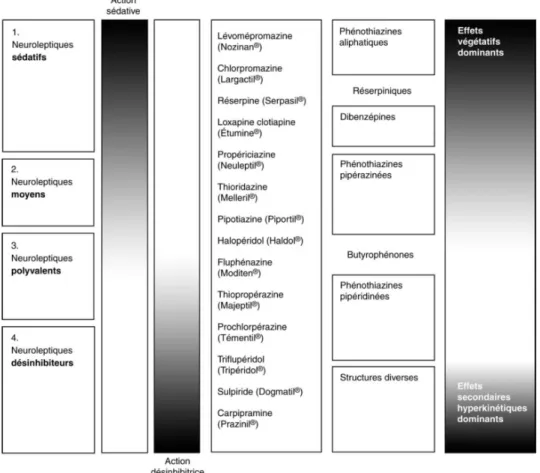
1) ClassificationOn peut classer les neuroleptiques en fonction de plusieurs types de critères : selon leur structure chimique ou selon leurs effets cliniques. Il existe environ une dizaine de classes pharmacologiques principales de neuroleptiques selon la structure chimique de ces molécules. Mais si l’on considère les effets cliniques de ces substances, on distingue des neuroleptiques
31
de première génération dits « conventionnels » ou « typiques », et des neuroleptiques de seconde génération dits « atypiques ».
Les effets cliniques d’un neuroleptique donné découlent de sa structure chimique et de son profil d’action sur les différents récepteurs. Cependant, sa formule chimique ne permet pas de prédire de façon certaine les effets thérapeutiques d’un médicament.
(i) Classification chimique
Il existe cinq principales classes de neuroleptiques de première génération :
- les phénothiazines : noyau tricyclique associé à une chaîne latérale liée à l’atome d’azote du noyau central. La nature de cette chaîne détermine la sous-classe de la substance :
o aliphatique - ou linéaire - : chlorpromazine, lévomépromazine, cyamémazine o pipéridinée : pipotiazine et thioridazine
o pipérazinée : fluphénazine.
- les thioxanthènes : flupentixol et zuclopenthixol résultent de modifications apportées au noyau des phénothiazines.
- les dibenzoxazépines : loxapine ou carpipramine.
- les butyrophénones dont le chef de file est l’halopéridol, cycle benzénique relié à un atome de fluor et à une chaîne pouvant comprendre des noyaux cycliques.
- les benzamides : sulpiride, tiapride, sultopride, amisulpride, possèdent quant à eux une structure à part.
Les neuroleptiques de seconde génération appartiennent aux classes principales suivantes : - les dibenzodiazépines et dérivés : clozapine, olanzapine et quétiapine à la structure
tricyclique proche de celle des phénothiazines.
- les benzisoxazoles : rispéridone de structure bicyclique. - les imidazolidinones : sertindole.
Apparu plus récemment, l’aripiprazole est, quant à lui, classé « autres antipsychotiques ». Les structures chimiques de ces différentes classes sont présentées dans la figue ci-après.
32
33 (ii) Classifications cliniques
Selon leurs effets cliniques, plusieurs classifications des neuroleptiques sont possibles. Classifications d’ensemble
En 1960, Lambert et Revol71 répartissent les neuroleptiques selon un axe où la chlorpromazine occupe une position médiane. A gauche, le pôle sédatif, où les neuroleptiques sont les plus actifs sur les manifestations d’anxiété et d’agitation. A droite, le pôle « incisif » (ou antiproductif), où les neuroleptiques sont les plus incisifs sur les manifestations délirantes des psychoses. Ce modèle ne tient toutefois pas compte de l’effet désinhibiteur correspondant à l’efficacité de certains neuroleptiques sur les symptômes déficitaires des psychoses: indifférence, repli sur soi, perte d’initiative, émoussement affectif, pauvreté des expressions… En 1975, Deniker et Ginestet72 conservent le principe d’une classification biaxiale en opposant les effets sédatifs aux effets désinhibiteurs, tout en intégrant une corrélation aux effets latéraux. Les neuroleptiques « moyens » sont dotés d’une action thérapeutique et d’effets secondaires modérés ; ils sont essentiellement anxiolytiques et peu antipsychotiques. Les neuroleptiques « polyvalents » ont une dominante antipsychotique, avec des propriétés sédatives (halopéridol) ou désinhibitrices.
34 Classifications spécifiques
Deux modèles principaux ont été proposés.
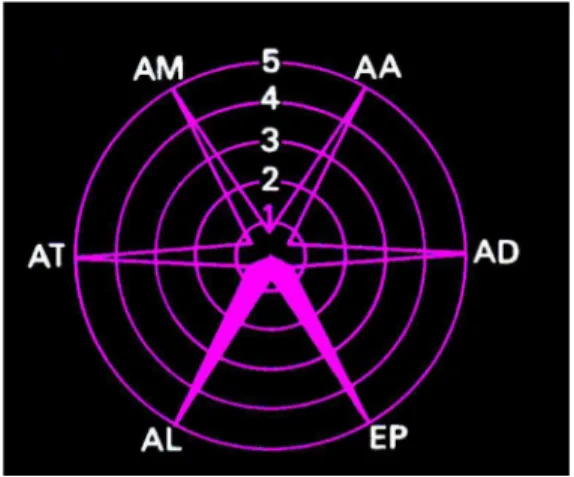
Delay et Deniker73, en 1961, quantifient sous forme d’histogrammes, en les opposant de part et d’autre d’une ligne horizontale, les effets psychiques recherchés et certains effets latéraux. Bobon74, de 1972 à 1975, propose quant à lui un modèle en étoile à six branches dont les longueurs sont proportionnelles de 0 à 5 à l’effet observé pour un neuroleptique prescrit à une posologie donnée. Aux actions psychiques classiques (AD anti-délirant, AA anti-autistique, AT ataraxique), il ajoute une quatrième propriété : AM anti-maniaque ; et ne retient que 2 effets latéraux (AL adrénolytique, EP extrapyramidal).
Figure 5. Exemple du modèle en étoile de Bobon
Enfin, la classification de Petit et Colonna75 introduit le paramètre posologique et a ainsi distingué des neuroleptiques monopolaires, qui se caractérisent par des effets sédatifs et neurovégétatifs quelle que soit la posologie utilisée (cyamémazine), et des neuroleptiques bipolaires, qui sont stimulants ou désinhibiteurs à faibles doses, alors qu’ils sont réducteurs et sédatifs à fortes doses (halopéridol, fluphénazine, pipotiazine).
2) Mécanismes d’action70
(i) Système dopaminergique
Une action antagoniste des récepteurs à la dopamine de type D2 est commune à tous les neuroleptiques, qu’ils soient de première ou de deuxième génération. L’action antagoniste des neuroleptiques s’exerce par l’intermédiaire de quatre voies dopaminergiques, avec pour conséquence certains effets thérapeutiques, mais aussi indésirables, de ces médicaments.
35
• Voie mésolimbique
Cette voie intervient dans la régulation de la vie émotionnelle et dans le contrôle de la motivation. Elle permet l’association des actions et de leurs conséquences. Cliniquement, un dysfonctionnement de cette voie se manifesterait par l’apparition de pensées ou de percepts inappropriés. L’action des neuroleptiques sur cette voie est donc recherchée car elle sous-tendrait leurs effets thérapeutiques dans la schizophrénie en s’opposant à l’hyperdopaminergie sous-corticale supposée.
• Voie mésocorticale
Cette voie favorise les performances du lobe préfrontal, c’est-à-dire tout ce qui concerne la planification des actions et le déclenchement des actions volontaires.
• Voie nigrostriée
Elle est impliquée dans le contrôle du mouvement. Une perte neuronale à ce niveau entraîne l’apparition d’une maladie de Parkinson. De la même manière, lorsque le blocage des récepteurs D2 de la voie nigrostriée par les neuroleptiques dépasse un certain seuil, des symptômes extrapyramidaux apparaissent. Ils peuvent se manifester sous la forme d’un syndrome parkinsonien, de dyskinésies aiguës ou d’une akathisie (impossibilité de tenir en place). Par ailleurs, l’utilisation à long terme de ces substances peut entraîner une hypersensibilisation de ces récepteurs, à l’origine de dyskinésie tardive. Ces effets indésirables neurologiques sont des manifestations à la fois très fréquentes et gênantes des neuroleptiques de première génération.
• Voie tubéro-infundibulaire
L’effet des neuroleptiques sur cette voie entraîne une diminution de l’effet inhibiteur sur la sécrétion de prolactine normalement exercée par la dopamine au niveau de l’hypophyse. Cet effet peut donc conduire à l’apparition d’une hyperprolactinémie, avec pour conséquences possibles une aménorrhée-galactorrhée chez la femme ou une impuissance chez l’homme.
Parallèlement à leurs effets sur les récepteurs de type D2, crédité à la fois de propriétés thérapeutiques et de certains effets indésirables, chaque neuroleptique possède un profil d’action spécifique sur certains autres récepteurs cérébraux.
36 (ii) Système sérotoninergique
Cet effet antagoniste des récepteurs 5-HT2 à la sérotonine est particulièrement important avec les neuroleptiques de seconde génération dont il représente une caractéristique centrale. Cet effet sur les récepteurs 5-HT2 augmenterait en particulier la tolérance neurologique des neuroleptiques au niveau nigrostriatal. Certains neuroleptiques sont toutefois atypiques alors qu’ils ne répondent pas à ce critère. C’est en particulier le cas de l’amisulpride qui n’entraîne pas d’effets neurologiques, alors qu’il n’agit que sur les récepteurs D2 et D3. L’antagonisme des récepteurs 5-HT2 ne constitue ainsi pas un facteur suffisant pour qu’un neuroleptique soit qualifié d’atypique.
(iii) Système adrénergique
Certains neuroleptiques possèdent un effet antagoniste sur les récepteurs α1-adrénergiques à l’origine d’effets secondaires tels qu’une baisse de la tension artérielle et une sédation, ou encore d’effets secondaires sexuels (troubles de l’érection ou de l’éjaculation).
(iv) Système histaminergique
Les effets antihistaminiques par antagonisme des récepteurs H1 de certains neuroleptiques peuvent entraîner une augmentation de l’appétit à l’origine d’une prise de poids ou encore une baisse de la vigilance et une sédation.
(v) Système cholinergique
La plupart des neuroleptiques possèdent une action anticholinergique centrale et périphérique par antagonisme des récepteurs muscariniques M1 à l’origine d’effets indésirables présentés dans la partie suivante.
b)
Effets délétères des neuroleptiques
1) Effets secondairesAvant toute prescription d’un antipsychotique, il est recommandé d’évaluer le rapport bénéfices/risques en tenant compte de leurs effets secondaires attendus. Ces derniers sont nombreux et de différentes natures.