Fractures fémorales sur prothèse totale de la
hanche
PTH; fractures sur prothèse totale de hanche
S
OMMAIRE
I- Introduction
……….……… 2II- Rappels
……….….……….. 4- Historique.
- Anatomique et physiologique.
III- Matériels et méthodes
……….………... 13VI- Discussion
………..…….……….. 28- Classification des fractures fémorales sur PTH.
- Epidémiologie.
- Facteurs de risque des fractures fémorales sur PTH.
- Principes thérapeutiques des fractures fémorales sur PTH.
V- Résultats
………..………56VI- Conclusion
……….……….… 58VII - Résumé
……….……….……….… 59I
NTRODUCTION
Avec la généralisation de l’arthroplastie de hanche, tout chirurgien orthopédiste sera, un jour ou l’autre, confronté au difficile problème de la prise en charge et du traitement d’une fracture du fémur survenant après arthroplastie de hanche.
L’expérience individuelle que peuvent avoir les chirurgiens de ces fractures est limitée : d’abord, parce que cette complication est rare, ensuite, parce que c’est le plus souvent une urgence qui rend le transfert rapide du patient en milieu spécialisé très difficile.
La perte de continuité osseuse du fût osseux fémoral, en cas d’arthroplastie de hanche, représente toujours un problème grave. Il s’agit en effet d’un os porteur soumis à des contraintes majeures en compression, torsion et cisaillement.
Les résultats du traitement sont parfois altérés par le descellement de la prothèse, et le pronostic vital peut être mis en jeu.
La connaissance parfaite de cette complication, de ses diverses thérapeutiques, mais aussi de ses méthodes de prévention est donc nécessaire. Il s’agit en effet d’un problème d’actualité en raison du vieillissement de la population, mais aussi de la mise en place de prothèses chez des patients de plus en plus jeunes dont le capital fonctionnel doit être préservé.
Le principal souci du chirurgien sera de redonner à ces patients la possibilité de se remettre en charge sur une prothèse stable et indolore dans les meilleurs délais.
De nombreuses classifications des fractures fémorales périprothétiques ont été proposées, celle de Vancouver décrite par Duncan paraît la mieux adaptée
car elle prend en compte le siège du trait de fracture, la stabilité de l’implant et la qualité du stock osseux.
De nombreuses attitudes thérapeutiques ont été proposées, en général on procède soit à l’ostéosynthèse soit au remplacement prothétique. Le meilleur traitement repose sur la prévention de ces fractures et donc sur la connaissance des situations à risque.
Notre étude va traiter de manière analytique et comparative trois cas de fractures fémorales sur prothèse totale de hanche au sein du service de traumatologie-orthopédie à l’hôpital Ibn Sina de Rabat, ainsi que les problèmes de prise en charge thérapeutique rencontrés entre 2006-2008.
R
APPELS
1/ RAPPEL HISTORIQUE
C’est en 1960 déjà que le chirurgien anglais Sir John CHARNLEY fit la 1ère
pose, avec succès, d’une PTH.
De façon classique, une PTH est faite de parties :
-la tige fémorale pénétrant le canal médullaire à l’extrémité supérieure du fémur ; porteuse à son extrémité supérieure, de la tête fémorale prothétique caractérisée par son petit diamètre en comparaison de nôtre tête fémorale anatomique.
-la cupule, ou cotyle, s’insérant dans la cavité naturelle du bassin : la cavité cotyloïdienne.
L’articulation prothétique fonctionne comme nôtre hanche par rotation de la tête fémorale dans la cavité cotyloïdienne.
2/ RAPPEL ANATOMIQUE ET PHYSIOLOGIQUE :
Le fémur est l’os le plus long du membre inférieur, le plus gros (par son volume), et le plus solide (quand on prend en compte sa résistance aux contraintes mécaniques, contraction des muscles…) du corps humain. Le fémur se compose d’un corps ( la partie centrale ou diaphyse) et de deux extrémités ou épiphyses. Un col extrêmement court unit l'extrémité supérieure à la diaphyse. Cette partie supérieure du fémur a la forme d'un 2/3 de sphère (une énarthrose) s’emboîtant dans l’acétabulum de l'os coxal. En situation proximale, on trouve deux reliefs osseux, les trochanters (le petit et le grand), permettant l’insertion des certains muscles. Ces 2 saillies ou apophyses sont en fait réservées à l'insertion de muscles qui sont chargés de faire tourner l'os sur son axe. Les épiphyses sont munies de trous nourriciers pour le passage des vaisseaux sanguins. Plus bas, la ligne âpre permet également l’insertion d'autres muscles, dont le muscle grand fessier et le muscle biceps fémoral. Distalement, on trouve
deux condyles (un médial et un latéral) et une fosse formant une articulation trochléarthrose avec le tibia et la rotule.
Dans la position debout, il n'est pas vertical, séparé par un intervalle considérable, correspondant à la largeur du bassin, mais incliné graduellement inférieurement et médialement pour se rapprocher de la ligne du centre du corps à son extrémité distale, afin de permettre à l'articulation du genou d'être le plus proche possible de la ligne de gravité du corps. Cet angle d'inclinaison varie d'une personne à l'autre, et est plus grand chez la femme que chez l'homme, dû à la largeur de son bassin. Le fémur, comme tout os long, est divisé en un corps et deux extrémités.
La coupe d'un fémur montre une cavité centrale ou médullaire contenant de la moelle jaune. Cette cavité est entourée par l'os compact. Ce dernier est enveloppée par une membrane, le périoste. La coupe des épiphyses montre de l'os spongieux riche en cavités remplies de moelle rouge. C'est à ce niveau que naissent les cellules sanguines. Les zones articulaires des épiphyses sont protégées par du cartillage artculaire.
Partie supérieure
L'extrémité supérieure du fémur est organisée en système de faisceaux partant de trois lames compactes qui sont : la lame compacte interne ou Arc d'Adams, la lame compacte externe et la lame compacte sus-cervicale. De la lame compacte interne part le faisceau trochantérien vers le grand trochanter. De la lame compacte externe, part le faisceau arciforme de Gallois vers la tête fémorale. De la lame sus-cervicale, partent des travées osseuses interne et externe. Ce système de faisceaux délimite une zone de faiblesse appelée triangle de Ward. L'union des faisceaux arciforme et trochantérien donne un système appelé système ogival.
La tête (caput femoris)
La tête a la forme de 2/3 de sphère d'environ 24 mm de rayon, et est dirigée vers le haut, vers l'intérieur et un peu vers l'avant, la majeure partie de sa convexité étant au-dessus et en avant. Sa surface est lisse, enrobée de cartilage, à l'exception d'une dépression ovoïde, la fossette de la tête (fovea capitis
derrière le centre de la tête, et donne un attachement au ligament de la tête fémorale (ligamentum capitis femoris, ancien ligament rond).
Le col (collum femoris)
Le col est un os plat pyramidal, reliant la tête avec le corps, et formant avec ce dernier un grand angle (l'angle cervico-diaphysaire). L'angle est plus grand à l'enfance. En effet, il est de 150° environ chez le nouveau-né et diminue durant la croissance. Chez l'adulte, le col forme un angle d'environ 126° avec le corps, Chez le vieillard seulement 120°. En plus de se projeter supérieurement et médialement du corps du fémur, le col se projette également antérieurement (angle d'antéversion), variablement chez les individus, allant en général de 10° à 15°.
Si l'angle cervico-diaphysaire est supérieur à 130° on parle de coxa valga, et s'il est inférieur à 110° on parle de coxa vara. Plus l'angle est petit plus il y a un risque de fracture du col du fémur (fréquence élevée chez le vieillard).
Les trochanters
Les trochanters sont des bosses-sphères proéminantes qui offrent un bras de levier aux muscles rotateurs de la cuisse. On retrouve deux trochanters : le grand et le petit.
Grand trochanter
Le grand trochanter (trochanter major) est une éminence quadrilatérale située à la jonction du col avec la partie supérieure du corps. Il est situé légèrement latéralement et postérieurement et, chez l'adulte, est environ 1 cm plus bas que la tête. Il a deux surfaces et quatre arêtes. La surface latérale sert d'insertion au muscle moyen glutéal (gluteus medius, ancien muscle fessier moyen). La surface médiale, plus petite que la latérale, présente à sa base une dépression, la fosse
trochantérique (fossa trochanterica, ancienne fossette digitale), où le tendon du
muscle obturateur externe (obturator externus). Au-dessus et en avant se trouvent le lieu de l'attachement de l'obturateur interne et des muscles jumeaux. L'arête supérieure est le lieu d'insertion du muscle piriforme. L'arête inférieure donne naissance à la partie supérieure du vaste latéral (vastus lateralis). L'arête
antérieure est proéminente, le muscle petit glutéal (gluteus minimus, ancien petit fessier) s'y rattachant.
Petit trochanter
Le petit trochanter (trochanter minor) est une éminence conique qui varie en grosseur chez différents individus. Il projette de la partie inférieuropostérieure de la base du col. À son sommet s'attache le tendon du muscle ilio-psoas.
Tubercule
Une proéminence, le tubercule du fémur, se trouve à la jonction de la partie supérieure du col et du grand trochanter. Il est le lieu d'attache de cinq muscles : muscle petit fessier latéralement, le vaste latéral en dessous et le tendon de l'obturateur interne et des deux gemilli au-dessus.
Ligne intertrochantérique
Descendant obliquement et médialement du tubercule, elle offre un attache au ligament ilio-fémoral de la hanche. Sa partie inférieure donne origine à la partie supérieure du vaste médial (vastus medialis). La ligne quadrate (linea quadrata) est le lieu d'origine du quadriceps fémoral (quadratus femoris) et de quelques fibres du muscle grand adducteur.
Partie postérieure
Le corps
Le corps comprend trois faces : antérieure, postérieure et postéro-interne.
La linea aspera (ou ligne âpre)
La linea aspera ou ligne âpre est une crête osseuse s'étendant verticalement sur la hauteur du fémur, trifurquant en haut et bifurquant en bas. Elle se trouve entre les faces postérieure et postéro-externe du corps du fémur. Elle se compose de deux lèvres qui s'évasent en haut et en bas mais se rejoignent sur toute la partie moyenne de l'os. On décrit une lèvre médiane et une latérale. Sur la lèvre médiane s'insère le muscle vaste médian du quadriceps, alors que sur la lèvre latérale s'insèrent le muscle vaste latéral du quadriceps, le muscle grand fessier et le muscle biceps fémoral par son ventre court. Entre les deux lèvres s'insèrent les différents muscles adducteurs de la cuisse. À cela s'ajoute la branche moyenne, de trifurcquation, sur laquelle s'insère le muscle pectiné.
Partie distale
L'épiphyse distale du fémur supporte : la surface patellaire (facies patellaris, ancienne trochlée fémorale), surface articulaire avec la patella , et les condyles, deux éminences latérales.
La surface patellaire
Elle est située à la partie ventrale de l'épiphyse distale du fémur, et a une forme de poulie, avec 2 facettes convexes (de haut en bas et transversalement) : une facette latérale et une facette médiale, de tailles inégales, se poursuivant en bas
par les condyles et séparées par une gorge. La joue externe est toutefois plus convexe, plus large, plus haute et plus saillante.
Les condyles
Les condyles sont des surfaces articulaires situées à l'extrémité inférieure du fémur. Les deux condyles sont séparés par une fosse intercondylienne.
Le condyle médial
Le condyle médial se situe sur la tubérosité interne du fémur.
Le condyle latéral
M
ATERIELS ET
M
ETHODES
Notre étude porte sur trois cas de fractures périprothétiques que voici le détail de leurs observations cliniques.
Cas n °1
Il s’agit de madame RH âgée de 66 ans. -Les antécédents pathologiques :
-cardiopathie droite sous traitement. -diabétique sous ADO.
-cholécystectomisée il y a 7 ans.
-porteuse de PTH il y a 5 ans du côté droit suite à une fracture du col.
-les circonstances de la fracture : chute de sa hauteur douleur + impotence fonctionnelle totale + sans ouverture cutanée admise le jour même aux urgences.
-L’examen à son admission retrouve une patiente en assez bon état général, eupnéïque, apyrétique, TA=120/80 mmhg.
-l’examen ostéo-articulaire trouve :
- une déformation de la hanche droite sans ouverture cutanée.
- une douleur intense à la mobilisation passive et active. - un membre inférieur droit en rotation externe.
- articulation controlatérale saine. - le reste de l’examen est normal. -l’examen cardiovasculaire trouve :
- tous les pouls sont conservés.
- pas de signes de décompensation cardiaque droite. -l’examen neurologique a montré une sensibilité et une motricité conservées du membre atteint.
-l’examen respiratoire trouve :
-pas déformation thoracique à l’inspection. -vibrations vocales bien transmises.
-murmure vésiculaire bien perçu. -ampliation thoracique à +4cm. -l’examen urogénital trouve :
-patiente ménopausée depuis 16 ans sans traitement substitutif.
-G5P5.
-pas de signes physiques d’incontinence urinaire. -anamnèse infectieuse négative.
-pas de contact lombaire. -l’examen digestif trouve :
-abdomen souple respire normalement.
-pas de sensibilité ni de voussure ni de masse palpable. -pas de matité declive à la percussion.
-pas d’HSMG flèche hépatique à 11cm. -les orifices herniaires sont libres.
-toucher rectal normal.
-l’examen des aires ganglionnaires ne trouve pas d’ADP périphérique. -l’examen de l’aire thyroïdienne trouve :
-pas de signes d’hypo ou d’hyperthyoïdie à l’anamnèse -pas de déformation cervicale.
-pas de goitre.
-pas de souffle ni de thrill à l’auscultation.
Paraclinique
Une simple radiographie du bassin a permis de poser le diagnostic de fracture fémorale sur PTH et de la starifier selon la classification de Johansson ( 5 ).
Le traitement chirurgical
-Patiente sous anesthésie générale en décubitus latéral gauche. -Voie d’abord postéro-externe de Moore.
-Ouverture de l’aponévrose du fascia. -Ouverture de l’articulation de la hanche. -Abord de la fracture du fémur :
-Avirement des berges. -Ablation du ciment.
-On chasse la tige du fémur du bout proximal du fémur.
-Abord du cotyle : ablation du cotyle + avirement de berge du cotyle. -Mise en place de l’anneau de Kaboul.
-Mise en place d’une tige de taille moyenne au niveau du fémur. -Mise en place d’une plaque de fémur 12 trous, 08 vis.
-Mise en place de la tête fémorale à col long. -Réduction de la tête dans le cotyle.
-Lavage abondant.
-Fermeture plan par plan sur 2 redons aspiratifs.
Cas n°2
Madame T.A âgée de 63 ans admise au service pour prise en charge d’une reprise de PTH gauche.
-ATCD : -césarienne il y a 45 ans pour MFIU.
-opérée il y a 13 ans pour PTH gauche suite à une fracture du col fémoral secondaire à une ostéoporose.
-rhinite allergique traitée médicalement il y a 3 ans.
-Circonstances de la fracture : chute de sa hauteur avec réception sur la hanche gauche.
-Admise le jour même aux urgences.
-L’examen à son admission retrouve : -une patiente en assez bon état général.
-eupnéique ,apyrétique. -état hémodynamique stable.
-L’examen ostéo-articulaire retrouve :
-déformation de la cuisse gauche. -pas d’ouverture cutanée.
-membre inférieur gauche en rotation externe.
-la mobilisation du membre impossible.
-L’examen neurologique ne trouve pas de déficit sensitivo-moteur. -L’examen cardio-vasculaire trouve :
- des pouls conservés. - B1 et B2 bien perçus
- pas de souffle à l’auscultation.
-l’examen respiratoire trouve :
-pas déformation thoracique à l’inspection. -vibrations vocales bien transmises.
-murmure vésiculaire bien perçu. -ampliation thoracique à +3cm. -l’examen urogénital trouve :
-patiente ménopausée depuis 16 ans sans traitement substitutif.
-G7P5.
-pas de signes physiques d’incontinence urinaire. -anamnèse infectieuse négative.
-pas de contact lombaire. -l’examen digestif trouve :
-abdomen souple respire normalement.
-pas de sensibilité ni de voussure ni de masse palpable. -pas de matité declive à la percussion.
-pas d’HSMG flèche hépatique à 12cm. -les orifices herniaires sont libres.
-toucher rectal normal.
-l’examen des aires ganglionnaires ne trouve pas d’ADP périphérique. -l’examen de l’aire thyroïdienne trouve :
-pas de signes d’hypo ou d’hyperthyroïdie à l’anamnèse -pas de déformation cervicale.
-pas de goitre.
-pas de souffle ni de thrill à l’auscultation.
-la bandelette urinaire est négative.
Paraclinique
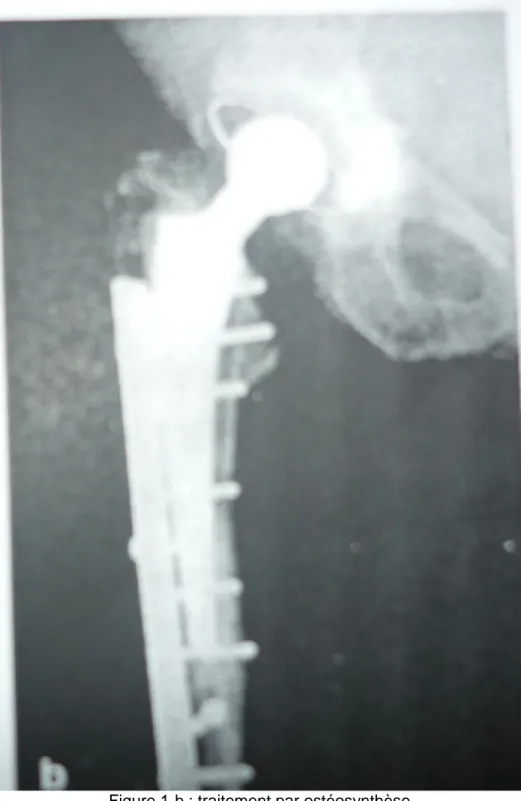
-Une simple radiographie du fémur gauche pose le diagnosic de fracture du 1/3 sup de la tige fémorale type II (voir fig 2) avec descellement fémoral associé.
-Le bilan pré-opératoire : -Rx du thorax : normale. -TP : 93% TCA : 37/32 sec -urée =0,23 créat=7,1 K+=4,32 -ECG : normal.
Le traitement chirurgical
-Patiente sous anesthésie générale en décubitus latéral droit. -Voie d’abord postéro-externe de Moore.
-Ouverture de l’aponévrose du fascia. -Ouverture de l’articulation de la hanche. -Abord de la fracture du fémur :
-Avirement des berges. -Ablation du ciment.
-On chasse la tige du fémur du bout proximal du fémur.
-Abord du cotyle : ablation du cotyle + avirement de berge du cotyle. -Mise en place de l’anneau de Kaboul.
-Mise en place d’une tige de taille moyenne au niveau du fémur. -Mise en place d’une plaque de fémur 12 trous, 08 vis.
-Mise en place de la tête fémorale à col long. -Réduction de la tête dans le cotyle.
-Lavage abondant.
-Ferméture plan par plan sur 2 redons aspiratifs.
Cas n°3 :
Madame R.D. âgée de 70 ans admise au service pour prise en charge de fracture du fémur droit sur PTH.
-ATCD : -suivie pour HTA depuis 20 ans sous traitement.
-diabétique sous ADO depuis 15 ans compliqué de néphropathie diabétique.
-opérée il y a 10 ans pour PTH droite suite à une fracture traumatique de la hanche droite (AVP).
-Circonstances de la fracture : un traumatisme minime. -Admise le lendemain de l’accident aux urgences.
-L’examen à son admission retrouve :- une patiente en mauvais état général. -apyrétique, eupnéique.
-TA=16/08 cmHg. -L’examen ostéo-articulaire trouve :-pas d’ouverture cutanée.
-déformation de la cuisse droite. -mobilisation presque impossible. -membre inférieur droit en rotation externe.
-L’examen neurologique ne trouve pas de déficit sensitivo-moteur.
-l’examen cardiovasculaire trouve :
- B1 et B2 bien perçus, pas de souffle surajouté. - tous les pouls sont conservés.
-l’examen respiratoire trouve :
-pas déformation thoracique à l’inspection. -vibrations vocales bien transmises.
-murmure vésiculaire bien perçu. -ampliation thoracique à +3,5cm.
-l’examen urogénital trouve :
-patiente ménopausée depuis 23 ans sans traitement substitutif.
-G4P3.
-pas de signes physiques d’incontinence urinaire. -anamnèse infectieuse négative.
-pas de contact lombaire. -l’examen digestif trouve :
-abdomen souple respire normalement.
-pas de sensibilité ni de voussure ni de masse palpable. -pas de matité declive à la percussion.
-pas d’HSMG flèche hépatique à 11cm. -les orifices herniaires sont libres. -toucher rectal normal.
-l’examen des aires ganglionnaires ne trouve pas d’ADP périphérique. -l’examen de l’aire thyroïdienne trouve :
-pas de signes d’hypo ou d’hyperthyroïdie à l’anamnèse -pas de déformation cervicale.
-pas de goitre.
-pas de souffle ni de thrill à l’auscultation.
Paraclinique
-Une simple radiographie du bassin a suffit pour poser le diagnostic de fracture du tiers moyen du fémur droit type II. (voir figure 4)
-Un bilan pré-opératoire : -Rx de thorax : normal. -ECG : normal.
-urée=0,30 créat=7,6 K+=4,5 -cycle glycémique : normal. ,
- Hb=13g/dl GB=7300 PLQ=230000.
Le traitement chirurgical :
-Patiente sous anesthésie générale en décubitus latéral gauche. -Voie d’abord postéro-externe de Moore.
-Ouverture de l’aponévrose du fascia. -Ouverture de l’articulation de la hanche. -Abord de la fracture du fémur :
-Avirement des berges. -Ablation du ciment.
-On chasse la tige du fémur du bout proximal du fémur droit.
-Abord du cotyle : ablation du cotyle + avirement de berge du cotyle. -Mise en place de l’anneau de Kaboul.
-Mise en place d’une tige de taille moyenne au niveau du fémur. -Mise en place d’une plaque de fémur 12 trous, 08 vis.
-Mise en place de la tête fémorale à col long. -Réduction de la tête dans le cotyle.
-Lavage abondant.
-Fermeture plan par plan sur 2 redons aspiratifs.
dd
D
ISCUSSIONI - Classification des fractures
Etudier les fractures du fémur associées à l’existence d’une prothèse de
hanche, c’est déjà se heurter à un problème de classification.
Ces fractures révèlent, en effet, d’une grande complexité et d’une grande variété, et il est important de pouvoir les classer en grands groupes pour lesquels l’orientation thérapeutique pourra être codifiée.
Il existe dans la littérature deux grands types de classification des fractures du fémur porteur d’implant fémoral :
-Des classifications basées sur la hauteur du trait par rapport à l’anatomie descriptive du fémur. On les nommera anatomiques.
-Des classifications basées sur la hauteur du trait par rapport à l’extrémité distale de l’implant fémoral. On les nommera prothétiques.
A/ CLASSIFICATIONS ANATOMIQUES
Chronologiquement les plus anciennes, elles apparaissent avec la description des fractures sur implants de Moore ou de Thompson.
L’émergence puis la généralisation des PTH, et l’utilisation du ciment lors de leur réalisation va entraîner une augmentation de m’incidence et de la variété de ces fractures. Mais les descriptions demeurent toujours anatomiques, distinguant les fractures du tiers proximal, moyen et distal du fémur.
-En 1964, PARRISH (25), à propos de 9 cas de fractures survenant entre 6 semaines et 4 ans après arthroplastie sans ciment décrit 4 groupes.
-Fracture en zone trochantérienne. -Fracture en zone proximale du fût. -Fracture en zone moyenne du fût. -Fracture en zone distale du fût.
-En 1977, ALIKHAN (26), à propos de 17 fractures peropératoires note que le tiers supérieur du fémur est majoritairement touché avec deux types de traits différents :
-Oblique court. -Oblique long. Il trouve des fractures :
-de l’extrémité supérieure du fémur obliques courtes et obliques longues dont le trait descend au niveau d’une queue prothétique standard.
-du tiers moyen. -du tiers inférieur.
-VAN ELEGEM (27) en 1979, après avoir insister sur la différence fondamentale entre fracture per- et post-opératoire, décrit une classification en trois secteurs fémoraux ainsi définis :
-Proximal, oblique long ou court, mais incluant la queue de l’imlant.
-Moyen.
B/ CLASSIFICATIONS PROTHETIQUES
Parallèlement à ces classifications anatomiques, on voit se développer d’autres classifications qui font appel à un élément fondamental : la stabilité résiduelle
de l’implant.
En effet, l’introduction du ciment pour sceller les implants introduit un nouvel
élément : la prothèse est-elle descellée par la fracture? Quelle est la stabilité résiduelle?
a/ Classification de WHITTAKER
-WHITTAKER (28) est le premier en 1974, à faire appel à ces notions à propos de 20 cas. Sa classification fait référence à la position du trait par rapport à la queue et au degré de déplacement.
Il distingue ainsi trois types :
-Type 1 : trait proximal, intertrochantérien, autour du tiers proximal de la queue, dont la stabilité est constante.
-Type 2 : trait oblique ou spiral, autour de l’extrémité de la tige, mais où la queue reste dans la cavité centro-médullaire et stabilise les fragments.
-Type 3 : sévèrement déplacée et instable, où la queue est délogée du fémur distal.
b/ Classification de HARRINGTON
-HARRINGTON (29) en 1977 et 1979, reprend cette classification et publie 30 cas. Il souligne, lui aussi, le rôle prédominant de la stabilité de l’implant puisque, pour lui, le type 2 évolue toujours favorablement quelque soit le traitement, grâce à l’effet « tuteur » que la queue prothétique y joue.
On le voit, c’est la classification du trait par rapport à l’extrémité de l’implant fémoral qui déterminera la stabilité.
c / Classification de JOHANSSON
-C’est JOHANSSON (5), en 1981, qui, à propos de 37 fractures (23 per-opératoires et 14 post-per-opératoires), propose clairement une classification en trois types par rapport à l’embase fémorale.
-Type 1 : trait en amont du bout de la prothèse fémorale, la prothèse assurant une certaine stabilité osseuse.
-Type 2 : trait en amont du bout de la prothèse, ou à cheval, l’extrémité de l’implant étant « déchaussée » du canal médullaire distal et ne stabilisant pas la fracture.
d/ Classification de BETHEA
-BETHEA (23), en 1982, classant 31 fractures, propose également trois types en tenant compte de l’orientation et du type du trait de fracture.
-Type A : fracture transversale ou spiroïde au niveau de la partie distale de prothèse fémorale.
-Type B : fracture spiroïde autour de la prothèse fémorale. -Type C : fracture comminutive autour de la prothèse fémorale.
LOWENHIELM (3) y adjoint en 1988 deux autres types :
-Type D : fracture transversale du tiers moyen au-delà de l’extrémité de la tige. -Type E : fracture supra-condylienne.
En fait, dans le bilan radiologique, deux éléments doivent être recherchés :
-Le niveau de la fracture par rapport à la prothèse. Le trait est-il à son niveau, ou à distance ?
-Les signes de descellement clinique (hanche douloureuse auparavant), et radiologique. Ce descellement pouvant être préfracturaire ou induit par le traumatisme qui descelle le fourreau de ciment.
e/ Classification de ROFFMAN
-ROFFMAN (30), en 1989, sur une petite série de 7 cas, décrit ainsi une classification basée sur la seule stabilité prédictive de l’implant après la fracture. Il définit trois groupes :
-Groupe 1 : Ancrage stable de l’implant.
-Groupe 2 : Il existe une interruption de l’interface os-ciment sur la majorité de l’implant. Seule la chirurgie de révision est autorisée.
-Groupe 3 : Trait distal par rapport à l’implant.
D’autres auteurs tentent d’associer dans leurs classifications les notions anatomiques (type de trait, localisation), importantes pour la décision thérapeutique, le choix de la voie d’abord…et les notions de stabilité et de descellement qui conditionnent l’avenir de l’implant.
f/ Classification de COOKE
-Ainsi COOKE (31), en 1988, propose une classification basée sur une des grandes séries de fractures post-opératoires sur embase cimentée publiées (75 cas). Il distingue quatre types :
-Type 1 : trait comminutif péri-prothétique entraînant toujours instabilité et descellement.
-Type 2 : trait oblique ou spiroïde autour du fût prothétique mais où la prothèse reste stable.
-Type 3 : Trait transversal en bout de queue, instable, mais où la tige prothétique reste scellée.
g/ Classification de SEROCKI
-SEROCKI (32), en 1992, à propos de 10 cas, fait, lui aussi, état d’une classification originale dérivée de celles de BETHEA (6) et de JOHANSSON (35). Elle comprend également quatre types :
-Type 1 : trait proximal, avec stabilisation intra-médullaire des fragments par la prothèse.
-Type 2 : trait en bout de queue, sans stabilité franche, car il existe toujours un refond proximal.
-Type 3 : trait distal, sans atteinte de l’implant. -Type 4 : trait comminutif en bout de prothèse.
h/ Classification de l’American Academy of Orthopaedic Surgeons
Cette classification (21) est plus complexe. Elle repose sur la division du fémur en trois parties et la description de six types de fractures :
Niveau 1 : portion du fémur située au dessus du petit trochanter
-type I : trait proximal par rapport à la ligne intertrochantérienne. -type II : trait vertical ou spiroïde ne dépassant pas le petit trochanter.
Niveau 2 : portion du fémur s’étendant 10cm au dessous du petit trochanter
-type III : trait vertical ou spiroïde dépassant le petit trochanter au-delà du niveau 3.
Niveau 3 : portion du fémur au-delà du niveau2 (sup à 10cm sous le petit
trochanter).
-type IV : trait à hauteur de l’extrémité distale de tige ; -IVA : spiroïde.
-IVB : transverse ou oblique court.
-type V : fracture comminutive située à hauteur du niveau 2 ou 3. -type VI : trait situé au-delà de l’extrémité distale de la prothèse.
Cette classification semble complexe. Elle possède l’avantage de s’adapter à un éventail extrêmement large de fractures que celles-ci soient per- ou postopératoires mais ne tient pas compte de la qualité de l’os.
i/ Classification de Vancouver
Plus récemment la classification de Vancouver décrite par Ducan et Masri (24) prend en compte le siège du trait de fracture, la stabilité de l’implant et la qualité du stock osseux. Elle paraît la mieux adaptée pour discuter l’indication thérapeutique.
Ainsi dans cette classification les types suivants sont décrits (voir schéma ci-aprés ).
1. type A : Trait situé à la partie proximale de la prothèse ;
-AG si le grand trochanter est concerné.
-AL si c’est le petit.
2. type B : Trait situé autour de l’extrémité distale de la tige ;
-B1 : tige non descellée.
-B2 : tige descellée.
-B3 : tige descellée et perte de substance osseuse. 3. type C : Trait situé au-delà de l’extrémité distale de la pièce fémorale ;
-soit à distance : C1
-soit à proximité : C2
Le type B2 de cette classification comprend aussi les cas où la prothèse n’était pas descellée avant la fracture mais où celle-ci rend manifestement la situation instable avec un descellement potentiel.
j/ Capital osseux fémoral
Quelque soit la classification adoptée, il paraît utile de qualifier l’état du fémur au regard de l’état osseux par exemple avec la classification lésionnelle de la SOFCOT précisée lors du symposium de 1999 (13). Cette classification reconnaît :
- un stade 0 et un stade I s’il y a peu de lésion osseuse ;
- un stade II si une corticale est très amincie sur toute la hauteur de la tige ;
- un stade III lorsqu’une corticale est en partie détruite ;
- un stade IV lorsque le fémur est pellucide ou avec disparition d’une zone corticale étendue.
Cela permet de préciser le type B1 et surtout B2 de la classification des fractures selon Ducan.
La multiplicité des classifications proposées témoigne, on le voit, de la complexité des problèmes posés lors de ces fractures.
Le but de toute classification, qui est de regrouper des patients, qui posent les mêmes problèmes, afin de dégager des options thérapeutiques claires impse une grande simplicité de tri.
Certaines classifications, qui créent des sous-groupes inutles, doivent être écartées.
Pour nous, la classification de VANCOUVER apparaît la plus adaptée à une étude comparative, car elle est la plus utilisée dans la littérature,
DE BEER (33), STERN (34), VICHARD (35), VAN ELEGEM (74), ZENNI (83), BARFOD (36), CHRISTENSEN (37), DYSART (38), OLERUD (39).
II- Epidémiologie
Dans ce chapitre, on étudiera juste les fractures post-opératoires. A/ Fréquence
Secard en estime la fréquence aux «alentours » de 0,1% et, de toute façon, inférieure à 0,6%.
On observe, cependant une tendance à l’augmentation au fil des années dans les différentes séries publiées. De 0,1 à 0,3% dans les séries des années 70 ( Mc ELFRESH (46), DOBBS (20) à 0,5% dans les séries les plus récentes (COURPIED (22)).
Cela tient , probablement, à l’augmentation du nombre de patients porteurs d’une arthropastie totale de hanche (60000 implants posés chaque année en France), mais à l’accroissement du nombre des arthroplasties itératives, qui créent certainement des conditions locales favorisantes.
Le tout étant, bien sûr, lié à l’allongement considérable de l’espérance de vie au cours des quarante dernières années à l’échelle mondiale. De 68,4 années en 1957, on est passé à 82,6 années en 2007, soit plus de dix années de vie gagnées en 50 ans. Par conséquent, un grand nombre de prothèses, implantées en primaire à l’âge de 60 ou 70 ans dans les années 60-70, ont été reprises 10 ou 15 ans après, chez des vieillards dont on n’attendait pas, au départ, qu’ils dépassent les 80 ans en si grand nombre…
A cela, il faut ajouter la mise en place de prothèse chez des patients de plus en plus jeunes. Déjà, CHARNLEY (10), en 1975, imputait certaines fractures de l’implant à l’hyper-activité de ses patients, liée au très bon résultat clinique apporté par l’arthroplastie.
Mc ELFRESH (46), lui aussi, évoque l’augmentation de l’activité des patients après le geste arthroplastique qui leur rend une indolence et une mobilité qu’ils n’avaient pas connue depuis souvent bien des années.
La prothèse induit des complications en autorisant la reprise d’activité « à risque ».
En fait, c’est l’évolution globale de notre société qui favorise la lente augmentation du nombre de fractures post-opératoires.
D’une part, l’augmentation constante du nombre de prothèses qui découle de l’augmentation de la durée de vie, de la qualité des soins, et d’autres part l’existence de conditions favorisantes (ostéoporose, violence des traumatismes..) participent à cette progression lente, mais inéluctable.
B/ Délai de survenue
La plupart des auteurs s’accordent pour une fourchette allant de un an (Mc ELFRESH (46) : 10,7 mois; WHITTAKER (28) : 70% à 1 an) à prés de 4 ans (ZENNI (18) : 46 mois en moyenne ; COOKE (31) : 3,6 ans).
LÖWENHIEM (3), dans un article publié en 1989, étudie l’incidence de fractures du membre inférieure (toutes fractures confondues, du bassin à la cheville) après PTH. Elle varie de 0 à 12,4% avec un pic de fréquence aux alentours de la dixième année post-opératoire. Cette étude, à la méthodologie discutable, ne doit être prise en compte qu’avec circonspection.
C/ Age des patients
Les âges de survenue sont très variables dans la littérature. L’âge moyen des femmes est constamment supérieur d’une dizaine d’année à celui des hommes (ADOLPHSON (20), ALIKHAN (26)).
Pour les fractures à distance de l’arthroplastie, l’âge de survenue est beaucoup plus avancé :
-75 ans pour HARRINGTON (29). -84 ans pour BARFOD (36). -81 ans pour KOLMERT (40). -77 ans pour MSIKA (41). -82 ans pour STERN (34).
-71 ans pour ZENNI (18).
Il est en général supérieur à 70 ans, et peut atteindre 84 ans de moyenne pour certains.
III- Les facteurs étiologiques et facteurs de risque de fractures fémorales périprothétiques
Tout d’abord il faut schématiquement connaître qu’il existe 3 types de traumatismes engendrant ces fractures :
-un traumatisme minime représenté le plus souvent par la chute de sa hauteur. -un traumatisme moyen correspondant à une chute d’environ un mètre.
-un traumatisme important comme un accident de la voie publique.
La fracture peut être secondaire à un traumatisme à haute énergie et les conditions fémorales interviennent assez peu bien que la différence d’élasticité entre la zone d’implantation prothétique et la diaphyse fémorale puisse favoriser la rupture. Très souvent en fait, il existe une fragilisation fémorale expliquant la survenue de la fracture à l’occasion d’un traumatisme minime ou la survenue d’une fracture progressive avec des douleurs croissantes pendant quelques jours puis brutalement l’impotence fonctionnelle de la fracture complétée.
Un certain nombre de facteurs de risque peuvent être appréciés.
1/ Diminution de la résistance osseuse
L’approche biomécanique :
L’os est un matériau anisotrope, plastique, visco-élastique, résistant aux
contraintes, mais fatigable.
Anisotrope :
Ses propriétés varient selon la direction des contraintes qui lui sont appliquées. Plastique :
La déformation plastique de l’os peut être considérable, jusqu’à aboutir à la rupture. Elle cependant quasi nulle lorsqu’une force est appliquée perpendiculairement à la diaphyse.
Visco-élastique :
L’os résiste d’avantage à une contrainte d’action rapide qu’à une contrainte
d’action lente.
Résistance :
L’os résiste mieux à des contraintes en compression qu’à des contraintes en traction. Ceci peut, cependant, varier selon la direction des forces appliquées et le type de l’os concerné.
La comparaison entre différents matériaux peut se faire grâce au module d’élasticité linéaire, ou module de Young.
Exemple : Os cortical : 2000kg/mm2 Acier : 20000kg/mm2
Ciment acrylique : 210kg/mm2
Ce module correspond à la contrainte qu’il faut appliquer à un matériau pour qu’il s’allonge de sa propre longueur.
Si l’on retient les variations de ce module, entre os, acier, et ciment, la logique veut que les charges, auxquelles est soumise l’extrémité supérieure du fémur, sont différemment réparties selon qu’il y a, ou non, un corps moins déformable dans l’os sous la forme d’une tige prothétique.
Ces nouvelles répartitions peuvent-elles être cause de fracture ? Travaux expérimentaux:
[Kümmer], le premier, explicite, d’aprés la théorie de Pauwels, les effets des
sollicitations sur l’extrémité supérieure du fémur.
Il appuie ses travaux sur des études photo-élastiques sur fémur sain et prothésé. Il conclut qu’une prothèse fémorale est soumise à un mouvement de bascule entraînant une très forte augmentation des contraintes sur le mur interne du moignon de col.
En l’absence de cimentation, ou en cas de descellement, ce mouvement de bascule en varus s’accentue et entraîne une résorption osseuse du Merckel et une lyse de la corticale diaphysaire externe en regard de la queue de prothèse.
[INDONG], en 1978, fait état d’une étude in vitro comparant les répartitions des
pressions sur des os de cadavres mis expérimentalement en charge, avec, et sans tige fémorale prothétique en utilisant 6 tiges différentes.
-Sur un os normal, il existe des contraintes maximales au niveau de la partie proximale du fémur qui décroissent progressivement en descendant vers la zone médiane du fût fémoral.
-Après insertion d’un composant fémoral, les contraintes se modifient, et deviennent maximales en bout de queue. Ces variations dépendent peu du diamètre de la queue, mais, par contre, l’absence de collerette annule quasiment les contraintes exercées sur le calcar et au-delà sur le col restant, et participe sans doute à la survenue de lyses du calcar observées après PTH.
Il préconise donc l’utilisation de tiges à collerettes qui, pour lui, sont les seules qui diminuent le risque de descellement et de fracture en conservant au tiers proximal du fémur prothésé un rôle quant aux transmissions des forces d’appui.
[PASSUTI], dans une étude plus récente, utilise la méthode des éléments finis,
mise au point par l’industrie, pour étudier les contraintes survenants au niveau de l’extrémité supérieure du fémur.
La modélisation du fémur et de ses déformations se fait, non pas grâce au module de Young, mais grâce à une matrice de 21 coefficients prenant en compte l’anisotropie de l’os. Elle permet de déterminer des lignes d’isocontraintes maximales.
Globalement, il confirme que l’introduction d’une prothèse rigidifie l’os et modifie le rayon de courbure du fémur : Dans l’os fémoral non prothésé, la déformation siège au tiers supérieur. A l’inverse, après implantation, la déformation apparaît au dessous de la queue de la prothèse. Il propose donc une prothèse à queue la plus courte possible, afin d’éviter de rigidifier exagérément l’os, et de respecter le caractère visco-élastique amortisseur de chocs de l’os normal.
Il démontre par ailleurs une augmentation particulière des contraintes le long de la face interne du fémur, entre l’extrémité distale de la prothèse et le condyle interne.
On peut être donc conclure qu’il existe une profonde modification structurale du fémur prothèsé, qui entraîne des pics de contrainte au niveau du calcar en cas de tige à collerette, et, dans tous les cas, en bout de queue, principalement surla corticale externe voire sur toute la partie distale du fémur.
[COURPIED], accorde une place particulière aux cas où ne persiste qu’une faible
zone fémorale d’élasticité normale entre deux parties rigides, comme on peut le rencontrer lorsqu’un fémur est porteur de deux prothèses, hanche et genou, avec
des tiges diaphysaires, ou d’une prothèse de hanche et d’une plaque condylienne.
Cette zone doit alors observer toutes les contraintes en flexion, ce qui peut souvent dépasser la résistance de l’os.
Il lui semble donc nécessaire lors de l’ostéosynthèse d’une fracture située à distance d’une tige diaphysaire, de faire chevaucher plaque et prothèse plutôt que de laisser persister un intervalle dangereux.
On peut tout d’abord, rencontrer de localisations tumorales ostéolytiques du fémur prothèsé. Ces cas, extrémement rares, ne peuvent cependant faire l’objet d’aucune prévention et ne seront pas développés dans ce travail.
Ostéoporose :
Toutes les causes d’ostéoporose sont à l’origine d’une perte des propriétés
mécanique en flexion et en compression du fémur. Ce phénomène est à l’origine de nombreuses fractures autour d’implants dont la fixation est souvent satisfaisante. Dans ce cadre les femmes ménopausées sont particulièrement exposées.
Sa grande fréquence dans la population féminine en seconde moitié de vie, et dans la population générale supérieure à 70 ans explique sans doute les caractéristiques épidémiologiques d’âge et de sexe que présentent les fractures du fémur sur prothèse.
En diminuant la densité osseuse, l’ostéoporose, qu’elle soit d’origine humorale ou iatrogène intervient à deux niveaux favorisants ces fractures :
-D’une part, par la fragilité osseuse qu’elle entraîne chez des sujets âgés, à l’équilibre parfois précaire, elle augmente le nombre de fractures du col et donc le nombra global d’implants prothétiques.
-D’autres part, elle majore la différence d’élasticité entre le segment proximal porteur d’un véritable tuteur et le segment distal.
Pathologies particulières :
Certains états pathologiques à l’origine d’une ostéopénie et donc d’une augmentation de la fragilisation osseuse sont particulièrement exposés à
l’apparition d’une fracture périprothétique. Parmi ceux-ci on peut citer : la polyarthrite rhumatoïde, l’ostéomalacie, la maladie de Paget…
Il existe par ailleurs des diminutions de la résistance osseuse par gracilité du fémur comme chez les patients souffrant de troubles neuromusculaires qui ont de plus un risque de chute plus élevé. Enfin il existe des diminutions de résistance mécanique par déformation avec notamment un canal médullaire étroit dans les séquelles de certaines pathologies de l’enfance (épiphysiolyse, ostéochondrite, arthrite, luxation congénitale).
Mais, outre ces facteurs liés aux caractères d’une population, il existe des causes de fragilisation osseuse propres aux arthroplasties. Ce sont :
2/ Implants non cimentés
Le développement de pièces fémorales non cimentées a été à l’origine d’une augmentation du nombre de fractures périprothétiques liées à la nécessité d’impacter à frottement dur de tels implants. La notion de press-fit est évidement intéressante pour favoriser la réhabitation osseuse mais comme la forme de la tige ne s’adapte jamais parfaitement à la forme du fémur les derniers millimètres d’impactation risquent de rompre la corticale en dépassant les limites d’élasticité de celle-ci. Ce type de fractures diminue avec l’expérience des opérateurs.
3/ Zone de concentration de contraintes
La présence d’un trou de vis est un facteur de concentration de contraintes à l’origine d’une diminution de la résistance osseuse pendant une durée supérieure ou égale à quatre semaines. De même l’extrémité d’une plaque de synthèse d’une fissure ou d’une fenêtre se comporte comme une zone de concentration de contrainte. (voir fig5)
A
B+C
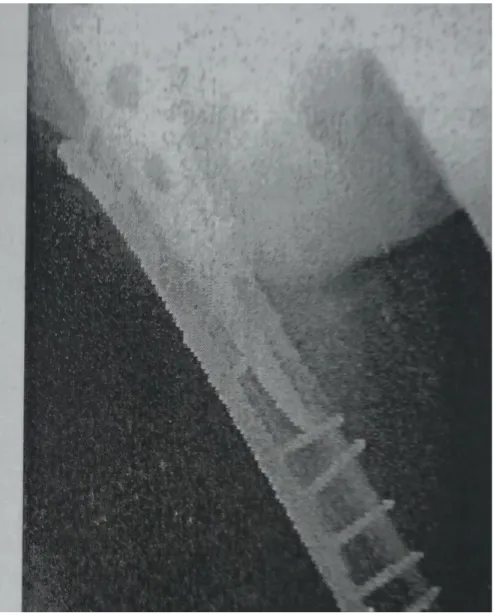
Figure5: A: fenêtre corticale externe pour curetage d’un granulome sans changement de prothèse (paris 1983) ;
B : fracture type B1 (stade lésionnel II) un an après en regard de l’extrémité de la fenêtre de 1987 ; ostéosynthèse par plaque vissée. Consolidation en 6 mois.
4/ Perte de substance corticale
De nombreux auteurs ont signalé le rôle des défauts corticaux dans la survenue de fracture périprothétique du fémur. Ces pertes de substances peuvent être liées à l’ablation d’un matériel de synthèse. Elles peuvent également se produire lors de l’ablation du ciment. La cause la plus fréquente actuellement semble être l’ostéolyse périprothétique se produisant autour d’implants descellés ou non (voir fig6). Les particules d’usure du polyéthylène sont largement incriminées dans ce processus d’ostéolyse. Ces particules se répandent d’abord dans la néo-articulation puis se rassemblent en zone déclive c'est-à-dire le calcar et la région du petit trochanter. Ensuite la migration se fait à l’interface du tissu inerte - tissu vivant c'est-à-dire entre ciment et os ou le long de la tige d’une prothèse non cimentée. L’ostéolyse est un processus ostéoclasique résultant de la réaction granulomateuse ’à corps étranger ‘ qui peut amenuiser considérablement voire détruire complètement une corticale de dedans en dehors.
Figure 6 : Chez un patient de 80ans, ostéolyse entre une tige fémorale descellée mais peu génante et une tige de prothèse de genou. Fracture (B2) (stade lésionnel II) traitée par ostéosynthèse et renforcement par baguettes d’allogreffe.
Des pertes de substance plus importantes concernant 50% de la largeur corticale réduisent la résistance en torsion de 44%. (10)
Les fractures se produisant moins d’un an après une arthroplastie sont largement associées à la création d’une fausse route peropératoire. Il est à noter que ces fausses routes sont particulièrement dangereuses lorsqu’elles sont situées sur la face externe du fémur qui est la face travaillant en traction.
La solution pour prévenir une fracture dans ce type de situation est de ponter la perte de substance d’une longueur au moins égale à deux fois la largeur diaphysaire.
5/ Descellements fémoraux
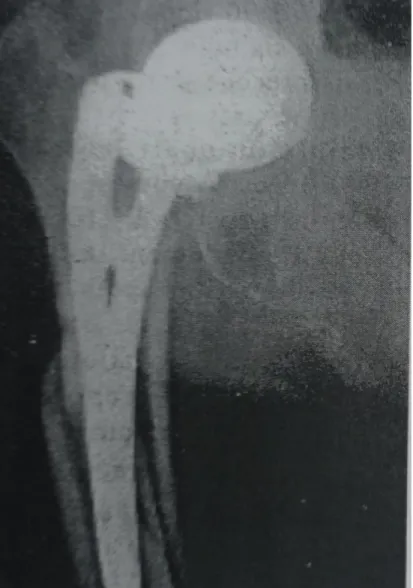
La présence d’un descellement fémoral est associée à une fracture périprothétique dans trois quarts des séries publiées. Les fractures observées autour d’implants descellés se produisent dans la partie proximale du fémur (voir fig 7). La transmission des contraintes pour un implant descellé se produit de façon non homogène entraînant une concentration de contraintes au niveau de certaines zones.
sur prothèse descellée. Reprise par changement de prothèse avec renforcement interne du fémur par allogreffe.
Bon résultat clinique et anatomique à 6 ans. (Paris 1990-1996) Schématiquement deux situations peuvent se présenter : soit le fémur est peu
altéré et deux problèmes sont à résoudre : la fracture et le changement d’implant ; soit le fémur est très altéré par une ostéolyse étendue et trois problèmes sont alors à résoudre : la fracture, le changement d’implant et la perte du stock osseux qui peut être reconstitué avec des greffes ou de façon spontanée.
6/ Chirurgie de reprise
Les reprises d’arthroplastie de hanche sont liées à un nombre élevé de fractures car plusieurs facteurs de risque sont souvent additionnés. Dans une étude de la SOFCOT en 1999 (22) il y avait 13% de fractures per-opératoires sur 1398 reprises.
7/ Raideurs articulaires :
Nous accorderons enfin une place aux ossifications péri-prothétiques. Elles surviennent dans 5 à 30% des cas selon POSTEL, et retentissent parfois sur la fonction aboutissant à des ankyloses complètes.
Nous ne discuterons pas ici de leurs causes, mais il faut souligner leur rôle favorisant les fractures, quelles qu’elles soient, en cas de traumatisme. En effet, le rôle amortissant des articulations n’est alors plus possible, et l’onde de choc se concentre sur les segments rigides et , de ce fait, les fractures.
Ainsi, AUFRANC, publie-t-il un cas de fracture chez une femme de 80 ans, 4 mois après arthroplastie. La présence d’une importante raideur de hanche liée à des ossifications hétérotopiques majorant les pics de contrainte en bout de queue.
SEGARD, lui aussi, ajoute aux autres facteurs de risque, la présence d’ossifications périprothétiques importantes.
IV- Les principes thérapeutiques
A- le traitement préventif
La prévention des fractures périprothétiques est sans doute la meilleure attitude thérapeutique.
1/ Avant l’intervention
Avant l’intervention, il faut essayer au mieux de prévoir les pièges possibles. Il faut connaître les antécédents du patient avec les interventions précédentes et apprécier les déformations osseuses, l’état du stock osseux, s’assurer qu’il n’y a pas de modification depuis la dernière consultation car parfois une ostéolyse peut s’aggraver rapidement menaçant la solidité d’une corticale. On peut souvent prévoir la difficulté de la luxation d’une hanche protruse ou de la mobilisation d’une hanche multi-opérée avec des parties molles scléreuses ou rétractées. De bonnes radiographies sont nécessaires surtout dans les reprises où il faut disposer de clichés de face et profil du fémur prenant la totalité de la région concernée par la tige, le ciment et toute zone de fragilité corticale. La taille et la situation des implants doivent être précisément prévues à l’aide de calques adaptés.
2/ Pendant l’intervention
Le chirurgien doit éviter des manipulations en force. Pour cela une bonne exposition est nécessaire surtout dans le cas d’arthroplasties itératives avec libération des parties molles souvent améliorées par une trochantérotomie plus ou moins prolongée en valve corticale externe.
a/ Ablation du ciment dans les reprises de prothèse
Il s’agit d’une phase difficile et dangereuse de l’intervention qui cherche à séparer le ciment élément dur que l’on veut détruire d’un élément fragile que l’on veut conserver intact : la corticale. Le danger est la fracture ou la perforation par
l’issue d’un outil qui progressera plus facilement dans l’élément fragile que dans l’élément dur. Le principe de l’ablation est la fragmentation du cylindre de ciment aux ciseaux à frapper utilisé de façon radiaire plutôt que de façon tangentielle. Si cette ablation ne peut être menée par voie endocanalaire à cause de l’étroitesse de la diaphyse ou de sa courbure ou encore de la longueur de cimentage il faut savoir recourir à une férotomie. Celle-ci va permettre de soulever par une valve externe ou antéro-externe le tiers ou la moitié de la circonférence corticale sur une longueur identique à celle du ciment imtracanalaire. Il faut par contre proscrire les fenêtres corticales qui sont ensuite à l’origine d’une zone de fragilité = farcteur de fracture secondaire.
De nombreux procédés de destruction du ciment par ultrasons (qui créent un échauffement local rendant le ciment pâteux) sont maintenant disponibles, mais il s’agit d’une technique très lente surtout utilisable lorsqu’on a une bonne vision de la jonction os-ciment, ce qui lui fait perdre un peu de son avantage.
En pratique, il faut utiliser les ciseaux ou les fraises avec précaution au maximum sous contrôle de la vue en s’aidant de lavage-aspiration et d’un système optique à lumière froide. Il ne faut pas hésiter à faire des radiographies peropératoires pour vérifier l’intégrité des corticales et la direction du fraisage intramédullaire.
b/ autres difficultés
_Chaque fois qu’il existe une zone de concentration de contraintes celle-ci doit systématiquement être pontée par une tige ou une allogreffe corticale d’une longueur supérieure ou égale à deux diamètres corticaux.
_En cas de fissure peropératoire l’utilisation de cerclage est recommandée pour éviter la propagation de la fissure et l’apparition d’une fracture. Chandler (17) ajoute à cette mesure préventive des renforcements par baguette d’allogreffe. _Eviter les fenêtres fémorales et savoir utiliser les fémorotomies longitudinales et tendues.
_Lors du scellement de la tige fémorale on veillera à ne pas utiliser le ciment trop tardivement afin d’éviter les chocs violents du marteau pour la positionner.
_Une radiographie de contrôle doit être faite en fin d’intervention et si une fausse route est découverte, il vaut mieux y remédier immédiatement que le regretter quelques semaines plus tard devant une fracture complétée.
3/ Après l’intervention
Après l’intervention, il faut conseiller le patient pour que la reprise de l’activité soit progressive et adaptée à la situation mécanique du fémur.
En cas de survenue de luxation des manœuvres de réduction doivent être faites en songeant à une éventuelle fragilité du fémur
Les patients porteurs d’arthroplastie de hanche doivent être suivis régulièrement notamment pour détecter et surveiller une ostéolyse corticale afin de permettre une reprise avant qu’une fragilisation osseuse excessive ne puisse conduire à une fracture. Cette surveillance devra aussi s’attacher à la prévention de l’ostéoporose ce qui nécessite un dépistage par une ostéoden- sitométrie chez les sujets à risque et un traitement actuellement fondé sur l’hormonothérapie substitutive chez la femme et l’emploi de dérivés calciques et de diphosphonates.
Enfin, il faut insister sur la prévention des chutes chez les sujets âgés qui consiste à appliquer un programme de rééducation adaptée après une 1ère chute mal expliquée.
B/ Le traitement curatif
Le but du traitement est de permettre la consolidation du fémur en bonne position avec une prothèse stable et le recours à une fonction de la hanche au moins égale à celle qui existait avant la fracture. De plus, il faut essayer de reconstituer au mieux le stock osseux souvent défaillant.
1/ Méthodes non opératoires a/ mise en décharge
La mise en décharge entre deux cannes anglaises est parfois proposée. Cette solution fait partie des suites habituelles en l’absence de complication. La durée de la décharge varie de 4 à 8 semaines.
b/ Traction
La durée de la traction varie de 2 à 3 mois. Cette méthode est associée à une morbidité importante due aux complications de décubitus ainsi qu’à un taux important de pseudarthrose, cal vicieux et raideur. Elle n’évite pas toujours le recours à la chirurgie (un tiers des cas selon la série de Aldophson (20)). Elle est parfois suivie d’une immobilisation plâtrée.
2/ Méthodes opératoires
a/ Ostéosynthèse par plaque
Il s’agit sans doute de la méthode la plus fréquemment utilisée. Elle permet en effet, une réduction anatomique et une mobilisation précoce. Le taux de pseudarthrose est extrêmement faible. La reprise de l’appui est a lieu entre 3 et 6 mois après la synthèse. Cependant certains inconvénients de la synthèse par plaque vissée ont été signalés :
-difficulté d’obtenir une fixation solide autour de la tige. -risque de fracture du ciment lors du forage de celui-ci. -résorption sous la plaque.
Pour ces raisons, des plaques dont la fixation n’utilise pas des vis au niveau de la tige ont été développées : plaques d’Ogden dont la partie proximale se fixe par des cercles métalliques (18) ou plaques de Mennen se fixant par des clamps (19). Lorsque le montage parait précaire il est possible de le rigidifier par une allogreffe corticale (hémi-cylindre fémoral ou tibial) (17).
b/ Reprise par prothèse à longue tige
Il s’agit de la méthode de choix en cas de descellement fémoral ou de fracture peropératoire. Souvent une ostéosynthèse complémentaire par cercles ou plus rarement par plaque est nécessaire et il parait utile notamment en cas de perte de substance corticale d’ajouter des greffes pour favoriser la consolidation ( 16 ). Plusieurs techniques ont été décrites dont celle de H.Wagner améliorée par P.Vives et C.Picault ( 15 ).
c/ Reconstruction par baguette d’allogreffe corticale
Ce type de traitement est pratiqué depuis une dizaine d’années ( 14 ). Il s’agit d’allogreffe du fémur ou de tibia. Le plus souvent deux baguettes d’allogreffe représentant chacune un tiers de circonférence sont placées de part et d’autre du fémur au niveau duquel il faut conserver la vascularisation de la ligne âpre. Elles sont fixées par des cercles métalliques et elles doivent s’étendre à 10cm de part et d’autre du trait de fracture. Ce type de traitement n’entraîne pas contrairement à l’ostéosynthèse par plaque métallique l’apparition de résorption osseuse. Le greffon pourrait par ailleurs favoriser la consolidation du foyer de fracture. Il est à noter cependant que ce type de greffe n’est pas disponible dans tous les centres. Par ailleurs, le coût est élevé et le risque de transmission virale n’est pas nul malgré toutes les précautions prises.
Cette technique peut être utilisée seule ou en association avec une ostéosynthèse par plaque métallique ou une reprise de la pièce fémorale.
d/ Traitement des pertes de substance osseuse étendues
En cas d’ostéolyse réduisant dangereusement les corticales fémorales, il faut essayer d’augmenter le capital osseux. Deux méthodes peuvent être employées : - soit un comblement par des greffes morcelées impactées ce qui nécessite souvent une rigidification première du fémur par des cercles métalliques ou par des baguettes d’allogreffe corticale.
- soit un remplacement du fémur proximal par une allogreffe segmentaire massive (10) (11).
C/ Surveillance
En outre l’état clinique du malade, il est capital de réaliser des clichés post-opératoires pour détecter à temps opportun une éventuelle complication et d’y agir de façon convenable.
Les 2 principales complications à craindre sont la pseudarthrose et le descellement secondaire. De façon générale, les complications possibles sont celles des fractures du fémur et de la chirurgie prothétique.
Plusieurs études prouvent l’importance de la surveillance des malades opérés pour reprise de PTH. (12) (13)
R
ESULTASLes données de la littérature montrent que le risque cumulé de fractures postopératoires était de 25,3% à 20 ans sur une série de 1442 arthroplasties primaires cimentées ( 3 ). Parmi les données les plus fiables de la littérature de le registre de Mayo Clinic ( 4 ) indique 1249 fractures per- et postopératoires sur un total de 30329 arthroplasties cimentées et non cimentées (soit 4,1) réalisées entre 1968 et 1998. En février 2008, Daniel J.Berry, chirurgien orthopédiste et ses collaborateurs ( CHU de Rennes) ont réalisé une étude portant 7612 PTH de 1ère intention sur une période de 10 ans et ont identifié le cas de fractures péri-prothétiques survenues trois mois après des PTH réalisées essentiellement avec des tiges non cimentées. Sur la totalité des cas étudiés, 28 fractures sont survenues environ un mois après l’intervention. De plus les enquêteurs ont démontré que l’indice de ces fractures a augmenté sensiblement entre 1987 et 2007 passant de 0,14% à 0,78% .
Pour ce qui est de notre étude portant sur 3 cas de fractures fémorales sur PTH ; l’évolution a été très favorable avec :
- des clichés post-opératoires qui n’ont pas révélés de complications - une anticoagulation préventive.
- un levé précoce avec aide bien entendu.
- un retour à la position verticale en moyenne dans 3 mois et 17 jours.
La prédominance féminine constatée dans notre étude est tout à fait conforme aux données de la littérature ( 6 ). Avec un moyen d’âge de 68 ans.
Nos trois patientes ont été potentiellement candidates à un traitement chirurgical c'est-à-dire à une ostéosynthèse par plaque vissée.
Comparativement aux données de la littérature, l’indication chirurgicale a été correcte puisque Courpied et ses collaborateurs (7) définissent de manière détaillée les indications thérapeutiques selon la classification de Vancouver. Pour notre étude ;