HAL Id: dumas-02078664
https://dumas.ccsd.cnrs.fr/dumas-02078664
Submitted on 25 Mar 2019HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Distributed under a Creative Commons Attribution - NonCommercial - NoDerivatives| 4.0 International License
Sensibilité des indicateurs écosystémiques à la pression
de pêche : modélisation trophique, analyse de réseau et
application en Baie de Seine
Juliette Champagnat
To cite this version:
Juliette Champagnat. Sensibilité des indicateurs écosystémiques à la pression de pêche : modélisation trophique, analyse de réseau et application en Baie de Seine. Sciences du Vivant [q-bio]. 2018. �dumas-02078664�
Sensibilité des indicateurs écosystémiques à
la pression de pêche : modélisation trophique,
analyse de réseau et application en Baie de
Seine
Par : Juliette CHAMPAGNAT
Soutenu à Rennes le 13/09/2018
Devant le jury composé de :
Président (Enseignant référent) : Didier Gascuel
Maître de stage : Frida Ben Rais Lasram et
Nathalie Niquil
Autres membres du jury :
Marie Savina-Rolland (Chercheur IFREMER Lorient)
Pierre-Yves Hernvann (Enseignant chercheur Agrocampus Ouest)
Les analyses et les conclusions de ce travail d'étudiant n'engagent que la responsabilité de son auteur et non celle d’AGROCAMPUS OUEST AGROCAMPUS OUEST CFR Angers CFR Rennes Année universitaire : 2017-2018 Spécialité : Ingénieur agronome Spécialisation (et option éventuelle) : Sciences halieutiques et aquacoles (Ressources et écosystèmes aquatiques)
Mémoire de Fin d'Études
d’Ingénieur de l’Institut Supérieur des Sciences agronomiques, agroalimentaires, horticoles et du paysage
de Master de l’Institut Supérieur des Sciences agronomiques, agroalimentaires, horticoles et du paysage
d'un autre établissement (étudiant arrivé en M2)
Ce document est soumis aux conditions d’utilisation
«Paternité-Pas d'Utilisation Commerciale-Pas de Modification 4.0 France»
(1) L’administration, les enseignants et les différents services de documentation d’AGROCAMPUS OUEST s’engagent à respecter cette confidentialité.
(2) Signature et cachet de l’organisme
(3).Auteur = étudiant qui réalise son mémoire de fin d’études
(4) La référence bibliographique (= Nom de l’auteur, titre du mémoire, année de soutenance, diplôme, spécialité et spécialisation/Option)) sera signalée dans les bases de données documentaires sans le résumé
Confidentialité
Non Oui si oui : 1 an 5 ans 10 ans
Pendant toute la durée de confidentialité, aucune diffusion du mémoire n’est possible (1).
Date et signature du maître de stage (2) : 28/08/2018 Frida Lasram
(ou de l’étudiant-entrepreneur)
A la fin de la période de confidentialité, sa diffusion est soumise aux règles ci-dessous (droits d’auteur et autorisation de diffusion par l’enseignant à renseigner).
Droits d’auteur
L’auteur(3) Champagnat Juliette autorise la diffusion de son travail (immédiatement ou à la fin
de la période de confidentialité)
Oui Non
Si oui, il autorise
la diffusion papier du mémoire uniquement(4)
la diffusion papier du mémoire et la diffusion électronique du résumé la diffusion papier et électronique du mémoire (joindre dans ce cas la fiche de conformité du mémoire numérique et le contrat de diffusion)
accepte de placer son mémoire sous licence Creative commons CC-By-Nc-Nd (voir Guide du mémoire Chap 1.4 page 6)
Date et signature de l’auteur : le 29/09/2018 Juliette Champagnat
Autorisation de diffusion par le responsable de spécialisation ou son représentant
L’enseignant juge le mémoire de qualité suffisante pour être diffusé (immédiatement ou à la fin de la période de confidentialité)
Oui Non
Si non, seul le titre du mémoire apparaîtra dans les bases de données. Si oui, il autorise
la diffusion papier du mémoire uniquement(4)
la diffusion papier du mémoire et la diffusion électronique du résumé la diffusion papier et électronique du mémoire
Date et signature de l’enseignant :
Remerciements
Je tenais à remercier en premier lieu Frida et Nathalie, mes encadrantes de stage. Elles m’ont guidé dans ce projet de stage tout en me laissant la liberté d’en faire ce qui me plaisait : merci pour cette confiance. Merci Frida pour les discussions et conseils tout au long du stage, et merci pour les « prises de décision » lorsque j’étais perdue. Merci Nathalie pour ton encadrement à distance, tes conseils pertinents et ta disponibilité.
Je remercie également Ghassen, Emma et Pierre, qui sans être mes encadrants ont été des soutiens solides. Merci Ghassen pour ta disponibilité et tes réponses toujours patientes au millier de questions que j’avais sur le modèle. Merci la « team Frida » : Pierre pour ton aide et tes conseils avisés en modélisation trophique ; Emma pour ton aide et soutien quasi H24 (on avait dit on ne parle pas travail à la maison !), ces simulations interminables à faire tourner et tes nombreuses relectures. Pierre, Emma, je n’oublie pas non plus votre patiente face à mes dilemmes de vie et surtout tous les bons moments Dino/vaisselle/chanson/autres.
Merci à l’ensemble de l’équipe TROPHIK pour votre écoute et vos conseils lors des Trophi-Mardi.
Merci au personnel du LOG pour l’accueil et pour l’initiation douloureuse mais hilarante au pilate. Merci à la team des doctorants et autres non-permanents pour ces cafés du matin à rallonge et les moments hors labo.
Merci à ceux qui m’ont supporté lors de la rédaction de ce mémoire, en premier lieu, Michèle ma grand-mère ; ainsi que la famille, les cousins et copains qui ont su me laisser travailler mais aussi me distraire quand il le fallait. Enfin merci à mes parents pour leur soutien de toujours.
Je tiens enfin à remercier France Energie Marine et l’ANR TROPHIK qui ont financé ce projet de recherche de master.
Table des matières
Introduction ... 1
I. Matériel et méthode ... 3
1. Zone d’étude ... 3
2. Modélisation et scénarisation ... 4
2.1. Ecopath with Ecosim (EwE) et Ecospace ... 4
2.1.1. Description des modèles ... 4
2.1.2. Simulation des scenarios ... 7
2.2. EcoTroph (ET ... 9
2.2.1. Description du modèle ... 9
2.2.2. Simulation des scenarios et comparaison avec les sorties Ecosim ... 10
3. Indicateurs ... 11
3.1. Indicateurs d’analyse de réseau ... 11
3.2. Indicateurs écosystémiques complémentaires ... 12
3.3. Méthodes d’analyse des indicateurs ... 13
II. Résultats ... 17
1. Sensibilité et choix des indicateurs ... 17
1.1. Sensibilité des indicateurs à la pression de pêche ... 18
1.2. Sensibilité des indicateurs aux hypothèses de modélisation ... 21
1.3. Redondance des indicateurs ... 22
1.4. Sélection des indicateurs ... 23
2. Spatialisation des indicateurs : simulations Ecospace et réponses observées ... 24
III. Discussion ... 26
1. Limites des modèles et des approches utilisées ... 26
2. Sélection des indicateurs au vu de leur sensibilité à la pêche et aux outils de modélisation et lien avec le fonctionnement de l’écosystème ... 28
3. Spatialisation des indicateurs et réponse de l’écosystème aux scénarios de pêche 32 Conclusion ... 34
Annexes ... 36
Liste des abréviations
AEP: Approche Ecosystémique des Pêches A: Ascendence
ACP : Analyse en Composante Principale
AMI : Average Mutual Information / Information mutuelle moyenne AoDC : Ascendence relative
API : Apex Predator Index / Indice des prédateurs supérieurs APL : Average Path length / Longueur moyenne des voies CAH : Classification Ascendante Hiérarchique
CGFS : Channel Ground Fish Survey / Campagne des poissons de fond en Manche
CHARM : Channel Habitat Atlas for marine Ressource Management / Atlas des habitats de la Manche pour la gestion des ressources
DCSMM : Directive Cadre sur le Milieu Marin
DC : Development Capacity / Capacité de développement D/H : Detritivorie sur Herbivorie
EE : Efficience Ecotrophique ENA : Ecological Network Analysis ET : EcoTroph
EwE Ecopath with Ecosim
FCI : Finn Cycle Index / Indice du cycle de Finn Hr : Diversité des flux
HTI: High Trophic Indicator/ Indicateur de haut niveau trophique
IBTS : International Bottom Trawl Survey / Campagne internationale de chalutage de fond OSPAR: Convention Oslo-Paris
mB: Multiplicateur de biomasse de phytoplancton mF : Multiplicateur d’effort de pêche
MTI : Marine Trophic Index
MTL: Mean Trophic Level / Niveau trophique moyen Ri : Overhead interne, redondance
TL : Trophic Level / Niveau trophique
TLc : Trophic level of the catch/ Niveau trophique moyen des captures T.. Total System Throughput/ Flux totaux du système
TE : Transfert Efficiency / Efficience de transfert
SOI : System Omnivory Index /indice d’omnivorie du système SNR : Signal to Noise ratio/ Ratio du signal sur le bruit
Liste des annexes
Annexe 1 : Distributions spatiales et descriptions des communautés de poisson et
céphalopodes en baie de Seine (Raoux 2017 modifée de (Vaz et al., 2007))Annexe 2 : : Représentation schématique de la théorie de l’aire de nourrissage : la biomasse
de la proie est divisée en deux fractions, une vulnérable, l’autre invulnérable (Walters et al., 1997).Annexe 3 : Groupes fonctionnels et estimations de leurs paramètres par le modèle EwE baie
de Seine (Halouani et al, in prep)Annexe 4 : Séries temporelles implémentées dans Ecosim baie de Seine (Halouani et al, in
prep)Annexe 5 : Ajustement du modèle Ecosim : séries temporelles de captures prédites (ligne) et
observées (point) (Halouani et al in prep)Annexe 6 : Carte d’habitat (en haut) et de bathymétrie (en bas) implémentées dans Ecospace
(Halouani et al, in prep)Annexe 7 :
Illustration des concepts théoriques clefs de la modélisation EcoTroph. a :Fonctionnement trophique d’un écosystème dans le cadre de modélisation d’EcoTroph (Gascuel et al., 2009). b: De la trajectoire d’une unique particule (ligne grise) à un flux moyen de biomasse (ligne noire) (Gascuel et al., 2008).
Annexe 8 Analyse de sensibilité des indicateurs calculés par simulation EcoTroph aux
paramètres et valeurs d’entrées de ces simulations. Distribution des valeurs des indicateurs centrées réduites par rapport au scénario de référence, en fonction des valeurs et paramètres d’entrée de la simulation. Les paramètres d’entrée de la simulation correspondent aux différentes années, qui sont chacune des conditions différentes de l’écosystème. Les paramètres testés sont: intensité et type du contrôle (valeurs testées : 0.2, 0.4 et 0.6), origine de la matière organique (attribution pour chaque année la valeur de son ration D/H)Annexe 9 : Indicateurs écosystémiques des phases I et II d’IndiSeas (Coll et al., 2016)
Annexe 10 : Structure détaillée d’un fichier SCOR (Araignous et al, in prep)
Annexe11 : Tableau récapitulatif de l’analyse de la sensibilité des indicateurs à la pêche par
les trois méthodes, en fonction de la stratégie de pêche et de leur groupe issu de la classificationListe des figures
Figure 1 : Localisation géographique de la baie de Seine (Raoux, 2017 modifiée d’après
(Dauvin, 2012).Figure 2 ; Emprise spatiale du modèle EwE de la baie de Seine (Halouani et al. in prep)
Figure 3 : Evolutions temporelles des indicateurs en fonction de la stratégie de pêche et du
multiplicateur d’effort. Les valeurs représentées sont des valeurs standardisées par rapport au scénario de référence. Les indicateurs représentés ici sont ceux dont les évolutions temporelles seront discutées par la suite.Figure 4 : Différence entre la moyenne d’une série de valeurs d’un indicateur pour un scénario
et celles de référence en fonction de l’engin de pêche et du multiplicateur d’effort. Les séries pour lesquelles le test de Wilcoxon ne perçoit pas de différence statistique (p.value <0.05) apparaissent en gris.Figure 5 :
Spécificité des indicateurs à la pêche à travers les différentes stratégies de pêcheobservée par la valeur absolue de la pente du SNR. Les indices pour lesquels la vérification des résidus a été jugée mauvaise n’ont pas été représentés (ici l’APL).
Figure 6 : Comparaison de la spécificité des indicateurs à la pêche ou aux changements
environnementaux par la méthode du ratio de gradient pour chaque type de stratégie de pêche. La ligne correspond à un ratio de gradient égal à 1 (i.e. avec la transformation ln(x+1), ln(2)=0.69).Figure 7 : Distribution des valeurs des indicateurs centrées-réduites par rapport au scénario de
référence des simulations issues d’Ecosim, les points rouges sont les valeurs des indicateurs centrées réduites par rapport au scénario de référence des simulations EcoTroph.Figure 8 : Résultats de l’ACP et de la CAH menées sur les séries temporelles des indicateurs.
a et b : premier et deuxième plan du cercle des corrélations de l’ACP. c : Cosinus carré des variables de l’ACP ; d : DendrogrammeFigure 9 : Evolution spatiale de AoDC, RoDC, FCI, MTL325, MTL4 et TLc en Baie de Seine
lorsque l’effort de pêche des chaluts est réduit de 50%Figure 10 : Evolution spatiale du pourcentage de différence par rapport au scénario de
référence de valeurs du MTL4 et de l’ascendence en Baie de Seine lorsque l’effort de pêche de la drague est réduit de 50%Figure 11 : Evolution spatiale du pourcentage de différence par rapport au scénario de
référence de valeurs de la redondance (Ri), du MTL2 et du HTI en Baie de Seine lorsque l’effort de pêche de tous les métiers est réduit de 50%Liste des tableaux
Tableau 1 : Ensemble des indices d’analyse de réseau utilisés dans l’étude (modifié à partir
de Araignous et al (in prep)).Tableau 2 : Indicateurs écosystémique complémentaires utilisés dans l’étude.
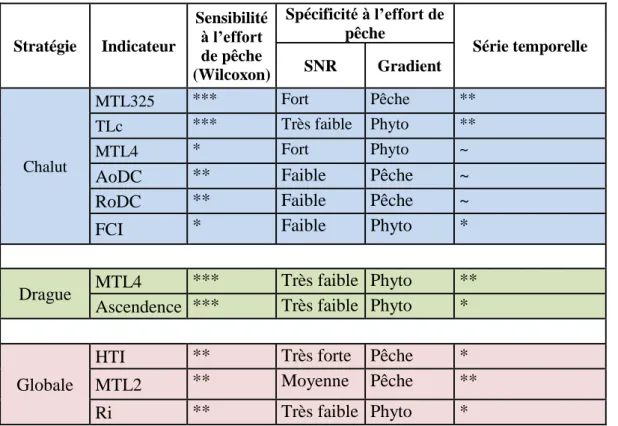
Tableau 3 : Sélection des indicateurs les plus sensibles à l’effort de pêche pour chaque
stratégie. La sensibilité est évaluée selon les trois méthodes vues précédemment. Pour le test de Wilcoxon le nombre d’astérisques correspond aux nombres de séries sensibles (sur trois multiplicateurs), pour le SNR la spécificité est classée de ns (non sensible) à forte, pour la méthode des gradients on indique pour quel facteur (pression de pêche ou biomasse de phytoplancton) l’indicateur s’est révélé le plus spécifique. La série temporelle est évaluée de peu stable et difficilement interprétable (~) à bonne (**).1
Introduction
Les activités anthropiques sont à l’origine de différents types de pression aux écosystèmes, les plus connues étant la surexploitation (Christensen et al., 2003 ; Olver et al., 1995 ; Pauly et al., 1998), la pollution (Boon et al., 2002), l’eutrophisation (Cloern, 2001), la fragmentation ou destruction des habitats (Layman et al., 2007 ; Melian et Bascompte, 2002), l’introduction d’espèces invasives (Zanden et al., 1999) et le réchauffement climatique (Kirby et al., 2009). Ces pressions causent des changements directs et indirects au sein des écosystèmes et notamment des modifications dans la structure et le fonctionnement des réseaux trophiques (De Ruiter et al., 2005 ; Moloney et al., 2011). Dans les écosystèmes marins, il a été démontré que la pêche est actuellement le facteur humain le plus « impactant » (Dayton et al., 1995 ; Worm et al., 2006).
Face à ce constat des objectifs de conservation et de gestion des écosystèmes ont été définis à l’échelle mondiale (Convention sur la Biodiversité Biologique signée lors du Sommet de la Terre de Rio de Janeiro en 1992) mais également régionale et locale. En Europe, la Directive Cadre Stratégie pour le Milieu Marin (DCSMM), adoptée par les états membre en 2008 s’engage à parvenir à un bon état écologique des mers européennes au plus tard en 2020. En France, la DCSMM est appliquée pour chaque façade maritime : Manche-mer du Nord, golfe de Gascogne, mer Celtique et Méditerranée occidentale. Le bon état écologique y est défini par 11 descripteurs différents. Plusieurs de ces descripteurs sont en relation avec la pression de pêche : la biodiversité (D1), la situation des espèces commerciales (D3), les réseaux trophiques marins (D4) ou l’intégrité des fonds (D6).
L’exploitation des ressources halieutiques a des conséquences sur différentes composantes de l’écosystème, il est donc nécessaire de considérer la gestion de la pêche d’une façon globale (Pikitch, 2004 ; Link, 2005). Cette vision holistique appelée Approche Ecosystémique des Pêches (AEP) marque une rupture avec la gestion traditionnelle des pêches c’est-à-dire stock par stock. Celle-ci a montré ses limites notamment car elle ne prenait pas en compte les espèces non-exploitées, les relations trophiques et les facteurs environnementaux qui interagissent avec l’espèce d’intérêt (Cury et al., 2005 ; Pikitch, 2004). La gestion écosystémique est une approche dont le but est de restaurer et maintenir la santé, la productivité et la biodiversité des écosystèmes tout en permettant à l’homme de garder une bonne qualité de vie en intégrant l’acquisition des ressources naturelles aux besoins sociaux et économiques (Szaro et al., 1998 ; Tam et al., 2017).
La mise en œuvre de l’AEP dépend notamment du développement d’outils permettant d’étudier l’écosystème dans son intégralité : c’est l’objectif des modèles écosystémiques (Smith et al., 2007). En effet ces modèles sont capables de tenir compte de la complexité des interactions entre les compartiments et de quantifier ces interactions. Parmi les modèles écosystémiques, le plus connu et utilisé par la communauté scientifique est Ecopath with Ecosim. Ce modèle d’équilibre de masse permet la représentation et l’analyse quantitative d’un réseau trophique en se basant sur un partitionnement des espèces en groupes fonctionnels (Christensen et Pauly, 1992 ; Polovina, 1984). On peut également citer les modèles « End to End » comme le modèle individu centré OSMOSE ou le modèle ATLANTIS, qui modélisent en détail le fonctionnement de l’écosystème, de la production primaire à l’exploitation par la pêche.
2
Afin de décrire les processus écologiques complexes et nombreux ayant lieu au sein d’un écosystème, de représenter le statut d’un écosystème (Tam et al., 2017 ; Cury et Christensen, 2005) mais également de communiquer avec les gestionnaires, des indicateurs écosystémiques sont calculés. Ces indicateurs procèdent à une simplification du fonctionnement réel de l’écosystème, indispensable pour la communication avec les gestionnaires (Jørgensen et al., 2010 ; Rice, 2003) et donc la mise en place de l’AEP. Par exemple, l’usage conjoint d’indicateurs et de points de référence peut servir à la fois à mesurer l’adéquation d’une mesure de gestion avec ses objectifs et participer à l’élaboration de règles pour une stratégie de gestion adaptative (Sainsbury, 2000). De nombreuses discussions actuelles portent sur le développement d’indicateurs capable de suivre les pressions et décrire les statuts des écosystèmes, notamment dans le cadre de la DCSMM (Rombouts et al., 2013). Les indices d’analyse de réseaux (ENA, « Ecological Network Analysis ») (Ulanowicz, 1996) ont par exemple été proposés pour la surveillance des réseaux trophiques (Niquil et al., 2014a). On peut également citer la démarche du groupe de travail IndiSeas qui met en place une sélection d’indicateurs afin d’évaluer l’impact de la pêche sur les écosystèmes marins exploités à l’échelle mondiale (Shin et al., 2010).
Un bon indicateur doit idéalement satisfaire certaines conditions : être sensible à l’intensité et à la direction (augmentation, baisse) de la réponse au processus ou à la pression qu’il représente ainsi qu’en être spécifique, avoir une solide base théorique, être réactif dans une période de temps appropriée et être mesurable et actualisable de façon rentable (Dale et Beyeler, 2001 ; Rice et Rochet, 2005 ; Link, 2010). Cette définition met en exergue le besoin d’explorer la sensibilité et spécificité des indicateurs écologiques aux différentes pressions individuelle mais aussi multiples et en interaction (Large et al., 2013 ; the IndiSeas Working Group et al., 2012).
C’est dans ce contexte que s’ancre la présente étude. Il s’agit de mener une expérimentation numérique pour évaluer la sensibilité et la spécificité d’un ensemble d’indicateurs écosystémiques, notamment les ENA, à la pression de pêche. Les réponses des indicateurs seront comparées en fonction de différentes stratégies de pêche (i.e. espèces ciblées), et de différents outils de modélisation (EwE, EcoTroph et Ecospace). Cette étude est adossée à l’ANR TROPHIK consacrée à l’étude du cumul d’impacts en Baie de Seine avec une attention particulière portée à l’éolien offshore et au projet de parc éolien au large de Courseulles-sur-mer.
Une revue des travaux antérieurs portants sur les indicateurs permet de formuler des hypothèses sur la réponse d’un certain nombre d’indicateurs. D’une part, les concepts de « fishing down » et « fishing through » the marine food web (Pauly et al., 1998 ; Essington et al., 2006) permettent de supposer que la pêche fera baisser la valeur des indicateurs basés sur les niveaux trophiques. D’autre part l’application des théories d’Odum sur la maturité (1969) et les réponses au stress (1975) aux indicateurs, suivant les hypothèses développées par Christensen (1995) et Ulanowizc (1996, 2009) permettent de prévoir la baisse des indicateurs de la maturité du système en réponse au stress qu’est la pêche.
Dans ce manuscrit, je présenterai d’abord les outils de modélisation, les différents scénarios de gestion de la pêche simulés, les indicateurs étudiés et les méthodes d’analyse. Puis j’évaluerai la sensibilité et spécificité des indicateurs à la pression de pêche afin de sélectionner les plus réactifs. Les indicateurs retenus seront spatialisés et utilisés pour évaluer l’impact de scénarios de pêche en Baie de Seine. En effet cette baie est soumise à de nombreux impacts anthropiques (Halpern et al., 2008), notamment la pêche avec une forte importance économique de la pêcherie de coquille Saint-Jacques (Parc éolien en mer du Calvados, 2015). Enfin je discuterai les hypothèses faites, et la sensibilité des indicateurs en lien avec les propriétés de l’écosystème.
3
I. Matériel et méthodes
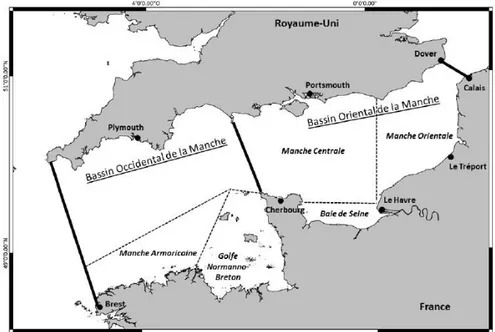
1. Zone d’étudeLa baie de Seine est située au nord-ouest de la France et s’ouvre sur le bassin oriental de la Manche (Figure 1). Elle forme un quadrilatère approximatif de 5000 km², soit environ 100 km de côté de l’est à l’ouest (de la côte est du Cotentin à l’extrémité occidentale du pays de Caux) et 50 km du nord au sud. La profondeur moyenne de la baie de Seine est de 30 m avec un maximum de 50 m. Le marnage maximum de la baie atteint 7.5 m à proximité de l’embouchure
de l’estuaire de la Seine. La Seine a un débit interannuel moyen de 400 m3.s-1, et domine donc
les apports continentaux de la baie (Dauvin et al., 2007).
Les courants de marée ont une moyenne d’un ou deux nœuds dans la partie sud de la baie et décroissent dans la partie Est. Ces courants influencent fortement la distribution des sédiments superficiels et des communautés benthiques faisant apparaitre un gradient du large vers la côte (Salomon et Breton, 1991 ; 1993 ; Dauvin et al., 2007).
Figure 1 : Localisation géographique de la baie de Seine (Raoux, 2017 modifiée d’après (Dauvin, 2012).
Les espèces benthiques présentes sont fortement liées au type de sédiments et peuvent être catégorisées en six communautés (Cabioch et Gentil, 1975). Les communautés halieutiques de la Manche orientale ont été décrites par Vaz et al (2007) à partir des données des campagnes halieutiques Channel Ground Fish Survey (CGFS). En baie de Seine, quatre communautés majeures allant du large au côtier ont été identifiées et sont détaillées en annexe 1 (Vaz et al., 2007 ; Carpentier et al., 2009).
La baie de Seine est un système fortement anthropisé et soumis à de nombreuses activités humaines. Une des activités majeures est la pêche commerciale avec près de 300 navires en activité qui génèrent un chiffre d’affaire de 85 millions d’euros et emploient 900 marins-pêcheurs. La coquille Saint-Jacques, espèce phare de la région représente environ 20% des débarquements totaux et un quart du chiffre d’affaire (Parc éolien en mer du Calvados, 2015) .
4
Elle est exploitée par environ 250 navires normands mais aussi du Nord pas de Calais pour des débarquements totaux de 5 000 à 15 000 tonnes selon les années, à l’échelle de la façade Manche-mer du Nord (Foucher et Fifas, 2015). Parmi les autres espèces cibles on peut citer la sardine (24% des débarquements), et en moindre mesure les poissons benthiques (plie, sole, limande), le tacaud, la dorade, la morue, la petite roussette et les céphalopodes. Les principaux engins sont la drague, les chaluts pélagiques et benthiques et les filets. Par ailleurs, un site au large de Courseulles-sur-mer a été retenu pour la construction d’un parc éolien offshore. Ce parc d’une cinquantaine de km², sera localisé au centre de la baie, à environs 10 km de la côte du Bessin (Figure 2). Il comprendra soixante-quinze turbines pour une puissance totale de 450 MW (Raoux, 2017). L’ANR TROPHIK vise à évaluer les impacts qu’aura l’installation de ce parc sur le fonctionnement de l’écosystème de la baie de Seine, tout en intégrant d’autres pressions subies par l’écosystème telles que la pêche ou les effets des changements climatiques sur les aires de répartition des espèces.
2. Modélisation et scénarisation
2.1. Ecopath with Ecosim (EwE) et Ecospace 2.1.1. Description des modèles
Ecopath
Ecopath est un modèle écosystémique d’équilibre de masse développé par Christensen et Pauly (1992) à partir d’une idée de Polovina (1984). Il permet la représentation d’un réseau trophique et la quantification des flux. Pour cela, l’écosystème est divisé en groupes
fonctionnels (mono- ou multispécifiques) et le modèle permet d’analyser les interactions trophiques entre chaque groupe (Christensen et Pauly, 1992 ; Christensen et Walters, 2004) Au sein d’un groupe fonctionnel, plusieurs espèces peuvent être agrégées en supposant que celles-ci partagent des caractéristiques communes comme leur régime alimentaire, leur comportement alimentaire ou leur croissance. Par ailleurs, un groupe monospécifique peut être divisé en « stanza » pour représenter plusieurs stades de son développement (e.g. larve, juvénile, adulte).
Ecopath s’appuie sur un système d’équations linéaires décrivant les interactions entre groupes. Chaque groupe fonctionnel i est régi par deux équations maitresses.
La première dite « d’équilibre des masses » contraint la différence entre flux entrants et sortants à être nulle :
𝑃𝑖 = 𝑌𝑖+ 𝐵𝑖× 𝑀2𝑖+ 𝐸𝑖+ 𝐵𝐴𝑖+ 𝑃𝑖× (1 − 𝐸𝐸𝑖) (Equation 1)
Avec Pi la production totale du groupe; Yi les captures totales; Bi la biomasse totale; M2i le taux
de prédation instantané ; Ei le taux de migration net (Emigration – Immigration); BAi le taux
d’accumulation de biomasse; 𝑃𝑖 × (1 − 𝐸𝐸𝑖) représente le taux des autres mortalités (eg ni par
prédation, ni par pêche), avec EEi l’efficience écotrophique du groupe soit la proportion de sa
production utilisée dans le système.
Cette équation peut aussi être exprimée comme suit :
5
Avec 𝑃 𝐵⁄ 𝑖 le ratio de la production sur la biomasse du groupe; 𝐵𝑗 la biomasse du
consommateur ou prédateurs j; 𝑄 𝐵⁄ 𝑗 la consommation par unité de biomasse de j et 𝐷𝐶𝑖𝑗 la
fraction du groupe i dans la diète de j.
La seconde équation assure la conservation de l’énergie, elle explicite l’utilisation de l’énergie provenant de la prédation. Elle est définie comme :
C𝑜𝑛𝑠𝑜𝑚𝑚𝑎𝑡𝑖𝑜𝑛 = 𝑝𝑟𝑜𝑑𝑢𝑐𝑡𝑖𝑜𝑛 + 𝑟𝑒𝑠𝑝𝑖𝑟𝑎𝑡𝑖𝑜𝑛 + 𝑎𝑙𝑖𝑚𝑒𝑛𝑡 𝑛𝑜𝑛 𝑎𝑠𝑠𝑖𝑚𝑖𝑙é soit :
𝑄𝑖 = 𝑃𝑖+ 𝑅𝑖+ 𝑈𝑖 (Equation 3)
Ecosim
Ecosim est la version dynamique d’Ecopath (Walters et al., 1997). Les équations sont dérivées des équations maitresses d’Ecopath, comme suit:
𝑑𝐵𝑖
𝑑𝑡 = 𝑔𝑖∑ 𝑄𝑗𝑖− ∑ 𝑄𝑖𝑗+ 𝐼𝑖− (𝑀0𝑖+ 𝐹𝑖+ 𝑒𝑖) × 𝐵𝑖 (Equation 4)
Avec 𝑑𝐵𝑖/𝑑𝑡 le taux de croissance durant l’intervalle de temps 𝑑𝑡 ; 𝑔𝑖 l’efficience de croissance
nette ; 𝑄 le taux de consommation ; 𝐼𝑖 le taux d’immigration du groupe ; 𝑀0𝑖 le taux des autres
mortalités naturelles (eg. Non causées par la prédation); 𝐹𝑖 le taux de mortalité par pêche ; 𝑒𝑖 le
taux d’immigration et 𝐵𝑖 la biomasse du groupe. 𝑄𝑗𝑖
Les deux sommes de consommation sont le cœur de cette équation et sont estimées par un modèle de consommation nommé « théorie d’aire de nourrissage » (foraging arena theory) (Christensen et Walters, 2004 ; Walters et al., 1997). Cette théorie divise la biomasse d’un groupe en une fraction vulnérable à la prédation et une fraction invulnérable (Annexe 2). Le
transfert entre ces deux fractions dérive d’un paramètre de vulnérabilité 𝑣𝑖𝑗 qui détermine
l’impact d‘une augmentation de la biomasse d’un prédateur sur la mortalité par prédation de sa proie (Christensen et al., 2008). Ce paramètre contrôle donc aussi ce qu’on appelle le type de contrôle : top-down, bottom-up or wasp-waist (Cury et Shannon, 2004).
Ecosim utilise un ajustement statistique sur les séries temporelles implémentées pour estimer les paramètres clefs de l’équation.
Ecospace
Ecospace est la version à la fois dynamique et spatiale d’Ecopath (Pauly, 2000). La biomasse de chaque groupe est dynamiquement distribuée sur une grille en deux dimensions selon l’habitat préférentiel de chacun. La distribution des groupes est aussi pilotée par le taux de dispersion qui est la capacité d’un groupe à se mouvoir d’une cellule à l’autre. Chaque habitat présente un comportement associé (taux de dispersion, d’alimentation, risque de prédation …) et une favorabilité à la pêche.
6
Le modèle EwE Baie de Seine
Plusieurs modèles EwE ont déjà été développés en Manche pour répondre à diverses questions écologiques ou simplement améliorer la compréhension du fonctionnement de l’écosystème. On peut citer celui de Standford et Pitcher (2004) qui est étendu à toute la Manche et pour lequel le module Ecosim a été utilisé sur la période 1973 - 1995. Dans le cadre du projet CHARM II, un modèle Ecopath a été construit par Villanueva en Manche Orientale (Carpentier et al., 2009), il a ensuite été étendu à toute la Manche et spatialisé sous Ecospace par Daskalov et al (2011). En 2017, Raoux et al ont développé un modèle EwE en baie de Seine, focalisé sur la zone du futur parc éolien de Courseulles-sur-mer. Un second modèle étendu à toute la baie de Seine a été construit par Halouani et al (in prep) afin de considérer les modifications de l’écosystème à plus grande échelle. C’est ce second modèle que j’ai utilisé. Il représente l’année 2000 (comme celui de Raoux et al (2017)) et couvre l’intégralité de la baie de Seine, et s’étend de la limite de la ZEE française au nord jusqu’à la côte au sud (la zone intertidale n’est pas prise en compte au vu de ses spécificités) (Figure 2).
Figure 2 ; Emprise spatiale du modèle EwE de la baie de Seine (Halouani et al. in prep)
Le modèle comprend 42 groupes fonctionnels, ceux-ci ont été composés en désagrégeant certains des 37 groupes du modèle de Raoux et al. (2017). Parmi ces groupes on retrouve : 1 groupe de producteurs primaires (phytoplancton), 2 groupes de zooplancton, 1 groupe bactérien, 8 groupes d’invertébrés, 19 groupes de poissons, 2 groupes de céphalopodes, 3 groupes d’oiseaux marins, 3 groupes de mammifères marins, ainsi qu’un compartiment pour les rejets de pêche et un pour les détritus (Annexe 3). La pêcherie est décomposée en 6 métiers : filets ciblant les démersaux et céphalopodes, chaluts pélagiques ciblant les petits pélagiques, chaluts de fond ciblant les démersaux et céphalopodes, chalut pélagique ciblant les démersaux, drague et « autres engins de pêche » (cette catégorie rassemble des engins peu représentés comme le chalut à perche ou le filet dérivant, et des associations engins-espèces différentes des catégories précédentes). Les données de pêche proviennent de l’outil SACROIS de l’IFREMER et ont été agrégées en métier pour être en cohérence avec le modèle. Les rejets ont été estimés à partir du rapport OBSMER (Cornou et al., 2015) et répartis pour chaque métier et groupe fonctionnel.
La qualité d’un modèle EwE s’estime en fonction de la qualité des données qui ont servi à sa construction. Pour faciliter cette estimation, l’utilisateur d’Ecopath peut renseigner la fiabilité de la donnée : c’est ce qu’on appelle le pedigree (Pauly et al., 2000). Le modèle a un pedigree
7
moyen de 0,57, ce qui le classe dans la catégorie des modèles avec un haut pedigree selon le classement de Morissette (2007), c’est à dire avec des données de bonne qualité, en comparaison avec les modèles couramment publiés.
Le modèle Ecosim simule la dynamique de l’écosystème de la baie de Seine entre 2000 et 2016 (même période temporelle que Raoux et al (2017)). Plusieurs séries temporelles de données ont été implémentées dans Ecosim : captures, effort de pêche, biomasse, mortalité par pêche et production primaire (Annexe 4). Elles ont ensuite été utilisées pour améliorer l’ajustement du modèle via l’estimation des vulnérabilités de chaque groupe.
Halouani et al (in prep) ont validé le modèle Ecosim en comparant les captures prédites aux données observées (Annexe 5). Globalement un bon ajustement est observé, avec une bonne représentation des tendances pour les groupes : coquille Saint-Jacques, flet, sole, dorade, poissons benthivores, sardine, tacaud, grondin, merlan, requin, raie, bar et maquereau. Cependant pour certains groupes comme la plie, la morue, les poissons piscivores, le chinchard, la capacité prédictive du modèle est faible. Les deux groupes de céphalopodes montrent un ajustement mitigé car les prédictions ne reproduisent pas entièrement la série de capture. Finalement, compte tenu de la faible proportion des groupes mal ajustés dans les captures (20%), le modèle est considéré comme satisfaisant et peut être utilisé comme une entrée du modèle Ecospace.
Le modèle Ecospace développé par Halouani et al (in prep) a la même emprise spatiale que le modèle EwE de baie de Seine (Figure 2). La carte de base est définie comme une grille de 70 lignes et 101 colonnes résultant en des cellules d’environ 1,6 km de côté. Plusieurs couches de données ont été implémentées pour définir la distribution spatiale des groupes et l’effort de pêche : bathymétrie, production primaire, type de fond et localisation des ports et du futur parc éolien pour les scénarios (Annexe 6). Les espèces benthiques ont été assignées à leurs habitats préférentiels en fonction du type de fond alors que la distribution des espèces mobiles dépend de la profondeur. La favorabilité des habitats a été définie à partir des données de la campagne de chalutage de l’IFREMER la Channel Ground Fish Survey (CGFS) qui a lieu tous les ans en octobre. Les zones de pêche ont été distribuées sur toute la zone, sauf pour la drague dont la zone d’action a été limitée aux gisements de coquille. Ensuite l’effort de pêche de chaque métier est assigné à chaque cellule selon un modèle de gravité qui prend en compte la profitabilité de la cellule, la distribution des autres flottilles et les coûts de navigation (Christensen et al., 2008). La distribution des espèces a été comparée aux sorties des modèles de niche de l’Atlas CHARM. Cet atlas recense les ressources maritimes de la Manche orientale (Carpentier et al., 2009). Certaines répartitions d’espèces pourraient être améliorée en ajoutant les données d’autres campagnes scientifiques, par exemple la campagne IBTS (International Bottom Trawl Survey) qui utilise un autre type de chalut et couvre une autre période. Finalement le réalisme du modèle spatial a été validé visuellement par des experts associés au projet (Eric Foucher, IFREMER Port-en-Bessin; Jean-Paul Robin Université de Caen, Ching Villanueva IFREMER Brest).
2.1.2. Simulation des scenarios
Pour évaluer la sensibilité d’une série d’indicateurs à la pression de pêche, j’ai eu recours à neuf scénarios qui ont été développés en utilisant le cadre de modélisation « Back to the Future » (Pitcher, 2005). Cette approche vise à utiliser les états passés d’un écosystème pour tester
8
différents objectifs de gestion. Cette méthode a été utilisée en raison du bon ajustement du modèle Ecosim et de l’absence de données prédictives de production primaire.
Les neufs scénarios sont une combinaison de trois « stratégies » de pêche (e.g. engins ciblés) et de trois multiplicateurs d’effort de pêche.
A partir des six métiers détaillés précédemment (filets ciblant les démersaux et céphalopodes, chaluts pélagiques ciblant les petits pélagiques, chaluts de fond ciblant les démersaux et céphalopodes, chalut pélagique ciblant les démersaux, drague et autres engins de pêche), je me suis concentrée sur deux engins particuliers : la drague et les chaluts. La drague a une importance économique prépondérante en baie de Seine et représente dans le modèle 19% des débarquements, en biomasse. De plus elle est considérée comme totalement sélective dans le modèle et cible donc uniquement la Coquille Saint-Jacques, je parlerais donc de la « stratégie drague ». Les chaluts sont divisés en trois métiers dans le modèle selon le type de chalut (de fond ou pélagique) et les espèces cibles (petits pélagiques, démersaux et céphalopodes). Considérant les interactions entre ces trois métiers, et leur importance globale (71% des débarquements), j’ai décidé de créer une « stratégie chalut » combinat les trois métiers. Un dernier type de scénario effectué modifie l’effort de pêche de tous les métiers en même temps et s’appelle donc « stratégie globale ». Les trois stratégies ciblent des espèces différentes et impactent donc le réseau trophique à différents niveau, l’idée est d’observer si les indicateurs ont la même réponse quelle que soit la stratégie ou s’ils sont spécifiques du ciblage de certains groupes trophique.
Les multiplicateurs d’effort de pêche (mF) appliqués sont {0.5, 0.8 et 1.2} par rapport aux séries d’effort de pêche. Ces valeurs ont été choisies car elles sont intermédiaires entre des multiplicateurs extrêmes (0, 1, 2 …) souvent utilisés en simulation et des modifications faibles de l’effort de pêche (0.05, 0.1, 0.15) plus réalistes. Pour coller à la démarche d’« expérimentation numérique » de l’étude et rester crédibles à des fins de gestion, il fallait d’une part rester dans le domaine des possibles tout en testant une gamme de variation suffisamment importante pour observer des réponses.
Les neufs scénarios ont été simulés sur Ecosim en modifiant les valeurs des séries d’effort de pêche des métiers concernés. Simultanément, en utilisant la fonction « Ecopath from Ecosim » d’EwE j’ai extrait, pour chaque scénario et chaque année un modèle Ecopath. Ces modèles Ecopath ont été re-équilibrés manuellement afin d’obtenir des modèles équilibrés (i.e. des EE<1 pour chaque groupe fonctionnel, voir encart 1). Pour tous les scénarios (y compris celui de référence), les années 2000, 2002 et 2015 présentaient des respirations négatives pour plusieurs groupes. Pour re-balancer ces groupes il aurait fallu faire des modifications en dehors de celle permise par la gamme d’incertitude des pedigrees. J’ai donc décidé de ne pas équilibrer ces années-là, et donc de considérer ultérieurement une série temporelle plus courte allant de 2003 à 2014. Hormis ces années problématiques la majorité des modèles étaient proches de l’équilibre et n’ont pas eu besoin de beaucoup de modifications.
9
2.2. EcoTroph (ET)
EwE fait partie de la catégorie de modèle dit « data driven » (e.g. piloté par les données), il ne propose pas de représentation théorique valable pour tous les écosystèmes. Au contraire EcoTroph (ET) se base sur une vision innovante de l’écosystème et permet d’explorer des aspects du fonctionnement des écosystèmes non représenté dans EwE. Cependant, la représentation simplifiée de l’écosystème fournie par EcoTroph, peut mener à une évaluation trop optimiste de la réalité, c’est pourquoi Gascuel et al (2009) conseillent de l’utiliser en complément d’EwE. C’est dans cette optique de comparaison que j’ai choisi d’également utiliser ET pour simuler puis calculer des indicateurs
2.2.1. Description du modèle
EcoTroph est une approche de modélisation dont l’idée de base est que la biomasse est distribuée de façon continue le long des niveaux trophiques (« Trophic level » TL) (Gascuel et Pauly, 2009 ; Gascuel et al., 2009). Au niveau trophique 1 la biomasse entre dans le système par l’activité photosynthétique des producteurs primaires, la détritivorie et le recyclage de la boucle bactérienne. En général il y a un saut de biomasse entre les niveaux trophiques 1 et 2. Au-dessus du niveau trophique 2, les diverses diètes des carnivores et omnivores rendent la distribution de biomasse continue le long des niveaux trophiques (Annex 6).
Le second point clef du modèle est que le fonctionnement d’un écosystème peut être modélisé par un flux de biomasse continue. Ce flux circule des producteurs primaires jusqu’aux prédateurs supérieurs par les processus ontogéniques et de prédation. Si l’on observe le devenir d’une particule de matière organique à travers le réseau trophique, on peut voir différentes vitesses de circulation : des mouvements continus liés aux processus ontogéniques et des sauts brusques dus aux événements de prédation. Le modèle considère toutes les trajectoires des particules en même temps, il en résulte un processus continu : le flux de biomasse (Annexe 7) (Gascuel et al., 2008).
Le flux de biomasse est alors considéré comme un processus physique et est caractérisé par des équations de dynamique des fluides. Pour simplifier l’expression mathématique de la densité
de biomasse, le modèle utilise des petites classes de niveau trophique ∆𝜏 = 0.1TL.
A un état permanent, la biomasse au sein d’une classe trophique peut être exprimée comme :
Encart 1 : Méthode adoptée pour équilibrer les modèles Ecopath
L’étape que l’on nomme « balancement » du modèle est en réalité l’étape d’estimation des paramètres manquants grâce à
l’équilibre des masses. Parmi les paramètres estimés l’efficience éco-trophique (EE) doit prendre des valeurs dans l’intervalle [0,1]. Si ce n’est pas le cas, l’EE est >1 et l’interface signale que le modèle n’est pas balancé. Un groupe dont l’EE est >1 est
surconsommé par rapport à sa production, plusieurs modifications sont envisageables (Christensen et al, 2008):
- Augmenter la biomasse ou le ratio production/biomasse du groupe
- Baisser sa consommation, pour cela on peut baisser le ratio consommation/biomasse ou diminuer la consommation d’un
prédateur. Pour modifier la consommation d’un prédateur il faut modifier sa matrice de régime alimentaire
Pour équilibrer un modèle on procède manuellement et pas à pas : on commence par modifier les paramètres du groupe avec l’EE la plus élevée. Pour modifier les paramètres d’entrée, on se base sur les pedigrees des paramètres du modèle. Ceux-ci évaluent la qualité des données et donc quantifient l’incertitude autour de la valeur implémentée. Pour chaque groupe on regarde quels sont les paramètres d’entrée avec la plus grande incertitude et on modifie ceux-ci prioritairement dans la gamme d’incertitude donnée par le pedigree.
10 𝐵𝜏=
Φ𝜏
𝐾𝜏× ∆𝜏 (Equation 5)
Avec 𝐵𝜏 la biomasse de la classe trophique, Φ𝜏 le flux moyen de biomasse circulant à travers la
classe trophique, et 𝐾𝜏 la vitesse moyenne du flux de biomasse à travers cette classe.
Au cours des transferts trophiques, le flux de biomasse subit des pertes naturelles à travers les mortalités non liées à la prédation, la respiration, l’égestion, l’excrétion et le détournement par la pêche. Il n’est donc pas conservatif et décroit à travers les niveaux trophiques selon l’équation suivante :
Φ(𝜏+∆𝜏)= Φ𝜏× exp [−(𝜇𝜏+ 𝜑𝜏) × ∆𝜏] (Equation 6)
Avec 𝜇𝜏 le taux net de perte de flux de biomasse et 𝜑𝜏 le taux de perte dû à la pêche. Le terme
exponentiel exp (−𝜇𝜏) est défini comme l’efficience du transfert (ET) entre les niveaux
trophiques. Dans la majorité des écosystèmes, ET=0.1(Pauly et Christensen, 1995).
La vitesse du flux de biomasse 𝐾𝜏 doit être estimée pour toutes les classes trophiques. On
s’attend à ce que cette vitesse décroisse lorsque les TL augmentent : les organismes de bas niveau trophique ont un métabolisme généralement plus rapide qui leur permet un turnover plus fréquent que celui des prédateurs supérieurs. Par ailleurs, on sait que les réactions métaboliques sont impactées par la température de l’environnement. Un modèle empirique a donc été
développé pour exprimer 𝐾𝜏 comme une fonction du niveau trophique et de la température de
l’eau (Gascuel et al., 2008). Ultérieurement d’autres modèles ont été mis au point pour estimer
𝐾𝜏 (Gascuel et al., 2009)
La pêche a été implémentée dans le modèle en utilisant le concept d’accessibilité : seulement une fraction de la biomasse de l’écosystème est accessible à la pêche. En appliquant ce concept aux équations précédentes (voir (Gascuel et al., 2011) pour les démonstrations), les captures par classes trophiques peuvent être exprimée comme suit :
𝑌𝜏 = 𝜑𝜏× Φ𝜏× ∆𝜏 Ou 𝑌𝜏 = 𝐹𝜏× 𝐵𝜏 (Equation 7)
Avec 𝐹𝜏 le taux de mortalité par pêche, 𝐵𝜏 la biomasse de la classe trophique, 𝜑𝜏 le taux de
perte de flux de biomasse dû à la pêche, Φ𝜏le flux moyen de biomasse à travers la classe
trophique et ∆𝜏 la classe trophique.
2.2.2. Simulation des scénarios et comparaison avec les sorties Ecosim
En parallèle de l’étude de sensibilité et de spécificité des indicateurs à la pression de pêche, la question de la robustesse de ces résultats à l’outil de modélisation se pose également. L’objectif de cette partie est de comparer la réponse de certains indicateurs à différentes hypothèses de modélisation. Pour cela j’ai utilisé EcoTroph pour simuler les neufs scénarios de pêche détaillés précédemment.
A partir du modèle Ecopath baie de Seine (i.e. année 2000), j’ai utilisé la fonction ET.transpose du package EcoTroph (Colleter et al 2013) passer des biomasses par compartiment à des biomasses par classe trophique. L’allocation de la biomasse d’un groupe trophique à une classe trophique se fait en supposant que tous les individus d’un groupe trophique n’ont pas le même niveau trophique mais que ces niveaux trophiques sont répartis de façon log-normale autour du
11
TL moyen du groupe (Gascuel et al., 2009). J’ai laissé l’accessibilité des groupes ciblés par la pêche à 0.8 (valeur par défaut). Puis à partir de ce modèle EcoTroph, la fonction create.ET.diagnosis a été employée pour simuler les différents scénarios (multiplicateur d’efforts * métiers ciblés). Cette fonction intègre également un certain nombre de paramètres variant entre 0 et 1, qui traduisent le fonctionnement de l’écosystème : le type de contrôle (top-down, bottom-up et leur intensité), l’origine de la matière disponible pour les consommateurs (majoritairement des détritus ou de la production autotrophe). Ces paramètres ont été laissés à leur valeur par défaut dans mes simulations. L’analyse de sensibilité de la réponse des indicateurs calculés aux paramètres de contrôle de l’écosystème est présentée en annexe (Annexe 8).
3. Indicateurs
Les indicateurs sont un point central de la gestion des pêches et de prise de décision
(Browman et Stergiou, 2004). Selon Hayes et al (2012), il y a de nombreuses définitions d’un indicateur écologique, mais elles s’accordent toutes sur deux points :
- Les indicateurs sont « des composants ou processus de l’écosystème qui peuvent être mesurés pour pouvoir nous dire quelque chose de l’impact des activités humaines sur la santé ou la durabilité du système »
- Les indicateurs « réduisent la complexité du monde réel en un ensemble restreint de caractéristiques qui sont utiles à des fins de gestion ou communication »
Ce rapport s’est concentré sur l’évaluation de la sensibilité à la pêche des indices d’analyse de réseaux (ENA). Pour faciliter les comparaisons, un ensemble d’indicateurs plus courants en AEP a aussi été utilisé.
3.1. Indicateurs d’analyse de réseaux (ENA)
En 1992, Constanza et al décrivent la santé d’un écosystème comme suit : « Un système écologique est en bonne santé et libre de « syndrome de détresse » s’il est stable et durable – soit s’il est actif, maintient son organisation et son autonomie au cours du temps et est résilient au stress ». Cette définition soulève trois propriétés : l’organisation, la vigueur (activité) et la résilience que Constanza et Mageau (1999) identifient comme les principaux attributs de santé et de performance d’un écosystème.
La vigueur d’un système est mesurée par son activité métabolique ou production primaire nette ou brute. L’organisation du système est liée au nombre et à la diversité des interactions entre les différents compartiments (Costanza et Mageau, 1999). La résilience renvoie à la capacité d’un écosystème à maintenir sa structure en présence d’un stress (Holling, 1986).
La quantification de la vigueur est assez directe, au contraire, l’organisation et la résilience sont moins tangibles mais peuvent être estimées par l’analyse de réseau (ENA). Cette approche permet d’analyser les interactions du système pour identifier des propriétés globales qui ne sont pas évidentes à partir d’observation directes (Fath et al., 2007). L’analyse de réseau fournit un ensemble d’indices qui combine les aspects qualitatif et quantitatif des dynamiques d’un écosystème (Ulanowicz, 1996 ; 2004).
12
Par ailleurs, un système transite par différents états appelés « succession » jusqu’à atteindre un état stabilisé (en homéostasie avec son environnement) pour lequel la biomasse maximale et les fonctions symbiotiques entre organismes sont maintenues en fonction de l’énergie disponible (Odum, 1969). En présence d’un stress les attributs d’un écosystème vont montrer certaines tendances décrites par Odum (1975). Certains auteurs ont relié l’évolution des indicateurs ENA, initialement utilisés pour décrire la structure et le fonctionnement d’un système, à ces tendances et au degré de maturité du système (Christensen, 1995 ; Ulanowicz, 2004 ; 2009 ; 1996). Dans cette étude j’ai utilisé douze indicateurs d’analyse de réseau pour étudier la réponse de l’écosystème à un stress : la pression de pêche. Leurs formules, abréviations, références et significations écologique sont présentés dans le tableau 1.
Tableau 1 : Ensemble des indices d’analyse de réseau utilisés dans l’étude (modifié à partir de
Araignous et al (in prep)).
3.2. Indicateurs écosystémiques complémentaires
Les indicateurs d’analyse de réseaux sont connus pour mettre en évidence des propriétés
émergentes des réseaux trophiques (Fath et al., 2007). En revanche on ne leur connait pas de
spécificité particulière à l’effort de pêche.
Indicateur Description Formule Interpretation Réference
T.. Flux totaux du système Quantité de matière traversant le système
(Unit: Flowbits)
Activité globale du système Ulanowicz 2004,Kay et al 1989
DH Ratio détrivores/herbivores Ratio de la consommation de détritus sur la consommation d'autotrophes
(Sans unité)
Système basé sur les détritivores ou
herbivores Ulanowicz 1992
SOI Indice d'omnivorie du système Variance des niveaux trophiques d'une espèce
(Sans unité)
Spécialisation trophique d'un prédateur Système en réseau complexe ou en
forme de chaine
Pauly et al. 1993
FCI Indice du cycle de Fynn % d'énergie recyclée dans la totalité des flux du système
(Sans unité)
Recyclage, compléxité des liens
internes Finn, 1980
APL voies (Average Path Length)Longueur moyenne des unité d'énergie entre son entrée et sa sortie du systèmeNombre moyen de compartiments traversés par une
(Sans unité)
Aggrégation du système Kay et al 1989
DC Capacité de développement Limite supérieure de l'ascendence
(Unit: Flowbits)
Potentiel maximum de l'ascendence Ulanowicz, 1986
A Ascendenc du système Magnitude et diversité des flux entre compartiments
(Unit: Flowbits)
Activité, maturité et organisation du
système, efficacité Ulanowicz 1986
AoDC Ascendence relative
(Sans unité)
Degré de spécialisation du système Ulanowicz, 1986
Ri Overhead interne, redondance Part non organisée du système
(Unit: Flowbits)
Mesure la multiplicité des flux
parallèles Ulanowicz, 1986
RoDC Relative overhead Proportion des flux overhead sur la capacité de développement total
(Sans unité)
Proportion des flux parallèle dans la
capacié totale du système Ulanowicz 1986
AMI
Information mutelle moyenne (Average Mutual
information)
Ascendence du système sur le nombre de flux total
(Sans unité)
Degré de spécialisation des flux du système, efficacité du transport de materiel, organisation des échanges du
système
Ulanowicz 2004, Miehls et al 2009
Hr Diversité des flux Indice de diversité de Shannon appliqué aux flux du système. Limite supérieure de l'AMI Redondance des processus du système, stabilité du réseau
Rutledge et al., 1976; Ulanowicz and Norden,
1990
1: Le mot "ascendence" est volontairement orthographié différemment d'ascendance pour permettre la distinction entre les deux (Ulanowizc, 1986) Tij =Flux du compartiment i au compartiment j
Zi = import du système passant par le compartiment i
yi= export du système provenant du compartiment i
.. = 𝐹𝑙𝑢 𝑡𝑜𝑡𝑎𝑢 𝑖𝑗 𝐷 = 𝐷𝑒𝑡𝑟𝑖𝑡𝑖𝑣𝑜𝑟𝑖𝑒 𝑒𝑟 𝑖𝑣𝑜𝑟𝑖𝑒 𝐹𝐶𝐼 = ∑ 𝑖 𝑖𝑗+ 𝑖 . . 𝑗 𝐴𝑃 = ( . . − 𝑖) ⁄𝑖 𝐷𝐶 = − . . × ∑ 𝑗𝑖𝑗 . . × 𝑖𝑗 . . 𝑖 𝐴 = 𝑖𝑗 × 𝑖𝑗× . . ∑ 𝑗.𝑗× ∑ 𝑖 𝑖. 𝑗 𝑖 = 𝐴/𝐷𝐶 𝑅𝑜𝐷𝐶 = 𝑅 𝐷𝐶⁄ 𝑅𝑖 = − 𝑖𝑗× 𝑖𝑗 𝑖.× .𝑗 𝑖𝑗 𝐼 = ∑ ∑ 𝑖 𝑗 𝑗× ∑ ∑ 𝑗 𝑗× 𝐷𝐶𝑗𝑖 × .𝑗 .𝑗 𝑖 𝑟 = 𝐷𝐶 . .⁄ 𝐴𝑀𝐼 = 𝐴 . .⁄ e1
13
J’ai donc choisi des indicateurs écosystémiques connus pour être sensibles à l’effort de pêche afin de permettre de comparer les réponses des différents indicateurs.
Le premier groupe d’indicateurs est celui des niveaux trophiques moyens (MTL 2, MTL325 et MTL4), ceux-ci renseignent le positionnement trophique global de l’écosystème modélisé et donc sur sa structure. Il s’agit d’une moyenne du niveau trophique de chaque groupe de l’écosystème pondéré par sa biomasse. Initialement utilisé pour évaluer toute la communauté de consommateur, il était calculé à partir du niveau trophique (TL) 2 (exclusion du phytoplancton). Pauly et Watson (2005) ont ensuite proposé un seuil de 3.25 pour prendre en compte uniquement la partie supérieure du réseau trophique et s’affranchir des fortes variations de biomasse des poissons planctivores liées à des facteurs environnementaux. Enfin le seuil de TL>4 a été proposé pour observer uniquement les variations des prédateurs supérieurs de l’écosystème (Essington et al., 2006).
Une majorité des indicateurs écosystémiques complémentaires choisis proviennent de la démarche IndiSeas. IndiSeas est un groupe de travail qui a pour but d’identifier les indicateurs pertinents pour évaluer, comparer et communiquer sur le statut écologique de plusieurs écosystèmes marins exploités. Durant la première phase du projet (2005-2009), le groupe a sélectionné sept indicateurs, la seconde phase (2010-2014) a permis de compléter cette liste avec six indicateurs englobant des notions de biodiversité et conservation (Annexe 9) (Shin et al., 2010 ; Coll et al., 2016). Parmi cette sélection d’indicateurs j’en ai utilisé trois : la biomasse totale de la communauté, le niveau moyen des captures (TLc), et le « Marine Trophic
Index »2(MTI), notamment car ils étaient facilement calculables à partir des sorties d’Ecosim.
J’ai également utilisés deux autres indices focalisés sur les biomasses des prédateurs
supérieurs : le « High Trophic Index » (HTI) et le « Apex Predator Index » (API) (Bourdaud et al., 2016).
Les formules, abréviations et références des indicateurs complémentaires sont présentés dans le tableau 2.
Tableau 2 : Indicateurs écosystémique complémentaires utilisés dans l’étude.
Description Formule Réference MTL Mean Trophic Level
Niveau trophique moyen de tous les consommateurs (>2)/niveaux trophiques supérieurs
(>3,25)/prédateurs supérieurs (>4) (Sans unité)
Pauly et al. 1998
Biom.to
t Biomasse totale Biomasse totale des espèces étudiées
Blanchard et Boucher 2001, Fulton et al 2005, Link 2005, Rochet et al 2005
TLc Niveau trophique des captures Niveau trophique moyen des captures
(Sans unité)
Cury et al 2005, Fulton et al 2005, Link 2005, Pauly and al 2000
MTI Marine Trophic Index Niveau trophique moyen des captures des niveaux trophiques supérieurs
(Sans unité)
Pauly et Watson 2005
HTI Indice de haut niveau trophique
(High Trophic Index)
Pourcentage de prédateurs supérieurs (TL>4) dans l'écosystème
(Sans unité)
Essington et al 2006, Shannon et al 2014, Bourdaud et al 2016
API Indicateur de prédateur supérieur (Apex Predator Index)
Pourcentage de prédateurs supérieurs (TL>4) sur le pourcentage de prédateur (en excluant les planctivores
TL>3.25) (Sans unité) Bourdaud et al 2016 Indicateur 𝑀 = ∑ 𝑖 𝑖× 𝐵𝑖 ∑ 𝐵𝑖 𝑖 Biom.tot =∑ 𝐵𝑖 𝑖 TLc = ∑ 𝑖× 𝑖 𝑖 𝑖 MTI = ∑ . . 𝑖× 𝑖. . 𝑖 𝑖 HTI = ∑ 𝐵𝑖. 𝐵𝑖. 𝑖 API = ∑ 𝐵𝑖. 𝐵𝑖. . 𝑖
14
3.3. Méthodes d’analyse des indicateurs
Les 20 indicateurs décrits précédemment ont été calculés sur R à partir des sorties des modèles Ecopath équilibrés (correspondant à chaque année de la série temporelle) pour chaque scénario. Pour le calcul des indices ENA, j’ai utilisé le package enaR (Borrett, Lau, 2014).
Sensibilité des indicateurs à la pêche
Le but de l’analyse est d’évaluer la réponse des indicateurs à la pêche en fonction du scénario (i.e. du multiplicateur d’effort de pêche et de la stratégie de pêche). Pour cela j’ai utilisé trois approches différentes, chacune présentant des cadres conceptuels et objectifs distincts. La première méthode teste la sensibilité des indicateurs à la pression de pêche, c’est-à-dire la capacité d’un indice à répondre à une modification de la pression de pêche. Les deux autres se concentrent sur la spécificité des indicateurs à la pêche, c’est-à-dire la part de réponse de l’indicateur lié à la pression de pêche comparé à d’autres facteurs environnementaux pouvant affecter l’écosystème (Shin et al., 2018).
Tout d’abord j’ai utilisé le test non paramétrique de Wilcoxon pour comparer la série d’un indicateur pour un scénario donné avec le scénario de référence. Ce test s’appuie sur le rang des valeurs d’un échantillon, pour déterminer s’il y a, ou non, une différence statistique entre la moyenne de deux séries appariées. Ici les séries sont considérées comme non indépendantes car elles proviennent de simulations basées sur une seule série temporelle initiale. Chaque série temporelle d’un indicateur, pour un scénario donné est centré réduit par rapport à la série temporelle du scénario de référence, puis comparée à cette série par le test de Wilcoxon. La standardisation est utilisée car les différents indicateurs ont des unités et surtout des ordres de grandeur très différents.
Ensuite j’ai utilisé la méthode du « Signal to Noise Ratio » (SNR, ratio bruit signal) (Shin et al., 2018 ; Houle et al., 2012), pour évaluer la spécificité des indicateurs à la pêche. Cette méthode vise à isoler les variations d’un indicateur dues à un changement dans la pression de pêche (le signal d’entrée) de celles dues à des changements environnementaux (le bruit). En effet les variations environnementales (de température, de salinité, de quantité de nutriments, de production primaire…) affectent les écosystèmes et peuvent logiquement modifier la valeur des indicateurs. Dans nos séries temporelles, les changements environnementaux sont visibles à travers leur variabilité interannuelle. Dans le modèle EwE, la variabilité environnementale est due aux variations de production primaire, c’est donc ce facteur qui va être considéré. Le SNR est une façon de standardiser la valeur d’un indicateur pour déconvoluer cette variabilité environnementale considérée comme aléatoire. Un SNR est calculé pour chaque indicateur, chaque stratégie de pêche et chaque multiplicateur d’effort de pêche. Une régression linéaire entre le SNR et le multiplicateur d’effort de pêche est ensuite menée. La pente de cette régression linéaire correspond donc à une variation de valeur de l’indicateur uniquement due à une variation de l’effort de pêche, elle représente donc la spécificité de l’indicateur à la pêche (voir encart 2). On va donc comparer la valeur absolue des pentes pour chaque indicateur et chaque stratégie de pêche, plus cette valeur est grande, plus l’indicateur est spécifique à la pêche. Cependant, on ne peut pas fixer un seuil pour déterminer si un indicateur est spécifique ou non, la valeur de la pente permet uniquement de comparer la spécificité des indicateurs entre eux.
15
Enfin ; pour compléter l’étude sur la spécificité d’un indicateur à la pression de pêche, j’ai utilisé la méthode des gradients pour évaluer l’importance relative de la pêche et des variations environnementales orientées dans la réponse d’un indicateur. Cette fois les variations environnementales ne sont plus considérés comme aléatoires mais orientées, c’est-à-dire distribuées le long d’un gradient (Shin et al., 2018). Dans nos simulations, les changements environnementaux sont représentés par la variation de la biomasse de phytoplancton au cours du temps. On peut donc attribuer un « multiplicateur de biomasse de phytoplancton » à chaque année de simulation. Ainsi chaque valeur d’un indicateur est une combinaison unique d’un multiplicateur d’effort de pêche (mF) et d’un multiplicateur de biomasse de phytoplancton (mB), pour chaque stratégie de pêche. Chaque valeur d’indicateur est alors standardisée par rapport à une valeur de l’indicateur pour laquelle mF=1 et mB=1. Ces valeurs sont réparties dans une matrice à deux dimensions (mF et mB) et des gradients (différence entre une valeur et celle de la case précédente) dans chaque direction sont calculés. La moyenne des gradients dans chaque direction exprime la variation de l’indicateur due soit à la pêche soit à la biomasse de phytoplancton. La spécificité de l’indicateur à la pêche est alors obtenue en calculant un ratio de ces moyennes de gradients, si le ratio est >1, l’indicateur est plus sensible aux variations d’effort de pêche qu’aux variations environnementales (voir encart 3). L’approche par la méthode des gradients permet de ne pas avoir à faire les hypothèses d’une régression linéaire multivariée car la linéarité est supposée uniquement localement. Et elle est applicable avec un petit nombre de données (ici n=4) contrairement à la régression non linéaire (Shin et al., 2018).
16
Sélection des indicateurs
On choisit d’effectuer une sélection d’indicateurs pour chaque stratégie de pêche. Celle-ci se base sur la sensibilité de l’indicateur à la pression de pêche à travers les trois méthodes d’analyse (test de Wilcoxon, pente du SNR et comparaison des gradients pêche et biomasse de phytoplancton), l’allure (stabilité et compréhensibilité) de leur série temporelle et leur redondance avec les autres indicateurs. Pour éviter cette redondance, une Analyse en Composante Principale (ACP) suivie d’une Classification Ascendante Hiérarchique (CAH) ont été réalisées : on ne choisira qu’un indicateur par groupe de la CAH.
17
Spatialisation des indicateurs
J’ai enfin simulé les scénarios de pêche, précédemment expliqués, sur le modèle Ecospace de la baie de Seine. Grace au nouveau plug-in « EnaR » implémenté dans le logiciel on obtient un fichier SCOR par cellule de la grille et par pas de temps de la simulation. Chaque cellule est considérée comme un « micro » modèle Ecopath dont les paramètres (biomasse, production/biomasse, consommation/biomasse, niveau trophique de chaque compartiment) sont exportés sous la forme d’un fichier SCOR (des détails sur la structure d’un fichier SCOR sont donnés annexe 10). A partir des fichiers SCOR les indicateurs détaillés précédemment sont calculés : une valeur d’indicateur est obtenue pour chaque cellule de la carte de base du modèle Ecospace. On obtient les évolutions spatiales et temporelles de chaque indicateur et les représente sous forme de carte. Cette méthode innovante et le plug-in implémenté dans Ecospace sont le résultat de la collaboration des développeurs d’EwE (Joe Buszowski et Jereon Steenbeek) avec Emma Araignous dans le cadre d’une demande de développement méthodologique exprimée par l’ANR TROPHIK (Araignous et al, in prep).
II. Résultats
1. Sensibilité et choix des indicateurs
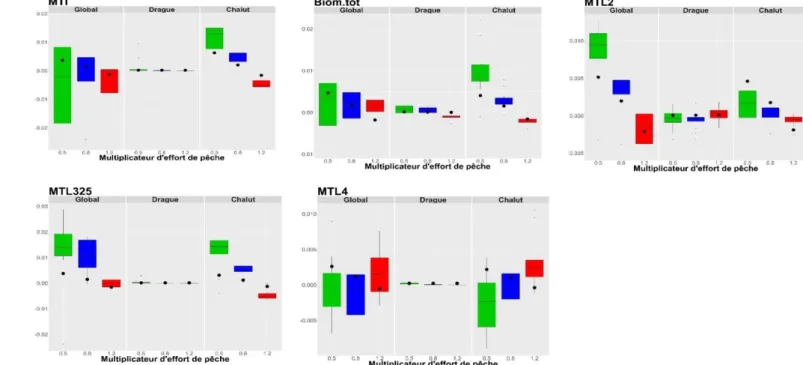
A partir des simulations d’Ecosim et des calculs sur R (package enaR), dix séries temporelles (correspondant aux trois stratégies de pêche et trois multiplicateurs d’effort de pêche ainsi que la série de référence) sont obtenues pour chaque indicateur. Elles sont représentées en valeur centrées-réduites par rapport au scénario de référence et seront utilisées pour interpréter la réponse de certains indicateurs (Figure 3).
18
Figure 3 : Evolutions temporelles des indicateurs en fonction de la stratégie de pêche et du multiplicateur d’effort. Les valeurs représentées sont des valeurs standardisées par rapport au scénario de référence. Les indicateurs représentés ici sont ceux dont les évolutions temporelles seront discutées par la suite.
1.1. Sensibilité des indicateurs à la pression de pêche
La sensibilité des indicateurs à la pression de pêche a été explorée par plusieurs méthodes.
Les résultats du test non paramétrique de Wilcoxon qui a été conduit pour évaluer la