HAL Id: dumas-01866727
https://dumas.ccsd.cnrs.fr/dumas-01866727
Submitted on 3 Sep 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Drépanocytose et grossesse
Claire Méligne
To cite this version:
ÉCOLE DE SAGES-FEMMES
UNIVERSITÉ DE CAEN
Sous la direction du Dr REPESSÉ
Mémoire présenté et soutenu par
Claire MÉLIGNE
Née le 27 Juin 1995
En vue de l'obtention du diplôme d'Etat
de Sage-femme
Promotion 2014 - 2018
REMERCIEMENTS :
Je remercie toutes les personnes qui ont contribué à l'élaboration de ce travail de fin d'études :
Docteur Yohann Repessé, hématologue au CHU de Caen et directeur de ce mémoire, pour son accompagnement et sa gentillesse.
Mme. Claire BOUET, sage-femme enseignante de l'école de sages-femmes de Caen, pour ses précieux conseils.
Le personnel des archives centrales pour leur accueil et leur disponibilité. Ma famille pour leurs encouragements et leur soutien, et plus particulièrement
ma sœur qui m'a donnée l'idée de ce sujet.
Mes amis et plus particulièrement Marie et Olivia pour tous ces bons moments partagés au cours de ces quatre dernières années.
ABBRÉVIATIONS :
CHU : centre hospitalier universitaire
CNGOF : Collège National des Gynécologues et des Obstétriciens Français CVO : crise vaso-occlusive
MFIU : mort fœtale in utéro
RCIU : retard de croissance in utéro SA : semaine d'aménorrhée
SOMMAIRE :
REMERCIEMENTS ABBRÉVIATIONS INTRODUCTION ... 1 ÉTUDE ... 9 MATÉRIEL ET MÉTHODE ... 10 Matériels ... 10 Méthodes ... 11Recommandations de prise en charge au cours des dernières années ... 11
Protocoles de prise en charge ... 12
Recueil des données ... 13
RÉSULTATS ... 14
Caractéristiques des patientes ... 14
Déroulement de la grossesse ... 15
Issue de la grossesse ... 18
Evaluation du respect des recommandations ... 20
DISCUSSION ... 23
Points forts et limites de l'étude ... 23
Résumé des principaux résultats et confrontation aux données de la littérature 24 Les complications maternelles et fœtales ... 24
Prise en charge transfusionnelle ... 27
Evaluation du respect des recommandations ... 30
Mes propositions de prise en charge ... 33
CONCLUSION ... 35 BIBLIOGRAPHIE
ANNEXES RÉSUMÉ
Page | 1
Page | 2 La drépanocytose est la plus fréquente des maladies génétiques. Sa transmission est autosomique récessive. [1]
Dans le monde, la drépanocytose touche approximativement 25 millions d'individus avec 312 000 nouveau-nés atteints chaque année. [2]
Elle serait apparue il y a 70 000 à 150 000 ans au sein de populations d'Afrique Sub-saharienne. Cette zone reste la région la plus concernée par la drépanocytose, mais celle-ci est également présente dans le pourtour méditerranéen (Maghreb, Italie du Sud, Grèce), au Moyen Orient et en Inde. A la suite des mouvements migratoires, elle s'est répandue en Europe, aux Antilles, en Amérique du Nord et du Sud. [1] En France, la prévalence de la drépanocytose est en augmentation continue, surtout en région parisienne et dans les départements d'outre-mer. [3] Elle concernait en moyenne 1 naissance sur 1 900 en 2013. [4]
La drépanocytose est due à une mutation ponctuelle du gène de la β-globine situé sur le chromosome 11. Cela entraîne la substitution d'une adénine en thymine (GAG GTG) qui remplace sur la chaîne β de l'hémoglobine un acide glutamique hydrophile par une valine hydrophobe. Une hémoglobine anormale est alors fabriquée qu'on nomme l'hémoglobine S.
L'hémoglobine S possède une nouvelle propriété, celle de la polymérisation. En effet, à l'état désoxygéné, on peut observer un accolement des molécules d'hémoglobines S entre elles par des liaisons entre les acides aminés qu'on appelle des fibres cristallines. On observe alors une déformation des hématies qui prennent la forme caractéristique de faucille, d'où le terme d'hématies falciformes.
Ces hématies falciformes ont alors une plasticité diminuée favorisant leur accumulation dans la microcirculation et une durée de vie réduite (une vingtaine de jours au lieu de 120 jours) entraînant une hémolyse chronique, ce qui explique les deux signes majeurs de la maladie qui sont l'obstruction des petits vaisseaux et l'anémie. La polymérisation de l'hémoglobine S est favorisée par l'hypoxie, la déshydratation, l'acidose ou l'hyperthermie. [3]
Page | 3 Il existe plusieurs génotypes de syndromes drépanocytaires dits majeurs. Il y a la drépanocytose homozygote avec le génotype SS qui représente la forme la plus fréquente (plus de 70% des syndromes drépanocytaires majeurs) et la plus grave. Puis, il y a des associations de l'hémoglobine S à d'autres mutations de l'hémoglobine comme le génotype SC pour la drépanocytose hétérozygote composite et le génotype Sβ pour la drépanocytose associée à la β-thalassémie. [1]
Le dépistage néonatal de la drépanocytose permet un diagnostic précoce de toutes les formes de syndromes drépanocytaires majeurs. Il est réalisé à 72h de vie à partir d'un prélèvement sanguin sur papier buvard en même temps que les autres dépistages (phénylcétonurie, hyperplasie congénitale des surrénales, mucoviscidose, hypothyroïdie congénitale). Il est pratiqué si l'un des parents ou les deux parents sont originaires d'une région à risque (Afrique, Pourtour méditerranéen, Moyen-Orient, Inde, Brésil, Départements d'Outre-Mer). [5]
Autrement, le diagnostic biologique se fait par frottis sanguin qui permet de mettre en évidence les hématies en forme de faucille et par électrophorèse de l'hémoglobine qui permet la séparation de l'hémoglobine normale appelée hémoglobine A de l'hémoglobine S. [4]
On note une grande variabilité d'expression phénotypique de la maladie d'un patient à l'autre et durant la vie d'un même patient. [1]
Au niveau de la clinique, l'anémie est souvent le premier signe de la maladie. Elle peut se traduire par une pâleur, une fatigue excessive, un essoufflement, une tachycardie ou un ictère.
Une aggravation de cette anémie peut survenir suite à une séquestration splénique ou des crises dites aplasiques.
La séquestration splénique est due à une suractivité de la rate dans l'élimination des hématies falciformes. Cela se traduit par des douleurs abdominales et une splénomégalie.
Les crises dites aplasiques sont dues à une absence de production des hématies. Elles peuvent être causées par une infection au parvovirus B19 ou par un manque en acide folique.
Page | 4 En général, l'anémie chronique est bien tolérée par les personnes drépanocytaires. [6]
L'obstruction des petits vaisseaux s'expriment par des crises vaso-occlusives (CVO) qui se manifestent par des douleurs vives et brutales pouvant causer à long terme une nécrose des organes. Elles sont essentiellement osseuses touchant la métaphyse et la diaphyse des os longs.
Des signes inflammatoires locaux et généraux peuvent être associés, ce qui nécessite tout de même la recherche d'une infection. [1]
Des complications ischémiques secondaires à la vaso-occlusion peuvent apparaître et atteindre la plupart des organes :
accident vasculaire cérébral ostéonécrose
accidents thrombotiques
occlusions rénales se traduisant par une hématurie suite à une nécrose papillaire occlusions spléniques par infarctus ou par séquestration
syndrome thoracique aigu
Le syndrome thoracique aigu est la complication grave la plus fréquente pouvant mettre en jeu le pronostic vital. Il se définit par l'association d'un nouvel infiltrat pulmonaire radiologique et d'un ou plusieurs des symptômes suivants : toux, fièvre, dyspnée aiguë, expectoration, douleur thoracique et anomalies auscultatoires. En pratique clinique, tout signe physique respiratoire est un syndrome thoracique jusqu'à preuve du contraire.
En prévention des CVO, des règles hygiéno-diététiques sont données aux patients.
Elles comprennent une hydratation orale de deux à trois litres par jour avec un demi-litre d'eau de Vichy dont la quantité est augmentée en cas d'effort, de forte chaleur, de fièvre, de diarrhée ou de vomissements, d'éviter le port de vêtements serrés, d'éviter les expositions au froid, à l'alcool et au tabac, d'éviter les circonstances d'hypoxie (les
Page | 5 séjours en altitude, les voyages en avion) et de pratiquer une activité physique modérée et adaptée. [7]
Le traitement des CVO comprend des antalgiques pour soulager la douleur. La dose des antalgiques peut être augmentée jusqu'à l'administration de morphine ou de dérivés opioïdes en cas de douleurs persistantes. Le patient doit également bénéficier d'une hydratation avec alcalinisation (eau de Vichy), d'une oxygénation et d'une kinésithérapie respiratoire incitative par prévention du syndrome thoracique aigu. [3]
On observe également dans la drépanocytose une susceptibilité accrue aux infections par la diminution des défenses immunitaires. Les personnes drépanocytaires sont plus sensibles aux pneumonies, à la grippe, aux hépatites, aux méningites, aux ostéomyélites, aux infections urinaires et aux septicémies [6].
Les infections favorisent la survenue des CVO et l'aggravation de l'anémie. Il est donc important de diminuer la sensibilité à ces infections. Pour cela, il faut maintenir à jour les vaccinations notamment anti-pneumococcique et anticoquelucheux. La vaccination antigrippale est recommandée. On administre parfois des antibiotiques au long cours en prévention (Oracilline®). [8]
Le défaut chronique de perfusion de certains organes entraîne leur défaillance, et donc l'apparition de complications chroniques.
Les principales sont la néphropathie pouvant évoluer vers une insuffisance rénale, l'hypertension artérielle pulmonaire, la cardiomyopathie pour compenser l'anémie chronique, les ulcères des jambes et la rétinopathie proliférante suite à une occlusion vasculaire rétinienne pouvant se compliquer d'un décollement de rétine ou d'une hémorragie intra-vitréenne.
De plus, l'hémolyse chronique entraîne une augmentation du flux de bilirubine dans les voies biliaires, ce qui explique la haute prévalence de lithiases pigmentaires chez ces patients (plus de 50% après l'âge de 20 ans).
Les programmes transfusionnels et l'hydroxyurée sont les seuls traitements de fond de la drépanocytose.
Page | 6 L'hydroxyurée stimule la production d'hémoglobine fœtale appelée hémoglobine F. Cette hémoglobine peut être synthétisée sans problème puisqu'elle ne comporte pas de chaîne β de la globine, ce qui permet de diminuer la polymérisation de l'hémoglobine S.
Grâce à ce traitement, on note une diminution des CVO, des syndromes thoraciques aigus, des hospitalisations, des transfusions et de la mortalité.
Ses indications sont la survenue de plus de 3 hospitalisations pour CVO en un an ou l'apparition ou la récidive d'un syndrome thoracique aigu grave.
Par mesure de précaution, ce médicament doit être arrêté dès qu'une grossesse est envisagée ou débutée.
La transfusion sanguine permet de diminuer la proportion d'hématies falciformes par l'apport d'hématies normales de donneurs sains compatibles.
Une transfusion ponctuelle est réalisée en cas de survenue d'une complication aigüe (aggravation de l'anémie, CVO, syndrome thoracique aigu).
Un programme transfusionnel est mis en place pour la prévention primaire ou secondaire de l'accident vasculaire cérébral en cas de vasculopathie cérébrale sténosante. Une transfusion sanguine est réalisée toutes les 3 à 6 semaines avec pour objectif de maintenir l'hémoglobine S en dessous de 30%.
Les principales complications transfusionnelles sont l'hémolyse post-transfusionnelle retardée qui est le plus souvent due à une allo-immunisation anti-érythrocytaire, et l'hémochromatose post-transfusionnelle. Les traitements chélateurs et les saignées permettent de limiter cette surcharge martiale.
Après la transfusion, l'hématocrite doit être en dessous de 33% pour éviter les complications de l'hyperviscosité sanguine (CVO, thromboses).
Les échanges transfusionnels ou exsanguino-transfusions correspondent à des transfusions accompagnées de saignées de 200 à 450 mL. Ils peuvent être réalisés si la concentration initiale en hémoglobine est supérieure à 7-8g/dL. [7]
D'autres traitements existent, notamment l'allogreffe de moelle qui se limite aux formes sévères (vasculopathie cérébrale, échec d'un traitement par hydroxyurée bien conduit) avec donneur HLA compatible.
La thérapie génique, elle, est encore à l'essai. Elle consiste à transfecter dans les cellules souches hématopoïétiques le gène β de la globine. [1]
Page | 7 Quel que soit le génotype (SS, SC, Sβ), la grossesse est une situation à haut risque chez les femmes drépanocytaires tant pour la mère que pour le fœtus, notamment au cours du troisième trimestre, lors de l'accouchement et dans le post-partum.
En effet, la grossesse augmente le risque de survenue de complications drépanocytaires, et inversement, la drépanocytose augmente le risque de survenue de complications obstétricales.
Les complications aigues de la drépanocytose susceptibles de survenir avec une plus grande fréquence sont l'aggravation de l'anémie dont le retentissement est à la fois fœtal et maternel, les CVO, le syndrome thoracique aigu et les infections urinaires.
Ce sont les modifications physiologiques de la grossesse qui favorisent leur apparition. L'anémie par hémodilution aggrave l'anémie préexistante. La demande importante en oxygène favorise la survenue d'un syndrome thoracique aigu. L'augmentation du débit cardiaque peut entraîner une mauvaise compliance ventriculaire avec des difficultés de remplissage durant la distale, ce qui majore le risque d'œdème aigu du poumon.
Les complications obstétricales les plus fréquentes sont la pré-éclampsie et l'hypertension gravidique. On note également une augmentation de la morbidité fœtale avec plus de retard de croissance intra-utérin (RCIU), de mort fœtale in utero (MFIU) et d'accouchements prématurés que dans la population générale. [9]
L'apparition de ces complications s'explique par l'apport insuffisant en oxygène et par l'existence d'infarctus placentaires liés à la présence d'hématies falciformes dans la circulation placentaire. [10]
A ces complications maternelles et fœtales est associée une proportion accrue de césarienne.
La mortalité maternelle périnatale survient principalement dans le post-partum dans 1 à 2% des grossesses en dépit de l'amélioration de la prise en charge. [9]
Page | 8 La transfusion sanguine reste une problématique importante dans la prise en charge de ces grossesses.
Effectivement, il a existé pendant longtemps un débat opposant les partisans de la transfusion prophylactique et ceux de la transfusion ponctuelle. [3] Aujourd'hui, dans les dernières recommandations françaises datant de 2015, il est préconisé d'instaurer un programme transfusionnel à partir de 22-26 semaines d'aménorrhée (SA) en cas de relais d'un traitement de fond par hydroxyurée, en cas d'atteinte organique sévère préexistante (insuffisance rénale, insuffisance cardiaque), en cas d'antécédents obstétricaux sévères ou en cas de survenue au cours de la grossesse d'une CVO sévère, de crises répétées, d'un syndrome thoracique aigu ou d'une anémie avec retentissement clinique maternel et/ou fœtal. En dehors de ces situations cliniques, la transfusion sanguine reste ponctuelle.
L'amélioration de la prise en charge de la drépanocytose a permis une augmentation de l'espérance de vie et donc un nombre croissant de femmes drépanocytaires en âge de procréer [11]. Ainsi, toute sage femme peut donc être confrontée à prendre en charge une patiente drépanocytaire.
La prise en charge de ces grossesses doit donc être multidisciplinaire avec un médecin référent pour la drépanocytose, une équipe de transfusion sanguine et un suivi par des gynéco-obstétriciens formés à la drépanocytose dans un centre hospitalier comprenant un service de réanimation néonatale et un service de soins continus voire de réanimation adulte. [7]
Au fil des années, de nombreuses recommandations ont été ajoutées concernant le suivi de ces grossesses à risque. Notre questionnement est donc : la prise en charge d'une grossesse chez une patiente drépanocytaire au CHU de Caen est-elle bien conforme aux recommandations nationales en vigueur ?
Dans un premier temps, nous vous présenterons le suivi de dix grossesses drépanocytaires pour ensuite évaluer le respect des recommandations.
Dans un second temps, nous comparerons nos données avec celles de la littérature et voir ainsi si nous pouvons apporter d'éventuelles améliorations à la prise en charge.
Page | 9
Page | 10
MATÉRIELS ET MÉTHODES :
Matériels :
L'objectif principal de ce mémoire est d'évaluer le respect des recommandations nationales dans la prise en charge des grossesses chez les patientes drépanocytaires au CHU de Caen.
Les objectifs secondaires sont :
d'évaluer la prévalence des complications maternelles et fœtales au sein de notre population
d'évaluer la prise en charge transfusionnelle et son impact au cours de ces grossesses.
Avec l'accord du comité de protection des personnes, nous avons conduit une étude rétrospective observationnelle entre juillet 2017 et janvier 2018.
Nous avons inclus dans notre étude toutes les femmes enceintes atteintes d'un syndrome drépanocytaire majeur suivies à la maternité du CHU de Caen.
Nos critères d'exclusion étaient : les patientes mineures les grossesses gémellaires
les patientes demandeuses d'une interruption volontaire de grossesse les patientes ayant un placenta prævia
et les patientes ayant fait une fausse couche spontanée inférieure à 12 semaines d'aménorrhées (SA).
Comme la base de données informatique n'a été développée qu'à partir de 2002, dix grossesses chez six patientes drépanocytaires ont été retenues pour l'étude. Ces grossesses ont eu lieu entre 2004 et 2017.
Page | 11
Méthodes :
Page | 12
Protocoles de prise en charge
Deux protocoles « Drépanocytose et Grossesse » se sont succédés au CHU de Caen. Le plus ancien datait de septembre 2007 (Annexe n°1) tandis que le deuxième qui est toujours en vigueur actuellement a été rédigé en février 2012 (Annexe n°2).
Ces protocoles de prise en charge spécifique de ces grossesses comprennent :
un interrogatoire qui permet de connaître les antécédents par rapport à la drépanocytose : rythme des crises drépanocytaires, antécédent de syndrome thoracique aigu, transfusions, ostéonécrose de la tête fémorale, lithiase vésiculaire... On vérifie également que la patiente était à jour au niveau de ses vaccinations.
une électrophorèse de l'hémoglobine du conjoint
un bilan initial en début de grossesse comprenant un électrocardiogramme, une échographie cardiaque, un fond d'œil, une épreuve fonctionnelle respiratoire, un bilan rénal, hématologique, viral et bactériologique.
un traitement systématique d'Aspégic® 100 mg/jour jusqu'à 35 SA et de Spéciafoldine® 5 mg/jour.
des consultations tous les 15 jours jusqu'à 35 SA puis toutes les semaines jusqu'à l'accouchement.
un suivi biologique (numération de formule sanguine, plaquettes, bilan
infectieux...) mensuel et un suivi échographique (biométries, dopplers utérins)
mensuel à partir de 26 SA. Dans le protocole de 2007, ce suivi échographique était commencé à partir de 24 SA. Dès 22 SA, des biométries et un doppler utérin doivent être réalisé dans le protocole de 2012.
une transfusion systématiquement tous les mois pour les patientes transfusées au long cours ou en cas d'antécédents de syndrome thoracique aigu, de complication neurologique, de pré-éclampsie, de RCIU et de MFIU dans le protocole de 2012. Pour les autres cas, la transfusion est indiquée en cas d'anémie sévère (Hémoglobine < 7g/dL).
Dans le protocole de 2007, les exsanguino-transfusions étaient débutées à partir de 24 SA ou avant selon la fréquence des CVO.
Page | 13 L'exsanguino-transfusion a pour but d'obtenir un taux d'hémoglobine normale aux alentours de 9 à 10 g/dL et de diminuer le taux d'hémoglobine S en dessous de 50%.
une hydratation, une antibiothérapie, une oxygénation, un réchauffement et une analgésie péridurale au cours de l'accouchement. Une ventouse doit être posée systématiquement après 20 minutes d'efforts expulsifs. Le placenta est envoyé en anatomopathologie. En cas d'hémorragie, l'usage du Nalador® doit être limité. une oxygénation, une kinésithérapie respiratoire, une hydratation, un traitement
anti-coagulant (sept jours) et antibiotique (dix jours) dans le post-partum pour prévenir les CVO et le syndrome thoracique aigu.
une oxygénation, un réchauffement, une hydratation, des antalgiques voire des morphiniques en cas de CVO. Il faut également donner les conseils suivants : éviter le froid, les efforts physiques prolongés, le stress, le tabac, l'alcool... [13] [14]
Recueil des données
Avec l'autorisation du chef de service de Gynécologie Obstétrique du CHU de Caen, j'ai pu avoir accès aux dossiers obstétricaux informatisés (Logiciel 4D Obstétrique) et sous format papier.
En effet, j'ai pu recueillir mes données à partir des dossiers de suivi de grossesse, des résultats des bilans biologiques, des comptes-rendus des hospitalisations et du détail de la prise en charge de ces grossesses.
Page | 14
RÉSULTATS :
CARACTÉRITIQUES DES PATIENTES
Tableau I : Génotype, Age, Gestité, Parité
Génotype drépanocytaire
Patientes Age moyen Gestité
moyenne Parité moyenne SS 4 26 1,6 0,4 SC 0 - - - Sβ 2 27 4,2 2
N (nombre total de patientes) = 6
Origine géographique
La majorité des patientes (67%) est originaire d'Afrique de l'Ouest tandis que deux patientes sont originaires d'Afrique centrale et des DOM-TOM respectivement.
Statut du conjoint
La majorité des partenaires est d'origine africaine. Seulement deux d'entre eux sont d'origine française.
Cinq partenaires (50%) ne sont pas porteurs du trait drépanocytaire. Deux (20%) sont porteurs d'une drépanocytose hétérozygote (Génotype AS), et trois (30%) ont un statut drépanocytaire inconnu malgré que deux d'entre eux soient d'origine africaine.
Quatre grossesses sont à risque de donner naissance à un enfant drépanocytaire homozygote.
Antécédents médicaux, chirurgicaux et gynécologiques
Toutes les patientes connaissaient leur statut drépanocytaire avant la grossesse.
Quatre patientes (67%) ont dans leurs antécédents médicaux des CVO. Deux sont de génotype SS tandis que les deux autres sont de génotype Sβ.
Une patiente de génotype SS a comme antécédents médicaux une ostéomyélite et une hémorragie rétinienne.
Page | 15 Une patiente de génotype Sβ souffre d'hypertension artérielle chronique.
Une patiente de génotype SS a subi une valvuloplastie sur rétrécissement mitrale et une cholécystectomie.
Une patiente de génotype Sβ présente une endométriose et un antécédent de dépression et de rupture de kyste ovarien.
DÉROULEMENT DE LA GROSSESSE Terme de la première consultation
Le terme moyen de la première consultation est de 12 SA + 3 jours.
Nombre d'échographies
Il y a 5,5 échographies obstétricales effectuées pendant la grossesse.
Hospitalisations
Huit grossesses ont nécessité une ou plusieurs hospitalisations. Le nombre moyen d'hospitalisations au cours de la grossesse est de 1,6 par patiente avec des extrêmes allant de 0 à 3 hospitalisations.
Tableau II : Motif d'hospitalisation
n % CVO 8 50 % Anémie symptomatique 2 12,5 % RCIU 2 12,5 % Pics hypertensifs 2 12,5 % Pré-éclampsie 1 6,25 % Traumatisme abdominal 1 6,25 %
N (nombre total d'hospitalisations) = 16 n = effectif
Page | 16
Complications
Toutes les grossesses sont marquées par une aggravation de l'anémie avec une hémoglobine en début de grossesse inférieure à leur hémoglobine de base.
Toutes les grossesses ont eu une complication ou plus.
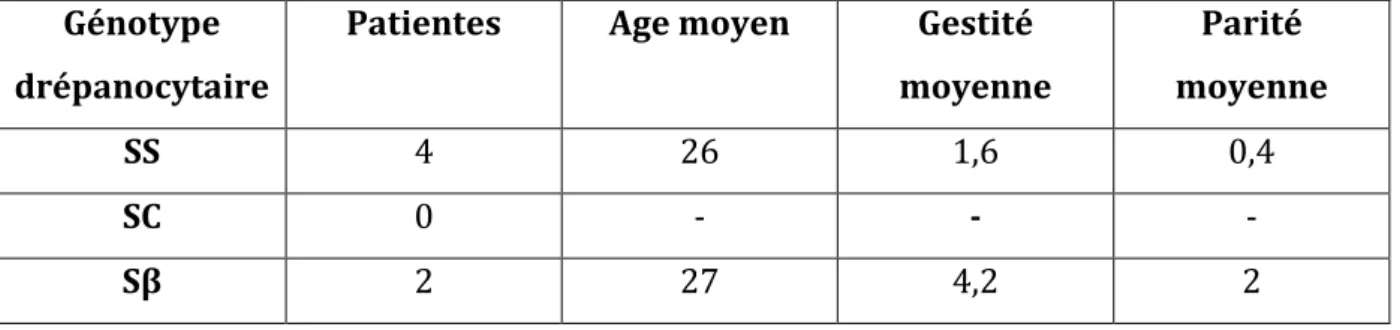
Figure 1 : Complications drépanocytaires, obstétricales et néonatales
Plusieurs CVO peuvent survenir au sein d'une même grossesse.
Tableau III : Survenue des complications en fonction du terme
1er Trimestre CVO
2ème Trimestre CVO, RCIU, MFIU, Pré-éclampsie
3ème Trimestre CVO, Anémie symptomatique, RCIU, MFIU, Cholestase gravidique, Infection urinaire, Pré-éclampsie
Post-partum CVO, Hypertension artérielle, Infection urinaire
N (nombre total de complications) = 24
42%
13%
9% 8% 8% 8% 4% 4% 4% CVO Prématurité Anémie symptomatique RCIU MFIU Infection urinaire Pré-éclampsie Cholestase gravidique Hémorragie de la délivrancePage | 17
Transfusions
Parmi les dix grossesses, six ont eu besoin d'une ou plusieurs transfusions sanguines.
Figure 2 : Type de transfusion Tableau IV : Indications des transfusions
n %
Programme transfusionnel secondaire 14 52 %
CVO 7 26 %
Programme transfusionnel dès le début de la grossesse 3 11 %
Anémie symptomatique 2 7 %
Hémorragie de la délivrance 1 4 %
N (nombre total de transfusions) = 27 n = effectif
Un seul programme transfusionnel a été mis en place à cause des antécédents sévères de la patiente.
Cinq programmes transfusionnels ont été mis en place secondairement, suite à la répétition ou la sévérité de complications.
63%
37%
Transfusion sanguine Exsanguino-transfusions
Page | 18
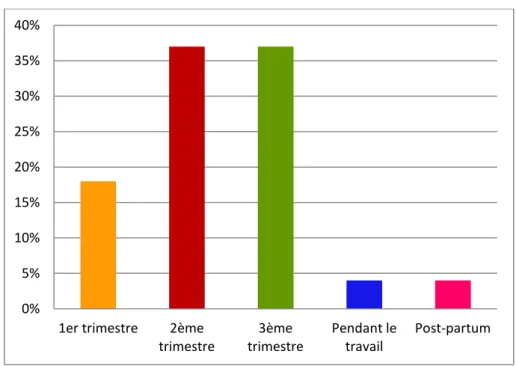
Figure 3 : Terme des transfusions
ISSUE DE LA GROSSESSE :
Tableau V : Voie d'accouchement
n %
Accouchement par voie basse spontané 0 0 %
Déclenchement du travail 3 30 %
Césarienne 6 60 %
Curetage évacuateur 1 10 %
N (nombre total de grossesses) = 10 n = effectif
Les indications de césarienne sont le RCIU sévère, la MFIU, la pré-éclampsie sévère, la drépanocytose non contrôlée et l'échec de déclenchement.
Les accouchements par voie basse sont quant à eux tous issus d'une maturation et/ou d'un déclenchement avec pour indication la drépanocytose ou une baisse des mouvements actifs fœtaux.
0% 5% 10% 15% 20% 25% 30% 35% 40%
1er trimestre 2ème trimestre 3ème trimestre Pendant le travail Post-partum
Page | 19
Terme d'accouchement
Huit enfants sont nés vivants (80%) dont cinq à terme (50%) et trois prématurément (30%). On note deux MFIU (20%).
Le terme moyen d'accouchement prématuré est de 30 SA + 4 jours. Les causes de prématurité sont le RCIU et une pré-éclampsie sévère.
Le terme moyen d'accouchement à terme est de 38 SA + 2 jours.
Poids de naissance
A terme, le poids de naissance moyen des nouveau-nés est de 2 406g.
Statut drépanocytaire des nouveau-nés
Tous les nouveau-nés ont bénéficié du dépistage néonatal de la drépanocytose. Quatre sont atteint d'une drépanocytose homozygote. Deux de ces couples n'avaient pas accepté le diagnostic anténatal tandis que pour les deux autres, le statut drépanocytaire du conjoint était inconnu.
Page | 20 ÉVALUATION DU RESPECT DES RECOMMANDATIONS :
Evaluation du respect des recommandations du Collège National des Gynécologues et Obstétriciens Français (CNGOF) de 2006 :
respectéPage | 21
Evaluation du respect des recommandations de la Revue de la médecine interne de 2009 :
respecté
non respectéPage | 22
Evaluation du respect des recommandations de la Revue de la médecine interne de 2015 :
respecté
non respectéPage | 23
DISCUSSION :
POINTS FORTS ET LIMITES DE L'ÉTUDE
En ce qui concerne les forces de l'étude, le faible nombre de patientes drépanocytaires m'a permis d'analyser de façon minutieuse les différentes données des dossiers médicaux : le mode de prise en charge et de surveillance comme la fréquence et les résultats des bilans biologiques, la réalisation ou non des doppler maternels et fœtaux...
De plus, cette étude est une observation supplémentaire sur le déroulement des grossesses drépanocytaires en France.
En effet, il existe très peu d'études françaises sur la drépanocytose et la grossesse. Au cours de mes recherches, j'ai identifié trois publications :
une étude en Guadeloupe entre 1993 et 1997 incluant 68 grossesses drépanocytaires [15]
une étude au CHU de Toulouse entre 2007 et 2010 incluant 14 grossesses drépanocytaires [16]
une étude en Guyane entre 2007 et 2013 incluant 62 grossesses drépanocytaires [17]
Cependant, cette étude reste restrictive puisqu'elle est basée sur un faible échantillon de patientes.
Ce nombre restreint de patientes se justifie par le fait que mon étude se limite à la maternité du CHU de Caen, et que la drépanocytose reste à ce jour une pathologie rare en Normandie. Une généralisation des résultats est donc discutable.
De plus, on ne peut pas réellement évaluer l'impact de la prise en charge actuelle du CHU de Caen sur la drépanocytose et grossesse puisqu'on ne compte que deux grossesses depuis les dernières recommandations de 2015.
La retranscription des données n’est pas exhaustive tant dans les dossiers papier que dans les dossiers médicaux informatisés, ce qui représente un biais d’information.
Page | 24 Par exemple, il n'est pas noté si un bilan pré-conceptionnel a été réalisé. De même, concernant les bilans biologiques en notre possession, nous ne pouvons pas savoir avec certitude s'ils sont tous présents.
RÉSUMÉ DES PRINCIPAUX RESULTATS ET CONFRONTATION AUX DONNÉES DE LA LITTÉRATURE
Durant la période d'étude, dix grossesses (cinq de femmes SS, cinq de femmes Sβthalassémique) ont été prises en charge chez six patientes (Tableau I).
Parmi elles, une patiente SS a eu deux grossesses et une patiente Sβ en a eu quatre. Huit enfants sont nés vivants dont cinq à terme et trois prématurément.
Les complications maternelles et fœtales :
Comme cela a déjà été rapporté par de nombreuses observations, notre étude montre une augmentation de la morbidité maternelle et fœtale.
En effet, il y a dans notre étude un taux élevé de complications maternelles (CVO, anémie symptomatique, pré-éclampsie, cholestase gravidique, infection urinaire) et fœtale (RCIU, MFIU, prématurité). Toutes les grossesses ont eu une complication ou plus mais aucune mort maternelle n'a été retrouvée.
Comme l'étude de Leborgne-Samuel et coll. de 1999 [15], la complication maternelle la plus fréquente est la CVO (42%) (Figure 1). Celle-ci est souvent associée à une aggravation de l'anémie (dossier n°4, n°9 et n°10) ou à un contexte infectieux (dossier
n°7).
La CVO peut survenir à n'importe quel terme de la grossesse. Toutefois, le troisième trimestre reste la période la plus à risque de complications drépanocytaires ou obstétricales (Tableau III).
Dans la plupart des études, il est montré que le post-partum est également une période à haut risque [15].
Cependant, seulement deux de nos patientes ont eu une complication pendant le post-partum (dossier n°7 et n°8). Dans le premier cas, une CVO, et dans le deuxième cas la
Page | 25 persistance d'une hypertension artérielle suite à une pré-éclampsie associée à une aggravation de l'anémie (Tableau III).
Cette différence peut être expliquée par le fait que dans la majorité des cas, la prise en charge en suites de couche au CHU de Caen est conforme aux recommandations (oxygénothérapie, antibioprophylaxie, hydratation, traitement anticoagulant préventif).
De plus, nous pouvons noter que le risque de pré-éclampsie (4%), d'anémie symptomatique (9%) et de syndrome thoracique aigu (0%) est sous-estimé dans notre étude. Effectivement, l'étude de Yu et coll. de 2009 [18] montre un taux d'anémie symptomatique à 34% et de pré-éclampsie à 9%, tandis que l'étude de Leborgne-Samuel et coll. [15] montre un taux de syndrome thoracique aigu à 13%. Ces différences peuvent être expliquées par le faible effectif de notre population.
Les principales complications fœtales sont le RCIU (8%) et la MFIU (8%)
(Figure 1). L'étude de Kuo et coll. de 2016 [19] montre bien le sur-risque de RCIU pour
les grossesses drépanocytaires avec un taux de RCIU à 16,2% pour ces grossesses contre 6,3% dans le groupe contrôle.
Cependant, le taux de RCIU reste variable d'une étude à l'autre. Par exemple, l'étude de Leborgne-Samuel et coll. [15] relève 8,8% de RCIU alors que deux autres études montrent un taux de RCIU aux alentours de 16% [17] [18].
Ces différences peuvent être expliquées par les prises en charge échographiques différentes d'un pays à l'autre.
Notre taux de MFIU est supérieur à ceux des autres études. L'étude de Leborgne-Samuel et coll. [15] montre un taux de MFIU à 5,8% tandis que l'étude de Oting-Ntim et coll. de 2010 [20] note 2,4% de MFIU.
Cependant, les deux MFIU de notre étude (dossier n°1 et n°6) ont été retrouvées chez une même patiente qui, en plus de sa drépanocytose βthalassémique, souffrait d'une hypertension artérielle chronique. Cette patiente avait également une mauvaise observance de son traitement anti-hypertenseur. Ces deux critères ajoutés augmentaient forcément son risque de MFIU au cours de ses grossesses.
Page | 26 Au cours de cette étude, nous avons observé 30% de naissances prématurées. Lorsqu'elle est présente, la prématurité est toujours induite du fait de complications annexes (RCIU, pré-éclampsie...).
Or, dans l'étude de Leborgne-Samuel et coll. [15] on observe un taux de prématurité spontanée de 3%. Dans les pays les moins avancés comme le Sénégal [21], le taux de prématurité spontanée est de 18,6%.
De plus, de nombreuses études montrent un taux de prématurité inférieure au notre. Le taux de prématurité était de 21% dans l'étude de Leborgne-Samuel et coll. [15], et de 19% dans l'étude de Oteng-Ntim et coll. [20]
Toutefois, le taux de prématurité chez les grossesses drépanocytaires reste nettement supérieur à celui de la population générale française qui est de 7,4%. [22]
Dans notre étude, le taux de césarienne s'élève à 60%, ce qui est en accord avec les données de la littérature.
En effet, on observe un taux élevé de césarienne dans toutes les études : 46,2% dans l'étude de Kuo et coll.[19]
43% dans l'étude de Yu et coll. [18]
48% dans l'étude de Leborgne-Samuel et coll. [15]
Tout comme dans l'étude de Yu et coll. [18] où 70% des césariennes se font en urgence, la majorité des césariennes de notre étude sont réalisées dans un contexte d'urgence, et non par contre-indication à la voie basse.
Les indications de césarienne sont le RCIU sévère, la MFIU, la pré-éclampsie sévère, la drépanocytose non contrôlée et l'échec de déclenchement.
Les accouchements par voie basse ont tous eu lieu après maturation et/ou d'un déclenchement. Trois ayant pour indication la drépanocytose, et un pour baisse des mouvements actifs fœtaux. Le terme moyen de déclenchement est de 38 SA + 2 jours, ce qui est en accord avec les nouvelles recommandations de 2015 qui préconisent un accouchement avant 39 SA [7].
Lorsque la grossesse est menée jusqu'à terme, le poids de naissance moyen des nouveau-nés à 38 SA + 2 jours est de 2 406g.
Page | 27 Si on place ce poids sur la courbe Audipog [23], on peut voir que ce poids est entre le 3ème et le 10ème percentile. Les nouveau-nés de mère drépanocytaires sont donc plus à risque d'hypotrophie néonatale.
Dans de nombreuses études, il est également montré que les patientes de génotype SS ont un risque plus élevé de complications. [15] [17] [20] Ceci n'est pas retrouvé dans notre étude. Cependant, notre échantillon de population comprend seulement deux patientes de génotype Sβ, dont une souffrant d'une hypertension artérielle sévère, ce qui augmente le risque de survenue de complications en rapport avec cette pathologie (MFIU, RCIU pré-éclampsie).
Ainsi, cette étude confirme que les femmes drépanocytaires sont plus à risque de complications au cours de leur grossesse. Comme d'autres études auparavant, notre étude montre que la complication qui survient le plus fréquemment est la CVO. On peut donc se demander si des améliorations peuvent être apportées dans la prise en charge pour en diminuer l'incidence.
Quant aux complications fœtales, les plus rencontrées sont le RCIU et la MFIU dont les taux restent variables d'une étude à l'autre.
D'autre part, le nombre limité de patientes de notre étude sous-évalue certaines complications comme l'anémie symptomatique, la pré-éclampsie et le syndrome thoracique aigu.
La prise en charge transfusionnelle :
Comme dans l'étude de Sharif et coll. de 2017 [24], l'indication de transfusion sanguine la plus fréquente est la CVO. Les autres indications sont l'anémie symptomatique et l'hémorragie de la délivrance (Tableau IV). Notre taux de grossesses transfusées est également similaire. En effet, 60% des grossesses ont eu besoin d'une ou plusieurs transfusions sanguines.
Par contre, les transfusions sont réalisées majoritairement au deuxième et au troisième trimestre (Figure 3) alors qu'elles avaient lieu surtout au troisième trimestre et au cours du post-partum dans l'étude de Sharif et coll.
Page | 28 Pour la plupart de ces patientes, la transfusion sanguine est d'abord ponctuelle suite à une CVO ou une anémie symptomatique. Puis, devant la répétition de ces complications, un programme transfusionnel ou d'échanges transfusionnels est mis en place secondairement. Suite à cette mise en place, on observe une absence de nouvelles complications drépanocytaires.
Au final, une seule patiente a eu un programme transfusionnel instauré dès le début de sa grossesse pour antécédents obstétricaux sévères (dossier n°3). Comme cette patiente souffrait d'hypertension artérielle chronique, celui-ci n'a pas été bénéfique puisqu'on notait des pics hypertensifs lors des transfusions. D'ailleurs, cette même patiente n'a pas eu de programme transfusionnel pour ses deux grossesses ultérieures.
La majorité des transfusions sont des transfusions sanguines (63%) (Figure 2). Les exsanguino-transfusions sont plus réalisées en traitement préventif que curatif puisque dans le contexte d'urgence, les taux d'hémoglobine ne le permettaient pas. Aucun incident transfusionnel n'a été relevé.
Aujourd'hui, il existe encore un débat qui oppose la transfusion sanguine prophylactique à la transfusion sanguine d'urgence indiquée en cas de complications drépanocytaires ou obstétricales. Mais, très peu d'études rigoureuses n'ont été menées sur le sujet.
La seule étude randomisée a été réalisée entre 1979 et 1986 au Royaume-Uni [25]. Une population de 72 femmes enceintes atteintes de la drépanocytose homozygote a été divisée en deux groupes. Le premier groupe recevait des transfusions prophylactiques pendant toute la durée de la grossesse tandis que le deuxième bénéficiait seulement de transfusions ponctuelles en cas d'urgence médicale ou obstétricale.
Cette étude a montré que la transfusion prophylactique n'a pas d'impact :
sur les complications obstétricales (terme d'accouchement, accouchement prématuré, décollement placentaire, pré-éclampsie, césarienne...)
sur la morbidité fœtale (RCIU, MFIU)
et sur les complications transfusionnelles (taux d'allo-immunisation similaire dans les deux groupes).
Page | 29 Par contre, elle permettait de diminuer la fréquence d'apparition des CVO (14% de
CVO dans le groupe transfusé au long-cours contre 50% dans le groupe transfusé ponctuellement).
En effet, la transfusion prophylactique permet de remédier aux modifications physiologiques apportées par la grossesse. En premier lieu, elle permet de corriger l'anémie en améliorant la capacité de transport en oxygène des hématies. En deuxième lieu, elle permet de réduire la proportion d'hémoglobine S en abaissant le stimulus médullaire, ce qui permet de bien diminuer la survenue des CVO.
Cependant, au vu des nombreuses complications transfusionnelles (allo-immunisation, surcharge martiale, infections transmissibles par le sang...), il n'est pas préconisé d'instaurer des transfusions prophylactiques pour toutes les grossesses drépanocytaires avec seulement pour but de réduire la survenue de ces CVO. Il faut baser l'instauration d'une transfusion prophylactique par rapport à l'histoire médicale des patientes (atteinte organique sévère préexistante, antécédents obstétricaux sévères). On peut retrouver cette notion dans les dernières recommandations françaises de 2015 [7].
Une méta-analyse réalisée en 2015 suggère que la transfusion prophylactique au cours d'une grossesse permet une réduction :
des CVO
de la mortalité maternelle des complications pulmonaires des embolies pulmonaires de la mortalité néonatale
et des accouchements prématurés.
Par contre, la transfusion prophylactique n'a pas d'impact sur la survenue ou non d'une pré-éclampsie ou d'un RCIU. Bien que les causes du RCIU puissent être diverses, le processus le plus probable dans le cadre de la drépanocytose est l'insuffisance placentaire suite à l'obstruction de petits vaisseaux pouvant entraîner une altération du développement du placenta. Cette méta-analyse explique cette absence d'impact par les circonstances dans lesquelles la transfusion prophylactique a été instaurée. Aucune étude n'a initié la transfusion prophylactique assez précocement pour avoir un effet bénéfique sur le développement précoce du placenta. Ils recommandent alors de
Page | 30 commencer un programme transfusionnel en péri-conceptionnel ou dès que la grossesse est diagnostiquée [26].
Nous pouvons voir dans notre étude que la transfusion sanguine est un point essentiel de la prise en charge des grossesses drépanocytaires. Elle peut être réalisée à visée préventive ou curative. Pendant de nombreuses années et encore aujourd'hui, un débat a opposé la transfusion prophylactique à la transfusion ponctuelle. Toutes les études affirment que la transfusion prophylactique diminue la fréquence des CVO.
Il a fallu attendre les recommandations françaises de 2009 [12] réactualisées en 2015 [7] pour avoir des indications plus concrètes de mise en place d'un programme transfusionnel prophylactique pendant la grossesse (programme transfusionnel avant la grossesse, relais d'un traitement par hydroxyurée, atteinte organique sévère préexistante, antécédents obstétricaux sévères, anémie avec retentissement maternel et/ou fœtal).
ÉVALUATION DU RESPECT DES RECOMMANDATIONS Les recommandations du CNGOF de 2006 :
Les recommandations de prise en charge du CNGOF de 2006 [3] sont globalement bien respectées mais non bénéfiques.
En effet, malgré une évaluation clinique, biologique et radiologique bien menée au cours de ces grossesses, on note la survenue de complications drépanocytaires pour les dossiers n°2, n°4 et n°5 (anémie symptomatique, CVO).
Lors de l'apparition des ces complications, le taux d'hémoglobine oscille entre 6,5g/dL et 8,3g/dL. Il nous est donc impossible de fixer un taux d'hémoglobine en dessous duquel une CVO ou une anémie symptomatique peuvent survenir.
Cependant, malgré l'absence de recommandations transfusionnelles concrètes à cette époque, c'est la mise en place de transfusions prophylactiques qui a permis l'absence de répétition de ces complications.
Page | 31 Bien que le suivi échographique ait été bien réalisé au cours de ces grossesses, on note la survenue de complications obstétricales pour les dossiers n°3 et n°4 (pré-éclampsie, RCIU). Le RCIU ne pouvait être prédit dans le dossier n°4.
Quant au dossier n°3, en lien avec la méta-analyse de 2015 [26], on peut se demander si la mise en place précoce d'un programme transfusionnel aurait pu éviter l'apparition d'une pré-éclampsie chez cette patiente qui avait déjà comme antécédent une MFIU. A l'exception du dossier n°4, l'électrophorèse de l'hémoglobine du conjoint a toujours été réalisée. Toutes les patientes ont bien bénéficié d'une analgésie péridurale.
Certaines recommandations ne sont pas respectées, mais cela n'a pas d'impact sur le déroulement de la grossesse.
Par exemple, lorsque le doppler utérin n'a pas été réalisé entre 20 et 24 SA, la grossesse ne s'est pas compliquée d'un RCIU. Il n'y a donc pas de retard dans le diagnostic de cette complication.
Lorsque l'antibioprophylaxie n'a pas été administré pendant le travail, la patiente n'a pas présenté d'infection au cours du post-partum.
Lorsque le réchauffement, la réhydratation, l'oxygénation et la prévention des thromboses et des infections n'ont pas été réalisés en suites de couches, on observe une absence de complication pour cette patiente.
Les recommandations de la revue de Médecine interne de 2009 :
Les recommandations de prise en charge de la revue de Médecine interne de 2009 [12] sont partiellement respectées.
En effet, au niveau du suivi biologique, il manque dans le bilan de début de grossesse les sérologies de l'hépatite C, du cytomégalovirus, du parvovirus B19 et le dosage des réticulocytes et de la ferritine dans le bilan mensuel. Le prélèvement vaginal trimestriel n'a jamais été réalisé. Aucun retentissement n'a été noté. Cette recommandation est d'ailleurs plus présente dans les recommandations de 2015.
L'échographie cardiaque et les épreuves fonctionnelles respiratoires ont bien été programmées.
Aucune transfusion n'a été réalisée pour ces trois grossesses. Pour les dossiers n°6 et n°8, un programme transfusionnel aurait du être mis en place avant 22 SA pour
Page | 32 antécédents de MFIU et de pré-éclampsie sévère. Cependant, un programme transfusionnel avait été mis en place à partir de 26 SA à sa dernière grossesse mais n'avait pas été bénéfique puisqu'il provoquait des pics hypertensifs à chaque transfusion sanguine chez cette patiente souffrant d'hypertension artérielle chronique. Ainsi, l'instauration d'un programme transfusionnel n'aurait pas forcément été bénéfique.
Certaines recommandations ne sont pas respectées et ont eu un d'impact sur le déroulement de la grossesse.
Par exemple, pour le dossier n°7, l'absence d'antibioprophylaxie pendant le travail et les suites de couches a entraîné une CVO suite à une surinfection de la cicatrice de césarienne.
Les recommandations de la revue de Médecine interne de 2015 :
Les recommandations de prise en charge de la revue de médecine interne de 2015 [7] sont globalement bien respectées et bénéfiques. En effet, les deux grossesses ont pu être menées à terme. Tous les accouchements ont bien eu lieu avant 39 SA.
Deux éléments peuvent avoir eu un impact sur la survenue de complications au cours de ces deux grossesses.
Le premier est que l'acide folique a été prescrit à 5mg par jour au lieu de 10mg par jour. On peut se demander si l'anémie symptomatique diagnostiquée dans le dossier n°9 aurait pu être évitée avec une bonne prescription.
Le deuxième concerne la prise en charge transfusionnelle qui est conforme aux recommandations mis à part qu'une exsanguino-transfusion aurait dû être réalisée dans le dossier n°10 puisque le taux d'hémoglobine était supérieur à 7,5g/dL. L'exsanguino-transfusion étant plus efficace pour diminuer le taux d'hémoglobine S [27] on peut se demander si elle aurait pu empêcher la répétition d'une nouvelle CVO.
Certaines recommandations ne sont pas respectées, mais cela n'a pas d'impact sur le déroulement de la grossesse.
Par exemple, au niveau du bilan biologique mensuel, il manquait surtout l'examen cytobactériologique des urines. Cependant, aucune des patientes n'a eu d'infection urinaire ou de CVO en rapport avec une infection urinaire.
Page | 33 Nous pouvons voir qu'au fil des années, nous avons une amélioration du pronostic maternel et fœtal puisque les dernières grossesses suivies au CHU de Caen ont pu être menées jusqu'à terme sans morbidité fœtale.
Les recommandations sur le suivi biologique mensuel, le suivi échographique et la prise en charge en suites de couches sont les points essentiels à respecter. Les deux derniers points sont globalement bien respectés au CHU de Caen. Le premier point reste encore à améliorer. En effet, le bilan biologique mensuel est souvent incomplet et ne permet pas une évaluation clinique optimale de la patiente.
Enfin, la transfusion sanguine reste l'enjeu majeur à affiner pour optimiser le suivi de ces grossesses.
Par l'analyse de ces différents cas cliniques, nous pouvons proposer trois améliorations à apporter à la prise en charge actuelle.
MES PROPOSITIONS DE PRISE EN CHARGE : Première proposition :
Chez les patientes ayant dans leurs antécédents médicaux plusieurs CVO, il faudrait instaurer des transfusions prophylactiques après la survenue d'une seule CVO pendant la grossesse. Cela permettrait d'éviter leur probable répétition.
En effet, à l'exception d'un cas clinique (dossier n°4), les patientes ayant eu des CVO pendant leur grossesse sont celles ayant dans leurs antécédents médicaux une ou plusieurs CVO (dossier n°5, n°7, n°9 et n°10).
Les patientes des dossiers n°7 et n°9 n'ont eu qu'une seule CVO pendant la grossesse alors qu'elles avaient dans leurs antécédents médicaux qu'une seule CVO.
Les patientes des dossiers n°5 et n°10 ont fait des CVO à répétition pendant la grossesse. Ces deux patientes avaient dans leurs antécédents médicaux de nombreuses CVO pendant l'enfance.
Page | 34 Celui-ci a été mis en place :
après la deuxième CVO pour le dossier n°5 après la troisième CVO pour le dossier n°10.
Suite à cette mise en place, on observe une absence de CVO, ce qui confirme la diminution des CVO par la transfusion prophylactique.
De plus, si le taux d'hémoglobine le permet, il est préférable d'effectuer des exsanguino-transfusions puisqu'elles sont plus efficaces pour réduire le taux d'hémoglobine S. Elles réduisent également la viscosité sanguine et n'entrainent pas de surcharge martiale. [27]
Deuxième proposition :
En cas d'antécédents de RCIU, de MFIU ou de pré-éclampsie, en plus de la prescription d'Aspégic® il faut instaurer un programme de transfusions prophylactiques en péri-conceptionnel ou dès le début de la grossesse afin d'avoir réellement un impact sur l'implantation et le développement placentaire, et ainsi diminuer le risque de récidive.
Troisième proposition :
Il faudrait instaurer l'oxygénothérapie nocturne pour toutes les patientes enceintes drépanocytaires pour augmenter le nombre d'hémoglobines S oxygénées et ainsi diminuer le nombre d'hémoglobines S désoxygénées. Au final, cela permettrait de diminuer le nombre d'hématies falciformes et donc de diminuer le risque de CVO.
Page | 35
Page | 36 Cette étude confirme que la grossesse chez la femme drépanocytaire est une grossesse à haut risque.
En effet, nous retrouvons dans notre population une grande partie des complications maternelles et fœtales décrites dans la littérature. Comme dans d'autres études, la complication la plus fréquente est la CVO pouvant survenir à n'importe quel terme de la grossesse. Il est donc important d'essayer de trouver des critères pouvant prédire sa survenue ou sa répétition.
Dans notre étude, nous avons remarqué que les femmes ayant des CVO à répétition correspondent aux femmes ayant dans leurs antécédents médicaux plusieurs CVO pendant l'enfance.
Cependant, il faudrait confirmer ou infirmer ce critère dans une étude avec un plus grand échantillon de patientes drépanocytaires.
La transfusion sanguine a une place essentielle dans la prise en charge préventive et curative de ces grossesses. Le seul rôle de la transfusion prophylactique qui a été prouvé à ce jour est sa capacité de diminuer la fréquence des CVO. Néanmoins, il faudrait étudier plus en profondeur son impact sur le RCIU ou la pré-éclampsie en instaurant un programme transfusionnel précoce en cas d'antécédents de ces deux pathologies.
Concernant les recommandations nationales de prise en charge des grossesses drépanocytaires, il faut savoir qu'elles sont globalement bien respectées au CHU de Caen. Il reste tout de même quelques écarts de pratique qui peuvent être expliquées par le fait que la drépanocytose reste une pathologie rare dans notre région et que tous les praticiens ne sont pas habitués à les prendre en charge.
Aujourd'hui, avec les flux migratoires, il est important que les professionnels de santé y soient formés. Le protocole Drépanocytose et Grossesse du CHU de Caen de 2012 [14] est en accord avec les recommandations actuelles [7] et permet d'aider au mieux les obstétriciens ou les sages-femmes qui peuvent rencontrer ces patientes au cours de leur grossesse, de leur accouchement ou du post-partum. Bien entendu, la prise en charge de ces grossesses doit être pluridisciplinaire avec une surveillance rapprochée et alternée entre un hématologue et un obstétricien dans une maternité de niveau III.
1. Mattioni S, Stankovic Stojanovic K, Girot R, Lionnet F. La drépanocytose en France. RFL. 2016 Avr ; (481) : 61-66
2. Oteng-Ntim E. Pregnancy in women with SCD is associated with risk of maternal and perinatal mortality and severe morbidity. J Midwifery Womens Health. 2017 Mar 3 ; 62 (2)
3. Janky E, Etienne-Julan M., Kadhel PH, Leborgne-Samuel Y, Melki E. Drépanocytose et grossesse. CNGOF. 2006 Nov 29 ; Tome XXX
4. Inserm. (page consultée le 28 novembre 2017). Drépanocytose : la maladie
génétique la plus fréquente en France, [en ligne].
https://www.inserm.fr/information-en-sante/dossiers-information/drepanocytose
5. Allaf B, Couque N, Benkerrou M. Dépistage néonatal de la drépanocytose. RFL. 2016 Avr ; (481) : 77-83
6. Orphanet. (page consultée le 20 novembre 2016) La Drépanocytose, anémie
falciforme, anémie à hématies falciformes. [en ligne]
https://www.orpha.net/data/patho/Pub/fr/Drepanocytose-FRfrPub125v01.pdf
7. Habibi A, Arlet JB, Stankovic K, Gellen-Dautremer J, Ribeil JA, Bartolucci P, Lionnet F, centre de référence maladies rares « syndromes drépanocytaires majeurs ». Recommandations françaises de prise en charge de la drépanocytose de l'adulte : actualisation 2015. Rev. Med. Interne. 2015 Mai 11 ; 36 (Issue 5, Supplément 1) : 5S3-5S84
8. Haute Autorité de Santé. (page consultée le 25 novembre 2016). Syndromes drépanocytaires majeurs de l'adulte. Protocole national de diagnostic et de soins pour une maladie rare. Janvier 2010 [en ligne]
https://www.has-sante.fr/portail/upload/docs/application/pdf/2010-04/ald_10_guide_drepano_adulte_web.pdf
9. Prise en charge de la grossesse chez les femmes atteintes d'un syndrome drépanocytaire majeur. In : Benachi A, Mandelbrot L, Picone O. Pathologies maternelles et grossesse. Issy-les-Moulineaux : Elsevier Masson SAS ; 2014 Nov : 301-308
10. Maladies hématologiques. In : Barron W, Lindheimer M, Davison J. Médecine de la femme enceinte. Paris : Flammarion Médecine-Sciences ; 1990 : 285-286
11. Oteng-Ntim E, Meeks D, Seed P, Webster L, Howard J, Doyle P, Chappell L. Adverse maternal and perinatal outcomes in pregnant women with sickle cell disease : systematic review and meta-analysis. J Blood. 2015 May 21 ; 125 (21) : 3316-3325
12. Lionnet F, Arlet JB, Bartolucci P, Habibi A, Ribeil JA, Stankovic K. Recommandations pratiques de prise en charge de la drépanocytose de l'adulte. Rev. Med. Interne. 2009 Sept 9 ; 30 (S3) : S162-S223
13. Simonet T, Grossetti E, Dreyfus M, Herlicoviez M. Protocole du CHU de Caen : Suivi de grossesse d'une femme drépanocytaire. 2007 Sept
14. Simonet T. Protocole du CHU de Caen : Drépanocytose et Grossesse. 2012 Fév 28 15. Leborgne-Samuel Y, Janky E, Venditelli F, Salin J, Daijardin JB, Couchy B, Etienne-Julan M, Berchel C. Drépanocytose et grossesse : revue de 68 observations en Guadeloupe. J Gynecol Obstet Biol Reprod. 2000 ; 29 (1) : 86-93
16. Fazal Janot J, Cougoul P, Comont T, Sartor A, Bloom D, Ollier S, Beyne-Rauzy O, Parant O, Adoue D. Drépanocytose et grossesse : l'expérience du CHU de Toulouse. Rev. Med. Interne. 2012 Juin ; 33 (S1) : S102
17. Elenga N, Adeline A, Balcaen J, Vaz T, Calvez M, Terraz A, Accrombessi L, Carlez G. Pregnancy in Sickle Cell Disease Is a Very High-Risk Situation : An Observational Study. J Gynaecol Obstet. 2016 ; 2016
18. Yu CKH, Stasiowska E, Stephens A, Awogbade M, Davies A. Outcomes of pregnancy in sickle cell disease patients attending a combined obstetric and haematology clinic. J Obstet Gynaecol. 2009 Aug ; 29 (6) : 512-516
19. Kuo K, Caughey AB. Contemporary outcomes of sickle cell disease in pregnancy. Am J Obstet Gynecol. 2016 Oct ; 215 : 505.e1-505e5
20. Chase AR, Sohal M, Howard J, Laher R, McCarthy A, Layton DM, Oting-Ntim E. Pregnancy outcomes in sickle cell disease : a retrospective cohort study from two tertiary centres in the UK. Obstet Med. 2010 ; 3 : 110-112
21. Faye BF, Kouame KB, Seck M, Diouf AA, Gadji M, Dieng N, Touré SA, Sali A, Toure AO, Diop S. Challenges in the management of sickle cell disease during pregnancy in Senegal, West Africa. Hematol J. 2018 Jan ; 23 (1) : 61-64
22. Inserm. (page consultée le 03 mars 2018). Prématurité : Ces bébés qui arrivent trop tôt, [en ligne]. https://www.inserm.fr/information-en-sante/dossiers-information/prematurite
23. Audipog. (page consultée le 03 mars 2018). Mise à jour des courbes de morphométrie néonatale : poids des garçons et des filles à la naissance, [en ligne].
http://www.audipog.net/pdf/courbes_pds.pdf
24. SharifJ, Byrd L, Stevenson K, Raddats J, Morsman E, Ryan K. Transfusion for sickle cell disease in pregnancy : a single-centre survey. BBTS. 2017Ju 30
25. Koshy M, Burd L, Wallace D, Moawad A, Baron J. Prophylactic red-cell transfusions in pregnant patients with sickle cell disease. N Engl J Med. 1988 ; 319 (22) : 1447-1452
26. Malinowski A, Shehata N, D'Souza R, Kuo K, Ward R, Shah P, Murphy K. Prophylactic transfusion for pregnant women with sickle cell disease : a systematic review and meta-analysis. Blood. 2015 Nov 19 ; 126 (21) : 2424-2435 27. Driss F, Tertian G, Becquemont L, Haddad B, Cynober T, Raphael M, Tchernia G.
Prise en charge des grossesses à risque chez les femmes drépanocytaires : intérêt d'une stratégie préventive par des transfusions de globules rouges ou des échanges érythrocytaires automatisés. Transfus Clin Biol. 2007 ; 14 (4) : 386-392