© Nicolas Perrot, 2020
Impact des déterminants génétiques et
environnementaux sur le risque de sténose aortique
Thèse
Nicolas Perrot
Doctorat en médecine moléculaire
Philosophiæ doctor (Ph. D.)
Impact des déterminants génétiques et
environnementaux sur le risque de sténose aortique
Thèse
Nicolas Perrot
Sous la direction de :
Benoit Arsenault, directeur de recherche
Yohan Bossé, codirecteur de recherche
ii
Résumé
La sténose aortique (SA) est caractérisée par un rétrécissement de l’orifice valvulaire, entraînant une résistance à l’écoulement du sang au travers de celle-ci. Les processus fibro-calciques impliqués dans la physiopathologie de la SA étaient considérés comme étant dégénératifs en raison de l’usure des feuillets dépendant du temps avec un dépôt de calcium passif. Dorénavant, il est admis que la maladie de la valve calcifiante est un processus de maladie actif avec dépôt de lipoprotéines, cascade inflammatoire et calcification active des feuillets. En l’absence de thérapie pharmacologique efficace, le seul moyen d’améliorer le pronostic est le remplacement valvulaire aortique. Cependant, cette procédure convertit une maladie valvulaire en une maladie prosthétique. La SA et les maladies cardiovasculaires partagent de nombreux facteurs de risques, notamment l’hypertension artérielle systémique, le diabète de type 2, l’obésité ainsi que l’hypercholestérolémie. Dans le cadre de cette thèse, je me suis intéressé à trois des facteurs de risque partagés, cibles de thérapies existantes ou en cours de développement visant les maladies cardiovasculaires : la lipoprotéine(a), PCSK9 (impliqué dans le métabolisme du cholestérol transporté par les lipoprotéines de faible densité/C-LDL) et la phospholipase A2 associée aux lipoprotéines (Lp-PLA2).
La première hypothèse de recherche était que les thérapies ciblant les trois facteurs de risque susnommés pourraient être repositionnées dans le traitement de la SA. L’objectif associé était d’apporter des évidences de causalité entre la lipoprotéine(a), PCSK9, et la Lp-PLA2 dans le risque de SA. La deuxième hypothèse de recherche était que le risque de SA pourrait être réduit par l’adoption d’un mode de vie sain et la gestion des facteurs cliniques. L’objectif associé était d'évaluer l'association entre un score de santé cardiovasculaire idéale défini par l’indice de masse corporelle, l’alimentation, l’activité physique, le statut tabagique, la pression artérielle systémique, le diabète de type 2, le cholestérol total et le risque de SA.
Les résultats de cette thèse suggèrent que les patients atteints de SA sont caractérisés par des niveaux plus élevés de Lp(a) par rapport aux individus sans SA. En étudiant l'association entre un score de risque génétique pondéré associé à des niveaux plus élevés de Lp(a) et le risque de SA stratifiées pour la présence de maladie coronarienne, nous avons constaté que l'association entre les niveaux de Lp(a) génétiquement élevés et la SA était indépendante de la présence ou de l’absence de maladie coronarienne. Pour caractériser davantage l'association entre la Lp(a) avec la calcification valvulaire, nous avons évalué la microcalcification de la valve aortique par 18F-NaF tomographie par émission de positron couplé à la tomographie axiale (PET/CT). Nous avons constaté que les individus sans SA avec un niveau élevé de Lp(a) avaient une captation de 40% plus élevée de 18F-NaF dans la valve aortique par rapport aux individus avec des niveaux plus faibles de Lp(a). Dans une étude de preuve de concept, nous avons constaté que les parents de premier degré de patients avec une
iii
SA et un niveau élevé de Lp(a) pourraient être plus à risque de microcalcification de la valve aortique mesurée par 18F-NaF PET/CT par rapport à des participants avec un niveau de Lp(a) inférieurs.
Par la suite nous avons confirmé que des variants dans le gène PCSK9 associées à des niveaux de C-LDL inférieurs sont également associées à un risque réduit de SA et nous avons démontré que PCSK9 est présente dans les valves aortiques humaines. Notre approche expérimentale in vitro, a montré que le traitement des cellules interstitielles valvulaires (VIC) avec un anticorps anti-PCSK9 réduisait l'accumulation de calcium dans les VIC soumis à un stimulus pro-ostéogénique.
Bien qu’une association entre une activité plasmatique plus élevée de Lp-PLA2 et le risque de SA ait été observé, aucune association entre des variants génétiques au locus PLA2G7, associées à la masse ou à l'activité de Lp-PLA2, et le risque de SA n’a été observée. Par conséquent, il est peu probable que la masse ou l'activité de Lp-PLA2 représente un facteur de risque causal ou une cible thérapeutique de la SA.
Finalement, nous avons montré que les individus avec un score de santé cardiovasculaire idéale plus élevé avaient un risque de SA significativement réduit de 55% comparativement aux individus avec un score plus faible.
L’ensemble de ces résultats suggère que les inhibiteurs présents et futurs de PCSK9 et de la Lp(a) pourraient être repositionnés afin de lutter contre la propagation de la SA. Finalement, nous avons observé une association importante entre les facteurs de risque associés à un mode de vie sain et l’incidence de la SA, suggérant ainsi que la SA pourrait être enrayée.
iv
Abstract
Aortic stenosis (AS) is characterized by a narrowing of the aortic valve opening, resulting in resistance to the flow of blood through it. The fibrocalcific processes involved in the pathophysiology of AS were once considered to be degenerative due to time-dependent leaflets thickening with passive calcium deposition. Henceforth, it is recognized that calcific aortic valve disease is an active disease process with the deposition of lipoproteins, inflammatory cascade and active calcification. In the absence of effective pharmacological therapy, the only way to improve the prognosis is aortic valve replacement. However, it converts a native valve disease into a prosthetic disease. AS and cardiovascular diseases share many risk factors, including systemic hypertension, type 2 diabetes, obesity, and high cholesterol. Within this thesis, I am particularly interested in three shared risk factors, approved targets of therapies or therapies under development targeting cardiovascular diseases: lipoprotein(a), PCSK9 (involved in the metabolism of low-density lipoproteins cholesterol/ LDL-C) and lipoprotein-associated phospholipase A2 (Lp-PLA2).
The first research hypothesis was that drugs targeting the three aforementioned risk factors can be repositioned in treatment of AS. The associated objective was to provide evidence of causality between lipoprotein(a), PCSK9 and Lp-PLA2 in the risk of AS. The second research hypothesis was that the risk of AS can be reduced by adopting a healthy lifestyle and managing clinical risk factors. The associated objective was that an ideal cardiovascular health score defined by body mass index, diet, physical activity, smoking status, systemic blood pressure, type 2 diabetes, total cholesterol is associated to the risk of AS.
The results of this thesis suggest that patients with AS are characterized by a higher level of Lp(a), compared to individuals without AS. By studying the association between a weighted genetic risk score associated with higher Lp(a) levels and the risk AS stratified for the presence of coronary artery disease, we found the association between genetically elevated Lp(a) level and AS to be independent of the presence or absence of coronary artery disease. To further characterize the association between Lp(a) with valve calcification, we evaluated microcalcification of the aortic valve by 18F-NaF positron emission tomography coupled with computed tomography (PET/CT). In adults without AS, our results suggest that compared to individuals with lower levels of Lp(a), individuals with a high level of Lp(a) had a 40% higher uptake of 18F-NaF in the aortic valve. In a proof of concept study, we observed that compared to participants with a lower Lp(a) level, first-degree relatives of patients with AS and a high level of Lp(a) may be at higher risk for aortic valve microcalcification assessed by 18F-NaF PET/CT.
Subsequently, we confirmed that variants in the PCSK9 gene lowering LDL-C levels are also associated with a reduced risk of AS and we showed that PCSK9 is expressed in human aortic valves. Our in-vitro experimental
v
approach has demonstrated that the treatment of valve interstitial cells (VICs) with an anti-PCSK9 antibody reduces calcium accumulation in VICs exposed to a pro-osteogenic stimulus.
We also observed that a higher activity of Lp-PLA2 in the plasma is associated with a higher risk of AS. However, we found no association between genetic variants at the PLA2G7 locus associated with the mass or activity of Lp-PLA2 and the risk of AS. Therefore, the mass or activity of Lp-PLA2 is unlikely to represent a causal risk factor or a therapeutic target for AS.
Finally, we showed that compared to individuals with a lower ideal cardiovascular health score, individuals with a higher score had a significantly 55% reduced AS risk.
All of these results suggest that the present and future inhibitors of PCSK9 and Lp(a) could be repositioned in order to fight the spread of AS. Ultimately, we observed a substantial reduction in the risk of AS in people with a healthy lifestyle who controlled clinical risk factors, suggesting that AS could be a preventable disease.
vi
Table des matières
Résumé ... ii
Abstract ... iv
Table des matières ... vi
Liste des figures ... x
Liste des tableaux... xii
Liste des abréviations, sigles, acronymes ... xiii
Remerciements ... xvi
Avant-propos ... xvii
Introduction ... 1
1. Généralités sur la valve aortique ... 1
2. Épidémiologie et étiologie de la sténose aortique ... 2
3. Physiopathologie de la sténose aortique ... 3
4. Modalités d’imagerie de la sténose aortique ... 6
4.1 Échocardiographie transthoracique ... 6
4.2 Tomographie axiale ... 7
4.3 Tomographie par émission de positron couplé à la tomographie axiale... 7
5. Facteurs de risque de la sténose aortique ... 9
5.1. Sexe ... 9
5.2. Obésité ... 9
5.3. Hypertension ... 10
5.4. Diabète de type 2 ... 10
5.5. Lipoprotéine de faible densité... 11
5.6. Facteurs de risque génétiques ... 13
5.6.1. Lipoprotéine(a) ... 13
5.6.2. NOTCH1 ... 18
5.6.3. PALMD ... 19
5.6.4. Autres facteurs de risques génétiques ... 20
6. Prise en charge de la sténose aortique ... 21
6.1. Thérapies pharmacologiques ... 21
6.1.1. Hypolipémiants ... 21
vii
6.2. Remplacement valvulaire aortique... 25
6.2.1. Remplacement valvulaire aortique chez les patients asymptomatiques ... 26
6.2.2. Remplacement valvulaire aortique chez les patients symptomatiques ... 26
6.2.3. Remplacement valvulaire aortique trans-cathéter ... 27
6.2.4. Limites du remplacement valvulaire aortique ... 29
7. Sténose aortique et maladies cardiovasculaires ... 30
7.1. Lipoprotéine(a) et les maladies cardiovasculaires ... 31
7.1.1. Épidémiologie de la Lipoprotéine(a) dans les maladies cardiovasculaires ... 31
7.1.2. Physiopathologie de la Lipoprotéine(a) dans les maladies cardiovasculaires ... 32
7.1.3. Thérapies ciblant la lipoprotéine(a) ... 32
7.2. Lp-PLA2 et les maladies cardiovasculaires ... 36
7.2.1. Épidémiologie de la Lp-PLA2 dans les maladies cardiovasculaires ... 36
7.2.2. Physiopathologie de la Lp-PLA2 dans les maladies cardiovasculaires... 36
7.2.3. Thérapie ciblant la Lp-PLA2 ... 36
7.3. LDL et les maladies cardiovasculaires ... 37
7.3.1. Épidémiologie des LDL dans les maladies cardiovasculaires ... 37
7.3.2. Physiopathologie des LDL dans les maladies cardiovasculaires ... 38
7.3.3. Thérapies ciblant les LDL via l’inhibition de PCSK9 ... 39
7.4. Facteurs de risque modifiables et les maladies cardiovasculaires ... 40
8. Randomisation mendélienne ... 41
8.1. Principe de la randomisation mendélienne... 41
8.2. Randomisation mendélienne et essais cliniques randomisés ... 42
8.3. Score de risque génétique ... 43
8.4. Randomisation mendélienne et anticipation des résultats d’essais cliniques randomisés ... 43
9. Problématiques, hypothèses et objectifs ... 45
Chapitre 1. Lipoprotein(a), oxidized phospholipids, and aortic valve microcalcification assessed by 18F-NaF PET/CT ... 51 1.1. Résumé ... 52 1.2. Abstract ... 52 1.3. Introduction ... 54 1.4. Methods ... 55 1.5. Results ... 56 1.6. Discussion ... 58
viii
1.7. References ... 60
1.8. Figures and tables ... 62
Chapitre 2. Genetic variation in LPA and calcific aortic valve stenosis in patients undergoing cardiac surgery and familial risk of aortic valve microcalcification ... 68
2.1. Résumé ... 69 2.2. Abstract ... 70 2.3. Introduction ... 71 2.4. Methods ... 72 2.5. Results ... 74 2.6. Discussion ... 75 2.7. Acknowledgements ... 77 2.8. References ... 78
2.9. Figures and tables ... 80
2.10. Supplementary data ... 84
2.10.1. Methods ... 84
2.10.1.1. Study populations ... 84
2.10.2. Supplementary references ... 88
2.10.3. Supplementary Tables ... 89
Chapitre 3. Genetic and in vitro inhibition of PCSK9 and calcific aortic valve stenosis ... 94
3.1. Résumé ... 95 3.2. Abstract ... 95 3.3. Introduction ... 96 3.4. Methods ... 97 3.5. Results ... 101 3.6. Discussion ... 102 3.7. References ... 105
3.8. Figures and tables ... 108
3.9. Supplementary data ... 113
3.9.1. Study populations ... 113
3.9.2. Supplementary references ... 115
3.9.3. Supplementary figures and tables ... 117
Chapitre 4. Lipoprotein-associated phospholipase A2 activity, genetics, and calcific aortic valve stenosis in humans ... 124
ix 4.2. Abstract ... 125 4.3. Introduction ... 127 4.4. Methods ... 127 4.5. Results ... 129 4.6. Discussion ... 129 4.7. References ... 132
4.8. Figures and tables ... 136
4.9. Supplementary data ... 140
4.9.1. Supplementary Methods ... 140
4.9.2. Supplementary references ... 143
Chapitre 5. Life’s simple 7 and calcific aortic valve stenosis incidence in apparently healthy men and women ... 144 5.1. Résumé ... 145 5.2. Abstract ... 145 5.3. Introduction ... 146 5.4. Methods ... 146 5.5. Results ... 147 5.6. Discussion ... 147 5.7. References ... 148
5.8. Figures and tables ... 149
Discussion ... 151
Conclusion... 160
Bibliographie ... 162
Annexe A. Ideal cardiovascular health influences cardiovascular disease risk associated with high lipoprotein(a) levels and genotype: The EPIC-Norfolk prospective population study ... 184
A.1. Résumé ... 185
A.2. Abstract ... 185
A.3. Introduction ... 186
A.4. Materials and methods ... 187
A.5. Results... 189
A.6. Discussion ... 190
A.7. References... 192
x
Liste des figures
Introduction
Figure 1. Variation du score calcique valvulaire aortique mesurée par tomodensitométrie axiale et de l'activité
de 18F-NaF mesuré par tomographie par émission de positrons après 1 an. ... 8
Figure 2. Composition de la lipoprotéine(a). ... 14
Figure 3. Guide de pratique pour le remplacement valvulaire chirurgicale ou trans-cathéter.. ... 28
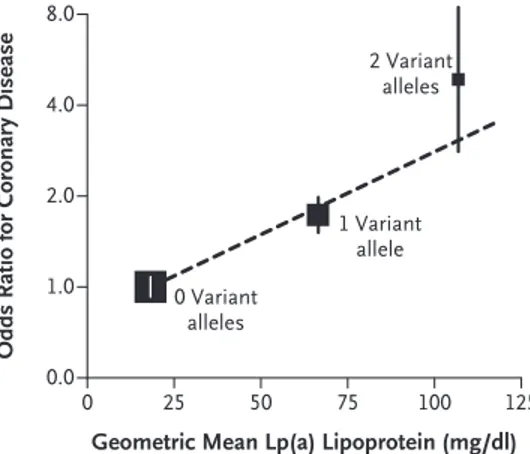
Figure 4. Association entre le score de risque de niveau de lipoprotéine(a) et le risque de maladie coronarienne dans la cohorte PROCARDIS. ... 32
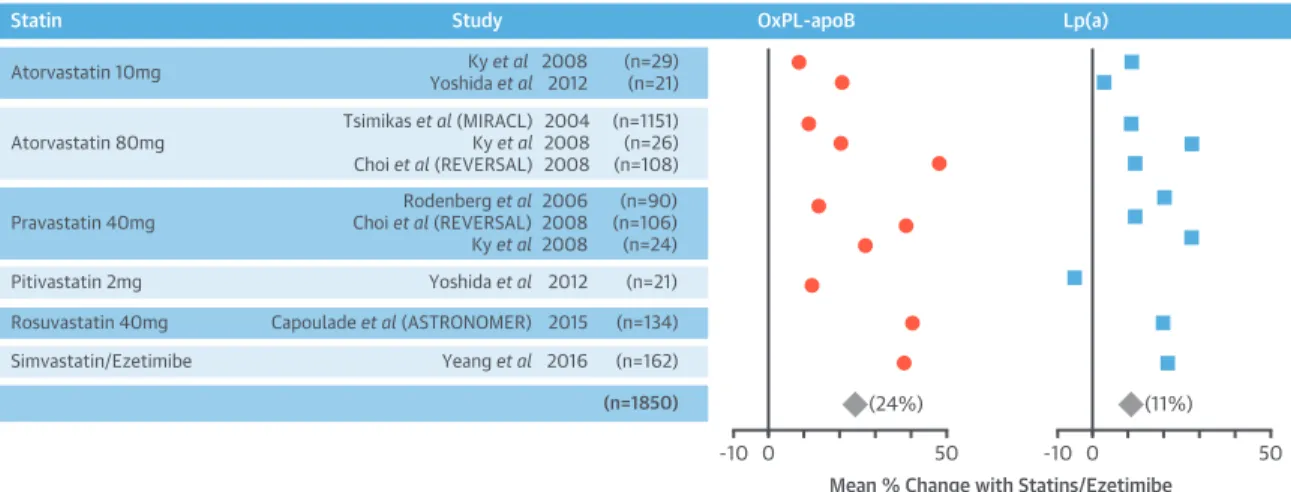
Figure 5. Effets des statines sur les niveaux OxPL-ApoB et de lipoprotéine(a). ... 33
Figure 6. Association log-linéaire par unité de variation de C-LDL et du risque de maladie cardiovasculaire telle que rapportée dans les méta-analyses d’études de randomisation mendéliennes, épidémiologiques et des essais cliniques randomisés. ... 38
Figure 7. Hypothèses définissant une variable instrumentale... 42
Figure 8. Analogie entre la randomisation mendélienne et les essais cliniques randomisés.. ... 43
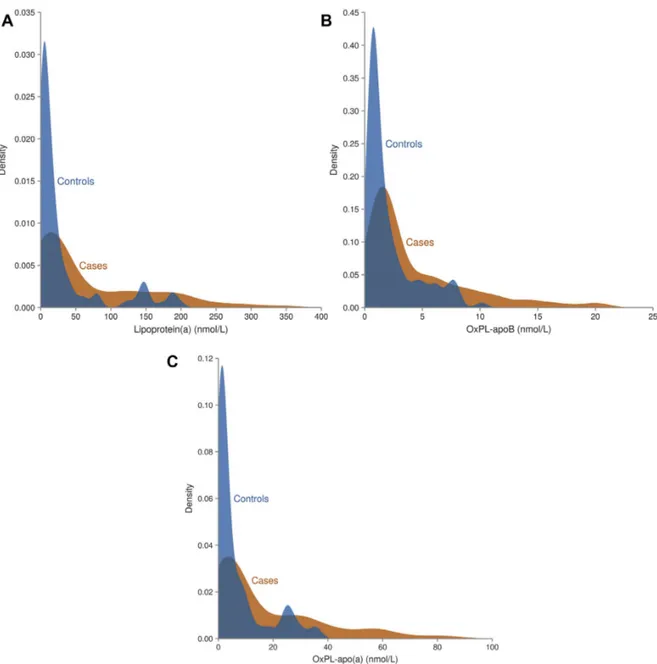
Chapitre 1. Lipoprotein(a), oxidized phospholipids, and aortic valve microcalcification assessed by 18F-NaF PET/CT Figure 1. Distribution and Lp(a) (A), Ox-PL-apoB (B) and Ox-PL-apo(a) (C) levels in patients with vs. without calcific aortic valve stenosis. ... 63
Figure 2. Lp(a) (A), Ox-PL-apoB (B) and Ox-PL-apo(a) (C) levels in patients with calcific aortic valve stenosis separated on the basis of estimated aortic valve calcium accumulation by echocardiography... 64
Figure 3. A) Representative image of aortic valve microcalcification in a patient with a low Lp(a) level (CT at the top left and PET/CT at the bottom left) and a patient with a high Lp(a) level (CT at the top right and PET/CT at the bottom right). B) Mean aortic valve calcium score in individuals with high vs. low Lp(a) levels C) Mean 18F -NaF uptake (tissue-to-background ratio) in individuals with high vs. low Lp(a) levels. ... 67
Chapitre 2. Genetic variation in LPA and calcific aortic valve stenosis in patients undergoing cardiac surgery and familial risk of aortic valve microcalcification Figure 1. Association of genetically elevated lipoprotein(a) levels with calcific aortic valve stenosis in individuals with coronary artery disease and those without coronary artery disease. ... 80
Figure 2. Association of genetically elevated lipoprotein(a) levels with calcific aortic valve stenosis in study subgroups. ... 81
Figure 3. Distribution of participant and comparison groups... 83
Figure 4. Study schematic. ... 83
Chapitre 3. Genetic and in vitro inhibition of PCSK9 and calcific aortic valve stenosis Figure 1. Association of the PCSK9 R46L variant with calcific aortic valve stenosis in a meta-analysis of ten cohorts totalizing 12,059 cases and 541,081 controls. ... 109
Figure 2. Impact of individual single nucleotide polymorphisms (A) and of a weighted genetic risk score of single nucleotide polymorphisms at the PCSK9 locus associated with low-density cholesterol levels LDL-C levels only (B) on calcific aortic valve stenosis in the UK Biobank. ... 109
Figure 3. PCSK9 is highly abundant in calcified leaflets. ... 110
Figure 4. PCSK9 expression and secretion is induced by osteogenic milieu in valve interstitial cells. ... 111
xi
Chapitre 4. Lipoprotein-associated phospholipase A2 activity, genetics, and calcific aortic valve stenosis in humans
Figure 1. Lp-PLA2 activity in patients with vs. without calcific aortic valve stenosis. ... 137 Figure 2. Meta-analysis of the per-allele association between four single nucleotide polymorphisms associated with Lp-PLA2 mass and/or activity and CAVS risk. ... 138 Figure 3. Summary figure. ... 139
Chapitre 5. Life’s simple 7 and calcific aortic valve stenosis incidence in apparently healthy men and women
Figure 1. Aortic valve stenosis event rates and hazard ratios for incident aortic valve stenosis in participants classified on the basis of ideal cardiovascular health quartiles after adjusting for age and sex. ... 150
Annexe A. Ideal cardiovascular health influences cardiovascular disease risk associated with high lipoprotein(a) levels and genotype: The EPIC-Norfolk prospective population study
Figure 1. Cardiovascular disease event rates (bars) and hazard ratios for incident cardiovascular disease in patients classified on the basis of ideal cardiovascular health categories and Lp(a) levels (A) and rs10455872 carrier status (B) after adjusting for age and sex. ... 197
xii
Liste des tableaux
Introduction
Table 1. Paramètres hémodynamiques selon la sévérité de la sténose aortique. ... 7 Table 2. Essais clinique contrôlés randomisés de thérapies hypolipémiantes dans la sténose aortique. ... 21 Table 3. Comparaison des caractéristiques de l'athérosclérose et de la sténose aortique. ... 31
Chapitre 1. Lipoprotein(a), oxidized phospholipids, and aortic valve microcalcification assessed by 18F-NaF PET/CT
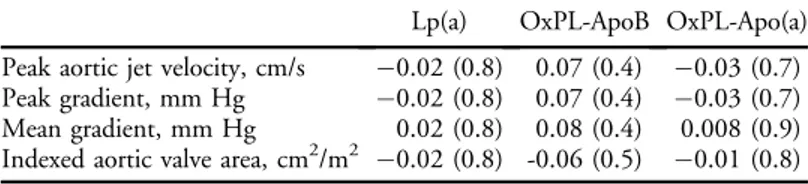
Table 1. Clinical characteristics of patients with versus without CAVS. ... 62 Table 2. Correlations among Lp(a), OxPL-apoB, and OxPL-apo(a) with aortic valve disease severity
parameters in patients with CAVS of the Quebec cohort. ... 64 Table 3. Mean Lp(a) levels in patients with CAVS at various Lp(a) thresholds. ... 65 Table 4. Clinical characteristics of individuals without CAVS with versus without elevated Lp(a) levels. ... 66
Chapitre 2. Genetic variation in LPA and calcific aortic valve stenosis in patients undergoing cardiac surgery and familial risk of aortic valve microcalcification
Table 1. Clinical characteristics of patients with calcific aortic valve stenosis, first-degree relatives, and a control group with low lipoprotein(a) (lp[a]) levels. ... 82
Chapitre 3. Genetic and in vitro inhibition of PCSK9 and calcific aortic valve stenosis
Table 1. Association of 10 independent single nucleotide polymorphisms at the PCSK9 locus and of a weighted genetic risk score with natural log-transformed lipoprotein-lipid levels in 9692 participants of the EPIC-Norfolk study. ... 108
Chapitre 4. Lipoprotein-associated phospholipase A2 activity, genetics, and calcific aortic valve stenosis in humans
Table 1. Single nucleotide polymorphisms included in the genetic association study. ... 136 Table 2. Clinical characteristics of study participants. ... 136 Table 3. Association between Lp-PLA2 activity and CAVS risk... 137
Chapitre 5. Life’s simple 7 and calcific aortic valve stenosis incidence in apparently healthy men and women
Table 1. Definition of the American Heart Association Life’s Simple 7 used in the European Prospective Investigation into Cancer and Nutrition-Norfolk study. ... 149
Discussion
Table 1. Distribution de la lipoprotéine(a) selon différents groupes ethniques... 153
Annexe A. Ideal cardiovascular health influences cardiovascular disease risk associated with high lipoprotein(a) levels and genotype: The EPIC-Norfolk prospective population study
Table 1. Baseline clinical characteristics of the total study population and the study population separated on the basis of high vs. low Lipoprotein(a) levels. ... 195 Table 2. Median Lp(a) level and the percentage of study participants with high Lp(a) level or carriersof the rs10455872 allele in each category of cardiovascular health metric. ... 196
xiii
Liste des abréviations, sigles, acronymes
18F-NaF Fluorure de sodium radiomarquéACE Enzyme de conversion de l'angiotensine ACVD Atherosclerotic Cardiovascular Disease
AHA American Heart Association
ALPL Alkaline phosphatase
apo Apolipoprotéine
ApoA-1 Apolipoprotéine A-1
ARA Antagonistes des récepteurs de l'angiotensine ARIC Atherosclerosis Risk In Communities
ARNm Acide Ribonucléique Messager
ATX Autotaxine
AU Arbitrary Unit
AVC Accident vasculaire cérébral
AVC Aortic Valve Calcification
AVR Aortic Valve Replacement
BMI Body Mass Index
BMP2 Bone Morphogenetic Protein 2
CAD Coronary Artery Disease
CAVS Calcific Aortic Valve Stenosis
CCM Centro Cardiologico Monzino
CD36 Cluster of Differentiation 36
CETP Protéine de transfert des esters de cholestérol
CHD Cardiovascular Heart Disease
CI Confident Interval
C-LDL Cholestérol-LDL
CRP Protéine C réactive
CT Computed Tomography
CVD Cardiovascular Disease
CVE Cellules endothéliales valvulaires
D.E.S.I.R The Data from the Epidemiological Study on the Insulin Resistance Syndrome DASH Dietary Approaches to Stop Hypertension
dL Décilitre
EGCUT Estonian Genome Center at the University of Tartu ELISA Enzyme-Linked Immunosorbent Assay
ENCORE East Norfolk Health Authority
EPIC European Prospective Investigation into Cancer and Nutrition
GAG Glycosamino-glycane
GERA Genetic Epidemiology Research on Aging HDL Lipoprotéines de haute densité
HF Hypercholestérolémie familiale
Hg Mercure
HPS2-THRIVE Heart Protection Study 2-Treatment of HDL to Reduce the Incidence of Vascular Events
xiv
ICD International Classification of Disease
IDEAL Incremental Decrease in End Points Through Aggressive Lipid Lowering IDL Lipoprotéines de densité intermédiaire
IECA Inhibiteurs de l'enzyme de conversion de l'angiotensine
IL Interleukine
IMC Indice de masse corporelle
IUCPQ Institut universitaire de cardiologie et de pneumologie de Québec
kb Kilobase
kDa Kilodalton
KIV Kringle 4
KIV2 Kringle 4 de type 2
KV Kringle 5
LDL Lipoprotéine de faible densité
LDL-C LDL-cholesterol
LDLR Récepteur du LDL
LIPG Endothelial lipase
Lp-PLA2 Phospholipase A2 associé aux lipoprotéines
Lp(a) Lipoprotéine(a)
LRP1 Low Density Lipoprotein Receptor-related Protein 1 LRP2 Low Density Lipoprotein Receptor-related Protein 2 lysoPA Acide lysophosphatidique
lysoPC Lysophosphatidylcholine
MBq Megabecquerel
MCP-1 Protéine chimio-attractrice des monocytes MDCS Malmo Diet and Cancer study
MECV Matrice extracellulaire valvulaire
mg Milligramme
mmol Millimole
MUHC McGill University Health Center
MYH6 Myosin Heavy Chain 6
NAV1 Neuron Navigator 1
NF-κB Facteur nucléaire κB NICD Notch Intracellular Domain
NOTCH1 Notch Homolog 1
NOTION Nordic Aortic Valve Intervention
OR Odds Ratio
Ox-LDL Lipoprotéines de basse densité oxydées
OxPL Phospholipide oxydé
P.R.E.G.O. Population de Référence du Grand Ouest
PALMD Palmdelphin
PET/CT Positron Emission Tomography/Computed Tomography
PGE2 Prostaglandine E2
QHLI Québec Heart and Lung Institute RANKL Ligand du récepteur de NF-κB
xv
RR Risque relatif
RUNX2 Runt-related Transcription Factor 2 RVA Remplacement valvulaire aortique
SA Sténose aortique
SCARB1 Récepteur scavenger B1
SCOPE-AS Symptomatic Cardiac Obstruction-Pilot Study of Enalapril in Aortic Stenosis
SD Standard Deviation
SEAS Simvastatin and Ezetimibe in Aortic Stenosis SNP Polymorphisme nucléotidique
SOLID-TIMI 52 Stabilization of Plaque Using Darapladib-Thrombolysis in Myocardial Infarction 52 SPARCL Stroke Prevention by Aggressive Reduction in Cholesterol Levels
SR-A Scavenger Receptor A
SREBP Sterol Regulatory Element-binding Proteins
STABILITY STabilization of Atherosclerotic plaque By Initiation of darapLadIb TherapY SURTAVI Surgical Replacement and Transcatheter Aortic Valve Implantation
SUV Standard uptake value
TAVI Trans-catheter Aortic Valve Implant
TBR Tissue-to-background Ratio
TEX41 Testis Expressed 41
TGFβ1 Facteur de croissance transformant β1
TLR Récepteur Toll-like
TNF Facteur de nécrose tumorale
TNFR1 Membre 1A de la superfamille des récepteurs du TNF TNT Treating to New Targets
TWAS Transcriptome-wide Association Study
UNLOAD Use of Nitroprusside in Left Ventricular Dysfunction and Obstructive Aortic Valve Disease VIC Cellules interstitielles valvulaires
VLDL Lipoprotéines de très basse densité
xvi
Remerciements
Benoit, merci de m’avoir donné ta confiance dans la réalisation de ce doctorat. Grâce à toi, j’ai pu m’épanouir dans la réalisation de tous ces beaux projets.
À toute l’équipe, Marjorie, Raphaëlle, Audrey-Anne, Stéfania, Jakie, Sylvain, Trish, Hasanga et William, merci d’avoir été là pendant les 5 à 7, laser game, randonnées, journées ski, hockey, tennis… Merci pour la création du groupe Facebook « pause labo » et de l’avoir alimenté en vidéos d’animaux drôles.
Merci à mon co-directeur Yohan Bossé ainsi que son équipe, notamment Zhonglin Li pour son aide précieuse. Merci Sébastien Thériault pour ton aide dans la réalisation de cette thèse.
Philipe Pibarot, Marie Annick Clavel et leurs équipes, notamment Lionel, Mylène, Caroline et Martine, je vous remercie pour avoir été là dès le début pour me transmettre votre expérience dans le recrutement de participants.
Merci à Déborah Argaud pour ton amitié, dans tous les moments. Merci également à Chloé, Mathilde et Nolwenn pour les fous rires.
Maxime Nadeau et l’équipe de médecine nucléaire, je vous remercie pour votre implication dans la réalisation de cette thèse.
Merci Clara de faire partie de ma vie.
Je tiens finalement à remercier l’ensemble des co-auteurs ainsi que les participants inclus dans toutes les études ayant permis la publication des articles inclus dans cette thèse.
xvii
Avant-propos
L’article présenté dans le chapitre 1 intitulé : « Lipoprotein(a), oxidized phospholipids, and aortic valve microcalcification assessed by 18F-sodium fluoride positron emission tomography and computed tomography » a été publié le 1er mai 2019 dans le journal « Canadian Journal of Cardiology Open ». Je suis co-premier auteur avec Audrey-Anne Després. Les autres auteurs sont : Anthony Poulin, Lionel Tastet, Mylène Shen, Hao Yu Chen, Raphaëlle Bourgeois, Mikaël Trottier, Michel Tessier, Jean Guimond, Maxime Nadeau, James C. Engert, Sébastien Thériault, Yohan Bossé, Joseph L. Witztum, Patrick Couture, Patrick Mathieu, Marc R. Dweck, Sotirios Tsimikas, George Thanassoulis, Philippe Pibarot, Marie-Annick Clavel, et Benoit J. Arsenault. J’ai participé au recrutement des participants, aux analyses, à l’interprétation des résultats et à la rédaction de l’article.
L’article présenté dans le chapitre 2 intitulé : « Genetic variation in LPA, calcific aortic valve stenosis in patients undergoing cardiac surgery, and familial risk of aortic valve microcalcification » a été publié le 29 mai 2019 dans le journal « Journal of American Medical Association Cardiology ». J’en suis l’auteur principal et les co-auteurs sont : Sébastien Thériault, Christian Dina, Hao Yu Chen, S. Matthijs Boekholdt, Sidwell Rigade, Audrey-Anne Després, Anthony Poulin, Romain Capoulade, Thierry Le Tourneau, David Messika-Zeitoun, Mikaël Trottier, Michel Tessier, Jean Guimond, Maxime Nadeau, James C. Engert, Kay-Tee Khaw, Nicholas J. Wareham, Marc R. Dweck, Patrick Mathieu, Philippe Pibarot, Jean-Jacques Schott, George Thanassoulis, Marie-Annick Clavel, Yohan Bossé et Benoit J. Arsenault. J’ai participé au recrutement des participants, aux analyses, à l’interprétation des résultats et à la rédaction de l’article.
L’article présenté dans le chapitre 3 intitulé : « Genetic and in vitro inhibition of PCSK9 and calcific aortic valve stenosis » a été publié en juillet 2020 dans le journal « Journal of the American College of Cardiology Basic : Basic to Translational Science ». Je suis co-premier auteur avec Vincenza Valerio. Les autres auteurs sont : Donato Moschetta, S. Matthijs Boekholdt, Christian Dina, Hao Yu Chen, Erik Abner, Andreas Martinsson, Hasanga D. Manikpurage, Sidwell Rigade, Romain Capoulade, Elvira Mass, Marie-Annick Clavel, Thierry Le Tourneau, David Messika-Zeitoun, Nicholas J. Wareham, James C. Engert, Gianluca Polvani, Philippe Pibarot, Tõnu Esko, J. Gustav Smith, Patrick Mathieu, George Thanassoulis, Jean-Jacques Schott, Yohan Bossé, Marina Camera, Sébastien Thériault, Paolo Poggio, et Benoit J. Arsenault. J’ai participé aux analyses de la partie bio-informatique, à l’interprétation des résultats et à la rédaction de l’article.
L’article présenté dans le chapitre 4 intitulé : « Lipoprotein-associated ahospholipase A2 activity, genetics, and calcific aortic valve stenosis in humans » a été publié le 7 juillet 2020 dans le journal « Heart ». J’en suis l’auteur principal et les co-auteurs sont : Sébastien Thériault, Sidwell Rigade, Hao Yu Chen, Christian Dina, Andreas Martinsson, S. Matthijs Boekholdt, Romain Capoulade, Thierry Le Tourneau, David Messika-Zeitoun, James C.
xviii
Engert, Nicholas J. Wareham, Marie-Annick Clavel, Philippe Pibarot, J. Gustav Smith, Jean-Jacques Schott, Patrick Mathieu, Yohan Bossé, George Thanassoulis et Benoit J. Arsenault. J’ai participé aux analyses, à l’interprétation des résultats et à la rédaction de l’article.
L’article présenté dans le chapitre 5 intitulé : « Life's simple 7 and calcific aortic valve stenosis incidence in apparently healthy men and women » a été publié le 15 octobre 2018 dans le journal « International Journal of Cardiology ». J’en suis l’auteur principal et les co-auteurs sont : S. Matthijs Boekholdt, Patrick Mathieu, Nicholas J. Wareham, Kay-Tee Khaw, Benoit J. Arsenault. J’ai participé au design expérimental, à l’interprétation des résultats et à la rédaction de l’article.
L’article présenté en Annexe A intitulé : « Ideal cardiovascular health influences cardiovascular disease risk associated with high lipoprotein(a) levels and genotype: The EPIC-Norfolk prospective population study » a été publié le 11 novembre 2016 dans le journal « Atherosclerosis ». J’en suis l’auteur principal et les co-auteurs sont : Rutger Verbeek, Manjinder Sandhu, S. Matthijs Boekholdt, G. Kees Hovingh, Nicholas J. Wareham, Kay-Tee Khaw et Benoit J. Arsenault. J’ai participé au design expérimental, à l’interprétation des résultats et à la rédaction de l’article.
1
Introduction
1. Généralités sur la valve aortique
Les valves cardiaques permettent un écoulement direct non obstrué et unidirectionnel du sang. Les feuillets d’une valve doivent accomplir les mouvements requis par le cycle cardiaque et doivent maintenir une force et une durabilité suffisantes pour résister à des contraintes et à des efforts mécaniques répétitifs pendant toute la vie. Les exigences fonctionnelles des valves cardiaques sont remplies par un ensemble spécialisé de cellules et une matrice extracellulaire hétérogène, disposées dans une structure tissulaire spatialement spécifique et différenciée.
Les quatre valves cardiaques ont un modèle architectural en couches similaires composé de cellules endothéliales valvulaires (CVE) sur les surfaces en contact avec le sang, de cellules interstitielles valvulaires (VIC), et de la matrice extracellulaire valvulaire (MECV)(1). La valve aortique normale comprend trois couches. La ventricularis, du côté ventriculaire des feuillets, est composé de fibres de collagène de type I, III et IV, de protéoglycanes, de fibronectine et surtout de fibres élastiques entrelacées et disposées en direction radiale. La fibrosa, du côté aortique du tractus, comprend principalement des fibroblastes et des fibres de collagène dont la direction est circonférentielle. La spongiosa est une couche de tissu conjonctif à la base du feuillet, entre la fibrosa et la ventricularis, composée de fibroblastes, de cellules mésenchymateuses et d'une matrice riche en mucopolysaccharides. L’ensemble de ces couches fonctionnent de concert pour fournir une résistance à la traction et une flexibilité pendant des décennies de mouvements répétitifs (2). Pendant la systole, la force exercée par le sang permet aux cuspides valvulaires de s'ouvrir permettant l’écoulement du sang au travers de la valve aortique. Dans la phase fermée, sous la contre-pression du sang dans l'aorte, les cuspides s'étirent et coaptent et, de ce fait, obturent l'orifice.
La sténose aortique (SA) est caractérisée par un rétrécissement de l’orifice valvulaire, entraînant une résistance à l’écoulement du sang au travers de celle-ci. La sténose aortique est une maladie à progression lente avec un continuum de maladie qui va d'un léger épaississement valvulaire sans obstruction de la circulation sanguine, appelé sclérose aortique, à la sténose aortique, une calcification sévère avec altération du mouvement des feuillets. Ce processus était considéré comme étant dégénératif en raison de l’usure des feuillets dépendant du temps avec un dépôt de calcium passif. Dorénavant, il existe des données histopathologiques et cliniques convaincantes suggérant que la maladie de la valve calcifiante est un processus de maladie actif semblable à l'athérosclérose avec dépôt de lipoprotéines, cascade inflammatoire et calcification active des feuillets (3).
2
2. Épidémiologie et étiologie de la sténose aortique
La prévalence de la sclérose aortique, phase précoce de la SA, est estimée à 25% à partir de 65 ans et à presque 50% à partir de 85 ans (4, 5). La proportion de patients avec une sclérose aortique qui progressent vers une SA est inférieure à 2% par année et de 10 à 15% sur une période de 2 à 5 ans (6-8). Pendant un suivi de 5 ans, 1% des personnes avec une valve normale ont développé une SA contre 9% des personnes avec une sclérose aortique (7). La sclérose aortique ne semble donc pas être une étape nécessaire pour développer une SA. Dans les pays développés, la SA est la troisième maladie cardiovasculaire la plus courante après la maladie coronarienne et l'hypertension artérielle systémique (9). En 1993, l'étude Helsinki Aging Study, une étude de dépistage échographique, a fourni des preuves d'une calcification et d'une dégénérescence accrues de la valve aortique avec l'âge (10). La présence de calcification valvulaire a été notée chez 75% des personnes âgées de 85 à 86 ans. La prévalence de la sténose valvulaire aortique est augmentée avec l'âge entre 1% et 2% chez les personnes âgées de 75 à 76 ans et à 6% chez celles âgées de 85 à 86 ans. De même, en 2003, l'étude Euro Heart Survey on Valvular Heart Disease a prospectivement interrogé 5001 personnes avec une maladie valvulaire native modérée à sévère, une endocardite infectieuse ou une intervention valvulaire antérieure, de 92 centres dans 25 pays (11). Parmi les maladies valvulaires natives du côté gauche, la SA était la plus fréquente (1197 des 2779 patients [43,1%]) et était sévère chez un nombre important de personnes affectées (809 des 1197 patients [67,6%]). La SA affectait en 2006 0,4% de la population des États Unis et sa fréquence augmente avec les catégories d’âges, de 0,3% chez les personnes de 18 à 44 ans, elle était de 11,7% chez les personnes de 75 ans et plus (12). En 2012, 5,2 millions de personnes étaient atteints de SA aux États Unis et en 2013 50 222 personnes sont décédées due à des valvulopathies dont 67,5% pour cause de maladie de la valve aortique (13, 14). L’incidence de la SA a été estimée à 4,9‰/an dans une population de 60 ans d’âge moyen à l’inclusion (15). La prévalence de la SA va probablement continuer d’augmenter avec le vieillissement de la population. Les prédictions actuelles estiment que le nombre de patients âgés de 70 et plus avec une SA dans les pays développés pourrait augmenter de 2 à 3 fois dans les 50 prochaines années (16-18).
Bien que la dégénérescence valvulaire, qui est caractérisée par un remodelage fibro-calcique des feuillets, soit l’étiologie la plus fréquente de sténose aortique, elle peut également être causés par une anomalie congénitale, une maladie rhumatismale, etc. La bicuspidie aortique est caractérisée par la présence de deux feuillets au lieu de trois et est, avec une prévalence inférieure à 2%, la malformation valvulaire congénitale la plus commune (19). Il a été constaté que les patients avec une valve bicuspide développent une SA environ une décennie plus tôt que les personnes avec une valve tricuspide (10, 15, 16, 20-23). De 20 à 25% des patients avec une bicuspidie aortique subiront un remplacement valvulaire aortique (RVA) dans leur vie et peuvent représenter jusqu’à 50% des RVA (20, 22, 24). Certaines personnes peuvent également présenter une valve unicuspide. La maladie rhumatismale est l’affection inflammatoire systémique la plus fréquente, malgré qu’elle soit peu
3
présente dans les pays développés, elle est la résultante d’une infection bactérienne à Streptococcus groupe A, non traitée durant le jeune âge (25). L’infection peut atteindre le cœur et entraîner une fusion des commissures valvulaires caractéristique, augmentant ainsi le risque combiné de sténose et de régurgitation aortique (26, 27).
3. Physiopathologie de la sténose aortique
La physiopathologie de la sténose aortique est un ensemble de processus actifs complexes, avec une série de mécanismes biologiques finement régulés. L’initiation des phénomènes fibro-calciques semble commencer par une dysfonction endothéliale entraînant l'échec du maintien de la barrière physique entre la cuspide interne et la circulation sanguine. Cette augmentation de la perméabilité de la couche de cellules endothéliales permet l’infiltration de lipoprotéines au sein des feuillets. Les premières études histologiques sur le sujet ont montré que plusieurs apolipoprotéines (apo), telles que l’apoB, l’apoE, l’apoA1 et l’apo(a), sont présentes dans les valves aortiques sténotiques explantées (28). Le stress oxydatif est également impliqué dans la SA. L'immunocoloration a montré que l'apoB colocalise avec des lipoprotéines de basse densité oxydées (Ox-LDL) dans les valves de patients atteints de SA (29, 30), et qu'il y a une association entre le niveau d'Ox-LDL et le degré d'inflammation et remodelage fibro-calcique dans les valves explantées (29, 31). Les protéoglycanes tels que le biglycane et la décorine sont surexprimés dans les valves aortiques au cours de la SA et pourraient participer activement à la rétention et à la modification des lipides (32, 33). De plus, il a été démontré que le facteur de croissance TGFβ1, qui est activé dans la SA, favorise l'allongement des chaînes glycosamino-glycanes (GAG) (34). À son tour, l'allongement de la chaîne GAG augmente l'interaction entre les protéoglycanes et les lipoprotéines (34). L'accumulation et la rétention de lipoprotéines dans la valve aortique sont des événements cruciaux, car les lipides peuvent être utilisés par différentes enzymes pour produire des composés dérivés de lipides bioactifs, tels que les lysophospholipides (35). La phospholipase A2 associée aux lipoprotéines (Lp-PLA2) transforme les phospholipides oxydés (OxPL) en lysophosphatidylcholine (lysoPC), ce qui favoriserait l'apoptose des VIC (36, 37). De plus, l'autotaxine, une lyso-phospholipase D, est probablement transportée dans la valve aortique par la lipoprotéine(a) (Lp[a]) et est également sécrétée par les feuillets valvulaires en réponse à divers stimuli, dont le facteur de nécrose tumorale (TNFα) (38). L'autotaxine catalyse la transformation de la lysoPC en acide lysophosphatidique (lysoPA). Outre les lysophospholipides, la voie de l'acide arachidonique, qui produit des leucotriènes et des prostaglandines, s'est avérée jouer un rôle considérable dans la minéralisation de la valve aortique (39). Ensemble, ces observations suggèrent que le processus fibro-calcique dans la valve aortique est une réponse à une blessure, qui pourrait être déclenchée par des espèces dérivées des lipides et une inflammation locale (36).
4
L'infiltration de la valve aortique par les lipoprotéines a un rôle central dans la promotion de l'inflammation, qui précède la minéralisation pathologique caractéristique de l'AS (40). Par conséquent, la rétention des lipides favorise un processus inflammatoire chronique qui, à son tour, pourrait induire un programme ostéogénique dans les valves aortiques. L'infiltrat inflammatoire dans les valves aortiques minéralisées explantées est composé de macrophages, de mastocytes, de cellules T CD4 et de cellules T CD8 (41). Plusieurs espèces de lipides oxydés pourraient activer la réponse immunitaire innée via les récepteurs de type Toll (TLR : toll-like receptor) et la voie du facteur nucléaire κB (NF-κB). Les TLR sont également exprimés par les VIC (dans le cas de TLR2 et TLR4) et peuvent favoriser un phénotype ostéogénique dans les VIC isolés (42, 43). Inversement, le rôle de l'immunité adaptative dans la SA calcifiante est encore inconnu, mais des études ont montré qu'un sous-ensemble de cellules T mémoire est activé pendant la SA et que l'expansion clonale d'un récepteur de lymphocytes T est présente dans des valves explantées (44). Ces données suggèrent que les réponses immunitaires innées et adaptatives sont probablement impliquées dans la pathobiologie de la SA.
Ensemble, ces résultats suggèrent que plusieurs processus favorisent la rétention des lipides dans la valve aortique et produisent des espèces lipidiques bioactives, qui à leur tour favorisent l'inflammation et la minéralisation des feuillets de la valve aortique. De plus, la production excessive et la désorganisation des fibres de collagène sont une caractéristique importante de la SA. L'inspection de valves sténotiques explantées chirurgicalement révèle deux caractéristiques, la fibrose et la calcification, qui modifient considérablement les propriétés biomécaniques des feuillets aortiques. Une petite proportion (10 à 15%) des valves sténosées présentent une métaplasie ostéogénique avancée avec la présence de cellules de type ostéoblaste (45). Les valves calcifiées contiennent souvent des infiltrats inflammatoires denses, contenant principalement des macrophages (46, 47). La minéralisation commence dans la couche fibreuse et est souvent localisée au voisinage des dépôts lipidiques. Une étude histopathologique, réalisée sur 285 valves aortiques de patients atteints de SA, a révélé que la présence d'infiltrats inflammatoires était liée au score de remodelage des feuillets (défini par un système de notation adapté de Warren et Yong (48) [9]. Score 1: léger épaississement fibreux - l'intégrité structurale des cuspides est maintenue; score 2: épaississement valvulaire modéré et calcification nodulaire précoce avec préservation de la fibrose; score 3: épaississement sévère avec de nombreux nodules calcifiés et une fibrosa déformée; score 4: épaississement et distorsion sévères avec de nombreux nodules calcifiés, fibrose importante et destruction de la plupart des composants structurels avec rupture du tissu élastique) et à la présence de néovascularisation (46). Bien que le rôle exact de la néovascularisation dans la progression de la SA soit encore largement inconnu, il est possible qu'elle soit impliquée dans le recrutement de cellules inflammatoires et ostéoprogénitrices.
La fibrose augmente la rigidité de la valve aortique et pourrait jouer un rôle considérable dans la promotion de la minéralisation. En effet, le collagène produit par les VIC fonctionne comme base pour la nucléation du calcium
5
et du phosphore (49). La minéralisation du collagène est augmentée in vitro par une population de VIC qui ont un phénotype pro-calcifiant avec une expression élevée de l’enzyme phosphatase alcaline (50, 51). De plus, la production accrue de plusieurs composants de la matrice extracellulaire, dont la périostine, la ténascine C et les protéoglycanes contribue au remodelage de la valve aortique (52, 53). Les facteurs de nécroses tumorales (TNF) sont sécrétés par les monocytes et les macrophages, et activent le membre 1A de la superfamille des récepteurs du TNF (TNFR1). L'activation de TNFR1 entraîne l'activation de NF-κB et de ses cibles en aval, y compris l’interleukine-1β (IL-1β) et l’interleukine-6 (IL-6). Ces cytokines favorisent la minéralisation des VIC et activent un programme ostéogénique (54-57). L’expression de l’IL-6 est augmentée dans les valves sténotiques humaines et elle est sécrétée en grande quantité par les VIC cultivés lorsqu'ils sont traités avec un milieu ostéogène (58). De plus, la suppression du gène IL6 réduit considérablement l'expression de la protéine osseuse morphogénétique (BMP2) et la minéralisation des VIC en culture (58). L'IL-6 induit l'expression de l'activateur du ligand du récepteur de NF-κB (RANKL) dans les cellules osseuses (59). Il est intéressant de noter que dans l'os, le RANKL est exprimé par les ostéoblastes et favorise la résorption des minéraux par les ostéoclastes. Il est donc possible qu'une dérégulation de RANKL-RANK-Ostéoprotégérine explique le lien entre l'ostéoporose et la calcification vasculaire/valvulaire (41). À cet égard, plusieurs études épidémiologiques ont souligné une association entre l'ostéoporose et la calcification vasculaire et/ou valvulaire (41, 60, 61). Les VIC subissent une différenciation ostéogénique impliquant des voies de signalisation WNT et NOTCH1. Cette dernière régule l'expression de plus de 1 000 gènes impliqués dans l'inflammation et l'ostéogenèse, incluant les facteurs de transcription BMP2 et RUNX2 (62-64).
Les mécanismes par lesquels les VIC minéralisent la matrice extracellulaire sont encore mal définis, mais des travaux d'observation et d'expérimentation récents suggèrent que les cellules sécrètent de petites vésicules riches en ectonucléotidases qui favorisent la nucléation du calcium et du phosphore (65, 66). La sécrétion de vésicules calcifiantes a été classiquement attribuée aux cellules qui se différencient en cellules de type ostéoblaste, auquel cas la calcification se poursuit par le dépôt d'une matrice minérale osseuse bien organisée, connue sous le nom d'hydroxyapatite de calcium (67). L'apoptose des VIC est favorisée par différents stimuli, y compris les cytokines, les espèces réactives de l’oxygène et la signalisation purinergique altérée, les corps apoptotiques ont des propriétés similaires aux vésicules calcifiantes. Dans les valves aortiques humaines, il est probable que les processus ostéogéniques et apoptotiques contribuent au processus de minéralisation et reposent au moins en partie sur les ectonucléotidases (68).
En résumé, l'oxydation et l'infiltration de la valve aortique par les lipides génèrent plusieurs espèces lipidiques bioactives qui déclenchent l'inflammation de la valve aortique. L'activation de plusieurs voies perturbe la biologie normale de la valve aortique et favorise le remodelage fibro-calcique conduisant à l’épaississement des cuspides et la présence de nodules riches en calcium à la surface des feuillets et/ou dans la région annulaire,
6
conduisant à une rigidification fonctionnelle et à une sténose. L’obstacle au flux sanguin ainsi généré entraîne une augmentation progressive de la pression dans le ventricule gauche durant la systole. Les symptômes de la SA (syncope, la dyspnée, l’angine, dysfonction ventriculaire gauche) sont essentiellement dus à un déséquilibre entre l'augmentation de la charge hémodynamique ventriculaire gauche causée par l’obstruction valvulaire, d'une part, et la capacité du ventricule gauche à surmonter cette augmentation de la charge, d'autre part. Cette augmentation de la pression systolique ventriculaire gauche conduit à une hypertrophie des cardiomyocytes et à une fibrose interstitielle diffuse (69). Cette fibrose interstitielle résulte de l'augmentation de la synthèse de collagène par les myofibroblastes et pourrait être, au moins en partie, réversible après remplacement valvulaire aortique (70). Les conséquences de la SA sur la fonction ventriculaire gauche sont d’autant plus importantes que la sténose est sévère.
4. Modalités d’imagerie de la sténose aortique
La suspicion d’une SA chez un patient est souvent due à la présence d’un murmure cardiaque en systole. L'imagerie cardiaque est essentielle à la prise en charge de la SA et est utilisée pour confirmer le diagnostic, évaluer la sévérité de la sténose et l’atteinte du myocarde. Pour mesurer ou prédire avec précision la progression de la maladie au fil du temps, les méthodes d'imagerie doivent avoir une reproductibilité et une robustesse suffisantes pour détecter de petits changements dans la sévérité de la maladie avec une grande précision. En milieu clinique, cela est de la plus haute importance lors du choix de la stratégie de prise en charge appropriée et du moment optimal d'intervention. Bien que l'échocardiographie transthoracique soit la méthode de référence pour évaluer la valve aortique et le myocarde, de nouvelles techniques d'imagerie démontrent des avantages potentiels et sont donc de plus en plus explorées.
4.1 Échocardiographie transthoracique
L’échocardiographie transthoracique permet d’évaluer l’anatomie, l’aspect et la mobilité des feuillets de la valve aortique et la perturbation hémodynamique résultante de la SA. Bien qu'il existe plusieurs paramètres échocardiographiques pour évaluer la gravité de la maladie, les lignes directrices actuelles recommandent d'évaluer la sévérité et la progression de la SA en fonction de la vitesse maximale du jet transaortique (Vmax), du gradient de pression moyen transvalvulaire (ΔP moyen) et de l’aire valvulaire aortique (AVA) (71, 72). Une limitation à considérer est que les mesures échocardiographiques de la SA fournissent souvent des évaluations contradictoires de la sévérité de la maladie. En effet, des résultats échocardiographiques discordants sont observés chez environ un quart des patients, résultant le plus souvent d'une zone valvulaire <1 cm2, suggérant une maladie sévère, et une vitesse maximale <4,0 m/s ou un gradient de pression transvalvulaire moyen <40 mmHg, indiquant une sténose modérée (Tableau 1) (73, 74).
7
Table 1. Paramètres hémodynamiques selon la sévérité de la sténose aortique.
DP moyen Vmax Aire valvulaire aortique
Sclérose aortique < 2,5 m/s
Sténose légère < 20 mmHg 2,6 - 2,9 m/s > 1,5 cm2
Sténose modérée 20 - 40 mmHg 3,0 - 4,0 m/s 1,0 - 1,5 cm2
Sténose sévère ≥ 40 mmHg ≥ 4,0 m/s < 1,0 cm2
DP moyen : gradient de pression transvalvulaire moyen. Vmax : vélocité transvalvulaire maximale.
En cas de SA à bas débit et bas gradient, le débit peut être temporairement augmenté pour évaluer avec précision la sévérité hémodynamique. L'échocardiographie de stress à la dobutamine est souvent utile à cet égard pour diagnostiquer une véritable SA sévère et pour discriminer les patients avec et sans réserve contractile (75, 76). Cependant, une proportion importante de patients présentant des résultats discordants se trouvent avoir un débit normal, ce qui rend les résultats échocardiographiques difficiles à interpréter. Pour ces raisons, l'intérêt pour le développement de nouvelles évaluations de la gravité et de la progression de la maladie dans la SA augmente, et de nouvelles techniques d'imagerie peuvent compléter l'échocardiographie pour juger de la gravité et surveiller la progression de la maladie.
4.2 Tomographie axiale
Malgré que l’échocardiographie permette une mesure semi-quantitative de la calcification macroscopique des feuillets valvulaires, la méthode de référence reste cependant la tomographie axiale (CT, computed tomography). La quantification de la charge calcique a donc été suggérée comme une méthode alternative indépendante du débit pour déterminer la gravité de la maladie (77). La charge calcique valvulaire peut être quantifiée en utilisant la méthode Agatston, qui englobe à la fois l'aire et la densité pondérée d'une région donnée calcifiée afin de calculer un score calcique (78). Le seuil de score calcique pour définir une sténose aortique sévère est de 2065 AU (arbitrary unit) chez l’homme et 1274 AU chez la femme avec une sensibilité de 86% et une spécificité de 79% (73). En plus de définir la sévérité, le score calcique offre une puissante prédiction des événements cliniques futurs. En effet, dans des études multicentriques récentes, une calcification sévère était associée à une augmentation de 3 à 4 fois de la mortalité ou de remplacement valvulaire (74, 79).
4.3 Tomographie par émission de positron couplé à la tomographie axiale
Les scanneurs hybrides tomographie par émission de positron couplé à la tomographie axiale (PET/CT, Positron Emission Tomography/Computed Tomography) fournissent des informations moléculaires détaillées sur l'activité de processus pathologiques spécifiques se développant in vivo. En principe, tout processus biologiquement actif peut être étudié en fonction de la disponibilité d'un radiotraceur. Ces radiotraceurs sont
8
injectés dans le corps et s'accumulent dans les zones de processus actif, émettant un rayonnement qui peut être détecté par le scanneur PET/CT. Le fluorure de sodium radiomarqué (18F-NaF) est un traceur qui peut être utilisé pour mesurer l'activité de microcalcification, car il est directement incorporé dans les cristaux d’hydroxyapatite par un mécanisme d'échange avec les groupes hydroxyles (80). L'activité 18F-NaF est augmentée chez les patients atteints de SA, avec une augmentation de la captation de 18F-NaF mesuré par PET/CT avec la sévérité de la SA (81). De plus, l'activité du 18F-NaF prédit la progression de la maladie mesurée par CT et échocardiographie (82, 83). Les nouvelles zones de macrocalcification semblent se développer là où l’activité de 18F-NaF est augmentée, ainsi le PET/CT permet de détecter la calcification en développement avant qu'elle ne soit visible au CT (figure 1).
Figure 1. Variation du score calcique valvulaire aortique mesurée par tomodensitométrie axiale et de l'activité de 18F-NaF mesuré par tomographie par émission de positrons après 1 an. A et B, valve aortique
de 2 patients présentant une sténose aortique légère (haut et bas). Sur le CT de base (à gauche), les régions atteintes de macrocalcification apparaissent en blanc. Les PET/CT (au milieu) montrent une captation intense de 18F-NaF (régions rouge, jaune) recouvrante et adjacente aux dépôts de calcium existants sur le CT. Les CT de suivi d'un an (à droite) montrent une augmentation de l'accumulation de calcium correspondant aux zones d’activités identifiées à la TEP de base.
C – D, Prédicteurs de la progression du score calcique de la valve aortique. Une corrélation a été observée entre l'activité
de base 18F-NaF dans la valve aortique et le changement subséquent du score de calcium à 1 an (A). Adapté de Dweck et al. (82).
Il faut garder à l’esprit qu’il s’agit davantage de l'étendue des lésions cardiaques liées à la SA, plutôt que la sévérité de la sténose, qui détermine la survenue de symptômes et d'événements cardiovasculaires. C'est la raison pour laquelle, outre le classement de la sévérité de la SA, il est également crucial d'évaluer le degré de lésions cardiaques au niveau du ventricule gauche, oreillette gauche, ventricule droit et oreillette droite. L’évaluation de la fonction cardiaque par échocardiographie et imagerie par résonance magnétique nucléaire est donc essentielle dans la prise en charge des patients atteints de SA.
9
5. Facteurs de risque de la sténose aortique
La SA étant une maladie complexe, les facteurs de risque de son développement et de sa progression sont multiples et restent en partie inconnus. Comme il a été discuté précédemment, la prévalence de la SA augmente graduellement avec l’âge, ce qui fait de l’âge le facteur de risque principal de la SA. Les études épidémiologiques observationnelles et les avancés de la génomique ont mis en évidence un certain nombre d’autres facteurs de risques environnementaux et génétiques.
5.1. Sexe
Les données échocardiographiques ont montré que le risque de développer une SA était deux fois plus élevé chez l'homme que chez la femme (84). Cependant, les études nationales basées sur les demandes d'indemnisation chez les patients hospitalisés ont montré une disparité moins prononcée, avec 55,1% des patients hospitalisés pour SA étant des hommes aux États-Unis, tandis que 52% sont des femmes en Suède, et 53% en Écosse (85-87). Fait intéressant, 60% des jeunes patients (≤ 75 ans) étaient des hommes et plus de 50% des personnes âgées étaient des femmes (88). Cela pourrait s'expliquer par le taux de valvules bicuspides congénitales qui est deux à trois fois plus élevé chez les hommes que chez les femmes. Pendant longtemps, le sexe masculin a été considéré comme un prédicteur d'une progression hémodynamique plus rapide de la SA, bien qu'un grand nombre d'études rétrospectives et prospectives aient réfuté cette hypothèse (79, 89, 90). Dans l'étude SEAS, les femmes et les hommes avaient des taux similaires de progression de la SA et d'événements liés à la SA (90).
5.2. Obésité
Dans les cohortes Cohort of Swedish Men et Swedish Mammography Cohort comprenant 71 817 participants avec un suivi moyen de 15,3 ans, 1297 individus ont développé une SA. Le surpoids (indice de masse corporelle [IMC] 25,0-29,9 kg/m2) et l'obésité (IMC> 30 kg/m2) augmentaient le risque de SA de 1,2 et 1,8 fois, respectivement. De plus, le surpoids (risque relatif [RR] : 1,6) et l'obésité (RR : 2,0) étaient également indépendamment liés au remplacement valvulaire aortique (91). Une étude récente de la Copenhagen General Population Study, a inclus plus de 100 000 participants avec des mesures d’indice de masse corporelle, de rapport taille-hanche et de tour de taille, et les informations sur 5 polymorphismes génétiques associés à l'obésité. Durant un suivi moyen de 8,7 années, l’incidence de 1215 cas de SA et 467 remplacements valvulaires aortiques ont été observés. L'obésité, estimée à partir de l'indice de masse corporelle, était associée à un risque plus élevé de sténose valvulaire aortique et de remplacement valvulaire, à la fois dans l’étude observationnelle et dans l’étude de randomisation mendélienne (92).
Les mécanismes qui lient l’obésité au développement de la SA restent incertains. Cependant, plusieurs études suggèrent que des médiateurs spécifiques du tissu adipeux pourraient jouer un rôle important dans la
10
physiopathologie de la SA. Une forte proportion de particules LDL petites et denses en circulation, caractéristique étroitement associée à l'obésité viscérale et à la résistance à l'insuline, a été liée à l'inflammation et au remodelage valvulaire aortique (29). Dans des valves aortiques explantées, le niveau valvulaire de LDL oxydée (Ox-LDL) est lié à la quantité de petites LDL denses en circulation. Le taux plasmatique d'adiponectine, une cytokine spécifique des adipocytes, est diminué chez les patients obèses viscéraux et est associé à l'inflammation et au remodelage de valves aortiques explantés (93). Plus récemment, une étude a montré que l'autotaxine (ATX), une lysophospholipase qui est sécrétée par les VIC et les adipocytes, favorise l'inflammation et la minéralisation de la valve aortique (38). De plus l’activité de l'ATX, qui est augmentée chez les individus obèses, est un prédicteur indépendant de la SA (94).
5.3. Hypertension
L'hypertension est très répandue chez les patients présentant une SA et ces maladies combinées représentent deux formes différentes de surcharge systolique ventriculaire gauche (84, 95). L’hypertension est associée à une calcification accrue de la valve aortique (96, 97). La présence d'hypertension est également associée à une mortalité accrue chez les patients asymptomatiques atteints de SA légère ou modérée (98). Une pression sanguine systolique élevée peut être un marqueur de l'activation du système rénine-angiotensine-aldostérone. Des études antérieures suggèrent que l'angiotensine II peut favoriser la fibrose, le remodelage et la calcification des tissus valvulaires aortiques (47, 99). Chez les patients avec un diagnostic de pré-hypertension opérés d'une SA symptomatique sévère, les taux d'angiotensine II circulants étaient associés à une inflammation et à un remodelage fibro-calcifique des valves aortiques (100). De plus, les degrés d'inflammation et de remodelage étaient plus faibles dans les valves aortiques explantées de patients traités par des bloqueurs du récepteur de l'angiotensine II (101). Une tension artérielle élevée peut augmenter le stress mécanique et ainsi provoquer des dommages endothéliaux et ainsi promouvoir l'infiltration des lipides et des cellules inflammatoires dans la valve (1).
5.4. Diabète de type 2
De grandes études récentes ont montré que la prévalence du diabète de type 2 est plus élevée dans les cohortes de SA que dans la population générale. Dans la cohorte CURRENT de 3815 patients atteints de SA sévère, 11,4% des patients avaient un diabète de type 2, dont 21% étaient sous insulinothérapie, tandis que dans l'étude PRIMID AS, 14,4% des 174 patients étaient diabétiques de type 2 (102, 103). Aux États-Unis, de 2009 à 2015, parmi les bénéficiaires de Medicare atteints de SA sévère subissant un remplacement valvulaire aortique, la prévalence du diabète de type 2 est passée de 19,7% à 31,6% (104). Dans une grande étude prospective, l'incidence de la SA chez les patients atteints de diabète de type 2 était de 3,42% contre 1,68% chez les patients non diabétiques (105). L’étude CANHEART a cherché à démontrer le lien entre des facteurs de risque
11
cardiovasculaires et le risque de SA dans plus d’un million d’individus pendant un suivi médian de 13 ans. Le diabète est associé à un risque dose dépendant augmenté de presque 50% (106).
Le diabète de type 2 non seulement prédispose à la SA dégénérative, mais peut également contribuer à une progression plus rapide de la SA. Plusieurs auteurs ont démontré l'interaction entre le diabète de type 2 et la progression et la sévérité de la SA, en particulier chez les patients avec une SA modérée (107-109). Cependant, il y a un manque de données sur l'effet longitudinal du diabète de type 2 sur la progression de la sévérité de la SA. Compte tenu des résultats opposés des études publiées, il manque des preuves précises que le diabète provoque/aggrave effectivement la SA. Néanmoins, à ce jour, il n'y a eu aucun essai contrôlé randomisé pour examiner spécifiquement si un traitement antihyperglycémique/antidiabétique peut empêcher le développement ou ralentir la progression de la SA.
Le diabète de type 2 augmente l'expression de la protéine C réactive (CRP) pro-inflammatoire et du facteur tissulaire chez les patients atteints de SA sévère. Le CRP active les macrophages et les lymphocytes T, la fixation du complément et module l'activation plaquettaire, tandis que le facteur tissulaire affecte la coagulation et conduit à la formation de thrombine qui, à son tour, augmente la calcification valvulaire (110, 111). Un taux plasmatique élevé de CRP est associé au développement du diabète, ce qui est consistant avec les données qui montrent une association indépendante entre la CRP et la progression de la SA (112). De plus, il a été démontré que dans les VIC, l'hyperglycémie transitoire conduit à une synthèse excessive de phospholipides pro-inflammatoires et à une activation de la coagulation, ce qui pourrait faciliter le développement d’une SA chez les patients atteints de diabète mal contrôlé.
5.5. Lipoprotéine de faible densité
Métabolisme
Le cholestérol circule dans l'organisme par 5 principaux types de lipoprotéines : chylomicrons, lipoprotéines de très basse densité (VLDL), lipoprotéines de densité intermédiaire (IDL), lipoprotéines de faible densité (LDL) et lipoprotéines de haute densité (HDL). Le foie sert d'organe clé pour le métabolisme et la régulation des taux plasmatiques de cholestérol. Le processus de formation des LDL commence lorsque le cholestérol intrahépatique, par absorption intestinale ou par synthèse de novo, est métabolisé par le foie (avec les protéines, les triglycérides et les phospholipides) en VLDL. Les VLDL pénètrent ensuite dans la circulation et sont convertis par la lipoprotéine lipase, la lipase hépatique et la protéine de transfert des esters de cholestérol (CETP) en espèces plus enrichies en cholestérol, d'abord IDL puis LDL.
Catabolisme
Les niveaux de cholestérol-LDL (C-LDL) plasmatiques sont déterminés par le taux de production de LDL et le taux de clairance des particules LDL, qui sont tous deux régulés par le nombre de récepteur au LDL (LDLR) à