L’EFFET D’UNE EXPOSITION PRÉNATALE AU MERCURE MÉTHYLÉ SUR LE COMPORTEMENT ET LES FONCTIONS COGNITIVES DES SOURIS
Mémoire Présenté
à la Faculté des études supérieures de !’Université Laval
pour l’obtention
du grade de maître en psychologie (M. Ps.)
École de psychologie
FACULTÉ DES SCIENCES SOCIALES UNIVERSITÉ LAVAL
JUIN 2001
RÉSUMÉ
Des travaux antérieurs ont montré qu’une exposition prénatale au mercure méthylé (MeHg) à forte dose peut provoquer l’apparition de symptômes moteurs et sensoriels graves. À des doses plus modérées, des études ont mis en évidence des symptômes sous- cliniques comportementaux et mnésiques qui constitueraient vraisemblablement les premiers signes d’une intoxication au MeHg. Cette étude vise à identifier chez la souris, modèle animal de l’intoxication humaine, des déficits comportementaux et mnésiques causés par une exposition aiguë au MeHg pendant les jours 7 à 9 de la gestation en tenant compte des effets moteurs et sensoriels potentiels d’une telle exposition. Les résultats montrent un déficit de persévération chez les souris traitées, mais aucune autre
modification des fonctions cognitives. Une exposition aiguë au MeHg pendant les jours 7 à 9 de la gestation serait davantage propice à l’apparition de symptômes sous-cliniques comportementaux que de problèmes mnésiques majeurs.
Signatures :
Étudiant : Philippe-Olivier Harvey
!-AVANT PROPOS
Je tiens à exprimer ma reconnaissance et remercier sincèrement mes directeurs de mémoire, M. François Y. Doré et Mme Sonia Goulet. Merci pour votre grande disponibilité, votre rigueur scientifique et vos bons conseils.
Merci à mes très chers parents. Votre support tout au long de ces années a été exemplaire et si précieux pour moi. Je sais queje peux toujours compter sur vous. Merci de croire en moi. J’espère que vous êtes fiers. Merci aussi pour votre support financier.
L’autonomie financière ne saurait tarder.
Merci à mes amis du laboratoire, Anne, Philippe et Valérie. J’ai eu beaucoup de plaisir à travailler avec vous. Nos croustillantes conversations ont su agrémenter nos longues périodes d’expérimentation dans l’animalerie de Robert-Giffard.
Merci à tous mes amis, spécialement à Jeff, Michel et François. Votre amitié est très précieuse.
Finalement, je tiens à exprimer de sincères excuses à mes souris qui, pendant une longue fin de semaine, ont souffert de la faim. Spécialement aux trois qui n’ont
TABLE DES MATIÈRES
Page RÉSUMÉ... II AVANT-PROPOS... ΠΙ TABLE DES MATIÈRES... IV LISTE DES FIGURES... V
INTRODUCTION... 1
Effets neurobiologiques... 2
Changements structuraux... 3
Changements biomoléculaires... 6
Facteurs influençant les effets neurotoxiques... 10
Symptômes associés à l’intoxication au MeHg... 14
Effets tératologiques... 15
Atteintes des fonctions motrices et de l’activité locomotrice... 17
Atteintes sensorielles... 18
Altérations comportementales et émotionnelles... 20
Atteintes cognitives... 20 Objectifs et hypothèses... 22 MÉTHODE... 23 Sujets... 23 Matériel... 23 Procédure... 27 Rotarod... 28 Labyrinthe en T... 28
Discrimination visuelle du labyrinthe en Y... 29
Open field... 30 Labyrinthe radial... 30 RÉSULTATS... 31 DISCUSSION... 46 CONCLUSION... 56 RÉFÉRENCES... 60
LISTE DES FIGURES Page Rotarod... 24 Labyrinthe en T... ... 25 Labyrinthe en Y... 26 Open field... 26 Labyrinthe radial... 27
Latences moyennes de chute (secondes) dans le rotarod à 20 rpm... 32
Nombres de sessions requises pour atteindre le critère lors de !’apprentissage à 0 seconde dans le labyrinthe en T (excluant les deux sessions ayant permis l’atteinte du critère)... 33
Nombres d’essais réussis lors de !’apprentissage à 0 seconde et du test avec délais de 30, 60 et 120 secondes dans la tâche du labyrinthe en T... 34
Nombres totaux de carrés traversés lors des cinq sessions dans Topen field... 35
Pourcentages de carrés centraux traversés lors des cinq sessions dans Topen field... 36
Nombres de redressements lors des cinq sessions dans Topen Figure 1 Figure 2 Figure 3 Figure 4 Figure 5 Figure 6 Figure 7 Figure 8 Figure 9 Figure 10 Figure 11 37 field
Figure 12 Nombres totaux de carrés traversés lors des premières (période 1) et des dernières (période 2) cinq minutes d’enregistrement pour
les cinq sessions dans !’open field... 38
Figure 13 Pourcentages moyens de carrés centraux traversés lors des premières (période 1) et des dernières (période 2) cinq minutes
d’enregistrement pour les cinq sessions dans Popen field... 39
Figure 14 Nombres moyens de redressements lors des premières (période 1) et des dernières (période 2) cinq minutes d’enregistrement pour les
cinq sessions dans Popen field... 40
Figure 15 Nombres de sessions nécessaires à l’atteinte du critère
d’apprentissage dans la discrimination visuelle... 41
Figure 16 Nombres de choix de couloirs par bloc de trois sessions dans la
phase d’apprentissage du labyrinthe radial... 42
Figure 17 Nombres de réussites par bloc de trois sessions dans le labyrinthe
radial... 43
Figure 18 Pourcentages de réussites par bloc de trois sessions dans le
labyrinthe radial... 44
Figure 19 Pourcentages d’erreurs de mémoire de référence par bloc de trois
sessions dans le labyrinthe radial... 45
Figure 20 Pourcentages d’erreurs de mémoire de travail par bloc de trois
L’effet d’une exposition prénatale au mercure méthylé sur le comportement et les fonctions cognitives des souris
INTRODUCTION
Le mercure est un métal encore utilisé aujourd’hui dans les domaines industriel,
médical et agricole. L’une de ses formes organiques, le mercure méthylé, est l’un des produits les plus répandus dans la chaîne alimentaire, notamment dans les poissons et les grains, mais aussi les plus toxiques pour le système nerveux.
Les effets neurotoxiques du mercure méthylé (MeHg) ont été mis clairement en évidence lors des études qui ont suivi la catastrophe écologique de Minamata au Japon dans les années 50. Suite au déversement d’une quantité importante de mercure dans la Baie de Minamata, la population riveraine fut exposée à de fortes concentrations de MeHg via une alimentation riche en poissons et fruits de mer. Cette intoxication au MeHg, quand elle n’était pas létale, s’accompagnait d’effets tératogènes et de symptômes neurologiques marqués : problèmes sensoriels (paresthésie), diminution du champ visuel, ataxie, problèmes de coordination musculaire, tremblements et dysarthrie (MacDonald & Harbison, 1977 ;
Takeuchi, Matsumoto & Koya, 1965). Les études ultérieures sur des populations humaines et des modèles animaux ont montré qu’une exposition au MeHg affecte principalement le développement du système nerveux. En effet, bien que le MeHg s’accumule plus lentement dans le cerveau que dans d’autres organes (foie et reins, par exemple), il demeure toutefois plus stable dans les tissus cérébraux et résiste donc mieux à une dégradation en mercure
inorganique, plus facilement éliminé par l’organisme. Avec le temps, le taux de MeHg dans le cerveau devient de trois à six fois plus élevé que celui mesuré dans le sang, atteignant un seuil de toxicité (Chang, 1997).
L’une des principales propriétés du MeHg est sa capacité à traverser le placenta et à endommager le système nerveux du fœtus (Spyker, 1975 ; Takeuchi et al., 1965). Plusieurs études démontrent que la vulnérabilité aux effets toxiques du MeHg est plus élevée durant la période périnatale qu’à l’âge adulte (Spyker & Smithberg, 1975). À Minamata, par exemple, des mères exposées au MeHg, mais qui ne présentaient aucun symptôme, ont donné naissance à des enfants sévèrement retardés (Spyker, 1975 ; Takeuchi et al., 1965). Cette vulnérabilité accrue du fœtus s’expliquerait entre autres par des différences dans le métabolisme de
certaines enzymes, dans la capacité d’excrétion des neurotoxines et dans le développement du système immunitaire (Spyker, 1975). Il semble donc important de bien définir les effets neurotoxiques du MeHg, tant sur le système nerveux en développement qu’à l’âge adulte.
En plus des nombreuses études neurobiologiques sur l’effet neurotoxique du MeHg, plusieurs travaux s’intéressent aux conséquences comportementales et cognitives d’une intoxication au MeHg. Les effets toxiques du MeHg se manifesteraient d’abord par de subtiles altérations comportementales et cognitives (symptômes sous-cliniques) et ce avant même l’apparition des symptômes classiques d’empoisonnement (Spyker, 1972). Une meilleure connaissance des premiers déficits comportementaux et cognitifs à survenir à la suite d’une exposition pourrait donc éventuellement permettre un diagnostic précoce d’une intoxication au MeHg, à un moment où le processus neurotoxique serait encore réversible (Spyker, 1973).
Effets neurobiologiques
Les effets neurobiologiques du MeHg sur les systèmes nerveux humain et animal touchent plusieurs régions cérébrales ainsi que différents mécanismes moléculaires et cellulaires.
Changements structuraux
Presque toutes les régions du système nerveux sont sensibles aux effets toxiques du MeHg chez l’humain, notamment le cortex cérébral, le cervelet, les structures sous-corticales, la substance blanche et la racine dorsale de la moelle épinière. Des atteintes similaires à celles mises en évidence chez l’humain ont été observées chez les rongeurs et les primates.
Chez l’humain, l’exposition au MeHg entraîne une atrophie cérébrale bilatérale, une diminution du nombre et de la taille des neurones corticaux, ainsi que des anomalies
structurales de ces neurones (Takeuchi et al., 1965). Les autopsies effectuées sur les victimes de Minamata ont permis de déceler une démyélinisation des fibres nerveuses et des anomalies cytoarchitecturales dans plusieurs aires corticales (Chang & Guo, 1998 ; Takeuchi et al., 1965). La fissure calcarine, le cortex cingulé et l’aire précentrale sont les parties du cortex les plus affectées par l’exposition au MeHg (Chang, 1997 ; Kakita et al., 2000 ; Takeuchi et al.,
1965). Les études sur des modèles animaux montrent des atteintes similaires à celles
observées chez les humains. Chez le macaque, une exposition prénatale au MeHg produit une atrophie du cortex cérébral, ainsi qu’une dégénérescence neuronale et de la gliose, les atteintes les plus importantes apparaissant dans le lobe occipital près de la fissure calcarine (Burbacher, Kodier & Weiss, 1990). Burbacher et al. (1990) notent aussi une désorganisation neuronale particulièrement marquée au niveau de la quatrième couche de 1’insula. Chez le rat, une dose unique de 4 mg/kg de MeHg administrée au 4e jour de la gestation entraîne une
dégénérescence de 10 à 15 % des neurones du cortex cérébral (Chang, 1994) et une arborisation dendritique atypique des neurones pyramidaux (Stoltenburg-Didinger & Markwort, 1990). Une dégénérescence neuronale dans le cortex cérébral est également
observée chez les souris intoxiquées, seules les cellules microgliales étant en évidence dans les régions touchées (Berthoud, Garman & Weiss, 1976).
En plus du cortex cérébral, il semble que le cervelet soit particulièrement vulnérable à la neurotoxicité du MeHg, plusieurs études ayant observé chez les humains une atrophie cérébelleuse associée à une réduction importante du nombre de cellules granulaires (Chang,
1997 ; Takeuchi et al., 1965). Chez les animaux, les changements morphologiques observés dans cette même région se résument à une dégénérescence des cellules de Purkinje, à une perte de cellules granulaires et à une prolifération des cellules gliales (MacDonald & Harbinson,
1977). Chez la souris, une dose unique postnatale de 8 mg/kg de MeHg entraîne plusieurs changements morphologiques dans le cervelet et même une dose réduite à 4 mg/kg provoque une réduction significative du nombre de neurones cérébelleux (Sager, Aschner & Kodier,
1984). Toujours chez la souris, Spyker (1975) note une augmentation du nombre de
lysosomes dans plusieurs cellules de Purkinje et dans les cellules granulaires du cervelet, en plus d’une dégénérescence des réticulums endoplasmiques rugueux. Ces changements morphologiques intracellulaires seraient les premiers symptômes d’une dégénérescence neuronale dans le cervelet (Spyker, 1975). La dégénérescence des cellules granulaires et de Purkinje est aussi une conséquence de l’exposition au MeHg observée chez le macaque (Burbacher et al., 1990).
Les autopsies effectuées sur des humains exposés de façon postnatale au MeHg montrent une atrophie des ganglions de la base (Amin-Zaki et al., 1976), mais les atteintes sous-corticales ont davantage été mises en évidence chez les modèles animaux. Chez la souris, une exposition quotidienne de 4 mg/kg de MeHg pendant 14 jours provoque une importante perte neuronale dans le striatum, le putamen, l’hypothalamus et le thalamus
(Berthoud et al., 1976). Dans cette étude, la dégénérescence neuronale dans le putamen était si marquée qu’il ne restait que des cellules gliales, des astrocytes et des résidus de noyaux
était diffuse, mais plus marquée dans les radiations optiques, qui ont pour destinations les aires visuelles. Chez le rat, une exposition périnatale prolongée de 3 mg/kg/jour de MeHg pendant 24 jours touche aussi l’hypothalamus (Kakita et al., 2000). Finalement, la dégénérescence des ganglions de la base a été notée également chez le macaque (Burbacher et al., 1990).
La substance blanche n’échappe pas aux nombreuses régions du système nerveux endommagées par une exposition au MeHg. On observe, chez l’humain, une démyélinisation chez plusieurs fœtus intoxiqués, ainsi qu’une hypoplasie du corps calleux (Amin-Zaki et al., 1976 ; Takeuchi et al., 1965). Des dommages à la substance blanche ont également été observés chez les macaques (Burbacher et al., 1990).
Le MeHg serait particulièrement toxique pour les cellules ganglionnaires de la racine dorsale en raison de la moins grande efficacité de la barrière hémato-encéphalique au niveau du système nerveux périphérique (Verity, 1997). La désintégration des réticulums
endoplasmiques rugueux est parmi les premiers changements neuronaux dans les ganglions de la racine dorsale (Chang, 1994).
Parmi les autres changements anatomiques causés par le MeHg chez le rat, une hydrocéphalie est remarquée après une exposition prénatale à une dose unique de 10 mg/kg de MeHg (Kutscher, Sembrat, Kutscher & Kutscher, 1985). Kakita et al. (2000) montrent chez le rat que les changements histologiques les plus importants suite à une exposition périnatale (3 mg/kg/jour de MeHg pendant 24 jours) se retrouvent dans le tronc cérébral. Ils observent aussi une dégénérescence neuronale accrue dans les noyaux réticulaires pontiques et dans l’olive inférieure et une dégénérescence moins marquée dans le noyau rouge et les noyaux amygdaliens.
Les dommages structuraux causés par le MeHg dans le système nerveux sont donc nombreux et diffus. Cependant, les diverses régions affectées présentent une sensibilité
variable aux effets toxiques du MeHg car, pour une même concentration de MeHg, les dommages structuraux diffèrent (Chang, 1997). Une meilleure compréhension des effets biomoléculaires du MeHg dans diverses régions est requise afin d’expliquer en partie ces différences.
Changements biomoléculaires
En dépit du fait que plusieurs études sur le MeHg s’intéressent à !’identification d’une région précise du système nerveux affectée par l’intoxication, il est maintenant clair qu’une pathogenèse multifactorielle contribue à l’apparition d’un vaste ensemble de dommages neurologiques (Verity, 1997). Les bases moléculaires de la neurotoxicité du MeHg étant multiples, les dommages morphologiques et les anomalies neurobiologiques qui en résultent sont vraisemblablement associés à plusieurs mécanismes toxiques agissant directement ou indirectement sur le système nerveux. Parmi les principaux effets biomoléculaires néfastes engendrés par le MeHg, on note l’inhibition de la synthèse protéique et macromoléculaire, des changements aux niveaux calcique, ionique et des neurotransmetteurs, de l’oxydation
cellulaire, des effets sur la migration cellulaire et une modification de la phosphorylation.
Inhibition de la synthèse protéique et macromoléculaire
Plusieurs chercheurs font un lien entre la toxicité du MeHg et certains groupes de protéines, notamment les protéines kinases A et C. Les résultats de Saijoh, Fukunaga, Katsuyama, Lee & Sumino (1991) montrent qu’une forte concentration de MeHg dans le cerveau peut inhiber non seulement les activités enzymatiques intracellulaires, mais aussi les liens entre les seconds messagers et les protéines kinases A et C. Saijoh et al. (1991) font une relation entre l’effet neurotoxique du MeHg sur les protéines kinases A et C et l’effet
protecteur du sélénium, un antioxydant dont les effets ont été étudiés en relation avec le MeHg (Cantin, 2001). Une injection de sélénium suite à une intoxication au MeHg permettrait de rétablir l’activité enzymatique entourant l’action de la protéine kinase C. L’augmentation de Ca2+ causée par le MeHg affecterait l’activité enzymatique des kinases et provoquerait
éventuellement la mort cellulaire. L’effet protecteur du sélénium serait possible par son action sur la concentration calcique intracellulaire. Verity (1997) a confirmé sur des cellules
granulaires que le MeHg inhibe certains mécanismes de transcription de EARN, entraînant l’inhibition de la synthèse de certaines enzymes kinases. Il suggère également que l’inhibition de la synthèse de certaines protéines pourrait résulter, entre autres, d’une dysfonction
mitochondriale engendrée par le MeHg et consécutive à une modification des charges énergétiques cellulaires (Verity, 1997). Par ailleurs, une exposition répétée au MeHg (1 mg/kg/jour) pendant 10 jours chez la souris diminue significativement la quantité de phospholipides dans le cerveau (Mehra & Kanwar, 1980).
Changements calcique, ionique et des neurotransmetteurs.
La dégénérescence neuronale causée par le MeHg serait reliée à une élévation de la concentration calcique à des niveaux toxiques (Sakamoto, Ikegami & Shimai, 1996 ; Verity, 1997). Sakamoto et al. (1996) montrent que l’injection de Flunarizine, un bloqueur des canaux calciques, réduit significativement la dégénérescence neuronale associée à
l’intoxication au MeHg. L’exposition au MeHg entraîne aussi des changements au niveau du flux de K+ dans certains neurones, ce qui provoquerait une augmentation de la rapidité de la dépolarisation membranaire. Il y aurait par conséquent une altération des gradients
transmembranaires, ce qui affecterait la libération et la recapture de certains
été établi entre la toxicité du MeHg et le métabolisme de l'acétylcholine. Chez les souris, une intoxication à long terme au MeHg produit une diminution de la quantité d'acétylcholine dans le striatum et le cortex cérébral (Kobayashi, Yuyama, Matsusaka, Takeno & Yanagiva, 1980), suggérant que le déficit cholinergique dans le striatum et les régions associées serait
responsable des symptômes moteurs, en particulier des tremblements, observés chez les sujets intoxiqués. Cette diminution du neurotransmetteur serait due à une inhibition de la synthèse de Γacétylcholine. D’autres neurotransmetteurs, dont les catécholamines, semblent aussi affectés par l’intoxication au MeHg (Annau & Cuomo, 1988 ; Cagiano et al., 1990 ; Verity, 1997). Une exposition prénatale au 8e jour de la gestation engendre chez le rat une
sensibilisation pharmacologique aux amphétamines en raison d’une augmentation de la densité des récepteurs dopaminergiques dans le striatum (Cagiano et al., 1990). Par ailleurs, une exposition prénatale à dose unique de MeHg inhibe la recapture du glutamate et stimule la libération de ce neurotransmetteur durant la vie postnatale, entraînant des déficits
d’apprentissage et de mémoire (Cagiano et al., 1990). Ces nombreux changements ioniques et les variations entourant les neurotransmetteurs viendraient également interférer avec la
transmission synaptique, entre autres dans la région CAI de l’hippocampe (Fountain &
Rowan, 2000 ; Gilbert & Burdette, 1995). La potentialisation à long terme (LTP), mécanisme synaptique associé à la mémorisation à long terme, est présente dans cette région de
!’hippocampe et pourrait être affectée par le MeHg (Gilbert & Burdette, 1995).
Oxydation cellulaire
Parmi les autres effets neurobiologiques observés suite à une intoxication au MeHg, on note des lésions associées à une oxydation des tissus cérébraux, principalement dans les cellules granulaires. En affectant les fonctions mitochondriales et les échanges ioniques, le
MeHg induirait une lipoperoxidation de la membrane cellulaire (Chang, 1997 ; Verity, 1997). La vitamine E et le sélénium apporteraient une protection contre cette oxydation (Verity,
1997).
Effets sur la migration cellulaire
Les déficits plus marqués à la suite d’une exposition prénatale au MeHg s’expliquent entre autres par les effets néfastes du MeHg sur la migration cellulaire et la cytoarchitecture. Ces effets néfastes se résument d’abord par une atteinte des molécules d’adhésion cellulaire (CAMs), primordiales lors de la phase de fasciculation de la migration des neuroblastes (Chang & Guo, 1998). Le MeHg ralentirait la transformation de la molécule eNCAM
(1embryonic neural cell adhesion molecule) et aNCAM {adult neural cell adhesion molecule),
ce qui engendrerait un problème dans la genèse synaptique et dans la stabilisation
cytoarchitectonique. Chang et Guo (1998) soutiennent que le MeHg affecterait aussi une importante protéine du cytoskelette, la protéine MAP {microtubule-associatedprotein), causant ainsi des problèmes dans le transport cellulaire. L’effet potentiellement néfaste du MeHg sur les microtubules est une hypothèse intéressante car elle expliquerait la dysplasie cellulaire et les problèmes migratoires. En effet, les microtubules forment la base structurale de l’axe mitotique et contrôlent la croissance cellulaire, la genèse des neuntes et l’élongation axonale (Verity, 1997).
Modification de la phosphorylation
Plusieurs fonctions neuronales sont influencées par l’état de phosphorylation / déphosphorylation de certaines protéines comme par exemple, la conductance ionique, la genèse neuronale et synaptique et la prolifération cellulaire. L’exposition au MeHg
stimulerait la phosphorylation protéique des cellules granulaires du cervelet. Cette
augmentation de la phosphorylation protéique pourrait résulter indirectement de la stimulation de certaines protéines kinases dépendantes du taux de Ca2+ (Verity, 1997). De plus, Verity (1997) suggère que des changements au niveau de la phosphorylation des MAPs
influenceraient la structure des microtubules.
Facteurs influençant les effets neuro toxiques
Plusieurs facteurs influencent l’importance des déficits qui découlent d’une exposition au MeHg. Parmi ces facteurs, on retrouve le stade de développement de l’organisme, l’espèce et la souche, les régions cérébrales atteintes et l’intensité de l’exposition. Tous ces facteurs influencent entre autres l’absorption, la concentration et l’excrétion du MeHg dans
l’organisme.
Stade de développement
La période du développement est déterminante pour l’intensité et la nature des déficits causés par un agent toxique. En général, un système organique est plus vulnérable aux effets toxiques lorsqu’il est en développement (Spyker, 1973). Les diverses périodes du
développement de l’organisme susceptibles d’induire des atteintes tératogènes peuvent être classées en trois catégories distinctes : la période du « tout ou rien », la période des
malformations et la période des déficits fonctionnels (Bennett & Finnell, 1998). La période du « tout ou rien » fait référence au fait qu’une exposition dans les premiers stades du
développement entraîne soit des atteintes suffisantes pour provoquer la mort de l’organisme, soit insuffisantes pour provoquer des effets notables. La période des malformations
toxique peut altérer la formation des structures embryonnaires et conduire ainsi à des malformations congénitales. Par exemple, chez la souris, les jours 5 à 15 de la gestation constituent une période plus vulnérable aux malformations congénitales causées par un agent toxique comme le MeHg (Spyker, 1973). Finalement, dans les derniers stades de la gestation où se déroulent l’histogenèse et la phase de maturation, l’exposition entraîne surtout des déficits fonctionnels.
Cette classification en trois périodes de vulnérabilité est moins claire pour le système nerveux humain que pour celui d’autres mammifères. Celui-ci commence à se développer dans l’embryon et sa maturation finale se poursuit quelques années après la naissance contrairement à quelques mois pour les rongeurs (Bennett & Finnell, 1998). Néanmoins, plusieurs études sur les humains et les animaux corroborent la vulnérabilité accrue à
l’intoxication lors des phases du développement prénatal. Par exemple, chez une population inuit, le taux sanguin de MeHg chez les mères était significativement inférieur à celui des fœtus qu’elles portaient (Hansen, Tarp & Bohm, 1990). Cette différence s’expliquerait par une incapacité du fœtus à déméthyler le mercure. Chez l’organisme adulte, la transformation du MeHg en forme inorganique en diminuerait l’absorption et le rendrait donc moins néfaste. L’incapacité du fœtus à déméthyler le MeHg expliquerait en partie les différences
symptomatiques d’une exposition prénatale (Hansen et al., 1990). Plusieurs chercheurs soutiennent que la période critique d’intoxication pour le système nerveux serait celle de la migration neuronale qui survient dans les derniers stades du développement d’un organisme (Chang, 1997 ; Sager et al., 1984 ; Spyker, 1973 ; Takeuchi et al., 1965). Les souris sont d’ailleurs plus résistantes à une exposition au MeHg si cette dernière a lieu avant le 9^ jour de la gestation (Spyker, 1973).
Spécificité de l’espèce et de la souche
Plusieurs recherches en neurotoxicologie tentent de déterminer l’importance de
l’espèce et de la souche sur les effets d’un agent toxique donné. Ces études visent entre autres à identifier les modèles animaux qui permettent, par comparaison, une meilleure
compréhension de la toxicité du MeHg chez l’humain. Dans sa récension des écrits sur la concordance animal/humain quant à la toxicité de divers agents, Schardein (1998) conclut que le rat et la souris sont les modèles les plus fidèles de l’effet tératogène du MeHg sur l’humain. Chez la souris en particulier, Schardein (1998) remarque que les anomalies structurales, les malformations et le comportement postnatal concordent avec les observations faites chez l’humain. En se basant sur les similitudes entre les neuropathologies consécutives à une forte exposition au MeHg chez des macaques et celles observées chez les victimes de Minamata, Burbacher et al. (1990) suggèrent que les effets sur la migration apparaissent tant chez
l’humain que chez les primates. Toutefois, certaines différences inter-espèces et inter-souches subsistent. Entre autres, le cervelet des primates ne semble pas être autant atteint par une exposition prénatale ou postnatale au MeHg que chez l’humain (Burbacher et al., 1990). Chez les rongeurs, l’absorption, la transformation et l’excrétion du MeHg varient non seulement d’une espèce à l’autre, mais aussi à l’intérieur d’une même espèce, selon le sexe et la souche (Doi, 1986 ; Yasutake & Hirayama, 1986). Dans une étude comparant le taux d’excrétion du MeHg chez les trois souches de souris C3H, C57BL et ICR, Doi (1986) observe que les souris de souche ICR excrètent davantage le MeHg via l’urine que les deux autres souches. De même, la souche C57BL aurait un taux d’excrétion du MeHg plus rapide que celui des souches BALB, C3H et AKR, en raison de différences dans la structure de l’hémoglobine (Yasutake & Hirayama, 1986). Les souris mâles de souche B6 auraient un taux d’excrétion supérieur à celui des souris femelles de même souche (Yasutake & Hirayama, 1988).
Finalement, les souris de souche A/Jax sont plus résistantes que les souris de la souche 129/SvSl pour les mêmes doses de MeHg (Spyker, 1973).
Régions cérébrales atteintes
Le MeHg est concentré davantage dans certaines parties du cerveau, peu importe l’espèce, la souche et le sexe de l’organisme (Vandewater, Racz, Noms & Buncel, 1983), en particulier le cortex antérieur et le cervelet. Les régions les plus atteintes sont : le cortex, le cervelet et les structures sous-corticales. Bien que la concentration de MeHg dans une région cérébrale précise soit un bon prédicteur de l’intensité des dommages, Vanderwater et al. (1983) notent que la sensibilité au MeHg peut varier d’une région cérébrale à l’autre, ce qui influence aussi l’importance des dommages au cerveau.
L’exposition
L’intensité d’une exposition au MeHg est évidemment un facteur déterminant pour la nature et la gravité des effets neurotoxiques sur un organisme. Les recherches sur les
populations humaines (Amin-Zaki et al., 1976 ; Harada, 1997 ; Takeuchi et al., 1965) et sur les modèles animaux (Burbacher et al., 1990 ; Chang, 1997 ; Spyker & Smithberg, 1975) ont permis de clarifier la présence d’un seuil d’exposition délimitant l’apparition des symptômes cliniques et sous-cliniques. Burbacher et al. (1990) suggèrent qu’une concentration cérébrale de MeHg supérieure à 12 ppm engendre, tant chez les humains que les animaux, de sévères symptômes moteurs et sensoriels. Des symptômes cliniques plus modérés, à savoir des réflexes et un tonus musculaire anormaux, des altérations de la coordination motrice et un retard mental, ont été notés chez des humains à une concentration cérébrale de MeHg variant entre 6 et 12 ppm (Amin-Zaki et al., 1976).
À une concentration plus faible, des études sur les macaques (Burbacher et al., 1990) et les rongeurs (Chang, 1997 ; Spyker & Smithberg, 1975) ont observé des atteintes sensorielles et cognitives plus subtiles, à des concentrations cérébrales de MeHg variant de 4 à 9 ppm. Il est de plus en plus clair que des symptômes sous-cliniques sont présents à des concentrations cérébrales de MeHg inférieures à 4ppm comme le laisse entendre la présence de déficits cognitifs chez des souris dans des tâches d’évitement et de conditionnement opérant sans la présence de symptômes moteurs ou sensoriels (Annau & Cuomo, 1988 ; Hughes & Annau,
1976). À titre de comparaison, une dose unique de 8 mg/kg de MeHg administrée à des souris lors du 2e jour postnatal entraîne une concentration cérébrale de 2,7 ppm, alors qu’une dose de 4 mg/kg produit une concentration cérébrale de 1,8 ppm (Sager et al., 1984).
Symptômes associés à l’intoxication au MeHg
Les premières observations faites sur la population de Minamata exposée au MeHg ont permis d’identifier plusieurs symptômes potentiels d’ordre développemental, moteur,
sensoriel, comportemental et cognitif (Takeuchi et al., 1965). Tous les enfants intoxiqués in
utero étaient ataxiques : aucun bébé ne pouvait ramper, se tenir debout ou parler avant l’âge de
3 ans et plusieurs enfants ne pouvaient toujours pas marcher à l’âge de 7 ans (Harada, 1997). Ils étaient aussi sévèrement affectés intellectuellement et plusieurs souffraient de strabisme, d’hypertonie, de mouvements involontaires et d’incontinence (Harada, 1997). Les premières études ont donc permis d’identifier et de clarifier l’étendue symptomatique reliée à
l’intoxication au MeHg et d’établir un lien entre les effets neurobiologiques du MeHg et les symptômes associés.
L’étendue symptomatique associée à l’exposition au MeHg touche divers aspects fonctionnels du système nerveux. Les aspects les plus étudiés sont : les effets tératologiques,
les atteintes des fonctions motrices et de l’activité locomotrice, les atteintes sensorielles, les altérations comportementales et émotionnelles et les atteintes cognitives.
Effets tératologiques
Les effets tératologiques comprennent, entre autres, des altérations de la maturation, du taux de survie et de la croissance chez les rejetons. Des rats exposés au MeHg à 2,5
mg/kg/jour pendant les jours 6 à 15 de la gestation ont des retards développementaux
significatifs quant à la différenciation sexuelle. Par contre, l’éruption des incisives ainsi que l’ouverture des paupières sont accélérées significativement (Geyer, Butcher & Fit, 1985). Ces manifestations représenteraient des malformations subtiles au niveau de la tête combinées à un retard de la maturation sexuelle. Elsner, Suter, Ulbrich et Schreiner (1986) observent
également un retard de la maturation sexuelle telle que mesurée par l’ouverture vaginale, chez des rats exposés au MeHg (0.025 mg/kg/jour) pendant les jours 6 à 9 de la gestation. De même, une dose de 8 mg/kg/jour de MeHg administrée aux jours 9 à 13 de la gestation entraîne une malformation du palais chez 30,1 % des fœtus et des déformations faciales dans 10.8 % des cas (Spyker, 1975).
Le taux de survie des portées est affecté par une exposition prénatale au MeHg. Une exposition unique au MeHg affecte directement le pourcentage de survie. À la suite d’une telle exposition au jour 7, 9, 12 ou 13 de la gestation, la moyenne de survie des souris est de 42.9 % pour une dose de 8 mg/kg, de 64,7 % pour une dose 4 mg/kg et de 90,7 % pour les souris contrôles (Spyker, 1972). Les études subséquentes ont confirmé qu’une dose unique de MeHg (13.5, 12, 10, 8 et 5 mg/kg) administrée entre le 7e et le 13e jour de gestation provoque chez les souris un taux de mortalité néonatale de plus de 50 % (Hughes & Annau, 1976 ; Shimai, Satoh & Yasuda, 1984 ; Spyker, 1975 ; Su & Okita, 1976). Une étude plus récente
sur des rats montre qu’une exposition prénatale à 4 mg/kg/jour de MeHg durant les jours 6 à 15 de la gestation entraîne un taux de mortalité fœtale de 90% et une mortalité néonatale de 100% (Goldey, O’Callaghan, Stanton, Barone & Crofton, 1994).
Le MeHg a aussi un effet sur la croissance et le poids moyen des rejetons. Une dose unique de MeHg (13.5, 12, 10, 8 mg/kg, 30 u mol/kg) injectée entre le 7e et 14e jour de la gestation entraîne une diminution significative du poids moyen des souris exposées dès les premiers jours néonataux (Hughes & Annau, 1976 ; Satoh, Yasuda & Shimai, 1985 ; Shimai, Satoh & Yasuda, 1984 ; Spyker, 1975 ; Su & Okita, 1976). Chez des rats, !’administration continue d’une faible dose de MeHg (25 ppm dans l’eau) durant la période prénatale entraîne une réduction significative du poids des principaux organes, dont le foie et les poumons, ainsi qu’une diminution de la taille du fœtus, sans augmenter le nombre des malformations
organiques (Chen, Body & Mottet, 1979). Le poids peu élevé engendré par une exposition prénatale peut persister relativement longtemps en période postnatale. Chez la souris, une exposition prénatale de 3mg/kg/jour pendant les jours 12 à 14 de la gestation entraîne un poids moyen significativement inférieur durant les 12 premières semaines postnatales (Kim, Nakai, Kasanuma & Satoh, 2000). Chez les primates, une exposition prénatale de 50 pg/kg/jour de MeHg produit un retard de la croissance postnatale (Barbadier et al., 1990). Une exposition postnatale peut aussi altérer le poids, comme le montrent les travaux de Hughes et Annau (1976). Ceux-ci observent une diminution significative du poids moyen chez des souris exposées à faible dose (3 mg/kg) 14 jours après leur naissance. La diminution de poids chez les sujets exposés ne serait pas seulement due à un ralentissement de la croissance, mais aussi à une perte d’appétit causée par l’exposition (Berthoud et al., 1976 ; MacDonald & Harbinson, 1977 ;Spyker, 1975).
Atteintes des fonctions motrices et de l’activité locomotrice
Les symptômes moteurs sont nombreux et bien documentés. Les observations faites à la suite de la catastrophe de Minamata ont permis d’identifier chez l’humain trois symptômes moteurs particulièrement courants : l’ataxie musculaire, les tremblements et la dysarthrie (MacDonald & Harbinson, 1977 ; Takeuchi et al., 1965). Ces trois symptômes moteurs avaient une prévalence de 100 % chez les jeunes enfants intoxiqués au MeHg en période prénatale (Takeuchi et al., 1965). D’autres symptômes moteurs tels des réflexes plus lents (54%) et la présence de mouvements involontaires (73%) ont aussi été observés. Plusieurs chercheurs associent les symptômes moteurs causés par l’exposition au MeHg à une atteinte importante du cervelet et du système dopaminergique de Taxe nigro-striatal (Annau & Cuomo, 1988 ; Berthoud et al., 1976 ; MacDonald & Harbinson, 1977 ; Rossi, Ahlbom, Ogren, Nicotera & Ceccatelli, 1997 ; Spyker, 1975).
Des études faites sur les modèles animaux confirment la présence de symptômes moteurs associés au MeHg. Par exemple, l’ataxie musculaire observée chez les humains est également mise en évidence chez la souris (MacDonald & Harbinson, 1977 ; Spyker, 1975). Une exposition chronique à 50 μg de MeHg/ml d’eau affecte la coordination motrice et provoque l’apparition des symptômes ataxiques dès le 8e jour d’exposition, suivi par des tremblements et des problèmes de flexion des membres postérieurs allant jusqu’à la paralysie totale vers le 17e jour d’exposition (MacDonald & Harbinson, 1977). L’exposition au MeHg a aussi un effet latent sur les fonctions motrices. Une injection prénatale unique de 8 mg/kg de MeHg durant les jours 7 à 13 de la gestation entraîne chez la souris une apparition tardive des symptômes ataxiques à l’âge adulte (Spyker, 1975). Un traitement au MeHg pendant les jours 9 à 14 de la gestation provoque un ralentissement significatif des réflexes et des postures anormales chez la souris (Rossi et al., 1997 ; Satoh et al., 1985 ; Watanabe, Yin, Kasanuma &
Satoh, 1999), tandis qu’une très forte dose unique de 20 mg/kg administrée pendant l’un des jours 13 à 17 de la gestation produit des troubles de flexion et des réflexes anormaux des membres postérieurs (Inouye, Murao & Kajiwara, 1985). Une exposition quotidienne de MeHg chez la souris entraîne une diminution significative des habiletés motrices lors du test du rotarod dans lequel l’animal doit maintenir son équilibre sur un cylindre mobile (Berthoud étal., 1976).
La locomotion et le niveau d’activité sont également affectés par une exposition au MeHg. Des souris exposées au MeHg à une dose unique de 8 mg/kg durant les jours 7 ou 9 de la gestation présentent des changements d’activité locomotrice spontanée dans l’open field et dans la nage : la latence d’exploration est plus longue et les mouvements de nage sont mal coordonnés (Spyker, 1972). Ces altérations comportementales et motrices seraient des indicateurs très sensibles d’une intoxication au MeHg et apparaîtraient bien avant les
symptômes plus sévères (Spyker, 1972). Plusieurs études subséquentes sur des souris et des rats ont confirmé que dans l’open field, la qualité de la locomotion, le niveau d’activité motrice, le nombre de redressements et la rapidité d’exploration sont significativement diminués par une exposition prénatale au MeHg (Annau & Cuomo, 1988 ; Danielsson et al.,
1993 ; Frederiksson, Dencker, Archer & Danielsson, 1996 ; Kim et al., 2000 ; Morganti. Lown, Salvaterra & Massaro, 1976 ; Rossi et al., 1997 ; Spyker, 1975 ; Sue & Okita, 1976 ; Watanabe et al., 1998 ; Wootten et al., 1985 ; Yin, Watanabe, Inaba & Satoh, 1997).
Atteintes sensorielles
Le MeHg affecte les fonctions sensorielles. Des enfants exposés au MeHg via leur alimentation montrent des latences plus lentes des potentiels évoqués auditifs du tronc
souvent interprétées comme un ralentissement de la conduction nerveuse et de l’activité corticale.
Les recherches animales confirment la présence d’un déficit des fonctions auditives à la suite d’une exposition à long terme au MeHg chez la souris (Wassick & Yonovitz, 1985) et le singe (Rice, 1996). Il semble que l’apparition de tels déficits auditifs doit être précédée d’une exposition chronique à long terme car une exposition prénatale unique au MeHg ne suffit pas à affecter les fonctions auditives chez les rats (Goldey et al., 1994). Le système visuel est également vulnérable à l’exposition au MeHg. Chez le rat, les potentiels évoqués visuels indiquent des latences anormales entre les pics NI et N3 pour les groupes exposés au MeHg, ce qui laisse supposer un ralentissement dans le traitement de l’information visuelle (Dellinger, Malek & Beattie, 1995). Ces résultats sont appuyés par des travaux sur les primates. Parmi les symptômes observés chez les singes exposés au MeHg, on note une constriction du champ visuel (Merigan, 1980), des déficits dans la vision à faible intensité lumineuse et une difficulté à reconnaître une cible mobile (Rice & Hayward, 1999).
Cependant, l’atteinte du système visuel n’apparaît qu’après une exposition en bas âge. Des macaques de 3 ans exposés au MeHg présentent des capacités visuo-spatiales déficitaires reliées à un dommage à la partie parvocellulaire du système visuel. Au contraire, des macaques âgés de 5 ans ne montrent plus ces déficits, ce qui laisse supposer une plasticité tardive du système visuel qui compense la perte parvocellulaire par une expansion du système magnocellulaire (Rice, 1996). Une telle exposition au MeHg engendre également des déficits visuels dans l’orientation spatiale (Rice & Hayward, 1999). Parmi les autres atteintes
sensorielles, notons des déficits de discrimination visuelle et olfactive chez des rats exposés au MeHg (0.025, 0.05, 0.5 et 5 mg/kg) pendant les jours 6 à 9 de la gestation (Elsner et al., 1986). Finalement, l’exposition au MeHg affecte également les fonctions somatosensorielles. Dés$^—^
singes exposés au MeHg de façon chronique pendant les sept premières années postnatales ou de façon chronique in utero jusqu’à l’âge de 4 ans montrent des seuils de sensibilité tactile plus élevés que les singes contrôles (Rice & Gilbert, 1995).
Altérations comportementales et émotionnelles
Certains chercheurs avancent l’idée que Fhypoactivité causée par le MeHg pourrait affecter la qualité des comportements sociaux. En effet, chez le macaque juvénile, une exposition prénatale au MeHg (50 pg/kg/jour) entraîne une diminution significative des comportements sociaux ludiques et une augmentation de l’apathie (Barbadier, Sacked & Mottet, 1990). Chez des rats exposés à 6 mg/kg de MeHg pendant les jours 6 à 9 de la gestation, !’acquisition des comportements sociaux est ralentie (Wootten et al., 1985). Des rats exposés au MeHg à une dose de 6 mg/kg aux jours 6 à 9 de la gestation présentent aussi une réactivité émotionnelle supérieure face aux stimuli stressants (Royalty, Taylor & Korol, 1987). Cette même étude montre également qu’une exposition prénatale au MeHg entraîne une augmentation significative du nombre de comportements d’agression (Royalty et al., 1987).
Atteintes cognitives
La neurotoxicité du MeHg s’étend aussi aux fonctions cognitives, telles que
!’apprentissage, !’attention et la mémoire. De telles altérations cognitives, ajoutées à de légers changements moteurs, seraient les premiers signes d’une intoxication au MeHg, d’où
l’importance d’une meilleure compréhension des symptômes cognitifs (Spyker, 1972). Chez l’humain, une étude menée chez des enfants de 7 ans a vérifié l’effet d’une exposition
Plusieurs tests neuropsychologiques ont permis d’identifier chez ces enfants des déficits cognitifs au niveau du langage, de !’attention et de la mémoire. Toutefois, une autre étude épidémiologique récente effectuée chez des enfants a obtenu des résultats plus mitigés quant aux symptômes cognitifs sous-cliniques engendrés par le MeHg (Crump et al., 1998).
Les modèles animaux exposés au MeHg ont aussi subi des atteintes cognitives. Dans une tâche de permanence de l’objet, des bébés singes exposés à 50 pg/kg/jour de MeHg prennent plus d’essais avant d’apprendre la tâche, ce qui suggère la présence de troubles représentationnels dans la modalité visuelle (Burbacher et al., 1990 ; Rice, 1996). Les bébés singes exposés au MeHg reconnaissent moins facilement un stimulus nouveau parmi un ensemble de stimuli déjà présentés (Rice, 1996). Dans plusieurs tâches de conditionnement, des rats exposés au MeHg (0.3 et 0.9 mg/kg) durant les jours 1 à 14 de la gestation ont besoin d’un plus grand nombre d’essais pour atteindre les critères de performance ce qui
s’expliquerait, selon Elsner et al. (1986), par une diminution de !’attention et une
augmentation de l’instabilité comportementale. Des rats exposés à une dose prénatale unique de 15 mg/kg au 8e jour de la gestation démontrent des déficits dans diverses tâches mnésiques (Cagiano et al., 1990). Les atteintes cognitives causées par le MeHg seraient stables dans le temps, comme le montre une étude sur la performance de rats exposés de façon prénatale dans la tâche d’apprentissage de labyrinthe aquatique en T. En effet, les déficits présentés par ces rats montrent que !’acquisition de !’apprentissage est plus lente, moins performante et que les déficits demeurent lors des phases de re-test, ce qui suppose non seulement un déficit
d’apprentissage, mais aussi un déficit mnésique permanent (Zenick, 1974).
L’acquisition et l’extinction d’un apprentissage semblent avoir une sensibilité différente à l’intoxication au MeHg. Dans une tâche de punition positive administrée à des souris exposées (3 et 5 mg/kg) pendant le 8e jour de la gestation, !’acquisition de
!’apprentissage est intacte mais l’extinction est accélérée (Hughes & Annau, 1976). Ces résultats sont corroborés par d’autres expériences montrant chez des rongeurs qu’une
exposition unique au MeHg pendant le 8e ou le 10e jour de la gestation entraîne seulement des déficits au niveau de la rapidité d’extinction (Annau & Cuomo, 1988 ; Shimai et al., 1984). Toutefois, Annau & Cuomo (1988) ont démontré qu’une exposition semblable effectuée pendant le 15e jour de la gestation entraîne des déficits combinés d’extinction et
d’apprentissage. La période prénatale d’exposition apparaît donc cruciale pour déterminer la nature et l’ampleur des déficits cognitifs.
Plusieurs études se sont intéressées à l’effet d’une exposition prénatale au MeHg sur !’apprentissage spatial. Ainsi, des rats et des souris exposés au MeHg de façon prénatale sont moins performants dans le test d’apprentissage spatial du labyrinthe aquatique de Morris (Kim et al., 2000 ; Vorhees, 1985). De même, une forte exposition prénatale au MeHg provoque chez des rats un ralentissement de !’habituation à un nouvel environnement spatial et une performance déficitaire dans la tâche du labyrinthe radial (Danielsson et al., 1993 ;
Fredriksson et al., 1996).
Objectif et hypothèses
L’objectif de !’expérimentation est d’identifier chez la souris des déficits
comportementaux et cognitifs causés par un traitement prénatal au MeHg administré aux jours 6 à 9 de la gestation, en tenant compte des effets moteurs et sensoriels. La première hypothèse de recherche est que les sujets exposés au MeHg seront significativement moins performants que les sujets contrôles aux diverses tâches cognitives administrées en laboratoire. La
deuxième hypothèse est que les déficits de performance seront plus importants chez le groupe à forte dose de MeHg (6 mg/kg) que chez le groupe à moyenne dose (4 mg/kg).
MÉTHODE Sujets
Les sujets utilisés sont 30 souris femelles de souche C57BL/6 provenant de portées différentes. Durant les jours 7, 8 et 9 de la gestation, les mères de ces souris ont reçu une dose de MeHg par injection dans l’estomac avec une solution tampon (PB S) une fois par jour. Les souris sont réparties également en trois groupes (n=10) selon la dose de MeHg à laquelle elles ont été exposées prénatalement, soit 0, 4 ou 6 mg/kg. Elles sont logées dans des cages
individuelles et soumises à une photopériode 12h-12h, !’administration des tests ayant lieu dans la phase diurne. Les souris ont libre accès à de l’eau durant toute l’expérience, mais leur ration quotidienne de nourriture est contrôlée de façon à abaisser leur poids à 85% du niveau normal. L’administration des tests comportementaux et cognitifs commence à l’âge de 6 semaines.
Matériel
Les tests administrés utilisent cinq appareils: un rotarod , un labyrinthe en T, un labyrinthe en Y, un open field et un labyrinthe radial.
Rotarod. L’appareil représenté à la Figure 1 est une boîte vide (35 x 45 x 110 cm) sans
couvercle. Au-dessus et au centre de cette boîte se trouve un cylindre rotatif (diamètre: 3 cm), relié à un moteur électrique à vitesse variable, sur lequel les souris doivent se tenir en
équilibre. Le plancher de l’appareil situé 65 cm sous le cylindre rotatif est recouvert d’une épaisse couche de ouate pour amortir la chute éventuelle des souris.
Figure 1 - Rotarod
Labyrinthe en T. Cet appareil (voir Figure 2), dont les murs et le plancher sont faits d’acrylique opaque, est divisé en trois sections: un compartiment de départ (30x10 cm), un couloir central (50x10 cm) et deux compartiments d'arrivée (30x10 cm) perpendiculaires au couloir central et situés de part et d’autre de ce dernier. Le compartiment de départ et l’entrée de chacun des compartiments d’arrivée sont fermés par une porte à guillotine. Au bout de chaque compartiment d’arrivée, une mangeoire opaque permet d’y déposer un renforçateur alimentaire.
Figure 2 - Labyrinthe en T
Labyrinthe en Y. Cet appareil (voir Figure 3), dont les murs et le plancher sont faits
d’acrylique opaque, est divisé en un compartiment de départ (30x10 cm) et une antichambre donnant sur deux couloirs parallèles (30x10 cm) séparés par un mur opaque. Le compartiment de départ et l’entrée de chaque couloir sont fermés par une porte à guillotine. Deux planchers amovibles, l’un blanc et l’autre noir, peuvent être insérés dans l’un ou l’autre des couloirs et couvrent également la moitié de l’antichambre. Au bout de chaque couloir, une mangeoire opaque peut contenir un renforçateur alimentaire.
Figure 3 - Labyrinthe en Y
Open field. L'appareil représenté à la Figure 4 est un champ ouvert carré de 1 x 1 m entouré de murs en acrylique opaque de 30 cm de hauteur. Le plancher est divisé en 25 carrés égaux.
Labyrinthe Radial. Ce labyrinthe est illustré à la Figure 5. Une plate-forme centrale
octogonale (diamètre: 30 cm) est entourée de murs de 40 cm de hauteur et, sur chaque face de cet octogone, une ouverture fermée par une porte à guillotine donne accès à un couloir sans mur (longueur: 60 cm; largeur: 6 cm) au bout duquel se trouve une mangeoire. Le labyrinthe est isolé par un paravent et des repères visuels sont placés sur les murs entourant le labyrinthe, de sorte qu'aucun d'eux ne soit associé exclusivement à un seul des huit corridors. Une caméra placée au-dessus du labyrinthe permet à l'expérimentateur d'observer à distance le
comportement des souris et d’actionner, grâce à des fils, les portes à guillotine de la plate- forme centrale.
Procédure
Tous les tests sont administrés en aveugle, chaque souris portant à l’oreille une étiquette codée permettant de différencier les groupes expérimentaux sans que
1 ’expérimentateur ne sache à quel groupe appartient chaque souris. Les tests dans le rotarod et dans le labyrinthe en T sont administrés durant les six premiers jours d'expérimentation. Une fois la tâche du rotarod terminée, seule l'administration de la tâche dans le labyrinthe en T se poursuit jusqu’à la fin de la phase avec délais. Suivent ensuite dans l’ordre le test de
discrimination visuelle dans le labyrinthe en Y, la mesure de l’activité spontanée dans l'open field qui dure 5 jours et la tâche dans le labyrinthe radial qui dure 25 jours.
Rotarod. La tâche dans le rotarod s'échelonne sur six jours. Les deux premiers jours servent à évaluer les habiletés motrices de base. Dans les quatre jours suivants, les souris sont soumises à une phase de test qui consiste dans !’apprentissage d’une coordination motrice. Chaque session quotidienne comprend cinq essais au cours desquels la souris doit se maintenir en équilibre sur le cylindre rotatif pendant 120 secondes. Une chute qui survient dans les 10 premières secondes d’un essai est considérée comme un faux départ et l’essai est repris après une pause de 30 secondes. Les souris sont testées par cohortes de six (deux à la fois), ce qui laisse un intervalle inter-essais de 4 à 5 minutes. Au Jour 1, le cylindre est immobile tandis qu’au Jour 2, il tourne à une vitesse de 3 rpm. Durant ces deux premiers jours, les souris doivent réussir quatre essais sur cinq pour passer à la phase de test. Durant les quatre jours suivants, le cylindre rotatif tourne à une vitesse de 20 rpm. La latence de chute est enregistrée pour chacun des cinq essais quotidiens et pour chaque essai réussi, la latence maximale de 120 secondes est enregistrée.
Labyrinthe en T. Le labyrinthe en T permet de mesurer un apprentissage spatial et la mémoire de travail spatiale. Cette tâche se déroule en trois phases successives : la familiarisation, l'entraînement sans délai et le test avec délais. La phase de familiarisation dure une journée et
permet à la souris de s'habituer au labyrinthe, au mouvement et au bruit des portes à guillotine et à la présence de renforçateurs. Chaque souris est placée pendant 10 minutes dans l’appareil, ce qui lui permet d'explorer tous les compartiments en consommant les renforçateurs dispersés dans le labyrinthe. La phase d'entraînement sans délai commence le lendemain de la
familiarisation et consiste en !’apprentissage de la tâche spatiale. Chaque session quotidienne comprend 11 essais consécutifs (un essai 0 suivi de 10 essais). A l'essai 0, un renforçateur est déposé dans chacune des mangeoires situées au bout des compartiments d’arrivée et la souris est libre de choisir l'un ou l'autre de ces compartiments. Au cours des 10 essais suivants, la souris doit choisir le compartiment d’arrivée opposé à celui qu’elle a choisi à l’essai
précédent. Il s’agit donc d’une tâche d’alternance spontanée. Un échec est noté pour chaque essai où la souris retourne dans le même compartiment qu’à l’essai précédent. L'entraînement sans délai se poursuit jusqu'à ce que l’animal ait maintenu une moyenne d'au moins huit réussites sur 10 essais pendant 2 jours consécutifs. Une fois ce critère atteint, la souris passe à la phase de test avec délais qui dure six jours et qui sert à mesurer la mémoire de travail spatiale. La procédure est la même que durant l'entraînement sans délai, à l'exception que chaque essai est séparé du précédent par un délai de 30, 60 ou 120 secondes. Chaque délai est testé pendant deux jours consécutifs puis augmenté.
Discrimination visuelle dans le labyrinthe en Y. Ce test permet de déceler la présence de déficits visuels pour des stimuli saillants. Dans cette tâche, la moitié des souris est renforcée quand elle choisit le corridor recouvert du plancher noir, tandis que l’autre moitié des souris est renforcée quand elle choisit le couloir recouvert du plancher blanc. La position (gauche- droite) du plancher noir et du plancher blanc varie d'un essai à l'autre selon une séquence semi- aléatoire prédéterminée. Chaque session quotidienne comprend 20 essais. Le test de
discrimination visuelle se divise en deux phases, soit une phase d'entraînement avec procédure de correction et une phase d'apprentissage sans procédure de correction. Durant la phase d'entraînement qui dure deux jours, la souris est placée dans le compartiment de départ et à l'ouverture de la porte à guillotine, elle doit choisir le compartiment dont le plancher est toujours renforcé. Si elle choisit l’autre couloir, un échec est enregistré et l’essai est immédiatement repris mais cette fois, seule la porte du couloir menant à la récompense est ouverte, ce qui constitue une réussite forcée. Dans les jours qui suivent, la procédure est similaire à celle de la phase d'entraînement, sauf qu'il n'y a pas de correction en cas d'échec. L'apprentissage se poursuit jusqu'à ce que la souris ait maintenu une moyenne d'au moins 17 réussites sur 20 essais pendant deux jours consécutifs.
Open Field. Le test de !'open field vérifie le niveau d'activité motrice spontanée, l'anxiété et l'exploration d'un nouvel environnement. La tâche de la souris consiste à explorer un champ ouvert pendant 15 minutes. Le test de !'open field dure cinq sessions à raison d'une session par jour. Au début de chaque session, la souris est toujours placée face tournée vers le même coin
de !’open field. Pendant les 5 premières minutes, !'expérimentateur note chaque carré périphérique ou central traversé par la souris et le nombre de redressements verticaux
effectués. Une fois les 5 premières minutes écoulées, la souris continue à explorer librement le champ ouvert pendant 5 minutes mais ses comportements ne sont pas enregistrés.
Finalement, la notation est reprise pour les 5 dernières minutes.
Labyrinthe radial. Cette version de la tâche permet de mesurer simultanément la mémoire de référence et la mémoire de travail spatiales. La tâche débute par une phase de familiarisation qui dure cinq jours. Durant cette familiarisation, des boulettes de nourriture sont dispersées
sur la plate-forme centrale et dans quatre couloirs choisis au hasard . Les portes à guillotine des huit couloirs sont alors ouvertes. La session prend fin lorsque tous les renforçateurs ont été consommés ou lorsque 10 minutes se sont écoulées. Une fois la familiarisation terminée, commence !’apprentissage de la tâche spatiale qui s’étend sur 15 jours, à raison d’une session par jour. À chaque session quotidienne, une boulette de nourriture est déposée dans la
mangeoire des quatre couloirs préalablement choisis au hasard, toujours les mêmes d’une session à l’autre. Au début d’une session, la souris est mise sur la plate-forme centrale et les huit portes à guillotine sont ouvertes simultanément pour lui permettre de choisir un couloir. Une fois qu’elle s’est rendue au bout du couloir et qu’elle est revenue à la plate-forme centrale, les huit portes sont fermées pendant 10 secondes, puis ouvertes à nouveau pour permettre un autre choix. La souris doit apprendre à visiter les couloirs appâtés et à éviter ceux qui ne le sont pas. Une erreur de mémoire de référence est enregistrée à chaque fois que la souris visite un couloir qui n’est jamais appâté et une erreur de mémoire de travail est enregistrée à chaque fois qu’elle retourne dans un couloir qu’elle a déjà visité durant l’essai en cours. Une session se termine quand l’un ou l’autre des critères suivants est atteint: la souris a visité les quatre couloirs appâtés, elle a fait 16 choix de couloirs ou 10 minutes se sont
écoulées.
RÉSULTATS
Rotarod
Toutes les souris ont atteint le critère de quatre essais réussis sur cinq aux deux sessions préliminaires à 0 rpm et 3 rpm. Leurs capacités motrices de base étaient donc
adéquates. Les résultats obtenus lors des quatre sessions de test montrent que les trois groupes de souris apprennent la coordination motrice requise lorsque que le cylindre tourne à une
vitesse de 20 rpm (Figure 6). Une ANOVA Groupe x Session avec mesures répétées sur le second facteur indique que le facteur Session, F (3,81)=15,62 p<0,0001, est significatif, ce qui confirme !’apprentissage. Toutefois, il n’y a aucune différence significative entre les groupes 0, 4 et 6 mg/kg puisque le facteur Groupe, F (2,27)=1,48, et !’interaction Groupe x Session, F (6,72)=0,63, ne sont pas significatifs. L’exposition prénatale au MeHg n’a donc pas d’effet sur !’apprentissage d’une coordination motrice.
Figure 6. Latences moyennes de chute (secondes) dans le rotarod à 20 rpm
Labyrinthe en T
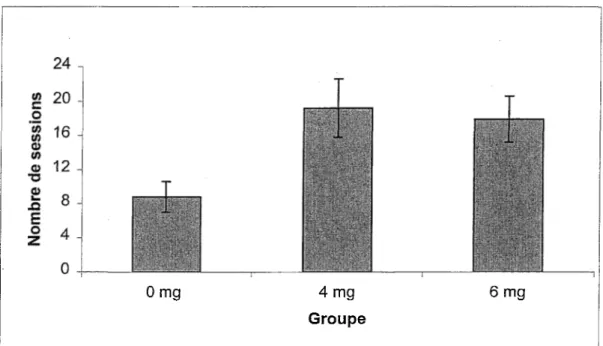
L’entraînement sans délai dans le labyrinthe en T consiste dans !’apprentissage de l’alternance spatiale spontanée. Les souris doivent réussir huit essais sur 10 en moyenne pendant deux sessions quotidiennes consécutives pour atteindre le critère de performance. Les résultats représentés à la Figure 7 suggèrent que l’exposition prénatale au MeHg a affecté !’apprentissage de cette tâche. Les groupes 4 et 6 mg/kg ont effectivement mis un plus grand
nombre de sessions pour atteindre le critère que les souris du groupe contrôle. Une ANOVA confirme qu’il y a une différence entre les trois groupes, F (2,29)=4,32 p<0,05 et un test de Newman-Keul (p<.05) montre que les groupes 4 et 6 mg/kg ont besoin d’un nombre significativement plus élevé de sessions pour atteindre le critère que le groupe contrôle.
0 mg 4 mg 6 mg
Groupe
Figure 7. Nombres de sessions requises pour atteindre le critère lors de !’apprentissage à 0 seconde dans le labyrinthe en T (excluant les deux sessions ayant permis l’atteinte du critère)
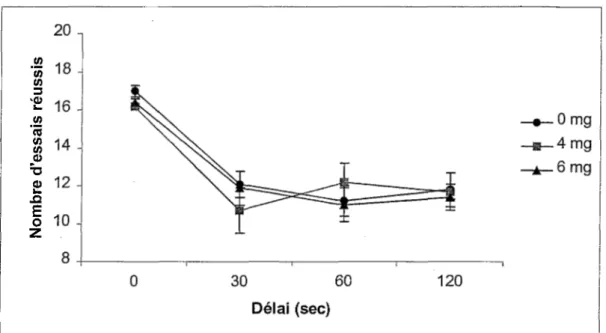
La comparaison des résultats obtenus lors de !’apprentissage sans délai avec ceux du test avec délais de 30, 60 et 120 secondes montre que chez les trois groupes de souris, le nombre d’essais réussis est plus élevé lors de !’apprentissage à 0 seconde que lors du test avec délais (Figure 8), ce qui est normal dans la mesure où les souris ont dû atteindre un critère de performance à 0 seconde. De plus, la performance des souris diminue à un niveau près du hasard avec l’apparition des délais. Une ANOVA Groupe x Délai avec mesures répétées sur le dernier facteur confirme que le facteur Délai, F (3, 81)= 35.48 p<0,0001, est significatif,
mais le facteur Groupe, F (2,27)=0,34, et !’interaction Groupe x Délai, F (6, 81)=0,59, ne sont pas significatifs. L’exposition prénatale au MeHg n’a donc pas affecté la performance dans le test avec délais.
.2
I
'Φ .2 π!
73 2 ¿2 E o ZFigure 8. Nombres d’essais réussis lors de !’apprentissage à 0 seconde et du test avec délais de 30, 60 et 120 secondes dans la tâche du labyrinthe en T
Open field
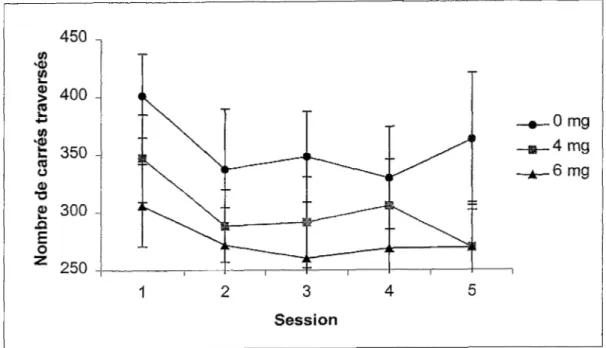
La Figure 9 illustre le nombre total de carrés traversés lors des cinq sessions dans !’open field chez les trois groupes. Les résultats obtenus indiquent qu’il n’y a aucune différence notable entre les trois groupes de souris. Une ANOVA Groupe x Session avec mesures répétées sur le dernier facteur confirme l’absence de différence significative entre les groupes, puisque que le facteur Groupe, F (2,27)=1,48, et !’interaction, F (8,108)=0,37, ne sont pas significatifs. L’exposition prénatale au MeHg n’a donc pas d’effet sur l’exploration
horizontale. L’ANOVA démontre, par contre, que l’exploration horizontale diminue au fil des sessions puisque le facteur Session, F (4,108)=3,03 p< 0,05, est significatif.
Figure 9. Nombres totaux de carrés traversés pendant les cinq sessions dans !’open field
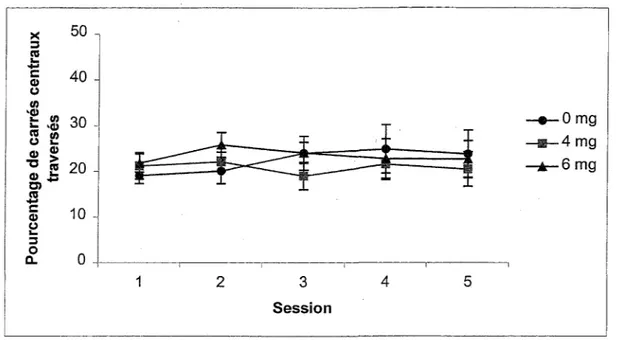
Une ANOVA sur le pourcentage de carrés centraux a été faite afin de comparer les niveaux d’anxiété chez les groupes, les souris anxieuses ayant une tendance exagérée à se tenir en périphérie d’un nouvel environnement. La Figure 10 montre que le pourcentage de carrés centraux traversés dans une session ne diffère pas d’un groupe de souris à l’autre, ni d’une session à l’autre. Une ANOVA Groupe x Session avec mesures répétées sur le dernier facteur confirme que les facteurs Groupe, F(2,27)=0,20, et Session, F(4,108)=0,61, de même que !’interaction, F(8,108)=0,97, sont non significatifs. L’exposition prénatale au MeHg n’a pas influencé l’état de peur chez les souris exposées.
½-6 mg
Session
Figure 10. Pourcentages de carrés centraux traversés lors des cinq sessions dans l’open field
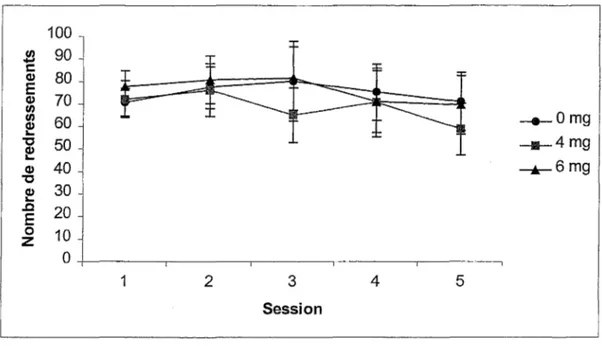
Quant au nombre de redressements sur les pattes postérieures lors des cinq sessions, la Figure 11 suggère que les trois groupes de souris ont en moyenne une fréquence de
redressements équivalente. Une ANOVA Groupe x Session avec mesures répétées sur le dernier facteur confirme que le facteur Groupe, F (2,27)=0,15, n’est pas significatif.
Aucune différence n’est notée quant au nombre de redressements au fil des sessions, le facteur Session, F (4,108)=1,26, n’étant pas significatif. L’interaction Groupe x Session,
F(8,108)=0,40, n’est pas significative. Tout comme l’exploration horizontale, l’exploration verticale n’est pas affectée par l’exposition prénatale au MeHg.
Session
Figure 11. Nombres de redressements lors des cinq sessions dans !'open field
La Figure 12 illustre le nombre total de carrés traversés en moyenne lors des premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement pour les cinq sessions dans !’open field. Cette figure démontre, d’une part, qu’il n’y a pas de différence entre les groupes et, d’autre part, que les souris des trois groupes ne traversent pas davantage de carrés dans l’une ou l’autre des deux périodes de 5 minutes. Une ANOVA Groupe x Période avec
mesures répétées sur le dernier facteur montre que le facteur Groupe, F(2,27)=1,48, le facteur Période, F(l,27)=1,58, et !’interaction, F(2,27)=0,11, ne sont pas significatifs.
Figure 12, Nombres totaux de carrés traversés lors des premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement pour les cinq sessions dans !’open field
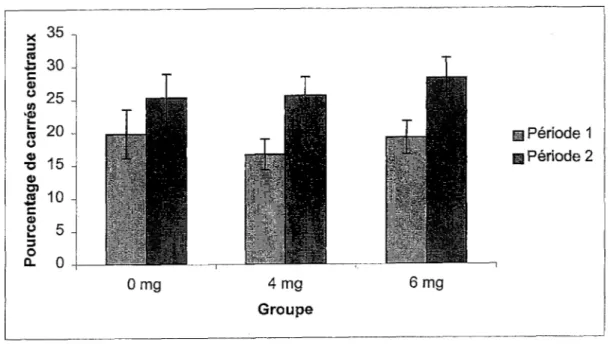
Les pourcentages de carrés centraux traversés lors des premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement ont été comparés afin d’évaluer !’habituation intra-session. La Figure 13 suggère que les souris traversent davantage de carrés centraux dans !’open field lors des 5 dernières minutes que lors des 5 premières. Cette hausse du pourcentage de carrés centraux lors des 5 dernières minutes se retrouve toutefois chez les trois groupes et aucune différence inter-groupes n’est donc observable sur la figure. Une ANOVA Groupe x Période avec mesures répétées sur le dernier facteur confirme !’augmentation du pourcentage de carrés centraux lors de la période 2, puisque le facteur Période,
F(l,27)=105,94 p< 0,0001, est significatif. Elle indique aussi que le facteur Groupe, F(2,27)=0,18, et !’interaction, F(2,27)=2,15, ne sont pas significatifs.
Figure 13. Pourcentages moyens de carrés centraux traversés lors des premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement pour les cinq sessions dans !’open field
Il ne semble également pas y avoir de différence entre les groupes quant au nombre de redressements lors des premières (période 1) et des dernières (période 2) 5 minutes
d’enregistrement dans !’open field (Figure 14). Le nombre de redressements ne semble pas non plus augmenter dans l’une ou l’autre des sessions. L’ANOVA Groupe x Période montre en effet que les facteurs Groupe, F(2,27)=0,ll, Période, F(l,27)=3,86, ainsi que !’interaction, F(2,27)=2,13, ne sont pas significatifs.
Figure 14. Nombres moyens de redressements lors des premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement pour les cinq sessions dans !’open field
Discrimination visuelle
La Figure 15 montre les nombres de sessions nécessaires à l’atteinte du critère
d’apprentissage dans la discrimination visuelle. Le résultat de l’ANOVA indique que les trois groupes de souris ne diffèrent pas significativement pour apprendre à discriminer un couloir à plancher noir d’un couloir à plancher blanc dans le labyrinthe en Y (Figure 15), F(2,27)=2,17.
Figure 15. Nombres de sessions nécessaires à l’atteinte du critère d’apprentissage dans la discrimination visuelle
Labyrinthe radial
Dans la tâche du labyrinthe radial, le nombre de choix de couloirs faits par essai diminue au fil des cinq blocs, mais les trois groupes ne diffèrent pas de façon évidente sur cette mesure (Figure 16). Une ANOVA Groupe x Bloc avec mesures répétées sur le dernier facteur démontre que le facteur Groupe, F(2,27)=0,53, et !’interaction, F(8,108)=1,34, ne sont pas significatifs. La diminution significative du nombre de choix au fil des blocs est
confirmée par le facteur Bloc, F(4,108)=14,79p<,0001, significatif. L’exposition prénatale n’a donc pas eu d’effet sur le nombre de couloirs visités par les animaux en cours d’essai.
0 mg *-4mg -à— 6 mg
Bloc
Figure 16. Nombres de choix de couloirs par bloc de trois sessions dans la phase d’apprentissage du labyrinthe radial
La Figure 17 illustre le nombre de réussites par bloc de 3 sessions. La similarité entre les groupes et les blocs de sessions est évidente. L’ANOVA Groupe x Bloc avec mesures répétées sur le dernier facteur confirme que les facteurs Groupe, F(2,27)=0,52, et Bloc, F(4,108)=1,03, ainsi que !’interaction, F(8,108)=0,49, ne sont pas significatifs. L’exposition prénatale n’affecte pas non plus le nombre de réussites dans cette épreuve d’apprentissage spatial et de mémoire spatiale.
Figure 17. Nombres de réussites par bloc de trois sessions dans le labyrinthe radial
La diminution du nombre de choix au fil des blocs de sessions (Figure 16) ajoutée à l’absence de changement quant au nombre de réussites d’un bloc de sessions à l’autre (Figure 17) mène logiquement à une augmentation du pourcentage de réussites au fil des sessions. C’est ce qui est représenté à la Figure 18 pour les trois groupes de souris. L’ANOVA Groupe
X Bloc avec mesures répétées sur le dernier facteur indique une augmentation du pourcentage
de réussites puisque le facteur Bloc, F(4,108)=353,67p<0,0001, est significatif. Par contre, le facteur Groupe, F(2,27)=0,47, et !’interaction Groupe x Bloc, F(8,108)=0,25, sont non
significatifs. L’exposition prénatale au MeHg n’affecte donc ni le pourcentage de réussites ni le nombre de réussites par bloc de sessions.