Synthèse de verres et vitrocéramiques à base de
fluoro-phosphates dopés par des ions Yb
3+, Er
3+et Tm
3+pour la luminescence dans le visible
Mémoire
Andrée-Anne Trudel
Maîtrise en chimie
Maître ès sciences (M.Sc.)
Québec, Canada
© Andrée-Anne Trudel, 2015
iii
Résumé
Depuis leur découverte à la fin des années 1950, les vitrocéramiques n’ont cessé de conquérir différents domaines d’intérêt. Plus récemment, ces matériaux ont fait leur arrivée dans le domaine de l’optique et de la photonique notamment pour leur habileté à augmenter l’intensité des émissions de type up-conversion. En ce sens, ce projet porte sur la génération de lumière blanche par addition des bandes d’émission, dans le bleu, le vert et le rouge, obtenues par up-conversion dans des verres et des vitrocéramiques dopés aux ions de terre rares Yb3+, Er3+ et Tm3+. Durant cette étude, une série de verres et de
vitrocéramiques transparentes fut fabriquée. Des analyses par spectrofluorimétrie démontrèrent une augmentation du phénomène d’up-conversion, de 10 à 160 fois plus importante selon les émissions, pour les vitrocéramiques que le verre. De plus, une large gamme de couleurs émises fut générée en modulant la puissance du laser et le temps de céramisation.
v
Table des matières
Résumé ... iii
Liste des tableaux ... vii
Liste des images ... ix
Liste des abréviations ... xi
Remerciements ... xiii
1. Introduction ... 1
1.1 Applications des vitrocéramiques en optique ... 4
1.2 Objectifs ... 5
2. Verres et vitrocéramiques ... 9
2.1 Définition du verre et de la transition vitreuse ... 9
2.2 Critères de formation vitreuse ... 10
2.3 Définition d’une vitrocéramique ... 13
2.4 Théorie de nucléation et de croissance ... 14
3. Les ions de terre rares et le phénomène d’up-conversion ... 21
3.1 Les ions de terre rares ... 21
3.2 Up-conversion ... 23
4. Méthodes expérimentales ... 29
4.1 Méthode de synthèse des verres ... 29
4.2 Méthode de fabrication des vitrocéramiques ... 31
5. Caractérisation des verres et vitrocéramiques ... 33
5.1 Calorimétrie différentielle à balayage ... 33
5.2 Spectroscopie UV-visible ... 35
5.3 Spectrofluorimétrie ... 37
5.4 Diffraction de rayons X ... 38
5.5 Microscopie électronique à balayage et à transmission ... 40
vi
6.1 Résultats et analyse thermique et optique des verres ... 43
7. Conclusion et perspectives ... 63
7.1 Conclusion ... 63
7.2 Perspectives ... 65
vii
Liste des tableaux
Tableau 1: Températures de transition viteuse (Tg), de cristallisation (Tx) et du pic de
cristallisation (Tp) ainsi que le ΔT pour chacun des verres de la série NYBCEr2Yb4Tmx ... 43
ix
Liste des images
Figure 1: Schéma d'un photodétecteur comprenant des nanocristaux de NaYF4 dopés aux
ions de terres-rares ... 5
Figure 2: Variation de l'enthalpie en fonction de la température ... 10
Figure 3: Représentation d'un réseau vitreux... 13
Figure 4: Taux de nucléation et de croissance des cristaux en fonction de la température .. ... 15
Figure 5: Énergie libre du liquide surfondu et du cristal en fonction de la température ... 15
Figure 6: Schéma de l'évolution de l'énergie libre du liquide surfondu à la formation d'un germe stable ... 16
Figure 7: Schéma du rayon critique de formation d'un germe... 17
Figure 8: Schéma de la diffusion des atomes dans le germe ... 17
Figure 9: Représentation de la croissance d'un germe de cristal ... 18
Figure 10: Schéma de l'énergie libre en fonction de l'état du système pour la croissance des cristaux ... 19
Figure 11: Diagramme d'énergie simplifié de l'ion erbium (Er3+) ... 22
Figure 12: Diagramme d’énergie simplifié de l’ion thulium (Tm3+) ... 22
Figure 13: Schéma représentant le processus d’absorption de photons à partir de niveaux énergétiques excités. Les flèches rouges représentent les absorptions de photons et la flèche bleue représente l’émission de type up-conversion. ... 24
Figure 14: Schéma représentant le processus de transfert énergétique entre deux ions. Les flèches rouges point-pointillées représentent l’absorption de photons. Les flèches rouges pointillées représentent le transfert énergétique et la flèche bleue représente l’émission de type up-conversion. ... 26
Figure 15: Schéma représentant le processus de l’avalanche de photons. Les flèches rouges point-pointillées représentent d’absorption de photons. Les flèches rouge pointillées représentent le transfert d’énergie entre les ions et la flèche bleue représente l’émission résultante. ... 27
Figure 16: Schéma de la progression thermique du verre durant sa synthèse ... 30
Figure 17: Photos de A) du creuset platine/or utilisé dans ce projet, B) du moule en acier inoxydable, C) du système de polissage utilisé, D) de la scie pour le taillage des échantillons, E) du verre avant le polissage et F) du verre après le polissage. .... 31
Figure 18: Schéma du thermocouple et des creusets à l'intérieur du four d'un calorimètre différentiel à balayage ... 34
Figure 19: Graphiques de la 1) température en fonction du temps des deux creusets dans le four du calorimètre et 2) de la différence de température entre ces deux creusets lors d'une transition ... 34
Figure 20: Thermogramme d'un verre représentant la température de transition vitreuse (Tg) et la température de cristallisation (Tx). ... 35
Figure 21: Spectres d’émissions de type up-conversion de la série de verre NYBC dopé avec 1 à 4% de TmF3 sous une excitation laser à 975 nm normalisé à 549 nm. Encadré : Diagramme de chromaticité réalisé à partir des spectres d’émission pour chacun des verres étudiés ... 46
x
Figure 22: Photos des verres de la série NYBC-x (x variant de 1 à 4 % de TmF3)
lorsqu’illuminés avec la diode laser à 975 nm (puissance de la diode de 30 mW et focus de 50 mm). ... 46
Figure 23: Spectre de transmission de la série de vitrocéramique en fonction du temps de
céramisation. Encadré : Photos du verre et de la vitrocéramique à 170h. ... 47
Figure 24: Diffratogrammes in-situ sur poudres du verre et des vitrocéramiques pris à
chaque heure durant 85h. Les quatre régimes de cristallisation sont identifiés i à iv à droite de l’image. ... 50
Figure 25: Diffractogrammes des rayons X ex-situ du verre et des vitrocéramiques d’1h,
2h, 3h, 6h, 16h et 170h. Les quatre régimes de cristallisation sont identifiés i à iv à droite de l’image. ... 50
Figure 26: Images de microscopie électronique à transmission (MET) du verre (a), de la
vitrocéramique recuite 1h (b) et celle traitée 2h (c). Images de microscopie électronique à balayage (MEB) des vitrocéramiques traitées 2h (d), de 6h (e) et de 170 h (f) à 380 °C. ... 51
Figure 27: Ratios, en base logarithmique, de l’intensité de chacune des bandes d’émission
des vitrocéramiques sur celle du verre en fonction du temps de traitement thermique des vitrocéramiques, en base logarithmique, avec une excitation laser à 975 nm à une puissance de 30 mW. ... 53
Figure 28: Spectres d’émission de type up-conversion réalisés sur le verre en fonction de
la puissance de la diode laser. Encadré : Graphique log-log de l’intensité de chacune des bandes d’émission en fonction de la puissance d’excitation. ... 54
Figure 29: Spectres d’émission de type up-conversion enregistrés sur la vitrocéramique de
170h en fonction de la puissance de la diode laser. Encadré : Graphique log-log de l’intensité de chacune des bandes d’émission en fonction de la puissance d’excitation. ... 55
Figure 30: Diagramme d’énergie simplifié des ions Yb3+, Er3+ et Tm3+ présentant les
différentes voies possibles d’excitation et de relaxation via des transitions radiatives (émissions) et non-radiatives ... 58
Figure 31: Diagramme de chromaticité illustrant l’évolution de la couleur perçue par l’œil
humain des verres et vitrocéramiques tridopées Yb/Er/Tm en fonction de la puissance d’excitation laser à 975 nm et du temps de traitement thermique à 380°C. ... 61
Figure 32: Photographies du verre et des vitrocéramiques traitées 2h et 170h à 380°C sous
xi
Liste des abréviations
CR Relaxation croisée
DSC Calorimétrie différentielle à balayage E1 Premier niveau d’énergie excité E2 Deuxième niveau d’énergie excité
ESA Absorption d’un photon à partir d’un niveau d’énergie excité ETxE Transfert énergétique vers l’ion erbium
ETxT Transfert énergétique vers l’ion thulium
GSA Absorption d’un photon à partir du niveau d’énergie fondamental
G Niveau d’énergie fondamental ITO Oxyde d’indium-étain
MEB Microscopie électronique à balayage MET Microscopie électronique à transmission
MEHPPV Poly[2-methoxy-5-(2-ethylhexyloxy)-1,4-phenylenevinylene]
RX Rayons X
Tf Température de fusion
Tg Température de transition vitreuse Tp Température du pic de cristallisation
TPA Transfert d’énergie après l’absorption de deux photons par deux ions
xiii
Remerciements
Durant mon projet de maîtrise, j’ai eu la chance de découvrir un nouveau domaine qui m’était totalement inconnu auparavant : les verres. Aussi, vers la fin de mon périple, j’ai réalisé que cette aventure m’avait permis non seulement d’acquérir de nouvelles techniques et notions à caractère scientifique, mais aussi d’évoluer sur le plan personnel. En ce sens, ceci n’aurait pu se produire si certaines personnes n’avaient pas joué un rôle majeur dans la réalisation de mes travaux de maîtrise.
J’aimerais premièrement remercier le professeur Younès Messaddeq de m’avoir donné la chance de réaliser ce merveilleux projet sur les verres et les vitrocéramiques. Ce dernier m’a permis de découvrir un domaine que je n’aurais peut-être jamais eu la chance de connaître autrement. J’aimerais aussi remercier le professeur Messaddeq pour ses judicieux conseils durant ces deux dernières années qui m’ont permis de faire évoluer mon projet.
Ensuite, j’aimerais remercier Yannick Ledemi pour son aide tout au long de mes travaux de maîtrise. C’est grâce à lui que j’ai pu être initiée à la fabrication des verres et des vitrocéramiques. Aussi, son expérience dans le domaine des verres et ses conseils m’ont permis de résoudre de nombreux dilemmes techniques. Je pense sincèrement que les résultats obtenus n’auraient pas été les mêmes sans son aide.
Aussi, j’aimerais remercier tous les membres du groupe de recherche et du COPL que j’ai côtoyés durant mes études à la maîtrise. Vous avez contribué à rendre mes deux années études merveilleuses en égayant mes journées chacun à votre manière.
Finalement, j’aimerais remercier ma famille et mes amis qui m’ont soutenue dans les moments les plus joyeux comme dans ceux les plus difficiles.
1
1. Introduction
Les vitrocéramiques sont, depuis leur découverte à la fin des années 1950, des matériaux de choix dans plusieurs domaines très différents les uns des autres. Leur intérêt repose sur la combinaison des propriétés des verres, en particulier leur faible coût de production lié à leur facilité de mise en forme, avec celles des monocristaux et/ou céramiques. Ensemble, ces deux matériaux aux structures et propriétés différentes donnent lieu à la formation d’un matériau composite aux propriétés uniques qui lui sont propres, c’est-à-dire absentes du verre ou de la céramique pris individuellement, tels que des propriétés thermiques, biologiques, électriques, mécaniques et optiques.
Les propriétés thermiques des vitrocéramiques ont joué un rôle important dans le début de la commercialisation de ce matériau. Lors de la découverte de la première vitrocéramique par S.D. Stookey en 19571, ce dernier travaillait alors pour la compagnie Corning Glass
Works. Suite à cet évènement, la compagnie décida de commercialiser le produit sous le nom Pyroceram qui donna lieu à la division CorningWare composée de plats et de plaques de cuisson à base de cette vitrocéramique2. Une des propriétés importantes dans le succès
de ce produit est la résistance aux chocs thermiques. Ceci est majoritairement dû au coefficient d’expansion thermique qui est très faible, de l’ordre de 1 x 10-7 °C-1, voire nul et
même négatif pour certaines compositions.
Les propriétés de biocompatibilité et de bioactivité ont aussi contribué grandement à l’intérêt des recherches scientifiques portant sur les vitrocéramiques. En effet, en contrôlant la composition des vitrocéramiques, il est possible de leurs donner un caractère biocompatible et même bioactif dans le but de recréer le plus possible la structure et les propriétés des os du corps humain composés de cristaux d’hydroxyapatite et de fibres de collagène. Une des premières synthèses de vitrocéramiques pour des applications biologiques fut réalisée par le groupe de Kokubo en 19823. Cette expérience consistait en la
2
préliminaires étaient prometteurs, mais l’apparition de fissures durant le processus de cristallisation limitait les applications. La solution à ce problème fut découverte par le même groupe de recherche quelques années plus tard4 en ajoutant une faible quantité de
CaF2 et en broyant et pressant de fines particules du verre avant la cristallisation. Ensuite,
durant le traitement thermique, il y avait densification de la vitrocéramique et cristallisations successives de la fluoroapatite et de la wollastonite résultant en un matériau homogène sans fissures ni pores. Par la suite, dans les années 1990, plusieurs groupes de recherche en biomatériaux s’intéressèrent aux vitrocéramiques à base de fluoroapatite et hydroapatite. Les applications visées pour ces matériaux sont les substituts de comblement osseux et dentaire et les revêtements de prothèses5.
Les propriétés de conductivité ionique ont aussi contribué, à plus petite échelle, à l’intérêt des recherches scientifiques pour les vitrocéramiques. En effet, les chercheurs essaient de combiner les coefficients d’expansion thermiques très faibles des vitrocéramiques avec les propriétés de conductivité ionique caractéristiques de certains verres contenant des ions mobiles dans leurs structures tels que Li+.6 Les premières expériences à ce sujet portèrent
sur des verres de silicates ou d’aluminosilicates dont les phases cristallines comportaient du lithium. Malheureusement, les résultats furent plutôt décevants comparativement à ceux des verres correspondants. Cependant, la structure de la matrice vitreuse peut être facilement modifiée en changeant légèrement la composition et/ou les proportions des différents composants du verre. Ainsi, en changeant la structure, la mobilité des ions peut elle aussi être modifiée et optimisée. Donc, les recherches les plus récentes à ce sujet portent plutôt sur ce dernier aspect autant pour la conductivité des verres que des vitrocéramiques.7
Les propriétés mécaniques sont très importantes pour le développement des vitrocéramiques. Comme mentionné précédemment, ces matériaux possèdent plusieurs propriétés intéressantes. Cependant, sans les excellentes propriétés mécaniques des vitrocéramiques, l’intérêt pour ce type de matériau ne serait pas le même. En effet, les faibles coefficients d’expansion thermique, la biocompatibilité, la bioactivité et la conductivité ionique sont amplifiés par les résultats de force à la rupture et de dureté qui sont de loin supérieurs à ceux des verres correspondants. Il y a que très peu de matériaux
3
qui ont d’aussi bonnes propriétés mécaniques en plus de toutes les autres propriétés mentionnées précédemment. Généralement, les valeurs moyennes de force à la rupture et de dureté sont respectivement d’environ 100-250 MPa et 1-2,5 MPa∙m1/2 pour une
vitrocéramique tandis que pour un verre, elles sont d’environ 50-70 MPa et 0,7 MPa∙m1/2
respectivement8. Aussi, des études plus spécifiques furent menées pour améliorer le plus
possible ces propriétés par George Beall et ces collègues. Ils réussirent à produire une vitrocéramique SiO2- Li2O-Al2O3-K2O-P2O5-ZrO2-ZnO-La2O3 dont la force à la rupture
était de 450-740 MPa et la dureté d’environ 3.13 MPa∙m1/2.9 Aujourd’hui, plusieurs
considèrent que les propriétés mécaniques des vitrocéramiques ont atteint un maximum, donc les recherches se tournent plutôt vers la réduction du stress résiduel à l’interface cristal-verre.10
Dans le domaine de l’optique, plusieurs recherches ont été menées ces dernières années pour générer des vitrocéramiques transparentes. En effet, en contrôlant la température et le temps de céramisation, il est possible de faire croître de très petits cristaux à l’intérieur de la matrice vitreuse, de l’ordre du nanomètre. Selon la théorie de Rayleigh,
𝐼 𝛼 𝐼0𝜆𝑟64 |𝑀𝑀22−1+2|2 (1)
où I est l’intensité de la lumière diffusée, I0 est l’intensité de la lumière incidente, r est le
rayon de la particule, c’est-à-dire un cristallite dans ce cas présent, λ est la plus petite longueur d’onde du domaine visé et M est la différence entre l’indice de réfraction du cristal et du verre. Selon cette théorie, la taille des cristaux doit être beaucoup plus petite que la plus petite longueur d’onde du domaine visé pour avoir un matériau transparent. Aussi, la différence d’indice de réfraction entre le milieu cristallin et le milieu vitreux doit être la plus petite possible. En général, on considère que le diamètre des cristaux doit être de l’ordre du dixième de la longueur d’onde, soit environ 40 nm pour un matériau dont le domaine de transparence est dans le visible, si la différence d’indice de réfraction entre les cristaux et le verre est plus petite que 0.3.11
4
1.1 Applications des vitrocéramiques en optique
Comme discuté dans les paragraphes précédents, les vitrocéramiques possèdent de nombreuses propriétés pouvant être exploitées dans plusieurs domaines. En optique, les applications pour ce matériau sont, pour le moment, limitées et peu connues, mais tendent à prendre de l’importance et à se diversifier.
Une application très importante des vitrocéramiques en optique est l’amplification des signaux de télécommunications à 1300 nm et 1550 nm. Ceci est possible grâce à un dopage des vitrocéramiques avec le praséodyme (Pr), qui peut émettre à 1300 nm, et l’erbium (Er) , qui peut émettre autour 1550 nm. Le groupe de recherche de Dejneka12 travailla à mettre au
point une composition avec d’excellentes propriétés optiques pour ce type d’application. Le système de SiO2-Al2O3-Na2O-LaF3 se révéla être le plus prometteur. En effet, l’énergie de
phonon de cette matrice vitreuse est basse ce qui limite les pertes dues aux relaxations non-radiatives. De plus, la transparence des vitrocéramiques était excellente, car les cristaux avaient des tailles variant de 7 à 33 nm et la durabilité chimique était de loin supérieure à celle des verres et vitrocéramiques à base de fluorure.
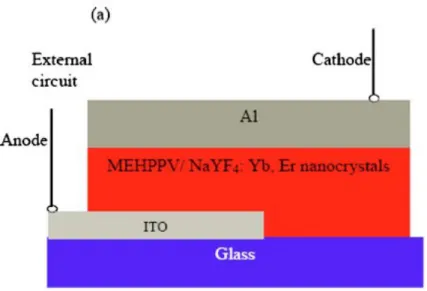
Une autre application des vitrocéramiques en optique est le développement de photodétecteurs dans le domaine du proche infrarouge. Celle-ci met en valeur une propriété de ce matériau soit l’augmentation de l’intensité des émissions de type up-conversion par rapport au verre correspondant. L’up-conversion est un phénomène physique au cours duquel des niveaux d’énergie excités, dont l’énergie excède celle des photons absorbés, sont peuplés Les photodétecteurs classiques sont fabriqués à partir de points quantiques dopés et incorporés dans une matrice de polymères conjugués. Le groupe de Sun13 travailla
sur une alternative aux points quantiques pour le même type d’application, car le jumelage point quantique et polymère conjugué était ardu afin d’obtenir une photodétection optimale. Ce groupe de recherche arriva à la conclusion que les nanocristaux dopés aux ions de terre rares étaient un type de matériau envisageable pour cette application. Pour ce faire, un matériau composite formé d’un mélange de nanocristaux de NaYF4 dopés aux ions
5
(MEHPPV) fut synthétisé. Ensuite, ce dernier était connecté à une électrode d’aluminium et une autre d’oxyde d’indium-étain. Le tout était recouvert d’une couche verre à une des extrémités. Le schéma du photodétecteur est présenté à la figure 1. Le fonctionnement de ce dernier repose sur l’absorption de la lumière dans le proche infrarouge par les dopants des nanocristaux. Ensuite, ces derniers émettent dans le domaine du visible suite aux transferts énergétiques entre les ions ytterbium et erbium. Puis, sous l’effet de la lumière dans le domaine du visible, un courant électrique photoinduit est transporté au travers du polymère jusqu’aux électrodes. Les tests effectués par le groupe de Sun démontrèrent que cette alternative était efficace pour le processus de photodétection, mais que l’efficacité d’up-conversion devait être améliorée.
Figure 1: Schéma d'un photodétecteur comprenant des nanocristaux de NaYF4 dopés aux
ions de terre-rares13
1.2 Objectifs
Les vitrocéramiques ont de nombreux avantages par rapport aux semi-conducteurs, aux métaux de transition et aux monocristaux dopés aux ions de terre rares pour la modulation de l’intensité d’émission autant dans le domaine de l’ultraviolet, du visible et de l’infrarouge. Elles peuvent apporter de très bonnes propriétés mécaniques, une bonne
6
transparence dans le domaine visé, une facilité de mise en forme et un coût de production faible. Une des propriétés des vitrocéramiques est l’augmentation de l’intensité de luminescence de type up-conversion. Durant l’étape de céramisation du matériau, les ions de terre rares qui sont répartis de manière homogène dans la matrice vitreuse se rapprochent les uns des autres et, dans certains cas, sont incorporés dans la phase cristalline. Ceci a pour effet de réduire la distance entre ces atomes ce qui facilite les transferts énergétiques entre les ions de terre rares et, donc, augmente l’efficacité d’émission de type up-conversion. Cette propriété des vitrocéramiques pourrait permettre le développement de source lumineuse et/ou de source laser pouvant être modulée. C’est pour cette raison que de nombreux groupes de recherche ont accordé un intérêt particulier à ce type de matériau.
Le premier groupe à s’être intéressé aux vitrocéramiques est celui d’Auzel en 1975.14 Leur
travaux portaient sur un système de fluorogermanate dopé avec des ions Yb3+, Er3+ et Tm3+.
Avec cette expérience, ce groupe de recherche fut le premier à démontrer une amplification du phénomène optique d’up-conversion dans des vitrocéramiques par rapport au verre correspondant. Malgré cette découverte, les vitrocéramiques formées étaient opaques et les cristaux à l’intérieur de celles-ci avaient des tailles élevées. Ainsi, ce groupe arrêta ces recherches autour du phénomène d’up-conversion et aucun autre article ne fut publié sur ce sujet. Par la suite, dans les années 1990, plusieurs groupes commencèrent à s’intéresser aux matériaux dopés aux ions de terre rares pour des applications en optique notamment le phénomène d’up-conversion. Celui de Wang et d’Ohwaki15 fut le premier groupe à
rapporter la fabrication d’une vitrocéramique transparente dans le domaine du visible sur un système de fluoroaluminosilicate présentant une augmentation de l’intensité d’émission de type up-conversion. Ce groupe fut aussi un des premiers à proposer que les ions de terre rares étaient incorporés dans la phase cristalline.
Suite aux développements dans le domaine des vitrocéramiques et autour du phénomène d’up-conversion, le projet présenté ci-dessous a été élaboré. Dans le cadre de celui-ci, l’objectif principal est de synthétiser des vitrocéramiques à partir d’une matrice vitreuse composée de NaPO3-YF3-BaF2-CaF2 dopée avec des ions de terre rares soient l’ytterbium
7
(Yb), l’erbium (Er) et le thulium (Tm). Celles-ci sont fabriquées dans le but de générer une lumière blanche par la combinaison de bandes d’émission dans le bleu, le vert et le rouge. Pour ce faire, la matrice vitreuse devra subir un traitement thermique, dont la température et le temps de céramisation doivent aussi être prédéterminés, pour la génération de cristaux dispersés de manière homogène dans le volume du verre. Ces derniers doivent être d’une taille suffisamment petite pour pouvoir conserver une bonne transparence dans le matériau. Par la suite, les vitrocéramiques ont été caractérisées par calorimétrie différentielle à balayage (DSC), spectroscopie UV-Visible, rayons X (RX), microscopie électronique à balayage (MEB), microscopie électronique à transmission (MET) et spectrofluorimétrie.
9
2. Verres et vitrocéramiques
2.1 Définition du verre et de la transition vitreuse
Selon la définition proposée par Zarzycki16, un verre est un solide non-cristallin présentant
le phénomène de transition vitreuse. Deux concepts sont très importants dans cette définition; le premier est que les verres ne présentent pas d’arrangement périodique à longue distance contrairement aux cristaux. Ceci peut être démontré par la prise du diffractogramme des rayons X. Sur ce dernier, les cristaux auront des raies assez fines et distinctes les unes des autres. Pour un verre, le diffractogramme ressemblera plutôt à un halo très peu représentatif. Le deuxième concept important dans cette définition est que tous les verres présentent le phénomène de transition vitreuse. Ainsi, en plus des verres inorganiques, comme la silice (SiO2), d’autres solides répondent à ces critères comme les
verres organiques et les verres métalliques.
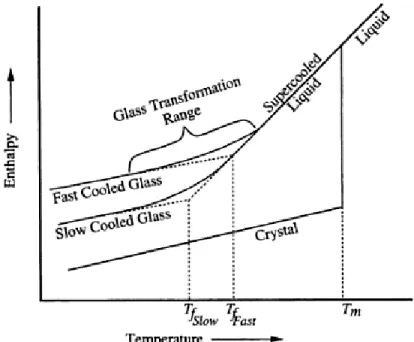
La transition vitreuse peut, quant à elle, être expliquée par la variation d’enthalpie en fonction de la température, comme illustrée à la figure 2. À haute température, au-dessus de la température de fusion, le verre est dans un état liquide, la viscosité de ce dernier est faible et l’enthalpie du système est élevée. À mesure que la température diminue, la viscosité du liquide augmente et l’enthalpie du système diminue. À la température de fusion, contrairement au cas d’un cristal, il n’y a pas de discontinuité dans la courbe de l’enthalpie en fonction de la température. À ce moment, le verre passe d’un état liquide à un état de liquide surfondu. L’enthalpie du système continue de diminuer alors que la viscosité augmente, pour atteindre une valeur autour 1013 poises à la température de transition
vitreuse (Tg). À cet instant, le matériau passe de l’état de liquide surfondu à l’état de solide vitreux. À des températures plus basses, l’enthalpie du système continue de diminuer, mais moins rapidement; la pente du graphique de celle-ci en fonction de la température est moins prononcée (voir figure 2). Au niveau de la thermodynamique, la transition vitreuse n’est pas une transformation du 1er ordre ni du 2e ordre. En effet, dans le premier cas, la dérivée
10
de l’enthalpie en fonction de la température n’est pas infinie en un point, comme c’est le cas dans le cas de la sublimation ou de la fusion. Ce n’est pas non plus une transformation du 2e ordre, car la dérivée seconde ne peut être infinie en un point. Ainsi, il faut plutôt voir
la transition vitreuse comme un processus durant lequel les éléments sont figés dans une structure semblable à celle d’un liquide plutôt qu’une transformation. De plus, il faut toujours considérer la température de transition vitreuse comme une gamme de température plutôt qu’une température fixe. Ceci est dû au fait que la Tg est une transition dynamique et peut varier en fonction de la vitesse de refroidissement du matériau. Ainsi, si le refroidissement se fait rapidement, la température de transition vitreuse sera un peu plus élevée que pour une vitesse de refroidissement plus lente.
Figure 2: Variation de l'enthalpie en fonction de la température17
2.2 Critères de formation vitreuse
William Houlder Zachariasen est un physicien célèbre pour ses travaux dans le domaine des verres au courant du 20e siècle. En 1932, il publia un article intitulé « The Atomic
11
ce dernier, Zachariasen développa une série de critères pour expliquer pourquoi certains oxydes peuvent former des verres tandis que d’autres non. Au départ, ces réflexions sur le sujet commencèrent par une série de règles :
1. Le nombre d’oxygènes autour d’un atome (A) doit être faible. 2. Aucun oxygène ne doit être partagé par plus de deux atomes A.
3. Les polyèdres du réseau vitreux doivent être liés par leurs sommets et non leurs arêtes ou faces.
4. Au moins trois sommets d’un polyèdre doivent être partagés avec d’autres polyèdres.
Par la suite, Zachariasen s’intéressa à la stœchiométrie des oxydes pouvant former des verres. Il détermina que les oxydes de type AO et A2O ne peuvent former de verre tandis
que les oxydes de type A2O3, AO2, A2O5, AO3 et A2O7 forment des réseaux vitreux. Ainsi,
il remarqua que ces derniers formaient soit des triangles, des tétraèdres ou des octaèdres. Donc, il ajouta un critère à sa série :
5. Les nombres d’oxygènes autour de A doivent être de 3 ou 4.
Cependant, ces critères sont élaborés pour des verres formés à partir d’un seul oxyde. Par la suite, Zachariasen s’intéressa donc à la formation de verre à partir de mélanges d’oxydes. Ainsi, il modifia ces premières règles :
1. L’échantillon doit contenir suffisamment de cations entourés par des tétraèdres ou des triangles d’oxygènes.
2. Les tétraèdres ou les triangles doivent être reliés par les sommets.
3. Certains oxygènes ont des liens avec deux cations et ne peuvent former de nouveaux liens avec d’autres cations.
12
Il donna le nom de « cations formateurs de réseau » aux ions capables, en association avec des oxygènes, de former un réseau vitreux.
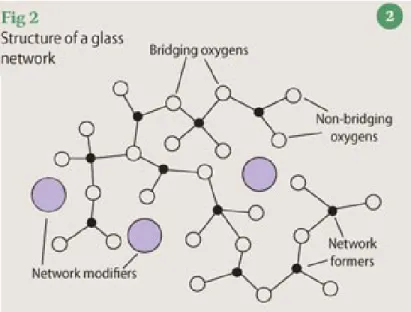
C’est à partir des travaux de Zachariasen qu’une classification des différents ions et de leurs rôles dans un réseau vitreux a été élaborée. Celle-ci comprend trois grandes catégories : les formateurs, les modificateurs et les intermédiaires.
Les ions formateurs, comme le phosphore et le silicium, ont comme caractéristique de pouvoir former des réseaux vitreux à eux seuls. Lorsque jumelés avec des atomes d’oxygène, ils forment des polyèdres, généralement de coordinations 3 ou 4. Les liens entre les différents polyèdres sont créés par les oxygènes qui peuvent faire deux liens avec des ions formateurs de verres. Ces derniers sont appelés oxygènes pontants.
La deuxième catégorie comprend les ions modificateurs du réseau vitreux. Ceux-ci sont principalement les éléments des familles des alcalins et des alcalino-terreux. Lorsqu’ajoutés aux verres, ils brisent les liens des oxygènes pontants qui deviennent alors non-pontants. Ceci a pour effet de diminuer la température de transition vitreuse et la viscosité du verre.
La dernière catégorie regroupe les ions intermédiaires comme l’aluminium (Al), le tellure (Te) et le titane (Ti). Ceux-ci agissent soit comme formateurs soit comme modificateurs tout dépendant de la composition du verre. Certains ions peuvent aussi jouer les deux rôles grâce à leurs multiples états de coordination.
Il existe plusieurs autres systèmes de classification comme celui de Goldschmidt19 basé sur
le rayon ionique, celui de Smekal20 basé sur le type de liaison (covalente, ionique,
métallique et les interactions de van der Waals) et celui de Stanworth21 basé sur le degré de
covalence de la liaison M-O, mais les critères de classification de Zachariasen sont ceux qui sont les plus utilisés.
13
2.3 Définition d’une vitrocéramique
Les vitrocéramiques sont des matériaux composites dans lesquels une ou plusieurs phases cristallines croissent dans une matrice vitreuse. À partir de cette définition, plusieurs termes importants peuvent être identifiés. Premièrement, les vitrocéramiques sont des matériaux composites ce qui signifie qu’elles constituent une combinaison de deux composants, plus précisément les céramiques et les verres. Ainsi, les vitrocéramiques ont été développées pour combiner les propriétés intéressantes des verres, soient la facilité de mise en forme et la transparence, avec les propriétés mécaniques provenant des phases cristallines. Comme mentionné précédemment, les vitrocéramiques possèdent aussi des propriétés qui sont propres à ce matériau et à la nature de leurs phases cristallines. Donc, comparativement aux céramiques traditionnelles et aux verres, ces propriétés peuvent être modulées en contrôlant la taille et le nombre des cristaux. Ensuite, une caractéristique importante pour qu’un matériel soit considéré comme une vitrocéramique est que le développement de ou des phases cristallines doit être contrôlé. En effet, la cristallisation doit se produire simultanément dans le volume du matériau et les cristaux d’une même phase cristalline doivent croître uniformément. La quantité de cristaux dans une vitrocéramique dépend du temps de céramisation et de la et/ou des phases cristallines, mais le volume occupé par ces
14
derniers peut, théoriquement, varier de 1 à 99 %. Une vitrocéramique est considérée comme telle tant qu’elle conserve une partie vitreuse et une autre cristalline.
Pour créer une vitrocéramique, au départ, un verre doit être préalablement synthétisé. Ce dernier doit comprendre tous les éléments nécessaires pour faire croître la phase cristalline désirée. Par la suite, le matériau est placé sans un four à une température comprise entre la température de transition vitreuse (Tg) et la température de cristallisation (Tx). Dans cette gamme de température, le verre est dans un état viscoélastique ce qui permet la nucléation et la croissance des cristaux.
2.4 Théorie de nucléation et de croissance
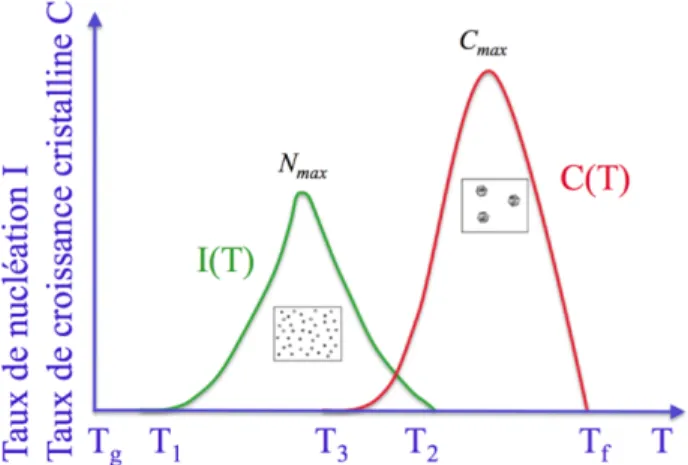
La formation d’une vitrocéramique passe principalement par deux processus dans la gamme de température entre Tg et Tx : la nucléation et la croissance des cristaux.
La nucléation est le processus par lequel il y a formation de germes. Ces derniers sont appelés nuclei. Il existe deux types de nucléation : homogène et hétérogène.23 La nucléation
homogène est un évènement stochastique. Ainsi, un nucleus a autant de probabilités de se former dans n’importe quelle partie du matériau. La nucléation hétérogène, quant à elle, se crée à partir de sites préférentiels comme des impuretés, des bulles, des défauts dans le matériau, des interfaces et des agents de nucléation.
La croissance des cristaux consiste en la croissance des germes qui peuvent être de différentes natures. Elle est limitée par la diffusion des composants dans le verre.
15
Figure 4: Taux de nucléation et de croissance des cristaux en fonction de la température23
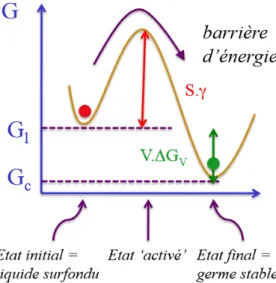
L’énergie de nucléation comprend deux contributions : une partie thermodynamique et une partie cinétique.
Pour la contribution thermodynamique, celle-ci est basée principalement sur le fait qu’il y a une variation de l’énergie libre lors de la formation d’un cristal par rapport au liquide surfondu.
Figure 5: Énergie libre du liquide surfondu et du cristal en fonction de la température23
Ainsi,
16
Donc, la nucléation est gouvernée par la diminution de l’énergie libre entre le liquide surfondu et le germe, ce qui est thermodynamiquement favorable et à l’augmentation de l’énergie de surface qui est la barrière d’énergie à surmonter pour la nucléation.
La diminution de l’énergie libre est donnée par :
∆𝐺𝑣 𝑥 𝑣𝑜𝑙𝑢𝑚𝑒 𝑑′𝑢𝑛 𝑛𝑢𝑐𝑙𝑒𝑢𝑠 𝑠𝑝ℎé𝑟𝑖𝑞𝑢𝑒 (4𝜋𝑟
3
3 ) (3)
La barrière d’énergie de surface est donnée par :
𝑇𝑒𝑛𝑠𝑖𝑜𝑛 𝑑𝑒 𝑠𝑢𝑟𝑓𝑎𝑐𝑒 (𝛾) 𝑥 𝑎𝑖𝑟𝑒 𝑑𝑒 𝑠𝑢𝑟𝑓𝑎𝑐𝑒 (4𝜋𝑟2) (4)
Ainsi, la nucléation est donnée par :
𝑊 = 4𝜋𝑟2𝛾 + 4𝜋 3 𝑟
3∆𝐺
𝑣 (5)
Donc, en combinant la barrière d’énergie d’activation, dominée par la tension de surface, avec la diminution de l’énergie libre par la création d’un nucleus par rapport au liquide surfondu, il est possible de déterminer le rayon critique d’un germe :
𝑟∗ = − 2𝛾
∆𝐺𝑣 (6)
Figure 6: Schéma de l'évolution de l'énergie libre du liquide surfondu à la formation d'un germe stable23
17
𝑊∗ = 16𝜋 3
𝛾3
∆𝐺𝑣2 (7)
Si le rayon est plus petit que le rayon critique (r*), la nucléation est dominée par l’énergie de surface, donc le germe ne sera pas stable et va se dissoudre. Si le rayon est plus grand que le rayon critique, le germe va croître, car l’énergie libre du système diminue.
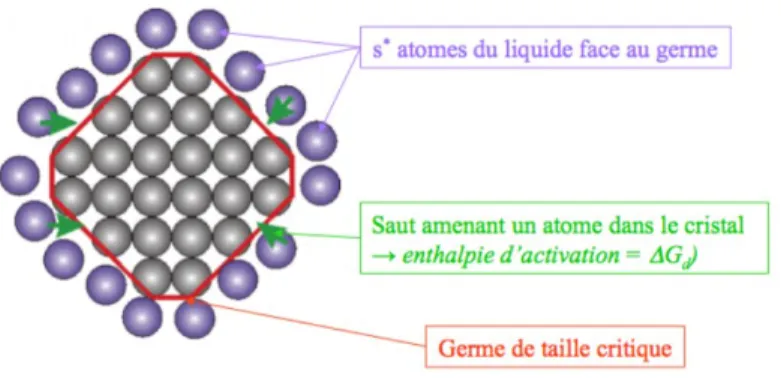
Pour les considérations cinétiques, il est important de déterminer la fréquence de saut d’un atome dans le cristal.
Figure 7: Schéma du rayon critique de formation d'un germe23
18
La fréquence du saut d’un atome dans le germe de taille critique est donnée par :
𝜈′= 𝑆∗𝜈𝑒−∆𝐺𝐷𝑘𝑇 (8)
où ν est la fréquence de vibration du réseau.
Donc, le taux de nucléation est égal aux nombres de particules de taille critique multiplié par la fréquence avec laquelle elles deviennent supercritiques.
𝐼 =𝑑𝑁𝑑𝑡 = (𝑁𝑡𝑒(−𝑊∗𝑘𝑇)) + (𝑠∗𝜈𝑒(−Δ𝐺𝑑𝑘𝑇)) (9)
Après simplification,
𝐼𝑠𝑡(𝑇) = 𝐼0𝑒(−𝑊∗+Δ𝐺𝑑𝑘𝑇 ) (10)
où Ist représente le taux de nucléation à l’équilibre et I0 le taux de nucléation initial.
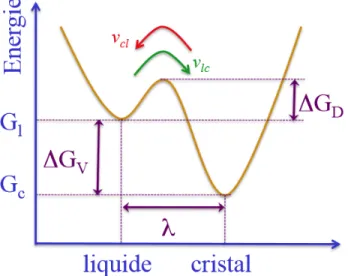
Ensuite, le taux de croissance cristalline est limité par deux facteurs : l’efficacité de la diffusion à l’interface du liquide et du cristal et le nombre de sites à l’interface qui peut incorporer des atomes.
19
Les transferts diffusifs peuvent être calculés en multipliant la distance pour que la diffusion s’opère, la fréquence de vibration atomique et la probabilité que la diffusion s’effectue :
𝜐𝑙→𝑐 = 𝜆𝜈𝑒−
Δ𝐺𝑑
𝑘𝑇 (11)
𝜐𝑐→𝑙 = 𝜆𝜈𝑒−Δ𝐺𝑑−Δ𝐺𝑣𝑘𝑇 (12)
où λ est la distance interatomique et ν est la fréquence de vibration atomique.
Figure 10: Schéma de l'énergie libre en fonction de l'état du système pour la croissance des cristaux23
Ainsi, la vitesse de diffusion est la différence entre les deux :
𝑉 = 𝜆𝜈𝑒−Δ𝐺𝑑𝑘𝑇 [1 − 𝑒Δ𝐺𝑣𝑘𝑇] (13)
Donc, le taux de croissance des cristaux est donné par :
21
3. Les ions de terre rares et le phénomène d’up-conversion
3.1 Les ions de terre rares
Les ions de terre rares sont aussi appelés ions lanthanides. Cette famille d’éléments s’étend, dans le tableau périodique, du lanthane (La) au lutécium (Lu). Les propriétés particulières de ces ions proviennent principalement du blindage des orbitales 4f qui sont, pour la plupart, totalement remplies, par les orbitales 5s2 et 5p6. Ainsi, les électrons de valences
sont peu perturbés par l’environnement externe et leurs transitions électroniques produisent des raies fines et intenses.24 Dans le cas des émissions de type up-conversion, spécialement
celles suivant un transfert d’énergie entre deux ions, certains ions de terre rares ont des caractéristiques, comme la différence entre les niveaux d’énergie et la probabilité d’absorption d’un photon à une certaine longueur d’onde, les démarquant des autres pour les rôles de donneurs et d’accepteurs d’énergie.
Les ions accepteurs d’énergie sont ceux qui vont recevoir l’énergie des ions donneurs et ainsi être excités à un niveau d’énergie supérieur avant de se relaxer, de manière radiative ou pas. D’une part, ces ions doivent posséder des niveaux d’énergie résonants. En effet, la différence d’énergie entre chaque niveau d’énergie excité et entre le premier niveau énergétique excité et le niveau fondamental doit être suffisamment proche pour faciliter les absorptions de photons et les transferts d’énergie. Aussi, le taux de relaxation non-radiative diminue exponentiellement en augmentant la différence d’énergie entre le niveau fondamental et le premier niveau d’énergie excité.25 Donc, en considérant ces deux
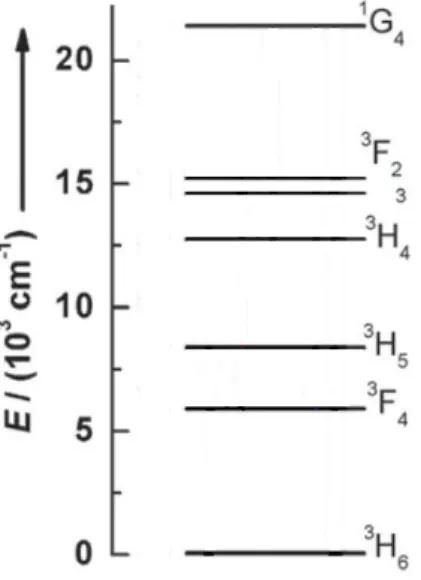
caractéristiques importantes pour les ions donneurs d’énergie dans le transfert de type up-conversion, les ions de terre rares les plus efficaces pour ce rôle sont l’erbium (Er3+) et le
thulium (Tm3+). Par exemple, l’ion erbium a une différence d’énergie d’environ 10 350
cm-1 entre les niveaux 4I
11/2 et 4I15/2 (voir figure 30 pour un diagramme des niveaux
énergétiques) tandis que celle entre les niveaux d’énergie 4F
7/2 et 4I11/2 est d’environ 10 370
22
émission de type up-conversion à l’aide de ces niveaux résonants avec la même source laser monochromatique. Pour l’ion thulium, les différences d’énergie entre les niveaux 3H
5 et 3H6
et celle entre les niveaux 3F
2 et 3F4 sont très semblables ce qui permet des émissions de type
up-conversion avec cet ion.
Figure 11: Diagramme d'énergie simplifié de l'ion erbium (Er3+)26
23
Les ions donneurs d’énergie sont ceux qui transfèrent l’énergie consécutivement à l’absorption d’un photon vers l’ion accepteur. Toutefois, la présence de ces ions n’est pas obligatoire pour observer une émission de type up-conversion. En effet, les ions, comme l’Er3+ et le Tm3+, peuvent agir à la fois comme donneur et accepteur d’énergie. L’émission
de type up-conversion est cependant moins efficace dans ce cas. Une des caractéristiques qui font d’un ion de terre rare un bon ion donneur d’énergie consiste en une forte probabilité d’absorption dans le domaine du proche infrarouge.26 Le processus classique
d’up-conversion consiste en l’absorption de photons dans cette zone pour ensuite émettre dans le domaine du visible. Un des meilleurs ions donneurs d’énergie est l’ytterbium (Yb3+), car il possède une section efficace d’absorption plus élevée que les autres
lanthanides autour de sa bande d’absorption (980 nm). Aussi, la transition entre le niveau d’énergie fondamental et le premier niveau d’énergie excité (2F
7/2→2F5/2) coïncide avec
plusieurs niveaux d’énergie des principaux ions accepteurs d’énergie comme l’Er3+, le
Tm3+ et l’Ho3+. Ainsi, l’ion ytterbium (Yb3+) est souvent l’ion donneur d’énergie dans les
couples donneur-accepteur pour l’émission de type up-conversion par transfert d’énergie.
3.2 Up-conversion
L’up-conversion ou conversion ascendante est un phénomène physique au cours duquel des niveaux d’énergie excités, dont l’énergie excède celle des photons absorbés, sont peuplés. Cette étape est suivie par une émission à une longueur d’onde plus courte que celle utilisée pour exciter le matériau.27 La fréquence des photons émis est donc plus grande que celle
des photons absorbés, d’où le terme « up-conversion ». Habituellement, la source lumineuse incidente émet dans le proche infrarouge et les émissions de type up-conversion ont lieu dans le visible. Ce processus lumineux peut se produire de trois façons : par l’absorption de photons à partir d’un niveau énergétique excité, par transfert énergétique entre deux ions et par avalanche de photons. Dans ces trois processus, l’absorption de photons se réalise successivement et non simultanément.
24
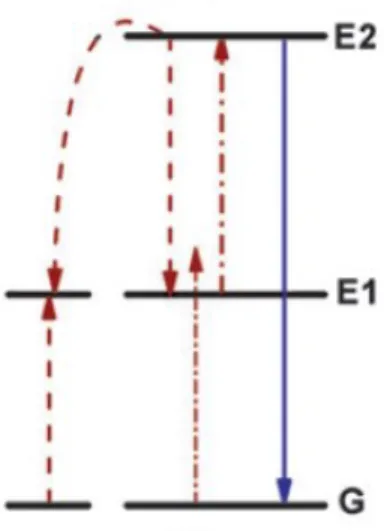
Pour l’absorption de photons à partir de niveaux énergétiques excités, tout prend forme à l’intérieur d’un même ion. Le principe de celle-ci fut proposé initialement en 1959 avec l’idée de construire un compteur de photons dans le domaine de l’infrarouge.28 Un
diagramme des différentes transitions de ce processus lumineux est présenté à la figure 13. D’une part, l’ion absorbe un premier photon à partir du niveau d’énergie fondamental (G). Il se retrouve alors excité à un premier niveau d’énergie (E1). Par la suite, l’ion absorbe un deuxième photon, de même énergie que le premier ou d’une énergie différente si une deuxième source lumineuse est utilisée, pour être excité à un deuxième niveau d’énergie (E2). Puis, à ce moment, l’ion excité retourne au niveau d’énergie fondamental en émettant à une longueur plus courte que la longueur d’onde d’excitation. Ce processus a pour avantage d’être indépendant de la concentration des ions de terre rares Cependant, dans le cas de l’utilisation d’une seule source laser, peu d’ions de terre rares ont des niveaux d’énergies également espacés ce qui limite le nombre d’ions pouvant être utilisés et la polyvalence de cette méthode.29
Figure 13: Schéma représentant le processus d’absorption de photons à partir de niveaux énergétiques excités. Les flèches rouges représentent les absorptions de photons et la flèche
bleue représente l’émission de type up-conversion.26
Le transfert énergétique entre deux ions de type up-conversion se réalise, comme son nom l’indique, par un transfert d’énergie entre deux ions voisins. Au départ, ces deux ions sont excités de leur niveau d’énergie fondamental (G) au premier niveau d’énergie excité (E1) par l’absorption de photons de même énergie. Par la suite, l’ion donneur transfère son
25
énergie à l’ion accepteur et retourne au niveau fondamental sans émettre. Simultanément, l’ion accepteur est promu au deuxième niveau énergétique excité (E2). À partir de ce point, il retourne à son niveau d’énergie fondamental en émettant à une longueur plus courte que la longueur d’onde des photons absorbés au début du processus.26 Jusqu’au milieu des
années 1960, les chercheurs pensaient que l’ion receveur d’énergie était à l’état fondamental lorsque le deuxième ion transférait son énergie. Cependant, suite à ces recherches, F. Auzel proposa que l’ion receveur d’énergie devait déjà être à un niveau d’énergie excité au moment où il recevait l’énergie provenant de l’autre ion.30 Aussi, il
proposa que le nombre de photons étant impliqués dans les transferts énergétiques pouvaient être supérieurs à deux. Mis à part le processus décrit dans les lignes précédentes, d’autres transferts énergétiques entre ions peuvent survenir donnant lieu à des émissions lumineuses de longueurs d’ondes plus courtes que celle de la source. D’abord, le premier processus débute par l’excitation de l’ion donneur d’énergie. Par la suite, ce dernier transfert son énergie à l’ion accepteur, mais, à ce moment, celui-ci est au niveau d’énergie fondamental. Ce transfert permet de propulser l’ion à un premier niveau d’énergie. Ceci est suivi d’une absorption de photon permettant d’atteindre un deuxième niveau d’énergie supérieur. Puis, le retour au niveau fondamental permet l’émission à une longueur d’onde plus courte que celle absorbée initialement. Un autre processus possible est caractérisé par deux transferts d’énergie consécutifs permettant d’atteindre des niveaux énergétiques supérieurs desquels l’émission à une longueur d’onde plus courte est réalisable. Ensuite, il est aussi possible que plusieurs ions coopèrent ensemble afin d’élever un de ceux-ci à des niveaux supérieurs excités. En ce sens, deux ions, initialement à des niveaux excités, transfèrent tour à tour ou simultanément leur énergie à un troisième ion qui sera excité à un niveau d’énergie supérieur. À partir de ce dernier, l’émission à une longueur d’onde plus courte que celle de la source sera réalisable.29
26
Figure 14: Schéma représentant le processus de transfert énergétique entre deux ions. Les flèches rouges point-pointillées représentent l’absorption de photons. Les flèches rouges pointillées représentent le transfert énergétique et la flèche bleue représente l’émission de
type up-conversion.26
L’avalanche de photons est le troisième processus pouvant produire l’up-conversion. Celui-ci débute par l’absorption d’un photon par un ion à partir de son niveau énergétique fondamental. Cette absorption n’est cependant pas en résonance avec le premier niveau excité et est donc très faible. Par la suite, il y a absorption d’un deuxième photon par le même ion à partir du premier niveau excité (E1) vers le deuxième niveau excité (E2). Puis, il se produit un transfert d’énergie dû à la relaxation non-radiative croisée entre l’ion excité au deuxième niveau et un autre ion se trouvant au niveau d’énergie fondamental. Il en résulte que les deux ions se retrouvent au premier niveau d’énergie excité (E1). À partir de ce moment, les deux ions peuvent facilement être excités au deuxième niveau d’énergie (E2) et émettre, à une longueur d’onde plus courte que la longueur d’onde d’absorption de départ, en retournant au niveau fondamental d’énergie.26
27
Figure 15: Schéma représentant le processus de l’avalanche de photons. Les flèches rouges point-pointillées représentent d’absorption de photons. Les flèches rouges pointillées représentent le transfert d’énergie entre les ions et la flèche bleue représente l’émission
résultante.26
Les trois processus produisant le phénomène d’up-conversion possèdent des efficacités très différentes. L’absorption de photons à partir de niveaux énergétiques excités est le processus le moins efficace. L’avalanche de photons est, quant à elle, très efficace, mais ce processus dépend de la puissance de la source lumineuse incidente et sa réponse, c’est-à-dire la lumière émise, peut être longue considérant les cycles d’absorption/relaxation. Finalement, le transfert énergétique entre deux ions offre une réponse rapide après l’excitation, n’est pas dépendant de la puissance de la source incidente et est très efficace lorsque les concentrations d’ions accepteurs et d’ions donneurs sont bien contrôlées.31
Dans ce projet, ce processus sera celui principalement observé pour l’émission de type up-conversion.
29
4. Méthodes expérimentales
4.1 Méthode de synthèse des verres
Comme mentionné précédemment, les vitrocéramiques sont, la plupart du temps, obtenues par cristallisation contrôlée d’un verre qui doit donc être préalablement synthétisé. Dans le cadre de ce projet, la composition choisie est 40% NaPO3-30% YF3-20% BaF2-10% CaF2-
4% mas. YbF3- 2% mas. ErF3- x% mas. TmF3. Cette composition a été choisie, car les
verres de fluorophosphates présentent de nombreuses caractéristiques uniques. En effet, ces derniers offrent un large domaine de vitrification, c’est-à-dire qu’ils forment facilement des verres.32 Ensuite, ils sont reconnus pour posséder une grande solubilité des ions de
terre-rares.33 Aussi, ils ont une bonne durabilité chimique par rapport à plusieurs autres
compositions34 et leur énergie de phonon est basse ce qui limite la relaxation non-radiative
des niveaux d’énergie excités.35 Dans la composition choisie, le « x » représente la
concentration de TmF3 variant d’un verre à l’autre, passant de 0 à 4 % massique. Les
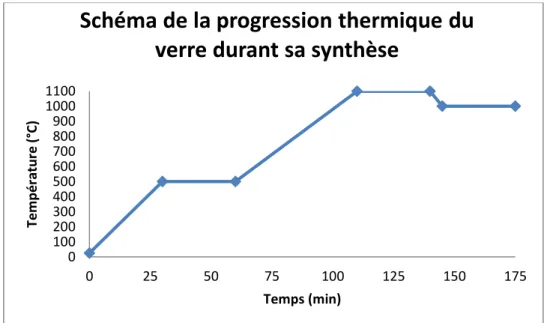
concentrations de chacun des composants sont en pourcentages molaires sauf pour les trois ions de terre rares dont les pourcentages sont sous forme massiques. Pour la synthèse de verres, d’une part, tous les produits sous forme de poudres présents dans la composition prédéterminée sont pesés dans les quantités voulues avec une précision de ± 1 mg. Par la suite, les poudres sont placées dans un creuset préalablement choisi en fonction du traitement thermique déterminé pour ce type de verre. Pour ce projet, le creuset utilisé était en platine/or, car cet alliage était préférable dans la gamme de températures pour la fusion du verre. Ensuite, le creuset est placé au four. Pour les verres que nous avons synthétisés, le traitement thermique consistait en une déshydratation/séchage des poudres à 500°C pendant 30 min, une fusion à 1100°C pendant 30 min et un dernier plateau thermique à 1000°C pendant 30 min pour l’homogénéisation du verre en fusion et pour augmenter la viscosité avant la coulée. Un graphique représentant les températures et la durée des paliers du traitement thermique est présenté à la figure 16. Ensuite, la coulée a lieu dans un moule en acier inoxydable. Celui-ci doit préalablement être chauffé à la température de recuit pour
30
éviter un refroidissement trop rapide et une rupture du matériau par choc thermique. Une fois le verre coulé dans le moule, le verre passe d’un état liquide à solide vitreux. Puis, le moule est placé dans un four à la température de recuit pour une durée de 6 heures suivi d’un refroidissement lent, environ 1°C/min, jusqu’à la température de la pièce. Cette étape permet de réduire le stress résiduel à l’intérieur du verre. Pour ce projet, la température de recuit est 280°C. Par la suite, le verre peut être démoulé et poli. Puis, un deuxième recuit est effectué sur le verre, à une température très près de la température de transition vitreuse, pour enlever tout stress résiduel qui pourrait être encore présent. Cette étape n’est pas essentielle, mais permet la taille du verre de manière précise et réduit le nombre d’éclats de verre qui pourraient se former durant cette étape. Finalement, le verre est taillé en plusieurs petites pièces permettant de réaliser plusieurs essais de céramisation sur le même échantillon.
Figure 16: Schéma de la progression thermique du verre durant sa synthèse
0 100 200 300 400 500 600 700 800 900 1000 1100 0 25 50 75 100 125 150 175 Tem p ér atu re (° C) Temps (min)
Schéma de la progression thermique du
verre durant sa synthèse
31
Figure 17: Photos de A) du creuset platine/or utilisé dans ce projet, B) du moule en acier inoxydable, C) du système de polissage utilisé, D) de la scie pour le taillage des
échantillons, E) du verre avant le polissage et F) du verre après le polissage.
4.2 Méthode de fabrication des vitrocéramiques
Une fois le verre formé, recuit, poli et taillé, les vitrocéramiques peuvent être préparées. Une courbe d’analyse thermique du matériau doit être réalisée afin de déterminer la température de transition vitreuse (Tg) et la température de cristallisation (Tx). La température de synthèse des vitrocéramiques se situe généralement entre ces deux températures. Plus la température choisie est élevée, plus la cristallisation de la vitrocéramique sera difficile à contrôler. Inversement, une température près de la Tg engendrera une cristallisation très lente dans le matériau. Ainsi, la température choisie doit tenir compte de ces paramètres pour pouvoir contrôler facilement la cristallisation sans que celle-ci ne prenne trop de temps avant d’apparaître. Pour ce projet, la température pour le traitement thermique des vitrocéramiques est 380°C. Cette dernière se situe plus près de la température de transition vitreuse (345°C) que de la température de cristallisation (407°C) pour favoriser la nucléation afin de créer plusieurs nuclei qui pourront ensuite croître légèrement afin de générer des cristaux de taille nanométrique pour que le matériau garde
A B C
32
une bonne transparence. Ensuite, une pièce de verre est placée dans un four préalablement chauffé à la température choisie. En plus de la détermination de la température optimale, le four utilisé doit permettre une homogénéisation de la température à l’intérieur de ce dernier pour pouvoir répéter l’expérience. En ce sens, le four utilisé comprenait une ventilation intérieure permettant de répartir également la température choisie dans tout l’espace du four. Plusieurs traitements ont été réalisés à la température de céramisation durant différentes durées variant de 0 à 170 h.
Plusieurs techniques ont été développées pour déterminer la température et le temps optimaux de céramisation des vitrocéramiques. Par exemple, le groupe de recherches de Calvez36 utilisa une de celles-ci pour la fabrication de vitrocéramiques à base de
chalco-halogénures. Cette dernière consistait à faire plusieurs traitements sur un même échantillon de verre à une température fixe dont les durées variaient. Par la suite, les échantillons sont analysés par DSC et celui qui obtient le pic de cristallisation le plus élevé permet de déterminer le temps optimal de céramisation. Le même principe est utilisé pour la température optimale en fixant la durée du traitement thermique.
33
5. Caractérisation des verres et vitrocéramiques
5.1 Calorimétrie différentielle à balayage
La calorimétrie différentielle à balayage, ou differential scanning calorimetry (DSC) en anglais, est une technique d’analyse thermique. Elle permet de mesurer l’évolution thermique d’un échantillon notamment en déterminant les températures de transition vitreuse (Tg), de cristallisation (Tx) et de fusion.
Le principe de cette technique d’analyse repose sur le dégagement ou l’absorption de chaleur associée à un changement d’état ou de phase. En effet, au départ, l’échantillon est placé dans un creuset sur un thermocouple. Un deuxième creuset, vide, est placé sur le porte-échantillon du thermocouple comme référence. Ce système est ensuite entouré d’un four. Le choix du four et du type de creuset dépend de la gamme de température visée. Dans le cadre de ce projet, le four utilisé était à base de carbure de silicium pouvant atteindre des températures jusqu’à 1500°C.37 Cependant, le creuset utilisé était formé
d’aluminium ce qui limitait la température maximale pouvant être atteinte (environ 600°C). Toutefois, pour l’échantillon analysé, à cette température, la plupart des transitions déterminantes pour ce projet avaient été observées. Ensuite, le four commence à chauffer l’enceinte où se trouvent les creusets et le thermocouple. Lors d’une transition de phase, l’échantillon absorbe (processus endothermique) ou dégage une quantité de chaleur (processus exothermique). Ainsi, la différence de chaleur entre le creuset de référence et le creuset contenant l’échantillon change. Ceci se traduit par l’apparition d’un pic endothermique ou exothermique sur le thermogramme.38 Le processus de fusion est illustré
par un pic endothermique, car l’échantillon absorbe de la chaleur durant celui-ci. Inversement, la cristallisation est un processus exothermique ce qui se traduit par un dégagement de chaleur. La transition vitreuse, quant à elle, ne se caractérise pas par l’apparition d’un pic sur le thermogramme, mais par un saut par rapport à la ligne de base.
34
Figure 18: Schéma du thermocouple et des creusets à l'intérieur du four d'un calorimètre différentiel à balayage38
Figure 19: Graphiques de la 1) température en fonction du temps des deux creusets dans le four du calorimètre et 2) de la différence de température entre ces deux creusets lors d'une
transition38
35
Dans le cadre de ce projet, l’appareil utilisé pour l’obtention de thermogrammes est un Netzsch DSC Pegasus 404F3 et les mesures ont été réalisées à une vitesse de 10K/min. L’incertitude sur les valeurs obtenues pour chacune des transitions de phases est donnée à ± 2°C. La détermination de la température de transition vitreuse (Tg), de cristallisation (Tx) et, lorsqu’il est possible, de la température de fusion est essentielle pour la fabrication de verres et de vitrocéramiques. Pour ce faire, à partir du thermogramme, les différentes températures des transitions sont identifiées par la rencontre de deux tangentes provenant d’un point avant le début de la transition et d’un autre après le début du processus. Un exemple est donné à la figure 20. La détermination de ces températures permet de définir la température à laquelle les vitrocéramiques seront réalisées, car celle-ci doit se trouver entre la Tg et la Tx pour pouvoir bien contrôler la cristallisation.
Figure 20: Thermogramme d'un verre représentant la température de transition vitreuse (Tg) et la température de cristallisation (Tx).
5.2 Spectroscopie UV-visible
La spectroscopie ultraviolet-visible est une technique de caractérisation d’échantillons gazeux, liquides ou solides dans le domaine des longueurs d’onde de l’ultraviolet (175 à 400 nm), du visible (400 à 750 nm) et du proche infrarouge (750 à 1200 nm). Elle se base
36
sur la propriété des molécules d’absorber la lumière à certaines longueurs d’onde spécifiques.
L’appareil utilisé, appelé spectromètre UV-visible, mesure l’intensité de la lumière qui passe au travers de l’échantillon. Pour cette expérience, l’appareil utilisé était un spectromètre à doubles faisceaux Cary 500 Varian. Cette mesure est comparée à celle de l’intensité de la lumière, dans les mêmes conditions, mais sans l’échantillon. Ainsi, la quantité de lumière qui traverse l’échantillon dépend de plusieurs paramètres comme le coefficient d’absorption linéaire et l’épaisseur de l’échantillon. Cette relation est représentée dans la loi de Beer-Lambert :
𝐼 = 𝐼0𝑒−𝛼𝑥 (15)
où I est l’intensité de la lumière passant au travers de l’échantillon, I0 est l’intensité de la
lumière sans l’échantillon, α est le coefficient d’absorption linéaire et x est l’épaisseur de l’échantillon. Dans le cadre de ce projet, tous les échantillons avaient une épaisseur de 1,5 mm. Ensuite, le rapport de ces deux mesures, appelé transmittance, peut être obtenu :
𝑇 = 𝐼𝐼
0 (16)
Cette valeur peut être transformée en pourcentage de transmission et en absorbance.
𝑃𝑜𝑢𝑟𝑐𝑒𝑛𝑡𝑎𝑔𝑒 𝑑𝑒 𝑡𝑟𝑎𝑛𝑠𝑚𝑖𝑠𝑠𝑖𝑜𝑛 = 𝑇 𝑥 100 (17) 𝐴𝑏𝑠𝑜𝑟𝑏𝑎𝑛𝑐𝑒 (𝐴) = − log(𝑇) (18)
La spectroscopie ultraviolet-visible permet aussi de visualiser la coupure de transmission dans le domaine de l’ultraviolet. Elle correspond à la différence d’énergie entre la bande de valence et la bande de conduction. Lorsque l’échantillon est illuminé par des longueurs plus courtes que la coupure de transmission, l’énergie est complètement absorbée par transition entre les deux bandes et la transmission est nulle. Pour des longueurs d’onde plus élevées que la coupure de transmission, l’énergie des photons n’est pas assez élevée pour que la
37
transition entre la bande de valence et la bande de conduction s’effectue. Alors, la lumière passe à travers l’échantillon sans être absorbée.
5.3 Spectrofluorimétrie
La spectrofluorimétrie est une technique d’analyse qui mesure la fluorescence d’un échantillon liquide ou solide. Elle se base sur le fait que certains matériaux peuvent absorber une quantité de lumière à certaines longueurs d’onde et réémettre à des longueurs d’onde spécifiques, en général, plus élevées que celles de la source incidente.
L’appareil utilisé pour ces analyses est un fluorimètre à doubles monochromateurs. Son principe de fonctionnement est le suivant : la lumière de la source d’excitation passe par un monochromateur pour ensuite frapper l’échantillon. À ce moment, une quantité de lumière est absorbée par l’échantillon et celui-ci réémet à une longueur d’onde différente. La lumière de fluorescence est, par la suite, captée à un angle de 90° par rapport au faisceau d’excitation et passe par un deuxième monochromateur avant d’atteindre le détecteur.
Dans le cadre de ce projet, le fluorimètre a été utilisé pour mesurer les émissions de type up-conversion. L’appareil utilisé était un Nanolog Horiba Jobin Yvon. La source d’excitation était une diode laser externe montée à 975 nm reliés à l’échantillon par une fibre optique standard monomode (SMF28). Cette dernière était reliée à un collimateur et à une lentille de focale de 18,4 mm. La diode laser était contrôlée par un contrôleur. Ce dernier a aussi permis la réalisation d’une étude en contrôlant la puissance de la diode. Le détecteur utilisé était un tube photomultiplicateur (PMT) fonctionnant de 250 à 850 nm. L’échantillon de verre ou de vitrocéramique était maintenu en place sur plaque munie d’un espacement central placée à 30° par rapport à la direction du faisceau d’excitation. Cet angle a été préféré, car c’est avec ce dernier que le plus grand nombre de photons était capté par le détecteur.