NICOLAS GRUYER
TRAITEMENT BIOLOGIQUE DES EFFLUENTS DE
SERRE PAR DES MARAIS FILTRANTS
ARTIFICIELS ET DES BIORÉACTEURS PASSIFS
Thèse présentée
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de doctorat en biologie végétale
pour l'obtention du grade de Philosophiae doctor (Ph.D.)
DEPARTEMENT DE PHYTOLOGIE
FACULTÉ DES SCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION UNIVERSITÉ LAVAL
QUÉBEC
2012
Résumé
Lors de l'irrigation des cultures de tomate produites en serre, une partie importante de l'eau enrichie en engrais est rejetée dans l'environnement afin de contrôler la conductivité électrique du milieu de culture et l'équilibre ionique de la solution du sol. Plusieurs contraintes limitent la réutilisation de cette eau, par exemple une surcharge de l'eau en ions sulfates (SO4 ~) et la présence d'agents pathogènes, comme Pythium ultimum ou Fusarium oxysporum. Les objectifs de cette recherche étaient de (1) réduire les S042~ en présence d'ions nitrates (N03~), (2) éliminer les agents pathogènes P. ultimum et F. oxysporum présents dans l'effluent de serre, (3) évaluer l'effet suppresseur de ces eaux traitées envers la pourriture pythienne, (4) comparer la croissance de plants de tomate irrigués avec les eaux traitées par les marais, (5) comprendre l'effet de différents amendements de C dans les marais filtrants sur la diversité métabolique et phylogénétique des populations microbiennes, et finalement (6) évaluer la capacité de bioréacteurs passifs à réduire les
-y _
SO4 en présence d'ions NO3 , et à éliminer les agents pathogènes P. ultimum et F. oxysporum. Nos résultats ont démontré l'importance de la quantité et de la qualité de la source exogène de carbone (C) pour réduire les ions NÛ3~ et SO42-. Pour un enlèvement optimal de S042~ et de NO3"" (99 %), l'apport de C exogène doit atteindre les seuils C :N = 3,4 et COD: S042~= 0,36. D'autre part, les marais filtrants ont été performants (99,99 %) à réduire les agents pathogènes P. ultimum et F. oxysporum, notamment par l'adsorption de ceux-ci au biofilm formé et par la production d'enzymes extracellulaires par les microorganismes. Le traitement des effluents par les marais confère également à l'eau des propriétés suppressives envers la pourriture pythienne. La quantité et la qualité du contenu en carbone utilisé pour amender les AWs ont eu une forte incidence sur l'activité métabolique des microorganismes pour l'utilisation des sources de N, P et S. Finalement, l'utilisation de bioréacteurs passifs a montré, par une activité microbienne importante, une efficacité similaire aux marais filtrants pour réduire les ions sulfates en présence de nitrates. De plus, les bioréacteurs passifs ont été aussi performants que les marais pour éliminer les agents pathogènes étudiés. L'utilisation des marais filtrants et des bioréacteurs constitue une alternative durable pour le traitement des effluents de serre.
Abstract
During the irrigation of hydroponics vegetable greenhouse crops, a significant portion of water enriched with fertilizers is released into the environment in order to control the electrical conductivity and the ionic balance of the nutrient solution. Several constraints limit the reuse of this water in time, such as an important build-up of undesirable ions (S04 ) and the presence of plant pathogens like Pythium ultimum and Fusarium oxysporum. The general objective of this research was to determine the efficacy of using sustainable and biological water treatment systems to treat greenhouse effluents. Specifically, goals of this study were to (1) reduce SO4 in the presence of nitrate (NO3 ), (2) eliminate plant pathogens P. ultimum and F. oxysporum in the effluent, (3) evaluate the suppressive effect of treated-water toward P. ultimum, (4) evaluate the growth of tomato plants irrigated with wetland treated-water, (5) determine the effect of various carbon amendments in wetland on the microbial metabolic and phylogenetic diversity, and finally (6) evaluate the efficacy of passive bioreactors to reduce SO4 ions with of NO3 , and remove plant pathogens P. ultimum and F. oxysporum. Our results have shown the importance of the quantity and quality of the exogenous carbon source to reduce simultaneously NO3 and SO4 in artificial wetlands (AWs). For high removal (99%) of NO3 and SO4 , carbon source input was determined by the ratios C N = 3.4 and DOC: SO4 = 0.36. The efficacy to remove water-borne plant pathogens P. ultimum and F. oxysporum was also high (99.9%) mainly due to their adsorption on biofilm and by the microbial production of cell wall degrading enzymes. Wastewater treated by AWs has suppressive properties towards root rot P. ultimum. The quantity and quality of the amended carbon source in AWs had a significant effect on the microbial metabolic activity for N, P and S sources utilization. Finally, the use of passive bioreactors has shown a same efficacy to AWs to reduce sulfate in the presence of nitrate as well as removing the studied plant pathogens. The use of AWs and bioreactors is a sustainable alternative to treat greenhouse effluents.
I l l
Avant-Propos
Les travaux de recherche réalisés durant cette thèse feront l'objet de plusieurs publications dans des revues avec comité de lecture, ainsi que des présentations dans des conférences et symposiums. L'ensemble des publications générées est détaillé ci-dessous.
Revues avec comité de lecture
Gruyer, N., Gravel, V., Zagury, G.L, Dorais, M. 2011. Removal of Pythium ultimum propagules in recycled greenhouse nutrient solution using artificial wetlands. Acta Horticulturae 893(2): 1179-1183.
Gruyer, N., Dorais, M., Zagury, G.L, Alsanius, B.W. 2011. Treated wastewater by artificial wetlands for making plantlet tomato plant nutrient solution. HortTechnology 21(6): 759-766.
Gruyer, N., Dorais, M., Alsanius, B.W., Zagury, G.J. 2012. Simultaneous removal of sulfate and nitrate from greenhouse effluent by artificial wetlands. Journal of Environmental Quality (soumis).
Revues avec comité de lecture en préparation
Gruyer, N., Dorais, M., Zagury, G.J., Alsanius, B.W. Removal of plant pathogens from recycled greenhouse effluent using artificial wetlands.
Gruyer, N., Dorais, M., Alsanius, B.W., Zagury, G.J. The use of passive bioreactor to reduce nitrate, sulfate and water-borne plant pathogens from greenhouse effluent. Gruyer, N., Dorais, M., Zagury, G.J., Alsanius, B.W. Metabolic and phylogenetic
diversities of microbial communities in the artificial wetlands used to treat greenhouse effluent.
Conférences et symposium
Gruyer, N., Dorais, M., Zagury, G.J., Alsanius, B.W. A passive biological approach to remove plant pathogens from greenhouse effluent. Canadian Organic Science Conference, 21-27 février 2012, Winnipeg, Manitoba, Canada.
Gruyer, N., Dorais, M., Zagury, G.J., Alsanius, B.W. The use of passive bioreactors to simultaneously remove NO3, SO4 and plant pathogens from organic greenhouse effluent. Canadian Organic Science Conference, 21-27 février 2012, Winnipeg, Manitoba, Canada.
Gruyer, N., Dorais, M., Zagury, G.J., Alsanius, B.W. 2011. Removal of plant pathogens in recycled greenhouse effluent using artificial wetlands. Greensys 2011, 5-11 juin, Halkidiki, Grèce.
Gruyer, N., Dorais, M., Zagury, G.J., Alsanius, B.W. Removal of sulfate and nitrate in recycled greenhouse effluent solution using artificial wetlands. Greensys 2011, 5-11 juin 2011, Halkidiki, Grèce.
Gruyer, N., Dorais, M., Zagury, G.J., Alsanius, B.W. Effectiveness of passive bioreactors for treating greenhouse effluent contaminated by pathogens and nutrient pollutants. Greensys 2011, 5-11 juin 2011, Halkidiki, Grèce.
Gruyer, N., Dorais, M., Zagury, G.J., Alsanius, B.W. 2011. Benefits of greenhouse effluent treatment through artificial wetland. 1st International symposium in Microbial Horticulture, 17-20 mai, Alnarp, Suède.
Gruyer, N., Dorais, M., Zagury, G.J., Alsanius, B.W. 2010. Utilisation des marais filtrants pour réduire les ions sulfates et les agents pathogènes des effluents de serre. Congrès conjoint AQSSS-SPPQ, 1-3 juin, Oka, Québec, Canada.
Gruyer, N., Gravel, V., Zagury, G.L, Dorais, M. Removal of Pythium ultimum propagules in recycled greenhouse nutrient solution using artificial wetlands. Greensys 2009, June 14-19, 2009, Québec, Canada.
Remerciements
Tout d'abord, j'aimerais remercier ma directrice, la docteure Martine Dorais, de son soutien et de son enthousiasme envers le projet. Merci, de m'avoir donné l'opportunité de réaliser ce projet et de m'avoir accueilli dans le laboratoire et ainsi rendu possible la réalisation de ce projet. Je remercie également mon codirecteur le professeur Gérald J. Zagury pour m'avoir transmis ses connaissances scientifiques sur les bioréacteurs passifs. Également, je tiens à exprimer mes vifs remerciements à ma codirectrice la professeure Beatrix W. Alsanius pour m'avoir permis d'intégrer la Postgraduate School in Microbial Horticulture et, par la suite, d'avoir accepté de devenir ma codirectrice. Elle fut toujours prête à partager son savoir et disponible pour me faire des commentaires constructifs et donner des encouragements.
Je tiens aussi à remercier mon mentor, Jean Charles Coté, pour nos discussions riches de sens et ses conseils avisés.
Je tiens par ailleurs à remercier toute l'équipe du laboratoire : Réjean pour son amitié, sa bonne humeur et ses 'bras' quand j'avais besoin d'aide dans la serre ; Vicky pour son amitié et notre 'collaboration' pendant sa maîtrise; Edith pour son aide dans le laboratoire et les analyses physico-chimiques ; Ann-Catherine pour m'avoir donné un coup de main pour la microbiologie ; Danya, pour nos belles discussions sur la science et Maggy pour son agréable compagnie ; Claudine pour avoir trouvé l'équipement nécessaire au montage des marais ; Valérie pour ses conseils, notamment sur Pythium. Votre aide fut grandement appréciée!
De plus, je tiens à remercier l'équipe des serres de l'Envirotron, soit Claudette Roy, Rachel Daigle et Carole Martinez pour leur aide et leur collaboration pour le bon fonctionnement des marais. Merci aux étudiants qui ont participé au projet de recherche.
Je voudrais remercier le FQRNT (programme BMP innovation), les Industrie Plant-Prod ainsi que tous les partenaires pour leur soutien financier. Ils ont rendu possible la réalisation
de ce grand projet.
Bien entendu, je tiens à faire des remerciements à mes proches, soit ma famille, mes amis (es) et ma belle-famille pour leur soutien et à leurs encouragements. Je tiens tout particulièrement à remercier mon sage ami Francis qui a su être présent et m'encourage tout au long des étapes du doctorat. Je tiens à remercier énormément Andy, mon mari, pour m'avoir encouragé à continuer de croire à ce projet et de m'avoir offert un environnement propice à la réussite. Son soutien moral et sa présence durant les moments plus difficiles m'ont aidé à aller jusqu'au terme de ce projet.
Vil
1\
Table des matières
Résumé i Abstract ii Avant-Propos iii Remerciements v Table des matières ix Liste des tableaux xiii Liste des figures xvii Liste des abbreviations xix CHAPITRE I. INTRODUCTION 1
1.1 L'eau et l'agriculture 1
1.1.1 L'industrie serricole 2 1.1.2 Les effluents de serre 2
1.1.3 La législation 3 1.1.4 La gestion des effluents 3
1.2 La recirculation des effluents de serre 4
1.2.1 Les ions indésirables 4 1.2.2 Les agents pathogènes 6 1.3 Les systèmes biologiques passifs de traitement des effluents : les marais filtrants
artificiels et les bioréacteurs 10 1.3.1 Principe des systèmes passifs de traitement des effluents 10
1.3.2 Les caractéristiques des systèmes 10 1.3.3 Les marais filtrants 11
1.3.4 Les bioréacteurs 12 1.3.5 Le rôle des plantes dans les marais filtrants 12
1.3.6 Les microorganismes dans les marais filtrants et les bioréacteurs 13 1.3.7 Les cycles biochimiques dans les marais filtrants et les bioréacteurs passifs 14
1.3.7.1 L'oxygène 14 1.3.7.2 Le carbone 15 1.3.7.3 L'azote 16 1.3.7.4 Le soufre 17 1.3.8 La dénitrification et la sulfato-réduction 19
1.3.9 La réduction des agents pathogènes 19
1.4 Hypothèses de recherche 20 1.5 Objectifs de recherches 21
1.6 Bibliographie 22 CHAPITRE II. ENLÈVEMENT SIMULTANÉ DU NITRATE ET DU SULFATE DES
EFFLUENTS DE SERRE PAR LES MARAIS FILTRANTS 31
2.1 Introduction 33 2.2 Material and methods 35
2.2.1 Experimental set-up and operation 35
2.2.2 Sampling and analyses 37 2.2.3 Sulfide removal from the treated effluent 39
2.2.4 Calculations and statistical analyses 39
2.3 Results 39 2.3.1 Characterization ofthe four types of artificial wetland 39
2.3.3 Nitrate and sulfate reduction rate 42 2.3.4 Culturable microorganisms 45 2.3.5 Sulfide removal from the treated effluent 45
2.4 Discussion 47 2.4.2 Variations among the wetlands 47
2.4.2.1 Redox potential 47 2.4.2.2 Dissolved organic carbon 47
2.4.3 Nitrate and sulfate removal 48 2.4.4 Dissolved sulfide production 50
2.4.5 Release of sulfate 51
2.5 Conclusions 51 2.6 References 53 CHAPITRE III. ÉLIMINATION DES AGENTS PATHOGÈNES PRÉSENTS DANS LES
EFFLUENTS DE SERRE PAR LES MARAIS FILTRANTS 59
3.1 Introduction 61 3.2 Material and methods 62
3.2.1 Experimental set-up and operation 62 3.2.2 Physicochemical and microbial analyses 64
3.2.3 Efficiency tests 64 3.2.4 Biofilm polysaccharide analysis 65
3.2.5 Enzyme activity 66 3.2.6 Statistical analyses 66 3.3 Results 66 3.4 Discussion 69 3.5 Conclusion 72 3.6 References 73 CHAPITRE IV. EFFET DE L'UTILISATION DE L'EAU TRAITÉE PAR LES MARAIS
FILTRANTS SUR LA POURRITURE PYTHIENNE ET LA CROISSANCE DES
PLANTS DE TOMATES 77
4.1 Introduction 79 4.2 Materials and Methods 80
4.2.1 Experimental set-up and operation 80
4.2.2 Plant material 81 4.2.3 Plant fertilization 82 4.2.4 Pythium inoculation 84 4.2.5 Mycelial growth effects 84 4.2.6 Evaluation of root colonization by the pathogen 85
4.2.7 Evaluation of plant growth and Chi a fluorescence 85 4.2.8 Evaluation of microbial activity in the tomato growing medium 86
4.2.9 Statistical analyses 86
4.3 Results 86 4.3.1 P. ultimum suppression 86
4.3.2 Plant growth 88 4.3.3 Chi a fluorescence 89
xi
4.4 Discussion 91 4.5 Conclusion 94 4.7 References 95 CHAPITRE V. DIVERSITÉS MÉTABOLIQUE ET PHYLOGÉNETIQUE DES
COMMUNAUTÉS MICROBIENNES DANS LES MARAIS FILTRANTS ARTIFICIELS
UTILISÉS POUR TRAITER LES EFFLUENTS DE SERRE 101
5.1 Introduction 103 5.2 Material and Methods 104
5.2.1 Experimental set-up and operation 104 5.2.2 Microbial community level physiological profiles (CLPP) 105
5.2.3 Molecular fingerprinting 106 5.2.3.1 DNA extraction from cell suspensions and PCR amplification 106
5.2.3.2 Denatured gradient gel electrophoresis (DGGE) 107
5.2.4 Calculation and statistic analyses 107
5.3 Results 108 5.3.1 Utilization pattern of carbon sources in wetlands 108
5.3.2 Aerobic utilization pattern of sucrose in wetlands 114 5.3.3 Utilization pattern of N, P and S sources in wetlands 116 5.3.4 Aerobic utilization pattern of nitrate and sulfate in wetlands 117
5.3.5 Aerobic utilization pattern of gentibiose, L-malic acid, laminarin and p-OHPAA 120
5.4 Discussion 122 5.5 Conclusion 124 5.6 References 125 CHAPITRE VI. UTILISATION DES BIORÉACTEURS PASSIFS POUR RÉDUIRE LES
NITRATES, SULFATES ET LES AGENTS PATHOGÈNES PRÉSENTS DANS LES
EFFLUENTS DE SERRE 129
6.1 Introduction 131 6.2 Material and methods 133
6.2.1 Experimental set-up and operation 133 6.2.2 Water-borne plant pathogen efficacy tests 134
6.2.3. Sampling and analyses 134 6.2.4 Evaluation of microbial activity 135
6.2.5 Calculations and statistical analyses 135
6.3 Results 136 6.3.1 Pathogen efficacy test 136
6.3.2 Sulfate and nitrate reduction 136 6.3.3 Dissolved organic carbon and redox potential 137
6.3.4 Microorganisms viable counts in treated water 138
6.3.5 Microbial activity 139 6.3.6 Dissolved sulfide 140
6.4 Discussion 140 6.5 Conclusion 143 6.6 References 144 CHAPITRE VII. CONCLUSION 149
7.1 Capacité à réduire les ions NÛ3~ et S042~ 149
7.3 Capacité d'élimination des agents pathogènes 151
7.4 Applications agronomiques 152
7.5 Recherches futures 154
Bibliographie 157 ANNEXE I. Redox potential and DOC variability 175
ANNEXE II. Sulfide removal from treated effluent with FeCb and carbon activated
treatments 177 ANNEXE III. Efficiency test performed with P. ultimum and F.oxysporum 178
ANNEXE IV. Plot ofthe first two principal component loadings for each substrate, derived
from the area under the color development profile 179 ANNEXE V. Distribution of microbial utilization of sucrose, N03~ and S042~ by principal
component analysis of intensity reactions and phylogenetic diversity, by cluster analyze of
DGGE profile 185 ANNEXE VI. Distribution of microbial utilization of gentibiose, L-malic acid, laminarin
and p-OHPAA by principal component analysis of intensity reactions and phylogenetic
diversity, by cluster analyze of DGGE profile 189 ANNEXE VII. Removal of Pythium ultimum Propagules in Recycled Greenhouse Nutrient
Solution Using Artificial Wetlands 193 ANNEXE VIII. Un système naturel et efficace pour recycler l'or bleu : les bassins filtrants
végétalisés 203 ANNEXE IX. Utilisation des marais filtrants pour purifier les effluents de serre 213
X l l l
Liste des tableaux
Tableau 1. Caractérisation minérale des effluents d'une culture conventionnelle de la
tomate de serre 6 Tableau 2. Traitements chimiques de désinfection des effluents de serre 8
Tableau 3. Traitements physiques de désinfection des effluents de serre 9 Table 4. Composition of the mixed organic carbon source used in AWC (artificial wetland
with complex carbon source) at the building stage and after 14 months of maturity (n
= 6) 36 Table 5. Physicochemical parameters of each type of artificial wetland (AW = wetland
units without addition of an external C source, AWS = 2 g L"1 of sucrose, AWC = wetland units with reactive mixture of compost and sawdust and AWC+S = AWC plus 2 g L"1 of sucrose added at the 19th week) during 28 weeks expressed by their pH, DOC (mg L"1), DOCS042", C N and redox potential (ORP, mV). Pooled data from
weekly sampling during 28 weeks (n = 224) 40 Table 6. DOC (mg L"1) horizontal variability in each type of wetland. ((AW = wetland
units without addition of an external C source, AWS = 2 g L'1 of sucrose, AWC = wetland units with reactive mixture of compost and sawdust and AWC+S= AWC plus 2 g L"1 of sucrose added at the 19th week) during 28 weeks. Pooled data from weekly sampling during 28 weeks (n = 224). Labels indicate differences within the type of
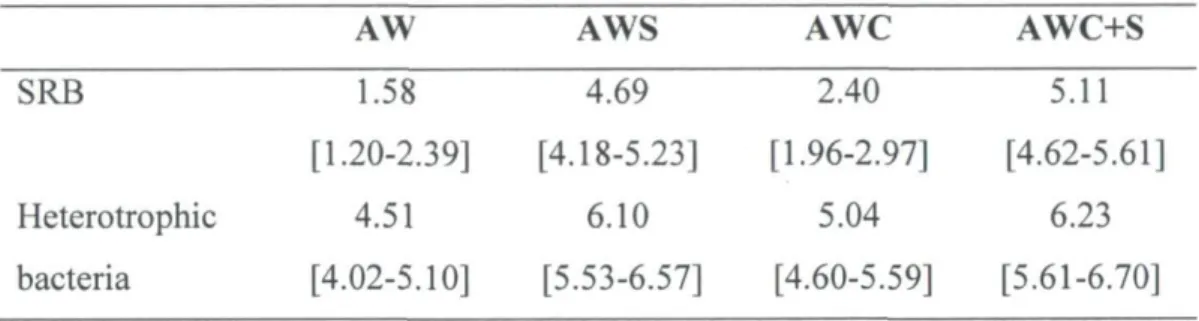
wetland 42 Table 7. Viable counts of sulfate-reducing bacteria (SRB) and heterotrophic bacteria (log
(CFU+1)), for the four types of wetlands (AW = wetland units without addition of an external C source, AWS = 2 g L1 of sucrose, AWC = wetland units with reactive mixture of compost and sawdust and AWC+S = AWC plus 2 g L"1 of sucrose added at the 19l week) during 28 weeks. Data are means with 95% confident interval of n =
224 45 Table 8. Characterization of each type of wetlands expressed by their porosity (%), pH,
DOC (mg L"1) and oxido-reduction potential (mV) from three types of wetland (AW = without external carbon source, AWS = 2 g L"1 of sucrose, and AWC = reactive mixture of compost and sawdust). Pooled data generated from 12 weeks samples 67 Table 9. Data are means with 95% confident interval of microbial viable counts (anaerobic
bacteria, aerobic bacteria, Bacillus spp., fungal flora, and Pseudomonas spp.) in three types of wetlands (AW = without external carbon source, AWS = 2 g L" of sucrose, and AWC = reactive mixture of compost and sawdust). Data are means of 12 weeks of
sampling of 8 wetlands replicates with 3 laboratory replicates (n = 288) 68 Table 10. Composition of the treated water from three types of wetland (AW= Artificial
wetland with no carbon source, AWS= Artificial wetland with sucrose, and AWC= Artificial wetland with compost), and the four nutrient solution treatments made with
treated water and adjusted with synthetic fertilizers 83 Table 11. Effects ofthe four nutrient solution treatments made with tap water (control),
AW (effluent from artificial wetland with no carbon source), AWS (effluent from artificial wetland with sucrose) and AWC (effluent from artificial wetland with compost) on the percentage inhibition of radial mycelial growth of Pythium ultimum. Treated water was sterilized by autoclaving or membrane filtered, or used directly without treatment (crude water). Data from the three concentration treatments (25%,
50% and 75% v/v) were pooled because no concentration effect was observed at P >
0.05) 87 Table 12. Root colonization by Pythium ultimum in tomato plants irrigated with four
nutrient solution treatments made with tap water (control), AW (effluent from artificial wetland with no carbon source), AWS (effluent from artificial wetland with sucrose) and AWC (effluent from artificial wetland with compost). Data are means of
six replications (n = 6) 88 Table 13. Effects of nutrient solution treatments made with tap water (control), AW
(effluent from artificial wetland with no carbon source), AWS (effluent from artificial wetland with sucrose) and AWC (effluent from artificial wetland with compost) on performance of plants tomato seedlings characteristics after 8 weeks of treatment. Plant stress indicator expressed as Fv: Fm ratio, maximum quantum efficiency of PSII,
of tomato plants. Data are means of six replications (n = 6) 90 Table 14. Average length of lag time and until end of exponential phase during the the
times course change of average well color development (AWCD) during utilization of C-, N-, P- and S-sources by microorganisms associated to filter medium samples from three types of wetland (AW = wetland units without addition of an external C source, AWS = 2 g L"1 of sucrose, AWC = wetland units with reactive mixture of compost and sawdust). Microbial utilization was studied using Omnilog PM panels (Biolog Inc., Hayward CA, USA; C-sources : PM1 and PM2, 190 sources; N-sources: PM3, 95 sources; P-sources: PM4, 59 sources; S-sources: PM4, 35 sources) during 96 h (incubation temperature : 25 °C). Utilization was measured through redox dye color change every 15 minutes using a video-based system (Omnilog, Biolog Inc., Hayward
CA,USA) ! Ill Table 15. The ten mostly utilized C-, N-, P- and S- sources by microbial communities
associated to three types of (AW = wetland units without addition of an external C source, AWS = 2 g L"1 of sucrose, AWC = wetland units with reactive mixture of compost and sawdust) on the basis of 379 sole substrates involving Omnilog PM panels 1 through 4. Utilization was followed during 96 h (incubation temperature 25 °C) by serial readings every 15 minutes determined by the area under the curve 112 Table 16. Average length of lag time and until end of exponential phase as well as area
under the curve for sucrose (well DU, PM1), N03" (well A4, PM3) and S042" (well F2, PM4) utilization by microorganisms associated to filter medium samples from three types of wetland (AW, artificial wetland with no carbon source supplemented ; AWS, artificial wetland with simple carbon source/sucrose; AWC, artificial wetland with complex carbon source). Microbial utilization was studied using Omnilog PM panels (Biolog Inc., Hayward CA, USA) during 96 h (incubation temperature : 25 °C). Utilization was measured through redox dye color change every 15 minutes using a
video-based system (Omnilog, Biolog Inc., Hayward CA, USA) 118 Table 17. Average length of lag time and until end of exponential phase as well as area
under the curve for gentibiose (well Cl, PM2), L-malic acid (well G12, PMI), laminarin (well A10, PM2) and p-OHPAA (well H2, PM1) utilization by microorganisms associated to filter medium samples from three types of wetland (AW, artificial wetland with no carbon source supplemented; AWS, artificial wetland with simple carbon source/sucrose; AWC, artificial wetland with complex carbon source). Microbial utilization was studied using Omnilog PM panels (Biolog Inc., Hayward CA, USA) during 96 h (incubation temperature : 25 °C). Utilization was
XV measured through redox dye color change every 15 minutes using a video-based
XVII
Liste des figures
Figure 1. Design of horizontal subsurface wetland equipped with five sampling collectors. Three sampling collectors (0 30 mm) were installed at 0.25 m below the filling filter media surface (one each at 0.20 m (A), 0.35 m (B), and 0.50 cm (C) from the inlet), along with one collector at 0.05 m (0.35 m from the inlet; D) and another at 0.35 cm
(0.35 cm from the inlet; E) 37 Figure 2. ORP variability (mV) in each type of wetlands (AW = wetland units without
addition of an external C source, AWS = 2 g L"1 of sucrose, AWC = wetland units with reactive mixture of compost and sawdust and AWC+S = AWC plus 2 g L"1 of sucrose added at the 19th week) during 28 weeks. Pooled data from weekly sampling
during 28 weeks (n = 224) 41 Figure 3. Percentage of sulfate and nitrate removal (mean values ± SE, n = 24) in the four
types of wetland (AW = wetland units without addition of an external C source (A-D), AWS = 2 g L"1 of sucrose (B-E), AWC = wetland units with reactive mixture of compost and sawdust ( C-F) and AWC+S = AWC plus 2 g L"1 of sucrose added at the
19th week (C-F) measured in effluent from wetlands, during 28 weeks 44 Figure 4. Sulfide production in mg L"1 for the fours types of wetlands AW = wetland units
without addition of an external C source, AWS = 2 g L"1 of sucrose, AWC = wetland units with reactive mixture of compost and sawdust and AWC+S = AWC plus 2 g L"1 of sucrose added at the 19th week) during 28 weeks. Data are means ± SE ofn = 8. ..46 Figure 5. Cell wall degrading enzyme (CDWE) activities (chitinase, cellulase, protease, P-1,4-glucanase, xylanase) in three types of wetlands (AW = without external carbon source, AWS = 2 g L"1 of sucrose, and AWC = reactive mixture of compost and sawdust). Data are means of 12 weeks of sampling of 8 wetlands replicates with 3 laboratory replicates (n = 288). Different letters indicate significant differences between the three types of wetland for microbial viable count (Tukey test P < 0.05). 69 Figure 6. Distribution of microbial utilization of C-, N-, P- and S-sources by principal
component analysis of area under the curve for plates PM1 and PM2 (190 wells-carbon source), PM3 (95 wells-nitrogen source), PM4-P (59 wells- phosphorus source), and PM4-S (35 well-sulfur source). Percentages on principal components represent the amounts of variation explain by each PC. AW = wetland units without addition of an external C source, AWS = 2 g L'1 of sucrose, AWC = wetland units
with reactive mixture of compost and sawdust 109 Figure 7. Average well color development (AWCD) in the three types of wetland (AW,
AWS and AWC), for C-sources utilization (PM1 and PM2, 190 selected carbon sources), n = 4. AW = wetland units without addition of an external C source, AWS = 2 g L*1 of sucrose and AWC = wetland units with reactive mixture of compost and
sawdust 110 Figure 8. Distribution of microbial utilization of sucrose (well DI 1, PMI), N03~ (well A4,
PM3) and SO4 (well F2, PM4) by principal component analysis of intensity reactions and phylogenetic diversity, by cluster analyze of DGGE profile. Percentages on principal components represents the amounts of variation explain by each PC. AW = wetland units without addition of an external C source, AWS = 2 g L'1 of sucrose, AWC = wetland units with reactive mixture of compost and sawdust (Annexe V)... 115
Figure 9. Distribution of microbial utilization of gentibiose (well C1, PM2), L-malic acid (well G12, PM1), laminarin (well A10, PM2) and p-OHPAA (well H2, PM1) by principal component analysis of intensity reactions and phylogenetic diversity, by cluster analyze of DGGE profile. Percentages on principal components represents the amounts of variation explain by each PC. AW = Artificial wetland with no carbon source supplemented, AWS = Artificial wetland with simple carbon source, and AWC
= Artificial wetland with complex carbon source (Annexe VI) 121 Figure 10. Evolution ofthe nitrate and sulfate removal (mean value) of non-sterilized and
sterilized bioreactors. Nitrate (300 mg L"1) was added to affluent at the 10th weeks until week 14. Date are means of n = 3. Significant differences (P < 0.05) were observed between the percentage of S042~ removal of non-sterilized and sterilized
bioreactors at week 1, 2, 3 and 14 137 Figure 11. Evolution of the physicochemical parameters (A: Dissolved organic carbon
(DOC) expressed in mg L ; B: oxido-reduction potential in mV) of non-sterilized and sterilized bioreactors. Nitrate (300 mg L"1) was added to the affluent at the 10th weeks,
until week 14. Data are means of n = 3 138 Figure 12. Evolution ofthe MPN of sulfate-reducing bacteria (SRB) and anaerobic bacteria
in non-sterilized (A) and sterilized (B) bioreactors, and microbial population expressed as enzyme activity fluorescein diacetate (C). Nitrate (300 mg L"1) was added to the
affluent at the 10th week until week 14. Data are means of « = 3 140 Figure 13. Système en série de traitement des effluents de serre 153
XIX
Liste des abbreviations
ANOVA: analysis of variance
AW: artificial wetland with no carbon source supplemented
AWs: artificial wetlands
AWC: artificial wetland amended with compost
AWC+S: artificial wetland amended with compost as in AWC plus 2 g L_1 sucrose
AWCD: average well color development
DGGE: denaturing gradient gel electrophoresis
DOC: dissolved organic carbon FDA: fluorescein diacetate LAR: leaf area ratio ORP: redox potential
PCA: principal component analysis PCR: polymerase chain reaction PDA: potato dextrose agar AWS: artificial wetland amended with PDB: potato dextrose broth 2 g L sucrose
CFU: coloniy forming unit
CLPP: Community level physiological profile
CWDE: cell wall degrading enzymes
p-OHPAA: p-hydroxy phenyl acetic acid TOC: total organic carbon
TSB: tryptic soy broth SLW: specific leaf weight SRB: sulfate reducing bacteria
CHAPITRE I. INTRODUCTION
1.1 L'eau et l'agriculture
Multiples sont les effets potentiels du changement climatique, notamment sur la disponibilité en eau. En effet, le changement climatique expliquerait environ 20 % de l'augmentation de la pénurie d'eau dans le monde, selon le rapport mondial de l'Unesco pour la mise en valeur des ressources en eau (Unesco, 2003). De surcroît, le changement climatique aggraverait les pénuries d'eau dues à la demande toujours croissante des activités agricoles et industrielles. En ce 21e siècle, le défi fondamental de l'agriculture sera de nourrir le monde sans nuire à l'environnement. La demande globale en produits alimentaires augmente à une vitesse alarmante. Pour soutenir la croissance de la population mondiale, les récentes prédictions de la FAO (2009) suggèrent une augmentation de 40 % de la production agricole d'ici 2030 et de près de 70 % d'ici 2050. L'accroissement de la production agricole a par conséquent entrainé une hausse importante de la consommation des fertilisants. Les engrais utilisés sont le plus souvent des mélanges d'éléments minéraux (azote (N), phosphore (P), potassium (K), calcium (Ca), magnésium (Mg), microéléments et autres éléments accompagnateurs, tels que le sulfate (SO42) et le chlorure (CL)) qui apportent un complément nutritif à la plante pour optimiser son développement. La FAO (2009) prédit que l'utilisation des engrais azotés atteindra 110 à 140 millions de tonnes en 2050, contre 90 millions de tonnes utilisées en 2000. Tous ces éléments, présents dans la solution nutritive, sont absorbés en partie par la plante ou adsorbés par le sol, mais la partie résiduelle excédentaire est éliminée par drainage. Les eaux de drainage d'origine agricole sont souvent contaminées par des éléments nutritifs comme l'azote et le phosphore, des pesticides, des agents pathogènes et des sels. Fréquemment, ces eaux polluées sont rejetées dans l'environnement entraînant de grands bouleversements dans la chaine trophique des écosystèmes aquatiques. Une des conséquences les plus visibles de ces rejets est l'eutrophisation des cours d'eau et la prolifération des algues bleues (ou cyanobactéries). En effet, l'accumulation d'éléments nutritifs stimule la croissance rapide des algues et des plantes aquatiques, restreignant ainsi la quantité d'oxygène et de lumière que peuvent assimiler les autres organismes de l'écosystème. C'est pourquoi de nouvelles pratiques agricoles doivent être développées et testées afin de réduire l'impact agricole sur les ressources en eau. L'utilisation rationnelle de l'eau devient certes une préoccupation
consommation en eau à l'échelle planétaire et en raison de la raréfaction prévisible de cette ressource autant en quantité qu'en qualité, le monde agricole doit trouver des moyens de recycler l'eau de drainage afin de réduire la pollution de la nappe phréatique et des cours d'eau environnants. De tels moyens doivent voir à la réduction nécessaire de la consommation de l'eau.
1.1.1 L'industrie serricole
Afin de répondre à la demande croissante des fruits et légumes frais, les producteurs cultivent davantage sur une très longue saison de production. Cette augmentation est largement visible au Canada où, entre 2009 et 2011, l'industrie des cultures légumières en serre a augmenté de 10 % pour atteindre un chiffre d'affaires de plus de 1 milliard de dollars (Statistique Canada, 2011). Plus de la moitié des serres canadiennes se trouvent dans la province de l'Ontario avec 1 304 hectares (ha) en 2010, suivie par la Colombie-Britannique et le Québec avec des superficies de 1 304 ha et 262 ha (Statistique Canada, 2011). Parmi les quatre principales cultures légumières (tomate, concombre, laitue et poivron), c'est la tomate qui est la plus cultivée.
1.1.2 Les effluents de serre
Lors de l'irrigation des cultures de tomate produites en serre, une partie importante de l'eau enrichie en engrais est rejetée dans l'environnement afin de contrôler la conductivité électrique du milieu de culture et l'équilibre ionique de la solution du sol. En général, les pertes en eau par lessivage peuvent représenter entre 10 % et 30 % du volume d'eau initial d'irrigation et jusqu'à 50 % durant l'été (Dorais et Dubé, 2011). Les eaux de lessivage sont souvent impropres à la réutilisation pour des raisons phytosanitaires et sont riches en éléments minéraux. Les effluents de drainage pour une culture de la tomate représenteraient un volume de 3 000 à 4 500 m3 d'eau par hectare et par an (Brajeul et coll., 2005; Morard et coll., 2004). Ils peuvent contenir une charge appréciable en nutriments, évaluée annuellement à près de six tonnes de sels minéraux (Morard et coll., 2004), mais ces effluents sont généralement très pauvres en carbone (Park et coll., 2008; Prystay et Lo, 2001).
1.1.3 La législation
Actuellement, la majorité des producteurs serricoles ne sont pas encore tenus de préparer un plan de gestion en ce qui concerne l'utilisation des éléments nutritifs. Il est probable que, dans un avenir rapproché, les serristes devront envisager des solutions afin de gérer toutes les solutions de lessivage ou d'eau de ruissellement. Les agriculteurs Québécois sont soumis au règlement sur les exploitations agricoles (Loi sur la qualité de l'environnement; Développement durable, environnement et Parc, Québec) alors que, du côté de l'Ontario, les producteurs doivent maintenant composer avec la loi sur la gestion des éléments nutritifs (Ministère de l'Agriculture, de l'alimentation et des affaires rurales, Ontario). À la suite du scandale de l'eau de Wakertown, les Ontariens se sont dotés d'outils pour mieux répondre aux nouvelles normes environnementales.
1.1.4 La gestion des effluents
De nouvelles pratiques agricoles doivent être développées et testées afin de réduire l'impact agricole sur les ressources en eau. Les exploitations serricoles ont diverses options de base pour gérer les solutions de lessivage provenant des cultures; elles peuvent d'une part, restreindre les eaux de lessivage en se servant de techniques d'irrigation en donnant, par exemple, uniquement la quantité d'eau dont la plante a besoin (Bar-Yosef, 1999 ; Klaring, 2001; Schwarz et coll., 1995 ) ou, d'autre part, recueillir les solutions de lessivage et de les traiter pour enlever les éléments nutritifs, les agents pathogènes et les résidus de pesticides avant de les déverser dans l'environnement ou de les recycler (Lequillec, 2002).
Dans le contexte actuel d'une gestion durable, le recyclage de l'eau de lessivage devient de plus en plus encouragé afin de réduire la pollution de la nappe phréatique et des cours d'eau environnants. En Europe du Nord, des systèmes à circuit fermé sont utilisés avec des techniques d'irrigation dans lesquelles les eaux sont réutilisées pour les mêmes cultures. Ainsi, l'eau qui s'écoule après l'irrigation est récupérée, désinfectée, puis mélangée à une solution nutritive fraiche afin de rééquilibrer les ions.
La composition et la quantité des effluents de serre varient fortement en fonction de différents paramètres comme le type de production, le substrat de culture, les méthodes d'irrigation et les périodes de culture. Peu importe le système utilisé pour recycler l'eau de lessivage, des problèmes majeurs pour la culture peuvent avoir lieu (Bar-Yosef, 2000; Lequillec, 2002). En effet, on observe généralement une surcharge de l'eau lessivée en certains éléments, comme les sulfates, les chlorures et le sodium (Brajeul et coll., 2005; Lequillec, 2002; Magen, 1999; Morard et coll., 2004; Savvas et coll., 2007). Un autre problème observé en système recyclé (fermé), et non le moindre, est la dissémination d'agents pathogènes pour les plantes avec l'utilisation des eaux de lessivage non traitées (Bar-Yosef, 2000; Lequillec 2002). Ces agents peuvent être des bactéries, des champignons ou des virus (Hong et Moorman, 2005; Pagliaccia et coll., 2007; Postma et coll., 2000; Postma, 2004; Tu et coll., 1999).
Dans le développement de systèmes de production durable, il est donc nécessaire de traiter les effluents pour la recirculation afin d'éviter ces problèmes majeurs pouvant mettre en péril la productivité des cultures.
1.2.1 Les ions indésirables
Trois éléments minéraux sont fréquemment retrouvés à des concentrations limitant un recyclage total : les sulfates, le sodium et les chlorures.
Quelques études ont porté sur l'accumulation des ions sulfates dans les eaux recyclées d'irrigation (Cerda et coll., 1984; Grattan et Grieve, 1999; Hao et Papadopoulos., 2002; Voogt et Sonneveld, 1997) et ont démontré que leurs effets sont autant dommageables qu'une eau d'irrigation riche en chlorure ou en sodium (Sharma et Manchanda, 1996; Zahoor et coll., 2008). Les plants de tomates cultivés à des concentrations élevées en sulfates (plus de 500 mg L"1) ont des tiges plus épaisses, des feuilles plus petites et de coloration verte foncée, entraînant une productivité moindre. Ces symptômes deviennent plus prononcés avec une augmentation des concentrations et avec l'âge des plants (Cerda et coll., 1984). Il a été observé que la productivité des plants de tomate diminue de 10 %,
lorsque la concentration en sulfates de la solution nutritive passe de 96 mg L"1 à 1063 mg L" . Au niveau racinaire, les ions sulfates et phosphates sont activement transportés, et il peut y avoir compétition pour le même système de transport entre ces deux ions (Cerda et coll., 1984). En cas d'excès, les ions sulfates forment également des précipités avec les ions calciums, magnesiums et potassiums (Adams, 1971; Lopez et coll., 1996; Voogt et Sonneveld, 1997) et interfèrent dès lors sur l'équilibre des autres ions par un débalancement ionique et une réduction de la disponibilité en calciums, magnesiums et potassiums pour la plante. Qui plus est, il a récemment été observé que, lors d'une irrigation avec une eau enrichie en sulfates, le lessivage des éléments essentiels N, P, K était augmenté (Savvas et Gizas, 2002; Zahoor et coll., 2008).
Bien que les ions sulfates puissent être déjà présents dans l'eau fraiche, l'apport majoritaire en ions sulfates se fait à partir des sources d'engrais. En effet, certains éléments nécessaires au développement de la plante sont amenés sous forme complexée avec l'ion sulfate, par exemple le magnésium sous forme de sulfate de magnésium ou, encore, le potassium sous forme de sulfate de potassium. La concentration d'ions sulfates dans la solution nutritive est alors en excès par rapport à ce que peut absorber la plante (Sonneveld, 1988). Dans les cas de recirculation, cet excès d'ions sulfates s'accumule facilement au cours du temps (Hao et Papadopoulos., 2002; Voogt et Sonneveld, 1997). Par exemple, durant l'expérience menée par Hao et Papadopoulos. (2002), dans un système en recirculation (fermé), la concentration en ions sulfates est passée de 50-100 mg L"1 à 200-250 mg L"1 au cours de la saison de croissance de 176 jours. L'accumulation a été observée après 70-80 jours après la plantation des plants de tomate et a nécessité un apport d'eau claire pour diminuer cet excès d'ions sulfates. Au Québec, le suivi des effluents de culture à l'échelle commerciale a également montré une accumulation importante d'ions sulfates pour des cultures conventionnelles ou biologiques de la tomate de serre (Tableau 1 ; Dorais et coll., 2009).
Eléments minéraux Effluents mg L"1 Eléments minéraux Effluents mg L"1 PO4 J 37,05 + 3,28 Ca2+ 233,28+19,98 N 03 405,61 ± 33,28 Mg2+ 250,00 ± -N 02 10,58 + 4,51 Mn2+ 0,14 + -NH4+ 56,22 ± 4,98 Zn2+ 1,05 +
-so
42~
932,90 + 62,83 Cu2+ 0,07 ± -Cl 84,32+ 12,19 Fe 1,35 + -K+ 549,69 + 83,72*basée sur les analyses minérales effectuées au cours d'une année dans une serre commerciale (Lévesque, 2011).
■y__
Il est de là pertinent de réduire ces ions SO4 afin d'obtenir un équilibre ionique souhaitable en vue de la recirculation des effluents et d'éviter ainsi tout rejet d'eaux usées dans l'environnement à la suite du déséquilibre nutritif.
Les ions sodiums ou chlorures se retrouvent souvent en excès dans l'effluent, voire même dans l'eau fraiche d'irrigation de certains pays arides (Savvas et coll., 2007), mais également du Canada et du Québec. L'osmose inversée permet de réduire efficacement la concentration en sodium de l'eau; par contre, elle est souvent très coûteuse et nécessite un
entretien important (Lequillec, 2002). Le traitement passif et durable du Na+ et Cl" pourrait
faire partie de travaux de recherche ultérieurs. Afin de réduire ces ions, l'utilisation de plantes halophytes dans les marais artificiels serait une solution à envisager.
1.2.2 Les agents pathogènes
Plusieurs agents pathogènes peuvent causer de sérieux problèmes phytosanitaires aux cultures en serre si les effluents de culture sont recirculés sans traitement de désinfection (Hong et Moorma, 2005). Ces agents pathogènes appartiennent à plusieurs groupes, tels que les oomycètes Pythium (Tu et coll., 1999) et Phytophtora (McPherson et coll., 1995), les champignons Fusarium oxysporum (Runia et Amsing, 2001), les bactéries Clavibacter
michiganensis (Huang et Tu, 2001), Pseudomonas corrugat (Scarlett et coll., 1978) et Ralstonia (Alsanius et Bergstrand, 2007), des virus Pépino virus (Fakhro et coll., 2005) ainsi que des nematodes Prathylenchus et Meloidogyne (Alsanius et Brand, 2000). Dans plusieurs cas, l'infection se fait à partir de l'eau recirculée (Stanghellini et Rasmussen,
1994).
Différentes méthodes de désinfection de l'eau ont été mises au point pour les cultures en serre comme l'ozonation, la chloration, le traitement thermique et l'irradiation aux UV, prévenant ainsi les risques de propagation des maladies (Ehret et coll., 2001; Lequillec, 2002), mais éliminant du même coup les microorganismes bénéfiques pouvant jouer un rôle majeur dans la suppression de certaines maladies (Postma et coll., 2000; Postma, 2004; Tu et coll., 1999). De plus, ces techniques, à l'exception du traitement thermique, peuvent difficilement être utilisées de façon efficace pour traiter des effluents de serre contenant une charge importnate en matière organique (p.ex. de cultures biologiques). De plus, un traitement au chlore d'un effluent contenant de la matière organique formera des composés organochlorés hautement cancérigènes. D'autre part, l'utilisation de biofiltres pour traiter les effluents de culture permet de conserver la microflore bénéfique existant dans les solutions de drainage (Déniel et coll., 2004), tout en ayant une très bonne efficacité d'élimination des agents pathogènes (Ehret et coll., 2001). Cependant, l'activité biologique n'est pas immédiate; il faut attendre de deux à six mois afin que les performances de désinfection du biofiltre deviennent maximales (Lequillec, 2002).
Les tableaux 2 et 3 présentent différentes techniques de traitement des eaux généralement utilisées en serriculture ainsi que leurs avantages, inconvénients et taux (%) d'efficacité, d'après les travaux de Ehret et coll. (2001) et de Lequillec (2002).
Traitements chimiques de
désinfection
Avantages Inconvénients (% d'élimination) Efficacité
Peroxyde d'hydrogène (H202) • Peu dispendieux • Aucun résidu • Aucune inquiétude environnementale
• Biocide peu efficace • La matière organique
diminue l'efficacité • Les métaux lourds
catalysent le H202
• Possibilité de phytotoxicité • Interfère avec les
éléments nutritifs • Flore bactérienne totale : 99,0 % • Pythium spp. : 99,9 % • Fusarium oxysporum: 99,9 % Chloration (chlore)/ Bromination (Brome) Peu dispendieux Biocides efficaces Activité résiduelle dans la zone de culture Possibilité de phytotoxicité Interfère avec les éléments nutritifs Contrôle et
manipulation difficile Risque pour la santé humaine • Flore bactérienne totale : 95,4 % • Pythium spp. : 99,9 % • Fusarium oxysporum : 99,6 % Ozonation (Ozone ou03) Aucun résidu Aucune inquiétude environnementale
• Ne contrôle pas tous les agents
pathogènes • Coûts élevés
d'investissement/ d'exploitation • Interfère avec les
éléments nutritifs Flore bactérienne totale : 99,9 % Pythium spp. : 99,9 % Fusarium oxysporum : 99,9 %
Tableau 3. Traitements physiques de désinfection des effluents de serre. Traitements
physiques de désinfection
Avantages Inconvénients Efficacité
(% d'élimination) Irradiation aux UV (Ultra-Violets) Installation compacte Nécessite peu d'espace Plus économique dans bien des cas Utilisé avec de faibles débits d'eau
Les systèmes à débits élevés sont dispendieux d'installation
La matière organique diminue l'efficacité Nécessite beaucoup d'entretien
Interfère avec les éléments nutritifs Flore bactérienne totale : 99,7 % Pythium spp. : 99,9 % Fusarium oxysporum : 99,9 % Chaleur/ Pasteurisation Efficace et fiable Tolère de très grands débits d'eau Contrôle simple des fonctions Exige peu d'entretien
Coût d'installation élevé Coûts d'exploitation élevés
Gros équipement exigeant beaucoup d'espace Besoin d'entreposage de refroidissement Flore bactérienne totale : 98,0 % Pythium spp. : 99,0 % Fusarium oxysporum : 99,1 % Filtration au sable/ Biofiltration lente Coûts d'opération faibles Enlève les contaminants et les agents pathogènes Nécessite beaucoup d'espace d'installation Coûts d'installation élevés
Rentable seulement pour les grosses fermes Nécessite un contrôle continu Flore bactérienne totale : les effluents des biofiltres contiennent 103 to 104UFCmL"' Pythium spp. : 99,9 % Fusarium oxysporum : 99,9 %
Bien que certains systèmes de désinfection et de traitement des eaux soient communément utilisés pour les cultures, ceux-ci n'éliminent pas les sels minéraux excédentaires présents. Une partie de la solution nutritive, lorsque celle-ci est trop chargée en ions S042~, Na+ ou
CL, est alors rejetée dans l'environnement. Les marais filtrants et les bioréacteurs représentent donc des systèmes de traitement biologique et passif pouvant éliminer certains minéraux excédentaires présents dans les effluents, tout en réduisant le risque de propagation des agents pathogènes (Kadlec et Wallace, 2009).
1.3 Les systèmes biologiques passifs de traitement des effluents : les marais filtrants artificiels et les bioréacteurs
1.3.1 Principe des systèmes passifs de traitement des effluents
Le principe des systèmes passifs de traitement consiste à faire circuler les eaux de drainage au travers des matériaux ou systèmes vivants. Ces systèmes sont constitués par un milieu solide servant à la fois de support à la croissance microbienne et de filtre. Les polluants (azote, sulfates, etc.) et les agents pathogènes sont enlevés de la phase aqueuse par différents mécanismes physiques, chimiques et biologiques (Stevick et coll., 2004). Les microorganismes présents sur le support utilisent les composantes de l'eau à traiter comme source de nourriture pour leur croissance et transforment ainsi la matière soluble en biomasse, en sous-produits de dégradation et en matière gazeuse. Ils sont d'ailleurs responsables de la formation de biofilm et de la production de composés secondaires (enzymes, antibiotiques), pouvant avoir des effets antagonistes (Cadoux et coll., 2000) contre certains agents pathogènes.
1.3.2 Les caractéristiques des systèmes
La composition du matériel filtrant doit correspondre à certains critères afin que celui-ci puisse adéquatement être utilisé dans un système passif de traitement des eaux. Le matériel filtrant doit représenter une source de nutriments (N, P, K, S) et de carbone organique nécessaire à la croissance de la biomasse, doit avoir une surface spécifique élevée permettant d'optimiser les transferts de matières entre la phase solide, liquide et gazeuse et favoriser la fixation et la croissance des microorganismes, doit avoir une capacité de rétention d'eau acceptable pour la croissance bactérienne et, finalement, doit maintenir une flore microbienne abondante et diversifiée (Malhautier, 2003).
En outre, la composition chimique et les paramètres physiques du matériel choisi comme la taille des particules, l'espace des pores, le degré d'irrégularité sont importants et peuvent avoir une influence sur le traitement des effluents (Stottmeister et coll., 2003). La roche volcanique est un matériel adéquat puisqu'elle est inerte, poreuse et rugueuse (Lequillec, 2002). De plus, avec sa faible granulométrie, les surfaces d'échanges sont importantes, ce qui favorise une filtration efficace et une bonne vitesse d'écoulement.
11 1.3.3 Les marais filtrants
Les marais épurateurs représenteraient une alternative biologique en ce qui concerne le traitement des effluents agricoles. C'est un système naturel d'épuration susceptible d'éliminer presque totalement les nitrates, les phosphates et les ions indésirables, comme le sulfate présent dans les eaux lessivées de la culture (Kadlec et Wallace, 2009). Les éléments polluants sont traités au cours de l'écoulement de l'eau usée dans les marais filtrants artificiels. Ce sont les interactions multiples entre les plantes, les microorganismes et le substrat qui permettent aux marais artificiels d'être des systèmes autosuffisants, nécessitant peu d'énergie et offrant une solution durable à l'épuration des eaux (Stottmeister et coll., 2003; Vymazal et coll., 1998; Werker et coll., 2002). De plus, comparativement aux procédés traditionnels de traitements des eaux, les marais artificiels ont un faible coût d'installation et d'exploitation ainsi qu'une facilité d'utilisation (Stottmeister et coll., 2003).
Les marais artificiels consistent simplement en un bassin rectangulaire pourvu d'une membrane étanche, de dimension restreinte et planté de macrophytes. Il existe plusieurs sortes de marais artificiels, classées selon trois types d'architecture ayant chacune leurs caractéristiques propres (Faulwetter et coll., 2009; Kadlec et Wallace, 2009), soit :
1. les marais surfaciques à flux horizontal, où l'eau s'écoule horizontalement au-dessus de la surface du sol;
2. les marais à flux vertical, où l'apport des effluents se fait verticalement par percolation à travers la matrice plantée;
3. les marais sous surfacique à écoulement horizontal au-dessous de la surface du marais.
Ce dernier type de marais est généralement anaérobie, comprenant des zones d'anoxies et d'aérobies. C'est généralement ce type de système qui est préconisé en climat froid parce que l'eau s'écoulant sous la surface est protégée des basses températures atmosphériques (Wallace et coll., 2001).
Différentes études ont précédemment montré une bonne efficacité des marais à réduire les ions nitrates présents dans différentes eaux usées. Lin et coll. (2002) ont estimé, par exemple, une réduction des nitrates de 70 % à 90 % pour un effluent aquacole. Une réduction des nitrates quasi-complète, présent dans un effluent de serre avec une concentration de 400 mg L"1, été observée par Lévesques (2011). Toutefois, la réduction des sulfates par les marais filtrants est généralement plus faible, plus spécifiquement autour de 50 % (Wiessner et coll., 2005).
1.3.4 Les bioréacteurs
Ces systèmes sont inspirés du principe du marais anaérobie, mais sont dépourvus de végétaux. Les bioréacteurs dépendent donc strictement de l'activité des microorganismes. Un bioréacteur est formé d'une cuve fermée contenant une couche de matière organique afin de soutenir la croissance des microorganismes effectuant le traitement. L'effluent à traiter est déversé en haut de la cuve et franchit la couche de matière organique par écoulement vertical. Après avoir traversé une couche de gravier drainant, 1'effluent quitte la cuve par le bas (Melanson, 2006).
Les bioréacteurs passifs sulfato-réducteurs, avec une conception relativement simple et peu coûteuse, ont démontré leur efficacité à court terme (3-5 ans) pour le traitement d'effluents miniers très riches en sulfates et en métaux (Neculita et coll., 2007; Neculita, 2008; Tsukamoto et coll., 2004; Zagury et coll., 2006). Ces bioréacteurs, dont le substrat était composé de sciure ainsi que de copeaux de bois, de compost de feuilles et de volaille, ont permis de réduire des concentrations initiales de sulfate de 5500 mg L"1 à moins de
1 mg L"1 (Neculita et Zagury, 2008). D'autres bioréacteurs ont réduit le contenu en nitrate de 30 % à 70 % (Christianson et coll., 2011). Les bioréacteurs peuvent de ce fait représenter une technologie intéressante afin de traiter les effluents de serre orsque l'espace est restreint ou en complément aux marais.
1.3.5 Le rôle des plantes dans les marais filtrants
Les végétaux utilisés dans les marais sont choisis pour leur affinité par rapport aux milieux aquatiques, au climat de la région et à leur tolérance à l'égard de certains composants tels les ions S042~ (Gravel et coll., 2011; Lévesque, 2011). La présence d'eau au niveau des
13 racines des macrophytes représente un stress, car elle empêche la diffusion de gaz au niveau des racines. Certaines plantes se sont alors adaptées en développant un tissu aérenchyme permettant le transport d'oxygène au niveau des racines et des rhizomes. La majorité de l'oxygène est utilisée par les racines et les rhizomes, mais comme ceux-ci ne sont pas complètement étanches, une partie de l'oxygène est alors perdue dans la rhizosphère (Brix, 1994, 1997). Cette perte d'oxygène racinaire est suffisante pour pallier à la demande des dégradations aérobies comme la nitrification de l'ammonium (Vymazal, 2005). Toutefois, cette zone aérobie autour des racines reste très limitée, soit de 1-3 millimètres (Vymazal, 2005).
La plante a également un autre effet sur le marais par les produits de la rhizodéposition (exsudats, mucigels, cellules mortes, etc.) qui sont responsables de plusieurs processus biologiques qui prennent place dans la rhizosphère. La composition de ces exsudats racinaires est variée; certaines substances sont des sucres, des vitamines (thiamine, riboflavine, pyridoxine), des acides organiques (malate, citrate, acides aminés), mais aussi des composés phénoliques et d'autres composants organiques (Stottmeister et coll., 2003). Ces substances dépendent cependant de l'espèce de la plante. Les produits de la rhizodéposition peuvent ainsi être utilisés par les microorganismes et stimuler leur croissance. Dans un marais filtrant, les plantes n'absorbent que 0,2 % à 5 % de certains éléments (N, P, Pb, Cu, Zn, Cd) (Brix, 1997), mais assurent surtout un support aux microorganismes qui décomposent la matière organique en suspension et les composés présents, tels que le nitrate et le sulfate.
Des études ont démontré que la présence de plantes dans les marais filtrants artificiels améliorent l'épuration (Fraser et coll., 2004; Picard et coll., 2005). En effet, Hatano et coll. (1993) et Munch et coll. (2005) ont d'ailleurs mesuré une densité microbienne de 10 à 100 fois plus importante dans les marais plantés par rapport aux marais non plantés.
1.3.6 Les microorganismes dans les marais filtrants et les bioréacteurs Les marais filtrants et les bioréacteurs offrent un environnement favorable au développement des microorganismes qui assurent en grande partie l'épuration des eaux
usées (Truu et coll., 2009). Deux groupes de microorganismes jouent un rôle important dans l'épuration des eaux usées : les bactéries et les champignons. Ils assurent l'assimilation, la transformation et le recyclage des éléments présents dans les eaux usées par divers métabolismes (Kadlec et Wallace, 2009).
Généralement, les microorganismes présents sont classés selon leur métabolisme. Les bactéries chimioautotrophes ne requièrent que du CO2 comme source de carbone et obtiennent leurs énergies en oxydant des substances inorganiques. Ces bactéries chimioautotrophes ont un rôle important dans l'épuration des eaux usées. À titre d'exemple, les bactéries Nitrosomonas oxydent l'ammonium en nitrite et les bactéries Nitrobacter oxydent le nitrite en nitrate. Toutefois, la majorité des microorganismes présents dans les marais filtrants et les bioréacteurs sont chimiohétérotrophes et doivent consommer des molécules organiques afin d'obtenir énergie et carbone. Ce sont les conditions d'oxydoréductions (redox) qui prévalent dans le milieu qui favorisent certains groupes de microorganismes et leur métabolisme (Faulwetter et coll., 2009). Cela sera d'ailleurs davantage développé plus loin.
1.3.7 Les cycles biochimiques dans les marais filtrants et les bioréacteurs passifs
1.3.7.1 L'oxygène
Les marais filtrants et les bioréacteurs passifs représentent un environnement idéal aux transformations chimiques, car on y retrouve naturellement un large gradient d'états oxydatifs mesuré par le potentiel d'oxydo-réduction (ORP). La concentration des molécules d'oxygène libres décroît rapidement avec la profondeur sous l'action des microorganismes qui consomment la matière organique présente. Un haut potentiel redox (ORP > 300 mV) est associé à un environnement oxydé et favorise les processus aérobies, comme la nitrification. En revanche, les potentiels redox bas (ORP < 100 mV) sont liés à des conditions réductrices et promeuvent des processus anaérobies, comme la dénitrification et la réduction du sulfate. Le type de respiration microbienne suit en ce sens une séquence prévisible au sein de la gamme du potentiel d'oxydoréduction (Faulwetter et coll., 2009; Vymazal, 2008).
15 Plus précisément, les sédiments des marais ont un gradient redox compris entre - 300 mV (zone fortement réduite) et + 700 mV (zone très oxydée) (Gambrell et Patrick, 1978). La décroissance du potentiel redox dans les marais est, dans la majorité des cas, verticale parce que la source principale de molécules d'oxygène libres provient de la diffusion atmosphérique au niveau de la surface du marais et au niveau de la rhizosphère des plantes macrophytes. C'est tout le long de ce gradient qu'ont lieu les différentes réactions métabolisées par des microorganismes, comme la dénitrification (+ 100 mV < ORP < + 350 mV), la réduction des sulfates (- 200 mV < ORP < - 100 mV) ou, encore, la fermentation (- 350 mV < ORP < - 100 mV). Dans les bioréacteurs passifs, c'est un gradient redox compris entre - 100 mV et - 200 mV qui est attendu (Neculita et coll., 2007). Ce sont ainsi des réactions anaérobies qui sont favorisées dans ce type de système de traitement des eaux.
Cette combinaison de différents potentiels redox permet d'avoir un ensemble de réactions conférant aux systèmes passifs de traitement de grands avantages comparativement aux autres technologies de traitement des eaux (Kadlec et Knight, 1996).
1.3.7.2 Le carbone
Dans les marais filtrants et les bioréacteurs, le cycle du carbone est d'une importance majeure puisque la majorité des microorganismes sont chimiohétérotrophes. Ces microorganismes sont en effet responsables de la dégradation d'une grande variété de composés organiques. Certains de ces composés sont facilement dégradés (glucose, sucrose, etc.) et utilisés par de nombreux microorganismes alors que d'autres composés sont plus récalcitrants et nécessitent l'action combinée de plusieurs groupes de microorganismes. De fait, certains microorganismes produisent des enzymes extracellulaires (proteases, cellulase, etc.) qui hydrolysent ces macromolécules en composé de taille facilement assimilable par d'autres microorganismes (Presser, 2006).
Les effluents de serres à traiter par les marais filtrants et les bioréacteurs sont certes relativement pauvres en carbone (Park et coll., 2008; Prystay et Lo, 2001). Le carbone devient par le fait même la ressource limitante pour les processus microbiologiques chimiohétérotrophes telles la dénitrification et la réduction du sulfate.
À ce sujet, Gagnon et coll. (2010) ont montré que l'apport de carbone exogène (saccharose) dans un marais filtrant à une teneur de 815 mg DOC L"1 (DOC : demande chimique en oxygène) permettait de réduire 65 % plus de nitrate que sans aucun apport de carbone exogène pour une concentration initiale de 230 mg L"1 de nitrate. De même, Lévesque (2011) a comparé l'efficacité de traitements des effluents de serre entre des marais filtrants avec ou sans l'ajout de saccharose et a montré que les marais ayant reçu une source de carbone ont été plus efficaces à éliminer les nitrates et les sulfates. De leur côté, Neculita et coll. (2007) ont répertorié les différentes sources de carbone utilisées pour des bioréacteurs passifs et leur efficacité respective à réduire les sulfates. Il en ressort qu'un bioréacteur passif, dont la source de carbone était du methanol, réduisait le sulfate à 60 % alors qu'un bioréacteur, où le carbone était apporté sous forme d'un mélange de copeaux de bois, de compost de feuille et de fumier de volaille, réduisait les sulfates à 20 %. Toutefois le choix de la source de carbone repose aussi sur sa disponibilité et son coût. L'utilisation d'une source de carbone locale et durable est souvent favorisée.
Des rapports ont ainsi été estimés pour permettre une réduction de certains éléments par les microorganismes chimiohétérotrophes. Par exemple, pour avoir une bonne réduction des nitrates par dénitrification, un rapport C :N de 2,5 à 5 est nécessaire pour traiter des eaux urbaines (Zhao et coll., 2010). Pour obtenir une bonne réduction des sulfates, c'est un rapport carbone organique dissous (COD) :SÛ4 compris entre 0,32 et 0,38 qui est suggéré par Neculita et coll. (2008).
L'apport et la sélection d'une source de carbone exogène sont donc importants afin d'assurer la performance et l'efficacité du traitement des eaux usées par les marais et les bioréacteurs (Cocos et coll., 2002; Zagury et coll., 2006).
1.3.7.3 L'azote
L'élimination de la pollution azotée est réalisée par différents microorganismes. Les chimioautotrophes oxydent l'ammoniac en nitrite, qui est oxydé à son tour en nitrate. Ces réactions de nitrification nécessitent la présence d'oxygène (ORP = + 300 mV, pH = 7,2 -9) et se réalisent ainsi dans la zone aérobie du système de traitement des eaux usées (Kadlec
17 et Wallace, 2009; Reddy et DeLaune, 2008). Toutefois, cette réaction ne sera pas favorisée dans nos systèmes passifs de traitements, majoritairement anaérobies.
La dénitrification est réalisée par les microorganismes chimiohétérotrophes, tels que Pseudomonas et Bacillus, qui utilisent le nitrate comme accepteur final d'électron et produisent successivement le protoxyde d'azote (N2O) et le gaz nitrogène (N2). Cette réaction nécessite une source d'énergie carbonée et des conditions anaérobies (+ 100 mV < ORP < + 300 mV; pH= 6-8) (Paul et Clark, 1989; Reddy et DeLaune, 2008). C'est cette seconde réaction qui nous intéresse étant donné la composition de notre effluent de serre riche en nitrate. En l'absence de conditions optimales (faible rapport C :N ou potentiel redox ORP > + 300 mV), la dénitrification peut être incomplète, résultant en l'émission de N2O qui constitue un gaz à effet de serre important (Kadlec et Wallace, 2009; Lévesque, 2011).
La réduction du nitrate en ammoniac (Dissimilatory Nitrate Reduction to Ammonia -DNRA) est aussi possible, mais sous certaines conditions spécifiques (Reddy et DeLaune, 2008), telles qu'en condition encore plus anaérobie (ORP < 0 mV). Le nitrate est transformé en NO2 et par la suite en NH4. Ce procédé de transformation est créé par des bactéries anaérobies facultatives et obligatoiresavec des métabolismes impliqués dans la fermentation. Les espèces de bactéries impliquées dans ce processus sont Clostridium et Bacillus (Tiedje, 1988). L'activité de la DNRA est possible lorsque le ratio C :N est élevé dans le marais.
Aussi, un autre type de respiration nommée Anaerobic ammonia oxidation permet l'oxydation de NH4 en nitrite par des bactérie dites anamox en condition anaérobie (Mulder et coll., 1995).
1.3.7.4 Le soufre
Dans les marais filtrants et les bioréacteurs, le cycle du soufre est caractérisé par une série de réactions faisant intervenir un certain nombre de microorganismes. En ce qui a trait aux ions sulfates, ils sont réduits lorsque le potentiel redox est compris entre - 100 et - 200 mV (Kadelec and Wallace, 2009). Cette réaction est ainsi réalisée par des microorganismes
anaérobies, tels que les Desulfovibrio spp. Les bactéries utilisent les ions sulfates comme accepteurs terminaux d'électrons en respiration anaérobie selon l'équation qui suit.
4H2 + S042~ -> H2S + 2H20 + OH"
Les principales pertes de soufre se font par l'atmosphère via le sulfure d'hydrogène (H2S). Cependant, les sulfures d'hydrogène peuvent être oxydés en soufre élémentaire ou en sulfate par certains microorganismes chimioautotrophes (p. ex., Thiobacillus sp) en milieu aérobie selon l'équation suivante.
2H2S + 02 -> 2S + 2H20
La toxicité du sulfure d'hydrogène est bien connue. En effet, des concentrations de sulfure d'hydrogène de plus de 0,5 mg L"1 ont eu des effets toxiques sur les microorganismes alors que des concentrations comprises entre 10 et 50 mg L"1 ont eu des effets nuisibles sur les plantes (Armstrong et coll., 1996; Chambers et coll., 1998; Wiessner et coll., 2008a,b). Afin de réduire sa toxicité et sa disponibilité, le sulfure d'hydrogène peut précipiter avec des métaux. L'immobilisation du sulfure d'hydrogène par le fer, le cuivre ou le zinc est d'ailleurs bien documentée (Jorgensen, 1982; Zagury et coll., 2006).
Le sulfate présent dans les marais, provenant des effluents ou même des pluies acides, subit une réduction avec la présence de matière organique selon l'équation :
2CH20 + S042" + H+ -» 2C02 + HS~ + H20
Cette réduction est généralement opérée par la bactérie sulfato-réductrice (BSR) et a tendance à alcaliniser le milieu (Zagury et coll., 2006). Ces bactéries sont d'une grande importance pour le cycle du soufre et peuvent être responsables de plus de 50 % de la dégradation de la matière organique dans les milieux à forte concentration de sulfate (Detmers et coll., 2004; Jorgensen, 1982; Leloup et coll. 2005; Li et coll., 1999). Cette réaction nécessite une source d'énergie carbonée et des conditions anaérobies (- 200 mV < ORP < - 100 mV; pH= 5-8) (Faulwetter et coll., 2009; Willow et Cohen, 2003). L'utilisation des BSR représente une alternative pour éliminer le sulfate des eaux usées à traiter. D'ailleurs, l'utilisation de marais filtrant ou de bioréacteurs associés aux BSR est
19 déjà largement répandue pour le traitement des résidus miniers à forte concentration de sulfate (Kadlec et Wallace, 2009; Neculita et coll., 2007; Reynols et coll., 1997). La BSR n'est cependant pas capable d'oxyder directement des molécules de carbone organiques complexes comme les polysaccharides, les protéines, la cellulose et l'hémicellulose. En présence de ces sources de carbone, c'est la synergie entre plusieurs groupes de microorganismes qui permettront de rendre accessible des molécules de carbone à courte chaîne à la BSR (Neculita et coll., 2007).
1.3.8 La dénitrification et la sulfato-réduction
En présence de nitrate, la réduction des ions sulfates par la BSR est limitée (Barton et Hamilton, 2007; Greene et coll., 2003; Mccready et coll., 1983; Moura et coll., 1997). En effet, dans les sédiments anaérobies, la dénitrification est la réaction la plus énergétiquement favorable en l'absence d'oxygène. Étant beaucoup moins énergétique, la réduction des ions sulfates a lieu lorsque le milieu ne contient plus de nitrate (Moura et coll., 1997; Whitmire et Hamilton, 2005). Par ailleurs, la dénitrification est réalisée par des bactéries anaérobies facultatives qui transforment le nitrate en nitrite en condition d'anoxie. Cette dénitrification nécessite une ressource carbonée dont l'accès peut représenter une zone de compétition avec la BSR, surtout lorsque cette ressource est limitée. Les nitrites alors produits lors de la dénitrification peuvent de plus inhiber et éliminer les populations de BSR présentes (Greene et coll., 2003).
1.3.9 La réduction des agents pathogènes
Les marais filtrants et les bioréacteurs s'avèrent être de bons moyens pour réduire les agents pathogènes présents dans les eaux usées. Le traitement biologique des eaux combine à la fois des processus physiques (filtration à travers le matériel, adsorption au niveau du biofilm, sédimentation), des processus chimiques (enzymes extracellulaires, antibiotiques) et des processus biologiques (activités antagonistes des microorganismes : compétition, prédation, etc.) dont l'efficacité est démontrée depuis les années 1990 (Ehret et coll., 2001; Postma et coll., 2000; Rey et coll. 1999; van Os, 1999; Wohanka, 1995). Toutefois, il est difficile d'estimer la proportion de chacun de ces processus dans l'élimination des pathogènes, étant donné qu'ils sont interreliés. Le biofilm, responsable de 1'adsorption, est produit par certains microorganismes qui peuvent excréter des composés secondaires,