HAL Id: dumas-01701262
https://dumas.ccsd.cnrs.fr/dumas-01701262
Submitted on 5 Feb 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Mise au point sur la biochimie et les implications du
sélénium en pathologie
Isabelle Joubert
To cite this version:
Isabelle Joubert. Mise au point sur la biochimie et les implications du sélénium en pathologie. Sciences pharmaceutiques. 1998. �dumas-01701262�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteurD
1111111
,~1ï~11nn111111
·
L
t_--C/
<-~ ,,~
UNIVERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
Année: 1998
N° D'ordre :
.:te
0'r-MISE AU POINT SUR LA BIOCHIMIE ET LES
IMPLICATIONS DU SELENIUM EN PATHOLOGIE
THESE
PRESENTEE POUR L'OBTENTION DU DOCTORAT EN PHARMACIE
DIPLOME D'ETAT
JOUBERT ISABELLE
THESE SOUTENUE PUBLIQUEMENT, le 16 Janvier 1998
à 18 heures.
DEY ANT LE JURY CO:MPOSE DE :
Mademoiselle le maître de conférence Pascale GUIRAUD (HDR), Président du Jury Madame le docteur Véronique DUCROS, Pharmacien Biologiste, PH
Madame le docteur Pascale JOLY, Pharmacien d'officine [Données à caractère personnel]
UNIVERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
Année: 1998
N° D'ordre:
MISE AU POINT SUR LA BIOCHIMIE ET LES
IMPLICATIONS DU SELENIUM EN PATHOLOGIE
THESE
PRESENTEE POUR L'OBTENTION DU DOCTORAT EN PHARMACIE
DIPLOME D'ETAT
JOUBERT ISABELLE
THESE SOUTENUE PUBLIQUEMENT, le 16 Janvier 1998
à
18 heures.
DEVANT LE JURY COMPOSE DE :
Mademoiselle le maître de conférence Pascale GUIRAUD (HDR), Président du Jury Madame le docteur Véronique DUCROS, Pharmacien Biologiste, PH
Madame le docteur Pascale JOLY, Pharmacien d'officine [Données à caractère personnel]
UNNERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
Domaine de la Merci 38700 LA TRONCHEDoyen de la Faculté M. le Professeur A. FAVIER Vice Doyen M. le Professeur J. CALOP
PROFESSEURS DE PHARMACIE
AGNIUS-DELORD Claudine Physique Pharmacie ALARY Josette Chimie Analytique BAKR! Abdelaziz Pharmacie Galènique
BENOJT-GUYOD jean-Louis Chimie Toxicologie et Eco-toxicologie CALOP jean Pharmacie Clinique et Bio-technique CUSSAC Max Chimie Thérapeutique
DEMENCE Pierre Physiologie/Pharmacologie DROUET Emmanuel Bactériologie
FA VIER Alain Biochimie
COULON Chantal Physique-Pharmacie GRILLOT Renée Parasitologie
LECLERC Gérard Chimie Organique MARIOTTE Anne-Marie Pharmacognosie
ROCHAT Jacques Hygiène environnement Droit et Economie Pharmaceutiques
ROUSSEL Anne-Marie Biochimie
SElG LE-MURA ND! Françoise Botanique et Cryptogamie ST El MAN Régine Biologie Cellulaire
REMERCIEMENTS
Je remercie Mademoiselle GUIRAUD d'avoir suivi mon travail tout au long d'une année. Je tiens à exprimer mes sincères remerciements à Madame JOLY et Madame DU CROS, membres du jury, pour leur aimable participation.
Je tiens aussi à remercier toutes les personnes qui m'ont apporté leur aide pour la réalisation de cette thèse.
INTRODUCTION I - GENERALITES
A - Historique
SOMMAIRE
B - Propriétés physico-chimiques C - Aspects nutritionnels du sélénium
1 -Le sélénium dans la nature 2 -Apports 3 -Besoins II - LA BIOCI-IlMIE DU SELENillM A - Métabolisme du sélénium 1 -Absorption intestinale 2 -Transport 3 -Distribution 4 -Métabolisme
5 - Incorporation du sélénium dans les protéines 6 -Elimination
Conclusion
B - Les fonctions biochimiques du sélénium
1 -Sélénoprotéines procaryotes 2 -Sélénoprotéines eucaryotes
2.1 -La GPX
2.2 - L' iodothyronine 5 '-désiodase de type 1 2.3 - La sélénoprotéine P 2.4 - La sélénoprotéine du muscle 2. 5 - La sélénoprotéine kératinoïde 1 2 2 2 4 4 6 9 10 10 10 11 11 13 15 18 18 18 19 20 20 29 31 32 32
2.6 - La thiorédoxine réductase 33 2. 7 - Cytochrome P450 à sélénium 34
2.8 - Sélénodiglutathion 34
Conclusion 3 5
C - La lutte contre les effets des radicaux libres 3 5 1 - Les radicaux libres : définition 3 5 2 - Production des radicaux libres 3 6 3 - Conséquences de l'attaque radicàlaire : grands désordres
structuraux et fonctionnels 3 8
4 - Les moyens de défense 40
Conclusion 43
III - IMPLICATIONS DU SELENIUM DANS DIFFERENTS PROCESSUS
PHYSIOLOGIQUES ET PATHOLOGIQUES 44 A- Cancer 44 1 - Preuves épidémiologiques 45 1.1 - Etudes géographiques 45 1.2 - Etudes cas-contrôles 46 1.3 - Etudes retrospéctives 47 1.4 - Etudes sur la supplémentation en sélénium 49 2 - Mécanismes d'action du sélénium dans la prophylaxie
du cancer 52
2.1 - Action antioxydante du sélénium dans la
cancerogènése 52
2.2 - Action sur le métabolisme des carcinogènes 53 2.3 - Effets sur la croissance cellulaire 54 2.4 - Inhibition de l'activation d'oncogènes 57 2.5 - Effet sur l'immunité 58 2.6 - Capacité d'antagoniser des métaux lourds 59
B - L'inflammation 1 -Rappels
2 - Intervention du sélénium
3 - Statut en sélénium dans l'inflammation 4 - Effet de la supplémentation en sélénium C - Atteintes cardio-vasculaires 1 -Maladie de Keshan 2 - Maladies cardio-vasculaires D - Mucoviscidose 1 -Présentation de la maladie 2 - Carence séléniée E-Diabète
1 -Défenses antiradicalaires lors du diabète 2 - Sélénium et diabète
Conclusion F - Dermatologie
G - Insuffisance rénale chronique
1 -Le statut en sélénium de l'urémique 2 - Causes possibles de cette diminution 3 -Effet de la supplémentation en sélénium Conclusion H- S.I.D.A. 1 -Rappels 60 60 62 64 65 66 66 67 71 71 72 77 77 77 79 79 ~ 81 82 83 83 83 84 84 2 - Implication du stress oxydatif chez le HIV
+ -
Statut en séléniumet autres antioxydants 85
2.1 - Marqueurs biologiques du stress oxydant 86 2.2 - Mécanisme physio-pathologique à l'origine
d'un stress oxydant
2.3 - Activation du NFkB par un stress oxydant 2.4 - Stress oxydant et apoptose
2. 5 - Les déficits nutritionnels
86 87 87
3 - Effet de la supplémentation en sélénium Conclusion I - Vieillissement Conclusion IV - LA TOXICITE DU SELENIUM Introduction
A - Toxicité cellulaire et tissulaire B - Toxicité animale 1 - Toxicité aiguë 2 - Toxicité chronique C - Toxicité humaine 1 - Toxicité aiguë 2 - Toxicités chroniques
3 - Toxicité des granions de sélénium
D - Produits en cause, mécanisme de la toxicité et traitement 1 - Produits en cause 2 - Mécanisme de la toxicité 3 - Traitement Conclusion 90 92 92 93 94 94 95 98 98 99
100
100 100 102103
103 104 104 105 V LE SELENIUM EN THERAPEUTIQUE ET EN PROPHYLAXIE NUTRITIONNELLECONCLUSION BIBLIOGRAPHIE
INDEX DES ABREVIATIONS INDEX DES TABLEAUX INDEX DES FIGURES
SERMENT DES APOTHICAIRES RESUME
106
110 112125
127
128
130
131INTRODUCTION
Le sélénium (Se) est un oligo-élément essentiel, très important pour l'organisme. De nombreuses enquêtes épidémiologiques ont montré une carence en Se dans un certain nombre de pathologies liées au vieillissement cellulaire.
Le Se est un régulateur du processus dégénératif lié à la sénescence. En effet, il entre dans la constitution de la glutathion peroxydase, une enzyme participant à la dégradation des peroxydes. L'étude du rôle thérapeutique du Se se développe. On peut opposer cet aspect au contexte nutritionnel qui reste toutefois intéressant.
En tant qu'agent antioxydant, le Se fait partie de tout un groupe de produits (vitamine E, vitamine C,
B
carotène, cuivre, zinc, manganèse) que le pharmacien d'officine peut proposer en supplémentation pour retarder le vieillissement des cellules, prévenir certaines maladies telles que le cancer, les maladies cardio-vasculaires.Dans ce travail, nous nous intéresserons à l'aspect nutritionnel du Se, à son métabolisme et à sa biochimie, en particulier les sélénoenzymes. Nous traiterons ensuite des pathologies liées à l'attaque radicalaire où le Se est largement impliqué, et nous conclurons sur la possibilité d'une supplémentation pharmacologique en Se.
1 - GENERALITES
A - HISTORIQUE
- 1295 : Marco Polo décrit les effets néfastes du Se. (Sélénose aiguë du bétail au Sud Est de la Chine)
- 1917 : Berzélius isole le Se.
- 1957 : Schwarz et Foltz découvrent que le Se, associé à la vitamine E et à des acides aminés soufrés, est capable de prévenir la dégénérescence nécrotique du foie chez le rat.
- 1973 : Rotruck et al. démontrent la présence du Se dans le centre actif de l'enzyme glutathion peroxydase (GPX) des mammifères.
C'est à partir de cette année que le Se a suscité un vif intérêt aussi bien en alimentation animale qu'humaine.
Son rôle essentiel chez l'homme n'a été mis en évidence que dans les années 80 par des supplémentations avec le sélénite de sodium montrant la réversibilité des manifestations cliniques liées à une carence en Se : douleurs musculaires, cardiomyopathie endémique de Keshan.
Depuis lors, un grand nombre de travaux ont été entrepris pour caractériser les états de carence en Se chez l'homme, d'origine nutritionnelle ou pathologique, et pour approfondir le rôle du Se comme facteur de risque dans le développement des pathologies telles que le cancer, les affections cardio-vasculaires et/ou les maladies dégénératives, les maladies virales.
B - PROPRIETES PHYSICO-CHIMIQUES
Le Se est un élément du groupe VI B de la classification périodique, avec l'oxygène, le soufre, le tellure et le polonium.
Tableau 1 : Caractéristiques physico-chimiques du Se Numéro atomique : 34
Masse atomique : 78,96
Degré d'oxydation: -2 (Séléniure) 0 (Se élémentaire) +4 (Sélénite) +6 (Sélénate) Point de fusion : 217° C Point d'ébullition: 685° C Masse volumique: 4,79 g/cm3
Du point de vue chimique, le Se ressemble au soufre.
Il se présente dans la nature sous forme de six isotopes stables comme indiqué dans le tableau 2.
Tableau 2 : Abondance naturelle des six isotopes stables du Se (36)
Isotope Abondance % Se 74 0,89 Se 76 9,36 Se 77 7,63 Se 78 23,78 Se 80 49,61 Se 82 8,73
Il existe aussi de nombreux isotopes radioactifs (Se79, Se81 ... ) mais le plus utilisé en
expérimentation est le Se75, émetteur de rayons
y,
à demi-vie courte de 120 jours.Les principales formes chimiques du Se dans la nature sont regroupées dans le tableau 3.
Tableau 3 : Formes chimiques du sélénium dans la nature - Sélénium métallique. - Sélénium minéral. H2Se H2Se03 H2Se04 Cd Se - Sélénium organique. Sélénol Sélénoéther Hydrure de sélénium
Acide sélénieux (dont le sel : sélénite Seol- ) Acide sélénique (dont le sel : sélénate Seo/-) Séléniure de cadmium
R-Se-H R-Se-R Séléno-amino-acides (Se remplace S) :
sélénométhionine; DL ou L CH3-Se-CH2- CH2-CH(-NH2)-COOH sélénocystéine HSe-CH(-NH2)-COOH sélénocystine COOH-(NH2-)CH-CH2-Se-S-CH2-CH(-NH2)-COOH Intermédiaires métaboliques : sélénodiglutathion sélénopersulfite sélénohomocystéine sélénocystathionine diméthyl séléniure ion triméthylsélénium Sélénoprotéines : G-S-Se-S-G G-S-Se-H HSe-CH2-CH2-CH(-NH2)-COOH HOOC-(H2N)HC-CH2-CH2-Se-CH2-CH
•
CH3-Se-CH3 (Nli2) + 1 (CH3)3 Se COOHformate déshydrogénase, glycine réductase, acide nicotinique, hydroxylase, thiolase, chez certains végétaux
protéines M, S, X et un cytochrome à sélénium, chez certains mammifères
glutathion peroxydase, chez l'homme Divers:
6 sélénopurine, Se-propyl ARNt, facteur 3 de la coagulation.
C - ASPECTS NUTRITIONNELS DU SELENIUM
1 -
Le Sélénium dans la nature
L'élément est largement distribué dans la croûte terrestre, mais sa teneur dans les sols varie considérablement d'une région à l'autre du globe. Des teneurs inférieures à 0,1 µg/g sont rencontrées dans des régions dites pauvres en Se ou séléniprives, telles la Nouvelle-Zélande, certaines régions de Chine ou la Finlande (86).
Un déficit en cet élément entraîne chez de nombreuses espèces animales des maladies graves : diathèse exsudative du poulet, dystrophie musculaire chez le porc, le veau, l'agneau. Les pertes économiques dues
à
ces maladies ont entraîné dans ces pays l'addition de Se à l'alimentation animale, ce qui a fait disparaître ces maladies liées au déficit en Se. De plus, en 1983, il a été recommandé en Finlande, que du Se sous forme de sélénate soit ajouté aux engrais afin d'augmenter la concentration en Se dans les plantes et donc dans la chaîne alimentaire.Un groupe de travail finlandais suit attentivement les conséquences à long terme d'une telle mesure sur la santé animale et humaine (42).
Au contraire, les teneurs en Se varient de 2 à 1 OO µg/g dans des contrées plus riches (sélénifères), comme plusieurs parties des Etats-Unis et du Canada.
A partir du sol, le Se peut être extrait par les plantes qui le transforment en composés organiques telle la sélénométhionine.
La disparité des teneurs des sols se répercute sur la teneur des végétaux qui peut varier de 0,01 à 10000 µg/g, mais la nature du sol joue un rôle, les sols alcalins facilitant l'oxydation en sélénate, facilement absorbable, les sols acides fixant le Se sous forme insoluble ( 48).
Le contenu en Se des eaux est également variable, de 0, 1 à 400 µg/l. Dans la plupart des cas cependant, il est nettement inférieur à 10 µg/l qui est la limite admise pour les eaux potables (86).
SOLS
ACIDES ALCALINS
Faiblement aérés Bien aérés
Séléniures ~ ~ n ~ ~ n ~ ~ n
de métaux lourds elementa1re
2- 0 2-
2-Se 1 Se Se03 Seoi..
1
l
1 \1 1 1 \
(insoluble) (insoluble) fe(OH)SeO 3 \
i
:
/Complexes Perte parl
t
/
(insolubles) drainage\PLANTES
~--Céréales et fourrages / ""' Plantes accumulant Se
2- ' 2
-Se-cystéine - Seo3 Seo4
-
n ~
~
Se-méthyl-Se-cystéine1
~
~
Se-cystathionineS ·d'T 1 Volatilisations des
-~ enosy méthyl séléniures
Se-methionin e Se-méthionine liée aux protéines
Hydrolyse dPSprotéines
1
Se-méthi.:inine ,. .. Protéines
1 Se-cystéine ANIMAUX animales SUPPLEMENTA TION / \
I
\·.
1 Se-cysréique t. Sél énot risul fur es ~---- -~ ~ -_=:s_-Se -S - R/
-1-=---
Héthylséléniures Triméthyl - Sélénium élémentaire \ Se-taurine2
-Apports
sélénonium Séléniures métalliques perte par excrétion, urinaire
1
1
1
t
1 exhalation
excrétion fécale \
. 1 \ 1
'
\~Figure 1 :
Le
cyc
le
duSe
dans
la
na
tu
re
(111).Dans
les
a
l
imen
ts
,
le
Se
va
se
t
rouve
r
à
des
taux
e
t
sous
une
fo
rme
va
r
iab
le
se
lon
le
type
d
'a
l
imen
t
e
t
se
lon
la
r
ichesse
des
so
ls
en
Se
.
Dans
l
'a
l
imen
ta
t
ion
,
le
Se
se
t
rouve
exc
lus
ivemen
t
sous
la
forme
de
composés
o
rgan
iques
en
géné
ra
l
inc
lus
dans
des
p
ro
té
ines
an
ima
les
ou
végé
ta
les
.
Les
fo
rmes
p
r
ima
i
res
son
t
surtout la sélénométhionine et la sélénocystéine. La sélenométhionine est plutôt un constituant des farines, tandis que la sélénocystéine se trouve dans les tissus arumaux, surtout sous laforme de GPX. (111).
D'après certains auteurs, 99% des apports de Se proviendraient des céréales, des graines, du poisson et de la viande, les autres aliments tels les fruits ou les légumes verts n'apportant que des quantités négligeables. La figure 2 donne une idée du type d'aliment qui contribue le plusàl'apport sélénié, tandis que la figure 3 donne une description plus détaillée. Alim. protéiniques 65,5 Aliments sucrés 15 Autres 8 Boissons et potages 5,6 Légumes et fruits 6
Figure2 : Apport alimentaire journalieren Se (89)
Poissons 9,7 Œufs 13,2 Saucisses 7,7 Viande7,,5 poulet Viande, porc 17,4 Viande, bœuf 3 Autres 7,9 Boissons, potages Laits, fromages 5,5 6,3 Légumes, fruits Farineux ~ 7,3
Les grains et les produits céréaliers sont des sources particulièrement riches en Se (sauf dans les régions pauvres en Se). En effet, la teneur des céréales va varier énormément selon le sol (de 0,06 à 16 nmol/g = de 0,005 à 1,3 µg/g) comme l'indique le tableau
suivant. Tableau 4 : Teneurs du blé en Se ( 48) ::1::1::11::::m11::::::::rn:::::::::::::::::::1:::::m:::n:::::m::::::::::1:1:1:::1m1w1111.1::::::1:i::rn:::::::::::::::::m:i: II:@:::::i:::::1:1m:::1i:w.1:m1:irni11m::::rn::1:::1: Canada 1300 16,45 Etats-Unis 0,368 à 0,703 4,68 - 8,90 Argentine 0,520 6,58 Suède 0,007 à 0,022 0,09 - 0,28 Finlande 0,004 à 0,085 0,05 - 1,08 Chine 0,005 à 0,019 0,06 - 0,24
D'une manière générale, les viandes, les poissons et produits de la mer ainsi que certaines noix sont également de très bonnes sources alimentaires de Se (86).
Par contre les fruits et les légumes (saufles champignons et l'ail), le lait et les produits
'a laitiers (sauf les oeufs et certains fromages), et les matières grasses sont de très pauvres
sources (86).
L'eau de boisson n'est généralement pas une source d'apport important, mais sa teneur qui peut n'être que de 12 nmol/l (1 µg/l) dans les zones pauvres en Se, peut s'élever jusqu'à 600 à 3800 nmol/l (50 à 300 µg/l) dans les zones sélénifères.
En ce qui concerne les viandes, des teneurs variant entre 0, 10 à 0,30 µg/g ont été rapportées (viandes maigres) ; lorsque les animaux sont convenablement approvisionnés en Se, leurs protéines renferment approximativement 1 µg/g de Se. Les abats sont particulièrement riches en cet élément (0,6 à 2 µg/g pour le foie et jusqu'à 6 µg/g pour les rognons). Le lait de vache n'apporte que 0,02 µg/l de Se. Les poissons et produits de la mer ont un contenu en Se significatif du point de vue apport alimentaire : cependant la biodisponibilité de l'élément serait limitée (20 à 50 %), vraisemblablement en raison de ses interactions possibles avec le mercure et d'autres métaux lourds. Contrairement aux produits de la mer, la biodisponibilité du Se dans les céréales, la levure de bière et la plupart des produits végétaux est plus élevée (85 - 100% ). En ce qui concerne ces derniers
produits, leur contenu en Se est réellement très faible, à quelques exceptions près : celles-ci incluant l'ail et l'oignon (0,5 à 3 µg/g), les champignons (1,5 à 2 µg/g), les feuilles de choux et les fruits secs (86).
3 - Besoins
Les besoins en Se ne sont pas définis avec certitude. En 1980, l'Académie Nationale des Sciences (USA) recommande un apport quotidien de 50 à 200 µg/jour, soit au moins 1 µg/kg de poids corporel.
En 1989, les apports recommandés sont de 70 µg/jour de Se pour l'homme et de 55 µg/jour pour la femme. En 1996, le FAO'(Food and Agricultural Organisation) propose un apport quotidien de 40 µg chez l'homme.
Cependant, aucun signe de déficit n'a été observé chez les populations néo-zélandaises dont l'apport quotidien est d'environ 30µg/jour. L'apport en Finlande avant 1979 se situait entre 20 et 30 µg/jour sans signe clinique de déficit. Une expérience réalisée chez des volontaires Nord-américains a montré qu'un apport quotidien réduit à 33 µg/jour pendant 45 jours n'a pas entraîné l'apparition de symptômes cliniques (42).
Cet apport tombe encore plus bas (8 µg/jour) dans certaines parties de la Chine où sévit la cardiomyopathie endémique de Keshan; Ces apports sont très en dessous de ce qu'on considère comme les apports alimentaires recommandés (111).
Les besoins en Se semblent augmenter pendant la grossesse ( 42).
II - LA BIOCHIMIE DU SELENIUM
A - METABOLISME DU SELENIUM
1 - Absorption intestinale
Les mécanismes biochimiques de la résorption dépendent de la forme chimique de l'élément dans le régime alimentaire.
Ces formes sont absorbées de façon importante au niveau du duodénum et du jéjunum. Les formes organiques semblent mieux résorbées que les formes inorganiques.
La sélénométhionine et la méthionine sont transportées de façon active par le même transporteur à travers la barrière intestinale, d'où une compétition entre les deux acides aminés.
Les formes minérales sont absorbées au ruveau de l'iléon. Dans la lumière intestinale, le sélénite réagit d'abord avec la cystéine ou le GSH pour donner un composé de type sélénosulfure (R-S-Se-S-R) ou sélénodiglutathion (G-S-Se-S-G) qui sera résorbé grâce à la gamma-glutamyl-transférase (47). Il peut aussi réagir avec des protéines à groupement thiol.
Le tableau 5 représente la biodisponibilité ou les facteurs influençant l'absorption.
Tableau 5 : Facteurs modifiant l'absorption du Se et sa biodisponibilité (28)
Vitamine C à faible dose, vitamine A et E Métaux lourds, argent, mercure, arsenic,
(sélénium) cadmium; la réciprocité est vraie (sélénium)
Glutathion (sélénite) Cystéine (sélénite)
Les métaux lourds modifient également la rétention du sélénium injecté.
Méthionine ( sélénométhionine)
Les métaux lourds diminuent l'absorption du Se mais inversement, en cas d'intoxication à ces métaux, l'administration rapide de Se diminuera aussi l'absorption de ces métaux, donc leur toxicité.
L'absorption est directement proportionnelle à la teneur en Se de la ration alimentaire. Elle ne parait pas dépendre du statut de l'organisme en cet élément. La phase d'absorption ne semble donc pas être un élément déterminant dans la régulation du taux de Se dans l'organisme.
2 - Transport
In vitro, pour pouvoir se lier aux protéines plasmatiques, le Se doit d'abord être capté par les globules rouges où il subit quelques modifications (cf métabolisme). En outre, in vivo, dans les premières heures, le Se serait lié aux LDL et VLDL. Cinq à dix heures plus tard, il serait pris en charge par les a et ~ globulines, l'albumine et la
sélénoprotéine P d'origine hépatique. Quoi qu'il en soit, le transport du Se est encore mal élucidé.
3 - Distribution
La distribution dépend : du mode d'administration, du statut en Se de l'organisme, de l'âge, de l'espèce animale et de la forme chimique de l'élément. Chez l'homme, on a estimé la teneur totale en Se du corps à 3 mg en Nouvelle-Zélande (116) et à 14,6 mg aux Etats-Unis (110), pour un poids moyen de 70 Kg.
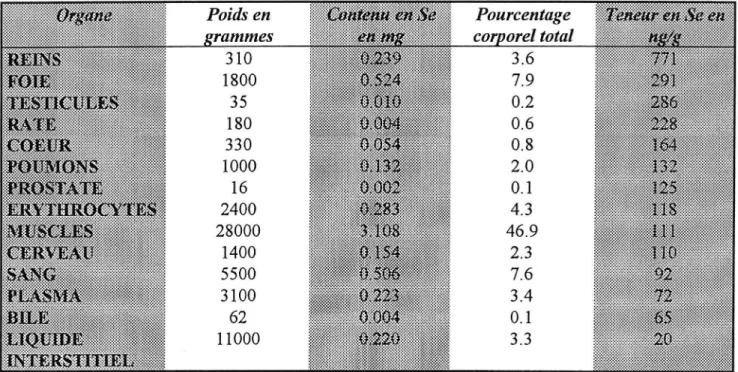
Le muscle squelettique est le principal organe de stockage du Se puisqu'il contient environ la moitié du Se corporel (90). Il est suivi par le foie, les reins, le plasma et les os. Le rein a la plus haute teneur en Se par unité de poids.
Tableau 6 : Se tissulaire chez l'adulte allemand (90) Poids en rammes 310 1800 35 180 330 1000 16 2400 28000 1400 5500 3100 62 11000 Pourcentage co orel total 3.6 7.9 0.2 0.6 0.8 2.0 0.1 4.3 46.9 2.3 7.6 3.4 0.1 3.3
Chez des rats carencés en Se, la mobilisation de ce dernier se fait de façon prioritaire vers ce que l'on appelle les organes nobles : le cerveau, les organes reproducteurs et les glandes endocrines (surrénales, corps jaune, ovaires, hypophyse, thyroïde) (8-70).
La distribution du Se semble dépendre de l'âge. Les concentrations des tissus rénaux, hépatiques ou de la rate sont plus élevées chez les rats nouveau-nés que chez les rats adultes mâles (2).
La forme chimique du Se administrée influence aussi sa distribution. La sélénométhionine et la sélénocystéine passent de manière plus importante au travers de la membrane placentaire que le sélénite (146).
La forme organique est mieux captée par les muscles et le pancréas, la forme minérale par le foie.
4 - Métabolisme
Le Se va subir une série de réactions afin d'être incorporé dans les protéines (synthèse de sélénoenzymes) ou d'être éliminé. Le tableau 7 résume la métabolisation du Se.
D'une part, la forme organique du Se (sélénométhionine) est transformée en sélénocystéine. Ce métabolisme est commun avec celui du soufre. D'autre part, la forme minérale du Se (sélénate) est métabolisée en séléniure d'hydrogène, ceci dans toutes les cellules.
On notera l'interconversion possible entre sélénocystéine et séléniure d'hydrogène grâce à
la seule enzyme spécifique du Se : la sélénocystéine lyase qui utilise un cofacteur, la vitamine B6.
Enfin, des réactions de méthylation permettent d'obtenir les métabolites d'élimination (47). Cette métabolisation est régulée par le statut en enzymes impliquées, le NADPH et le pyridoxal. Ils agissent donc sur la biodisponibilité du Se.
Tableau7: Métabolisme du Se dans lacellule (47)
Sélénométhionine
1
1
Se adénosyl sélénométhionine
2
1
Se homocysteine
3 Sérine
-+Vit. 85
Se cystathionine
Sélénopyruvique
4
Se-taurine sérine
""'
~
Sélénate (Se042-)
'
Sélénite (Se032-)
r-2GSH
Séléno diglutathion (G-S-Se-S-G) NAD PH 7 NAOP Persulfite (G-S-Se-H) NAD PH 7 NADP ---GSH
Sélénocystéine Séléniure d'hydrogène (H2Se)
'
s
--
.
.
.
:
t_Y
i
t
:a
:
alanine
8
Méthane sé!éno!
/
~
Méthyl Se cystéine Diméthyl séléniure (CH3-Se-CH3)
"-o
imé
thy
lsé
léno
~ n
j
Systèmes enzymatiques utilisés : 1/méthionine adénosyl transférase
21 séléno adénosylniéthionine transférase
31 cystathioninefi synthétase
41 cystathionase
Triméthyl sé!énonium (CH3)Se+
51 séléno cystéine/lyase
61 thioSmethyl transférase
71
glutathion réductase8/méthyl transférase
5
-Incorporat
ion
du
Se
dans
les
proté
ines
L'incorporation du Se dans les protéines peut s'effectuer de plusieurs manières en fonction de lanature du dérivé sélénié. Ces divers mécanismes sont repris dans la figure 4.
Selenite ---Selenocysteine+--Selenomethionine
1
~
/c;g
\2
1Se= R-S-SeSR Se cysteine Cysteinyl \RNA
~
lRNAJ
\:
- ~
Se Fe Proteins R-S-SeH .., SeProleins
~ ~
j
'
f
{
R-SeH ___//
"
S-Se
Se-R . ROH (GPx) 1,2,3,4 :voies non spécifiques
5,6, 7 : voies spécifiques
Figure 4 :Mécanismes possibles pour l'incorporationdu Se dans les protéines chez les procaryotes(47)
La sélénométhionine alimentaire est incorporée dans un acide ribonucléique de transfert(ARNt) non spécifique. Le Se constituant le centre actifde laGPX est sous forme de sélénocystéine dont lesquelette carboné proviendrait de la sérine.
Comme l'indique la figure 5, l'ARN de transfert de la sérine est tout d'abord phosphorylé par une kinase spécifique, puis le groupe phosphate est échangé soit spontanément, soit de manière enzymatique avec le séléniure, ce qui aboutit à la formation de sélénocystéine t-ARN.
Contrairement à ce que l'onpensait, le Se ne serait donc pas incorporé sur la sérine déjà fixée à la GPX, mais bien sur l'ARN de transfert (22).
S'erine-0-P
~
Selenocysleine \,, H2Se \ So·Cy••ioo\·td
ADP,j
SpecificSerinyl tRNAKinase
AT0]''"'
®
Serinyl tRNA Synthase""---</
""'
Serine .,,mRNAof Se Glutalhione peroxydase
0
~
l
-Se Cyst-. · Se Glutathion peroxydase
Figure 5 : Incorporation du Se dans laGPX (22)
Chez lesprocaryotes, des expériences sur une sélénoenzyme très proche de la GPX ont montré l'existence dans lecode génétique d'un codon spécifique pour leséléilocystéinyl t-ARNqui est lecodon
UGA
,
différent du codonUGU
de lacystéine.Ce codon
UGA
est habituellement un des trois codons employés pour la terminaison de la traduction.La cellule peut différencier un codon
UGA
stop du codonUGA
spécifique de la sélénocystéine. En effet, chez les procaryotes comme chez les eucaryotes, les ARN messagers de sélénoprotéines contiennent des régions structurées indispensables à l'insertion de sélénocystéine en réponse au codonUGA
(structure secondaire en t ige-boucle). La localisationde ces régions est cependant spécifique de chaque lignée évolutive (117).La figure 6 reprend les étapes de l'incorporation de sélénocystéine dans les protéines chez les procaryotes. La sérine est dans un premier temps chargée sur l'ARNtSec (ARN de transfert de la sélénocystéine) par la séryl-ARNt synthétase. Le résidu sérine fixé à l'ARNtSec est reconnu par la sélénocystéine synthase, produit du gène Sel A qui, avec l'aide d'une molécule de Se activée résultant d'une réaction catalysée par la protéine SEL
D, va transformer cet acide aminé en sélénocystéine. Finalement, un complexe ternaire GTP-SEL B-séléno-cysteyl-ARNtSec est formé, permettant l'incorporation de sélénocystéine dans les sélénoprotéines en réponse au codon UGA (117).
ARN! Sec
UCA
. X Séryl-tRNA syn1hétase L-sérine+ATP --....__
1
séryl-ARNt Sec
UCA
l
SELA ou sélénocystéine synthase aminoacrylyl-ARNt~~se·-+ATP+Mg2
+)
SELO SEU\ ou sé!énocystéine synthase H2P03SeH
T
sé!énocystéyl-ARNt~~
1
SELS +GTPSELB-GTP-sélénocystéyl-ARNt~~
Incorporationde sélénocystéine dans lessé!énoprotéin.es en réponseaucodon UGA
Figure 6: Mécanisme d'incorporation de sélénocystéine dans les sélénoprotéines procaryotes (117)
Chez les eucaryotes, le système d'incorporation de sélénocystéine est proche mais pas encore clairement identifié (117). La sérine est aussi un précurseur direct de la sélénocystéine.
Stadtman (114) a établi la présence d'un ARNtSec analogue de celui trouvé chez E. Coli, l'es 'ten ' cafi ·tion d e cetARN Sec t par a1 ' senne· et sa conversion· en se'1 ' enocystey' l - ARN Sec t . D'après Richard et al. (100), cet ARN1Sec est ubiquitaire dans le règne animal et semble
impliqué dans la synthèse de toutes les protéines séléniées eucaryotes. Etant donné ce mécanisme original de traduction du code génétique, le facteur limitant de la synthèse des sélénoprotéines est lateneurintracellulaire en Se.
6 - Elimination
Il existe plusieurs voies d'élimination.
La voie urinaire est la principale voie d'excrétion (60%), suivie par la voie fécale (35%) puis l'haleine, la salive et la sueur (1%).
Dans l'urine, on retrouve l'ion triméthylsélénonium, hydrosoluble, mais aussi les sélénites et sélénates.
Les fèces contiennent la partie d'élément non résorbée et des formes provenant des sécrétions intestinales.
Le diméthylséléniure, composé volatil, est éliminé par les poumons. En cas d'intoxication, cette excrétion augmente et donne l'odeur d'ail de l'haleine (22).
Conclusion
Chez le sujet sain, il y a autant de Se éliminé que de Se absorbé, entraînant un bilan nul sans surcharge. L'absorption semble être indépendante du statut en Se. Ainsi une supplémentation abusive sera superflue et pourra même provoquer une intoxication.
B - LES FONCTIONS BIOCHIMIQUES DU SE
Le Se se trouve principalement incorporé dans notre organisme sous forme d'un acide aminé : la sélénocystéine (cf. figure 7).
coo·
1 °R3N-C-H 1 CH2 1 SeHFigure 7 : L'acide aminé sélénocystéine est la forme principale d'assimilation de Se dans
Les sélénoprotéines à sélénocystéine :
Plusieurs types de sélénoprotéines à sélénocystéine ont été identifiées à ce jour(tableau 8). Tableau 8 :Les différentes sélénoprotéines connuesàce jour(d'après le 117 modifié)
SELENOPROTEINES EUCARYOTES
Glutathion peroxydases Tétra-iodothyronine 5' désiodase
Sélénoprotéine P Sélénoprotéine du muscle Sélénoprotéine kératinoïde
Thiorédoxine réductase Cytochrome P450àsélénium
Sélénodiglutathion
1
-Sé
lénoproté
ines
procaryotes
Chez les procaryotes, les sélénoprotéines constituent trois grands groupes. 1.1 -Les formiates deshydrogénases
Elles sont trouvéessous troisformes chez E.Coli.
La première enzyme (FDHN) est liée au complexe nitrite réductase par l'ubiquinone. Sa structure oligomérique de type ~ a été étudiée par Enoch et Lester (1975) qui ont
mis en évidence un atome de Se par sous-unitéa.
La deuxième formiate déshydrogénase (FDHH) appartient au complexe formiate déshydrogénase-hydrogénase connu sous le nom de formiate-hydrogène lyase et contient un sélénopolypeptide de 80 kDa.
Plus récemment enfin, une troisième formiate déshydrogénase (FDHo) de 110 kDa contenant une sélénocystéine a été identifiée(117).
1.2 - Les hydrogénases
Les hydrogénases existent sous deux formes chez Methanoccus vannielii.
La première est représentée par une enzyme de 340 kDa, de structure oligomérique a2f34y2. Chaque sous-unité f3 contient une sélénocystéine.
La deuxième forme, plus grande, est un agrégat, probablement un tétramère de l'espèce de 340 kDa (117).
1.3 - La sélénoprotéine A du complexe glycine réductase
La sélénoprotéine A du complexe glycine réductase des Clostridiae a fait l'objet
d'études intéressantes sur le mécanisme d'incorporation de sélénocystéine puisque c'est grâce à cette protéine qu'il a été démontré pour la première fois que le Se était présent sous forme de sélénocystéine (117).
2 - Sélénoprotéines eucaryotes
De nombreuses sélénoprotéines ont été répertoriées chez les eucaryotes : - les glutathion peroxydases
- la tétra-iodothyronine 5' désiodase - la sélénoprotéine P
- la sélénoprotéine du muscle
- les sélénoprotéines kératinoïdes du spermatozoïde humain - la thiorédoxine réductase
- le cytochrome P450 à Se. - le sélénodiglutathion
2.1 - La GPX = glutathion peroxydase
a) Introduction
Le Se est le constituant essentiel du site actif de la GPX.
In vitro, elle empêche l'oxydation de l'hémoglobine et l'hémolyse des globules
rouges, induites par le peroxyde d'hydrogène H202. En effet, il est décomposé par le glutathion réduit GSH, en présence de GPX selon la réaction suivante.
GPX
H202
+
2 --~ 2H20+
GSSG , pour donner de l'eau et du glutathion oxydé(111). b) Les deux classes de peroxydases
Il existe deux types de GPX chez les mammifères; une sélénoenzyme responsable de 65% de l'activitétotale, et une enzyme non séléno-dépendante.
=>
lesperoxydases séléno-dépendantes (Se GPX ou GPX) Elles possèdent une forte affinité pour H202.Elles sont localisées principalement au niveau du foie, du rein, du cristallin, des cellules sanguines et du cerveau. On les retrouve dans le cytosol et la matrice mitochondriale (99).
La teneur de la GPX est extrêmement liée aux apports de Se, ce qui en fait un bon marqueur des carences en Se notamment en ce qui concerne la GPX cellulaire (érythrocytaire ou plaquettaire) (100).
=>
lesperoxydases non séléno-dépendantes (GST)Elles sont encore appelées glutathion-S-transférases, et montrent une large spécificité pour les peroxydes organiques, une très faible affinité pour H202., une cinétique et des propriétés physiques différentes de laGPX.
Chez l'homme, elles sont localisées essentiellement au niveau du foie. Ces enzymes ne participent pas à l'activitéantiradicalaire dans l'érythrocyte(99).
c) Structure, activité et rôle physiologique des GPX séléno-dépendantes
=>
laGPX cellulaireElle comprend quatre sous-unités de poids moléculaire 18000à22000 Da. Elle renferme un atome de Se par sous-unité. Il n'y a aucun autre métal dans laprotéine.
Comme l'indiquent les figures 8 et 9, l'atome de Se se trouve au niveau du site catalytique de l'enzyme, sous forme sélénol au sein d'un résidu sélénocystéine (Se-cys) incorporé dans la chaîne polypeptidique au centre d'une poche hydrophobe à la surface de la protéine (9). Cette enzyme est localisée dans le cytosol et la matrice mitochondriale des cellules.
H
-CO-NH-C-CO-NH-1CH2
1SeH
Figure 9 : Site actif de la GPX (44)
La cinétique de cette enzyme est non michaelienne. En effet, pour de fortes concentrations en substrat, la vitesse de la réaction augmente indéfiniment avec la concentration en GSH.
Pour des concentrations plus faibles en substrat, la vitesse est indépendante de la concentration en GSH.
La GPX séléniée est très active vis-à-vis de faibles concentrations de H202 (<10-6 M) alors que la catalase est inactive à de telles concentrations (9).
Cette enzyme réduit H202, les hydroperoxydes orgaruques libres tels que les hydroperoxydes d'acides gras libres mais elle n'agit sur les hydroperoxydes lipidiques estérifiés liés à la membrane qu'après hydrolyse enzymatique par la phospholipase A2 (54). La figure 10 résume ces différents rôles.
'
PEROXYSOME
Figure 10: Rôle de la GPX dans les réactions d'oxydoréduction intracellulaires (44)
Les besoins en Se sont à déterminer car on passe très rapidement d'un état de carence à un état toxique.
Chez le rat, il est difficile de corréler l'apport alimentaire en Se et l'activité de la GPX cellulaire. Il est admis qu'il existe une corrélation linéaire entre la concentration érythrocytaire en Se et l'activité de la GPX érythrocytaire chez l'animal. Chez l'homme une meilleure corrélation serait observée entre le taux plasmatique en Se et l'activité de la GPX érythrocytaire (9).
Pour vérifier un état de carence en Se chez l'homme ou le rat, il est nécessaire de mesurer l'activité GPX des plaquettes. En effet, en cas de carence en Se, après apport sélénié, on observe une augmentation très rapide de l'activité GPX plaquettaire (9).
Toute une série d'études montrent l'importance d'une supplémentation en Se. Des rats avec un régime pauvre en Se ont développé une nécrose du foie. L'addition de Se
à la nourriture a prévenu le développement de ces symptômes.
D'autre part, dans une région de Chine pauvre en Se, les humains développent la maladie de Keshan (cardiomyopathie endémique de l'enfant et de la femme). La relation entre cette
pauvreté en Se et la maladie fut démontrée par la prévention de la maladie en supplémentant la population en sélénite de sodium.
De plus, en 1978, des nutritions parentérales totales ont induit une déficience en Se et donc des maladies telles que myopathie, cardiomyopathie ( lorsque le Se n'était pas considéré comme essentiel dans la nutrition parentérale totale) (52).
Burk observe que chez le rat, 25% du Se total est présent dans la GPX cellulaire du foie. Celle-ci régule le taux intracellulaire d'hydroperoxydes. Une déficience en Se entraîne une baisse du taux de GPX cellulaire, bien tolérée chez le rat (16).
Lors d'une autre étude, Burk retrouve qu'une déficience en Se entraîne une chute de l'activité de l'enzyme à des niveaux très bas, souvent moins de 5% de l'activité (15). Le Se est une défense contre les oxydants : Burk a montré que chez des rats déficients en Se, après administration de « diquat », ils mourraient en quelques heures, après avoir développé des taux élevés de lipoperoxydation et une nécrose massive du foie. L'administration d'une dose physiologique de Se dix heures avant le diquat a provoqué une forte protection contre la péroxydation lipidique et la nécrose du foie, et a permis la survie (15).
Lors d'une étude en double aveugle menée par Thomson (125), 33 femmes de Nouvelle-Zélande, âgées de 18 à 23 ans, ont reçu chaque jour pendant 32 semaines, 200 µg de Se sous forme de sélénométhionine ou de sélénate ou un placebo pour le troisième groupe. L'activité de la GPX plaquettaire a augmenté ainsi que le taux de Se et de GPX dans le sang total, les globules rouges et le plasma, dans les deux premiers groupes.
La sélénométhionine était plus efficace sur l'augmentation de la concentration en Se que le sélénate; mais les deux étaient aussi efficace l'un que l'autre sur l'activité de la GPX dans le sang total, les globules rouges et le plasma.
Cependant, le sélénate a mieux agit sur l'activité de la GPX plaquettaire.
Rannem et al. ont constaté une déplétion en Se chez 9 patients recevant une nutrition parentérale à long terme. Le taux ·de Se est significativement plus bas dans le plasma et les globules rouges des patients que chez les témoins. Le taux de la GPX du plasma et des globules rouges a diminué aussi.
Après administration de 200 µg de Se par jour sous forme de sélénite pendant quatre mois, suivi de 1 OO µg de Se par jour pendant huit mois, le taux de Se plasmatique s'est élevé à des valeurs légèrement mais significativement plus hautes que chez les témoins.
Le Se du globule rouge a atteint un niveau normal chez la plupart des patients après quatre mois de substitution, mais est resté inférieur à celui des témoins. La GPX plasmatique et érythrocytaire n'était pas différente par rapport aux témoins. Cela suggère que tous les patients sous nutrition parentérale à long terme devraient recevoir au moins 1 OO µg de sélénite de sodium par jour pour éviter la déplétion en Se (97).
:::::;> la GPX plasmatique
Elle possède aussi quatre unités de 21 à 23 kDa avec un atome de Se par sous-unité. Mais, c'est une glycoprotéine qui diffère de la forme cellulaire par son antigénicité, ses paramètres cinétiques, sa mobilité électrophorétique et sa sensibilité aux métaux (43). Son origine est encore mal élucidée. Elle pourrait être sécrétée par le foie. Plus récemment, une origine rénale a été reconnue pour cette enzyme (1 OO).
Elle est très active sur les hydroperoxydes organiques du plasma mais avec une affinité variable. Elle catalyse la réduction des peroxydes du t-butyl et de l'hydrogène (78).
L'activité spécifique de la GPX plasmatique représente 10% de celle de la GPX cellulaire. De plus, cette enzyme a une spécificité pour le GSH dix fois moins importante que la GPX cellulaire, ce qui entrerait en compte dans la baisse de l'activité.
Elle pourrait utiliser d'autres cofacteurs réducteurs telle la thiorédoxine (100).
Chez les personnes sélénodéficientes traitées par du Se, l'action de la GPX plasmatique revient à la normale en trois à quatre semaines, alors que cela demande trois à quatre mois dans le cas des GPX cellulaires. Le traitement par du Se commence à agir, dès les premiers jours pour l'enzyme plasmatique tandis qu'il y a un temps de latence de trois à quatre semaines avant d'observer tout accroissement significatif de l'activité peroxydasique cellulaire (56).
=>
la GPX membranaire(ou d'Ursini ou phospholipide hydroperoxyde GPX ou ph-GPX)
Elle fut isolée par Ursini (126). Elle est purifiée à partir de foie de porc, de coeur ou de cerveau et se trouve très abondante dans les testicules où elle est exprimée après la puberté (101). C'est un monomère de 20 kDa, contenant un résidu sélénocystéine. Elle est liée aux membranes. Elle catalyse la réduction des hydroperoxydes d'acides gras estérifiés en phospholipides sans action préalable de la phospholipase A1 aussi bien que les hydroperoxydes organiques libres, d'où son nom de ph-GPX ( 100-117-12 7).
En cas de déficience en Se, l'activité de la ph-GPX est maintenue à un niveau élevé dans le foie et le coeur, tandis que celle de la GPX cellulaire décroit rapidement (7-0-100).
=>
la GPX gastro-intestinaleA la fin des années 80, une quatrième GPX sélénodépendante a été isolée de foie humain ou de lignées cellulaires d'hépatocarcinome.
C'est un tétramère de poids moléculaire 75 kDa localisé dans le cytosol des cellules.
Elle catalyse la réduction d'H202, des hydroperoxydes organiques mais pas des hydroperoxydes de phospholipides.
Elle est appelée GPX-GI puisqu'elle a été détectée dans le foie et l'intestin humain ainsi qu' exclusivement dans l'intestin des rongeurs ( 43).
d) Mode d'action
Le mécanisme d'action de la GPX est représenté par la figure 11.
Le Se est le véritable site actif de la GPX : c'est par le passage de la forme sélénol (Se-H) à celle de l'acide sélénique (Se-OH) qu'il est capable de donner l'électron nécessaire à la transformation du peroxyde en un composé stable.
Ce site sélénol : - s'oxyde
- fixe un glutathion en libérant de l'eau
ROOH,1-fD f.,©,GSSP-Prot-So9
~
(Pro<-SeH • GSSG) Prct-S-0OH GSH (Prot-Se-SG • GSH} ~ OH • GSH)~
Pmt&-SG~
Figure 11 :Cycle catalytique du Se dans laGPX (22)
Plus précisément, des études de diffraction aux rayons X coupléesàla détermination de la séquence peptidique de l'enzyme ont permis de montrer l'existence d'un résidu cystéineàl'intérieur de la protéine avec le groupement thiol voisin de l'atome Se.
Il est donc probable que le soufre joueun rôle important dans la réaction enzymatique qui semble constituée de troisétapes successives.
La première étape correspond à laréduction de l'hydroperoxydepar legroupement sélénol du site actif, avec formation d'un intermédiaire sélénosulfure entre une cystéine et une sélénocystéine.
Il se produit ensuite une réduction de la forme oxydée de l'enzyme qm pourrait théoriquement s'effectuer soit avec le soufre d'une cystéine voisine, soit avec une molécule de GSH, liéeàl'enzyme. Il semblerait que se soit la deuxième possibilité qui soit utilisée par l'enzyme. Il se formerait un complexe entre l'enzyme oxydée et une molécule de GSH, et une réaction intermoléculaire conduirait à une liaison covalente entre le GSH et la sélénocystéine.
La troisième étape du cycle fait intervenir une deuxième molécule de GSH qui régénère l'enzyme et libèreune molécule de GSSG (9).
2.2 - L'iodothyronine 5'-désiodase de type 1 (5'DI)
Cette protéine assure la transformation au niveau de certains organes de la tétraiodothyronine (T4) en triiodothyronine (T3), plus active pour la liaison au récepteur (85).
=>
Les familles de désiodases Il existe trois types de désiodases.•Le foie, les reins et la thyroïde contiennent une désiodase de type I (23, 70).
Elle est aussi présente dans d'autres tissus tel que le cerveau, mais en concentration beaucoup plus faible.
La 5'DI catalyse de préférence la désiodation de la rT3 (T3 reverse) et aussi de la T4 (70). •L'hypophyse, le cerveau, le système nerveux central et certains tissus adipeux contiennent des désiodases de type II et quelquefois de type III. La désiodase de type II n'est pas une sélénoenzyme(23), tandis que la désiodase de type III a été identifiée comme une sélénoprotéine (34 bis).
Le substrat préférentiel de la désiodase de type II est la T4, ceux de l'enzyme de type III sont les dérivés sulfatés de la T 3.
Le tableau 9 reprend les caractéristiques des trois désiodases et la plupart de leurs propriétés biochimiques (70). Leur mécanisme d'action est complexe.
Tableau 9 : Résumé des propriétés des trois types de désiodases (70).
Substrat rT3>>T4>>T3 T4>rT3 T3 (-sulfate) >T4
préférentiel
Poids moléculaire 55 000, 200 000, Inconnu 27 kDa/sous-unité 29 kDa/sous-unité 32 kDa/sous-unité
Distribution Foie, reins, thyroïde, Hypophyse, système Presque tous les
tissulaire système nerveux nerveux central, tissu tissus central adipeux brun
Localisation Foie : reticulum Membranes Membranes
subcellulaire endoplasmique microsomales microsomales Reins : membrane
:::> Structure, localisation, activité de la 5 'DI
La 5'DI est composée de deux sous-unités identiques, de 27 kDa chacune, dont le centre actif est la sélénocystéine (10-70).
Sa localisation cellulaire varie selon les tissus :
• au niveau du foie, elle est située à la surface de la membrane du reticulum endoplasmique (côté cytosolique ),
• au niveau du cortex rénal et de la thyroïde, elle est située sur la membrane basale de la cellule (côté cytosolique) (70).
L'enzyme du foie est la source principale de TJ circulante.
Les enzymes des reins et de la thyroïde produisent une plus petite quantité de T 3 circulante.
La fonction exacte de la 5'DI de la thyroïde est encore mal connue.
70% de la T3 circulante proviendrait d'une désiodation extrathyroïdienne. Au niveau de la
thyroïde, soit la TJ proviendrait d'une iodation incompléte de la thyroglobuline, soit de l'action de la 5'DI du thyrocyte sur la T4 (70).
=>Mode d'action de la désiodase de type I:
T4 réagit tout d'abord avec l'enzyme dans laquelle le Se se trouve sous forme de sélénolate pour former un complexe enzyme-iodure, avec relâchement d'iodothyronine désiodée. Ce complexe pourrait alors réagir avec un cofacteur non identifié de type thiol (GSH ?) pour libérer l'iodure et régénérer la forme active de l'enzyme. Ainsi, on peut expliquer l'effet d'inhibition de la désiodation périphérique de la T4 par les antithyroïdiens dérivés de la thiourée (23).
Ceux-ci agissent en compétition par rapport au cofacteur. Ils bloquent l'enzyme dans son état oxydé (complexe enzyme-iodure). D'autres inhibiteurs de la 5'DI comme les flavonoïdes sont en compétition par rapport au substrat (in vitro) (70).
=> 5'DI et statut en sélénium
Un déficit en Se abaisse l'activité des désiodases de type I et II, donc le taux de T4
En cas de déficience en Se, l'activité de la 5'DI de la thyroïde ne décroit pas ou peu, tandis que celle de la 5'DI du foie et du rein est visiblement réduite. Lors de la synthèse des sélénoprotéines, l'incorporation du Se se fait préférentiellement dans la 5'DI que dans la GPX cellulaire.
Les métabolismes du Se et de l'iode sont très liés : pour former les hormones thyroïdiennes, la glande thyroïde utilise H202 pour oxyder les iodures puis les résidus tyrosyls de la thyroglobuline, en présence d'une thyroperoxydase. __
Une carence en iode stimule la glande thyroïde (par augmentation
de
la TSH sérique), donc la production de H202 augmente. La thyroperoxydase est débordée, et donc l'excès de H202 conduira à une atrophie de la glande (11).Contempré a montré que la supplémentation en Se de patients déficients en iode aggrave la fonction thyroïdienne. Le Se, en stimulant l'activité GPX, consomme le H202 et donc freine la synthèse des hormones thyroïdiennes (29). La carence en Se pourrait protéger contre la carence en iode en diminuant la désiodation périphérique de la T 4 et
donc en conservant les iodures (31 ).
Par contre, la supplémentation en iode smv1e de celle en Se améliore la fonction thyroïdienne (30).
2.3 - La sélénoprotéine P (Se-P)
Il existe une autre sélénoprotéine, différente de la GPX, qui a été retrouvée dans le plasma d'animaux de plusieurs espèces: rat, hamster, porc, mouton, singe et chez l'homme (145).
En 1987, Yang (141) a purifié cette protéine par chromatographie d'immunoaffinité.
Elle est fabriquée dans le foie qui la sécrète ensuite dans le plasma. Sa demi-vie est courte (3 à 4 heures) (17).
Burk et Hill (16) ont retrouvé des ARN messagers correspondant à la Se-P dans plusieurs tissus autre que le foie. Cela indique que cette enzyme est synthétisée dans plusieurs autres sites que le foie.
Selon Hill (59), sa structure est une simple chaîne polypeptidique de 41 kDa, contenant dix résidus sélénocystéine dans sa structure primaire.
Elle est aussi riche en cystéine et en histidine (114).
L'analyse de la séquence de l' ADN de cette protéine indique la présence de 366 acides aminés ( 17).
La fonction biologique de cette protéine est inconnue. Elle aurait un rôle de transporteur du Se, du plasma vers les tissus. Wilson pense que la Se-P se lie aux récepteurs membranaires des cellules nécessitant du Se. Ensuite elle est internalisée puis dégradée dans le lysosome. La sélénocystéine libère alors le Se sous forme de séléniure qui est incorporé dans d'autres sélénoprotéines telles que la GPX (138).
Cette protéine aurait aussi un rôle de protection contre les radicaux libres au mveau plasmatique (16), mais aucun système pour la régénérer n'a été décrit (114).
Chez le rat, la Se-P contient 65% du Se plasmatique (16). Une déficience en Se, chez le rat, réduit le taux de Se-P à moins de 10% du taux normal. L'administration de Se à des rats déficients en Se conduit à une rapide augmentation du taux de la Se-P plasmatique. Douze heures après l'injection de 50µg de Se, la concentration est de 78% par rapport au témoin. L'activité de la GPX reste à 5% du témoin (141).
2.4 - La sélénoprotéine du muscle (encore appelée G ou W)
Cette protéine de bas poids moléculaire (9500 à 9900 Da) a été isolée en 1993 du cytosol du muscle de rat. Glutamate, glycine, lysine, leucine et valine sont les principaux acides aminés présents dans cette protéine. Elle contient aussi une sélénocystéine par molécule. Son rôle biologique est inconnu (129). Son gène a été cloné. Cette protéine est un composant du muscle, muscle cardiaque inclus, et a été détectée chez plusieurs espèces animales (114).
Son dysfonctionnement serait responsable des troubles de la dystrophie musculaire mis en évidence lors des déficiences humaines en Se (86).
2.5 - Sélénoprotéines kératinoïdes du spermatozoïde humain
Des sélénoprotéines kératinoïdes de 15 à 20000 Da existent également dans le spermatozoïde humain. Elles se forment en même temps que la maturation de la cellule. Cette protéine est associée à la membrane externe (capsule) de la mitochondrie du spermatozoïde. Elle contient trois sélénocystéines. Elle est responsable de l'intégrité du
flagelle (86). Elle joue vraisemblablement un rôle structural en permettant la formation de la gaine hélicoïdale mitochondriale autour du flagelle du spermatozoïde (69).
Chez l'homme, de faibles taux en Se séminal ont été associés à des cas d'infertilité masculine. Ce rôle du Se pourrait expliquer le fait que le besoin soit plus important pour l'homme que pour la femme (86).
2.6 - La thiorédoxine réductase (TR)
C'est une flavoprotéine qui a été isolée du foie de rat, du placenta humain, des lymphocytes T humains et d'une culture cellulaire d'adénocarcinome de poumon humain (51-118). Elle est présente dans la membrane plasmique et la membrane du reticulum endoplasmique (118). Elle comporte deux sous-unités identiques de 57 kDa chacune. Chaque sous-unité contient un F AD et une sélénocystéine.
Gladyshev (51) a identifié la TR dans les lymphocytes T humains. D'après le clonage du gène issu du placenta humain, la sélénocystéine de cette protéine correspond au codon TGA.
Les trois derniers acides aminés du peptide de la forme issue des lymphocytes T, situés à
l'extrémité C terminale, sont la cystéine, la sélénocystéine et la glycine (51).
Tandis que pour l'isoenzyme, issue du placenta humain, le peptide ne posséde pas les deux derniers acides aminés ( sélénocystéine et glycine) ( 51).
On observe dans la région N terminale de la TR issue du placenta, une séquence d'acides aminés commune à celle de la glutathion réductase (Cys Val Asn Val Gly Cys) (118).
La flavoprotéine du poumon ne réagit pas avec les anticorps anti-thiorédoxine du foie de rat. Mais une seconde forme de cette protéine est reconnue par ces mêmes anticorps (51).
La TR des lymphocytes T présente une réaction croisée avec ces anticorps (51 ).
Chaque isoenzyme a une activité thiorédoxine réductase similaire (51). La TR a divers substrats tels que la thiorédoxine (protéine à groupement thiol), la protéine disulfide isomérase.
Ces protéines participent à une réaction en chaine visant à réduire des molécules (ribonucléotides, résidus méthionine sulfoxide, forme quinonique de la vitamine E ... ).
La TR catalyse larégénération de laforme réduite de ces protéines, par l'intermédiaire du NAD PH.
Les figures 12 et 13 illustrentdeux exemples d'action de laTR.
NADPH+H+
_...s
~
TR /SH NADP+ T 1 --._SH P-S-CH3 Met (0)-R 0Il
P-S-CH3 0Il
Figure12 :.Réductiondes.résidus méthionine sulfoxide (P-S-CH3) des protéines par la méthionine sulfoxide réductase (Met (0)-R), dépendante de laTR et de lathiorédoxine
(118).
Thiorédoxine
y
Protéine disulfide réductase isomérase-H2Th
io
rédox
ine
A__
P
ro
té
ine
d
isu
l
f
ide
réductase -H2 isomérase •
~ ~
-ascorbate
Î
Asco
rba
te
A
c
r
-
tocophé
ro
l
•
semiqumoneFigure13 :Interconversion de l'a.-tocophérolet de l'a.-tocophérol semiquinone, liéeà la TR dépendante du Se (118).
2.7 -CytochromeP450àsélénium
Un cytochrome P450 d'origine humaine (hIIB3) pourrait contenir de la sélénocystéine (114).
Il module la prolifération des cellules tumorales en inhibant l'incorporation des acides aminés dans les protéines. Il est formé en présence de quantités très importantes de Se dans l'organisme, à doses dites « pharmacologiques
»
(22).Conclusion
D'autres sélénoprotéines encore peu connues ont été identifiées dans de nombreux organes. Dans plusieurs cas, l'élément y est présent sous forme de sélénocystéine.
On peut aussi synthétiser des protéines contenant de la sélénocystéine.
On notera que les enzymes à sélénocystéine ont une activité catalytique bien plus élevée que leurs analogues soufrés (enzymes à cystéine).
L'incorporation du Se dans les sélénoprotéines est régulée : avec une faible prise de Se (20 µg/jour), la ph-GPX et la désiodase sont complètement saturées, tandis que les autres sélénoprotéines (GPX cellulaire, sélénoprotéine P, GPX gastro-intestinale, sélénoprotéine W ... ) nécessitent une concentration en Se plus élevée pour être saturées (70).
C -
LA LUTTE CONTRE LES EFFETS DES RADICAUX LIBRES
1- Les radicaux libres de l'oxygène: définition
L'oxygène (02) est Ja source principale des radicaux libres. Ces composés sont physiologiques et indispensables. La cellule les utilise dans de nombreux processus tel l'oxydation des acides gras et des alcools, l' hydroxylation de diverses molécules, la formation de dérivés de l'acide arachidonique (12-HPETE) ou la biosynthèse de la thyroxine qui s'effectue par l'intervention d'une thyroperoxydase sélénodépendante. En outre, ils contribuent à la phagocytose, un des mécanismes de défense de notre organisme. Mais, l'accumulation de ces substances peut diminuer l'activité métabolique de la cellule et même la tuer (22).
Les principaux radicaux libres de l'oxygène sont : - l'oxygène singulet (102)
- le radical hydroxyle (OH') - le radical hydrogène (H')
Bien que les peroxydes ne fassent pas partie de cette classe stricto sensu (un électron libre, non apparié dans la couche externe), ils s'en rapprochent par leur activité cellulaire (22).
Ces radicaux libres sont instables, très réactifs et toxiques pour les organites et les membranes cellulaires.
Ils sont porteurs d'un électron célibataire, ils cherchent à l'apparier. Leur durée de vie est très courte (10 -6s); l'électron manquant au radical libre est le plus souvent «arraché» à une chaîne carbonée voisine, aboutissant à la formation d'un néoradical qui réagira de la même façon initiant ainsi une réaction en chaîne qui menace l'intégrité de la matière (20).
2 - Production des radicaux libres
Il existe différents processus de production in vivo :
- Au niveau de la chaîne respiratoire (environ 5% de l'oxygène respiré par l'individu se transforme en anions superoxydes, grâce à une réaction de réduction par la NADPH oxydase de la membrane des macrophages)
- Lors du métabolisme de substances toxiques (éthanol, dérivés chlorés, médicaments tels que anti-inflammatoires, antitumoraux)
- biosynthèse des prostaglandines
- phagocytose ( rôle bénéfique entraînant la destruction des nucro-organismes)
- radiations ionisantes.
=>Formation des radicaux libres inorganiques de l'oxygène, et de l'oxygène singulet:
gam d'énergie
-?1Lw
~
tt,02
~
off (
tt,o
:gamr nr
;,et'
électron 2H+ H+ H20 H+L'anion superoxyde a des propriétés pro-inflammatoires et chirniotactiles. L'oxygène singulet est formé en faible quantité.
La surproduction de l'anion entraîne l'accumulation d'H202, dont la demi-vie est plus longue. Il se forme alors un pool conséquent en l'absence d'un système de dégradation efficace, représenté par la catalase mais surtout la GPX. Ce peroxyde est relativement stable, mais en présence d'ions ferreux,ilforme un radical hydroxyle, par la réaction de Fenton, au potentiel d'oxydation très élevé.
Ce radical est très réactif Il réagit à l'endroit où il est formé et peut attaquer toutes les macromolécules de l'organisme
protéoglycanes...(56).
lipides membranaires, ADN, protéines,
=>Formation des radicaux organiques de l'oxygèneet des peroxydes
,.
Mécanisme d'auto-oxydation des acides gras (111):
2RH+ --~ 2R ·+ 2OH· (extraction de l'hydrogène)
R. +02--ROO. (peroxydation) ROO . +RH--ROOH + R' (hydroperoxydation)
Ces réactions démarrent le plus souvent par l'extractiond'un hydrogène en position allylique. Le radical ainsi formé peut donner lieu à une peroxydation et conduire à un hydroperoxyde. Les réactions en chaînes peuvent s'arrêter par recombinaison de deux radicaux entre eux :
--~ -
R'+Roo· ROOR
ROO . +ROO . ROOR +02 Mécanisme de peroxydation des lipides (111)_:_
LH +OH ' L. + H20 radical lipidique L ·+02 LOO.
radical peroxyde LOO . +LH LOOH + L.
Les radicaux libres peuvent agir sur les AGPI (Acides Gras Polyinsaturés) et conduireàla formation d'un radical libre allylique primaire. Cette étape initiale peut être suivie d'une succession de réactions en chaîne sur d'autres AGPI, et aboutir à la formation de peroxydes LOOH car le néoradical lipidique peut réinitier le cycle. Elle peut s'accompagner de l'isomérisation et de la fragmentation de la chaîne, pour conduire à du dialdéhyde malonique (ou malonedialdéhyde MDA) en particulier (111).
HC--CH2 --CH
~
~
0
0
Figure 14: Malonedialdéhyde
De plus, les hydroperoxydes peuvent en présence de Fez+ participeràlaréaction de Fenton:
--~ 3++LO. +OH
-radical alkoxy
avec production du radical alkoxy, agent aussi«dangereux »et réactif que le radical hydroxyle.
Comme on levoit, lalipidoperoxydationest un processus auto entretenu.
3
- Conséquences
de
l
'attaque
rad
ica
la
ire
grands
désordres
structuraux
et
fonct
ionne
ls
=>D'une part, les radicaux libresoxydent les lipides membranaires :
les lipides, c'est-à-dire les triglycérides simples et les phospholipides, sont déposés en bicouche au niveau des membranes de lacellule et de ses structures, ou en monocouche au niveau des membranes des lipoprotéinescirculantes. Les lipides les plus exposésà l'attaque des radicaux libres sont le cholestérol et les AGPI, en particulier ceux qui sont constitués d'un enchaînement malonique de doubles liaisons en position« cis» :
-CH=CH-CH-CH= CH
-I
hydrogène allylique