CARACTERISATION DU CORTEGE
ECTOMYCORHIZIEN D'UNE PLANTATION
FORESTIÈRE ET SYLVOPASTORALE
D'EUCALYPTUS UROGRANDIS AU BRÉSIL
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval dans le cadre du programme de maîtrise en Agroforesterie
pour l'obtention du grade de Maître es Sciences (M.Se)
DEPARTEMENT DES SCIENCES DU BOIS ET DE LA FORET FACULTÉ DE FORESTERJE, DE GÉOGRAPHIE ET DE GÉOMATIQUE
UNIVERSITÉ LAVAL QUÉBEC
2010
La présente étude traite des communautés de champignons ectomycorhiziens retrouvés en association avec Eucalyptus urograndis dans un système de plantation monoculturale et deux systèmes agroforestiers sylvopastoraux à Viçosa, dans l'état du Minas Gérais, Brésil. Un des systèmes sylvopastoraux est composé d'£. urograndis et d'herbe de fourrage (Brachiaria spp.), tandis que l'autre est composé d'une culture mixte de Brachiaria et de deux espèces ligneuses, E. urograndis et Acacia mangium. La composante animale (vaches Holstein) était temporairement intégrée dans les deux systèmes sylvopastoraux. La caractérisation des communautés a été faite pour ces trois systèmes, et ces derniers ont été comparés. Selon les données issues de la ségrégation morphologique, aucune différence n'a été trouvée aux niveaux de la structure des communautés et du taux de mycorhization des apex racinaires d'Eucalyptus. Les indices de diversité et d'équitabilité ont montré une différence entre le système agroforestier composé d'Eucalyptus et de Brachiaria et les deux autres systèmes. L'analyse phylogénétique des séquences d'ITS des champignons a révélée une grande diversité de Thelephoraceae pour les trois systèmes. Les représentants des Sclerodermataceae et Hydnangiaceae n'étaient pas aussi diversifiés que ceux des Thelephoraceae, mais parmi les plus abondants.
Abstract
The present study examines the ectomycorrhizal communities associated with Eucalyptus urograndis under a monocultural and two silvopastoral plantation systems, in Viçosa, State of Minas Gérais, Brazil. One of the silvopastoral systems comprised E. urograndis and Brachiaria spp. forage grass, whereas the other system included a mixture of Brachiaria and two tree species, E. urograndis and Acacia mangium. The animal component (Holstein cows) was temporarily integrated into the two sylvopastoral systems. The ectomycorrhizal communities were characterized for the three systems and compared amongst themselves. Based on the data collected from morphological segregation, no significant difference was observed at the levels of community structure and mycorrhization colonization rates of the root tips of Eucalyptus. The diversity and evenness indices were significantly different between the agroforestry system composed of Eucalyptus and Brachiaria, and the other two systems. The phylogenetic analysis of the fungal ITS sequences revealed high diversity of Thelephoraceae for the three systems. Representatives of Sclerodermataceae and Hydnangiaceae were not as diversified as those of Thelephoraceae, but amongst the most abundant.
Avant-propos
Le plus gros des remerciements va à mon directeur Damase P. Khasa, qui dès notre première rencontre m'a pris sous son aile, et m'a guidée à travers des étapes de ce projet (parfois à de très grande distance). Merci de m'avoir permis de voyager ainsi, de connaître le monde de la recherche, le Brésil et 1TCOM. Je remercie aussi mon co-directeur Jean Bousquet pour ses conseils précis et ciblés dans l'analyse des données moléculaires.
Agradeço a Doutora Maria Catarina Megumi Kasuya, que me apoiou durante minha estadia no Brasil. Graças a voce, eu pude fazer esta pesquisa e visitar estes lugares maravilhosos do seu pais. Tanto na esfera profissional quanto na pessoal, voce cuidou de mim e para que tudo corresse bem. Um grande obrigado!
Aproveito esta oportunidade para também agradecer mais uma vez, Sabrina Feliciano Oliveira, sem quem nunca teria conhecido a vida estudante brasileira. Um aceno a todas as pessoas maravilhosas que me apoiaram no BIOAGRO. Especialmente Muriel, Marliane, Irene e José Maria. Obrigada para tudo.
Merci à Marie-Ève Beaulieu, Annie Champagne, André Gagné, Estelle Campagnac et Sauphie Senneville, pour toutes les fois où j'ai cogné à votre porte juste pour une petite question de deux secondes. Ces deux secondes se transformant souvent en plusieurs minutes, je vous remercie d'avoir pris le temps de m'aider. Sans vous, la réalisation de ce travail aurait été impossible.
Un petit clin d'oeil va à mes collègues de bureaux : Gabriel Sarasin, Alain René Atangana et Ridha Boukadida avec qui j'ai partagé ces longues heures (rarement silencieuses) et beaucoup de café.
Le meilleur pour la fin : ceux sans qui je n'aurais probablement pas le bonheur d'écrire ces mots de la fin ou du début.
Mille milliards de mercis à Simon qui me supporte, m'encourage, me motive, me rend heureuse et surtout, qui m'inspire.
Cent mille milliards de mercis à mes parents, Joyce, Robert et Daniel (c'est quand même tout un privilège que d'en avoir trois). Vous m'avez supporté à travers toutes mes remises en question, aussi existentielles soient-elles, et grâce à vous, voici l'aboutissement de ces sept années universitaires. Merci à ma soeurette Sabrina, qui m'a toujours encouragée malgré la distance qui nous sépare. Merci aussi à mes frérots, Johnnatan et Charles, pour exister, simplement.
Pour finir, j'envoie une petite pensée à ma chère et défunte grand-maman Rita, partie avant d'avoir compris c'était quoi une mycorhize, et plus particulièrement ce qu'on fait à l'école quand on n'a pas de cours.
Only after the last tree has been cut down. Only after the last river has been poisoned. Only after the last fish has been caught. Only then will you find that money cannot be eaten.
Résumé i Abstract ii Avant-propos iii Table des matières v Liste des tableaux vii Liste des figures viii
CHAPITRE 1 1 Revue de la documentation scientifique 1
1.1 La mycorhize 2 1.1.1 Les ectomycorhizes 3
1.1.2 La biologie des ectomycorhizes 6 1.1.3 Formation de la symbiose 8 1.1.4 Effets de la symbiose 9 1.1.5 Les communautés ectomycorhiziennes 10
1.1.6 Analyse moléculaire des communautés d'ectomycorhizes 11
1.2 Plantations et Eucalyptus 14 1.2.1 Plantations forestières 14 1.2.2 Plantations d'Eucalyptus au Brésil 16
1.2.3 Plantations, Eucalyptus et Mycorhizes 17
1.2.4 Eucalyptus urograndis 20
1.3 Agroforesterie 22 1.3.1 Le sylvopastoralisme 24
1.3.2 Agroforesterie et mycorhizes 25 1.4 But, objectif et hypothèse de recherche 27
1.5 Références 28 CHAPITRE 2 37
Preliminary survey of ectomycorrhizal communities in Eucalyptus urograndis
monocultural and silvopastoral plantation systems in Brazil 37
2.1 Avant propos 38 2.2 Résumé 39 2.3 Abstract 40 2.4 Introduction 41 2.5 Material and methods 43
2.5.1 Study site and Sampling 43 2.5.2 Morphological typing and numerical analysis 44
2.5.3 Molecular typing and numerical analysis 45
2.6 Results 47 2.6.1 Morphotyping 47 2.6.2 Molecular typing 51 2.7 Discussion 54 2.8 Conclusion 56 2.9 References 57
CHAPITRE 3 64 Conclusion générale 64
3.1 Récapitulatif sur les objectifs de recherche 65 3.2 Récapitulatif sur la méthodologie et les résultats 65
3.3 Perspectives de recherche 66
Liste des tableaux
Chapitre 1
Tableau 1.1: Les différents types de mycorhizes 3 Tableau 1.2: Estimation des périodes d'apparition et d'évolution des champignons
mycorhiziens à l'échelle géologique 4 Tableau 1.3 : Familles de plantes vasculaires et les espèces aptes à établir la symbiose
ectomcorhizienne 5
Chapitre 2
Table 2.1: Mycorrhization level and diversity indices used to characterize the three
different forest and agroforesty systems 48 Table 2.2: Phylogenetic grouping of the morphotypes into phylotypes and affiliation to
Liste des figures
Chapitre 1
Figure 1.1: Photographies d'un manchon ectomycorhizien de Cenococcum sp 7 Figure 1.2: Esquisse des détails du manchon ectomycorhizien formé SUT Al nus crispa avec
Alpova diplophloeus 8 Figure 1.3: Localisation des amorces ribosomales autour des régions ITS1 et ITS2 12
Figure 1.4: Facteurs contribuant aux changements dans les communautés des champignons
ectomycorhiziens suite aux coupes forestières 18 Figure 1.5: Systèmes agroforestiers de type sylvopastoral: (A) Eucalyptus urograndis et
l'herbacée Brachiaria spp.; (B) Jeunes Eucalyptus urograndis avec fèves de soya. ...23 Chapitre 2
Figure 2.1: Relative abundance (bars) and frequency (solid line) distributions of the
morphotypes for the three forest and agroforestry systems 49 Figure 2.2: (A) Detrended correspondance analysis of the abundance of the morphotypes
and the three forest and agroforestry systems. (B) Cluster analysis of the abundance of
the morphotypes (group average linkage method) 50 Figure 2.3: Phylogenetic placement of the morphotypes, based on Bayesian and maximum
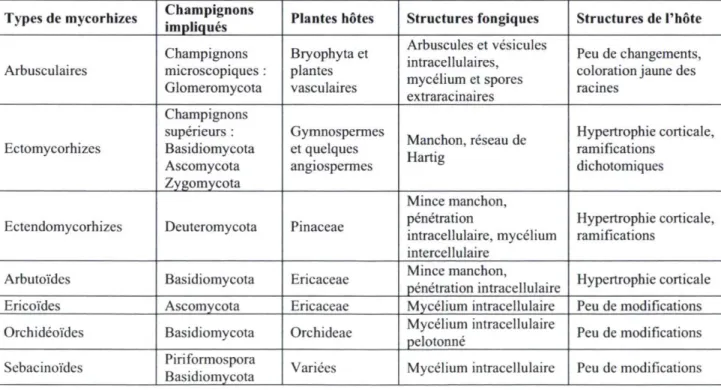
Les champignons jouent plusieurs rôles dans les écosystèmes et les deux principaux sont la décomposition de la matière organique et l'établissement de symbioses (Christensen 1989). En effet, certains champignons peuvent s'associer avec des algues, des insectes, des animaux ou des plantes. Cette dernière, qui implique des champignons et des plantes, se nomme la mycorhize. Plus précisément, les mycorhizes sont le résultat de l'association de champignons aux racines, ou rhizoïdes, des végétaux dans une relation symbiotique. Les associations mycorhiziennes sont présentes sur tous les continents et dans presque tous les biomes. En effet, au moins 90% des plantes terrestres sont associées à un champignon mycorhizien (Cairney 2000; Hibbett et al. 2000). Il existe plusieurs formes d'associations mycorhiziennes, qui peuvent être intra- ou inter-cellulaires (Tableau 1.1).
Les champignons participant à la symbiose mycorhizienne appartiennent aux embranchements des Glomeromycota, Basidiomycota, Ascomycota, et Zygomycota, selon le type d'association (Fortin et al. 2008). En général, les mycorhizes participent à la facilitation du transport de l'eau et des nutriments vers la plante, modifient le mouvement de l'eau et des ions à l'intérieur de la plante et facilitent le mouvement d'eau et de sucres entre les plantes (Smith et Read 2008). Elles participent aussi à la protection de la plante contre les pathogènes du sol (Azcôn-Aguilar et Barea 1996).
Le groupe des mycorhizes arbusculaires (MA) est le plus répandu et le plus étudié. Les MA sont formées par des champignons appartenant au groupe monophylétique des Glomeromycota et une gamme très variée de plantes. Selon une estimation conservatrice, 80% des plantes seraient associées à au moins un type de champignon à mycorhizes arbusculaires (Goltapeh et al. 2008). Les MA sont présentes dans les forêts tempérées, boréales, tropicales, dans les forêts de région aride, et même dans les jardins domestiques. Dans cette association, il y a formation de structures fongiques à l'intérieur même des
(Parniske 2008).
Les mycorhizes éricoïdes sont celles où des champignons de l'embranchement des Ascomycota s'associent avec les plantes de l'ordre des Ericales. Dans plusieurs situations édaphiques extrêmes, ces mycorhizes sont essentielles à la survie des éricacées (Caimey 2003). Les mycorhizes des orchidées sont quant à elles constituées de l'association des plantes de la famille des Orchidaceae avec plusieurs champignons des Basidiomycota. Outre les ectomycorhizes (ECM) qui feront l'objet d'une élaboration particulière, trois autres types de mycorhizes sont connus: les ectendomycorhizes, les mycorhizes arbutoïdes et les mycorhizes sebacinoïdes.
Tableau 1.1: Les différents types de mycorhizes. (Tableau modifié de Fortin et al. (2008)).
Types de mycorhizes Champignons impliqués Plantes hôtes Structures fongiques Structures de l'hôte Arbusculaires Champignons microscopiques :
Glomeromycota Bryophyta et plantes vasculaires Arbuscules et vésicules intracellulaires, mycélium et spores extraracinaires Peu de changements, coloration jaune des racines Ectomycorhizes Champignons supérieurs : Basidiomycota Ascomycota Zygomycota Gymnospermes et quelques angiospermes Manchon, réseau de Hartig Hypertrophie corticale, ramifications dichotomiques
Ectendomycorhizes Deuteromycota Pinaceae
Mince manchon, pénétration intracellulaire, mycélium intercellulaire Hypertrophie corticale, ramifications
Arbutoïdes Basidiomycota Ericaceae pénétration intracellulaire Mince manchon, Hypertrophie corticale Ericoïdes Ascomycota Ericaceae Mycélium intracellulaire Peu de modifications Orchidéoïdes Basidiomycota Orchideae pelotonné Mycélium intracellulaire Peu de modifications Sebacinoïdes Piriformospora Basidiomycota Variées Mycélium intracellulaire Peu de modifications
1.1.1 Les ectomycorhizes
En termes évolutifs, les ECM sont beaucoup plus récentes que les MA (Caimey 2000; Smith et Read 2008; Tableau 1.2). Les plus anciens fossiles d'ECM remontent au Tertiaire,
lieu beaucoup avant cela, soit autour de 200 MA, puisque les Pinaceae (une des principales plantes hôtes des ECM) et autres angiospermes ectomycorhiziens existaient bien avant 50 MA (Alexander 2006; Cairney 2000). Ces estimations de dates sont sujettes à contestation, puisque certains auteurs affirment que la radiation des ECM aurait eu lieu beaucoup plus tôt (Alexander 2006).
Les champignons ectomycorhiziens forment un groupe polyphylétique, tout comme les plantes qui participent à cette symbiose (Hibbett 2000). La capacité des plantes à s'associer à ces champignons serait donc apparue plus d'une fois dans l'évolution. Au moins une première fois avec des plantes ancêtres des Pinaceae et une autre fois avec des plantes ancestrales des angiospermes (Cairney 2000; Bruns et Shefferson 2004).
Tableau 1.2: Estimation des périodes d'apparition et d'évolution des champignons mycorhiziens à l'échelle géologique (tiré de Cairney (2000)).
Period Approximate Events and evidence
lime Reference Quaternary < 1.8 mya Tertiary < 65 mya Cretaceous < 145 mya Jurassic < 208 mya Triassic <245mya Permian < 290 mya Carboniferous < 363 mya Devonian <409mva Silurian
Ordvician < 439 mya <510mva
Fossil ectomycorrhizas (ca. 50 mya) Fossil Ericaceae-like plants (ca. 90 mya) Appearance or cricoid mycorrhizas? Evolution of mushrooms (ca. 130 mya)a
Fossil Pinaceae (ca. 200 mya) Appearance of ectomycorrhizas?
Evolution of higher basidiomycetc lineages (ca. 220 mya)3
Fossil basidiomycetes (ca. 290 mya) Fossil arbuscular mycorrhizas (ca. 400 mya) Divergence of basidiomvectes from ascomycetes (ca. 390 mya)"
Fossil ascomycetes (ca. 410 mya)
Evolution of arbuscular mycorrhizal fungi (ca. 460 mya)*
Appearance or arbuscular mycorrhizas?
Fossil G/omitf-Iikc fungi (ca. 460 mya) First land plants (ca. 475 mya)
Pre-basidiomycetes/ascomycetes diverged from Glomaceae (ca. 500 mya)*
LePage et al (1997) Nixon and Crcpct (1993) Berbee and Taylor (1993) Hibbett et al. (1997) Berbee and Taylor (1993) Dennis (1970)
Remv et al (1994); Taylor et al. (1995) Berbee and Taylor (1993)
Sherwood-Pike and Gray (1985) Simon et al. (1993)
Rcdecker et al. (2000a) Kenrick and Crane (1997) Berbee and Tavlor (1993) "Denotes molecular clock estimates inferred from rates of DNA nucleotide substitutions
Parmi les groupes les plus connus de champignons ectomycorhiziens, on retrouve les bolets, les amanites, les chanterelles, les russules et les truffes (Fortin et al. 2008). Malgré le fait que les symbioses ectomycorhiziennes impliquent moins de 5% des plantes terrestres, on estime qu'environ 20 000 espèces de champignons (213 genres) et 25 000 espèces (30 familles) de plantes forment des ectomycorhizes (Molina et al. 1992; Smith et
uniquement, il pourrait exister plusieurs centaines de milliers d'espèces de champignons aptes à faire des ECM (Caimey 2000).
Les champignons ectomycorhiziens appartiennent aux Basidiomycota, aux Ascomycota et en moindre importance aux Zygomycota (Caimey 2000; Smith et Read 2008). Ils s'associent principalement aux espèces ligneuses, mais aussi à certaines herbacées (Tableau
1.3). Puisque les plantes ectomycorhiziennes peuvent généralement s'associer à plusieurs groupes de champignons différents, on estime que leur spécificité est faible, ce qui leur confère un net avantage évolutif. En effet, le fait de s'associer à des groupes aux propriétés différentes pourrait permettre aux végétaux de profiter d'une gamme plus étendue de nutriments (Smith et Read 2008).
Tableau 1.3: Familles de plantes vasculaires et les espèces aptes à établir la symbiose ectomycorhizienne (modifié de Brundrett (2009)).
Famille Nombre de genres d'espèces Nombre
Gnetaceae 1 35 Pinaceae 11 250 Cyperaceae 1 132 Asteropeiceae 1 8 Nyctaginaceae 3 5 Polygonaceae 2 29 Myrtaceae 10 1800 Fabaceae 35 1100 Betulaceae 6 130 Casuarinaceae 2 SO Fagaceae 8 750 Junglandaceae 2 32 Nothofagaceae 1 35 Phyllanthaceae - 105 Salicaceae 2 385 Rhamnaceae 4 130 Rosaceae 3 29 Cistaceae 8 180
Sarcolaenaceae 8 60
Tiliaceae 1 22
Meliaceae 1 5
Ericaceae 17 130
Sapotaceae 1 80
1.1.2 La biologie des ectomycorhizes
Les ectomycorhizes sont caractérisées par trois structures principales: le réseau de Hartig, le manchon mycorhizien et le réseau mycélien extraradical (Figure 1.1; Smith et Read 2008). La forme de chacune de ces structures peut varier selon le champignon et l'hôte, et peut être utilisée pour l'identification du champignon. Le développement des structures ectomycorhiziennes est le résultat d'interactions génétiques, chimiques et moléculaires entre le champignon et la plante, ainsi que de la synchronisation de la croissance racinaire et la différenciation fongique (Brundrett et al. 1996).
Le manchon mycélien se forme autour de l'apex des jeunes racines fines (Figure 1.1; Brundrett et al. 1996). Il consiste en une épaisse masse fongique pseudoparenchymateuse qui enveloppe l'extrémité de la racine (Martin et al. 2001; Figure 1.2). L'arrangement des cellules du manchon est caractéristique de l'espèce, il peut ainsi être plus ou moins dense et plus ou moins structuré (Martin et al. 2001). La croissance des apex racinaires ectomycorhizes est ralentie, par rapport aux racines non-colonisées, ce qui permet au champignon de construire son mycélium sur l'apex racinaire (Chilvers et Gust 1982).
Grossissement 40X et 2,5X.
Une autre des caractéristiques distinctives des ectomycorhizes est la formation d'un réseau d'hyphes intraracinaires et extracellulaires: le réseau de Hartig. Ainsi, contrairement aux mycorhizes arbusculaires, les hyphes des ECM ne pénètrent pas à l'intérieur des parois cellulaires des végétaux. Le réseau d'hyphes, qui parvient à pénétrer dans la racine, va former un réseau dense entre les cellules épidermales et corticales, qui constituera le réseau de Hartig (Martin et al. 2001; Smith et Read 2008).
Les hyphes extraracinaires des champignons ectomycorhiziens se développent depuis le manchon et forment des filaments, qui peuvent être individuels ou regroupés et qui s'appellent des rhizomorphes (Smith et Read 2008). La complexité de ces structures varie beaucoup selon l'espèce, allant d'un hyphe simple à un regroupement complexe (Agerer 2001). Il existe aussi une grande plasticité phénotypique dans la formation des hyphes en milieu naturel (Smith et Read 2008). Les hyphes des ECM sont principalement distribués dans les sols forestiers et contribuent à la biomasse des sols (Brundrett et al. 1996). Dans une expérience en pot, on a trouvé que les ECM pouvaient produire jusqu'à trois fois plus de mycélium extraradical que les MA (Jones et al. 1998).
La dissémination des propagules est surtout effectuée par la voie aérienne, via les fructifications et par les inoculums de sol provenant des plantules (dans un contexte de plantation). Les rhizomorphes sont aussi une source de propagation importante, mais ne
Manchon mycélien
Réseau de Hartig
Cellules corticales de la racine
Figure 1.2: Esquisse des détails du manchon ectomycorhizien formé sur Alnus crispa avec Alpova diplophloeus (image reproduite et adaptée de Smith et Read 2008).
1.1.3 Formation de la symbiose
Smith et Read (2008) ont résumé les étapes majeures impliquées dans la formation de la symbiose ectomycorhizienne. Premièrement, le début de la phase présymbiotique est caractérisé par la sécrétion d'exsudats racinaires par la plante. Ceci a pour effet de stimuler la germination des spores et le développement des hyphes. Suite à ces événements, l'hyphe entre en contact avec la racine. Les poils racinaires des racines non colonisées offrent une grande surface de colonisation potentielle pour les champignons. Suite au premier contact, le champignon subit des altérations morphologiques qui enveloppent partiellement le poil racinaire. 11 y a fusion d'hyphes, une croissance accrue et le développement de la symbiose.
épidermiques. Après la pénétration du champignon, les cellules épidermiques de la plante subissent des altérations morphologiques, comme une elongation ou une augmentation de la croissance radiale. La profondeur du réseau de Hartig varie selon le champignon et la plante (angiosperme ou gymnosperme, Figure 1.2).
1.1.4 Effets de la symbiose
La symbiose ectomycorhizienne induit plusieurs effets, à la fois sur le champignon et sur son hôte végétal. On pourrait classer, de manière générale, ces effets en deux catégories : les effets sur la nutrition et les effets sur la défense.
Plusieurs effets sur la nutrition de la plante et du champignon ont été rapportés dans la littérature et certains ne sont pas sans rappeler l'affiliation évolutive des champignons ECM aux saprophytes, comme la capacité à dégrader la lignine (Abuzinadah et Read 1989; Cao et Crawford 1993; Caimey 2000; Nehls et al. 2010). Un des effets les plus importants serait l'augmentation de la surface de contact par les hyphes fongiques au-delà de la zone d'exploitation des racines (Smith et Read 2008). Cette caractéristique est d'autant plus importante chez les mycorhizes arbusculaires que chez les ECM, mais le champignon reste quand même la première interface entre la plante et les nutriments (Horton et Bruns 2001 ). Les champignons ECM assimilent les acides aminés du sol et facilitent les transferts vers les plantes hôtes des formes minéralisées d'azote, de phosphore et aussi de certaines formes organiques d'éléments (Caimey 2000, Taylor et al. 2004). Ils ont aussi la capacité de dissoudre les éléments nutritifs par la sécrétion d'acides organiques (Landeweert et al. 2001; Van Hees et al. 2006). Le diamètre des hyphes étant généralement grandement inférieur à celui des racines, cela permet au champignon d'avoir accès à des ressources autrement inaccessibles. En plus de l'amélioration de la nutrition minérale chez la plante, une tolérance accrue à la sécheresse et une protection contre les métaux lourds peuvent être induites par la mycorhization (Parke et al. 1983; Osonubi et al. 1994). Un autre bienfait de cette symbiose est une protection contre des organismes pathogènes (Marx 1972; Peterson
et al. 1984; Branzanti et al. 1999). En effet, le champignon offre aussi une barrière physique via le manchon.
1.1.5 Les communautés ectomycorhiziennes
Les champignons ectomycorhiziens varient entre eux quant à leur capacité d'accéder aux nutriments, leurs affinités pour les microsites du sol, leur tolérance aux facteurs abiotiques, leurs patrons de colonisation des apex racinaires et leur capacité à se disperser et à répandre leurs spores (Jones et al. 2003). Ceci a nécessairement une influence sur la structure de la communauté et ses composantes.
Le simple recensement des carpophores ne semble plus approprié dans les études de communautés pour plusieurs raisons. La plus importante est qu'utilisée seule, l'analyse morphologique entraîne souvent des erreurs humaines pour les mycotaxanomistes non expérimentés. D'autant plus que l'abondance des fructifications des champignons ectomycorhiziens ne correspond généralement pas à l'abondance sous-terraine (Gardes et Bruns 1996; Dahlberg et al. 1997). Aussi, la production de fructifications varie d'une espèce à l'autre, selon les stratégies de reproduction et de nutrition de chacune (Bonello et al. 1998; Giachini et al. 2000, Fortin et al. 2009). La production de fructifications est aussi affectée par des facteurs abiotiques et varie d'une année à l'autre (Dahlberg et al. 1997; Sakakibara et al. 2002; Giachini et al. 2004; Gévry et al. 2009). Lors d'une collecte de fructifications, de nombreux carpophores peuvent passer inaperçus, comme ceux qui ont des fructifications hypogées, trop petites pour être vues (ex. ascomycetes). Il en est de même des champignons comme Cenococcum geophilum qui n'ont pas de stade sexuel connu (Sakakibara et al. 2002).
Malgré que les recherches sur la structure des populations des ectomycorhizes aient débutées depuis plus d'une décennie, sa compréhension reste faible, tant dans les écosystèmes aménagés que naturels (Bonello et al. 1998; Giachini et al. 2004; Peay et al. 2010). Il est maintenant reconnu qu'une communauté d'ectomycorhizes est composée de
plusieurs taxons, mais que quelques-uns seulement représentent la majorité de la biomasse épigée (Dahlberg et al. 1997). Par exemple, dans un inventaire effectué sur six ans, on a trouvé que plus de la moitié des espèces recensées avaient été observées au cours d'une seule année. Dans cette étude, seulement sept espèces (sur 47) ont été observées sur les six années d'étude (Dahlberg et al. 1997).
L'espèce ligneuse dominante d'un système forestier aménagé ou naturel aurait plus d'influence sur la diversité des mycètes que la situation géographique. Ceci a été illustré en Australie, où l'on a comparé les communautés de champignons dans une plantation de Pinus radiata, d'Eucalyptus globulus, une forêt d'Eucalyptus naturelle et une zone de pâturage (Kasel et al. 2008). Les facteurs abiotiques (pH, disponibilité de l'eau, type de sol) ont tout de même un effet sur la structure des communautés et la production de fructifications (Peay et al. 2010).
1.1.6 Analyse moléculaire des communautés d'ectomycorhizes
Il existe un intérêt grandissant pour l'étude des communautés ectomycorhiziennes et ceci implique l'utilisation d'outils de caractérisation efficace. Traditionnellement, des analyses morphologiques étaient utilisées, faute d'alternatives. Ainsi, plusieurs atlas ont été élaborés pour permettre l'identification des champignons ectomycorhiziens à partir des sporocarpes, des apex racinaires (Agerer 1987-2002; Goodman et al. 1996-1999) et même des hyphes mycéliens (Agerer 2001). L'utilisation d'outils moléculaires est aujourd'hui devenue une pratique courante dans les analyses de communautés fongiques. C'est en grande partie leur accessibilité et leurs applications multiples qui leur ont valu cette popularité. Les études moléculaires ont aussi l'avantage d'être indépendantes face aux influences biotiques et abiotiques, ce qui n'est pas le cas des méthodes traditionnelles (Egger 1995).
1000 2000 3000 4000 5000 6000
SSU ITS1 ITS2 LSI!
5.8S / ITS5 %-, ITSJ / ITS9mun ~ITS1-F /NSA3 NSI1~ ITS3 58A2F 58A1F NL5mun 58A2R NLB4 NLC2 ITS4-B
ITSIOmun ITS8mun NL6Bmun NL8mun NL6Amun
ITS2 ITS4
1400 1600 1800 2000 2200 2400 2600 2800 3000 3200
Figure 1.3: Localisation des amorces ribosomales autour des régions ITS1 et ITS2. Tiré de Martin et Rygiewicz (2005).
La technique la plus commune est l'application de la réaction en chaîne de polymerase (PCR) associée aux analyses des polymorphismes de longueur de fragments de restriction (RFLP) (Horton et Bruns 2001). Les analyses de RFLP permettent de quantifier les variations dans les séquences d'ADN par l'entremise de digestions de ces fragments par des enzymes de restriction (Freeland 2005). Les fragments ainsi obtenus sont séparés par une migration sur gel d'agarose. On peut ensuite visualiser les bandes à l'aide de molécules capables de se fixer sur l'ADN et d'émettre une fluorescence (SYBR green, bromure d'éthidium).
espèces, les marqueurs utilisés doivent être largement conservés au sein du groupe taxonomique d'intérêt, tout en affichant une très grande variabilité entre les espèces (Egger
1995). Pour les analyses de communautés fongiques par PCR-RFLP, la région ITS de l'ADN ribosomal est la plus utilisée (Gardes et Bruns 1993). LTTS est le Internai Transcribed Spacer, une portion d'ADN non codante, qui se situe entre les ADN ribosomaux de structure. Ce dernier est reconnu pour évoluer très rapidement et permet de faire la distinction entre les espèces de végétaux et de champignons (White et al. 1990; Glen et al. 2001). Plus spécifiquement, les marqueurs utilisés amplifient les séquences ITS1 et ITS2, qui se situent de part et d'autre de l'operon ribosomal 5,8S (Figure 3; White et al. 1990; Martin et al. 2005). Il en existe un grand nombre de copies et les régions flanquantes sont très conservées.
Dans une étude comparant deux techniques d'identification, soit l'identification morphologique et les analyses par PCR-RFLP, on a trouvé que la précision des deux techniques était sensiblement la même. Dans 93% des cas, l'identification morphologique correspondait aux résultats obtenus par les patrons de bandes de la PCR-RFLP (Sakakibara et al. 2002). L'identification morphologique était basée sur l'observation des caractéristiques suivantes: couleur, texture, abondance d'hyphes externes et texture des filaments d'hyphes sous observation à 40X (tel que suggéré par Goodman et al. 1996). Les mycorhizes jugées les plus représentatives étaient observées sous un grossissement de 400X - 1000X de sorte à observer la partie interne et externe du manchon et à les caractériser selon la forme des cellules. Ces deux typages combinés ont permis d'identifier la majorité des mycorhizes. Les auteurs (Sakakibara et al. 2002) concluent que le morphotypage, lorsqu'il est bien fait, peut être utilisé pour regrouper les ectomycorhizes jusqu'au niveau de l'espèce pour la majorité des champignons, mais pas pour tous. Les analyses PCR-RFLP des ITS permettent aussi d'identifier les groupes taxonomiques, mais pas toujours les espèces. L'étude morphologique suggérée par Sakakibara et al. (2002) est très détaillée, mais Horton et Bruns (2001) ont démontré que même une séparation grossière permettrait de séparer les morphotypes, à un niveau similaire aux RFLP. Des résultats similaires ont été obtenus par Burke (2005) en comparant l'analyse morphologique à celle des patrons T-RFLP (Terminal - Restriction Fragment Length Polymorphism) des
ITS1 et ITS2. Dans la grande majorité des cas, un morphotype était associé à un seul patron TRFLP.
L'analyse détaillée des morphotypes n'est donc pas nécessaire, surtout à une époque où les outils moléculaires sont accessibles et les experts en mycotaxonomie sont rares (Horton et Bruns 2001). Il a aussi été démontré dans certaines études que plusieurs morphotypes pouvaient donner le même patron de bandes RFLP et qu'un seul morphotype pouvait à lui seul donner des patrons différents et irréguliers (Timomen et al. 1997; Glen et al. 2001; Burke et al. 2005). L'étape de l'analyse morphologique ou de RFLP, qui fait partie de l'analyse des communautés ectomycorhiziennes, doit donc être complétée par une analyse des séquences, de sorte à confirmer ou infirmer les différentes espèces trouvées. Cette étape d'analyse moléculaire fine permet aussi de sauver beaucoup de temps, puisqu'une analyse en profondeur des manchons mycorhiziens n'est plus indispensable (Burke et al. 2005).
L'analyse morphologique peut parfoismener à plus de morphotypes que l'analyse moléculaire, puisqu'elle est sujette aux différences induites par l'âge du manchon, l'expression phénotypique, les conditions environnementales et naturellement, l'habileté de l'observateur à séparer les types (Burke et al. 2005). Depuis que l'accès au séquençage est devenu abordable, plusieurs auteurs ont eu recours à cette technologie pour contourner les problèmes mentionnés précédemment et identifier les champignons par le biais de leur séquence ITS (Egger 1995; Chen et Caimey 2002; Giomaro et al. 2002; Anderson et Caimey 2004; Karkouri et al. 2005). Teste et al. (2009) ont passé directement au séquençage après avoir fait l'extraction d'ADN. Les morphotypes qui ne pouvaient pas être identifiés par BLAST, ont été identifiés, du mieux possible par une analyse morphologique détaillée a posteriori.
1.2 Plantations et Eucalyptus
1.2.1 Plantations forestières
préoccuper des forêts naturelles et a peu à peu réalisé que ces dernières ne suffiraint pas à répondre aux besoins de la population grandissante. Plusieurs auteurs suggérèrent alors que des plantations artificielles pourraient diminuer la pression exercée sur le milieu naturel et ainsi préserver une plus grande proportion des forêts, tout en catalysant la réhabilitation des terres abandonnées (Bernhard-Reversat et al. 2001; Bowyer et al. 2005).
Les plantations industrielles sont d'un grand intérêt pour la production de grandes quantités de fibre pour les pâtes et papiers, le bois-énergie et le bois de construction. La population grandissante de la planète exerce une pression croissante sur les ressources naturelles; la sylviculture et particulièrement la ligniculture, sont des solutions potentielles au manque de bois (Bowyer et al. 2005). Pour plusieurs pays, la production de bois par les plantations forestières est la source primordiale d'énergie et de biomasse. À Madagascar par exemple, la production en bois des plantations de l'île compte pour plus de 50% de l'approvisionnement de la population en énergie domestique (CIRAD 2009). La production mondiale de pâtes à partir de Y Eucalyptus a passé de 22 millions à 35 millions de tonnes entre 1979 et 1995 (Bernhard-Reversat et al. 2001).
Le cyclage des nutriments, qui va ultimement influencer la nutrition naturelle des arbres, est grandement influencé par la vitesse du recyclage. Le taux de décomposition de la litière forestière est influencé par plusieurs facteurs abiotiques (température, humidité, composition chimique) et biotiques (activités de la microfaune, des champignons et des bactéries) (Molina et al. 1992; Spangenberg et Fôlster 2002). Ces facteurs, qu'ils soient abiotiques ou biotiques, seront affectés par les activités de coupes industrielles, comme la coupe à blanc (Jones et al. 2003). Ainsi, si les communautés fongiques et la pédofaune sont affectées de sorte que le taux de décomposition devennait inférieur au taux de production, il y aurait accumulation au sol, ce qui mobiliserait plusieurs nutriments essentiels, les rendant non disponibles pour l'arbre. La fertilité à long terme des sols concernés serait altérée. Il est donc essentiel de bien connaître les organismes du sol à l'intérieur des plantations forestières, puisque la nutrition des arbres et la fertilité des sols à moyen et long terme en sont dépendants.
Les plantations forestières comportent des avantages et des inconvénients. Parmi les inconvénients les plus notables, outre les aspects sociaux, il on retrouve les dommages causés à l'environnement. Les préoccupations principales incluent la chute de fertilité du sol due à l'acidification, l'exploitation des ressources hydriques, la propagation de maladies et la réponse de la flore et de la faune natives associées à la forêt naturelle (Cannell 1999; Bowyer et al. 2005). Les propriétés physicochimiques, telles que la composition du sol et sa structure, pourraient aussi être affectées (Bernhard-Reversat et al. 2001). Les effets négatifs de la monoculture peuvent être minimisés avec des techniques de gestion appropriées et ainsi permettre de maximiser les effets positifs. L'importance relative des impacts négatifs des plantations sur l'environnement par rapport aux bienfaits pour la société dépend donc des méthodes de gestion employées (Bowyer et al. 2005).
La haute productivité par aire d'exploitation est généralement très avantageuse pour les compagnies forestières. D'un point de vue comparatif, on estime que la production de bois et de fibres est généralement moins nocive pour l'environnement que la production de plusieurs autres types de matières premières (Bowyer et al. 2005). Aussi, il a été démontré que les forêts aménagées, comme les monocultures d'Eucalyptus, stockent plus de carbone que les forêts naturelles, ce qui représente un intérêt dans la lutte aux changements climatiques (Cannell 1999).
1.2.2 Plantations & Eucalyptus au Brésil
Les genres Eucalyptus et Pinus ont été introduits au Brésil au début du 20ième siècle, dans le but de fournir de la fibre aux industries de pâtes et papiers et pour stimuler l'économie (Giachini et al. 2004). Ces arbres se sont très bien adaptés, grâce à la richesse des sols et à l'abondance de l'eau. C'est en 1868 que les premiers Eucalyptus ont été introduits au Brésil, mais ce n'est pas avant 1904 que les plantations commerciales ont vu le jour et déjà, en 1909, on comptait 144 espèces introduites (Assembléia Legislativa do Estado de Minas Gérais, 2010).
h'Eucalyptus est une importante source d'énergie et de pâtes pour le Brésil et le reste du monde (Ceccon 2005). On estime que 25% de toutes les populations forestières artificielles sont des plantations d'Eucalyptus (Bowyer et al. 2005). Une grande partie de son intérêt, par rapport aux autres espèces ligneuses, est sa rapidité de croissance. Les plantations du sud et du centre du Brésil, comme celles de l'état de Minas Gérais, sont généralement de courte rotation, entre six et 10 ans (Spangenberg et Fôlster 2002). Dans des conditions climatiques appropriées, l'Eucalyptus croît plus rapidement que la majorité des autres espèces arborescentes, même celles qui sont locales ou endémiques (Poore et Fries 1986). Les états du Brésil où l'on retrouve le plus d'Eucalyptus sont au sud du pays, soit les états de Sào Paulo et du Minas Gérais (Metro 1982).
Les plantations d'Eucalyptus peuvent avoir d'importants impacts sur le climat local, le microclimat à l'intérieur de la forêt, l'écoulement superficiel de l'eau, la recharge des nappes phréatiques et la teneur en eau du sol (Poore et Fries 1986). Ces effets peuvent être considérés comme positifs ou négatifs, selon l'état initial du site et les différents points de vue environnementalistes. On constate que les plantations artificielles d'Eucalyptus peuvent aussi affecter la faune (micro faune, macro faune, faune aviaire, insectes etc.). En effet, la diversité des vertébrés et des invertébrés est inférieure dans les monocultures d'Eucalyptus que dans la forêt native (Lindenmayer et Hobbs 2004). Ceci est dû, au moins en partie, à la simplification des systèmes de plantations : absence d'arbres morts, de vieux arbres, d'arbres creux, faible diversité de végétaux herbacés et arbustes. Le dépôt de litière sous ces systèmes de plantations est aussi nettement inférieur aux dépôts en forêts naturelles (Bernhard-Reversat et al. 2001).
1.2.3 Plantations, Eucalyptus et Mycorhizes
Les plantations industrielles mènent à des changements dans les processus du sol et affectent la richesse ectomycorhizienne ainsi que les relations de dominance entre les espèces présentes (Chapela et al. 2001; Kasel et al. 2008 ; Figure 1.4). On a déjà rapporté une diminution de la richesse et une altération de la structure des communautés des espèces
mycorhiziennes et autres microorganismes du sol suite à des activités sylvicoles (Vâldes et al. 2009). Puisque le type d'exploitation a une influence plus importante sur la composition de la communauté que le type de sol ou la localisation, il est impératif de recueillir des informations sur les groupes mycorhiziens associés aux arbres mis en culture sous les différents régimes (Kasel et al. 2008). Par exemple, plusieurs compagnies préparent les sites de plantations en enlevant la couche organique du sol avant de planter, tandis qu'il est bien connu que la plus grande diversité d'espèces ectomycorhizienne se retrouve dans les horizons organiques du sol (Jones et al. 2003). Un autre exemple de pratique forestière inappropriée au maintien des communautés d'ECM est la coupe à blanc, qui prive les champignons de leur source principale de sucres (Jones et al. 2003).
Which factors contribute to the changes in the ECM fungal community on clearcuts?
Shift in amount or type of inoculum Dying hyphae and ectomycorrhizas Temperature non-symbiotic organisms
Change in soil environment
Physical Moisture Biological Soil microflora and fauna introduction of ECM fungi from nursery Chemical
z
pH Carbon inputs Changes in potential hosts or non-hosts decrease inhost age planting or regeneration of different tree species
Figure 1.4: Facteurs contribuant aux changements dans les communautés des champignons ectomycorhiziens suite aux coupes forestières. Tiré de Jones et al. (2003).
provenance exotique qui pourrait avoir des effets allélopathiques sur les organismes du sol. En général, des effets allélopathiques peuvent êtres observés entre des espèces de provenance différente ou dans des conditions où les microorganismes du sol sont incapables de détruire les toxines métaboliques (Souto et al. 2001). Dans les plantations d'Eucalyptus, on a retrouvé une quantité élevée de composés phénoliques, dont certains ont un effet allélopathique sur la végétation avoisinante (Bernhard-Reversat et al. 2001). Ceci a été démontré en Espagne par la décomposition des parties aériennes d'Eucalyptus globulus qui dégagent des phytotoxines, empêchant la croissance des plantes de sous-bois (Souto et al. 1994). Les ectomycorhizes ont une réponse différente des autres organismes du sol lorsqu'ils sont en présence de phytotoxines (Pellissier et Souto 2010). La croissance de certains champignons ectomycorhiziens peut même être stimulée par des extraits foliaires de certaines plantes. La réponse des mycorhizes aux produits allélochimiques est complexe et dépend de la structure chimique des composés allélopathiques, de leur concentration et de l'espèce de champignon. La relation entre ces composantes ne peut donc pas être généralisée puisque chaque espèce aura une réponse particulière aux composés et à leur concentration (Rose et al. 1983).
Il existe une succession des espèces ectomycorhiziennes dans les forêts (Jones et al. 2003). Les révolutions de 7-10 ans au Brésil de l'Eucalyptus impliquent qu'on ne retrouve pas, ou très peu de vieux arbres sur les sites plantés. La diversité des organismes du sol est par le fait même diminuée. D'autant plus que les champignons qui colonisent les racines des jeunes pousses ne sont pas les mêmes en forêt naturelle et en plantation (Jones et al. 2003).
Plusieurs plantes, dont celles du genre Eucalyptus, sont capables de former à la fois des ectomycorhizes et des mycorhizes arbusculaires (Lapeyrie et al. 1985; Chilvers et al. 1987; Oliveira et al. 1997; Dos Santos et al. 2001). En début de croissance, chez les Eucalyptus, les MA dominent sur les ECM. Dans une étude faite en pots où l'on a inoculé des plantules d'Eucalyptus dumosa avec des champignons mycorhiziens provenant de sols naturels, on a trouvé qu'après 2 mois, 52% des racines étaient colonisées par des MA et 10% par des ECM (Chilvers et al. 1987). Après 5 mois, les proportions étaient inversées et on retrouvait 10% des racines colonisées par des MA et 54% par des ECM. En nature, c'est autour de 7-8
mois qu'il y aura inversion des proportions, jusqu'à l'atteinte d'un équilibre où les ECM domineront largement les MA (>90% et <5% de colonisation des racines par les ECM et par les MA, respectivement) (Bellei et al. 1992). Quoiqu'il n'y ait probablement pas d'effet antagoniste entre les deux types de champignons mycorhiziens, cette succession caractéristique serait en partie due à une compétition entre les champignons (Chilvers et al.
1987). Les patrons de colonisation successive des racines dépendraient aussi de la vocation antérieure du site. En effet, si une plantation est installée sur une terre anciennement agricole, la proportion de MA sera plus élevée que si on installe la plantation sur une terre forestière (Oliveira et al. 1997).
Plusieurs études se sont déjà intéressées aux communautés de champignons ectomycorhiziens dans les plantations d'Eucalyptus au Brésil (Singer et Araûjo 1979; Yokomizo 1986; Giachini et al. 2000, 2004). Ces études étaient centrées sur l'identification morphologique des fructifications présentes dans les plantations et ont grandement contribué aux connaissances des ECM au Brésil. Plusieurs nouvelles espèces ont été décrites et une relation a pu être établie entre les champignons ECM présents en Australie et ceux au Brésil (Giachini et al. 2000).
1.2.4 Eucalyptus urograndis
Le genre Eucalyptus est subdivisé en 13 sous-genres et contient plus de 800 espèces, pour la majorité originaires de l'Australie (Poore et Fries 1986; Brooker 2000; Brooker et Kleinig 2001). De nos jours, plusieurs hybrides sont utilisés pour la culture, comme dans le cas de cette étude, qui traite de Eucalyptus urograndis. Ce dernier est obtenu par le croisement entre E. grandis et E. urophylla. E. grandis est originaire du sud-est de l'Australie (Nouvelle-Galles). Il est apprécié pour son bois flexible, sa facilité d'adaptation à de nouveaux climats et son taux de croissance rapide (Metro 1982).
Dans une étude qui comparait le contenu en calcium de l'écorce de différentes espèces d'Eucalyptus (élément souvent limitant dans les sols Brésiliens), E. grandis était celui qui
accumulait le plus de biomasse et de nutriments (Spangenberg et Fôlster 2002). E. urophylla est quant à lui originaire du Timor et des autres îles de l'Archipel indonésien. Sa particularité de bien s'adapter à de très basses latitudes et altitudes lui a valu beaucoup d'intérêt au sein de la communauté scientifique. Sa facilité à s'hybrider, sa croissance rapide, la solidité de son bois et sa résistance aux champignons pathogènes en font aussi une espèce intéressante pour l'industrie.
1.3 Agroforesterie
De façon générale, l'agroforesterie est l'ensemble des systèmes et techniques d'utilisation des terres où des plantes ligneuses vivaces sont délibérément associées aux cultures ou à la production animale sous forme d'un arrangement spatial ou d'une séquence temporelle prenant place sur une même unité de gestion de la terre (Lundgren et Raintree 1982). Plus précisément, on considère qu'il s'agit d'un système dynamique d'aménagement écologique des ressources naturelles, qui en intégrant les espèces ligneuses aux champs agricoles, fermes et autres paysages, diversifie, augmente la production et engendre des bénéfices socio-économiques et environnementaux pour les propriétaires terriens (Leaky 1996).
Un des intérêts principaux de l'agroforesterie, par rapport aux monocultures, se situe au niveau des interactions entre les composantes d'un système (Malézieux et al. 2009). L'agroforesterie peut augmenter la productivité du système lorsque les arbres capturent des ressources inutilisées par les cultures (Cannell 1996). Il existe des interactions aériennes et sous-terraines entre les composantes et elles peuvent être neutres, négatives ou positives, selon le cas (Schroth 1999).
Les interactions les plus évidentes impliquent des effets sur : i) la qualité chimique (C, N, P, Ca, Mg, K, Al), physique (agrégation, porosité et densité) et biologique (macrofaune, communautés microbiennes, mycorhization et fixateurs d'azote) des sols, ii) la compétition pour les ressources (air, eau, nutriments), iii) le microclimat (ombrage, interception de l'eau de pluie), iv) la gestion des mauvaises herbes et la conservation des sols (ruissellement et érosion éolienne) (Rao et al. 1998; Ong et al. 2002; Malézieux et al. 2009). Ces interactions sont particulièrement importantes en région aride où l'eau est une ressource limitante, ou dans les régions où le sol est peu fertile. Il existe plusieurs bénéfices à l'intégration d'arbres à enracinement profond aux systèmes agroforestiers, puisqu'ils contribuent au maintien des fonctions de l'écosystème par le cyclage des nutriments (Ong et al. 2002; Shibu 2009). L'optimisation de l'utilisation des nutriments, par un partage de l'espace sous-terrain, induit une remise en circulation des nutriments stockés en
profondeur. Par exemple, l'arbre puise les minéraux dans les profondeurs du sol et les stocke dans ses feuilles (Rao et al. 1998). Ces dernières peuvent ensuite servir d'engrais pour les herbacées ou de fourrage pour le bétail. Naturellement, des relations de compétition peuvent aussi exister, ayant parfois pour effet de diminuer le rendement global (Fernandez et al. 2008).
Dans plusieurs écosystèmes terrestres, l'agroforesterie est une méthode de gestion des sols qui a des effets bénéfiques sur l'environnement, comme la préservation de la biodiversité et la séquestration du carbone (Young 1997 ; Shibu 2009). Ceci est d'autant plus vrai lorsqu'on la compare à des systèmes monoculturaux agricoles ou forestiers (Young 1997; Cardoso et al. 2003; Vidal et al. 2003).
Figure 1.5: Systèmes agroforestiers de type sylvopastoral: (A) Eucalyptus urograndis et l'herbacée Brachiaria spp.; (B) Jeunes Eucalyptus urograndis avec fèves de soya. La composante animale (vaches Holstein) est intégrée temporairement dans ces deux systèmes sylvopastoraux.
Quelques études ont déjà été menées sur des systèmes agroforestiers où la composante arborescente est l'Eucalyptus (Mohsin et al. 2003; Ceccon 2005 ; Kruschewsky et al. 2007). Souvent, chez les jeunes plantations (<2 ans) il n'y a pas d'effet négatif de la culture mixte sur l'une ou l'autre des composantes quand les ressources hydriques sont abondantes (Ceccon 2005; Kruschewsky et al. 2007). On a même noté une augmentation de la biomasse chez Eucalyptus camaldulensis lorsqu'il était cultivé avec le riz par rapport à sa monoculture (Ceccon 2005).
1.3.1 Le sylvopastoralisme
Le système sylvopastoral est considéré par certains comme la simple combinaison d'arbres, de pâturage et de bétail (Nair et al. 2004). Il s'agit en fait d'une pratique qui intègre délibérément les arbres, les herbes de fourrage et le bétail dans un système où les interactions sont planifiées et gérées pour produire à la fois du bois, du bétail et du fourrage de qualité dans une perspective intégrée d'environnement durable (Clason et Sharrow 2000; Figure 1.5). Le sylvopâturage est le type de système sylvopastoral le plus fréquemment rencontré et est aussi la forme la plus intensive de sylvopastoralisme, puisque chaque composante est gérée pour optimiser le rendement du système. Les systèmes sylvopastoraux sont des systèmes durables, qui créent de l'hétérogénéité spatiale en favorisant la création ou le maintien de la biodiversité (McAdam 2004). Les arbres présents dans les systèmes sylvopastoraux peuvent être un refuge pour plusieurs animaux et oiseaux.
Comme pour les autres systèmes agroforestiers, les systèmes sylvopastoraux influencent le recyclage des minéraux, la modification de l'hydrologie et la circulation d'énergie par la manipulation de la structure des communautés (Clason et Sharrow 2000). D'autant plus qu'ils sont d'un intérêt paysager, puisqu'ils contribuent à embellir le paysage rural (Nair et al. 2004). La qualité de vie du bétail est naturellement améliorée par la présence d'arbres. Le microclimat est aussi modifié par la présence des arbres dans les systèmes sylvopastoraux. La superposition de deux strates végétales, affecte l'état thermique et hygrométrique de l'air au voisinage du sol (Baldy et al. 1993). Globalement, sous couvert
arboré, on trouve que l'amplitude thermique diminue, l'humidité de l'air augmente et l'humidité du sol est altérée. La sélection d'arbres, d'herbes et d'animaux doit être faite avec soin en tenant compte du climat, du type de sol, de la compatibilité des composantes, mais aussi des marchés potentiels (Clason et Sharrow 2000). Les systèmes agrisylvopastoraux sont parmi les plus complexes puisqu'ils intègrent en plus de la composante ligneuse, les composantes agricole et animale.
1.3.2 Agroforesterie et mycorhizes
Des arbres à croissance rapide ou à usages multiples sont généralement utilisés dans les systèmes agroforestiers africains et sud américains. Ces derniers peuvent offrir du bois, du fourrage et des fruits à leurs cultivateurs (Ingleby et al. 2007). Pour fournir ainsi toutes ces ressources, spécialement dans des conditions de sols pauvres, les arbres doivent s'associer à des mycorhizes. Cette association symbiotique permet d'augmenter la prise d'une ressource limitante quelconque et peut aussi augmenter l'habileté du système à utiliser les ressources non limitantes (José et al. 2006). L'importance de maintenir les populations mycorhiziennes actives dans les plantations agroforestières est maintenant démontrée (Young 1989; Ingleby étal. 2007).
Dans les régions où l'agroforesterie est plus intensivement étudiée, comme celles arides d'Afrique, l'eau peut être un facteur limitant. Il est donc surtout question de mycorhizes arbusculaires, puisque les ectomycorhizes ont une importance nettement moindre dans de tels systèmes (Ingleby et al. 2007). En effet, les ECM sont présentes sur une proportion plus faible des familles de végétaux et ces dernières jouent un rôle moindre dans les zones où l'eau est une ressource limitante (Haselwandter 1996). Les trois familles de végétaux les plus utilisées en agroforesterie des zones humides et sèches, et qui forment à la fois des ECM et des MA, sont les Casuarinaceae, Myrtaceae et Leguminoseae (Haselwandter et al.
1996).
on a trouvé une plus grande quantité de spores de MA dans les systèmes agroforestiers (Cardoso et al. 2003). Ceci serait dû à la plus grande abondance des racines dans le sol, surtout au-delà de 20 cm de profondeur. Dans une autre expérience où l'on visait à comparer la diversité des MA d'une plantation de peuplier et d'un système en culture intercalaire avec du soya et du peuplier, on a trouvé que la diversité de la parcelle agroforestière était supérieure à celle de la plantation forestière (Chifflot et al. 2009).
Les ectomycorhizes sont d'un intérêt particulier dans les systèmes agroforestiers, grâce à leur production de fructifications comestibles (Leaky 1996). Des techniques d'aménagement mycosylvicole peuvent être adaptées pour favoriser la production de champignons qui servent parfois à l'alimentation et la pharmacopée.
1.4 But, objectif et hypothèse de recherche
Le but de cette étude est de déterminer s'il y a un avantage à utiliser le système sylvopastoral, en eucalypticulture, en ce qui concerne la conservation de la diversité des organismes fongiques du sol, par rapport à la monoculture. L'objectif est de caractériser les communautés d'ectomycorhizes présentes dans un système monocultural et deux systèmes sylvopastoraux. Les communautés d'ectomycorhizes retrouvées dans une plantation d'Eucalyptus urograndis ont été analysées et comparées avec celles de deux parcelles agroforestières de type sylvopastoral. Dans un des systèmes sylvopastoraux, un mélange de Brachiaria (B. brizantha cv. Xaraés; B. decumbens cv. Basilisk; B. brizantha cv. Piatà) a été semé entre des rangées d'Eucalyptus urograndis et des vaches laitières y sont intégrées. Dans l'autre système, les rangées d'arbres sont composées de E. urograndis et d'Acacia mangium alternés, ainsi que de Brachiaria spp. et des vaches. L'hypothèse de recherche est que la diversité biologique est supérieure dans les parcelles agroforestières que dans les parcelles monoculturales.
1.5 Références
Abuzinadah, R.A., Read, D.J. (1989) The role of proteins in the nitrogen nutrition of ectomycorrhizal plants. New Phytologist, 112 : 61-68.
Agerer, R. (2001) Exploration types of mycorrhizae: A proposal to classify ectomycorrhizal mycelial systems according to their patterns of differentiation and putative
ecological importance. Mycorrhiza, 11 : 107-114.
Agerer, R. (1987-2002) Colour Atlas of Ectomycorrhizae. 1 st—8th edition. Einhorn-Verlag, Germany.
Alexander, I.J. (2006) Ectomycorrhizas: Out of Africa? New Phytologist, 172 : 589-591. Assembleia legislativa do estado de Minas Gérais (2004) O eucalipto. Cartilhas, 35 p. Azcôn-Aguilar, C, Barea, J.M. (1996) Arbuscular mycorrhizas and biological control of
soil-bom plant pathogens - an overview of the mechanisms involved. Mycorrhiza, 6 : 457-464.
Baldy, C, Dupraz, C, Schilizzi, S. (1993) Vers de nouvelles agroforesteries en climats tempérés et méditerranéens : 1. Aspects agronomiques. Cahiers Agricultures 2 : 375-386.
Bellei, M.M., Garbaye, J., Gil, M. (1992) Mycorrhizal succession in young Eucalyptus viminalis plantations in Santa Catarina (southern Brazil). Forest Ecology and Management, 54 : 205-213.
Bonello, P., Bruns, T.D., Gardes, M. (1998) Genetic structure of a natural population of the ectomycorrhizal fungus Suillus pungens. New Phytologist, 138 : 533-542.
Brazanti, M.B., Rocca, E., Pisi, A. (1999) Effect of ectomycorrhizal fungi on chestnut ink disease. Mycorrhiza, 9 : 103-109.
Brooker, M.I.H. (2000) A new classification of the genus Eucalyptus L'Her. (Myrtaceae). Australian Systematic Botany, 13 : 79-148.
Brooker, M.I.H., Kleinig, D.A (2001) Field guide to eucalypts Hawthorn Victoria: Bloomings Books, Melbourne, Australia, 356 p.
Brundrett, M.C. (2006) Understanding the roles of multifunctional mycorrhizal and endophytic fungi. Soil Biology, 9 : 281-298.
Brundrett, M.C. (2009) Mycorrhizal associations and other means of nutrition of vascular plants: understanding the global diversity of host plants by resolving conflicting information and developing reliable means of diagnosis. Plant and Soil, 320 : 37-77. Bruns, T.D., Shefferson, R.P. (2004) Evolutionary studies of ectomycorrhizal fungi: recent
advances and future directions. Canadian Journal of Botany, 82 : 1122-1132. Burke, D.J., Kendall, J.M., Rygiewicz, P.T., Topa, M.A. (2005) Ectomycorrhizal fungi
identification in single and pooled root samples: terminal restriction fragment length polymorphism (TRFLP) and morphotyping compared. Soil Biology and
Biochemistry, 37 : 1683- 694.
Caimey, J.W.G. (2000) Evolution of mycorrhiza systems. Naturwissenchaften, 87 : 467-475.
Caimey, J.W.G., Meharg, A.A. (2003) Ericoid mycorrhiza: a partnership that exploits harsh edaphic conditions. European Journal of Soil Science, 54 : 735-740.
Cannell, M.G.R., Van Noordwijk, M., Ong, C.K. (1996) The central agroforestry hypothesis: the trees must acquire resources that the crop would not otherwise acquire. Agroforestry Systems, 34 : 27-31.
Cannell, M.G.R. (1999) Environmental impacts of forest monocultures: water use,
acidification, wildlife conservation and carbon storage. New Forests, 17 : 239-262. Cao, W., Crawford, D.L. (1993) Carbon nutrition and hydrolytic and cellulolytic activities
in the ectomycorrhizal fungus Pisolithus tinctorius. Canadian Journal of Microbiology, 39 : 529-535.
Cardoso, I.M., Boddington, C, Janssen, B.H., Oenema, O., Kuyper, T.W. (2003) Distribution of mycorrhizal fungal spores in soils under agroforestry and monocultural coffee systems in Brazil. Agroforestry Systems, 58 : 33-43.
Ceccon, E. (2005) Eucalyptus agroforestry system for small farms : 2-year experiment with rice and beans in Minas Gérais, Brazil. New Forests, 29 : 261-272.
Chapela, I.H., Osher, L.J., Horton, T.R., Henn, M.R. (2001) Ectomycorrhizal fungi introduced with exotic pine plantations induce soil carbon depletion. Soil Biology and Biochemistry, 32 : 1733-1740.
Chifflot, V., Rivest, D., Olivier, A., Cogliastro, A., Khasa, D. (2009) Molecular analysis of arbuscular mycorrhizal community structure and spores distribution in tree-based intercropping and forest systems. Agriculture, Ecosystems and Environment, 131 : 32-39.
Chilvers, G.A., Gust, L.W. (1982) Comparison between the growth rates of mycorrhizas, uninfected roots and a mycorrhizal fungus of Eucalyptus st-johnii R.T. Bak. New Phytologist, 91 :453-466.
Chilvers, G.A., Lapeyrie, F.F., Horan, D.P. (1987) Ectomycorrhizal vs endomycorrhizal fungi within the same root system. New Phytologist, 107 : 441-448.
Christensen, M. (1989) A view of fungal ecology. Mycologia, 81 : 1-19.
CIRAD-Madagascar. Plantations forestières : Les plantations forestières à Madagascar. [En ligne], http://www.cirad.mg/fr/plantfor.php, (page consultée le 19 octobre 2010). Clason, T.R., Sharrow, S.H. (2000) Silvopastoral practices. Tiré de : North American
agroforestry: An integrated science and practice. Garrett, H.E. (Ed) American Society of Agronomy, Wisonsin, USA, pp. 105-132.
Conn, C, Dighton, J. (2000) Litter quality influences on decomposition, ectomycorrhizal community structure and mycorrhizal root surface acid phosphatase activity. Soil Biology and Biochermistry, 32 : 489-496.
Dahlberg, A., Jonsson, L., Nylund, J-E. (1997) Species diversity and distribution of biomass above and below ground among ectomycorrhizal fungi in an old-growth Norway spruce forest in south Sweden. Canadian Journal of Botany, 75 :
1323-1335.
Dos Santos, V.L., Muchovej, R.M., Borges, A.C., Neves, J.C.L., Kasuya, M.C.M. (2001) Vesicular-arbuscular- /ecto-mycorrhiza succession in seedlings of Eucalyptus spp. Brazilian Journal of Microbiology, 32 : 81-86.
Egger, K.N. (1995) Molecular analysis of ectomycorrhizal fungal communities. Canadian Journal of Botany, 73 (Suppl. 1) : S1415-S1422.
Fernandez, M.E., Gyenge, J., Licata, J., Schilichter, T., Bond, B.J. (2008) Belowground interactions for water between trees and grasses in a temperate semiarid agroforestry system. Agroforestry Systems, 74 : 185-197.
Fortin, J.A., Plenchette, C, Piche, Y. (2008) Les mycorhizes : La nouvelle révolution verte. Editions MultiMondes, Québec, Canada, 148 p.
Fortin, J.A., Lamhamedi, M.S. (2009) Ecophysiology of sporocarp development of ectomycorrhizal basidiomycetes associated with boreal forest gymnosperms. Tiré de: Advances in Mycorrhizal Science and Technology. Khasa, D.P., Piché, Y., Coughlan, A.P. (Eds), NRC Research Press, Ottawa, Canada, pp. 161-174. Freeland, J. (2005) Molecular Ecology. John Wiley & Sons Ltd, Sussex, England. 388 p.
Gagné, A., Jany, J-L., Bousquet, J., Khasa, D.P. (2006) Ectomycorrhizal fungal communities of nursery-inoculated seedlings outplanted on clear-cut sites in northern Alberta. Canadian Journal of Forestry Research, 36 : 1684-1694.
Gardes, M., Bruns, T.D. (1993) ITS primers with enhanced specificity for basidiomycetes -application to the identification of mycorrhizae and rusts. Molecular Ecology, 2 :
113-118.
Gardes, M., Bruns, T.D. (1996) Community structure of ectomycorrhizal fungi in a Pinus muricata forest: above- and below-ground views. Canadian Journal of Botany, 74 :
1572-1583.
Gévry, M-F., Villeneuve, N. (2009) Ecology and management of edible ectomycorrhizal mushrooms in eastern Canada. Tiré de: Advances in Mycorrhizal Science and Technology. Khasa, D.P., Piché, Y., Coughlan, A.P. (Eds), NRC Research Press, Ottawa, Canada, pp. 175-191.
Giachini, A.J., Oliveira, V.L., Castellano, M.A., Trappe, J.M. (2000) Ectomycorrhizal fungi in Eucalyptus and pinus plantations in southern Brazil. Mycologia, 92 : 1166-1177. Giachini, A.J., Souza, L.A.B., Oliveira, V.L. (2004) Species richness and seasonal
abundance of ectomycorrhizal fungi in plantations of Eucalyptus dunnii and Pinus taeda in southern Brazil. Mycorrhiza, 14 : 375-381.
Glen, M., Tommerup, I.C., Bougher, N.L., O'Brien, P.A. (2001) Specificity, sensitivity and discrimination of primers for PCR-RFLP of larger basidiomycetes and their
applicability to identification of ectomycorrhizal fungi in Eucalyptus forests and plantations. Mycological Research, 105 : 138-149.
Goltapeh, E.M., Danesh, Y.R., Prasa, R., Varma, A. (2008) Mycorrhizal fungi : what we know and what we should know? Mycorrhiza 1 : 3-27.
Goodman, D.M., Durall, D.M., Trofymow J.A., Berch S.M. (Eds) (1996-1999) Concise descriptions of some North American ectomycorrhizae. Canada-BC Forest Resource Development Agreement, Canadian Forest Service, Victoria, Canada.
Haselwandter, K., Bowen, G.D. (1996) Mycorrhizal relations in trees for agroforestry and land rehabiliation. Forest Ecology and Management, 81 : 1-17.
Hibbett, D.S., Gilbert, L-B., Donoghue, M.J. (2000) Evolutionary instability of ectomycorrhizal symbioses in basidiomycetes. Nature, 407 : 506-508.
Horton, T.R., Bruns, T.D. (2001) The molecular revolution in ectomycorrhizal ecology: peeking into the black-box. Molecular Ecology, 10: 1855-1871.
Ingleby, K., Mason, P. A., Last, F. T., Fleming, L. V. (1990) Identification of
ectomycorrhizas. ITE Research Publication No. 5, Her Majesty's Stationary Office Publication Center, London, United Kingdom, 112 p.
Ingleby, K., Wilson, J., Munro, R.C., Cavers, S. (2007) Mycorrhizas in agroforestry: spread and sharing of arbuscular mycorrhizal fungi between trees and crops: complementary use of molecular and microscopic approaches. Plant and Soil, 294 :
125-136.
Jones, D.M., Durall, D.M., Tinker, P.B. (1998) A comparison of arbusucular and ectomycorrhizal Eucalyptus coccifera: Growth response, phosphorus uptake efficiency and external hyphal production. New Phytologist, 140 : 125-134. Jones, M.D., Durall, D.M., Caimey, W.G. (2003) Ectomycorrhizal fungal communities in
young forest stands regenerating after clearcut logging. New Phytologist Review, 157:399-422
Jose, S., Williams, R., Zamora, D. (2006) Belowground ecological interactions in mixed species forest plantations. Forest Ecology and Management, 233 : 231-239.
Karkouri, K.E., Martin. F., Douzery, E., Mousain, D. (2005) Diversity of ectomycorrhizal fungi naturally established on containerised pinus seedlings in nursery conditions. Microbial Research, 160 : 47-52.
Kasel, S., Bennett, L.T., Tibbits, J. (2008) Land use influences soil funal community composition across central Victoria, south-eastern Australia. Soil Biology & Biochemistry, 40 : 1724-1732.
Kruschewsky, G.C., Macedo, R.L.G., Venturin, N., De Oliveira, T.K. (2007) Arranjo estrutual e dinâmica de cercimento de Eucalyptus spp., em sistem agrossilvipastoril no cerrado. Cerne, 13 : 360-367.
Landeweert, R., Hoffland, E., Finlay, R.D., Kuyper, T.W., van Breemen, N. (2001) Linking plants to rocks: ectomycorrhizal fungi mobilize nutrients from minerals. Trends in Ecology & Evolution, 16 : 248-254.
Lapeyrie, F.F., Chilvers, G.A. (1985) An endomycorrhiza-ectomycorrhiza succession associated with enhanced growth of Eucalyptus dumosa seedlings planted in a calcareous soil. New Phytologist, 100 : 93-104.
Leaky, R.R.B. (1996) Definition of agroforestry revisited. Agroforestry Today, 8 : 5-7. Lepage, B.A., Currah, R.S., Stockey, R.A., Rothwell, G.W. (1997) Fossil ectomycorrhizae
from the Middle Eocene. American Journal of Botany, 84 : 410-410.
Malézieux, E., Crozat, Y., Dupraz, C , Laurans, M., Makowski, D., Ozier-Lafontaine, H., Rapidel, B., De Tourdonnet, S., Valantin-Morison, M. (2009) Mixing plant species in cropping systems : concepts, tools and models. A review. Agronomy and
Sustainable Development, 29 : 43-62.
Marx, D.H. (1972) Ectomycorrhizae as biological deterrents 3558 to pathogenic root infections. Annual Review of Phytopathology 10 : 429-454.
Martin, K.J., Rygiewicz, P.T. (2005) Fungal-specific PCR primers developed for analysis of the ITS region of environmental DNA extracts. BMC Microbiology, 5 : 28-39. Martin, F., Duplessis, S., Ditengou, F., Lagrange, H., Voiblet, C , Lapeyrie F. (2001)
Developmental cross talking in the ectomycorrhizal symbiosis : Signals and communication genes. New Phytologist, 151 : 145-154.
McAdam, J.H. (2004) Silvopastoral systems in North-West Europe. Tiré de :
Silvopastoralism and sustainable land management. Mosquera-Losada, M.R., McAdam, J., Rigueiro-Rodriguez, A. (Eds), CABI Publishing, Cambridge, USA, pp. 19-23.
Mohsin, F., Singh, R.P., Rajput, D.K. (2003) Biomass of Eucalyptus hybrid plantations under agroforestry system. Indian Forester, 129 : 1037-1040.
Molina, R., Massicotte, H.B., Trappe, J.M. (1992) Specificity phenomena in mycorrhizal symbiosis: community ecological consequences and practical implications. Tiré de: Allen, M.F. (Ed) Mycorrhizal functioning. Chapman and Hall, London, pp. 357-423.
Muleta, D., Assefa, F., Nemomissa, S., Granhall, U. (2007) Distribution of arbuscular mycorrhizal fungi spores in soils of smallholder agroforestry and monocultural coffee systems in southwestern Ethiopia. Biology and Fertility of Soils, 44 : 653-659.
Munyanziza, E. (1996) Domestication of mushrooms from the miombo woodlands: current status and crucial issues for agroforestry. Tiré de : Domestication and
commercialization of non-timber forest products in agroforestry systems. Leaky, R.R.B., Temu, A.B., Melnyk, M., Vantomme, P. (Eds) Food and Agriculture Organization of the United Nations, Rome, 298 p.
Nair, P.K.R., Bannister, M.E., Nair, V.D., Alavalapati, J.R.R., Ellis, E.A., Jose, S., Long, A.J. (2004) Silvopasture in south-eastern United States: more than just a new name for an old practice. Tiré de : Silvopastoralism and Sustainable Land Management. Mosquera-Losada, M.R., McAdam, J., Rigueiro-Rodriguez, A. (Eds), CABI Publishing, Cambridge, USA, pp.72-82.
Nehls, U., Gôhringer, F., Wittulky, S., Dietz, S. (2010) Fungal carbohydrate support in the ectomycorrhizal symbiosis: a review. Plant Biology, 12 : 292-301.