Année 2019
Thèse N° 187
Epidémiologie des entérobactéries
multirésistantes productrices
de carbapénèmase à l’HIT
THÈSE
PRÉSENTÉE ET SOUTENUE PUBLIQUEMENT LE 01/07/2019
PAR
Mlle.
Soukaina TIDRARINE
Née Le 03 Aout 1991 à Agadir
POUR L’OBTENTION DU DOCTORAT EN MÉDECINE
MOTS-CLÉS
Entérobactéries - Résistance bactérienne - Carbapénèmase
JURY
M.
M
PmeP.
M.
M.
M
me.
S. ZOUHAIR
Professeur de Bacteriologie-Virologie
K. ZAHLANE
Professeur de Bactériologie-Virologie
M. KHALLOUKI
Professeur d’Anesthesie-Réanimation
A. BOUKHIRA
Professeur de Biochimie-Toxicologie
L. ARSALANE
PRESIDENT
RAPPORTEUR
JUGES
Au moment d’être admis à devenir membre de la profession médicale, je m’engage
solennellement à consacrer ma vie au service de l’humanité.
Je traiterai mes maîtres avec le respect et la reconnaissance qui leur sont dus.
Je pratiquerai ma profession avec conscience et dignité. La santé de mes malades
sera mon premier but.
Je ne trahirai pas les secrets qui me seront confiés.
Je maintiendrai par tous les moyens en mon pouvoir l’honneur et les nobles
traditions de la profession médicale.
Les médecins seront mes frères.
Aucune considération de religion, de nationalité, de race, aucune considération
politique et sociale, ne s’interposera entre mon devoir et mon patient.
Je maintiendrai strictement le respect de la vie humaine dés sa conception.
Même sous la menace, je n’userai pas mes connaissances médicales d’une façon
contraire aux lois de l’humanité.
Je m’y engage librement et sur mon honneur.
FACULTE DE MEDECINE ET DE PHARMACIE MARRAKECH
Doyens Honoraires : Pr. Badie Azzaman MEHADJI
: Pr. Abdelhaq ALAOUI YAZIDI ADMINISTRATION
Doyen : Pr. Mohammed BOUSKRAOUI
Vice doyen à la Recherche et la Coopération : Pr. Mohamed AMINE Vice doyen aux Affaires Pédagogiques : Pr. Redouane EL FEZZAZI
Secrétaire Générale : Mr. Azzeddine EL HOUDAIGUI
Professeurs de l’enseignement supérieur
Nom et Prénom Spécialité Nom et Prénom Spécialité
ABKARI Imad Traumato-
orthopédie
FINECH Benasser Chirurgie – générale ABOU EL HASSAN Taoufik Anésthésie-
réanimation
FOURAIJI Karima Chirurgie pédiatrique ABOUCHADI Abdeljalil Stomatologie et chir
maxillo faciale
GHANNANE Houssine
Neurochirurgie ABOULFALAH Abderrahim Gynécologie-
obstétrique
GHOUNDALE Omar Urologie ABOUSSAIR Nisrine Génétique HAJJI Ibtissam Ophtalmologie ADERDOUR Lahcen Oto- rhino-
laryngologie
HOCAR Ouafa Dermatologie ADMOU Brahim Immunologie JALAL Hicham Radiologie AGHOUTANE El Mouhtadi Chirurgie pédiatrique KAMILI El Ouafi El
Aouni
Chirurgie pédiatrique AIT AMEUR Mustapha Hématologie
Biologique
KHALLOUKI Mohammed
Anesthésie- réanimation AIT BENALI Said Neurochirurgie KHATOURI Ali Cardiologie AIT BENKADDOUR Yassir Gynécologie-
obstétrique
KHOUCHANI Mouna
Radiothérapie AIT-SAB Imane Pédiatrie KISSANI Najib Neurologie AKHDARI Nadia Dermatologie KOULALI IDRISSI
Khalid
Traumato- orthopédie ALAOUI Mustapha Chirurgie- vasculaire
péripherique
KRATI Khadija Gastro- entérologie AMAL Said Dermatologie KRIET Mohamed Ophtalmologie
clinique
AMMAR Haddou
Oto-rhino-laryngologie
LAKMICHI Mohamed Amine
Urologie AMRO Lamyae Pneumo- phtisiologie LAOUAD Inass Néphrologie ARSALANE Lamiae Microbiologie
-Virologie
LOUZI Abdelouahed Chirurgie – générale ASMOUKI Hamid Gynécologie-
obstétrique
MADHAR Si Mohamed
Traumato- orthopédie ASRI Fatima Psychiatrie MANOUDI Fatiha Psychiatrie
BEN DRISS Laila Cardiologie MANSOURI Nadia Stomatologie et chiru maxillo faciale
BENCHAMKHA Yassine Chirurgie réparatrice et plastique MOUDOUNI Said Mohammed Urologie BENELKHAIAT BENOMAR Ridouan
Chirurgie - générale MOUFID Kamal Urologie BENJILALI Laila Médecine interne MOUTAJ Redouane Parasitologie BOUAITY Brahim Oto-rhino-
laryngologie
MOUTAOUAKIL Abdeljalil
Ophtalmologie BOUCHENTOUF Rachid Pneumo- phtisiologie NAJEB Youssef Traumato-
orthopédie BOUGHALEM Mohamed Anesthésie -
réanimation
NARJISS Youssef Chirurgie générale BOUKHIRA Abderrahman Biochimie - chimie NEJMI Hicham Anesthésie-
réanimation BOUMZEBRA Drissi Chirurgie
Cardio-Vasculaire
NIAMANE Radouane Rhumatologie BOURROUS Monir Pédiatrie NOURI Hassan Oto rhino
laryngologie BOUSKRAOUI Mohammed Pédiatrie OUALI IDRISSI
Mariem
Radiologie CHAFIK Rachid Traumato-
orthopédie
OULAD SAIAD Mohamed
Chirurgie pédiatrique CHAKOUR Mohamed Hématologie
Biologique
QACIF Hassan Médecine interne CHELLAK Saliha Biochimie- chimie QAMOUSS Youssef Anésthésie-
réanimation CHERIF IDRISSI EL
GANOUNI Najat
Radiologie RABBANI Khalid Chirurgie générale CHOULLI Mohamed
Khaled
Neuro pharmacologie RAFIK Redda Neurologie DAHAMI Zakaria Urologie RAJI Abdelaziz
Oto-rhino-réanimation orthopédie EL ANSARI Nawal Endocrinologie et
maladies métaboliques SAMKAOUI Mohamed Abdenasser Anesthésie- réanimation
EL BARNI Rachid Chirurgie- générale SAMLANI Zouhour Gastro- entérologie EL BOUCHTI Imane Rhumatologie SARF Ismail Urologie
EL BOUIHI Mohamed Stomatologie et chir maxillo faciale
SORAA Nabila Microbiologie - Virologie EL FEZZAZI Redouane Chirurgie pédiatrique SOUMMANI
Abderraouf
Gynécologie- obstétrique EL HAOURY Hanane Traumato-
orthopédie
TASSI Noura Maladies infectieuses EL HATTAOUI Mustapha Cardiologie YOUNOUS Said Anesthésie-
réanimation EL HOUDZI Jamila Pédiatrie ZAHLANE Mouna Médecine interne EL KARIMI Saloua Cardiologie ZOUHAIR Said Microbiologie ELFIKRI Abdelghani Radiologie ZYANI Mohammed Médecine interne ESSAADOUNI Lamiaa Médecine interne
Professeurs Agrégés
Nom et Prénom Spécialité Nom et Prénom Spécialité ABIR Badreddine Stomatologie et
Chirurgie maxillo faciale
GHAZI Mirieme Rhumatologie ADALI Imane Psychiatrie HACHIMI
Abdelhamid
Réanimation médicale ADARMOUCH Latifa Médecine
Communautaire (médecine préventive, santé publique et hygiène)
HAROU Karam Gynécologie- obstétrique
AISSAOUI Younes Anesthésie - réanimation HAZMIRI Fatima Ezzahra Histologie – Embryologie - Cytogénéque AIT BATAHAR Salma Pneumo-
phtisiologie
IHBIBANE fatima Maladies Infectieuses ALJ Soumaya Radiologie KADDOURI Said Médecine interne ANIBA Khalid Neurochirurgie LAHKIM Mohammed Chirurgie générale
Mohammed Chirurgie maxillo faciale
BAIZRI Hicham Endocrinologie et maladies
métaboliques
LOUHAB Nisrine Neurologie BASRAOUI Dounia Radiologie MAOULAININE Fadl
mrabih rabou
Pédiatrie (Neonatologie) BASSIR Ahlam Gynécologie-
obstétrique
MARGAD Omar Traumatologie -orthopédie BELBACHIR Anass Anatomie-
pathologique
MATRANE Aboubakr Médecine nucléaire BELBARAKA Rhizlane Oncologie
médicale
MEJDANE Abdelhadi Chirurgie Générale BELKHOU Ahlam Rhumatologie MLIHA TOUATI
Mohammed
Oto-Rhino - Laryngologie BENHIMA Mohamed Amine Traumatologie -
orthopédie
MOUAFFAK Youssef Anesthésie - réanimation BENJELLOUN HARZIMI
Amine
Pneumo- phtisiologie
MOUHSINE Abdelilah Radiologie
BENLAI Abdeslam Psychiatrie MSOUGGAR Yassine Chirurgie thoracique BENZAROUEL Dounia Cardiologie NADER Youssef Traumatologie -
orthopédie BOUKHANNI Lahcen Gynécologie-
obstétrique
OUBAHA Sofia Physiologie BOURRAHOUAT Aicha Pédiatrie RADA Noureddine Pédiatrie BSISS Mohamed Aziz Biophysique RAIS Hanane Anatomie
pathologique CHRAA Mohamed Physiologie RBAIBI Aziz Cardiologie DAROUASSI Youssef Oto-Rhino -
Laryngologie
ROCHDI Youssef Oto-rhino- laryngologie
DRAISS Ghizlane Pédiatrie SAJIAI Hafsa Pneumo- phtisiologie EL AMRANI Moulay Driss Anatomie SALAMA Tarik Chirurgie pédiatrique EL HAOUATI Rachid Chirurgie Cardio-
vasculaire
SEDDIKI Rachid Anesthésie - Réanimation EL IDRISSI SLITINE Nadia Pédiatrie SERGHINI Issam Anesthésie - Réanimation
EL KHADER Ahmed Chirurgie générale TAZI Mohamed Illias Hématologie- clinique EL KHAYARI Mina Réanimation
médicale
TOURABI Khalid Chirurgie réparatrice et plastique
maladies métaboliques
EL OMRANI Abdelhamid Radiothérapie ZARROUKI Youssef Anesthésie - Réanimation FADILI Wafaa Néphrologie ZEMRAOUI Nadir Néphrologie FAKHIR Bouchra Gynécologie-
obstétrique
ZIADI Amra Anesthésie - réanimation FAKHRI Anass Histologie-
embyologie cytogénétique ZIDANE Moulay Abdelfettah Chirurgie Thoracique Professeurs Assistants
Nom et Prénom Spécialité Nom et Prénom Spécialité ABDELFETTAH Youness Rééducation et
Réhabilitation Fonctionnelle
ELOUARDI Youssef Anesthésie réanimation ABDOU Abdessamad Chiru Cardio
vasculaire
ELQATNI Mohamed Médecine interne AIT ERRAMI Adil Gastro-entérologie ESSADI Ismail Oncologie Médicale
AKKA Rachid Gastro -
entérologie
FDIL Naima Chimie de
Coordination Bio-organique
ALAOUI Hassan Anesthésie - Réanimation
FENNANE Hicham Chirurgie Thoracique AMINE Abdellah Cardiologie GHOZLANI Imad Rhumatologie
ARABI Hafid Médecine physique et réadaptation fonctionnelle
HAJJI Fouad Urologie ARSALANE Adil Chirurgie
Thoracique
HAMMI Salah Eddine Médecine interne ASSERRAJI Mohammed Néphrologie Hammoune Nabil Radiologie AZIZ Zakaria Stomatologie et
chirurgie maxillo faciale
JALLAL Hamid Cardiologie
BAALLAL Hassan Neurochirurgie JANAH Hicham Pneumo- phtisiologie BABA Hicham Chirurgie générale LAFFINTI Mahmoud
Amine
Psychiatrie BELARBI Marouane Néphrologie LAHLIMI Fatima
Ezzahra
Hématologie clinique BELFQUIH Hatim Neurochirurgie LALYA Issam Radiothérapie
toxicologie environnementale BELHADJ Ayoub Anesthésie
-Réanimation
MAHFOUD Tarik Oncologie médicale BELLASRI Salah Radiologie MILOUDI Mohcine Microbiologie -
Virologie BENANTAR Lamia Neurochirurgie MOUNACH Aziza Rhumatologie BENNAOUI Fatiha Pédiatrie NAOUI Hafida Parasitologie
Mycologie BOUCHENTOUF Sidi
Mohammed
Chirurgie générale NASSIH Houda Pédiatrie BOUKHRIS Jalal Traumatologie -
orthopédie
NASSIM SABAH Taoufik Chirurgie Réparatrice et Plastique
BOUTAKIOUTE Badr Radiologie NYA Fouad Chirurgie Cardio - Vasculaire
BOUZERDA Abdelmajid Cardiologie OUERIAGLI NABIH Fadoua
Psychiatrie CHETOUI Abdelkhalek Cardiologie OUMERZOUK Jawad Neurologie
CHETTATI Mariam Néphrologie RAISSI Abderrahim Hématologie clinique DAMI Abdallah Médecine Légale REBAHI Houssam Anesthésie -
Réanimation DOUIREK Fouzia Anesthésie-
réanimation
RHARRASSI Isam Anatomie-patologique EL- AKHIRI Mohammed Oto- rhino-
laryngologie
SAOUAB Rachida Radiologie EL AMIRI My Ahmed Chimie de
Coordination bio-organnique
SAYAGH Sanae Hématologie EL FAKIRI Karima Pédiatrie SEBBANI Majda Médecine
Communautaire (médecine préventive, santé publique et hygiène)
EL HAKKOUNI Awatif Parasitologie mycologie
TAMZAOURTE Mouna Gastro - entérologie EL HAMZAOUI Hamza Anesthésie
réanimation
WARDA Karima Microbiologie EL KAMOUNI Youssef Microbiologie
Virologie
ZBITOU Mohamed Anas
Cardiologie ELBAZ Meriem Pédiatrie ELOUARDI Youssef Anesthésie
Toutes les lettres ne sauraient trouver les mots qu’il faut…..
Tous les mots ne sauraient exprimer la gratitude,
L’amour, le respect, la reconnaissance.
Aussi, c’est tout simplement que :
qui m’a permis de voir ce jour tant attendu.
Aucune dédicace ne saurait exprimer l’immense affection et amour que je
te porte.
A mon très cher père Monsieur Abdallah Tidrarine
Que ce travail qui vous est personnellement dédié soit le fruit de tes
sacrifices, ta patience et ta confiance et le modeste témoignage de mon
profond respect et mon plus grand amour.
J’espère être ta fierté comme tu l’es à mes yeux, et que Dieu tout puissant
te garde en vie pour que tu puisses me guider vers d’autres pas si
sereinement et affectueusement.
Je ne saurai remercier Dieu assez de m’avoir gâtée depuis ma naissance
par le don de t’avoir comme génitrice. Tu es mon 1er et plus grand amour
sur cette Terre ; tu es ma meilleure amie et mon plus grand soutien. Tes
prières ont été pour moi d’un grand soutien au cours de ce long parcours.
Tu incarnes la bonté, le bonheur et la tendresse.
A ma très chère mère Madame Aicha Aboudrar
Merci de m’avoir soutenue et aidée à surmonter tous les imprévus de la
vie. Que ce travail, qui représente le couronnement de vos sacrifices
généreusement consentis, de vos encouragements incessants et de votre
patience, soit l’expression de mon immense gratitude et de mon éternelle
reconnaissance.
Puisse Dieu très haut, t’accorder, santé, bonheur et longue vie, et faire en
sorte que jamais je ne te déçoive.
et à ma chère soeur Fatima ezzahra,
je ne peux exprimer à travers ses lignes tous mes sentiments d’amour
envers vous. Puisse l’amour et la fraternité nous unissent à jamais. Je
vous souhaite la réussite dans votre vie, et d’être combler de bonheur.
Merci d’être toujours présents à mes côtés et de m’avoir continuellement
encouragé.
A mes grand-mères yamna et haddia
Je vous rends hommage par ce modeste travail en guise de ma
reconnaissance éternelle et de mon amour infini. Que Dieu le tout
puissant vous procurez santé et longévité.
À ma chere tante khadija
Merci d’avoir toujours été à mes côtés. Merci pour votre confiance et vos
encouragements.
A mes oncles et tantes et leurs conjoints(es), maternels et paternels
A mes cousins et cousines
A toute la famille Tidrarine et Aboudrar
Petits et grands
Merci pour votre amour, vos prières et vos encouragements qui m’ont été
d’un grand soutien au cours de ce long parcours, J’espère que vous
trouverez à travers ce travail l’expression de mes sentiments les plus
chaleureux. Que ce travail vous apporte l’estime, et le respect que je porte
à votre égard, et soit la preuve du désir que j’aie depuis toujours pour
vous honorer. Vous êtes pour moi une source inépuisable de sagesse. Il y a
tant de chaleur dans la bonté de vos coeurs. Il n’y a aucun mot qui suffit
pour vous dire merci, je vous aime énormément. J’implore Dieu pour qu’il
À tous mes chèrs amis
Ghizlane Boufous ,Hind abdeljalil,zakia askhatir,fatima zahra mahfouf ,
asma sadik , hind zrikm , samira lafraxo , mariam mansouri , asma ait
mahdi
Aux personnes que j’ai côtoyées au cours de mon parcours médical dans
les différents services sans distinction.
A Notre Maitre et Président de Jury :
Monsieur le Professeur ZOUHAIR Said
Qui m’a fait l’honneur de présider le jury de cette thèse. Je vous exprime
par ces quelques mots mon profond respect et ma reconnaissance de
m’avoir permis de réaliser ce travail. Je vous remercie infiniment pour
votre aide ainsi que votre disponibilité et votre soutien tout au long de
cette expérience enrichissante.
A Notre Maitre et Rapporteur de thèse :
Madame le Professeur ZAHLANE Kawtar
Il m’est impossible de dire en quelques mots ce que je vous dois. Par votre
rigueur, votre dynamisme et votre passion dans l’exercice de votre
métier, vous avez su me communiquer le désir d’offrir le meilleur de
moimême.
Vous m’avez fait un grand honneur en acceptant de me confier la
responsabilité de ce travail. Je vous en remercie profondément. Je vous
suis très reconnaissant pour tout le temps et les sacrifices que vous avez
dû faire aux dépens de votre travail et de vos obligations, Pour tous vos
efforts incomparables, Pour toutes ces longues heures dépensées à
m’expliquer, pour toutes ces informations si précieuses, gratuitement
livrées, ainsi que pour vos encouragements inlassables, vos conseils
judicieux, et vos remarques hors-paires.
Vos qualités scientifiques, pédagogiques et humaines m’ont profondément
émuet resteront pour moi un exemple à suivre.
A Notre Maitre et Juge :
Monsieur le Professeur khallouki Mohammed
C’est un très grand honneur que vous ayez acceptéde siéger parmi notre
honorable jury.
C’est pour nous l’occasion de vous témoigner respect et grande
considération.
A Notre Maitre et Juge :
Monsieur le Professeur Boukhira Abdarrahman
C’est un très grand honneur que vous ayez accepté de siéger parmi notre
honorable jury.
Je vous exprime ici mes remerciements sincères, mon admiration et mon
profond respect.
A Notre Maitre et Juge :
Madame le Professeur ARSALANE Lamiae
Vous me faites l’honneur de juger ce travail.
Je vous exprime ici mes remerciements sincères , mon admiration et mon
profond respect.
Aux médecins du service de Microbiologie de l’hopital Ibn Tofail de
Marrakech.Aux techniciens du laboratoire, et A tout le personnel du
Tableau I : Les services présents à l’hôpital Ibn Tofail en 2011 et 2015. Tableau II : les différents antibiotiques utilisés pour l’antibiogramme.
Tableau III : Répartition globale des Entérobactéries isolées selon les espèces bactériennes Tableau IV : Fréquence d’isolement des EPC au sein des entérobactéries isolées Tableau V : Répartition des EPC selon les services d’isolement.
Tableau VI : Répartition des E.P.C selon la nature des prélèvements Tableau VII : Répartition globale des E.P.C selon les espèces bactériennes Tableau VIII : Évolution des E.P.C selon les années d'étude
Tableau IX : classification des entérobactéries les plus rencontrées en pathologie humaine Tableau X : Caractères biochimiques des entérobactéries les plus fréquemment rencontrées Tableau XI : Classification d'Ambler des β-lactamases
Tableau XII : Classification des entérobactéries et profil de résistance naturelle aux β-lactamines
Tableau XIII : Phénotypes de résistance acquise des entérobactéries
Tableau XIV : Les antibiotiques classiquement testés pour les entérobactéries Tableau XV : Activité in vitro des carbapénèmes sur les bactéries à Gram négatif Tableau XVI : Caractéristiques des principales carbapénèmases acquises chez les BGN Tableau XVII : Critères de sensibilité/résistance selon les recommandations
américaines (CLSI) et européennes (EUCAST)
Tableau XVIII : Comparaison de 4 tests phénotypiques de détection des EPC [29]
Tableau XIX : Comparaison des différents tests disponibles pour la détection des EPC Tableau XX : Comparaison des taux de fréquence des Entérobactéries
Tableau XXI : comparaison de frequence d’isolement des EPC Tableau XXII : comparaison du sexe ratio (H/F)
Tableau XXIII : Comparaison de répartition d’EPC selon les services hospitaliers Tableau XXIV : comparaison de la répartition des EPC selon la nature du prélèvement Tableau XXV : comparaison de la repartition des EPC selon le germe isolé
Tableau XXVI : comparaison de taux de resistance à l’EPC
Tableau XXVII : Principales mesures de maîtrise de la transmission croisée à partir d’un patient détecté porteur d’une BHRe.
Figure 1 : Test de Hodge modifié Figure 2
: Test de détéction des EPC
Figure 3 : un nouvel algorithme de criblage
Figue 4 : Fréquence d’isolement des EPC au sein des entérobactéries isolées Figure 5 : Répartition des EPC selon le sexe.
Figure 6 : Répartition des E.P.C selon les services d’isolement. Figure 7 : Répartition des E.P.C selon la nature des prélèvements Figure 8 : Répartition globale des E.P.C selon les espèces bactériennes Figure 9 : Evolution des E.P.C selon les années d’étude
Figure 10 : Profil de résistances globales des E.P.C aux antibiotiques
Figure 11 : Pourcentage de résistance d’E.P.C aux antibiotiques au service de réanimation Figure12 : Pourcentage de résistance d’E.P.C aux antibiotiques aux services de chirurgie Figure 13 : Pourcentage de résistance d’E. P.C aux antibiotiques aux services de médecine Figure 14 : Taux de résistances des différents E.P.C aux différents antibiotiques(%) Figure 15 : Taux de résistance aux ATB en fonction des sites de prélèvements
les plus fréquents
Figure 16 : Les bacilles à Gram négatif observés au microscope optique (Gx100)
Figure 17 : Structure et aspect microscopique des Enterobacteriaceae.
Figure 18 : Noyau Bêta lactame
Figure 19 : Structure schématique de la paroi bactérienne et de la membrane cytoplasmique. Figure 20 : Structure chimique de base des carbapénèmes
Figure 21 : Structure chimique des différents carbapénèmes Figure 22 : Test de Hodge modifié
Figure 23 : Détection de l’activité carbapénèmase par spectrométrie de masse MALDI-TOF Figure 24 : Principe du Carba NP test à gauche et RAPIDEC® CARBA NP à droite,
Figure 26 : Potentiostat « fait-maison » et électrode avec 8 sondes Figure 27 : Principe d’un test immunochromatographique
Figure 28 : Algorithme phénotypique de criblage des souches d’entérobactéries productrices de carbapénèmases au sein des souches non-sensibles aux carbapénèmes (2015) : recommandations (2018) du CASFM/EUCAST. Figure 29 : Distribution mondiale des EPC KPC
Figure 30 : Distribution mondiale des EPC NDM
Figure 31 : Distribution mondiale des EPC OXA-48-like
Figure 32 : Évolution du nombre de signalements d’infections nosocomiales et d’entérobactéries productrices de carbapénèmases entre 2002 et 2015. Figure 33 : évolution des EPC selon les années selon le centre national de référence Figure 34 : Différents niveaux de précautions « en fusée à trois étages »
à appliquer pour maîtriser la diffusion de la transmission croisée des bactéries multirésistantes (BMR) ou hautement résistantes émergentes (BHRe) aux antibiotiques.
ARS. : Agence régionale de santé
ATCC. : American type culture collection (contrôle de qualité) ATM. : Aztréonam
BCP. : Bromocrésol Pourpre BGN. : Bacille Gram négatif
BHRe. : Bactérie hautement résistante émergente BLSE. : β-lactamase à spectre étendu
BMR. : Bactérie multi-résistante
CASFM. : Comité de l'antibiogramme de la société française de microbiologie CAZ. : Ceftazidime
C1G. : Céphalosporines de 1ère génération C2G. : Céphalosporines de 2ème génération C3G. : Céphalosporines de 3ème génération
CCLIN. : Centre de coordination de la lutte contre les infections nosocomiales CF. : Céfalotine
CHU. : Centre hospitalier universitaire CIM. : Carbapenem inactivation method CLSI. : Clinical & laboratory standards institute CMI. : Concentration minimal inhibitrice CNR. : Centre national de référence CTX. : céfotaxime
DHP. : Dihydropeptidase
EPC : Entérobacteries productrices de carbapénèmase E.coli : Escherichia coli
EARS-Net : European antimicrobial resistance surveillance Network EBLSE. : entérobactérie productrice de β-lactamase à spectre étendu ECDC. : European center for disease prevention and control
EDTA. : Acide éthylène-diamine-tétra-acétique
EHPAD. : Etablissement d’hébergement pour personnes âgées dépendantes EPC. : Entérobactérie productrice de carbapénèmase
ERT. : Ertapénème
EUCAST. : European committee on antimicrobial susceptibility testing FEP. : Céfépime
HCSP. : Haut conseil de santé publique IMP. : Imipénème
InVS. : Institut national de veille sanitaire KPC. : Klebsiella pneumoniae carbapenemase
MALDI-TOF. : Matrix-Assisted Laser Desorption Ionization - Time Of Flight MBL. : Métallo-β-lactamase
MH. : Mueller-Hinton
MHT. : Test de Hodge modifié
NDM. : New-Delhi métallo-β-lactamase
ONERBA. : Observatoire national de l'épidémiologie de la résistance bactérienne aux antibiotiques PCC. : Précautions complémentaires contact
PCR. : Réaction de polymérisation en chaîne PIP. : Pipéracilline
PLP. : Protéines liant les pénicillines
SFAR. : Société française d’anesthésie et réanimation SM. : Spectrométrie de masse
SPILF. : Société de pathologie infectieuse de langue française SRLF. : Société de réanimation de langue française
TCC. : Ticarcilline + acide clavulanique TIC. : Ticarcilline
TZP. : Pipéracilline + tazobactam KT : cathéter
MATÉRIEL ET MÉTHODOLOGIE 4
I. Matériel 5
1. Type et cadre d’étude 5
2. Souches étudiées 5
II. Méthodologie 6
1. Modalité de recueil des données 6
2. Isolement et identification des bactéries. 7
3. Etude de la sensibilité aux antibiotiques 7
4. Méthode phénotypique de détection des entérobactéries productrices
de carbapénèmase: 8
5. Analyse statistique des données 11
RÉSULTATS 12
I. Epidémiologie des entérobactéries productrices de carbapénèmase à l’HIT 13 1. Répartition globale des Entérobactéries isolées selon les espèces bactériennes 13 2. Fréquence des E.P.C au sein des entérobactéries isolées 13 3. Répartition des E.P.C selon le sexe des patients 14 4. Répartition des E.P.C selon les services d’isolement. 14 5. Répartition des E.P.C selon la nature des prélèvements 15 6. Répartition globale des E.P.C selon les espèces bactériennes 16
7. Évolution des E.P.C selon les années d'étude 17
II. Profil de résistances des E.P.C aux antibiotiques 18 1. Profil de résistances globales des E.P.C aux antibiotiques 18 2. profil de résistance des EPC aux ATB selon les services 19 3. Profil de résistance des E.P.C aux ATB selon l’espèce bactérienne 21 4. profil de résistance aux ATB en fonction des sites de prélèvements les plus
fréquents 22
III. La comparaison des différents tests de détection des E.P.C : 22
DISCUSSION 23
I. Rappel 24
1. Les entérobactéries 24
2. Mécanismes de résistance des entérobactéries aux antibiotiques : 30
3. Les carbapénèmes 36
4. Les carbapénèmases 40
5. Détection des carbapénèmases au laboratoire de microbiologie médicale 44
II. Discussion des résultats 56
1. Epidémiologie des enterobactéries productrices de carbapénèmase 56 2. Epidémiologie de la résistance aux antibiotiques des EPC 65
IV. Traitement des infections dues à entérobactéries productrices de carbapénèmases 76
1. Carbapénèmes 77
2. β-lactamines : aztreonam, C3G et témocilline 78
3. Polymyxines (colistine, polymyxine B) 79
4. Tigécycline 79 5. Aminosides 79 6. Fosfomycine 80 CONCLUSION 81 ANNEXES 83 RÉSUMÉS 86 BIBLIOGRAPHIE 90
La résistance croissante des bactéries aux antibiotiques est devenue un enjeu majeur de santé publique faisant craindre des situations épidémiques et endémiques et des impasses thérapeutiques [1,2]. L’urgence de la situation est telle que les autorités sanitaires internationales se mobilisent activement pour sauvegarder les antibiotiques afin que les progrès qu’ils ont permis dans le traitement et la prévention des infections bactériennes depuis 70 ans ne soient pas réduit à néant dans quelques années[3–4]. C’est notamment le cas pour les bêtalactamines, pilier de l’antibiothérapie des infections à entérobactéries.
Certaines entérobactéries potentiellement très pathogènes, Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae ou aérogènes, sont devenues résistantes à l’ensemble des molécules de cette classe, y compris les carbapénèmes [5,6].
Cette résistance reste beaucoup plus fréquente en milieu hospitalier qu’en milieu communautaire, en rapport avec la pression de sélection exercée par l’usage massif des antibiotiques et le support plasmidique favorisant une rapide et large diffusion [7].
L’émergence de la résistance aux carbapénèmes par production de carbapénèmase représente une étape supplémentaire vers la pan-résistance aux antibiotiques chez les entérobactéries [3,8]. Ces carbapénèmases sont de différents types : des métallo-bêtalactamases (IMP, VIMP), des carbapénèmases de classe A (KPC, GES, etc.) et des oxacillinases [9].
De nombreuses épidémies de souches d’entérobactéries productrices de carbapénèmase ont été rapportées dans le monde entier et en Europe, tout particulièrement dans le Sud du continent (Italie, Espagne, Grèce) [8]. La résistance aux carbapénèmes est variable, toujours plus marquée chez Enterobacter cloacae et Klebsiella pneumonaie que chez E. coli ou Proteus mirabilis.
Dès lors, il est devenu nécessaire de connaitre la bactérie, de bien maîtriser ses mécanismes de résistance, ainsi tester leur comportement vis-à-vis des autres antibiotiques afin d’apporter une solution thérapeutique et une fin à ce fléau.
Dans le cadre de la surveillance et de la lutte contre l’émergence et la dissémination des souches d’entérobactéries productrices de carbapénèmase, on a procédé à la réalisation de cette étude rétrospective des différents prélèvements biologiques provenant de différents services pendant une période de cinq ans au sein de laboratoire de Microbiologie de l’Hôpital Ibn Tofail de Marrakech dont l’objectif est :
• D’établir le profil épidémiologique des entérobactéries productrices de carbapénèmase dans l’hôpital Ibn Tofail.
• D’évaluer le niveau de résistance aux différents antibiotiques chez les différentes souches d’entérobactéries productrices de carbapénèmase isolées au Laboratoire de Bactériologie de l’Hôpital Ibn Tofail de Marrakech des différents prélèvements biologiques.
• Comparer l’efficacité de deux tests phénotypiques utilisés pour la détection de carbapénèmase chez les entérobactéries.
• Proposer des mesures de prévention et de contrôle à appliquer pour prévenir la propagation des souches productrices de carbapénèmase dans les milieux de soins
MATÉRIEL
&
I. Matériel
1. Type et cadre d’étude
Il s’agit d’une étude descriptive rétrospective, menée au sein du laboratoire de microbiologie de l’Hôpital Ibn Tofail Marrakech (HIT Les données ont été recueillies à partir des registres du service.).
L’étude a été conduite du 1er
2. Souches étudiées :
Janvier 2011 au 31 Décembre 2015. Le choix de cette période a été dicté par la délocalisation de certains services, essentiellement médicaux, vers l’hôpital Arrazi du CHU Mohammed VI, et ce, dès l’année 2015.
Les souches sont été isolées de différents prélèvements: Pus, Urines (ECBU), Cathéters, hémocultures, prélèvements génitaux, prélèvements respiratoires, liquides de ponctions (liquide céphalo-rachidien, d’ascite, pleural) et matériel d’ostéosynthèse.
2.1. Critères d’inclusions
L’étude a porté sur tous les prélèvements bactériologiques à visée diagnostique reçus au laboratoire de microbiologie de l’HIT, provenant de patients hospitalisés dans les différents services de notre établissement ou consultant à titre externe.
2.2. Critères d’exclusions
Les souches isolées d’un même malade et dont le profil de sensibilité est identique ont été considérées comme doublons.
Les prélèvements effectués dans le cadre d’une enquête épidémiologique.
Les prélèvements ont été adressés par les différents services médicaux, chirurgicaux et de réanimations de l’hôpital Ibn Tofail (Tableau I ).
Tableau I : Les services présents à l’hôpital Ibn Tofail en 2011 et 2015. Services médicaux - Cardiologie (CARD) - Endocrinologie (END) - Hématologie-oncologie (H-O) - Gastrologie-entérologie (G-E) - Dermatologie (DER) - Néphrologie (NEP) - Médecine interne (M-I) - Neurologie (NEU) - Rhumatologie (RHU) Services chirurgicaux - Oto-rhino-laryngologie (ORL) - Chirurgie cardiovasculaire (CCV) - Maxillo-faciale (CMF) - Viscérale (CHV) - Traumatologie A et B (TRA) (TRB) - Ophtalmologie (OPH) - Plastique (CHP) - Neurochirurgie (NCH) - Urologie (URO)
Services de réanimation - Réanimation médicale et chirurgicale (RMC) - Déchoquage (DECH)
Service externe
II. Méthodologie
1. Modalité de recueil des données
Le recueil des informations est réalisé à partir des fiches d’antibiogramme et des registres du laboratoire en exploitant les données suivantes :
− Le sexe du patient. − Le numéro d’entrée − La date de prélèvement − Le service d’origine. − La nature du prélèvement.
− L’espèce bactérienne isolée.
− L’interprétation des résultats de l’antibiogramme.
2. Isolement et identification des bactéries.
Les prélèvements sont ensemencés selon leur nature et le site infectieux, sur milieux de culture enrichis (gélose au sang cuit supplémenté en vitamines, gélose au sang frais) et/ ou sélectifs (CLED ou BCP) pour l’isolement des entérobactéries. L’incubation se fait à 37°C pendant 24H.
L’identification des souches bactériennes a été basée sur l’étude des caractères de la famille (bacilles à Gram négatif non exigeants, métabolisme fermentaire, aéro-anaérobies, nitrate réductase positive, oxydase négative), leurs caractères morphologiques, culturaux et biochimiques
3. Etude de la sensibilité aux antibiotiques
Pour chaque souche, la sensibilité a été déterminée par antibiogramme standard par écouvillonnage selon la méthode de diffusion en milieu gélosé Mueller-Hinton. La méthode de diffusion consiste à placer plusieurs disques imbibés d’antibiotiques sur une ou plusieurs boites de pétri préalablement ensemencées par la suspension bactérienne. L’effet de ces antibiotiques est observé par la diffusion concentrique autour de chaque disque d’antibiotique et la mesure des diamètres d’inhibition. Les boites peuvent être mises en incubation à 37°C dans les conditions requises. Le choix des antibiotiques et les critères de lecture et d’interprétation sont ceux du comité de l’antibiogramme de l’association française et européenne de microbiologie (CASFM 2013 /EUCAST 2015).
Le tableau ci-dessous présente les différents antibiotiques testés pour l’antibiogramme des bactéries isolées.
Tableau II: :les différents antibiotiques utilisés pour l’antibiogramme.
Les souches bactériennes ont été classées en trois catégories cliniques : sensible (S), intermédiaire (I) et résistante (R).
4. Méthode phénotypique de détection des entérobactéries productrices de
carbapénèmase :
La détection des carbapénèmases chez les entérobactéries est recommandée sur le plan épidémiologique pour surveiller et contrôler leur diffusion.
Bétalactamines Pénicillines Ampicilline : AMP Amoxicilline : Amx Ticarcilline : TIC Pipéracilline : PIP Mécillinam : Mec Carbapénème Imipenème : IMP Ertapénème : ERT Monobactame Aztréonam : AZT Inhibiteurs de bétalactamase Amoxicilline-Acide clavulanique : AMC Tiracilline Acide-Clavulanique : TCC0 Pipéracilline-Tazobactam TZP Céphalosporines Céfalotine(C1G) KF Céfoxitine(C2G) FOX Ceftriaxone (C3G) CRO Céfotaxime(C3G) CTX Ceftazidime(C3G) CAT Aminosides Gentamicine (G) Tobramycine (Tob) Amikacine (AK)
Quinolones Acide Nalidixique(AN)
Ciprofloxacine (Cip) Autres Triméthoprime-Sulfaméthoxazole(Sxt) Colistine (Ct) Fosfomycine (Fos)
4.1. Technique de diffusion en milieu Mueller Hinton (MH)
Selon les recommandations du Comité de l’Antibiogramme de la Société Française de Microbiologie (CA-SFM), l’ertapénème est le carbapénème qui possède la meilleure sensibilité pour la détection des EPC. Ainsi, toute souche possédant une diminution de sensibilité à l’ertapénème [une diamètre d’inhibition (disque 10 μg/ml) < 28 mm (CASFM-2013) ou < 25 mm (CASFM 2015)] par test de diffusion en gélose peut être suspecté de production de carbapénèmase et doit être soumise à d’autres test de détection et confirmation.
4.2. Test de Hodge modifié.
Dans notre contexte, entre l’année 2011 et 2015, toute souche d’entérobactérie résistante à l’ertapénème par méthode de diffusion en milieu gélosé a été considérée suspecte de production de carbapénèmase et a été soumise à un hodge test et conservée à -80°C.
Ce test permet la mise en évidence d’une synergie d’activité enzymatique entre les souches productrices de carbapénèmase (souches à tester) et souches sauvages de référence sensibles. Il repose sur l’utilisation d’un disque d’ertapénème 10μg et la souche de référence sensible E. coli ATCC ensemencée par écouvillonnage sur gélose Mueller-Hinton. Les souches test suspectes de produire une carbapénèmase et les souches témoins sont ensemencées en stries depuis le disque vers le bord de la gélose. La déformation de la zone d’inhibition de la souche suspectée le long de la strie est considérée comme productrice d’une carbapénèmase. Cependant ce test n’est plus recommandé car difficile à standardiser et manque de spécificité et de sensibilité.
Figure 1 : Test de hodge modifié
Toutes les souches détectées productrices de carbapénèmase pendant les années 2011 /2015 ont été conservées à moins 80°C. Durant notre étude, ces souches ainsi congelées ont été toutes décongelées et retestées par le test de criblage recommandé par EUCAST en 2018.
4.3. Test de criblage des souches d’EPC
Ce test repose sur l’utilisation de ces 3 antibiotiques suivants (ticarcilline + acide clavulanique, témocilline, imipenème ou méropénème) qui doivent être testés dans l’antibiogramme standard.
Figure 3 : un nouvel algorithme de criblage [10]
Durant notre étude et afin de comparer les anciens tests phénotypiques recommandés pour la détection de la carbapénèmase chez les entérobactéries, notamment le Hodge test, et le récent test de criblage, toutes les souches d’entérobactéries détectées productrices de carbapénèmase entre 2011 et 2015 et conservées à -80°C ont été décongelées et réévaluées par le test de criblage.
5. Analyse statistique des données
L’exploitation informatique des données a été faite à l’aide du logiciel Access et Excel (Office 2007 de Microsoft) .
I. Epidémiologie des entérobactéries productrices de carbapénèmase
à l’HIT
1. Répartition globale des Entérobactéries isolées selon les espèces
bactériennes
Durant la période d’étude allant du 1er janvier 2011 au 31 Décembre 2015 ,2130
entérobactéries ont été isolées ; avec une prédominance d’E Coli qui a représenté 42%, suivie de
klebsiella pneumoniae 30%, d’Enterobacter cloacae 9%, de Proteus Mirabilis 6 % ,d’Enterobacter spp 4% ,de Proteus Vulgaris 1% , les autres entérobactéries ont représenté 8% de l’ensemble.
Tableau III:: Répartition globale des Entérobactéries isolées selon les espèces bactériennes
Bactéries Nombre Pourcentage
Escherichia coli 895 42% Klebsiella pneumoniae 646 30% Enterobacter cloacae 182 9% Proteus mirabilis 134 6% Enterobacter spp 85 4% Proteus Vulgaris 23 1% Autres 165 8% Total 2130 100
2. Fréquence des E.P.C au sein des entérobactéries isolées
Au sein des entérobactéries isolées n=2130, les entérobactéries productrices de carbapénèmase (EPC) ont représenté 5% (n=100) de l’ensemble des entérobactéries.
Tableau IV : Fréquence d’isolement des EPC au sein des entérobactéries isolées
Phénotype Nombre Pourcentage
NN E.P.C 2030 95%
E.P.C 100 5%
Figue 4 : Fréquence d’isolement des EPC au sein des entérobactéries isolées
3. Répartition des E.P.C selon le sexe des patients
Dans notre étude, la population était majoritairement masculine avec un sexe ratio H/F : 1.7.
Figure 5 : Répartition des EPC selon le sexe.
4. Répartition des E.P.C selon les services d’isolement.
Les E.P.C ont été retrouvé dans les différents secteurs d’activité à l’ HIT ; avec une prédominance manifeste au niveau des services de réanimation 41% , suivi par les services de chirurgie avec 26% ,et des services de médecine avec 22%, le reste des E.P.C 11 % provenaient des patients externes .
5%
95%
E.P.C
Non E.P.C
63%
37%
MASCULIN
FEMININ
Tableau V : Répartition des EPC selon les services d’isolement.
service nombre pourcentage
réanimation 41 41%
service de chirurgie 26 26%
Service de médecine 22 22%
externe 11 11%
total 100 100%
Figure 6 :Répartition des E.P.C selon les services d’isolement.
5. Répartition des E.P.C selon la nature des prélèvements
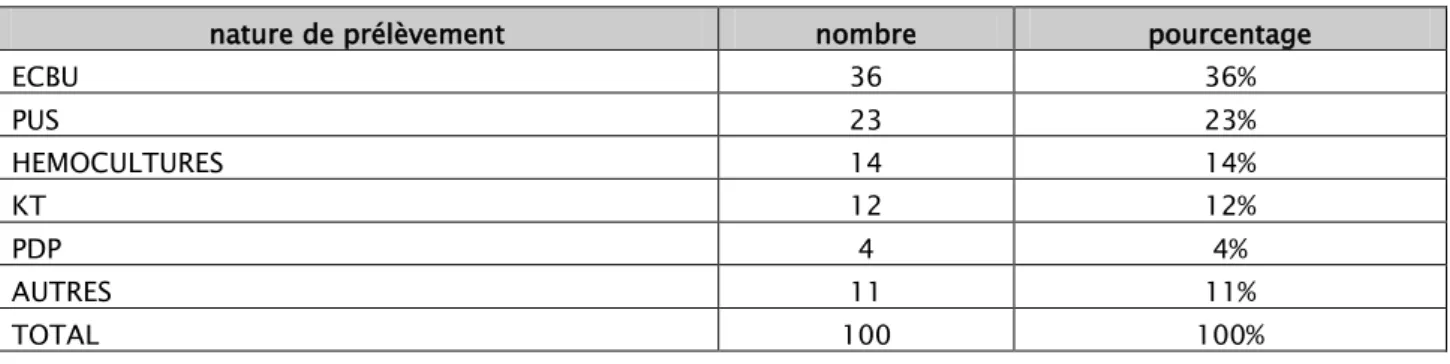
La répartition des E.P.C selon la nature des prélèvements a révélé la prédominance des souches au niveau des ECBU 36% , suivie par les pus 23% ,les hémocultures qui représentent 14%, des KT qui représentent 12% , les PDP (prélèvements distaux protégés) qui représentent 4% et 11% pour les autres sites infectieux.
Tableau VI : Répartition des E.P.C selon la nature des prélèvements
nature de prélèvement nombre pourcentage
ECBU 36 36% PUS 23 23% HEMOCULTURES 14 14% KT 12 12% PDP 4 4% AUTRES 11 11% TOTAL 100 100% 0% 5% 10% 15% 20% 25% 30% 35% 40% 45%
reanimation
chirugie
medecine
externe
41%
26%
22%
Figure 7 : Répartition des E.P.C selon la nature des prélèvements
6. Répartition globale des E.P.C selon les espèces bactériennes
La répartition des E.P.C selon les espèces bactériennes a révélé la prédominance de
kleibssella pneumoniae qui représente 37% , suivis d’Enterobacter cloacae représente 29% ; d’E. Coli 13% , d’Enterobacter spp et Citobacter Freundii représentent chacune 6% , de Providencia Stuarti représentent 3% , les autres souches représentent 6% .
Tableau VII : Répartition globale des E.P.C selon les espèces bactériennes
Bactéries nombre Pourcentage
Klebsiella pneumoniae 37 37% Enterobacter cloacae 29 29% E. coli 13 13% Enterobacter spp 6 6% Citrobacter freundii 6 6% Providencia Stuarti 3 3% autres 6 6% Total 100 100%
36%
23%
14%
12%
4%
11%
ECBU
PUS
HEMOCULTURE
KT
PDP
AUTRES
Figure 8 : Répartition globale des E.P.C selon les espèces bactériennes
7. Évolution des E.P.C selon les années d'étude
En 2011, 274 souches d’entérobactéries ont été isolées dont 7 souches productrices d’E.P.C, soit une fréquence de 3%.
En 2012, sur les 350 souches d’entérobactéries isolées, 27 souches étaient productrices d’E.P.C, soit 8%.
En 2013, sur les 651 souches d’entérobactéries isolées, 19 souches sont productrices d’E.P.C, soit 3%.
En 2014, 566 entérobactéries ont été isolées dont 21 souches productrices d’E.P.C, soit une fréquence de 4%.
En 2015 ,289 souches d’entérobactéries productrices d’E.P.C ont été isolées dont 26 souches productrices d’E.P.C, soit 9%.
37%
29%
13%
6%
6%
3%
6%
Kleibssella pneumonaie
Enterobacter cloacae
Ecoli
Enterobacter spp
Citrobacter freundii
Providencia Stuarti
autres
Tableau VIII: Évolution des E.P.C selon les années d'étude
années total des entérobactéries nombre d'E.P.C Fréquence %
2011 274 7 3% 2012 350 27 8% 2013 651 19 3% 2014 566 21 4% 2015 289 26 9% total 2130 100 5%
Figure 9 : Evolution des E.P.C selon les années d’étude
II. Profil de résistances des E.P.C aux antibiotiques :
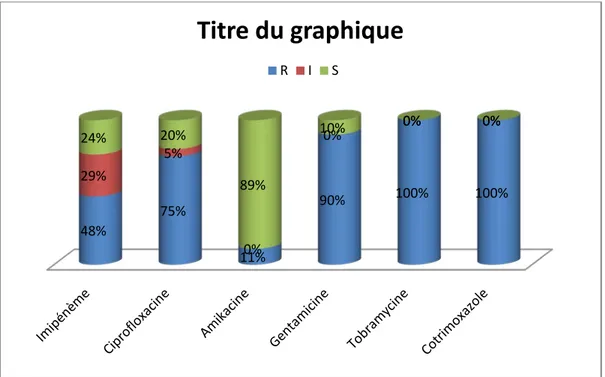
1. Profil de résistances globales des E.P.C aux antibiotiques
Sur les 100 souches des EPC isolées de l’HIT, 54% des souches isolées étaient résistantes l’imipénème, 68% à la ciprofloxacine et 90 % à la tobramycine
67% des isolats etaient sensible à l’Amikacine et toutes les souches étaient sensibles à la colistine.
3%
8%
3%
4%
9%
0% 1% 2% 3% 4% 5% 6% 7% 8% 9% 10% 2011 2012 2013 2014 2015Figure 10 : Profil de résistances globales des E.P.C aux antibiotiques
2. profil de résistance des EPC aux ATB selon les services :
2.1. Service de réanimation
Sur 41 souches E.P.C isolées au service de réanimation, 92% à la Cotrimoxazole, 82% à la Tobramycine, et 63% des souches étaient résistantes à l’imipénème, 50% à la Gentamicine et 48% des souches isolés étaient résistants à l’Amikacine.
Le taux de sensibilité à l’Amikacine était à 53%.
Figure 11 : Pourcentage de résistance d’E.P.C aux antibiotiques au service de réanimation
54% 68% 32% 77% 90% 0% 95% 24% 31% 67% 23% 10% 100% 5% R I S 63% 53% 48% 50% 82% 92% 20% 47% 53% 50% 18% 8% R I S
2.2. Service de chirurgie
Sur 26 souches E.P.C isolées au service de chirurgie, 100% des souches isolées étaient résistantes à la Cotrimoxazole et la Tobramycine ,90% à la Gentamicine, 48% à l’Imipénème.
Le taux de sensibilité à l’Amikacine était à 89%.
Figure 12: Pourcentage de résistance d’E.P.C aux antibiotiques aux services de chirurgie
2.3. Services de médecine
Sur 22 souches E.P.C isolées au service de médecine, 100% des souches isolées étaient résistantes à la Gentamicine ,95% à la Tobramycine, 94% à Cotrimoxazole, 86% à la Ciprofloxacine et 55% à l’imipénème.
Le taux de sensibilité à l’Amikacine était à 68% 48% 75% 11% 90% 100% 100% 29% 5% 0% 0% 0% 0% 24% 20% 89% 10% 0% 0%
Titre du graphique
R I SFigure 13 :Pourcentage de résistance d’E. P.C aux antibiotiques aux services de médecine
3. Profil de résistance des E.P.C aux ATB selon l’espèce bactérienne
L’étude des résistances des principales entérobactéries productrices de carbapénèmase de notre série montre que Klebsiella pneumoniae, E.coli et Enterobacter Cloacae ont un taux de résistance très proches à tous les antibiotiques avec un taux moins important à l’Amikacine .
Figure 14 : Taux de résistances des différents E.P.C aux différents antibiotiques selon l’espèce bactérienne(%) 55% 86% 27% 100% 95% 94% 27% 14% 68% 0% 5% 6% R I S 63 66 31 72 87 95 54 73 33 80 89 89 66 75 48 68 89 100
Titre du graphique
4. profil de résistance aux ATB en fonction des sites de prélèvements les plus
fréquents
Les taux de résistance étaient plus importants chez les E.P.C au niveau d’ECBU, d’hémocultures et des souches isolées des pus pour la Gentamicine et la Tobramycine
Les taux de résistance les moins importants étaient retrouvés chez les souches isolées au niveau d’ECBU pour la Cotrimoxazole et l’Amikacine.
Figure 15 : Taux de résistance aux ATB en fonction des sites de prélèvements les plus fréquents
III. La comparaison des différents tests de détection des E.P.C :
Les deux tests : Hodge test modifié et test de criblage ont aboutit aux mêmes résultats. 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% 49% 91% 13% 94% 89% 10% 65% 45% 41% 80% 100% 92% 64% 71% 36% 80% 75% 83%
I. Rappel
1. Les entérobactéries
1.1. Généralités
Les entérobactéries constituent un grand groupe de bactéries ayant une forte similitude. La création de ce groupe a été proposée par Rahn en 1937 qu’il dénomma Enterobacteriaceae. Si le nom de famille est toujours maintenu, en revanche le classement des bactéries dans la famille a beaucoup évolué [11].
Les entérobactéries constituent l’une des plus importantes familles de bactéries très hétérogène sur le plan pathogénie et écologie [12]. On compte plus de 30 genres 130 espèces qui sont rassemblés selon leurs caractères bactériologiques ; en effet elles sont soit parasites (Shigella, Yersinia pestis), soit commensales (Escherichia coli, Proteus mirabilis, Klebsiella spp), soit encore saprophytes (Serratia spp, Enterobacter spp)[13,14].
On les retrouve dans une grande majorité de prélèvements. Seuls les genres et les espèces qui ont un intérêt médical reconnu nous intéressent. Une centaine d’espèces d’entérobactéries sont individualisées, mais 23 d’entre elles représentent 99% des souches isolées en clinique[15].
1.2. Caractéristiques générales
La famille des entérobactéries comprend de nombreux genres bactériens répondant à la définition suivante :
• Bacilles à Gram négatif • aéro-anaérobies facultatifs
• immobiles ou mobiles par ciliature péritriche • culture aisée
• catalase positive,
• nitrate réductase positive • dépourvues d’oxydase • catalase positive • fermentaire [12].
Figure 16 :Les bacilles à Gram négatif observés au microscope optique (Gx100)
1.3. classification
La famille des entérobactéries comprend actuellement une centaine d’espèces [16]. Les entérobactéries d’intérêt médical appartiennent à 12 genres : Citrobacter, Enterobacter, Escherichia, Hafnia, Klebsiella, Morganella, Proteus, Providencia, Salmonella, Serratia, Shigella, et Yersinia (Tableau IX) [17].
Tableau IX: classification des entérobactéries les plus rencontrées en pathologie humaine [18]
Genres Espèces
Groupe I
Edardsiella
Salmonella Salmonella typhi Salmonella paratyphi Salmonella enteritidis
Groupe II
Escherichia Escherichia coli
Shigella Shigella dysenteriae Shigella flexneri Shigella boydii Shigella sonnei Levinea Groupe III
Klebsiella Klebsiella pneumoniae Klebsiella oxytoca Enterobacter Enterobacter aerogenes Enterobacter cloacae Serratia Serratia marcescens
Erwinia Groupe IV Proteus Proteus mirabilis Proteus vulgaris Proteus rettgerii Providencia
Groupe V Yersinia Yersinia enterolitica Yersinia pseudotuberculosis
1.4. Habitats
Les entérobactéries sont largement retrouvée sur les plantes, dans le sol, dans l’eau et le tube digestif de l’homme et des animaux d’où leur nom .elles constituent en effet une part prépondérante de la flore intestinale de l’homme mais sont relativement rencontrées dans d’autres sites du corps .ce caractère ubiquitaire n’est cependant pas général puisque quelques espèces occupent des niches écologique précises (exemple de salmonella Typhi) [19].
1.5. Caractères bactériologiques
a. Caractères morphologiques :
Les Enterobacteriaceae sont des bacilles à Gram négatif, le plus souvent courts (1 à 6 m), droits, immobiles ou mobiles par une ciliature péritriche , non sporulés et peuvent être capsulés (Klebsiella) [20]. La plupart des espèces pathogènes pour l'Homme possèdent des fimbriae ou pili communs qui sont des facteurs d'adhésion [21-22].
b. Caractères culturaux :
Elles ont la capacité de pousser facilement sur des milieux ordinaires (gélose ou bouillon nutritif) en 18 à 24 h. La température optimale de croissance est de 37° mais la culture est possible entre 20° et 40° en aérobiose ou en anaérobiose [23].
Leur pousse se révèle par un trouble uniforme du bouillon et par l’apparition de colonies d’un diamètre supérieur à 1 mm sur milieu gélosé. Ainsi on distingue trois types de colonies :
− Colonies S (smooth) : arrondies, lisses, humides, blanches ou translucides. − Colonies R (rugueuses) : sèches à contours irréguliers et mates (bactéries − vieillies ou anormales).
− Colonies M (muqueuses) : grosses colonies ± confluentes (klebsiella spp). Envahissement de la gélose : formation d’un tapis uniforme (Proteus).
c. Caractères biochimiques
L’identification du genre et espèce bactérienne repose d’abord sur l’étude des caractères biochimiques [24,25]. Des galeries biochimiques permettent de déterminer avec précision le genre et l’espèce, se basant sur :
• L’étude du métabolisme glucidique (dégradation des sucres: glucose, lactose, galactose),
• L’étude du métabolisme peptidique par la dégradation des acides aminés, recherche d’uréase et de tryptophane désaminase (TDA),
• L’utilisation du citrate comme seule source de carbone, • La production d’acétoïne, d’H2S,
• L’hydrolyse de la gélatine
d. Caractères antigéniques :
Les entérobactéries possèdent plusieurs types d'antigènes différents :
• antigènes O : antigène de paroi constitué de lipopolysaccharides (LPS) thermostable, perdu chez les souches R (colonies rugueuses) qui deviennent autoagglutinables en eau distillée
• antigène H : antigène flagellaire (bactéries mobiles) constitué de flagelline thermolabile
• antigène K : antigène capsulaire ( Klebsiella et certaines souches d' E. coli , Shigella,
Citrobacter et Salmonella « antigène Vi ») constitué de couches externes de polysaccharides qui peuvent masquer l'antigène O (une ébullition de 2 heures permet de démasquer l'antigène O chez ces souches)
• antigène de Kunin ou Enterobacteriaceae common antigen (ECA) constitué d'un glycophospholipide spécifiquedes entérobactéries ;
• antigènes d'adhésines ( pili , fimbriae ). [20].
1.6. Pouvoir pathogène
a. Pathogènes opportunistes
Se sont des entérobactéries d’origine intestinale qui peuvent à des degrés divers devenir agressives pour l’Homme. La fréquence de leurs manifestations pathologiques est en augmentation, car souvent due à l'existence chez ces espèces de plasmides de résistance aux antibiotiques permettant leur sélection.
Les pathogènes opportunistes les plus souvent rencontrés sont les bactéries des genres Citrobacter, Enterobacter, Klebsiella, Protéus et Serratia [27].
b. Pathogènes vrais
Les pathogènes vrais sont représentés par exemple, par Salmonella Typhi responsable de la typhoïde, Shigella dysenteriae responsable de la dysenterie et Yersinia pestis agent de la peste. Leur mise en évidence dans un prélèvement Clinique devra toujours être prise en considération. Ces organismes produisent des facteurs de virulence qui peuvent générer des infections très graves.
2. Mécanismes de résistance des entérobactéries aux antibiotiques :
2.1. La résistance des entérobactéries aux bêtalactamines
a. Betalactamines :
Les bêtalactamines constituent la principale famille d’antibiotiques en raison de l’extrême diversité de leurs structures, liée en premier lieu aux progrès de l’hémisynthèse obtenus depuis 50 ans. Il en résulte un choix thérapeutique important : aminopénicillines, carboxypénicillines, acyluréidopénicillines, céphalosporines et enfin carbapénèmes.[28]
Elles ont en commun un noyau bêtalactame [29] (Figure 18 : Noyau ) associé à des cycles et des chaînes latérales variables qui expliquent les propriétés pharmacocinétiques et le spectre d'activité des différents produits.
Figure 18 : Noyau Bêtalactame [29]
La grande variété de leurs modes d'administration, leur large spectre d'activité antibactérien associé à une action bactéricide, une bonne diffusion tissulaire, une bonne tolérance et un faible nombre d'interactions médicamenteuses expliquent leur popularité et l'importance de leur utilisation [30].
b. Mode d’action des bêtalactamines :
Les b-lactamines sont des antibiotiques bactéricides qui inhibent la synthèse de la paroi bacetrienne .les tanspeptodases et carboxypeptidases,enzyemes associées à la membrane cytoplasmique ,fixent de façon covalente ces antibiotiques .cette liaison est due à une analogie structurale entre le substrat naturel de ces enzymes ,l’acyl-D-alanyl-D-alanine et le cylce B-lactame. Leurs cibles sont diverses et dénommées PLP qui jouent un rôle prépondérant dans la synthèse du peptidoglycane [31].
Chez les entérobactéries , pour traverser la couche la plus externe de nature polyosidique, la diffusion s’effectue au travers des porines , qui laissent passer les molécules hydrophiles comme les pénicillines ou les céphalosporines[28].
Les entérobactéries peuvent développer plusieurs mécanismes de résistance aux bêtalactamines [5]
• Modification de la cible PLP
• résistance par efflux actif : des pompes efflux qui peuvent expulser l’antibiotique hors de la cellule même contre le gradient de concentration ;
• résistance par imperméabilité : une altération qualitative ou quantitative
Figure 19 : Structure schématique de la paroi bactérienne et de la membrane Cytoplasmique[30]
c. Mécanisme de résistance des entérobactéries aux bêtalactamines
Le mécanisme le plus fréquent de résistance aux β-lactamines chez les BGN est l’inactivation enzymatique liée à la production d’une β-lactamase, entraînant une hydrolyse plus ou moins totale de l’antibiotique par la bactérie [32]. C’est lors de l’apparition des céphalosporines de troisième génération (C3G) dans les années 1980-1985, puis des carbapénèmes, que ces enzymes ont « explosé » chez les entérobactéries [33].
Depuis les années 1980, de nombreuses enzymes inactivant les β-lactamines, les β- lactamases, ont émergé [34]. Elles sont réparties en 4 classes selon la classification d’Ambler.
c.1. Classification d’Ambler
D’après la classification d’Ambler (Tableau XI), les β-lactamases sont réparties en 4 classes en fonction de leur structure primaire [35]. Les enzymes de classe A, C et D sont dites à
sérine active (type sérine) tandis que la classe B regroupe les métallo-β-lactamases (métallo-enzymes) nécessitant la présence d’un ion Zn2+ au niveau de leur site actif. Une autre classification existe, la classification fonctionnelle de Bush, mais est peu utilisée dans le monde médical, en raison de sa complexité.
Tableau XI. Classification d'Ambler des β-lactamases
Ambler Site actif enzymes inhibiteur substrats
A Sérine Pases à spectre
restreint clavulanate pénicillines
A Sérine Pases à large
spectre clavulanate Pénicillines + C1G
A Sérine β-lactamases à
spectre étendu clavulanate
Pénicillines + céphalosporines A Sérine Pases résistante aux inhibiteurs - Pénicillines A Sérine Carbénicillinases clavulanate Pénicillines dont Carbénicilline
A Sérine Céfuroximases clavulanate Céphalosporines
A Sérine Carbapénèmases clavulanate
Péni. + céphalo. + carbapénèmes
B Zn2+ Carbapénèmases EDTA Péni. + céphalo. +
carbapénèmes C Sérine Céphalosporinases Cloxacilline Céphalosporines D Sérine Oxacillinases + /clavulanate Pénicilline dont
cloxacilline / carba
Pases : pénicillinases ; péni. : pénicillines ; céphalo. : céphalosporines, C1G : céphalosporines de 1ère génération
c.2. Phénotypes de résistance des entérobactéries aux bétalactamines
La résistance des entérobactéries aux betalactamines set soit naturelle, soit acquise
Phénotype sauvage ou résistance naturelle
les entérobactéries sont classées en 7 groupes en fonction de leur sensibilité naturelle aux B-lactamines [32]. La classification a évolué à partir de l’approche phénotypique de l’antibiogramme. Elle
a permis de revoir les groupes pour inclure les nouvelles espèces et a été adaptée en fonction des caractéristiques génomiques des β- lactamases et des résistances identifiées
Tableau XII : Classification des entérobactéries et profil de résistance naturelle aux β-lactamines[36]
Résistance acquise ou phénotypes « résistants »:
Les phénotypes de résistance acquise des entérobactéries pour les β-lactamines sont décrits dans le Tableau XIII.
Tableau XIII: Phénotypes de résistance acquise des entérobactéries[36]
d. Antibiogramme des entérobactéries :
Selon les recommandations 2018 (EUCAST)) (version 1.0) du CASFM (Comité de l’antibiogramme de la société française de microbiologie) et de l’European Comittee on antimicrobial susceptibility testing (EUCAST) [10], l’antibiogramme des entérobactéries est réalisé par diffusion en milieu gélosé, sur gélose MH (Müeller-Hinton) avec un inoculum de 0.5 McFarland. Il est ensuite incubé à 35 +/- 2°C pendant 20 +/- 4h. Les antibiotiques classiquement testés sont décrits dans le Tableau XIV.
Tableau XIV: Les antibiotiques classiquement testés pour les entérobactéries [10]
3. Les carbapénèmes
Les carbapénèmes représentent une classe d’antibiotiques de la famille des bêtalactamines dont l’usage est croissant ces dernières années en raison de la pandémie mondiale à entérobactéries productrices de betalactamses à spectre élargi(EBLSE) [37]
Les carbapénèmes sont des antibiotiques à usage hospitalier pouvant être utilisés en traitement probabiliste en cas de suspicion d’infection à une bactérie multi-résistante. Leur utilisation est justifiée en raison de leur activité conservée à l’égard des BGN (y compris
P.aeruginosa et A.baumanii) résistants aux céphalosporines de troisième génération, par production d’une BLSE ou hyperproduction d’une céphalosporinase [37].
Quatre molécules sont actuellement disponibles sur le marché : l’imipénème (Tiénam1, et spécialités génériques) depuis 1986, le méropénème (Méronem1) depuis 1997, l’ertapénème (Invanz1) depuis 2002, et tout récemment le doripénème (Doribax1), commercialisé en France en mars 2009[38].
3.1. Structure chimique
La structure des carbapénèmes comprend un noyau β-lactame auquel est fusionné un cycle distinct de celui des pénicillines (l’atome de soufre est remplacé par un carbone en position 1 et le cycle comporte une liaison C2-C3 insaturée – (Figure 20). Cette structure présente une grande stabilité grâce à 2 éléments :
− les atomes d’hydrogène en C5 et C6 sont orientés en trans ; − une chaîne hydroxyéthyl en C6.
Figure 20. Structure chimique de base des carbapénèmes [39]




![Tableau IX: classification des entérobactéries les plus rencontrées en pathologie humaine [18]](https://thumb-eu.123doks.com/thumbv2/123doknet/2003933.2326/55.892.103.826.149.703/tableau-ix-classification-enterobacteries-rencontrees-pathologie-humaine.webp)
![Tableau X: Caractères biochimiques des entérobactéries les plus fréquemment rencontrées [26]](https://thumb-eu.123doks.com/thumbv2/123doknet/2003933.2326/57.892.131.805.336.1057/tableau-caracteres-biochimiques-enterobacteries-frequemment-rencontrees.webp)
![Figure 18 : Noyau Bêtalactame [29]](https://thumb-eu.123doks.com/thumbv2/123doknet/2003933.2326/60.892.184.723.110.375/figure-noyau-betalactame.webp)
![Figure 19 : Structure schématique de la paroi bactérienne et de la membrane Cytoplasmique[30]](https://thumb-eu.123doks.com/thumbv2/123doknet/2003933.2326/61.892.145.771.258.583/figure-structure-schematique-paroi-bacterienne-membrane-cytoplasmique.webp)