Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS Faculté des sciences du sport
Centre de recherches sur la cognition et l'apprentissage (Poitiers) (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Cognition, comportements, langage(s) - CCL (Poitiers) Secteur de recherche : Sciences et Techniques des Activités Physiques et Sportives
Présentée par :
Aurore Meugnot
Immobilisation de courte durée d'un membre et Imagerie motrice
Directeur(s) de Thèse : Yannick Blandin, Lucette Toussaint Soutenue le 25 juin 2014 devant le jury Jury :
Président Aymeric Guillot Professeur - Université Lyon 1 Rapporteur Aymeric Guillot Professeur - Université Lyon 1
Rapporteur Philip Jackson Professeur - Université de Laval (Canada)
Membre Yannick Blandin Professeur - Université de Poitiers
Membre Lucette Toussaint Maître de conférences , HDR - Université de Poitiers
Membre Florent Lebon Maître de conférences - Université de Bourgogne
Pour citer cette thèse :
Aurore Meugnot. Immobilisation de courte durée d'un membre et Imagerie motrice [En ligne]. Thèse Sciences et Techniques des Activités Physiques et Sportives. Poitiers : Université de Poitiers, 2014. Disponible sur Internet <http://theses.univ-poitiers.fr>
!–!
!Faculté!des!Sciences!du!Sport!
! Centre!de!Recherches!sur!la!Cognition!et!l’Apprentissage! CNRS!–!UMR!7295! !Thèse
! Pour!obtenir!le!grade!de!:!Docteur!de!l’Université!de!Poitiers!
Spécialité!:!Sciences!et!Techniques!des!Activités!Physiques!et!Sportives! !Immobilisation!de!courte!durée!d’un!membre!!
et!Imagerie!motrice!
Soutenue!publiquement!le!25!juin!2014!par!!Aurore!MEUGNOT!
!Sous!la!direction!de!Mme!Lucette!TOUSSAINT!et!M.!Yannick!BLANDIN
! ! ! Membres!du!Jury!:
! M.!Guillot!Aymeric!(PU,!Université!de!Lyon,!France)!N!Rapporteur! M.!Jackson!Philip!(PU,!Université!de!Laval,!Canada)!N!Rapporteur! M.!Lebon!Florent!(MCF,!Université!de!Bourgogne,!France)!N!Examinateur! M.!Blandin!Yannick!(PU,!Université!de!Poitiers,!France)!N!Directeur! Mme!Toussaint!Lucette!(MCFNHDR,!Université!de!Poitiers,!France)!N!Directrice!R
EMERCIEMENTS
!
!Je tiens! tout! d’abord! à! remercier! Aymeric! Guillot! et! Philip! Jackson! pour! avoir! accepté! d’évaluer! ce! manuscrit! de! thèse.! Je! remercie! également! Florent! Lebon! pour! avoir! accepté!de!faire!partie!de!mon!jury!de!soutenance.!!
Merci! également! à! Yannick! d’avoir! accepté! de! diriger! cette! thèse.! Merci! pour! tes! conseils!avisés,!notamment!lors!de!la!lecture!finale!de!ce!document.!!
Un! immense! merci! pour! Lucette! à! qui! je! dédie! ce! travail.! Merci! de! m’avoir! ouvert! cette! voie.! Merci! pour! ton! investissement,! ta! disponibilité,! ton! écoute,! ta! gentillesse,! ton! soutien,! ta! bonne! humeur! et! ta! confiance.! Un! merci! tout! personnel! pour! les! moments! de! partage,!mais!aussi!pour!avoir!accepté!et!facilité!mon!travail!à!distance,!me!permettant!ainsi! de!concilier!vie!privée!et!thèse.! ! Je!tiens!également!à!remercier!le!CerCA!pour!m’avoir!accueillie!et!permis!de!réaliser! mes!recherches!dans!des!conditions!matérielles!et!financières!idéales.!Un!merci!particulier!à! Hélène!et!MarieSAnnick!pour!leur!compétence!et!leur!réactivité!pour!tout!ce!qui!concerne! l’administratif.!Merci!à!MarieSfrançoise,!Didier,!Jean!et!Yves!pour!m’avoir!aidée!à!mettre!en! place!mes!expériences.!Merci!aux!membres!de!l’équipe!ATCO!(anciens!et!présents),!Abdel,! Arnaud,!Camille,!les!Cédric!(le!petit!et!le!grand!;N)!!!),!Christel,!Michel!et!Nathalie!pour!leur! aide!et!leurs!conseils,!notamment!lors!des!séminaires!d’équipe.!
Merci! à! Cédric! pour! m’avoir! accompagnée! à! mes! débuts! en! tant! que! chargée! d’enseignement,!et!m’avoir!aidée!pour!la!préparation!de!mes!cours.!
!
Merci! à! tous! les! copains! du! labo,! les! ‘’anciens’’!:! d’abord! à! Geoffroy! qui! m’aura! si! souvent!aidée!et!servi!d’exemple!pendant!ma!thèse.!Mais!aussi!à!Guillaume!et!son!humour! déroutant,! Arnaud,! Olivier,! Julien! et! André.! Et!puis!les!‘’actuels’’!:!Anne,! Arnaud! et! AnneS Lise,!la!secrétaire!la!plus!cool!de!l’université!;N)!!!Merci!à!Solen!pour!ton!écoute!la!première! fois!à!Montpellier…!et!les!suivantes!plus!récemment.!Un!gros!Gros!GRos!GROs!GROS!MERCI!
encouragements! de! ces! derniers! mois.! Un! grand! merci! à! Nounagnon! pour! avoir! travaillé! avec!moi!sur!cette!thématique!et!nous!avoir!toutes!supportées!dans!le!bureau.!Si!j’ai!tant! aimé!le!labo!c’est!aussi!grâce!à!vous…! Un!merci!tout!spécial!à!Nadia!pour!la!nounou!formidable!qu’elle!est,!et!m’avoir!ainsi! permise!de!reprendre!le!taekwondo.!! ! Je!tiens!également!à!remercier!tous!les!amis,!membres!de!ma!famille!mais!aussi!les! étudiants! qui! ont! accepté! de! participer! à! mes! expériences.! Une! pensée! particulière! à! Thomas!et!Maman!qui!ont!été!mes!tout!premiers!‘’cobayes’’…et!Antoine!pour!les!manipes! qui!ont!suivi.!
!
Enfin,! mes! pensées! vont! à! ma! famille…d’abord! à! Papa! et! Maman…merci! pour! les! parents!formidables!que!vous!êtes,!merci!d’être!là!quoi!qu’il!arrive,!dans!les!mauvais!comme! les!bons!moments…je!vous!dois!aussi!la!réussite!de!ce!travail…! À!Sophie,!Stéphane!et!Thomas!qui!me!manquent!et!que!j’aimerais!voir!plus!souvent…! À!mes!grandsSparents!que!j’aime!tendrement…! À!Claude!et!Jacquotte,!parce!qu’on!ne!pouvait!pas!rêver!mieux!comme!beauxNparents…! ! Et!puis…à!Antoine,!pour!ton!amour!au!quotidien!et!ton!soutien,!surtout!ces!derniers! mois.!Merci!d’avoir!avalé!les!kilomètres!toutes!les!semaines!sans!jamais!te!plaindre…Merci! d’avoir! accepté! d’être! loin! de! ta! fille! sans! jamais! m’en! faire! le! reproche…Merci! pour! tes! paroles! de! réconfort! les! jours! où! je! doutais…parce! que! je! t’aime! et! que! tu! me! rends! heureuse…!!
À! Anouk…mon! bébé…! même! si! finir! un! doctorat! est! moins! facile! quand! on! est! maman…même!si!mon!sommeil!en!a!pris!un!sacré!coup…la!vie!est!bien!plus!chouette!depuis! que!tu!es!là,!et!ce!travail!prend!une!saveur!toute!particulière!grâce!à!toi.!
!
! !
S
OMMAIRE
!
!
P
REAMBULE 4P
ARTIE1 –
C
ADRE THEORIQUE 6Chapitre 1 – L’approche cognitive de la motricité humaine 7
I. Une approche représentationnelle de la motricité humaine 7 II. Informations sensorielles, Planification et Contrôle des actions 9
III. Modèles internes, Planification et Contrôle des actions 11
Le modèle interne inverse 12
Le modèle prédictif 13
Évolution des modèles inverses avec la pratique 15
Localisation potentielle des modèles internes dans le cerveau 16
Chapitre 2 – Expérience corporelle et Plasticité cérébrale 18
I. Concept de ‘’plasticité cérébrale’’ : Introduction et Définition 18
II. Effets de l’Immobiliation d’un membre sur le SNC 20
Immobilisation de longue durée 21
Immobilisation de courte durée 24
III. Effets bilatéraux d’une immobilisation de courte durée 28
IV. Comment pallier les effets de l’immobilisation d’un membre 32 Chapitre 3 – Imagerie motrice et Exécution motrice : de fortes similitudes 36
I. Imagerie motrice : Définitions et fondements théoriques 36
Imagerie motrice explicite vs. implicite 36
La théorie cognitive de la simulation motrice 36
L’approche ‘’embodied’’ des processus d’imagerie motrice 37
II. Imagerie motrice implicite et plasticité cérébrale 39
Un exemple d’imagerie motrice implicite : le paradigme de rotation mentale 39
III. Imagerie motrice explicite et plasticité cérébrale 42
Imagerie motrice visuelle vs. kinesthésique 42
Pratique mentale et performance motrice 46
Chapitre 4 – Objectifs expérimentaux 50
P
ARTIE2 –
P
ARTIE EXPERIMENTALE 51Chapitre 5 – Axe théorique : Effet d’une immobilisation de courte durée sur
les représentations sensorimotrices 52
Publication 1 54
Publication 2 66
Publication 4 95
P
ARTIE3
–
D
ISCUSSION GENERALE118
Chapitre 7 – Bilan et perspectives 119
I. Immobilisation de courte durée et Représentations sensorimotrices 120
L’immobilisation de courte durée d’un membre affecte la capacité à se représenter
mentalement une action 120
Quelle est l’origine de la perturbation du SNC induite par la privation d’exercice ? 123
À quoi est dû le transfert intermanuel observé après 48 herues d’immobilisation 125
Immobilisaton de courte durée et qualité des représentations sensorimotrices 126
Pour conclure sur nos travaux…et ouvrir vers d’autres objectifs 128
Immobilisation de courte durée d’un membre…Quelles implications cliniques ? 131 II. Immobilisation de courte durée et Pratique mentale 134
La pratique mentale en imagerie kinesthésique permet de pallier les effets néfastes de l’immobilisation de courte durée de la main 134
Immobilisation d’un membre et Pratique mental : vers des perspectives de recherche
appliquée 135
B
IBLIOGRAPHIE137 ! ! ! ! !
P
REAMBULE
!
!!
Je me souviens très bien la 1ère fois où Lucette m’a parlé de mon sujet de thèse… « Tu sais Aurore, ma fille Léna s’est cassée le bras gauche en tombant d’un arbre il y a 2 ans. Elle a eu le bras platré et en écharpe pendant plusieurs semaines. Elle a parfaitement récupéré, mais depuis j’ai constaté qu’elle avait tendance à délaisser son bras, le gardant contre son ventre, comme lorsqu’il était en écharpe. Alors je lui dis souvent : Léna, tu as un bras gauche !! N’oublie pas… ». Puis elle a continué : « Je me dis que ça n’est pas anodin de ne pas pouvoir bouger son membre pendant plusieurs semaines pour le système sensorimoteur. Au-delà des effets périphériques sur le membre, par exemple la perte de masse musculaire, il doit aussi y avoir des répercussions fonctionnelles qui seraient liées à des changements au niveau central. Du coup, j’ai fait une recherche…et à ma grande surprise, j’ai trouvé uniquement deux articles montrant l’impact d’une immobilisation sur la performance motrice, et évoquant l’hypothèse d’un déficit central pour expliquer la perturbation. » Et elle me montre les articles d’Huber et al., (2006) et de Moisello et al. (2008). Elle m’explique rapidement leur contenu : « Par exemple dans Huber, les auteurs montrent qu’une immobilisation de 12 heures seulement suffit pour modifier la représentation cérébrale du membre. [… …] ». 12 heures seulement…! Puis elle termine : « Et moi, je me disais que l’imagerie motrice serait un bon moyen pour mettre en évidence les effets centraux de l’immobilisation de la main. Nous on utilise des tâches où… [… …] ».
J’ai trouvé ça génial comme idée… cette thématique réunissait des problématiques passionnantes : la plasticité cérébrale, l’imagerie motrice…et au delà de l’intérêt théorique de ce sujet, j’ai été séduite par les applications pratiques sur lesquelles il pouvait déboucher dans le domaine de la rééducation.
Au travers de ce travail, nous avons donc questionné le lien entre imagerie motrice et immobilisation de courte durée d’un membre, l’objectif principal étant de mettre en évidence
L’hypothèse était que l’immobilisation pourrait avoir l’effet inverse de l’apprentissage moteur. Dit un peu trivialement, quand le cerveau est stimulé, il se développe, et quand il n’est plus sollicité, il régresse. Une autre question nous tenait à cœur, bien qu’il ne s’agisse pas du cœur de ce travail : l’imagerie motrice pourrait-elle, dans le cadre d’une pratique mentale, contrecarrer les effets délètères induits par l’immobilisation du membre sur le SNC ?
Ce mémoire s’organise selon trois parties. La première partie, intitulée cadre théorique, comporte trois chapitres. Dans le premier chapitre, nous revenons sur l’approche cognitive de la motricité humaine. En effet, évoquer les mécanismes altérés par l’immobilisation d’un membre, ou encore, chercher à comprendre en quoi l’imagerie motrice est un bon moyen pour étudier l’impact de l’immobilisation sur le système sensorimoteur nous a amené à nous poser beaucoup de questions. À commencer par une en apparence toute simple : comment, finalement, le cerveau élabore et contrôle nos actions ? Puis d’autres…Qu’est ce qu’un ’’modèle interne’’ ? En quoi l’absence d’informations proprioceptives affecte le système sensorimoteur ? etc. Le chapitre 1 synthétise les réponses à toutes ces questions. Le second chapitre correspond à une revue de la littérature synthétisant les travaux sur l’immobilisation de courte durée d’un membre. Un dernier chapitre est consacré à la problématique de l’imagerie motrice, où nous faisons notamment la distinction entre imagerie implicite et explicite, pour illustrer leur rôle respectif dans l’évaluation du système sensorimoteur et les apprentissages sensorimoteurs.
Dans une seconde partie, nous présentons notre travail expérimental au travers de 4 publications. Ce travail se divise selon deux axes de recherche : le premier axe, dit ’’théorique’’ qui est le cœur de cette thèse et comporte 3 publications. Nous avons cherché à comprendre l’impact d’une immobilisation de courte durée du membre supérieur sur les représentations sensorimotrices au moyen d’une tâche d’imagerie motrice (tâche de jugement de latéralité manuelle). Dans ces études, différentes manipulations expérimentales ont été réalisées concernant l’immobilisation (durée, membre) et la tâche de jugement de latéralité manuelle (nature des stimuli, modalité de réponse, etc) Dans le second axe, dit ’’pratique’’, nous examinons les effets de la pratique en imagerie motrice explicite pour pallier les effets néfastes d’une immobilisation de courte durée du membre supérieur sur le fonctionnement du système sensorimoteur.
Dans la dernière partie, discussion générale, nous discutons les résultats obtenus à l’appui de la littérature de référence. Nous exposons également les perspectives de ces travaux.
!
!
!
!
!
!
!
P
ARTIE!
1!–
!
C
ADRE!THEORIQUE
!
! ! ! ! ! ! ! ! ! !C
HAPITRE!
1
!
–
!
L’
APPROCHE!COGNITIVE!DE!LA!MOTRICITE!HUMAINE
.!
I. Une!approche!représentationnelle!de!la!motricité!humaine.
!Selon l’approche cognitive de la motricité, les actions volontaires sont pilotées par le cerveau. Ce dernier est perçu comme un prédicteur sensorimoteur qui génère une commande motrice, l’envoie aux muscles (considérés comme de simples effecteurs) et en contrôle l’exécution. Autrement dit, avant d’être déclenchée, l’action sera mentalement représentée sous différents formats, selon un mode computationnel. Avec l’expérience le SNC mémorise des informations sur la biomécanique du corps, certains phénomènes physiques du monde extérieur (Jordan, 1996) et leurs interactions (Wolpert et Ghahramani, 2000). C’est à partir de ces connaissances intériorisées et des informations sensorielles sur l’état actuel du corps et de l’environnement qu’il effectue un certain nombre de calculs pour établir et/ou (ré)ajuster la commande motrice. La notion de représentations sensorimotrices se trouve donc au cœur des problématiques de recherche en psychologie de l’action.
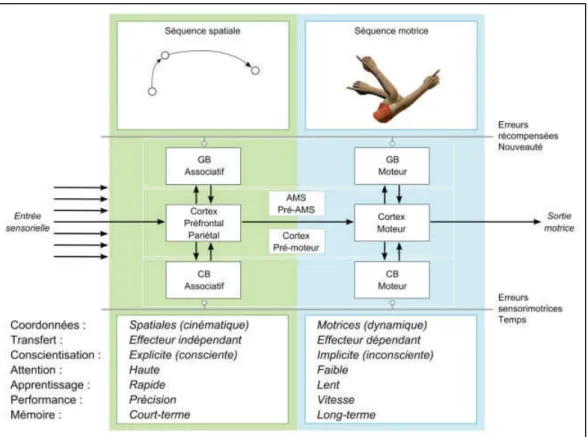
De façon générale, une représentation fait référence aux informations mémorisées non directement perceptibles. La représentation d’une action est sensorimotrice car elle se fonde sur des informations motrices (paramètres cinématiques et dynamiques inhérents au geste). Elle est aussi sensorielle car le cerveau mémorise des informations relatives aux conséquences que l’action produit sur le corps et l’environnement (informations visuelles, proprioceptives, vestibulaires, tactiles, auditives). Une représentation sensorimotrice est par nature multi-sensorielle puisque nos capteurs fonctionnent en synergie. Notons qu’on parle aussi de mémoire sensorimotrice notamment pour désigner un geste appris, c’est-à-dire fréquemment répété et stabilisé (Wolpert et al., 2011). Au cours des cinquante dernières années, de nombreuses études comportementales ont ainsi été menées pour définir précisément la nature et le contenu des différents formats de représentation d’une action et déterminer comment ces dernières se construisent et évoluent avec la pratique physique. Une autre question visait également à identifier les substrats neuronaux qui les sous-tendent. En d’autres termes, où peut-on localiser les représentations sensorimotrices dans le cerveau ? Parmi tous les travaux réalisés, on peut citer ceux d’Hikosaka et al. (2002). Ils ont proposé un modèle détaillé schématisant sur le plan comportemental et neurophysiologique l’apprentissage de séquences motrices (Figure 1).
Figure 1 : Représentation schématique de l’apprentissage de séquences motrices
– Extrait et traduit de Hikosaka et al. (2002).
Nous ne nous attarderons pas davantage sur ce modèle mais retiendrons simplement qu’il fait état de plusieurs niveaux de représentations sensorimotrices d’une action : un premier niveau plutôt abstrait où la représentation est indépendante de l’effecteur et encodée selon des informations de nature visuo-spatiale (cinématique du geste selon une trajectoire dessinée dans l’espace). Un second niveau où la représentation est incarnée (ou embodied en anglais), c’est-à-dire directement liée à un effecteur et définie à partir d’informations motrices (dynamique du geste en terme de muscles impliqués et forces générées). Dans les travaux réalisés pendant ma thèse, je me suis demandée, dans le cas où l’immobilisation de courte durée d’un membre affecte les représentations sensorimotrices, quel niveau serait affecté ? Les effets de la privation d’exercice sont-ils généraux (effector independent) ou spécifiques au membre immobilisé (effector dependent) ?
II. Informations!sensorielles,!Planification!et!Contrôle!des!actions.
! !Certains chercheurs se sont plus particulièrement intéressés au rôle et à la place des différentes modalités sensorielles dans l’élaboration d’une représentation sensorimotrice (planification) et/ou le contrôle du geste, notamment la vision et la proprioception (pour une revue, Sarlegna & Sainburg, 2009). Les systèmes sensoriels ont longtemps été étudiés de façon séparée avant qu’on prenne en compte le caractère multi-sensoriel de la motricité et qu’on cherche à comprendre leurs interactions. Les tous premiers travaux ont porté sur l’étude du rôle de la vision pendant le contrôle de mouvements de pointage (Woodworth, 1899). D’autres travaux suivront et permettront notamment de distinguer le rôle de la vision off-line (issue des essais antérieurs) vs. on-line (disponible pendant l’action), ou encore le rôle des informations visuelles statiques (position des effecteurs avant l’action, localisation spatiale de la cible à atteindre) vs. dynamiques (effecteurs en mouvement) lors de la planification et/ou du contrôle du mouvement (Bagesteiro et al. 2006; Brenner and Smeets, 2003; Desmurget et al. 1997; Elliott et al. 1991; Ghez et al. 1995; Paillard 1996; Prablanc et al. 1979a, 1979b; Proteau et al. 2000, 2009; Robin et al., 2004, 2005; Rossetti et al. 1995; Sarlegna et al. 2003, 2004 ; 2006 ; Vindras et al. 1998). Des travaux investiguant le rôle de la proprioception ont également été réalisés (Coello & Grealy, 1997; Cordo et al., 1995; Desmurget et al., 2000; Goodbody & Wolpert, 1999; Messier et al., 2003; Mott & Sherrington, 1895; Paillard & Brouchon, 1974; Pennel et al., 2003; Rossetti et al., 1995; Sainburg et al., 1993; 1995) et plus tardivement l’importance du système vestibulaire (Bisdorff et al., 1996; Bringoux et al., 2002, 2003, 2007; Bronstein, 1999; Brookes et al., 1993; Clark & Graybiel, 1963a; Kanayama et al., 1995).
Concernant la proprioception, par exemple, les recherches sur les personnes souffrant de désafférentation proprioceptive complète ont permis de mettre en évidence le rôle crucial des informations issues du corps propre pour planifier l’action et en contrôler le déroulement (Ghez et al., 1995; Gordon et al., 1995; Messier et al., 2003 ; Sainburg et al., 1993 ;1995; Sarlegna et al., 2006). Testées dans une tâche de pointage, ces personnes commettent des erreurs importantes dans l’amplitude et la direction de leur geste (Ghez et al. 1995; Gordon et al. 1995). Elles ne parviennent pas non plus à maintenir leur position à la fin du mouvement : leur main dérive alors qu’elles la croient stable.
!
La contribution des informationsproprioceptives afférentes pour programmer et contrôler le mouvement a également été mise en évidence chez des personnes saines. Des auteurs ont notamment montré le rôle de la proprioception dans la planification et la programmation de l’action (Desmurget et al., 2000; Goodbody & Wolpert, 1999; Messier et al., 2003; Rossetti et al., 1995). Au même titre que la vision, la proprioception permet de coder et localiser la position de la main avant l’initiation du mouvement. Dans le cas où la position initiale visible de la main est déviée juste avant le début du mouvement par le biais de prismes et qu’aucun contrôle visuel de la trajectoire n’est possible, l’erreur de pointage observée ne correspond qu’à 1/3 du déplacement visuel initial induit par les prismes (Rossetti et al., 1995). Ce biais partiel révèle l’importance du codage proprioceptif de la position de la main au départ, la proprioception ayant partiellement compensé la déviation prismatique. Une étude récente utilisant la technique de réalité virtuelle confirme la contribution mutuelle de la vision et la proprioception dans la planification d’un mouvement de pointage (Sarlegna et al., 2003). L’avantage de cette technique est qu’elle permet d’isoler les rôles respectifs de la vision dynamique et de la proprioception dans le contrôle du mouvement. Tout comme Hikosaka et al. (2002), les auteurs mentionnent deux niveaux de représentation d’une action. Durant la 1ère phase de planification, les propriétés cinématiques du geste seraient définies. Cette phase se ferait sur la base de la vision. Dans la seconde phase, le système s’appuierait sur les informations proprioceptives pour élaborer une représentation des propriétés dynamiques du bras et de la main.
!
Bien que présentant une infime partie de la littérature, ces expériences montrent la nécessité d’un couplage étroit des informations visuelles et proprioceptives, aboutissant à une représentation multisensorielle de l’action. Enfin, notons que l’élaboration d’une représentation sensorimotrice est spécifique des sources d’informations sensorielles présentes dans l’environnement, le système privilégiant notamment la modalité sensorielle considérée comme la plus fiable pendant la pratique (Fleishman & Rich, 1963; Gullaud & Vinter, 1998 ; Jeannerod, 1988; Proteau, 1992; Proteau & Carnahan, 2001; Redding et al., 2005; Robin et al., 2004, 2005; Schmidt & Lee, 2005; Toussaint & Blandin, 2010).
!
Autrement dit, si vous avez appris un geste sans la vision, vous serez peu (ou moins) efficace ensuite si vous le réalisez avec la vision. Il nous semblait important de souligner ce point car il s’avère crucial lorsqu’on effectue une pratique mentale. Nous y reviendrons dans le chapitre 3, consacré à l’imagerie motrice.III. Modèles!internes,!Planification!et!Contrôle!des!actions
!Un concept clé dans l’approche cognitive de la motricité est celui des modèles internes. Cette notion est ambiguë et porte un double sens. Lorsqu’il est employé au singulier, un modèle interne peut désigner la représentation d’un geste qu’on a appris. Pour reproduire le geste, le cerveau fait donc directement appel à ce modèle (ou mémoire) interne, ce qui simplifie l’élaboration de la commande motrice. Dans ce cas, on considèrera que modèle interne et représentation sont des synonymes. Au pluriel, les modèles internes renvoient à des structures ou des processus capables de simuler des comportements naturels. Autrement dit, les modèles internes seraient des ‘’constructeurs de représentations’’. Afin d’éviter toute confusion, nous retiendrons uniquement cette seconde définition : les modèles internes désignent les processus qui permettent d’élaborer les représentations sensorimotrices, ou plus simplement une action. D’après la définition de Wolpert et Ghahramani (2000), le terme modèle traduit donc l’idée que le cerveau reconstruit l’interaction des systèmes sensoriels et moteurs ainsi que leur interaction avec le monde physique. Le terme interne signifie que ces processus sont intériorisés par le SNC, et physiologiquement implémentés par des réseaux neuronaux plastiques qui s’actualisent par des phases d’apprentissage.
Introduit dès 1910 par Helmholtz (Von Helmholtz, 1910), l’existence des modèles internes dans le cerveau a longtemps fait débat au sein de la communauté scientifique avant que cette notion s’impose pour expliquer le fonctionnement du système sensorimoteur. En effet, les mouvements volontaires ont longtemps été considérés comme relevant de deux sous-systèmes distincts, avec d’un côté les mouvements balistiques (très rapides) qui ne peuvent être modifiés une fois déclenchés, et de l’autre, les mouvements conduits (lents) qui peuvent être contrôlés en cours d’exécution via les réafférences sensorielles (Woodworth, 1899; Keele, 1968; Schmidt et al., 1979). Cependant, cette vision se révélait incomplète car elle ne permettait pas d’expliquer la complexité du système sensorimoteur, qui comme tout système biomécanique possède une part inhérente de variabilité (bruit moteur), ni sa capacité à s’adapter à des perturbations environnementales lors de mouvements rapides (Goodale et al., 1986 ; Prablanc et Martin, 1992). Le concept de modèles internes fut alors introduit dans les modèles de planification et contrôle moteur, afin notamment d’expliquer ces ajustements très précoces (Wolpert et Gharamani, 2000; Wolpert et al., 1995 ; Desmurget and Grafton, 2000).
Il en existe deux types : le modèle interne inverse (ou contrôleur) et le modèle interne prédictif (ou modèle interne direct).
Le#modèle#interne#inverse.#
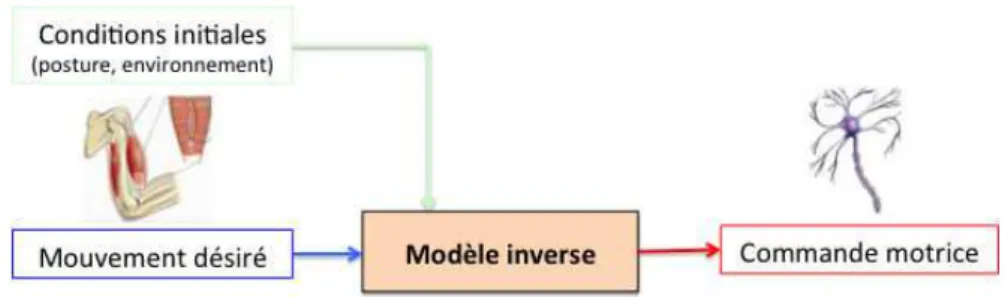
Le modèle inverse calcule la commande motrice à partir du mouvement souhaité (par ex., saisir un verre) et des conditions initiales (informations sur la cible, la posture du corps). Le terme inverse indique que la relation causale entre la commande motrice et le mouvement est inversée. En effet, habituellement, le cerveau envoie une commande motrice (entrée du système) et à la sortie on trouve les conséquences sensorielles de cette commande (action). Le modèle inverse fait le contraire, puisqu’il intègre en entrée l’ensemble des propriétés du système musculo-squelettique et environnementales et émet en sortie une estimation de la commande motrice en accord avec l’intention de l’action (Figures 2 et 4). Autrement dit, il modélise la relation entre les conséquences sensorielles attendues sur le corps et l’environnement, et l’action à réaliser pour les obtenir. Concrètement, pour saisir un verre, le modèle inverse peut utiliser en entrée la trajectoire de la main attendue afin de produire les commandes musculaires permettant au bras de réaliser la trajectoire souhaitée.
Figure 2 : Représentation schématique du modèle inverse
Au niveau comportemental, l’existence des modèles internes inverses est démontrée par exemple par Shadmehr et Mussa-Ivaldi (1994). Dans cette étude, les participants réalisent des mouvements du bras pour pointer une cible, mais ils sont soumis à un champ de force inhabituel. Dans un premier temps, les trajectoires de la main sont largement distordues et les erreurs spatiales finales sont élevées par rapport aux mouvements réalisés dans des conditions environnementales sans ces forces perturbatrices. Après quelques essais, les trajectoires redeviennent progressivement normales, c’est-à-dire rectilignes et avec de faibles erreurs
environnementales normales), les mouvements du bras sont à nouveau perturbés mais dans le sens opposé (effet-miroir) aux forces exercées précédemment.
Ce résultat est classique dans la littérature et a également été rapporté dans d’autres études utilisant un champ de force artificiel (Bhushan & Shadmehr, 1999; Hinder & Milner, 2003; Lackner & Dizio, 2005) mais aussi en situation de micro-gravité (Papaxanthis et al., 1998; Papaxanthis et al., 2005) ou en présence d’une déviation prismatique ou de la force de coriolis dans une pièce rotative (Lackner & Dizio, 1994, 1998). Ces perturbations en miroir peuvent s’expliquer par l’utilisation d’un modèle interne inverse de la dynamique du bras qui s’est adapté aux nouvelles contraintes dynamiques de l’environnement, dans le cas présent, le champ de force artificiel. Dans la condition normale, le modèle inverse estime la commande motrice appropriée qui anticipe et prédit la variabilité endogène du bras. Dans la condition où le champ de force est appliqué, il se retrouve face à des contraintes nouvelles, qu’il ne sait pas compenser, ce qui aboutit à une distorsion spatiale du mouvement de pointage. Durant les essais, le modèle s’adapte progressivement à ces nouvelles contraintes et génère des commandes prenant en compte le nouveau champ de force. Lorsqu’on stoppe brutalement le champ de force, le modèle inverse continue de générer les commandes intégrant les forces perturbatrices, qui ne sont donc plus adaptées aux conditions normales, ce qui produit des trajectoires distordues, cette fois, dans le sens opposé au champ de force artificiel.
Le#modèle#interne#prédictif.
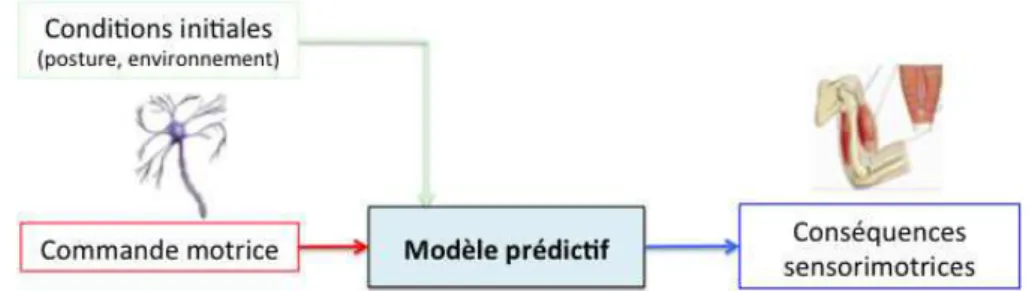
Le modèle prédictif est lui-même séparé en deux composantes : dynamiques et sensorielles. Ce modèle simule de façon anticipée les conséquences sensorielles (modèle prédictif sensoriel) et motrices (modèle prédictif dynamique) de la commande motrice. Pour cela, il utilise en entrée une copie de la commande motrice émise par le modèle inverse (copie d’efférence) et l’état présent du système et de l’environnement (Figures 3 et 4). Il intervient dès l’envoi de la commande motrice et est implémenté de façon récursive pendant le mouvement en parallèle du traitement des réafférences sensorielles réelles. Par exemple lors d’un mouvement du bras, le modèle prédictif dynamique de la mécanique du bras prédit l’évolution future du système (vitesses et positions à venir jusqu’à l’atteinte de la cible). Ces variables prédites permettent ensuite au modèle prédictif sensoriel d’estimer les conséquences sensorielles de ces états futurs (par exemple au niveau proprioceptif, le raccourcissement ou l’allongement des fibres musculaires). Il établit ainsi de façon anticipée la relation causale
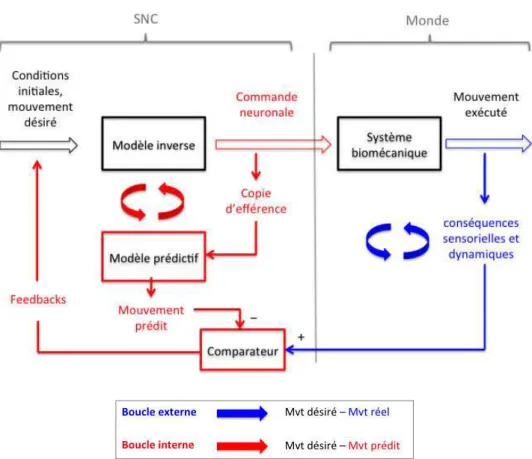
entre le déroulement du mouvement et ses conséquences sensorielles. S’il y a un écart entre les estimations faites par le modèle prédictif et le mouvement souhaité, le système pourra réajuster en temps réel la commande motrice. Cette capacité d’anticipation de l’état sensori-moteur futur du système est particulièrement intéressante car elle permet notamment de compenser les délais de traitement (mesure, conduction, intégration) des conséquences sensorielles réelles du mouvement (boucle externe sur la Figure 4) et donc d’expliquer les ajustements très précoces réalisés par le système, même sur des mouvements rapides.
Figure 3 : Représentation schématique du modèle prédictif.
Au niveau comportemental, les preuves expérimentales sur l’existence des modèles prédictif sont nombreuses (voir pour revue Miall & Wolpert, 1996). La prédiction sensori- motrice peut être généralisée pour de nombreux systèmes effecteurs. Par exemple, l’utilisation d’un modèle interne prédictif a été démontrée dans les mouvements de poursuite d’une cible (Vercher et al., 2003). Les auteurs montrent qu’un modèle prédictif est utilisé par l’œil pour prédire les mouvements de la main, permettant ainsi une bonne coordination entre l’œil et la main.
L’existence des modèles internes prédictifs a également été montrée lors de la manipulation manuelle d’objets (Augurelle et al., 2003; Flanagan et Wing, 1993, 1997). Classiquement, les auteurs montrent que le SNC utilise un modèle interne pour réguler correctement la force de préhension du bras en fonction de la charge de l’objet. Concrètement, lorsqu’on tient un objet, la force exercée sur l’objet surpasse légèrement la charge de l’objet afin qu’il ne tombe pas. Cette force de préhension est prédictive dans le sens où elle anticipe toutes modifications de la charge de l’objet lors de son déplacement, permettant ainsi au cerveau d’ajuster la force de préhension pendant le déplacement de l’objet, et ce, même en l’absence des informations sensorielles tactiles (Kawato, 1999; Thonnard et al., 1999).
Figure 4 : Représentation schématique de l’utilisation des modèles internes durant un
mouvement – Extrait de Lebon et al. (2013).
Évolution#des#modèles#internes#avec#la#pratique.
En théorie, les modèles internes apparaissent comme des processus ’’magiques’’, permettant ainsi une optimisation parfaite des gestes. Cela semble vrai pour les experts dont la fluidité et l’impression de facilité témoignent de la maitrise quasi parfaite de leurs actions. Ça l’est beaucoup moins pour un débutant, dont les performances sont plutôt caractérisées par une maladresse et une lenteur gestuelle. Ainsi, l’acquisition d’une habileté motrice peut s’expliquer par une amélioration des modèles internes. Au départ, le modèle est imprécis et peu efficace pour compenser des perturbations externes. Le système est alors fortement dépendant des réafférences sensorielles (boucle externe). Avec la répétition de l’action, les modèles internes s’affinent, les représentations sensorimotrices produites deviennent de plus en plus précises et fines, on devient de moins en moins dépendant des rétroactions
sensorielles, même si ce mode de contrôle reste néanmoins utile au système, notamment pour assurer la précision terminale des gestes.
En outre, le modèle prédictif jouerait un rôle primordial dans le développement des représentations sensorimotrices, s’adaptant plus rapidement que le modèle inverse à un environnement nouveau. Flanagan et collaborateurs (2003) l’ont joliment démontré dans une étude utilisant une tâche de manipulation d’un objet durant laquelle le mouvement du bras des participants était soumis à des forces perturbatrices. Les auteurs ont évalué la capacité des sujets à contrôler leurs actions dans ce nouvel environnement, ainsi que leur aptitude à prédire les conséquences de leurs actions sur l’objet manipulé. Les résultats indiquent que la prédiction de l’action sur l’objet est apprise beaucoup plus précocement que le contrôle de la dynamique du bras. Les auteurs suggèrent donc que les sujets ont d’abord appris à prédire les conséquences du geste avant d’apprendre à le contrôler. En fait, en situation d’apprentissage, le modèle prédictif serait utilisé pour entrainer le modèle inverse afin d’obtenir une commande motrice adéquate et un contrôle fin du geste.
Localisation#potentielle#des#modèles#internes#dans#le#cerveau.#
Les travaux concernant les sites neurophysiologiques des modèles internes mettent en évidence l’activation de nombreuses régions cérébrales, dont deux principalement : le cervelet et le cortex pariétal (Blakemore et Sirigu, 2003). Des travaux en neuroimagerie indiquent que le cervelet effectue des opérations caractéristiques des modèles inverses et prédictifs (Blakemore et al., 1998; Imamizu et Kawato, 2008). Les données neurophysiologiques et comportementales chez des sujets sains et cérébrolésés indiqueraient également que les modèles internes sont localisés dans le cervelet. Par exemple, les cellules de Purkinje émettent des décharges complexes lorsqu’elles reçoivent des conséquences sensorielles imprévues (Kawato, 1999 ; Ito, 2008). Ces décharges spécifiques pourraient être à l’origine du signal d’erreur sensori-motrice, témoignant ainsi de l’activité de modèles internes. Cette hypothèse s’est confirmée par des études chez des patients cérébelleux qui présentaient des difficultés à prédire les conséquences de l’action (Blakemore et al., 1998; Chen et al., 2006).
Certaines données attestent également de l’élaboration de prédictions sensorimotrices dans le cortex pariétal. Par exemple, Wolpert et collaborateurs rapportent des troubles assez étranges chez une patiente souffrant d’une lésion pariétale. Cette dame ressentait bien un objet
complètement au bout de quelques secondes. En l’absence de la vision, elle ne détectait donc plus l’objet. Par contre, dès qu’on retirait l’objet de sa main, elle en détectait à nouveau la présence. De plus, elle n’arrivait pas à maintenir constante une force de préhension sans la vision (Wolpert et al., 1998). Selon les auteurs, ces altérations motrices reflèteraient l’incapacité du système à maintenir des représentations internes de l’état du corps et indiquerait donc la présence de modèles internes prédictifs dans le cortex pariétal.
En résumé…
Pour conclure sur ce chapitre, selon l’approche cognitive de la motricité, nos actions sont d’abord des ‘’représentations’’ construites par le cerveau sur la base d’informations qu’il possède en mémoire ou qu’il capte dans l’environnement. Le concept de modèle interne offre une base théorique intéressante pour expliquer comment les représentations sont formées et peuvent évoluer avec la pratique pour optimiser la performance motrice. Les études en apprentissage moteur ont ainsi permis de mieux comprendre le fonctionnement du système sensorimoteur, expliquant comment l’action est représentée et contrôlée par le système (modèles internes). Les chercheurs ont également apporté des données sur le contenu de ces représentations, et comment elles pouvaient évoluer au fil des expériences corporelles des individus. Dans ce travail de thèse, nous nous sommes également intéressés à la plasticité des représentations sensorimotrices et des processus qui les sous-tendent, en prenant le contre-pied de l’apprentissage moteur, c’est-à-dire dans le cas d’une immobilisation d’un membre ou restriction sensorimotrice. Les processus sensorimoteurs s’adaptent–ils tout autant à une diminution soudaine du niveau de sollicitation du système, comme c’est le cas lors d’une sollicitation accrue (apprentissage) ? Nos représentations sensorimotrices sont-elles sensibles au point d’être perturbées par l’immobilisation temporaire d’un membre ? Parce qu’elle permet spécifiquement d’évaluer les représentations sensorimotrices, nous avons choisi d’étudier l’impact d’une immobilisation de courte durée chez des participants sains dans une tâche d’imagerie motrice implicite. Le choix d’utiliser l’imagerie motrice est justifié dans le chapitre 3, consacré à cette problématique. Mais avant cela, nous faisons un état de l’art sur la question des effets centraux de l’immobilisation d’un membre dans le chapitre suivant.
C
HAPITRE!
2
!
–
!
E
XPERIENCE!
C
ORPORELLE!ET!
P
LASTICITE!CEREBRALE
.!
!
I. Concept!de!«!Plasticité!cérébrale!»!:!Introduction!et!Définition.
! !Notre cerveau (ou Système Nerveux Central- SNC) n’est pas une matière figée. Bien au contraire, il subit un perpétuel remaniement. Cette faculté de plasticité, parfois étonnante, lui est inhérente et se trouve à la base des processus d’apprentissage et de mémorisation. Ce phénomène est appréhendé à différents niveaux, et de nombreux travaux, issus de différents champs scientifiques en neurosciences, ont permis des avancées importantes dans la compréhension des mécanismes impliqués. Par exemple, au niveau moléculaire, on s’intéresse aux changements intervenant dans l’expression de neurotransmetteurs, tandis qu’au niveau cellulaire, l’intérêt est porté aux assemblages et connexions synaptiques. Au niveau neuro-anatomique, on cherche à mesurer les modifications structurelles (changement de l’activité cérébrale). Enfin, au niveau comportemental, où on s’intéresse au fonctionnement du SNC, on cherche à identifier les changements de stratégie et de performance. De part notre domaine de recherche, nous nous intéressons plus particulièrement à la littérature portant sur le niveau neuro-anatomique et surtout comportemental.
Dans le domaine de la motricité, la plasticité dépendante de l’usage d’un membre, ou plus généralement de notre activité (‘use-dependent’ ou ‘activity-dependent’ plasticity) désigne les changements cérébraux se produisant en fonction de nos expériences corporelles, c’est-à-dire en termes plus ‘’expérimentaux’’, en fonction du niveau de sollicitation sensoriel et moteur. Cette forme de plasticité est différente de celles liées au développement ou à des lésions cérébrales (plasticité post-lésionnelle ou pathologique dans le cas d’une maladie neuro-dégénérative). Parmi les situations sensorimotrices (excès ou carences) les plus étudiées, on retrouve la pratique motrice (e.g. pratique du piano ou lecture du braille, Pascual-Leone et al., 2005), la privation sensorielle (e.g. visuelle : paradigme des yeux bandés, Pascual-Leone et al., 2005, ou sensitive : désafférentation, Rossini et al., 1996 chez l’humain ; Calford & Tweedale, 1991c, 1988 chez l’animal) et/ou motrice (amputation, Chen et al., 2002 chez l’humain; Florence & Kaas, 1995 chez le singe). De façon générale, une augmentation du niveau de sollicitations sensorimotrices se traduit par une augmentation des
al.,1995). A l’inverse, la restriction ou privation sensorimotrice entraîne une diminution des représentations cérébrales des muscles « déconnectés », ces régions étant alors ‘’grignotées’’ par les représentations des membres adjacents et/ou proximaux. (Elbert et al., 1997). En outre, bien qu’elles soient le plus souvent adaptatives (positives), certaines situations entraînent parfois des changements maladaptatifs (négatifs). Par exemple, l’amputation peut s’accompagner de douleurs ‘’fantômes’’ (Flor et al., 2006 ;Ramachandran & Ramachandran, 2000). D’autres montrent qu’un entraînement intensif peut conduire à une dystonie focale, bien connue chez l’écrivain ou le musicien - on parle aussi de crampe de l’écrivain ou du musicien (Pascual-Leone & al., 2005 ;Konczak & Abbruzzese, 2013).
Parmi toutes les situations énoncées, celle concernant l’apprentissage moteur (ou pratique physique) est sans doute l’une des plus connues et documentées. On connaît bien les modifications cérébrales qui accompagnent l’amélioration du comportement suite à un entraînement physique (chez l’animal : Nudo et al., 1996; chez l’humain : Doyon et al., 2011; Doyon & Ungerleider, 2002), ou bien selon une approche cognitive, les effets de la pratique physique sur le développement des représentations sensorimotrices et l’amélioration de la performance qui en découle (Hikosaka et al., 1995 chez le singe; chez l’humain : Wolpert et Kawato, 1998; Bapi et al., 2000, Hikosaka et al., 2002; Wrong et al., 2011). En revanche, la littérature est beaucoup moins abondante concernant la situation inverse, c’est- à-dire dans le cas de l’inactivité physique ou l’immobilisation du membre. Les travaux scientifiques se sont largement centrés sur ses effets musculaires, délaissant la question de son impact fonctionnel et structurel. Une immobilisation de plusieurs semaines entraîne une diminution de la force maximale et une plus grande fatigabilité du muscle, résultant d’une atrophie musculaire (Adams et al., 1994; Bodine, 2013 ; Duchâteau & Hainaut, 1990; Caiozzo, 2002; Hortobagyi et al., 2000) et/ou de changements neuronaux (diminution de la transmission du signal le long des voies spinales, Lundbye-Jensen & Bo Nielsen, 2008; Seki et al., 2001ab; Seki et al., 2007). Par contre, qu’en est-il de l’efficience motrice ? Porter une attelle pendant plusieurs jours ou semaines altère t-il notre locomotion ou notre dextérité manuelle en fonction du membre immobilisé (la jambe ou le bras, respectivement) ? Dans ce cas, quelle serait l’origine des altérations comportementales observées ? Au-delà du déficit de force, il nous semble aussi important de connaître plus largement les conséquences fonctionnelles de l’inactivité physique et donc de s’interroger sur l’origine centrale de ces déficits.
Dans ce travail de thèse, nous nous sommes plus particulièrement intéressés à l’impact d’une période d’immobilisation d’un membre sur les processus cognitifs qui sous-tendent l’action volontaire. Outre son intérêt théorique, les questions abordées pourraient intéresser le domaine de la rééducation, les thérapeutes étant quotidiennement confrontés au phénomène d’immobilisation : blessures et interventions post-opératoires, thérapie motrice par contrainte induite (TMCI) chez des patients hémiplégiques, ’’décubitus’’ (ou ‘’bed-rest’’), patients souffrant de troubles sensorimoteurs aigüs les amenant à délaisser le membre atteint (e.g. parkinsoniens) etc. Si leur travail consiste à lutter contre la perte de masse musculaire des patients, il passe aussi par la restauration et l’entretien des aptitudes motrices.
II. Effets!de!l’Immobilisation!d’un!membre!sur!le!SNC.!
!L’immobilisation d’un membre se traduit par une restriction des mouvements volontaires, ce qui équivaut à une ’’restriction sensorimotrice’’. Le cerveau ou SNC ne reçoit plus ou très peu d’informations sensorielles (proprioceptives mais aussi tactiles et visuelles) (afférences ou ‘’input’’) et il n’est plus sollicité pour envoyer des commandes motrices (efférences ou ‘’output’’).
Immobilisation#de#longue#durée.## #
Immobilisation de longue durée et TMS. Chez l’humain,!les premières études sur les effets centraux de l’immobilisation d’un membre ont été réalisées avec des patients immobilisés pendant plusieurs semaines suite à une fracture (Liepert et al., 1995; Zanette et al., 1997; Kaneko et al., 2003; Zanette et al., 2004). Toutes ont recours à la stimulation magnétique transcranienne (TMS selon l’abréviation anglaise), technique non-invasive permettant entre autres : (1) de tester le niveau d’excitabilité des voies corticospinales provenant du cortex moteur primaire et se connectant aux motoneurones (au niveau de la moelle épinière) innervant les muscles périphériques, et (2) de réaliser une cartographie motrice (localiser la surface, la densité et le volume des neurones connectés à un muscle). Rappelons que cette technique consiste à appliquer une impulsion magnétique à travers le crâne (ciblant le cortex moteur primaire) de façon indolore au moyen d’une bobine, activant ainsi les neurones ’’touchés’’ par la stimulation. L’expérimentateur recueille la réponse
d’une électromyographie de surface (EMG). Dans le cas de l’immobilisation, la TMS était réalisée juste après le retrait du plâtre (test) puis plusieurs jours voire semaines après le retrait du plâtre (re-test). Les chercheurs ont recueilli les PMé sur les muscles du membre immobilisé et ceux du membre non-immobilisé ainsi que sur un groupe contrôle (sujets sains non immobilisés).
Ces études obtiennent des résultats contradictoires, ces derniers pouvant s’expliquer par des protocoles expérimentaux variables d’une étude à l’autre. On observe des différences de protocoles d’immobilisation (durée, procédure et partie du corps immobilisée), de participants (nature de la blessure, avec ou sans douleur) ou encore de mesures (paramètres recueillis, conditions de mesure : au repos, contraction, intensité de la stimulation). Pour autant, ces études s’accordent sur deux points : (1) l’inactivité physique induit une réorganisation de l’activité cérébrale, comme l’indiquent les résultats différents entre les mesures recueillies sur le membre immobilisé par rapport au membre libre et au groupe contrôle, alors que le niveau d’excitabilité spinale reste constant. Les changements de réponses EMG suite à la TMS seraient donc attribuables à des changements corticaux. (2) Ces changements sont réversibles puisqu’il n’y a plus de différence entre les groupes lors du re-test.
Parmi ces résultats contradictoires, on mentionnera tout d’abord ceux de Liepert et al. (1995) qui rapportent une diminution de la surface corticale représentant le membre immobilisé (plâtre à une jambe pendant 4 à 6 semaines). Se référant notamment à l’étude de Pascual-Leone & Torres (1993) chez des personnes aveugles lisant le braille, les auteurs suggèrent que l’immobilisation induirait l’effet inverse de la pratique physique entraînant une réduction des représentations corticales. Tout comme les modifications aux niveaux musculaire et spinal, ces changements centraux seraient à l’origine de la diminution de la production de force musculaire. Kaneko et collaborateurs (2003) obtiennent également une diminution de l’excitabilité corticale chez des patients ayant porté un plâtre au bras pendant 3 à 6 semaines. Ils observent une diminution de l’amplitude des PMé recueillis lors d’une contraction volontaire sur les muscles immobilisés par rapport aux mesures effectuées sur le groupe contrôle (non-immobilisé) et lors du re-test chez les patients préalablement immobilisés (2 mois après le retrait du plâtre).
En revanche, Zanette et al. (1997) rapportent une hyperexcitabilité corticale (augmentation du volume des aires cérébrales représentant les muscles immobilisés, la surface restant inchangée) chez des patients dont le bras était immobilisé 4 semaines suite à une fracture du poignet. Les auteurs invoquent un déséquilibre des circuits inhibiteurs intracorticaux correspondant aux muscles du membre immobilisé, les interneurones des muscles proximaux n’agissant plus sur les muscles distaux et réciproquement. Cette hypothèse semble confirmée par Zanette et al. (2004). Ces auteurs ont également utilisé la TMS juste après le retrait du plâtre sur 9 patients immobilisés pendant 4 à 6 semaines du bras gauche suite à une fracture du poignet. En plus des paramètres enregistrés dans leur étude précédente (cartographie motrice et courbe de recrutement représentée par l’amplitude des PMé en fonction de stimulations d’intensité croissante ; Zanette et al., 1997), ils ont recueilli les réponses motrices consécutives à une double stimulation (variation de l’intervalle inter-stimuli), obtenant ainsi les données reflétant l’inhibition et la facilitation intracorticales. Les résultats indiquent une diminution de l’inhibition intracorticale des circuits du membre immobilisé et une hyperexcitabilité corticale dans le cortex controlatéral au membre immobilisé (augmentation du volume cortical), ce dernier résultat pouvant être la conséquence du précédent. Les auteurs énoncent cependant la difficulté d’interpréter la courbe de recrutement, l’amplitude des PMé pouvant être modulée par des facteurs d’origine spinale et périphérique. Par exemple, la libération de réflexes excitateurs contrôlés au niveau de la moelle épinière viendrait parasiter la mesure des mécanismes intra-corticaux (Hess et al., 1987). L’augmentation brusque des afférences sensorielles (le membre venait juste d’être libéré de son plâtre) pourrait aussi expliquer l’augmentation de l’excitabilité corticale, celles-ci jouant également un rôle sur l’excelles-citabilité motrice (Ridding et al., 2001). Enfin, les auteurs évoquent la possibilité que l’hyperexcitabilité corticale soit une réaction liée à la douleur consécutive à la blessure (Birbaumer et al., 1997 ; Flor et al., 1995).
Par la suite, cette hypothèse sur la présence ou non de douleurs est plusieurs fois mentionnée pour expliquer les résultats contradictoires des études testant l’impact de l’immobilisation d’un membre sur le fonctionnement du SNC chez de patients plâtrés (Clark et al., 2008 ; Facchini et al., 2002 ). Plus récemment, d’autres études en TMS ont été conduites chez des personnes qui ne souffraient d’aucune fracture, dont on immobilisait un membre parfaitement sain pendant une à trois semaines (Robert et al., 2007 ; Clark et al.,
certains résultats obtenus sur des patients immobilisés, cependant leur retombée est limitée. Les résultats sont tout autant variables d’une étude à l’autre, les auteurs ayant du mal à expliquer ces incohérences, les attribuant à des périodes et des procédures d’immobilisation différentes et surtout à des conditions de mesure non identiques. En outre, la difficulté d’interprétation des PMé est encore une fois invoquée, les changements corticaux ne pouvant pas être isolés de l’influence des niveaux inférieurs.
Immobilisation de longue durée et IRMf. Nous terminerons par deux études récentes, réalisées chez des patients immobilisés plusieurs semaines des suites d’une fracture, mais ayant eu recours à l’imagerie par résonnance magnétique (IRM) (Lissek et al., 2009 ; Langer et al., 2012). Contrairement aux études utilisant la TMS, ces deux études obtiennent des résultats concordants.
Lissek et collaborateurs (2009) ont d’abord démontré les répercussions de l’immobilisation sur les fonctions perceptives. Ils ont évalué l’acuité tactile de 31 patients immobilisés d’un bras des suites d’une fracture (en moyenne depuis 22 jours) et sur 36 participants sains, à partir du test de Weber. Ce test mesure le seuil de discrimination tactile du doigt. On applique 2 pointes simultanément sur le bout de l’index (au minimum 5mm), le patient doit dire s’il perçoit une ou deux pointes. Le seuil de discrimination tactile correspond à la plus petite distance entre 2 pointes, localisées et perçues séparément. Les tests étaient refaits 18 jours en moyenne après le retrait du plâtre (retest). Les sujets contrôle ne montrent pas de différence entre le seuil des deux mesures, contrairement aux patients plâtrés qui obtiennent des seuils plus élevés pour l’index immobilisé. Lors du retest, les seuils de l’index immobilisé étaient revenus au même niveau que ceux du doigt non-immobilisé et identique aux valeurs du groupe contrôle. Les auteurs ont également évalué les changements neuronaux qui pourraient être associés à cette perte fonctionnelle. Ils ont mesuré l’activité de la région représentant l’index dans le cortex somatosensoriel via l’utilisation de l’IRM fonctionnelle (IRMf) chez 12 patients après 22 jours d’immobilisation et 2 semaines après le retrait du plâtre. L’IRMf se fonde sur l’observation en temps réel des variations régionales de volume, de débit et d’oxygénation du sang, permettant ainsi de « tracer » la consommation en oxygène par les neurones, autrement dit, de détecter une zone cérébrale activée. Les mesures révèlent une diminution de l’activité cérébrale dans la région représentant le doigt immobilisé par rapport au doigt non-immobilisé. La seconde session d’imagerie ne montre aucune différence d’activité cérébrale entre les 2 doigts. Des analyses de corrélation sont effectuées entre la
durée d’immobilisation et les données d’imagerie et entre les données comportementales et cérébrales. Elles révèlent que plus la durée d’immobilisation est grande, plus la diminution de la représentation somatosensorielle de l’index immobilisé est importante. De même, plus le seuil de discrimination tactile augmente, plus la réduction de l’activité corticale est importante.
Les répercussions de l’immobilisation sur le fonctionnement cortical ont également été illustrées par Langer et al. (2012) sur 10 sujets droitiers, blessés au membre supérieur droit et immobilisés au moins 14 jours. Ils ont eu recours à l’imagerie de tenseur de diffusion qui permet d’étudier in vivo, l’architecture des fibres nerveuses de la substance blanche (paramètres recueillis : tractographie de fibre et fraction d’anisotropie) dans le cortex sensorimoteur. Cette technique repose sur la détection des mouvements des molécules d’eau dans les fibres nerveuses. En outre, les auteurs réalisent une IRM en 3D pour avoir la morphométrie du cerveau, obtenant ainsi des mesures sur l’épaisseur corticale. Ce paramètre reflète la densité de la matière grise du cortex, une diminution indiquerait une arborisation neuronale moins importante. Les mesures révèlent une diminution de la fraction d’anisotropie et de l’épaisseur corticale représentant la main immobilisée.
Ces derniers travaux apportent un éclairage intéressant sur les effets de l’immobilisation d’un membre. Ils établissent un lien entre changements cérébraux et conséquences fonctionnelles, autre que la production de force. Cependant, comme cela a souvent été relevé, l’étude des effets de l’inactivité physique chez des patients blessés et sur des périodes d’immobilisation de plusieurs semaines présente des limites. C’est donc tout naturellement que les travaux « glissent » vers des protocoles plus pertinents, testant les effets de périodes d’immobilisation beaucoup plus courtes sur des personnes saines. Comme nous allons le voir dans la partie suivante, celles-ci semblent plus judicieuses pour appréhender le phénomène d’immobilisation et notamment comprendre son impact sur la plasticité cérébrale.
#
Immobilisation#de#courte#durée#
Compte tenu des limites que présentent les études sur des patients plâtrés, les chercheurs simplifient les protocoles expérimentaux afin de mieux isoler et mettre en évidence les effets centraux propres à l’immobilisation du membre. L’étude de Facchini et collaborateurs (2002) marque ce tournant dans l’approche du phénomène d’immobilisation.
les auteurs ont testé l’excitabilité cortico-spinale via la TMS sur des sujets sains, immobilisés de 2 doigts de la main gauche (non-dominante) pendant 4 jours. Les résultats indiquent clairement une diminution de l’excitabilité corticale sans altérer les niveaux spinal et musculaire. Ainsi, une immobilisation de courte durée pourra être définie comme une restriction sensorimotrice ne dépassant pas quelques jours et affectant uniquement le niveau central du système nerveux. Notons également que la diminution de l’excitabilité corticale suite à une immobilisation de la main sur une période de 4 jours a été récemment répliquée (Ngomo et al., 2012).
Les données au niveau neuro-anatomique…
Roll et collaborateurs (2012) ont évalué l’impact du port d’une prothèse immobilisant la main droite de sujets sains pendant une semaine sur la plasticité cérébrale, via l’utilisation de l’IRMf. Cette étude est intéressante car, à notre connaissance, il s’agit de la seule étude en IRMf qui montre les effets de l’immobilisation d’un membre sur l’ensemble des régions cérébrales impliquées dans une action, et pas uniquement sur le cortex moteur et/ou somatosensoriel primaire. Les auteurs ont scanné le cerveau des participants pendant qu’ils réalisaient des mouvements de flexion/extension du poignet avant et juste après l’immobilisation du membre. Les résultats révèlent des changements sur les régions corticales activées pendant le mouvement, à savoir : dans l’hémisphère controlatéral à la main immobilisée, le cortex sensorimoteur primaire, le cortex prémoteur dorsal, le lobe pariétal inférieur, et, de façon bilatérale, l’aire motrice supplémentaire. Outre les régions sensorimotrices primaires directement connectées au corps, la perturbation périphérique induirait également des changements sur les régions motrices voisines de ces dernières. Ainsi, ces résultats révèlent que l’absence de mouvement ralentirait le fonctionnement de l’ensemble du système sensorimoteur.
Une étude inédite utilisant la technique de l’électroencéphalographie quantitative (EEGq) a également montré que l’immobilisation de courte durée d’un membre affectait non seulement les régions sensorimotrices représentant les membres, mais également les cortex prémoteur et préfrontal impliqués dans la planification/programmation du mouvement ainsi que le cortex pariétal, siège des processus d’intégration sensorimotrice (Fortuna et al., 2013). L’EEGq est une méthode souvent utilisée en milieu clinique. Elle permet de mesurer l’activité neuroélectrique pendant la réalisation d’une tâche, et plus particulièrement d’obtenir une
cartographie spatio-fréquentielle du cerveau. Concrètement, on place des électrodes sur l’ensemble du scalp d’un individu (généralement une vingtaine) afin de recueillir l’activité oscillatoire du cerveau sur différentes bandes de fréquence. On distingue 5 bandes de fréquence correspondant à des rythmes différents (béta, théta, delta, alpha, gamma). Dans cette étude, les auteurs ont analysé la bande de fréquence béta (bien connue pour être liée aux processus sensorimoteurs) avant et après 2 jours d’immobilisation de la main droite sur quinze sujets sains. Les résultats révèlent un changement de l’activité de l’ensemble du système sensorimoteur (cortex sensorimoteur primaire, régions pariétal et prémotrice) suite à la restriction sensorimotrice.
Les données comportementales...
D’autres chercheurs ont testé des périodes encore plus courtes, se questionnant sur la durée de restriction sensorimotrice nécessaire pour observer des changements dans le fonctionnement du SNC (Huber et al., 2006; Moisello et al., 2008) :
Huber et al. (2006) ont immobilisé la main gauche de personnes droitières pendant 12 heures. Ils montrent une diminution de l’excitabilité des zones corticales représentant le membre immobilisé. Ils ont également évalué la performance des participants dans une tâche de pointage de cible afin de voir si les changements cérébraux s’accompagnaient d’une détérioration de la performance motrice. Les résultats indiquent une altération de la coordination motrice, les sujets étant moins précis pour pointer les cibles après l’immobilisation de la main (voir aussi Moisello et al., 2008 pour des résultats similaires). Ce déficit fonctionnel est corrélé à la diminution de l’activité somatosensorielle, ce qui laisse supposer qu’il serait d’origine centrale, et en particulier lié à un déficit du traitement des informations proprioceptives dynamiques. Ce changement pourrait avoir altéré les voies de traitement et d’intégration de ces informations, celles-ci jouant un rôle majeur dans la planification et le contrôle des mouvements (voir chapitre suivant, paragraphe sur le rôle des informations sensorielles dans la planification et le contrôle des actions). Par conséquent, un dysfonctionnement dans le traitement de ces signaux pourrait être à l’origine de la maladresse observée sur les mouvements de pointage après immobilisation. Les auteurs soulignent d’ailleurs la ressemblance des résultats avec ceux observés dans une tâche similaire chez des patients désafférentés (Sainburg et al., 1995).
Selon Moisello et collaborateurs (2008), la diminution soudaine des afférences proprioceptives pendant 12 heures pourrait aussi avoir directement impacté les processus de planification et de contrôle de l’action, c’est-à-dire les « modèles internes » qui permettent au système de se représenter une action ainsi que ses conséquences sensorielles (Wolpert & Kawato, 2008 ; Elliott et al., 2010, voir chapitre suivant sur les modèles internes). Cette hypothèse est plausible si l’on se réfère aux données neurophysiologiques précédemment citées (Fortuna et al., 2013; Roll et al., 2012). Notons que Moisello et al. (2008) ont également montré que la performance motrice n’était pas affectée après seulement 6 heures d’immobilisation du membre. Il faudrait donc au minimum 10 heures d’immobilisation pour observer des modifications cérébrales (Avanzino et al., 2011) et comportementales (Bassolino et al., 2012).
Deux autres études comportementales ont investigué plus spécifiquement l’impact fonctionnel d’une immobilisation de courte durée de la main (Bassolino et al., 2012 ; Bolzoni et al., 2012) :
Bolzoni et al. (2012) ont mis en évidence les effets d’une immobilisation de 12 heures de la main et du poignet droit sur le contrôle postural de l’épaule et du bras, et en particulier les processus d’ajustement posturaux anticipés. Pour cela, les auteurs ont enregistré l’activité des muscles du bras et de l’index impliqués dans la réalisation d’un mouvement de flexion de l’index, avant (pré-test) et après (post-test) la période d’immobilisation. Afin d’évaluer le contrôle postural, les expérimentateurs ont appliqué un goniomètre sur le coude et l’épaule des sujets, cet appareil permettant de mesurer les déplacements angulaires au niveau d’une articulation. Les auteurs rapportent que l’activité des muscles « fixateurs » du mouvement est altérée après les 12 heures d’immobilisation, induisant une moins bonne stabilisation du coude et de l’épaule pendant le mouvement.
Bassolino et collaborateurs (2012) ont, quant à eux, examiné l’impact fonctionnel de l’immobilisation sur la cinématique d’un geste de saisie d’objet. Dans cette étude, les sujets avaient la main droite immobilisée pendant 10 heures par un bandage adhésif. Ils avaient également le bras placé dans une écharpe orthopédique. La tâche de saisie se déroulait de la façon suivante : les sujets étaient assis à une table, l’expérimentateur plaçait devant eux un crayon, toujours au même endroit. Ils devaient le saisir, sans aucune contrainte de temps, commençant et finissant le mouvement par la même position des doigts ‘’en pince’’. Après 15