Étude de l’influence des neurones sensoriels dans deux
mécanismes de l’inflammation neurogène :
l’angiogenèse et la réépithélialisation en condition
glyquée.
Mémoire
Lorène Mottier
Maîtrise en biologie cellulaire et moléculaire
Maître ès sciences (M.Sc.)
Québec, Canada
© Lorène Mottier, 2014
III
Résumé
L’inflammation neurogène est un processus inflammatoire induisant la libération de neuropeptides, en particulier la Substance P et le Calcitonin Gene-Related Peptide (CGRP), par les neurones sensoriels. Lors de ce processus, l’angiogenèse et la réépithélialisation, sont essentielles pour que l’inflammation diminue suite à une lésion. Dans le cadre de pathologies telle que le diabète, les patients sont souvent atteints de neuropathies en plus de souffrir d’une mauvaise guérison des plaies où l’angiogenèse est diminuée. Pour mieux comprendre ses phénomènes, deux modèles ont été reconstruits par génie tissulaire à partir d’éponge de collagène et de chitosane : l’un permettant de mimer un derme endothélialisé innervé reconstruit, et le second est un modèle permettant de suivre la réépithélialisation dans un modèle glyqué par du glyoxal, au cours du temps. À la vue de nos résultats, la Substance P semble être un neuropeptide jouant un rôle majeur dans l’angiogenèse et la réépithélialisation.
V
Abstract
Neurogenic inflammation is an inflammatory process, characterized by the release of neuropeptides, particularly substance P and Calcitonin Gene-Related Peptide (CGRP), in sensory neurons. During this process, angiogenesis and reepithelialization following an injury are essential to reduce inflammation. Within certain diseases, such as diabetes, angiogenesis is diminished, and patients are often suffering of diabetic neuropathies and poor wound healing. To understand that process, two models were reconstructed using tissue engineering with a collagen and chitosan sponge: one model mimics a reconstructed endothelialized and innervated dermis, and the second one follows over time re-epithelialization in a glycated model using glyoxal. Based on our results, substance P seems to be a neuropeptide playing a major role in both mechanisms.
VII
Table des matières
RÉSUMÉ ... III ABSTRACT ... V TABLE DES MATIÈRES ... VII LISTE DES TABLEAUX ... XI LISTE DES FIGURES ... XIII LISTE D’ABRÉVIATIONS ... XV REMERCIEMENTS ... XIX
CHAPITRE I : INTRODUCTION ET PROBLEMATIQUE ... 1
1.1 LA PEAU ... 3
1.1.1 L’épiderme ... 4
1.1.2 Le derme ... 5
1.1.3 L’hypoderme... 6
1.2 NERFS SENSORIELS CUTANES ... 7
1.2.1 Le système nerveux ... 7
1.2.1.1 Le système nerveux central ... 8
1.2.1.2 Le système nerveux périphérique ... 8
1.2.2 Les neurones ... 9
1.2.3 Les neurones sensoriels ... 10
1.2.4 Les récepteurs neuronaux cutanés ... 11
1.2.5 L’inflammation neurogène ... 11 1.2.6 Les neuropeptides ... 11 1.2.6.1 Substance P ... 12 1.2.6.2 CGRP ... 12 1.2.6.3 VIP ... 14 1.2.6.4 PACAP ... 15 1.2.7 Neurotrophines... 15 1.2.7.1 NGF ... 16 1.2.7.2 BDNF ... 16 1.2.7.3 NT-3 ... 17 1.3 LE SYSTEME VASCULAIRE ... 17 1.3.1 Vasculogenèse ... 17 1.3.2 Angiogenèse ... 18 1.3.3 Facteurs angiogéniques ... 21 1.3.3.1 VEGF ... 21 1.3.3.2 Le bFGF ... 22 1.4 PLAIES CUTANEES ... 22
1.4.1 Différents types de plaies ... 22
1.4.2 Guérisons des plaies ... 23
1.4.3 La réépithélialisation ... 25
1.5 LA REACTION DE MAILLARD ... 26
1.5.1 La glycation ... 26
1.5.2 Les Advanced Glycation Endproducts (AGEs) ... 27
1.5.2.1 Produit de fin de glycation : le CML et le CEL ... 28
1.5.3 Produit de glycation intermédiaire : Le glyoxal et méthylglyoxal ... 28
1.5.4 Le Diabète et la neuropathie diabétique ... 29
1.6 PROBLEMATIQUE ... 30
VIII
1.6.2 OBJECTIFS ... 31
CHAPITRE II : MATERIELS ET METHODES ... 33
2.1 EXTRACTION DES DIFFERENTS TYPES CELLULAIRES ... 35
2.1.1 Fibroblastes ... 35
2.1.2 Kératinocytes ... 35
2.1.3 Cellules endothéliales ... 36
2.1.4 Purification des cellules endothéliales... 36
2.1.5 Neurones sensoriels ... 37
2.2 PRODUCTION DES EPONGES DE COLLAGENE-CHITOSANE ... 38
2.2.1 Protocole ... 38
2.2.2 Collagène ... 39
2.2.3 Chitosane ... 40
2.3 CULTURE DES EPONGES ... 40
2.3.1 Influence des neurones sensoriels sur l’angiogenèse ... 40
2.3.1.1 Compte de Capillary Like-Tube (CLT) : Immunohistochimie ... 42
2.3.2 Influence des neurones sensoriels sur la réépithélialisation dans un contexte de glycation ... 43
2.3.2.1 Mesure de fermeture des plaies ... 46
2.3.2.2 Transduction des kératinocytes ... 46
2.3.3 Test de migration : chambre de Boyden ... 47
2.3.4 Test de prolifération : CC-kit 8 ... 47
2.4 ELISA ... 47
2.5 IMMUNOFLUORESCENCE ... 48
2.6 ANALYSES STATISTIQUE ... 50
CHAPITRE III : INFLUENCE DES NEURONES SENSORIELS SUR L’ANGIOGENESE ... 51
3.1 RESULTATS ... 53
3.1.1 Antagonistes utilisés au cours de l’expérience ... 53
3.1.2 Effet des antagonistes sur le nombre de CLT dans le derme endothélialisé reconstruit ... 54
3.1.3 Influence des neuropeptides sur la libération de facteurs de croissance par les cellules endothéliales et les fibroblastes ... 56
3.1.4 Effet des neuropeptides sur la migration et la prolifération des cellules endothéliales ... 58
3.1.5 Expression du récepteur CGRP ... 59
3.1.6 Expression du récepteur SP ... 60
3.1.7 Expression de TRPV1 ... 60
3.2 DISCUSSION ... 61
3.2.1 Effet des antagonistes sur le nombre de CLT dans le derme endothélialisé reconstruit ... 61
3.2.2 Influence des neuropeptides sur la libération de facteurs de croissance par les cellules endothéliales et les fibroblastes ... 63
3.2.3 Effet des neuropeptides sur la migration et la prolifération des cellules endothéliales ... 64
3.2.4 Expression des récepteurs spécifiques à CGRP, SP et TRPV1 ... 65
CHAPITRE IV : INFLUENCE DES NEURONES SENSORIELS SUR LA REEPITHELIALISATION DES PLAIES DANS UN CONTEXTE DE GLYCATION ... 67
4.1 RESULTATS ... 69
4.1.1 Comparaison histologique de peaux de patients diabétiques versus des peaux normales humaines... 69
4.1.2 Effet de la glycation sur la prolifération des cellules endothéliales ... 70
4.1.3 Influence de la glycation sur la guérison des plaies ... 71
4.1.4 Expression de CML dans la guérison des plaies ... 73
4.1.5 Caractéristique histologique de l’effet du glyoxal sur les plaies reconstruites... 76
4.2 DISCUSSION ... 76
4.2.1 Comparaison histologique de peaux de patients diabétiques versus des peaux normales humaines... 76
IX
4.2.3 Influence de la glycation sur la guérison des plaies ... 78
4.2.4 Expression de CML dans la guérison des plaies ... 79
CONCLUSION ET PERSPECTIVE ... 81
BIBLIOGRAPHIE ... 85
XI
Liste des tableaux
Tableau 1 : Tableau des conditions utilisées lors des expériences sur l’influence des neurones sensoriels dans l’angiogenèse. ... 42 Tableau 2 : Listes des anticorps utilisés ... 50 Tableau 3 : Liste des Antagonistes et inhibiteur ... 53
XIII
Liste des figures
Figure 1 : Schéma de la peau ... 3
Figure 2 : Les différentes structures de l'épiderme ... 5
Figure 3 : Structure du derme ... 6
Figure 4 : Structure du Système Nerveux ... 7
Figure 5 : Structure d'un neurone ... 9
Figure 6 : Neurones sensoriels provenant des DRGs vers différents récepteurs neuronaux ... 10
Figure 7: Schéma du récepteur de la CGRP ... 14
Figure 8: Mécanisme de la vasculogenèse ... 18
Figure 9: L'angiogenèse par bourgeonnment ... 19
Figure 10 : L'angiogenèse par intussusceptions ... 20
Figure 11 : Types de plaies cutanées ... 23
Figure 12 : Étapes de guérisons des plaies ... 25
Figure 13 : Schéma de la réaction de Maillard à partir d'une molécule de glucose... 27
Figure 14 : Extraction des DRG ... 37
Figure 15 : Schéma de fabrication des éponges de collagène et chitosane ... 39
Figure 16 : Formation du collagène ... 40
Figure 17 : Schéma du protocole permettant d'observer l'influence des neurones sensoriels sur l'angiogenèse. ... 41
Figure 18 : Photo d'un marquage de l'Ac PECAM-1 par immunohistochimie sur une coupe de 7µm d'épaisseur ... 43
Figure 19 : Chronologie de la culture de notre modèle de guérison des plaies ... 44
Figure 20 : Schéma de culture pour l'étude de la guérison des plaies ... 45
Figure 21 : Principe d'un ELISA ... 48
Figure 22 : Principe d'immunofluorescence ... 49
Figure 23 : Graphique montrant le % de CLT dans le derme reconstruit endothélialisé (DRE) en fonction des antagonistes ajoutés dans le derme reconstruit endothélialisé innervé (DREI). ... 54
Figure 24 : Graphique montrant le pourcentage de CLT dans le DRE en fonction des DREI traité avec les antagonistes et inhibiteur. ... 55
Figure 25 : Graphique représentant la libération de VEGF (A) et de NGF (B) en fonction de la concentration en SP et CGRP. ... 57
Figure 26 : Graphique représentant le pourcentage de prolifération (A) et le pourcentage de migration (B) des cellules endothéliales en fonction de concentration croissante de Substance P et de CGRP. ... 58
Figure 27 : Photo du marquage des deux sous unités du récepteur au CGRP, CLRL (en rouge) et RAMP1 (en vert), immunofluorescence effectué sur les cellules endothéliales et les fibroblastes. ... 59
Figure 28 : Photo du marquage du récepteur à la SP, PECAM (en rouge) et NK1 (en vert), immunofluorescence effectué sur les cellules endothéliales et les fibroblastes. ... 60
Figure 29: Photo du marquage du récepteur TRPV1, TRPV1 (en rouge), NF160(en vert) et DAPI (en bleu), immunofluorescence effectué sur les cellules endothéliales, les fibroblastes et les neurones sensoriels. ... 61
Figure 30 : Histologie de peau normal humaine (PNH) et de patients diabétique de type 1 (T1) et de type 2 (T2) ... 69
Figure 31 : Graphique représentant le pourcentage de cellules endothéliales en fonction des concentrations de glyoxal, et de SP. ... 70
XIV
Figure 32 : Suivie de la réépithélialisation des plaies a cours du temps à partir de photo prise en fluorescence pour détecter la GFP. ... 72 Figure 33 : Graphique représentant la vitesse de réépithélialisation en fonction des concentrations de glyoxal G200 (200µM) et G300 (300µM) et de l'innervation. ... 73 Figure 34 : Immunofluorescence montrant l'expression du CML dans le modèle de guérison de plaie en condition glyquée par le glyoxal ... 75 Figure 35 : Comparaison des structures histologiques des modèles 3D de guérison des plaies avec et sans traitement au G500 ... 76
XV
Liste d’Abréviations
AGE Advanced End Product
AMD Adrenomedulline
AMPc Adénosine Monophosphate cyclique
Ang1 Angopoiétine 1
BDNF Brain-Derived Neurotrophic Factor
CEL Nε-(carboxyethyl)lysine
CGRP Calcitonin Gene-Related Peptide
CRLR Calcitonin Receptor Like Receptor
CLT Capillary Like Tube
CML Nε-(carboxymethyl)lysine
DAB 3,3’-Diaminobenzidine
DMEM Dulbecco’s Modified Eagle’s Medium
DRE Derme Reconstruit Endothélialisé
DREI Derme Reconstruit Endothélialisé Innervé
DRG Dorsal Root Ganglion
EGF Endothelial Growth Factor
EGM2 Endothelial Cell Growth Media 2
ELISA Enzyme-Linked Immune Sorbent Assay
bFGF basic Fibroblast Growth Factor
FGFR Fibroblast Growth Factor Receptor
GFP Green Fluorescent Protein
GDNF Glial cell line-Derived Neurotrophic Factor
HBSS Hank’s Balanced Salt Solution
HRP Horseradish Peroxidase (Peroxydase de Raifort)
HUVEC Human Umbilical Vein Endothelial Cell
IL-1 Interleukine 1
MEC Matrice Extra Cellulaire
NKA Neurokinine A
NK1/2/3 Neurokinine 1/2/3
NGF Nerve Growth Factor
NT-3/4/5 Neurotrophine 3/4/5
P75NTR P75 neurotrophin receptor
PACAP Pituitary Adenylate Cyclase-Activating Peptide
PBS Phosphate Buffered Saline
PDGF Platelet-derived growth factor
PECAM-1 Platelet Endothelial Cell Adhesion Molecule-1
PFA Paraformaldehyde
PlGF Placenta Growth Factor
RAGE Receptor for Advanced Glycation End-Products
XVI
RCP Receptor Component Protein
ROS Reactive Oxygen Species
SN Système nerveux
SNA Système nerveux automatique
SNC Système nerveux central
SNE Système nerveux entérique
SNP Système nerveux périphérique
SNS Système nerveux somatique
SP Substance P
TGF-β Transforming Growth Factor beta
TNF-α Tumor Necrosis Factor alpha
Trk Tropomyosin-Receptor Kinase
TRPV1 Transient Receptor Potential Vanilloid 1
UV Ultra violet
VEGF Vascular Endothelial Growth Factor
VEGFR Vascular Endothelial Growth Factor Receptor
VIP Vasoactive Intestinal Peptide
XVII
“Life is like a box of chocolates, You never know what you're gonna get.”
XIX
Remerciements
J’aimerais tout d’abord remercier mon directeur de recherche, Dr François Berthod, qui m’a accordé toute sa confiance et m’a permis de faire parti de son équipe. Merci pour ses conseils, son soutient tout au long de ma maîtrise et pour l’autonomie que j’ai pu acquérir
au cours de mon cursus de 2ème cycle. Je souhaiterais également remercier Dr François A.
Auger et Dr Lucie Germains, qui ont su monter un laboratoire comme le LOEX et qui m’ont permis ainsi qu’aux autres étudiants, de faire notre cursus d’études gradué dans des conditions optimales avec un matériel et des techniques de qualité.
Merci à Mathieu, qui m’a formé à mon arrivée. Un très grand merci à Sabrina, non seulement pour son aide au laboratoire, mais aussi pour sa confiance, sa joie de vivre et son amitié. Un gros merci à Sébastien qui aura été mon mentor, mon maitre yoda, j’espère qu’un jour je saurais dépasser le maitre ! Sans vous les heures sous la hotte auraient été très longues.
Un énorme merci tout particulier à ma belle rouge, Audrey, pour sa gentillesse, son sourire, son énergie, sa personnalité, sa marginalité, ses coups de speed. Pour la motivation que tu as su m’apporter. Pour tous ces moments passés, en voyages, au laboratoire, et toutes les aventures que l’on a pu vivre ensemble. Grâce à toi ces deux années resteront gravés dans le marbre.
Un gros merci à Virginie, pour sa présence, son soutien, sa confiance, pour ces moments passés ensemble.
Merci à tous mes amis que j’ai eu la chance de connaitre durant ces deux années à Québec, à mes amis du LOEX, merci pour tous les moments inoubliables qu’on aura passé tous ensemble. Merci en particulier à Pascal pour son amitié, son aide et tous les bons moments durant ces deux années.
Merci également à toute ma famille pour leurs encouragements et leur confiance à toutes les étapes importantes de ma progression.
Pour finir un énorme merci à mes parents qui m’ont soutenue dans tout mes choix, qui m’ont permis de voyager pour avoir le meilleur dans mes études, qui m’ont toujours tout donné pour ma réussite, et m’ont poussés à me dépasser. Pour tout votre amour et vos sacrifices je ne vous remercierais jamais assez.
Je dédie ce mémoire à mon grand père, qui je l’espère de là où il est, verra tout le chemin parcouru, et l’accomplissement de toutes mes années de travail. Je te remercie papi pour ces années de conseils, d’encouragements, de soutien, à tout jamais tu resteras mon étoile dans le ciel.
1
Chapitre I : Introduction et
problématique
3
1.1 La peau
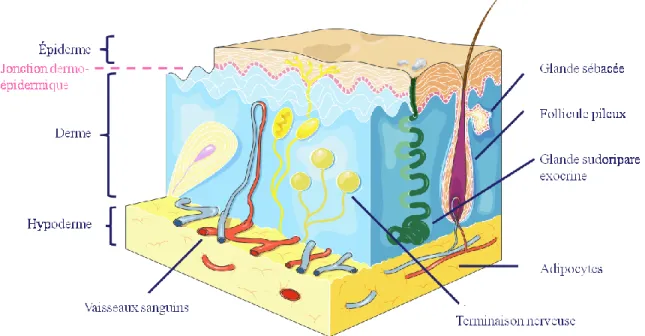
La peau est un organe essentiel du corps humain. Elle recouvre une surface d’environ 2m² et pèse entre 4.5 et 5 kg. Elle mesure de 0.5 à 4 mm d’épaisseur, en fonction de sa localisation. La peau est divisée en trois parties : en premier lieu l’épiderme qui est la partie superficielle et la plus fine, le derme situé plus en profondeur est la partie la plus épaisse constitué principalement de tissus conjonctif et finalement l’hypoderme qui est la couche sous-cutanée (Fig. 1)[1].
La peau possède différentes fonctions physiologiques en dehors de son rôle dans la protection de l’organisme contre d’éventuels agents pathogènes, ou menaces environnementales. L’une d’entre-elles, la thermorégulation, qui correspond à la régulation homéostatique de la température du corps. Ce phénomène est régulé par la sécrétion de sueur par les glandes sudoripares exocrines, et par la régulation du flux sanguin. Soit par la vasodilatation des vaisseaux lors de l’effort ou lors de l’augmentation de la température corporelle, soit par la vasoconstriction des vaisseaux sanguins pour économiser de la chaleur en cas de diminution de la température de l’organisme [1].
Ensuite, les sensations cutanées, la peau permet de ressentir de la chaleur ou du froid par exemple, à travers les nombreuses terminaisons nerveuses et récepteurs présents dans celle-ci.
Figure 1 : Schéma de la peau (Modifié de http://smart.servier.fr/slidekit/?item=147)
4
Par ailleurs, la peau est un organe essentiel à la synthèse de la vitamine D, en effet, un précurseur de celle-ci est présent dans la peau et va être activé par les rayons ultra-violets (UV) du soleil, entrainant sa synthèse [1].
1.1.1 L’épiderme
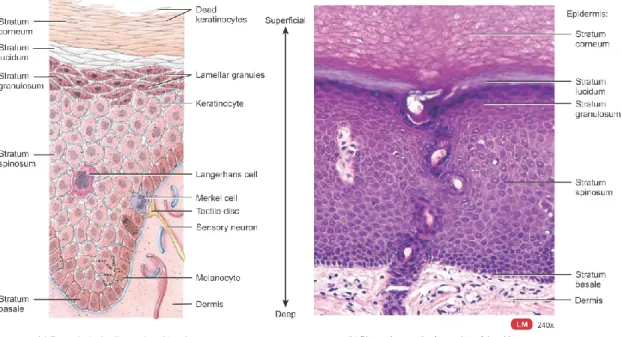
La peau est composée, à sa surface, d’un épithélium pavimenteux stratifié formant l’épiderme. Celui-ci est lui-même principalement composé de quatre types cellulaires. Les kératinocytes représentant le type majoritaire (90%) et compose l’épithélium. Ils produisent de la kératine, une protéine fibreuse intracellulaire, dont le rôle est d’assurer une forte résistance mécanique dans la cohésion intercellulaire via les desmosomes [1]. Ensuite on trouve les mélanocytes, sécrétant de la mélanine, une protéine colorée brune servant de chromophore capable d’absorber les UV captés par la peau. Elles sont liées à la pigmentation de la peau et des poils. Un transfert de mélanine se fait des mélanocytes vers les kératinocytes via les mélanosomes pour permettre la protection de la peau contre les rayons UV [2]. Puis viennent les cellules de Langerhans qui sont des cellules dendritiques présentatrices d’antigène. Elles sont responsables de la défense immunitaire de l’épiderme. Pour finir, les cellules de Merkel, situées dans la couche basale de l’épiderme, participent à la perception tactile via un contact synaptique avec les neurones sensoriels [1].
La couche de kératinocytes est elle-même séparée en 4 couches distinctes qui suivent la maturation et la différenciation de l’épiderme (Fig. 2). Tout d’abord la couche basale, composée d’une seule strate de kératinocytes cubiques parsemées de cellules souches qui se divisent en de nouveaux kératinocytes [3]. C’est cette couche cellulaire qui permet le renouvellement régulier de l’épiderme. Les mélanocytes, les cellules de Langherans et les cellules de Merkel y sont également localisés. En remontant vers la surface de l’épiderme, on trouve la couche épineuse composée de 8 à 10 strates de kératinocytes polyédriques, puis la couche granuleuse composée de 3 à 5 strates de kératinocytes aplatis, dont les noyaux et les organites commencent à dégénérer. La dernière couche de l’épiderme, la couche cornée, est composée de 25 à 30 strates de kératinocytes anucléés contenant principalement de la kératine [1].
5
1.1.2 Le derme
Le derme est un tissu conjonctif situé en dessous de l’épiderme, il est composé d’un réseau dense de collagènes et de fibres élastiques. Différents types de cellules composent le derme. Les fibroblastes, les macrophages, les mastocytes, les cellules dendritiques et les cellules souches des follicules pileux. D’autres cellules sont présentes au niveau du derme, les éosinophiles et les neutrophiles. Elles s’infiltrent dans les tissus pour se rendre sur le site de l’inflammation. Des vaisseaux sanguins, des nerfs, ainsi que des follicules pileux sont également présents (Fig. 3)[1]. Le derme est séparé en deux régions, la région papillaire et la région réticulaire. La région papillaire se situe à la surface du derme, elle est composée en majorité de tissus conjonctifs aréolaires. Des structures ondulées de types digitiformes appelées papilles du derme permettent d’augmenter la surface de contact entre le derme et l’épiderme et ainsi favoriser les échanges thermiques et de nutriments entre ces tissus. Dans cette structure de papilles dermiques se trouvent les capillaires sanguins. De plus, des récepteurs sensoriels, les corpuscules de Meissner, qui sont des terminaisons nerveuses, sont également retrouvés au niveau de ces structures. La région réticulaire, située dans la partie profonde du derme, est un tissu conjonctif dense et irrégulier, composé en majorité de fibres de collagènes, de fibres élastiques, de fibroblastes et de
Figure 2 : Les différentes structures de l'épiderme (Principles of human anatomy J. TORTORA 1994)
6
macrophages [4]. Dans cette région les fibres de collagènes sont assemblées avec les fibres élastiques de manière structurée, octroyant à la peau ses propriétés d’élasticités, de résistances aux tensions ainsi que d’extensibilités [5]. Le collagène est une des composantes majeures du derme, principalement le collagène de type I [4]. D’autres structures sont également présentes à ce niveau, les vaisseaux sanguins, les nerfs, les follicules pileux, les glandes sébacées, ainsi que les glandes sudoripares qui occupent l’espace libre entre les fibres de collagène [1].
1.1.3 L’hypoderme
L’hypoderme est une couche sous-cutanée, composé de tissus conjonctifs et d’adipocytes. Cette structure permet de faire un lien entre la peau et d’autres organes tels que les os et les muscles. Comme le derme, l’hypoderme contient aussi des terminaisons nerveuses appelées corpuscules de Pacini, et sont sensibles à la pression. Il a pour fonction d’absorber les chocs et de protéger les os et les muscles sous-jacents. C’est également un site important de stockage d’énergie du corps humain. Par ailleurs, cette structure participe à la régulation thermique de l’organisme [1].
Figure 3 : Structure du derme (Fundamentals of Anatomy & Physiology 9e édition F. H. MARTINI)
7
1.2 Nerfs sensoriels cutanés
1.2.1 Le système nerveux
Le système nerveux (SN) humain est responsable de l’envoi, de la réception et du traitement des influx nerveux. Il a différentes fonctions.
Premièrement, la fonction sensorielle, liée aux différents récepteurs sensoriels qui sont capables de détecter les stimulis internes ou externes à l’organisme.
Deuxièmement la fonction intégrée à l’organisme, dans laquelle le SN est capable d’analyser les différentes informations transmises par les différents récepteurs sensoriels. Dans un premier temps, le SN va stocker l’information et, dans un deuxième temps, il va avoir la capacité de prendre les décisions nécessaires pour effectuer une réponse adaptée à la situation. Pour finir, la fonction motrice, après l’intégration des informations sensorielles, le SN va induire une réponse motrice au niveau de l’organisme, par exemple en induisant la contraction musculaire. Les neurones impliqués dans cette fonction sont les neurones moteurs ou les neurones efférents [1]. Toutes ces structures sont divisées dans le système nerveux en deux sous catégories, le système nerveux central (SNC) et le système nerveux périphérique (SNP) (Fig.4) [1].
Figure 4 : Structure du Système Nerveux (tiré de "Principe d'anatomie et de physiologie" Derrickson B. and Tortora G.J. 2007)
8
1.2.1.1 Le système nerveux central
Le système nerveux central regroupe la moelle épinière et l’encéphale. La moelle épinière est protégée par les os qui composent la colonne vertébrale. L’encéphale, comprenant le cerveau, le tronc cérébral et le cervelet, est protégé par la boite crânienne. Le SNC à pour rôle de recevoir, d’enregistrer et d’interpréter les différentes informations arrivant du SNP. Pour cela le SNC traite les informations en provenance de sources comme le système nerveux sensoriel et de la mémoire ou des émotions. Ensuite les signaux sont analysés, la réponse est adapté en fonction de celui-ci et transmit à travers les nerfs pour induire la stimulation de muscles ou de glandes.
1.2.1.2 Le système nerveux périphérique
Le SNP est composé de structures extérieures au SNC dont les nerfs crâniens, les nerfs spinaux, les ganglions, le plexus entérique et les récepteurs sensoriels. Il est divisé en deux sous partie le système nerveux somatique (SNS) et le système nerveux autonome (SNA). Ce dernier est lui-même constitué de trois autres structures le système nerveux sympathique, le système nerveux parasympathique et le système nerveux entérique.
D’abord, le système nerveux somatique est composé de neurones sensoriels appelés neurones sensoriels somatiques. L’information va être transmise vers le SNC via les neurones sensoriels somatiques à partir des différents récepteurs sensoriels situés dans la peau, ainsi que des récepteurs associés à la vue, à l’ouïe, à l’équilibre, au goût et à l’odorat. Les neurones moteurs somatiques vont, quant à eux, transmettre l’information du SNC vers les muscles squelettiques [1].
Ensuite, le système nerveux autonome est composé des neurones sensoriels autonomes et des neurones moteurs autonomes. Les neurones sensoriels autonomes sont capables de transmettre l’information des récepteurs sensoriels autonomes localisés principalement dans les organes viscéraux, comme les muscles lisses, ainsi que les organes contenus dans le thorax, l’abdomen, et le pelvis, vers le SNC. Les neurones moteurs autonomes, transmettent l’information du SNC vers les muscles lisses, les muscles cardiaques ou les glandes. Les neurones sensoriels autonomes sont eux même subdivisés en deux catégories, le système sympathique et parasympathique. Les nerfs présents dans le système sympathique et parasympathique sont sensitifs et moteur.
9 Finalement, le système nerveux entérique est une sous partie du SNA. Il contrôle l’activité motrice, la vascularisation et la sécrétion de l’appareil digestif. Il est composé des neurones sensoriels entériques et des neurones moteurs entériques. Les neurones sensoriels entériques vont être capables de détecter les différences chimiques dans l’intestin. Alors que les neurones moteurs entériques sont capables d’induire la contraction des muscles lisses. Ces neurones moteurs vont avoir un contrôle sur la sécrétion de l’intestin, comme l’acidité venant de l’estomac, ou les cellules endocrines qui secrètent les enzymes digestives et des hormones [1].
1.2.2 Les neurones
Les neurones sont composés de dendrites et d’axones qui vont transporter l’information sous forme de stimulus. Les neurones sont capables de répondre à un stimulus en le transformant en une impulsion nerveuse correspondant à un signal électrique se propageant le long de la membrane du nerf. Ce transfert d’informations va être favorisé par la gaine de myéline composée au niveau du SNC par les oligodendrocytes et au niveau du SNP par les cellules de Schwann entourant l’axone (Fig.5).
Outre les organites normalement présents dans le corps cellulaire comme les lysosomes, les mitochondries et l’appareil de Golgi, le cytosquelette des neurones comprend également les neurofibrilles et les microtubules qui permettent le transfert de certains organites du corps cellulaire vers les axones. Les fibres nerveuses correspondent à toutes extensions partant du corps cellulaire, cela regroupe les dendrites et les axones [1].
Figure 5 : Structure d'un neurone
10
1.2.3 Les neurones sensoriels
La peau est innervée de manière importante par des neurones sensoriels qui proviennent des ganglions de la racine dorsale (DRG) (Fig.6). L’innervation cutanée est importante pour la détection des différentes sensations comme la température, le toucher et la douleur [6]. L’innervation de la peau joue également des rôles au niveau du maintien de l’homéostasie de la peau et participe à différents processus physiologiques comme la guérison de plaie cutanée [7]. Les plaies cutanées sont souvent observées chez des patients souffrants de lésions au niveau des nerfs périphériques, comme dans le cas d’une neuropathie diabétique (ce phénomène sera abordé dans la section 1.5.4) [8, 9].
Les neurones sensoriels et les différentes cellules de la peau communiquent via l’intermédiaire de différentes molécules comme des neuropeptides, des neurohormones et des neurotrophines. Leurs récepteurs spécifiques sont par ailleurs exprimés à la fois par les cellules neuronales et non neuronales [10].
Les fibres nerveuses sensorielles partent des nerfs rachidiens, pour s’étendre jusque dans la peau. Il existe plusieurs types de fibres nerveuses qui sont classées selon leur vitesse de conduction ainsi que selon leur diamètre. Les fibres cutanées sont composées des fibres myélinisées Aβ (diamètre : 6 à 12µm et vitesse de conduction : 35 à 75 m/s), des fibres myélinisées Aδ (diamètre : 1 à 5µm et vitesse de conduction : 4 à 30 m/s) et des fibres non myélinisées de type C (diamètre : 0,2 à 1,5µm et vitesse de conduction : 0,5 à 20 m/s). Il existe d’autres types de fibres
Figure 6 : Neurones sensoriels provenant des DRGs vers différents récepteurs neuronaux
Source : modifié de : Caspary et al. Patterning cell types in the dorsal spinal cord: what the mouse mutants say
11 somatiques sensorielles classées de type Aα. Elles sont de plus grand calibre et innervent les articulations et les muscles principalement [11].
1.2.4 Les récepteurs neuronaux cutanés
Des récepteurs liés aux neurones sensoriels sont présents au niveau de la peau. Ceux-ci sont spécifiques à différentes sensations, on retrouve les mécanorécepteurs détectant les sensations de toucher, de pressions, de vibration, d’équilibre ; les thermorécepteurs détectant les changements de température ; les osmorécepteurs détectant la pression osmotique des liquides corporels ; les chémorécepteurs détectant les changements chimiques; et les nocirécepteurs capables de détecter et de répondre à un stimulus douloureux provenant d’une lésion tissulaire physique ou chimique [1].
1.2.5 L’inflammation neurogène
L’inflammation neurogène est un phénomène correspondant à une réponse pro-inflammatoire suite à une lésion ou à un stress au niveau d’un tissu. Elle se traduit par la stimulation des terminaisons nerveuses des neurones sensoriels, ce qui va entrainer la libération en concentration très importante de neuropeptides tels que le Calcitonin Gene-Related Peptide (CGRP), la Substance P (SP) et la Neurokinin A (NKA). Les neurones sensoriels qui sont impliqués dans la réponse inflammatoire, contiennent des nocirécepteurs dit polymodaux. Ils sont capables de détecter les changements de températures, des modifications chimiques et des stimuli mécaniques importants [12].
1.2.6 Les neuropeptides
Les neuropeptides sont principalement sécrétés par les neurones sensoriels, néanmoins ils peuvent également être produits au niveau de la peau par les kératinocytes [13, 14]. Dans la peau humaine, on retrouve près de 20 neuropeptides différents [15, 16], dont certains participent à l’initiation de nombreuses réactions inflammatoires [17]. Les neuropeptides les plus abondant de
12
la peau, la substance P et le CGRP, sont produits par des fibres cutanées de type C et de type Aδ [18].
1.2.6.1 Substance P
La substance P est un neuropeptide appartenant à la famille des tachykinines, composée de 11 acides aminés. Les récepteurs des tachykinines sont des récepteurs couplés à la protéine G. Ces récepteurs sont la neurokinine 1, 2 et 3 (NK1, NK2 et NK3). Le récepteur NK1 a une forte affinité pour la substance P.
La substance P est libérée par les neurones sensoriels à partir des terminaisons afférentes vers les tissus périphériques [19, 20]. Il est courant de retrouver les nerfs sensoriels cutanés, produisant de la substance P, associés au réseau vasculaire [21].
La substance P stimule la prolifération, la migration des fibroblastes, et est fortement impliquée dans l’inflammation neurogène [7, 22, 23]. De plus, il a été montré par plusieurs études que la substance P est un médiateur de la douleur [24, 25]. Par ailleurs le développement d’antagoniste anti-NK1, le récepteur à la substance P, on permit «d’identifier, in vivo, des réponses synaptiques impliquant la substance P endogène et déclenchées par la stimulation naturelle de récepteurs cutanés nociceptifs » [26-28].
Lors de la phase initiale dans la guérison des plaies, des études ont observées une modification du collagène présent dans la matrice extracellulaire, le collagène III serait remplacé par le collagène I et la SP participerait à ce phénomène activement [29]. De plus, la concentration de Substance P présente dans le derme est connue pour augmenter lors de la guérison cutanée [30]. Suite à une blessure, la substance P libérée dans les tissus va être capable d’augmenter la perméabilité micro vasculaire et l’extravasation des protéines [31] favorisant ainsi la guérison.
1.2.6.2 CGRP
Le Calcitonine Gene-Related Peptide est un neuropeptide de 37 acides aminés appartenant à la famille des calcitonines. Le CGRP est produit par les neurones nociceptifs afférents du SNC et
13 du SNP, il est exprimé plus particulièrement dans le sous-ensemble des fibres afférentes Aδ et C. Le CGRP peut alors être libéré suite à des stimulations chimiques engendrant un stress au niveau du tissu [32]. Le CGRP, comme la substance P, est capable de stimuler les fibroblastes, l’inflammation neurogène, l’organisation de l’épiderme et la prolifération des kératinocytes [7, 22, 23, 33]. Il favorise la prolifération des cellules endothéliales [33]. Le CGRP a également un effet vasodilatateur important sur les petits et gros vaisseaux sanguins [34, 35]. Des études ont également montré que le CGRP aurait un rôle important dans la vasodilatation des vaisseaux au niveau du tissu méningé ayant pour conséquence des migraines importantes. Pour essayer de remédier à l’effet migraineux du CGRP, un antagoniste spécifique du récepteur au CGRP a été synthétisé, le BIBN4096 [36-38].
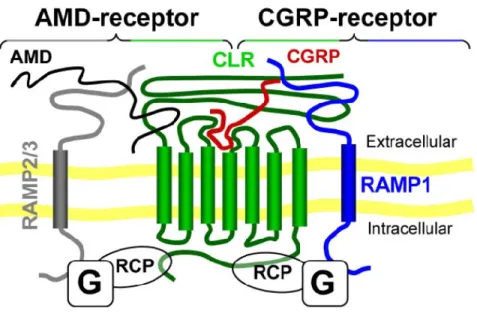
Le récepteur du CGRP est un récepteur couplé à la protéine G, composé de plusieurs sous unités [39] dont une protéine de 7 domaines transmembranaires appelée Calcitonin Receptor Like
Receptor (CRLR). Ce domaine correspond au domaine de liaison du peptide CGRP ainsi que
d’un autre neuropeptide appelée l’Adrenomedullin (AMD) [40, 41]. Une seconde sous-unité, composée d’un seul domaine transmembranaire, compose le complexe du récepteur de CGRP, appelée Recepteur Activity-Modifying Protein (RAMP). Il existe 3 sous-unités RAMP s’associant à différents peptides, RAMP-1, RAMP-2 et RAMP-3. Lorsque la protéine RAMP1 s’associe au CRLR, le récepteur est alors spécifique au CGRP et de faible affinité pour l’AMD, en revanche si c’est le protéine RAMP2 ou RAMP3 qui s’associe avec le CRLR, le récepteur sera spécifique à l’AMD [42] (Fig.7).
Finalement le récepteur intracellulaire du CGRP appelé Receptor Component Protein (RCP) est important pour le couplage des deux sous unités du récepteur et la transmission du signal intracellulaire [43]. Le CGRP, au niveau du système nerveux central est un inhibiteur de la dégradation de la substance P [44].
14
1.2.6.3 VIP
Le vasoactive intestinal peptide est une hormone peptidique, composée de 28 acides aminés. VIP est un neuropeptide faisant partie de la famille des glucagons/sécrétines. Il est retrouvé au niveau des fibres nerveuses associées au réseau vasculaire du derme, ainsi qu’aux follicules pileux [45, 46]. VIP peut lier des récepteurs de PACAP et de VIP avec différentes affinités, ce sont des récepteurs couplés à des protéines G qui activent l’adénylate cyclase [47]. Suite à leurs activation, le peptide VIP favorise la prolifération et la migration des kératinocytes ainsi qu’une augmentation de leur production de Vascular Endothelial Growth Factor (VEGF) [47-49]. Par ailleurs, VIP aurait également un effet vasodilatateur et favoriserait l’angiogenèse suite à l’augmentation de la production d’Adénosine Monophosphate cyclique (AMPc) par les cellules endothéliales [50, 51].
Figure 7: Schéma du récepteur de la CGRP
(Source: Lennerz, J.K., et al., Calcitonin receptor-like receptor (CLR), receptor activity-modifying protein 1 (RAMP1), and calcitonin gene-related peptide (CGRP) immunoreactivity in the rat trigeminovascular system: differences between peripheral and central CGRP receptor distribution. J Comp Neurol, 2008.
15
1.2.6.4 PACAP
Pituitary adenylate cyclase-activating polypeptid (PACAP) est une protéine qui est semblable à
VIP, il est capable de se lier avec le récepteur de VIP et le récepteur de PACAP avec une affinité plus ou moins importante. Il existe plusieurs isoformes de PACAP, le PACAP-38 et PACAP-27. Le PACAP-38 est composé de 38 acides aminés, il est capable, par clivage, de donner un résidu de 27 acides aminés, PACAP-27 [52]. Le neuropeptide humain PACAP-27 partage 68 % d’homologie avec le neuropeptide VIP humain [53]. PACAP-38 est principalement sécrété dans le système nerveux central et reste la forme dominante présente au niveau du tissu cérébral, PACAP-27 n’y étant représenté qu’à 10 % de la quantité de PACAP total [54, 55]. Par ailleurs PACAP est également retrouvé en concentration importante au niveau des fibres nerveuses nociceptives qui sont particulièrement associées au réseau vasculaire et aux follicules pileux. PACAP peut être retrouvé au niveau des fibres nerveuses exprimant déjà la SP, le CGRP ou le VIP [46, 56]. PACAP a des effets neuroptrophique et neuroprotecteur induit par des mécanismes directs et indirects [57].
1.2.7 Neurotrophines
Les neurotrophines sont des facteurs qui sont essentiels à la survie et à la différenciation des fibres nerveuses, ainsi qu’au guidage de ces derniers. La famille des neurotrophines comprend le
nerve growth factor (NGF), le brain-derived growth factor (BDNF), et les neurotrophins 3, 4/5,
6 (NT-3, NT-4/5, NT-6).
Les neurotrophines se lient à leurs récepteurs de hautes affinités respectifs,
Tropomyosin-receptor-kinase A, B et C (TrkA, TrkB, et TrkC). Ces récepteurs font partie de la famille des
tyrosines kinases. Un récepteur de faible affinité où toutes les neurotrophines peuvent se lier existe également, c’est le récepteur au neurotrophine p75. Lorsque les neurotrophines s’y lient, cela augmente le signal d’activation des récepteurs à activités tyrosine kinase [58].
Dans de récentes études, il a été montré que les neurotrophines pourraient avoir un rôle de facteur de croissance angiogénique, comme le VEGF, par exemple. En effet, il semblerait que les neurotrophines pourraient avoir un effet direct sur l’expression du récepteur Trk sur les cellules endothéliales, qui expriment les récepteurs Trk au niveau de leurs membranes plasmiques, mais
16
également un effet indirect via le recrutement de facteurs pro-angiogéniques [59-61]. Ainsi, il est important de noter que les neurotrophines et leurs récepteurs ne sont pas seulement présents au niveau du système nerveux mais aussi au niveau des cellules non neuronales [62-64].
1.2.7.1 NGF
Le NGF est une protéine importante pour la survie et la croissance des cellules neuronales. Le NGF est capable de lier 2 types de récepteurs, le TRK-A pour lequel il a une forte affinité et p-75NTR (neurotrophine receptor) qui est de faible affinité pour le NGF [65].
En plus de permettre la survie des cellules de type neuronal et non-neuronal, sa présence stimule la croissance des neurites et permet la différenciation cellulaire [65].
Le NGF peut être produit par plusieurs cellules composant la peau et être récupéré par les neurones sympathiques et les petits neurones sensoriels. Le NGF est également essentiel à la survie des fibres nerveuses sympathiques et permet la régulation de l’expression de la SP et du CGRP[66]. Le NGF est principalement exprimé par les kératinocytes au niveau de la peau [67, 68]. D’après une étude, le NGF semblerait augmenter l’expression du VEGF ainsi que la surface du réseau vasculaire [69].
1.2.7.2 BDNF
En tant que membre de la famille des neurotrophines, le Brain-derived growth factor (BDNF) participe à la survie, à la croissance et à la différenciation des neurones. En effet, des souris modifiées génétiquement pour être incapables de produire du BDNF montrent un mauvais développement du cerveau et du système nerveux sensoriel [70].
En plus de se lier au récepteur, de faible affinité p75, le BDNF se lie à plus forte affinité le récepteur TrkB présent à la surface cellulaire. TrkB est un récepteur à tyrosine kinase. De plus, des études montrent que le BDNF serait un facteur pro-angiogénique en agissant directement au niveau des cellules endothéliales [71, 72].
17
1.2.7.3 NT-3
Cette neurotrophine est importante pour le développement des neurones du système nerveux central et périphérique. Les souris modifiées génétiquement pour ne pas exprimer NT-3 développent un déficit important au niveau du système nerveux sensoriel [70]. Le NT-3 lie le récepteur Trk-C avec une forte affinité. Il semblerait que le NT-3 soit un facteur angiogénique pour les cellules endothéliales exprimant le récepteur Trk-C [73].
1.3 Le système vasculaire
1.3.1 Vasculogenèse
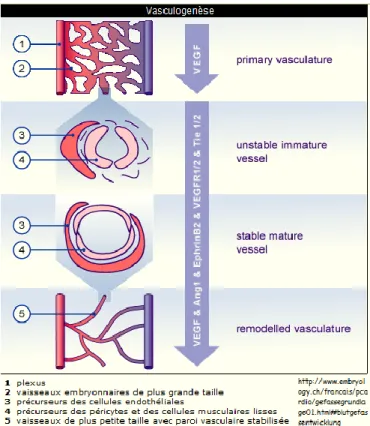
La vasculogenèse correspond à la formation embryonnaire des premiers vaisseaux sanguins et lymphatiques. Lors de la gastrulation, le mésoderme, situé entre l’ectoderme et l’endoderme, participe à la vasculogenèse. Au cours de cette étape, des précurseurs endothéliaux appelés angioblastes vont migrer, se différencier et s’assembler pour permettre de former un réseau vasculaire primitif, appelé plexus primaire (Fig. 8) [74, 75].
La formation de ce réseau vasculaire primitif est favorisée par des facteurs de croissances telles que le VEGF, l’angiopoiétine 1 (Ang1) et l’éphrineB2. Grâce à ces facteurs de croissances, le réseau vasculaire se structure, devient plus stable, et les jonctions entre les cellules endothéliales se renforcent suite à la sécrétion de protéines de la matrice extracellulaire (MEC). Autour des proto-capillaires, les cellules endothéliales vont se différencier en péricytes et cellules musculaires lisses. Les péricytes participent au modelage du réseau vasculaire ainsi qu’à la stabilité des capillaires [76].
Des études montrent que les angioblastes exprimeraient des marqueurs spécifiques permettant de diriger la formation du réseau sanguin vers une différenciation artérielle ou veineuse. En effet, l’éphrineB2 semblerait amener les cellules vers une différenciation artérielle et permettrait l’épaississement des parois vasculaires de ces vaisseaux durant la vasculogenèse (Fig. 8) [77].
18
1.3.2 Angiogenèse
La croissance et l’extension du réseau vasculaire primitif s’effectue grâce à l’angiogenèse, permettant ainsi la formation d’un réseau de capillaires.
L’angiogenèse est un phénomène extrêmement contrôlé par l’organisme, mais dans le cadre de certaines pathologies, elle devient incontrôlée comme par exemple dans le cadre de l’arthrite rhumatoïde, de la rétinopathie diabétique, du psoriasis ou de la croissance des tumeurs [78]. Ce processus est également très important dans le cadre de la guérison d’une plaie. Les interactions formées entre les cellules endothéliales et la M.E.C. sont importantes dans le cadre de la néovascularisation in vivo et in vitro [79, 80].
L’angiogenèse est régulée grâce à de nombreux facteurs de croissance comme le VEGF, le basic
Fibroblast Growth Factor (bFGF), les angiopoiétines et les éphrines ainsi que par leurs Figure 8: Mécanisme de la vasculogenèse
(Source :
http://www.embryology.ch/francais/pcardio/gefassegrundlage01.ht ml#blutgefassentwicklung)
19
Figure 9: L'angiogenèse par bourgeonnment
(Source: Adams, R.H. and K. Alitalo, Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol, 2007. 8(6): p. 464-78.)
récepteurs [81, 82] . L’un des premiers facteurs de croissance des cellules endothéliales découvert a été le bFGF.
Deux mécanismes différents permettent la formation de nouveaux vaisseaux sanguins, soit par bourgeonnement, soit par intussusception (division), soit par la formation de vacuoles. Les parois des vaisseaux sanguins sont composées de cellules endothéliales, de cellules musculaires lisses ainsi que de péricytes qui vont être regroupés sous le nom de cellules murales.
Lors de la formation des nouveaux vaisseaux par bourgeonnement (Fig. 9), les cellules murales vont se contracter suite à l’activation de l’angiogenèse via des facteurs tels que le VEGF, permettant ainsi d’activer les cellules endothéliales. Celles-ci vont sécréter des protéines permettant de dégrader la M.E.C., permettant leur migration. L’augmentation du bourgeonnement des cellules endothéliales est favorisée par un gradient de VEGF. Ensuite, la fusion entre deux bourgeonnements de vaisseaux adjacents, grâce à des signaux d’adhésion, a lieu. Le processus de fusion entre les cellules endothéliales permet ensuite la formation de la lumière du vaisseau et la maturation de ces parois est favorisée par le passage du flux sanguin [83].
20
Lors de l’angiogenèse par division des colonnes se forment à travers les capillaires au niveau du réseau vasculaire qui est en croissance. Dans un premier temps, une zone de contact se fait entre les parois des capillaires, ensuite une réorganisation des jonctions intracellulaires de l’endothélium est mise en place avec un trou central au niveau de la bicouche de cellules endothéliales. La colonne tissulaire va se développer, suite à l’extension cytoplasmique des myofibroblastes ainsi que des péricytes et à l’extension des fibres de collagènes. La colonne augmente de diamètre et reforme alors un nouveau réseau de capillaires (Fig. 10) [83, 84].
Figure 10 : L'angiogenèse par intussusceptions
(Modifiée de: Adams, R.H. and K. Alitalo, Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol, 2007. 8(6): p. 464-78. Et Ribatti, D. and V. Djonov, Intussusceptive microvascular growth in tumors. Cancer
21
1.3.3 Facteurs angiogéniques
1.3.3.1 VEGF
Le vascular endothelial growth factor est une protéine produite par les cellules permettant l’activation de la vasculogenèse ou de l’angiogenèse. Elle est essentielle à la formation du réseau vasculaire [85]. Il existe 5 isoformes de VEGF, le A, B, C, VEGF-Det le PlGF (Placenta Growth Factor) [86]. Le VEGF-A qui est couramment appelé VEGF, est le plus abondant des isoformes [83]. Il intervient dans l’angiogenèse en augmentant la migration des cellules endothéliales, la mitose des cellules endothéliales, l’activité des métalloprotéinases, l’activité de αvβ3, ainsi qu’en participant à la création de la lumière des vaisseaux sanguins. De plus, il a un effet chimiotactique sur les macrophages et les granulocytes, et participe à la vasodilatation. Le VEGF-B participe à l’angiogenèse embryonnaire. Le VEGF-C et le VEGF-D participe principalement à la lymphangiogenèse. Puis, le PlGF est important dans la vasculogenèse, mais également dans l’angiogenèse au cours de certaines figure de cas tel qu’une ischémie, une inflammation, une guérison de plaie ou un cancer [87].
Dans le cadre de certaines pathologies entrainant une hypervascularisation causée par un dérèglement de l’angiogenèse, les traitements privilégiés vont être l’utilisation des anti-VEGF pour ralentir la néo-vascularisation. Il joue également un rôle important dans la formation de l’angiogenèse dans le cadre de la guérison des plaies [88].
Les récepteurs au VEGF sont caractérisés par leur partie extracellulaire qui est composée de 7 domaines semblables aux immunoglobulines, c’est donc également une sous famille des récepteurs à tyrosine kinases. Il existe trois types de récepteurs au VEGF, le VEGFR-1, le VEGFR-2 et le VEGFR-3. L’activation du récepteur VEGFR-1 permet l’activation de la migration cellulaire mais n’induit pas la prolifération cellulaire [89]. En revanche le récepteur VEGFR-2 joue un rôle important dans la différenciation des cellules endothéliales, et est également important lors de la formation de nouveaux vaisseaux sanguins [90]. Le VEGFR-3 est seulement exprimé par les vaisseaux lymphatiques [91].
22
1.3.3.2 Le bFGF
Le bFGF (basic Fibroblast Growth Factor) est un facteur de croissance sécrété par plusieurs types cellulaires, les cellules endothéliales, les fibroblastes, les kératinocytes ainsi que les cellules inflammatoires. Il permet d’induire la différenciation et la prolifération des cellules endothéliales [92, 93] et active la croissance des fibroblastes et des kératinocytes dans la guérison des plaies par exemple [94]. De plus, des études ont montrées que le bFGF était capable d’augmenter le niveau d’expression du VEGF lors de l’angiogenèse [95].
Il y a quatre récepteurs du bFGF, FGFR-1 à 4, le FGFR-1 et le FGFR-2 sont exprimés par les cellules endothéliales [93].
1.4 Plaies cutanées
La guérison des plaies cutanées est un processus très important pour permettre de maintenir l’homéostasie cutanée. Lorsque la peau est lésée, l’organisme devient plus sensible au milieu extérieur, aux agressions mécaniques, chimiques ou aux infections, d’où la nécessité de rétablir rapidement la barrière épidermique [96].
1.4.1 Différents types de plaies
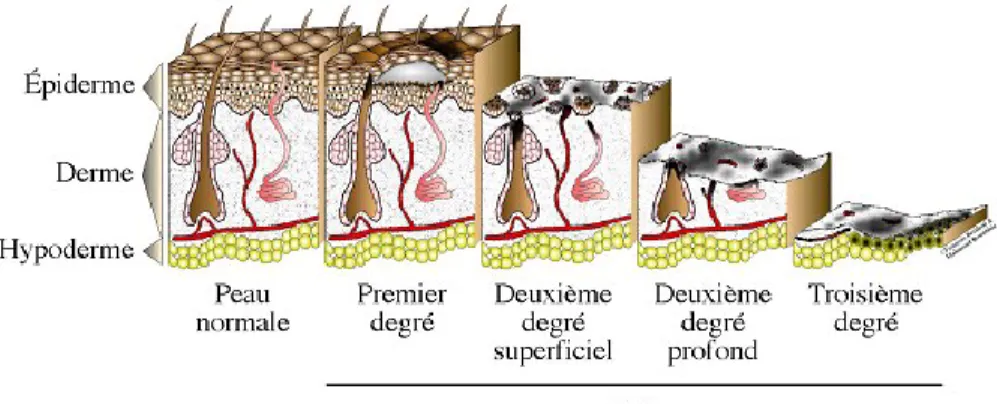
Il existe trois niveaux de gravité d’une plaie, d’abord les plaies de premier degré qui atteignent seulement l’épiderme, lors d’une légère brulure par exemple.
Les plaies du deuxième degré, il en existe deux types, les superficielles et les profondes. Lors des plaies du deuxième degré superficiel, la plaie atteint le derme papillaire alors que les plaies profondes vont toucher le derme jusqu’à la région réticulaire.
Les plaies les plus profondes sont appelées des plaies du troisième degré. Elles se traduisent par la destruction du derme et de l’épiderme, ainsi que des terminaisons nerveuses, ces types de plaies peuvent avoir lieu suite à une brulure importante ou à une coupure profonde (Fig. 11).
23 Outre le niveau de gravité des plaies, elles peuvent également être classées en deux autres catégories, les plaies chroniques et les plaies aiguës. Les plaies chroniques surviennent souvent suite à certaines pathologies telles que la mauvaise circulation sanguine ou le diabète. Ce sont des plaies qui auront de la difficulté à cicatriser et souvent le temps de cicatrisation sera prolongé. Alors que les plaies aigües sont plus particulièrement causées par un événement précis sur un sujet sain, tel qu’une coupure ou une brulure [97].
1.4.2 Guérisons des plaies
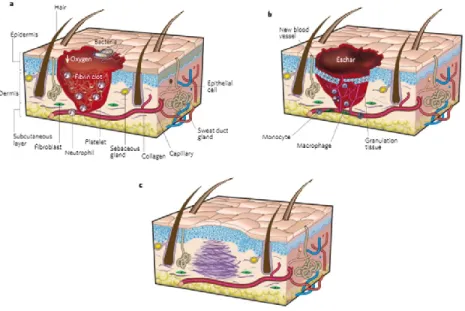
Physiologiquement, il existe trois phases distinctes au cours de la guérison des plaies. La phase inflammatoire, la phase proliférative, et la phase de maturation (épithélialisation et remodelage) (Fig. 12) [98-100].
La première étape, la phase inflammatoire aussi appelé phase de détersion, se déroule immédiatement après un dommage au niveau d’un tissu. Cette phase permet d’éliminer les tissus nécrosés. Au cours de cette étape, suite à une cascade de coagulation, un caillot de plaquette va se former au niveau de la plaie ainsi qu’une matrice de fibrine servant par la suite d’échafaudage pour la migration des cellules sur la zone de blessure. La thrombine, intervenant dans la formation du caillot plaquettaire, ainsi que l’IL1, participant à l’activation de l’inflammation, participent à l’activation de facteurs de croissance tel que PDGF (Platelet-derived Growth Factor). Le PDGF ainsi que plusieurs autres facteurs intervenant lors de l’inflammation ont une
Figure 11 : Types de plaies cutanées (Source : Dr François Berthod)
24
action sur la vasodilatation et la perméabilité des vaisseaux sanguins cutanés. Les neutrophiles vont ensuite être recrutés dans la plaie, par l’activation du complément et la dégranulation des plaquettes ainsi que la présence des produits de dégradation bactériennes [101]. Les monocytes sont recrutés par chimiotactisme au niveau de la plaie puis différenciés en macrophage grâce à la libération de cytokines (IL-1, TNF-α, TGF-β…) par les plaquettes [102]. L’interleukine-1 joue un rôle majeur dans la guérison d’un tissu. Il va être libéré par les neutrophiles et par les kératinocytes lésés, permettant le recrutement de chemokine et autres médiateurs inflammatoires au niveau de la plaie, comme IL-8 [103].
La deuxième étape, la phase proliférative, permet la formation d’un nouveau tissu de granulation. Les macrophages ainsi que différents facteurs tel que le VEGF, bFGF, l’IL-1, TNF-α, TGF-β, PDGF, induisent la formation de la MEC servant de support pour la formation du tissus de granulation. Ces facteurs vont également permettre la prolifération et la migration à partir des bords de la plaie de deux types cellulaires, les fibroblastes et les cellules endothéliales. Les fibroblastes vont s’insérer dans la MEC et permettre la formation du tissu de granulation. Une fois ce tissu formé, la MEC dans la plaie va être détruite pour laisser place à une matrice formé par les fibroblastes [98]. La prolifération des cellules endothéliales permet la néovascularistation au niveau de la plaie, favorisé par l’hypoxie tissulaire présente sur le site lésé.
La troisième étape correspond à la phase de contraction, d’épithélialisation et de remodelage. C’est une phase de maturation, il va y avoir une accumulation de collagènes et une réorganisation des paquets de fibres de collagènes [29, 101, 102, 104]. Les fibroblastes formant le tissu de granulation se différencie en myofibroblastes. Cette différenciation est activée par une molécule, l’α-actine muscle lisse, permettant le rapprochement des bords de la plaie et sa contraction. Les kératinocytes vont ensuite proliférer et migrer à partir des bords sains de la plaie. La phase de remodelage de la cicatrice, aussi appelé phase de résolution se met en place. Le tissu de granulation et les cellules qui ont participées à la guérison de plaie, comme les macrophages et les myofibroblastes, rentrent en apoptose et quittent la plaie. Le nombre de capilaire diminue au cours du remodelage de la cicatrice. Les molécules interagissant entre les cellules neuronales et les cellules de la peau participent à la guérison des plaies cutanées [10]. Il a été montré que la dénervation de la peau affecte directement plusieurs phases de la guérison des plaies et entraine une mauvaise guérison [105-107]. De plus, la substance P favorise la
25 guérison des plaies dans un contexte pathologique comme le diabète [108] mais également dans un modèle sain [109]. La libération de la substance P par les neurones sensoriels cutanés au cours de la guérison des plaies va permettre d’activer les kératinocytes pour qu’ils puissent produire des cytokines et autres facteurs pro inflammatoires comme IL1-a [110].
1.4.3 La réépithélialisation
L’épiderme a une fonction de barrière très importante pour protéger l’organisme [1]. La réépithélialisation, suite à une plaie par exemple, est donc un mécanisme essentiel au cours de la guérison car il permet de redonner à la peau sa fonction de protection de l’organisme, en évitant ainsi les risques d’infections au cours de la guérison cutanée complète. Elle s’effectue donc dans les heures suivant la lésion [111]. Suite à la plaie, un caillot de fibrine va se développer pour reformer rapidement une barrière, par la suite les kératinocytes situés sur les bords de la plaie vont migrer le long du lit de celle-ci, ils vont alors proliférer pour former un nouvel épithélium. La morphologie des kératynocytes change, ils perdent leur polarité et deviennent plus allongés et aplatis, ils débutent ensuite leur migration. Les cellules participant à la réépithélialisation sont
Figure 12 : Étapes de guérisons des plaies
(Source: Grose, R. and S. Werner, Wound-healing studies in transgenic and knockout mice. Mol Biotechnol, 2004. 28(2): p. 147-66)
26
issues de la couche basale de l’épiderme mais également des cellules souches présentent au niveau des follicules pileux [111, 112].
1.5 La réaction de Maillard
1.5.1 La glycation
La glycation est aussi appelée réaction de Maillard du nom du scientifique Louis Camille Maillard qui la décrite pour la première fois en 1912 [113]. C’est une réaction biochimique non enzymatique permettant l’addition d’un sucre de type aldéhyde ou cétone sur un groupe ε-amino d’un résidu lysine et sur un groupe α-amino du N-terminal d’une protéine [114]. À ne pas confondre avec la glycosylation qui est l’addition d’un sucre de manière enzymatique à une protéine.
Au cours de la glycation, il existe deux étapes importantes. La première étape intervient rapidement, elle consiste à l’interaction des sucres réduits comme le glucose avec un groupement amine libre sur le N- terminal d’un résidu lysine et d’un résidu arginine des protéines. Une base de Schiff va alors être formée, à partir de laquelle des produits d’Amadori seront synthétisés. Cette première réaction est réversible jusqu’à la formation des produits d’Amadori et sera dépendante de la concentration de chacun des composés de la réaction. La seconde étape en revanche est plus tardive et est irréversible. Elle amène, après une série de déshydratation, de condensation, d’hydrolyse, d’oxydation et de cyclisation, à la formation d’Advanced Glycation End-product (AGE). Le processus de glycation altère l’activité biologique des protéines. La réaction de Maillard se divise en plusieurs voies de réduction d’un sucre, par exemple le glucose (Fig. 13).
La glycation est souvent induite par des conditions pathologiques provenant d’un stress oxydatif, augmentant la quantité de protéines glyquées par cette réaction, par ailleurs, le stress oxydatif est dépendant de la quantité d’AGEs formés [115].
27 La cytotoxicité induite par la glycation est due à 3 mécanismes principaux. D’abord la glycation entraine l’inhibition des fonctions spécifiques des protéines, puis la formation de réticulation, d’agrégation et de précipitation des protéines, et enfin elle entraine la production de molécule réactive à l’oxygène [116].
1.5.2 Les Advanced Glycation Endproducts (AGEs)
Les AGEs formés lors de l’étape tardive de la réaction de glycation sont en parti caractérisés. Les
plus caractéristiques de cette réaction vont être le Nε-(carboxymethyl)lysine (CML) [117, 118],
le Nε-(carboxyethyl)lysine (CEL) [119], le pentosidine [120, 121], le pyrraline [122], et l’imidazolone [123].
Le récepteur des AGEs, RAGE (receptor for AGE), fait partie de la famille des immunoglobulines des molécules de surface cellulaire. Ce récepteur est exprimé dans un grand
Figure 13 : Schéma de la réaction de Maillard à partir d'une molécule de glucose.
(Source : Kikuchi, S., et al., Glycation--a sweet tempter for neuronal death. Brain Res Brain Res Rev, 2003. 41(2-3): p. 306-23)
28
nombre de cellules différentes, comme les cellules endothéliales, les cellules musculaires lisses, les phagocytes mononucléaires et les neurones [116]. Le récepteur des AGEs peut être régulé dans beaucoup de types cellulaires par différents facteurs diabétiques comme le glucose, l’insuline, les AGEs, et les espèces réactives à l’oxygène (ROS) [124-127]. La formation d’AGE est possiblement inhibée par un inhibiteur spécifique, l’aminoguanidine [128].
1.5.2.1 Produit de fin de glycation : le CML et le CEL
Le CML peut être produit à partir de voies diverses. Soit à partir du fructose-lysine, un des produits d’Amadori, par coupure oxydative [129], soit à partir du glyoxal formé par autoxydation du glucose [130], soit d’un glycolaldehyde formé à partir d’un produit de base de Schiff [131]. Le CML est un produit de glycoxidation, en effet, il se forme à partir de sucre et de protéines qui demande une réaction de glycation et des réactions d’oxydation pour se former [132]. Par ailleurs, outre le glucose, certains acides gras insaturés sont également source de CML comme l’acide oleic ou l’acide linoleic. De plus une étude aurait émis l’hypothèse que le CML serait plutôt un marqueur d’oxydation plutôt que de glycation [117]. En revanche, le niveau de CML dans le sérum reste un marqueur de complications diabétiques [133].
Le CEL est formé au cours de la réaction de Maillard, à partir du méthylglyoxal comme produit intermédiaire de glycation [119]. Néanmoins il peut se former également à partir du triose phosphate, ainsi que d’autres sucres. Par ailleurs, le CEL s’accumule au niveau des protéines de l’œil avec l’âge. La concentration de CEL dans les tissus est un biomarqueur couramment utilisé pour confirmer le niveau de stress oxydatif.
1.5.3 Produit de glycation intermédiaire : Le glyoxal et méthylglyoxal
Même si le glucose est un sucre réduit, il faut attendre une période d’incubation importante pour obtenir la formation d’AGEs [121]. Pour pouvoir étudier la glycation sur des périodes plus courte, des produits de glycation intermédiaire comme le méthylglyoxal [134] ou le glyoxal on été utilisés. Dans la littérature, le glyoxal et le méthylglyoxal semblent intéressant parmi les dicarbonyls intracellulaires existant, pour la formation final de CEL et CML [135, 136].
29
1.5.4 Le Diabète et la neuropathie diabétique
Le diabète est une maladie liée au dysfonctionnement de la régulation de la glycémie entrainant une hyperglycémie. Il existe deux types de diabètes principaux, le diabète de type 1, appelé également diabète insulinodépendant qui est lié à une maladie auto-immune ayant pour conséquence la destruction par le système immunitaire des cellules β des ilots de Langerhans du pancréas, ne produisant alors plus d’insuline dans le sang. Le diabète de type 2, appelé non-insulinodépendant survient suite à une obésité ou un excès pondéral important, les cellules ne sont plus sensibles à l’insuline pour réguler le taux de sucre dans le sang à cause de l’hyperglycémie constante.
Certaines complications diabétiques sont dues à un manque de sensibilité au niveau des extrémités des patients plus particulièrement au niveau des pieds. Ce manque de sensibilité ainsi que les autres complications diabétiques sont certainement causé par l’hyperglycémie, entrainant une toxicité au niveau des neurones sensoriels et des autres cellules impliquées dans la guérison des plaies. En effet, l’hyperglycémie va entrainer la réaction de Maillard, formant alors des AGEs qui vont être la cause de ces complications. En plus d’être responsable des complications diabétiques, les AGEs sont aussi associés au changement lié au vieillissement. Le diabète est le
problème de santé majeur du 21ème siècle et est en constante augmentation. Des études ont estimé
que le nombre de patients diabétiques augmenterait entre 2000 et 2030 pour passer de 171 millions à 366 millions [137]. Au canada, entre 1998 et 2008, le nombre de cas diabétique diagnostiqué a augmenté de 70 % [138]. Les ulcères au niveau des pieds des patients diabétiques sont causés par différents facteurs au cours de son développement. Tout d’abord des neuropathies vont atteindre les fibres sensorielles, les fibres vasomotrices et autonomiques entrainant la perte progressive de sensation au niveau des extrémités inferieures, couplés à la déformation osseuse entrainant de forte pression au niveau de la voute plantaire et à une altération de la régulation du flux sanguin cutané.
Sur le nombre de patients diabétiques ayant des ulcères au niveau des extrémités inférieurs, 20 % ont également un mauvais débit sanguin, 50 % ont une neuropathie, et 30 % sont atteints de ces deux types de complication [139].