Impacts des conditions environnementales sur la
nitrification, l’assimilation et l’ammonification dans
l’Arctique canadien
Mémoire
Gabrièle Deslongchamps
Maîtrise en Biologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Gabrièle Deslongchamps, 2014
Résumé
Les principaux objectifs du présent mémoire étaient de quantifier les distributions horizontales et verticales des flux azotés dans différents secteurs de la baie de Baffin et de la mer du Labrador ainsi que d’évaluer la réponse de ces processus à diverses perturbations expérimentales (exposition à la lumière, baisse de pH et enrichissement en ammonium) représentatives des changements actuellement observés dans l’océan Arctique. Contre toutes attentes, les flux azotés ont montré une réponse mineure aux traitements, impliquant toutefois une diminution locale de la nitrification en présence de lumière dans un secteur caractérisé par une fraction supérieure d’eau d’origine Atlantique. Ce dernier résultat suggère une réponse différentielle de la nitrification aux changements de régime lumineux résultant de la fonte des glaces. Les conclusions découlant de cette étude ont contribué à l’amélioration de notre compréhension du cycle de l’azote dans un contexte de changements climatiques rapides.
Table des matières
Résumé ... iii
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... ix
Remerciements ... xi
Avant-propos ... xiii
1. Introduction générale ... 1
1.1 Mise en contexte ... 1
1.2 Le cycle de l’azote marin ... 1
1.2.1 Les différentes formes d’azote ... 2
1.2.2 Les étapes du cycle de l’azote ... 2
1.3 Problématique ... 4
1.3.1 Nutrition azotée et concept de production nouvelle et régénérée ... 4
1.3.2 Interactions entre la nitrification, l’assimilation et l’ammonification ... 4
1.3.3 Émission de GES ... 5
1.4 Impacts des facteurs environnementaux sur le cycle de l’azote ... 5
1.4.1 Disponibilité en lumière ... 6 1.4.2 Acidification ... 7 1.4.3 Enrichissement en ammonium ... 8 1.5 Hypothèses et objectifs ... 10 1.5.1 Hypothèses ... 10 1.5.2 Objectifs ... 11
2. Impacts of environmental conditions on nitrification, ammonium uptake and ammonification in Baffin Bay and Labrador Sea ... 13
2.1 Résumé ... 13
2.2 Abstract ... 14
2.3 Introduction ... 15
2.4 Materials and Methods ... 17
2.4.1 Study area and sampling design ... 17
2.4.2 Nitrogen fluxes ... 18 2.4.3 Nutrients ... 20 2.4.4 Other measurements ... 20 2.4.5 DIN extractions ... 21 2.4.6 Mass spectrometry ... 21 2.4.7 Calculations ... 22
2.4.8 Nomenclature, data handling and statistical analyses ... 23
2.5 Results ... 24
2.5.1 General ... 24
2.5.2 Vertical distribution of N cycling rates in the dark ... 24
2.5.3 Horizontal distribution of N cycling rates in the dark ... 28
2.5.4 Response of N cycling rates to experimental treatments ... 29
2.5.5 Principal component analysis ... 30
2.6 Discussion ... 33
2.6.2 Substrate availability and competitive interactions between nitrification and uptake 34 2.6.3 Temperature effect ... 35 2.6.4 Ocean acidification ... 36 2.7 Conclusion ... 37 3. Conclusions générales ... 39 4. Références bibliographiques ... 43 5. Annexe A ... 53
Liste des tableaux
Table 2.1 Environmental variables measured at stations where vertical profiles of N fluxes were assessed. Z: depth, T: water temperature, S: salinity, pH1: in situ pH measured before incubation, Chl a: chlorophyll a concentration, NH4+: ammonium concentration, NO3-: nitrate concentration,
NO2-: nitrite concentration, % PW: percentage of Pacific water. ... 25
Table 2.2 Environmental variables at stations where experimental treatments were assessed. Z: depth, T: water temperature, S: salinity, pH1 : in situ pH measured before incubation, pH2 : pH after the addition of HCl + NaHCO3, pH3 : pH after 24 h incubation, Chl a: chlorophyll a
concentration, NH4+: ammonium concentration, NO3-: nitrate concentration, NO2-: nitrite
concentration, % PW: percentage of Pacific water. No SCM (higher chl a concentrations) was detected at stations 137, 138 and 140. ... 26 Table 2.3 Threshold of significance of environmental variables on the vertical and horizontal distributions of nitrification (Nr), NH4+ uptake (ρ) and ammonification (Ar) rates measured in
dark. PAR: ambient light expressed as photosynthetic active radiation, Z: depth, T: water temperature, S: salinity, Chl a: chlorophyll a concentration, NH4+: ammonium concentration,
NO3-: nitrate concentration, NO2-: nitrite concentration, r2: regression coefficient of the model, ns:
not significant. ... 29 Table 2.4 Pearson correlation coefficients (r) between dark rates of nitrification, NH4+ uptake and
ammonification on vertical and horizontal distributions. ... 29 Table 2.5 Nitrification rates and environmental parameters reported in the upper ocean (< 50 m) from other studies. NA: data not available. ... 36
Liste des figures
Figure 1.1 Schématisation simplifiée du cycle de l’azote en milieu marin. AO : azote organique (inclus l’azote organique particulaire et dissout); DNRA : réduction dissimilatrice du NO3- en
NH4+. ... 3
Figure 1.2 Équilibre chimique entre les formes ammoniac (NH3) et ammonium (NH4+) en milieu
marin en fonction du pH du milieu. Figure modifiée à partir de Sawyer and McCarty (1978). ... 8 Figure 2.1 Location of the sampling stations in Baffin Bay and Labrador Sea in the Canadian Arctic during fall 2012. The western side (Canada) of the region is influenced by Pacific-derived water from the central Arctic while the eastern side (Greenland) is characterized by a higher proportion of Atlantic-derived water. Yellow symbols indicate stations where vertical distributions of N fluxes were measured and red symbols indicate stations where experiments were performed, for a total of 11 samplings at 10 locations (St 133 sampled twice). ... 18 Figure 2.2 Flow diagram of the procedures used to obtain rates of nitrification, NH4+ uptake and
ammonification rates with the 15N tracer method. The isotopic enrichment of the 15N-NH4+ pool
was assessed by the diffusion method (Slawk and Raimbault 1995) while the enrichment of the
15N-NO
3- pool was assessed by the denitrifier method (Sigman et al. 2001). ... 19
Figure 2.3 Vertical distribution of physico-chemical variables (temperature in red, NH4+
concentration in blue and NO3- concentration in green) and dark rates of nitrification, NH4+
uptake and ammonification (nmol l-1 d-1) in (A) Atlantic derived-water (St 133), (B) Pacific-derived-water (St 147) and (C) a mixture of both water types (St 117). Note that the y-axes use the logarithmic scale. Error bars provide the standard deviation of triplicates. ... 27 Figure 2.4 Horizontal distribution of potential nitrification rates (nmol l-1 d-1) at the (A) surface and (B) SCM. Nitrification rates in surface water were not assessed in the northern part of BB. Numbers indicate the highest, lowest and intermediate nitrification rates for each depth. ... 28 Figure 2.5 Rates of nitrification, NH4+ uptake and ammonification (nmol l-1 d-1) in the different
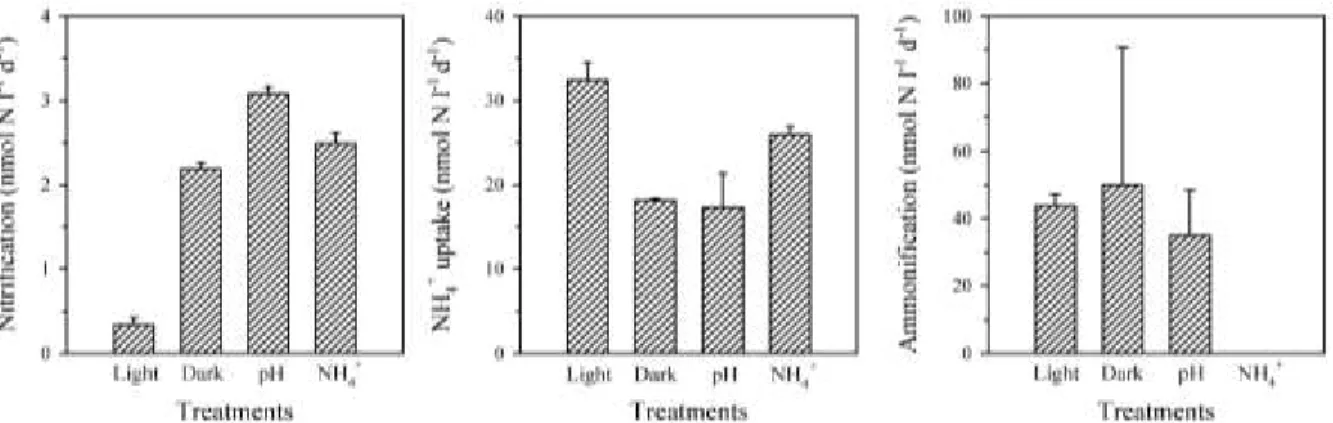
experimental treatments (light, darkness, reduced pH + darkness, and enriched NH4+ + darkness)
at the surface of station 137. Error bars indicate triplicate standard errors. ... 30 Figure 2.6 Responses of nitrification, NH4+ uptake and ammonification to treatments for samples
originating from the surface (circles) and the SCM (squares) at experimental stations. For each N cycling step, dark rates are plotted against rates measured (A) in the light (B) under reduced pH in the dark and (C) under enriched NH4+ in the dark. Black symbols allow to track stations 137
and 138, the only ones for which nitrification rates were substantially and statistically (P < 0.05) higher in the light than in the dark (red ellipse), on the other graphs. Error bars indicate triplicate standard errors. ... 31 Figure 2.7 Principal component analysis (PCA) centered and reduced for stations where surface and SCM nitrification rates were measured. (A) PCA factor loadings plot, (B) associated repartition of stations and (C) histogram of eigenvalues. The orientation of the vectors relative to each other indicates the correlation, anti-correlation and independence between variables. Variables are correlated when their vectors have similar direction and anti-correlated when the
direction are opposite. Vectors with perpendicular direction indicate independence between the variables. The red ellipse refers to stations (St 137 and 138) where nitrification rates were higher in darkness than in the light treatment (see Fig. 2.6a). ... 32 Figure 2.8 Relationship between (A) the relative responses of nitrification and NH4+ uptake to
the light-dark treatment and (B) nitrification rate and specific NH4+ uptake rate in the light
treatment. In (A) the response is calculated in a mirror fashion for nitrification (dark/light) and uptake (light/dark) since those should covary positively and in a 1:1 ratio under strict interference competition (dotted line). Black symbols refer to stations 137 and 138. The size of the symbols on both graphs refers to NH4+ concentrations (µmol l-1 d-1). ... 32
Remerciements
Je tiens à remercier toutes les personnes qui se sont impliquées au cours des nombreuses étapes ayant mené à l'aboutissement de ce projet. Je remercie en premier lieu mon directeur de recherche, Jean-Éric Tremblay, pour m’avoir épaulé tout au long de mes travaux de recherche ainsi que de m’avoir permis de réaliser cette expérience enrichissante, tant au niveau professionnel que personnel. Je tiens également à souligner l’aide précieuse de Jonathan Gagnon qui m’a aidé pendant plusieurs étapes de mes travaux allant de la préparation des missions, l’échantillonnage sur le terrain ainsi que l’analyse des données. Je remercie aussi Julie Granger ainsi que sa professionnelle de recherche, Lija Treibergs, qui m’ont assisté et hébergé lors d’un stage à l’Université du Connecticut durant lequel j’ai analysé une grande partie de mes échantillons.
Un merci spécial à toutes les autres personnes qui m’ont assisté pendant mon travail sur le terrain, entre autres, Amandine Lapoussière et Sylvain Blondeau, ainsi qu’à l’équipage du Henri Larsen et les membres du Ministère des Pêches et Océans Canada qui, malgré quelques difficultés techniques, m’ont permis d’obtenir toutes les données qui sont présentées dans le présent manuscrit. Je tiens aussi à remercier Stephen Punshon et Melissa Wartman pour l’analyse des données de pH, Christine Michel pour l’analyse des données de chlorophylle a ainsi que Patrick Raimbault, Nicolas Schiffrine, Alexandre Forest et Josiane Mélançon pour leur aide indispensable pour l'achèvement des calculs et des analyses statistiques.
Ces remerciements ne sauraient être complets sans mentionner le support de mes amis, qui ont été de fidèles compagnons pendant toutes ces soirées passées à étudier et à rédiger mon mémoire, et de ma famille, qui m’a toujours supporté. Votre présence a grandement contribué à ma motivation et ma persévérance tout au long de ma maîtrise. Merci aussi à mes collègues de bureau, Jean-Sébastien et Jonathan, avec qui j’ai partagé mes différents états d’âme durant les dernières années.
Cette recherche a été supportée financièrement par le Conseil de recherches en sciences naturelles et en génie (CRSNG), par ArcticNet et par les subventions du Fond québécois de la recherche sur la nature et les technologies (FQRNT) à Québec-Océan.
Avant-propos
Le présent mémoire expose les travaux de recherche effectués au cours de ma maîtrise, laquelle fut réalisée sous la supervision du Professeur Jean-Éric Tremblay. Le manuscrit comporte trois chapitres, dont une introduction et une conclusion générales. Le corps du mémoire, le deuxième chapitre, est présenté sous forme d'article scientifique rédigé en anglais qui sera soumis sous peu à la revue « Marine Ecology Progress Series ». Les noms des personnes ayant contribué à la réalisation de ce dernier chapitre sont inscrits à la liste des coauteurs de l’article scientifique. Plus exactement, ces coauteurs sont, dans l'ordre : Jean-Éric Tremblay1, Jonathan Gagnon1, Julie Granger2 et Lija Treibergs2.
J'ai personnellement participé à chacune des étapes ayant mené à ce produit final, depuis la planification des missions en mer et la préparation du matériel jusqu'à l'écriture entière du présent manuscrit. L’intégralité de mes données a été récoltée au cours d’une mission en mer d’une durée de six semaines à bord du Henry Larsen à l’automne 2012. J'ai également accompli la majorité des analyses en laboratoire avec l’aide de Jonathan Gagnon (professionnel de recherche du laboratoire) avant de procéder à l'analyse et à l'interprétation des résultats et d'entamer, finalement, le processus rédactionnel.
Au cours de ma maîtrise, j’ai également eu le privilège de participer à trois autres missions en mer à bord de l’Amundsen à l’été 2013 (Arctique canadien) et à bord du Helmer-Hanssen à l’hiver et au printemps 2014 (Arctique norvégien). Ces missions ont été pour moi une occasion unique d’acquérir de nouvelles compétences et expériences de travail. J’ai aussi eu la chance de participer à sept congrès tant à l’échelle provinciale, canadienne, qu’internationale. Au cours de ces divers congrès, j’ai présenté mes données à trois reprises sous forme d’affiches scientifiques et deux fois sous forme de présentations orales. Encore une fois, je remercie mon directeur de recherche pour m’avoir offert la possibilité de participer à toutes ses expériences.
1 Département de biologie et Québec-Océan, Université Laval, 1045 Avenue de la médecine, Québec, Québec G1V
0A6, Canada.
2 Department of Marine Sciences, University of Connecticut, 1080 Shennecossett Road, Groton, Connecticut, USA,
1. Introduction générale
1.1 Mise en contexte
Les changements climatiques associés à l’augmentation importante des concentrations de gaz à effet de serre, notamment le dioxyde de carbone (CO2), sont susceptibles d’affecter plusieurs
processus biologiques. Des études ont montré une augmentation de 0,6 °C de la température moyenne à l’échelle mondiale au cours des deux derniers siècles (ACIA 2005). La Terre a déjà connu d’autres périodes de réchauffement, mais la rapidité de celle que nous vivons présentement est préoccupante (Miller 2004), particulièrement dans l’Arctique où la fonte accélérée des glaciers et la diminution du couvert de glace ont des répercussions locales et globales importantes sur le niveau des océans et, probablement, sur certains grands cycles biogéochimiques. À cet effet, les perturbations du cycle de l’azote pourraient avoir un impact majeur étant donné sa relation étroite avec la productivité biologique et le cycle du carbone (Capone 2008). Il est bien démontré que l’azote est une ressource limitante dans plusieurs régions océaniques, incluant l’Arctique (Eppley et al. 1969; Caperon et Meyer 1972; McCarthy et Goldman 1979; Tremblay et Gagnon 2009). Les microorganismes marins jouent un rôle capital puisqu’ils sont impliqués dans toutes les étapes du cycle de l’azote (Ward 1986; Arrigo 2005) et que les autotrophes sont responsables de la moitié de la production primaire globale (Behrenfeld et al. 2006). Des fluctuations de la quantité totale d’azote et de la forme chimique sous laquelle on le retrouve pourraient affecter la production primaire, le type d’organisme qui l’effectue, ainsi que la production de l’oxyde nitreux (N2O), un puissant gaz à effet serre.
1.2 Le cycle de l’azote marin
Le cycle de l’azote à travers les différents réservoirs environnementaux est influencé par plusieurs facteurs physiques, chimiques et biologiques (Chapin et al. 2004). L’activité humaine et les nombreux facteurs naturels qui interviennent dans le cycle de l’azote rendent son étude complexe d’un point de vue biogéochimique.
1.2.1 Les différentes formes d’azote
L’azote gazeux (N2) est une molécule très stable qui nécessite l’action d’enzymes spécialisées
pour être fixée, brisée puis assimilée. Les autres formes d’azote inorganique utilisables sont dites « fixées » et, bien que disponibles pour un plus grand éventail d’organisme, sont généralement peu abondantes dans la couche de surface de l’océan. Le nitrate (NO3-) correspond à l’état le plus
oxydé de l’azote. C’est la forme dominante d’azote biologiquement disponible dans les couches intermédiaires et profondes bien oxygénées. Les organismes doivent toutefois le réduire en nitrite (NO2-) puis en ammonium (NH4+) avant de l’assimiler. Le NO2- est un produit intermédiaire du
cycle. Il a une très courte durée de vie et est généralement toxique (Brandes et al. 2007). Le NH4+
est, à l’opposé du NO3-, la forme la plus réduite de l’azote et la moins coûteuse à assimiler d’un
point de vue énergétique (McCarthy et al. 1977; Glibert et al. 1982). Pour cette raison, le NH4+
est souvent préféré par le phytoplancton et les autres microorganismes marins malgré la prédominance du NO3- (Dortch 1990; Song et Ward 2007). Bien que le NH4+ soit généralement
moins abondant, il peut dominer dans les milieux pauvres en oxygène ou affectés par l’activité humaine. On retrouve aussi l’azote dans la matière organique dissoute (AOD) et particulaire (AOP). L’AOD est un mélange complexe de composition très variée alors que l’AOP est principalement associée aux organismes, au détritus et aux sédiments (McCarthy et al. 1998). Il existe d’autres composés azotés intermédiaires pouvant jouer des rôles clés (ex : N2O), mais
ceux-ci sont généralement très peu abondants (Gruber 2008).
1.2.2 Les étapes du cycle de l’azote
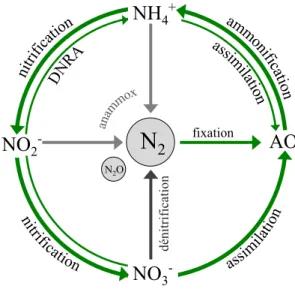
Le cycle de l’azote peut être divisé en quatre principales étapes : la fixation de l’azote, l’ammonification (ou régénération de NH4+), la nitrification et la dénitrification (Fig. 1.1). En
milieu océanique, l’azote entre dans le système via plusieurs mécanismes (précipitations, ruissèlement d’origine terrestre ou encore dépôt atmosphérique et solubilisation dans l’océan) ainsi que sous différentes formes (Capone 2008). Bien qu’étant la forme dominante en milieux océaniques, le N2 n’est pas directement utilisable pour la plupart des organismes (Sharp 1983).
Le principal mécanisme permettant la conversion du N2 en une forme biologique assimilable est
la fixation par les cyanobactéries diazotrophes (Zehr et al. 2000). Seulement quelques espèces de procaryotes, incluant des bactéries photosynthétiques (cyanobactéries), sont capables de réduire
le N2 en NH4+, qui peut par la suite être assimilé dans les acides aminés, purines, glucoses ou
autres métabolites (Miller 2004; Cabello et al. 2004). L’ammonification comprend tous les processus par lequel l’azote organique est transformé en NH4+ (décomposition bactérienne,
excrétion par le zooplancton, etc.). Ce processus permet de remettre l’azote sous sa forme la plus facilement assimilable en circulation. Le NH4+ peut alors être assimilé par différents organismes
ou encore nitrifié, c’est à dire oxydé en NO2- puis en NO3- par l’action de bactéries marines
chimioautotrophes. La première et la seconde oxydation sont réalisées par des bactéries du groupe Nitrosomonas et du groupe Nitrobacter, respectivement (Gruber 2008). En plus des bactéries nitrifiantes, certaines archées contribuent également à l’oxydation du NH4+ (Ward
2008). Le NO3- peut alors être assimilé par les organismes ou retourné en N2 via la dénitrification
qui se déroule en milieu anoxique, soit dans les eaux profondes et le sédiment. Les bactéries dénitrifiantes effectuent une chaine de réduction afin d’utiliser les groupements oxygènes attachés au NO3- pour décomposer (respirer) la matière organique (Arrigo 2005). L’oxydation
anaérobique du NH4+ (annamox) est un processus découvert récemment (Mulder et al. 1995), qui
s’ajoute à la dénitrification pour permettre le retour de l’azote en N2 (Ward et al. 2007). Une
partie de l’azote qui entre dans les réactions de nitrification et de dénitrification est libéré dans l’atmosphère sous forme de gaz à effet de serre, le N2O (Gruber 2008).
Figure 1.1 Schématisation simplifiée du cycle de l’azote en milieu marin. AO : azote organique (inclus l’azote organique particulaire et dissout); DNRA : réduction dissimilatrice du NO3- en NH4+.
NO
3-NH
4+N
2 N2O dé ni tr if ic at io n fixationNO
2-AO
1.3 Problématique
En Arctique, le couvert de glace saisonnier et les apports importants d’eau douce ou relativement peu salée par les fleuves et l’océan Pacifique maintiennent une stratification verticale importante qui limite le mélange des eaux et, par le fait même, l’apport de NO3- en surface (Carmack et
Wassmann 2006; Tremblay et al. 2008). Dans les eaux de surface pauvres en azote, les processus microbiens qui affectent le recyclage et la transformation des nutriments sont reconnus pour être d’une importance capitale pour soutenir la croissance du phytoplancton et l’écosystème pélagique (Harrison 1980). En région polaire, toutefois, peu de choses sont connues sur ces processus, leur réponse aux changements du milieu ainsi que leurs impacts sur la nutrition du phytoplancton et le cycle de l’azote.
1.3.1 Nutrition azotée et concept de production nouvelle et régénérée
Le recyclage de l’azote à l’intérieur de la couche euphotique alimente la composante dite « régénérée » de la production primaire totale (i.e., quantité de carbone fixé par unité de temps et d’espace), tandis que la composante dite « nouvelle » dépend des apports d’azote provenant de l’extérieur de cette couche (Dugdale et Goering 1967; Eppley et Peterson 1979). Cet azote allochtone peut provenir de la fixation de N2 et de la remontée des eaux profondes sous forme de
NO3- (ex : évènements d’upwelling ou de mélange vertical) ou encore des précipitations et du
ruissèlement de l’azote organique et inorganique en milieu côtier (Tremblay et Gagnon 2009). En milieu océanique, on considère généralement le NH4+ comme une source d’azote recyclée,
puisqu’il est mis en circulation à l’intérieur de la zone euphotique par l’ammonification de la matière organique, et le NO3- comme une source allochtone puisqu’il est souvent absent de cette
zone et doit y être amené par des processus physiques (Ward 2008).
1.3.2 Interactions entre la nitrification, l’assimilation et l’ammonification
L’ammonification est vue comme étant la principale source d’azote recyclé (Sarmiento et Gruber 2006). Une fois disponible, le NH4+ présent dans les eaux bien oxygénées peut soit être assimilé
par les organismes marins ou oxydé par les procaryotes nitrifiants. Lorsque la nitrification se produit dans la zone euphotique, elle fournit du NO3- « recyclé » qui peut être confondu avec du
NO3- allochtone puisqu’en pratique on suppose que le NO3- provient de l’océan profond. Au-delà
de cet enjeu opérationnel, la nitrification dans toute la colonne d’eau fait le lien entre la régénération (production d’ammonium utilisable par les organismes) et la dénitrification (perte d’azote du système) (Ward 1995). Elle soutient la chimiosynthèse (production primaire procaryote), retire un peu d’azote du système en libérant un gaz à effet de serre, le N2O, et
transfère l’azote de sa forme la plus accessible à une forme oxydée coûteuse, voire même impossible à assimiler pour certains organismes photosynthétiques ne possédant pas l’enzyme nitrate réductase (ex : certaines souches de Prochlorococcus; García-Fernández et al. 2004; Martiny et al. 2009). On peut ainsi voir l’assimilation du NH4+ et la nitrification, qui sont toutes
deux assujetties à la l’ammonification, comme des processus compétitifs avec des conséquences distinctes pour la production primaire et le climat (Dortch 1990; Ward 2008). Ces trois étapes du cycle de l’azote, pour lesquelles très peu de choses sont connues dans l’Arctique, ont été étudiées plus en détail au cours du présent projet.
1.3.3 Émission de GES
Tel que mentionné précédemment, certaines étapes du cycle de l’azote (i.e., la nitrification et la dénitrification) sont associées à la libération d’un produit intermédiaire, le N2O. Ce gaz à effet de
serre, 200 fois plus puissant que le CO2, contribue actuellement à environ 6 % du réchauffement
global (Ramaswamy et al. 2001). La nitrification favorise les émissions de N2O directement et
indirectement en fournissant le substrat pour la dénitrification dans les zones dépourvues d'oxygène de la colonne d'eau et les sédiments. Ainsi, on estime que des changements dans les taux de nitrification pourraient engendrer des conséquences importantes sur le climat en modifiant les émissions de N2O dans l’atmosphère (Bange 2008).
1.4 Impacts des facteurs environnementaux sur le cycle de l’azote
Plusieurs facteurs, aussi bien physiques que biologiques, sont susceptibles d’influencer le cycle de l’azote et, plus particulièrement, les processus de nitrification, d’assimilation et d’ammonification (Hebert 1999). Dans les écosystèmes naturels, la croissance des populations de microorganismes peut être limitée par plusieurs facteurs incluant la lumière, le pH et la
disponibilité en NH4+ (Jannasch et Mateles 1974). Par ailleurs, l’historique et la biodiversité
distincte des différentes masses d’eau qui transitent dans l’Arctique peuvent également influencer ces processus azotés.
1.4.1 Disponibilité en lumière
La lumière joue un rôle important sur le cycle de l’azote dans les écosystèmes marins en stimulant l’assimilation et l’excrétion d’azote inorganique ainsi qu’en inhibant la nitrification bactérienne (Nelson et Conway 1979; Hooper et Terry 1973, 1974). Cependant, les travaux portant sur l’effet de la lumière sur la nitrification sont en apparence contradictoires. Bien qu’il existe plusieurs évidences de l’inhibition des bactéries nitrifiantes par la lumière (Ward 2008), la découverte récente de l’importance des archées nitrifiantes en milieux océaniques a suscité de nouveaux questionnements (Wutcher et al. 2006).
L’oxydation du NH4+ en NO2- puis en NO3- est réalisée à la fois par des bactéries et des archées
nitrifiantes (Miller 2004). Plusieurs études réalisées sur des cultures bactériennes en laboratoire et en milieu naturel ont montré une photoinhibition de la nitrification bactérienne (Hyman et Arp 1992). Cette sensibilité des bactéries nitrifiantes à l’inhibition par la lumière a été utilisée pour expliquer les faibles taux de nitrification souvent observés dans les eaux de surface ainsi que l’accumulation importante de NO3- dans les eaux profondes (Guerrero et Jones 1996; Horrigan et
al 1981; Olson 1981; Ward et al 1982). Puisque certaines études ont indiqué que l’oxydation du NH4+ est inhibée par la lumière, on s’attendrait à ce que la nitrification soit restreinte à la zone
aphotique et associée avec l’ammonification en profondeur (Horrigan et al. 1981; Ward 1986; Vanzella et al. 1989). Cependant, des taux de nitrification importants ont été mesurés à l’intérieur de la zone euphotique à quelques reprises (Yool et al. 2007; Ward 1987b; Dore et Karl 1996). La récente découverte de l'importance des archées, dont certaines seraient possiblement moins sensibles à l'inhibition de la lumière, pourrait expliquer la présence d’activité nitrifiante dans les eaux de surface (Church et al. 2010).
En milieu polaire, Pedneault et al. (2014) ont étudié l’expression du gène de l’ammonium monooxygénase (enzyme responsable de la première étape de la nitrification; amoA) afin de déterminer le potentiel de nitrification du groupe d’archée Crenarchaeota. L’expression d’amoA
s’est avérée positive et répandue dans la colonne d’eau, étant même souvent plus marquée près de la surface. Bien que ce résultat puisse être lié à une luminosité relativement faible dans l’Arctique (découlant de l’angle solaire bas et de la couverture de glace), l’effet de la lumière sur les taux de nitrification reste à quantifier dans cette région. Il est aussi important de noter qu’en milieu naturel, l’inhibition de la nitrification pourrait être causée par l’interférence des algues qui assimilent plus efficacement le NH4+ dans la couche euphotique, ce qui n’est pas incompatible
avec l’expression du gène amoA. Il donc probable que la nitrification soit plus importante dans la partie inférieure de la zone euphotique, où l’on retrouve également un maximum de chlorophylle
a (SCM) dans l’Arctique (Martin et al. 2010).
En modifiant la quantité de lumière atteignant la colonne d'eau, la diminution rapide de la glace de mer observée en régions polaires pourrait donc affecter le cycle de l’azote de diverses façons. Une baisse des taux de nitrification par une photoinhibition plus intense pourrait réduire la quantité d’azote disponible sous forme de NO3-, avantageant par le fait même les organismes qui
utilisent que le NH4+ comme source d’azote, en plus d’affecter les émissions de N2O vers
l'atmosphère.
1.4.2 Acidification
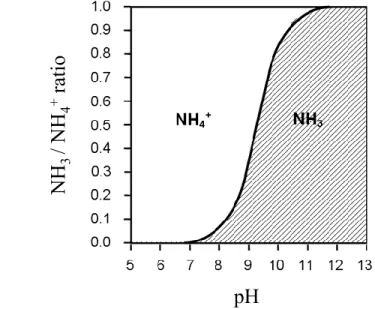
L’acidification des océans suite à la dissolution du dioxyde de carbone d’origine anthropique dans l’eau de mer pourrait avoir des répercussions importantes sur l’écologie marine et les processus biogéochimiques (Orr et al. 2005; Gattuso et al. 1997). Les résultats de l’étude de Beman et al. (2011) suggèrent que l’acidification (ou baisse de pH) pourrait affecter le cycle de l’azote en diminuant les taux de nitrification de façon importante au cours des prochaines décennies. Cette réduction résulterait d’une modification de l’équilibre chimique entre l’ammoniac (NH3) et le NH4+. Il a été démontré dans le passé que le NH3 (plutôt que le NH4+)
serait le véritable substrat de la nitrification étant donné sa plus grande affinité avec l’enzyme
amoA (Suzuki et al. 1974; Ward 1987a). Ainsi, lorsque le pH océanique baisse, une plus grande
part de l’azote se retrouve sous la forme NH4+ par rapport à la forme NH3 (Fig. 1.2), réduisant
ainsi la quantité de substrat disponible pour la nitrification et entrainant par le fait même une diminution de la contribution relative du NO3- à l’azote inorganique total. Avec l’acidification
des océans, on peut donc s’attendre à ce que l’assimilation du NH4+ augmente au détriment des
processus de nitrification et de dénitrification (Hutchins et al. 2009). Toutefois, les résultats de l’étude de Beman et collaborateurs (2011), réalisée en région relativement chaude, ne sont pas directement extrapolables aux régions froides. Étant donné la plus grande solubilité du CO2 en
milieu polaire, une acidification plus importante des eaux est prévue en hautes latitudes (Fabry et al. 2009). Aucune étude n’a encore relié les taux de nitrification, d’assimilation et d’ammonification aux gradients spatiaux de pH importants observés dans l’océan Arctique (Yamamoto-Kawai et al. 2009).
Figure 1.2 Équilibre chimique entre les formes ammoniac (NH3) et ammonium (NH4+) en milieu marin en fonction
du pH du milieu. Figure modifiée à partir de Sawyer et McCarty (1978).
1.4.3 Enrichissement en ammonium
Étant la forme d’azote la plus facilement assimilable par les organismes d’un point de vue énergétique, plusieurs étapes du cycle de l’azote sont fortement influencées par la disponibilité du NH4+ dans la colonne d’eau. Lorsque mesurés en même temps, les taux d’assimilation sont
généralement plus élevés dans la partie supérieure de la zone euphotique alors que les taux de nitrification sont plus importants en profondeur (Ward 1987b). Ce patron suggère que, dans les eaux de surface bien éclairée, le phytoplancton assimile efficacement le NH4+ alors que les
procaryotes nitrifiants sont soit incapables de compétitionner pour le substrat ou encore inhibés par la lumière. En contrepartie, dans la partie inférieure de la zone photique, la limitation par la
N
H
3/ N
H
4 +r
at
io
pH
lumière empêche les organismes photosynthétiques d’assimiler efficacement le NH4+, ce qui
permet aux organismes nitrifiants d’utiliser le substrat disponible (Ward 2008). Bien qu’il n’existe pas d’évidence directe de cette compétition entre les organismes photosynthétiques et nitrifiants dans la colonne d’eau, des études réalisées dans la partie supérieure des sédiments ont montré un avantage compétitif des algues benthiques par rapport aux communautés de bactéries nitrifiantes (Risgaard-Petersen et al. 2004).
Les taux de nitrification sont étroitement dépendants de la quantité de NH4+ disponible dans le
milieu, et, par le fait même, des taux d’ammonification (Ward 1985). Un couplage des deux processus est observé dans la colonne d’eau (Ward 2008). Il a été démontré que les taux de nitrification diminuent rapidement en profondeur et que cette diminution est corrélée avec une réduction du NH4+ mis en circulation par le recyclage (Ward 1986). En Arctique, l’augmentation
du ruissèlement et des apports de matières organiques d’origine terrigène dans certaines régions pourrait potentiellement stimuler le relargage de NH4+ via la décomposition bactérienne (Peterson
et al. 2002). Un recyclage plus important de la matière organique libèrerait davantage de NH4+
dans le milieu marin qui pourrait par la suite être utilisé comme substrat par les organismes nitrifiants. Des expériences réalisées en culture ont montré que le NH4+ a une influence de
premier ordre sur les taux de nitrification lorsque les concentrations du milieu se situent entre 10 et 100 µM. Toutefois, cette dépendance entre les concentrations en substrat et la nitrification est beaucoup plus difficile à démontrer en milieu océanique où les concentrations sont généralement beaucoup plus faibles (Ward 2008). Plusieurs expériences d’ajout de 15NH4+ en concentrations
traces ont montré que la nitrification est indépendante des concentrations en NH4+ du milieu
(Olson 1981; Ward et Kilpatrick 1990). Cependant, davantage d’études sont nécessaires afin de mieux comprendre cette corrélation entre les taux de nitrification et les concentrations ambiantes en NH4+.
1.5 Hypothèses et objectifs
1.5.1 Hypothèses
Dans un but de mieux comprendre l’impact potentiel des changements physiques actuellement observés en Arctique sur le cycle de l’azote, les hypothèses de recherches suivantes ont été émises :
H1. La lumière a un impact négatif sur les taux de nitrification, mais positif sur les taux d’assimilation. Pour tester cette hypothèse, deux conditions expérimentales ont été comparées : incubation au noir et incubation en condition simulée de lumière (PAR ≈ 200 µmol de photons m-2 s-1).
H2. L’acidification a un impact négatif sur les taux de nitrification, mais positif sur les taux d’assimilation. Un ajout de HCl en combinaison avec du NaHCO3 a
été utilisé afin de réduire le pH du milieu d’environ 0.3 unité. Cette baisse correspond au pH moyen envisagé en 2100 par l’IPCC (750 ppm). L’ajout d’acide en combinaison avec les ions CO32- permet de diminuer le pH de l’échantillon sans
toutefois changer l’alcalinité du milieu et donc de simuler une baisse de pH telle qu’observée en milieu naturel.
H3. L’enrichissement en NH4+ a un impact positif sur les taux de nitrification et d’assimilation. Pour tester cette hypothèse, 2 µM de 14NH4Cl ont été ajoutés aux
bouteilles d’incubation. Bien qu’élevée, cette concentration est parfois retrouvée dans les eaux de surface et est donc représentative d’un enrichissement important des eaux en substrat.
Des incubations d’une période de 24 heures ont été réalisées en présence d’un traceur isotopique (15N) dans des incubateurs à température contrôlée. Étant donné l’abondance et la complexité des facteurs qui contrôlent la régénération du NH4+ dans la colonne d’eau, aucune hypothèse
1.5.2 Objectifs
Le premier objectif du présent projet était de quantifier les processus de nitrification, d’assimilation, et d’ammonification à différentes profondeurs ainsi que dans différents secteurs des mers de Baffin et du Labrador. La distribution verticale des taux de transformation d’azote a été déterminée en incubant au noir des échantillons d’eau provenant de différentes profondeurs (surface, SCM, minimum de température, maximum de température, maximum de NO3- et fond)
en présence d’un traceur isotopique (15N) pendant 24 heures. La distribution horizontale des processus azotés a quant à elle été quantifiée par l’incubation au noir d’échantillons d’eau récoltés à deux profondeurs dans la couche euphotique (surface et SCM) et provenant de l’ensemble de la région océanique à l’étude. L’analyse de ces distributions a permis de quantifier les taux de nitrification, d’assimilation et d’ammonification ainsi que de déterminer l’effet de différents paramètres environnementaux (lumière, profondeur, pH, température, salinité, concentration en nutriments et en chlorophylle a) sur ces processus.
Le deuxième objectif était de déterminer la sensibilité des processus de nitrification, d’assimilation et d’ammonification à différentes perturbations expérimentales (éclairement, acidification et enrichissement en NH4+). Pour tester ce dernier objectif, des échantillons d’eau
provenant de la couche euphotique (surface et SCM) ont été incubés sous les différentes conditions expérimentales testées en présence de 15N. La quantification de ces taux a permis de déterminer l’impact de la lumière, du pH et de l’ajout de NH4+ sur les différents processus étudiés
2. Impacts of environmental conditions on nitrification,
ammonium uptake and ammonification in Baffin Bay and
Labrador Sea
2.1 Résumé
Dans l'océan Arctique, les conditions de croissance des organismes vivants sont en plein changement; l'étendue, l'épaisseur et la persistance de la glace de mer saisonnière sont en déclin rapide (affectant la disponibilité de la lumière et le mélange vertical), le ruissèlement d'eau douce augmente et l'océan se réchauffe et s’acidifie. Toutefois, les répercussions de ces multiples facteurs de stress sur le cycle de l’azote ainsi que sur la structure du réseau alimentaire polaire sont encore mal définies et quantifiées. Au cours du présent projet, les effets de différentes variables environnementales et de perturbations expérimentales sur les taux de nitrification ainsi que leur interaction avec l’assimilation et le recyclage de l’ammonium ont été évalués en mers de Baffin et du Labrador à l’automne 2012. Les résultats de l’étude montrent que la lumière n’a pas d’impact négatif sur les taux de nitrification dans la zone euphotique, à l’exception de deux stations caractérisées par une fraction plus élevée d’eau d’origine Atlantique. Ceci suggère que le déclin continu de la glace de mer devrait avoir une incidence minimale sur la nitrification de surface dans les eaux arctiques dérivées du Pacifique. Par ailleurs, l’enrichissement en ammonium et la réduction du pH n'ont eu aucun effet perceptible sur les taux de transformation de l’azote aux profondeurs échantillonnées. La baisse importante du pH océanique (i.e., acidification) prévue au cours du prochain siècle est donc peu susceptible d'affecter directement le cycle de l’azote dans la partie supérieure de l'océan Arctique.
2.2 Abstract
In the Arctic Ocean, the growth conditions of living organisms are changing dramatically; the extent, thickness and seasonal persistence of sea ice are declining rapidly (thereby affecting light availability and vertical mixing), freshwater runoff is increasing and the ocean is warming and acidifying. These multiple stressors are bound to alter nitrogen (N) cycling and the structure and function of marine food webs, but their impacts are poorly quantified. Here we assessed the effect of environmental variables and experimental perturbations on nitrification rates and their interaction with ammonium uptake and ammonification in Baffin Bay and the Labrador Sea during fall 2012. Light had no adverse impact on nitrification rates in the euphotic zone, except at the two stations containing the highest fraction of Atlantic water. This result suggests that the ongoing decline of sea ice should minimally impact surface nitrification within Pacific-derived Arctic waters. Ammonium enrichment and pH reduction had no discernible effect on N cycling rates at the depths sampled. The substantial drop in seawater pH (i.e., acidification) predicted for this century is therefore unlikely to directly affect N cycling in the upper Arctic Ocean.
2.3 Introduction
The nitrogen (N) cycle controls the bioavailability of nitrogenous nutrients. It limits biological productivity in several marine regions and ultimately constrains biogenic fluxes of the greenhouse gases carbon dioxide and nitrous oxide (N2O) across the air-sea interface (Gruber
2008; Zehr 2002). As a limiting nutrient, N plays a particularly important role for primary producers and marine microbes in many marine environments, including the Arctic Ocean (Tremblay and Gagnon 2009). This small ocean is severely impacted by climate change (ACIA 2005) through drastic reductions in the extent, thickness and persistence of sea-ice. The loss of sea ice increases the availability of light in the water column and may indirectly affect N cycling through changes in vertical stratification, acidification and microbial activity. The impacts of these perturbations on N cycling in the Arctic Ocean are still poorly understood.
Many forms of organic and inorganic N can be utilized by phytoplankton and other microbes, but the reduced form, ammonium (NH4+), is the preferred source (McCarthy et al. 1977; Gilbert et al.
1982). In well-oxygenated waters, the NH4+ may either be taken up by autotrophs or oxidized by
nitrifying organisms. Nitrification occurs through two independent steps initiated by the oxidation of NH4+ to nitrite (NO2-) and followed by the oxidation of NO2- to nitrate (NO3-), which
are mediated by different microorganisms (Ward 2008). While the first step was thought to be performed by a limited number of ammonia-oxidizing bacteria (AOB), recent evidence indicates that ammonia-oxidizing archaea (AOA) are also involved (Francis et al. 2007) and may even be dominant in some areas (Horak et al. 2013).
Nitrification links the most oxidized (NO3-) and most reduced (NH4+) N pools and therefore
determines the overall proportion of each in marine waters (Gruber 2008). Because NH4+ is also
taken up by phytoplankton and other microbes in surface waters, nutrition may compete with nitrification for NH4+, with different consequences for primary production and climate (Ward
2008). In oceanic waters the two processes depend on ammonification (often referred as NH4+
regeneration or recycling), which makes NH4+ available through various processes such as
bacterial decomposition and zooplankton excretion. Oceanic waters are usually depleted in NH4+
due to the rapid consumption of this N form by organisms (Gruber 2008). In this case the recycling of NH4+ through ammonification is the main source of regenerated N in the upper
oxidation (Tremblay et al. 2008). Otherwise the link between these N cycling rates and ammonification is presumably tenuous when NH4+ has been accumulating or supplied from other
sources.
Light is thought to play an important role by stimulating the uptake and excretion of inorganic N as well as inhibiting bacterial nitrification (Nelson and Conway 1979; Hooper and Terry 1973, 1974). Many culture-based and field observations showed photoinhibition of bacterial nitrification (Hyman and Arp 1992). This susceptibility of marine nitrifying bacteria to inhibition by sunlight was used to explain the accumulation of NO3- in deep waters (Guerrero and Jones
1996; Horrigan et al. 1981; Olson 1981; Ward et al. 1982). Although bacterial nitrifiers are widely reported to be inhibited by natural light levels, nitrification does occur within the euphotic zone (Yool et al. 2007). The recent recognition of the importance of AOA, some of which are possibly less sensitive to light inhibition, could explain the presence of substantial nitrification rates in surface waters (Church et al. 2010). However, what is interpreted as “light inhibition” of ammonium oxidizing organisms (AOO) in the field can also result from interference competition from phytoplankton, which have an advantage at high light levels (Ward 2008).
Nitrification may also be impacted by ocean acidification (Hutchins et al. 2009). Because NH3 is
thought to be the actual substrate used by nitrifying organisms (Suzuki et al. 1974; Ward 1987a), a drop in pH might negatively affect AOO by shifting the equilibrium between uncharged ammonia (NH3) and ammonium ions (NH4+) toward the latter (Zeebe and Gladrow 2001). The
projected reduction in seawater pH over the next century is expected to reduce the fraction of NH3 by nearly 50%, from 6 % to 3 % (Bange 2008), suggesting a possible negative impact of
acidification on marine nitrification rates through a reduction in substrate availability. This effect of pH is likely to be more manifest at low NH4+ concentrations, since there may otherwise be
enough NH3 available despite the shift in chemical equilibrium. A study realized in oligotrophic
(low NH4+ concentrations) and warm waters has shown a reduction up to 38% of nitrification
rates under lower pH (Beman et al. 2011). However, the effect of acidification on nitrification rates in cold oceans such as the Arctic, where relatively high pH reductions are expected (Fabry et al. 2009), has not been assessed.
The main objective of this study was to evaluate the impact of natural variations and experimental perturbations of light, pH and NH4+ on nitrification and its interaction with NH4+
uptake and ammonification in the cold surface waters of the Arctic Ocean. The second objective was to evaluate the vertical distribution of these rates in the water column. To do so we elected to work in Baffin Bay (BB) and the Labrador Sea (LS), which are influenced by strong gradients in the contribution of Atlantic and Pacific-derived water. The western BB and LS receive cold and fresh Pacific-derived water from the central Arctic, while the eastern BB and LS are exposed to relative warm and salty Atlantic-derived water (Tremblay et al. 2002). We hypothesized that (1) N fluxes in the area vary according to the different characteristics of water masses and (2) light exposure and reduced pH affect nitrification negatively while enriched NH4+ promotes higher
nitrification rates.
2.4 Materials and Methods
2.4.1 Study area and sampling design
This study was carried out aboard the Canadian research icebreaker CCGS Henry Larsen from 12 September to 16 October 2013 during a joint DFO-ArcticNet expedition. The work was conducted in different sectors of BB and LS, two regions influenced by Pacific and Atlantic-derived waters (Fig. 2.1). At each station, water samples were collected with a rosette sampler equipped with 12L Niskin-type bottles (OceanTest Equipment Inc., n = 24), a conductivity-temperature-depth (CTD) profiler (SBE-911, Sea-Bird Inc.), a nitrate sensor (ISUS V2, Satlantic), a chlorohyll fluorometer (Seapoint Sensors Inc.) and a sensor measuring photosynthetically active radiation (PAR; QCP2300, Biosperical Instruments Inc.). All water samples were pre-filtered on a
300-three sites where the vertical distribution of N fluxes was assessed (stations 117, 133 and 147), water samples were collected at six depths including the surface, subsurface chlorophyll maximum (SCM), temperature minimum and maximum, NO3- maximum and bottom. At all other
stations, experimental perturbations were performed on water samples from the upper ocean (surface and SCM) where light is susceptible to affect N cycling rates. At each station, the targeted depths were chosen during the down cast of the CTD.
Figure 2.1 Location of the sampling stations in Baffin Bay and Labrador Sea in the Canadian Arctic during fall 2012. The western side (Canada) of the region is influenced by Pacific-derived water from the central Arctic while the eastern side (Greenland) is characterized by a higher proportion of Atlantic-derived water. Yellow symbols indicate stations where vertical distributions of N fluxes were measured and red symbols indicate stations where experiments were performed, for a total of 11 samplings at 10 locations (St 133 sampled twice).
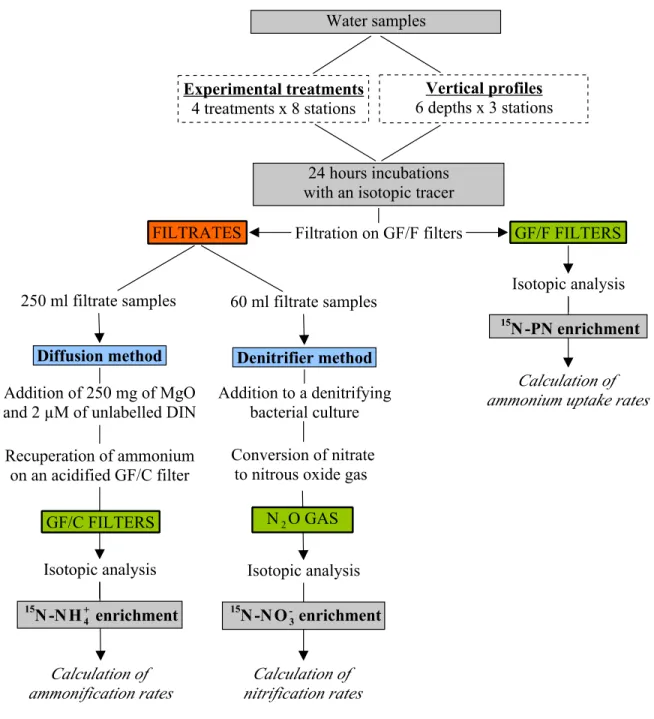
2.4.2 Nitrogen fluxes
The flow diagram presented in Fig. 2.2 provides an overview of the method. To determine vertical profiles of nitrification, NH4+ uptake and ammonification rates in the dark, duplicate 600
ml water samples from six depths were incubated with 0.1 µM of 15N-labelled NH4+ in
temperature-controlled incubators during 24 h. To standardize conditions, the temperature in the incubators was set to 0˚C for the duration of the experiment. Incubations were terminated by filtering through pre-combusted (450˚C) Whatman GF/F filters (25 mm in diameter, nominal porosity of 0.7 µm). Filters were placed into 2 ml cryovials, dried for 24 h at 60˚C and stored dry until further processing at the home laboratory. These filters were used to determine the final 15N enrichment of the particulate nitrogen (PN) to determine net uptake. The filtrate was split in two separate aliquots of 60 ml and 250 ml. The first was immediately frozen at -20˚C and the second was poisoned with HgCl2 and stored at 4˚C in order to prevent bacterial activity during storage.
These aliquots were used to measure the isotopic 15N enrichment of the dissolved NO3- pool (60
ml) and the 15N enrichment of the dissolved NH4+ pool (250 ml). The same procedure was
repeated for non-incubated samples, which were filtered immediately after the addition of tracer, in order to assess the initial 15N enrichment of filters and filtrates at time zero (t0).
Figure 2.2 Flow diagram of the procedures used to obtain rates of nitrification, NH4+ uptake and ammonification
rates with the 15N tracer method. The isotopic enrichment of the 15N-NH4+ pool was assessed by the diffusion
method (Slawk and Raimbault 1995) while the enrichment of the 15N-NO
3- pool was assessed by the denitrifier
method (Sigman et al. 2001).
At all other stations, water samples from the surface and SCM were incubated in triplicates in temperature-controlled incubators during 24 h with 15N-NH4+ tracer under four different
experimental conditions: (1) simulated ambient light, (2) darkness, (3) darkness + reduced pH and (4) darkness + enriched NH4+. Light in the incubators was set to about 200 µmol quanta m-2
s-1, which corresponds to the higher range of in situ irradiance measured in the upper mixed layer during the expedition. The acidification (pH decrease) was according to Riebesell (2010) by adding HCl in combination with NaHCO3. This method mimics the change in carbon chemistry
in the ocean by acidifying the sample without changing the alkalinity of the water. This procedure resulted in a pH drop of 0.3 unit, which corresponds to the average ocean acidification (750 ppm) predicted for 2100 by the IPCC (2007). The NH4+ enrichment was done by adding 2
µM of 14N-NH4+ to the water samples prior the addition of the 15N tracer. The final NH4+
concentration in bottles slightly exceeded the maximum in situ NH4+ concentrations observed in
the upper water column during the expedition. Handling of t0 samples, filtrations and
post-processing of filters and filtrates were done as explained above.
2.4.3 Nutrients
Concentrations of NH4+ were determined on fresh samples with the fluorimetric method (Holmes
et al. 1999). Others nutrients were collected into acid-washed 15-ml polyethylene tubes after a filtration through a GF/F filter inserted in a filter holder to remove large particles. Nutrient samples were quickly frozen and stored at -20˚C. Soon after the cruise, frozen samples were rapidly thawed at home laboratory and concentrations of inorganic nutrients, NO3-, NO
2- and
phosphate (PO43-), were determined using routine colorimetric methods adapted from Hansen and
Koroleff (2007) with a Bran and Luebbe Autoanalyzer III. The analytical detection limit was 0.02 µmol l-1 for NH4+ and NO2-, 0.03 µmol l-1 for NO3- and 0.05 µmol l-1 for PO43-. The percentage of
Pacific waters (%PW) was calculated from the nitrate and phosphate data according to Jones et al. (2003).
2.4.4 Other measurements
Chlorophyll a (chl a) was determined with the fluorometric method (Parsons et al. 1984) by filtering 500 ml to 1 l onto GF/F filters. Pigments were extracted in 90 % ethanol for 24 h at 4˚C in the dark and concentrations were determined using a Turner Designs 10-AU fluorometer (before and after acidification). The pH measurements were assessed using the spectrophotometric method as explained by Dickson et al. (2007).
2.4.5 DIN extractions
The 15N enrichment of dissolved NO3- (60 ml filtrate samples) was assessed with the denitrifier
method (Sigman et al. 2001; Casciotti et al. 2002; Granger 2011). Briefly, the water sample was added to a bacterial culture of the denitrifying bacteria Pseudomonas aureofaciens (ATCC 13985), which lacks an active terminal N2O reductase. The volume of sample was adjusted to
achieve a final sample size of 10-20 nmoles N (5-10 nmol N2O), which was optimal for the
system used. The isotopic enrichment of the N2O was analyzed by mass spectrometry.
The 15N enrichment of dissolved NH4+ pool (250 ml filtrate samples) was assessed with the
diffusion method (Slawk and Raimbault 1995). The sample was buffered with 250 mg of MgO to raise the pH above 9 and 2 µM 14N-NH4+ was added as a “carrier” to provide sufficient N for
mass spectrometric analysis. A strip of glass-fiber filter (GF/C) wetted with 50 µl of 0.5 N H2S04
was suspended above the sample to trap the liberated NH4+ (Paasche and Kristiansen 1982). The
bottle was then capped tightly and left for a week at 60°C in an oven. The strip was removed, oven-dried at 60°C and stored in a desiccator for subsequent mass spectrometric analysis.
2.4.6 Mass spectrometry
The isotopic composition of N2O gas was analyzed with continuous flow
Isotope-Ratio-Mass-Spectrometer (IRMS; Delta Plus, Thermo‐Finnigan) coupled with a gas bench. Filters from incubations (GF/F) and diffusion method (GF/C) were dried again at 60°C during 48 h, wrapped in tin foil and pressed tightly to evacuate air. Samples were then processed in an elemental analyzer and a continuous-flow IRMS (Delta V Advantage, Thermo-Finnigan) using the modified Dumas method (Fiedler and Proksch 1975). All isotopic enrichments were expressed as atom% relative to internationally reference standards (L-glutamic acid, USGS-40, USGS-41 and IAEA-N3) calibrated against N2. Isotopic ratios from the IRMS analyses were then used to
2.4.7 Calculations
Nitrification rates (Nr, in nmoles l-1 d-1) were calculated from the 15N enrichment in the dissolved
NO3- pool at the end of the incubation according to Christman et al. (2011).
(Eq. 1) Nr = [NO3 -] t x RNO 3 -RNH 4 +
where RNH4 and RNO3 are the 15N atm % excess enrichments in the NH4+ pool at the beginning of
the incubation and in the NO3- pool at the end of the incubation, respectively, [NO3-] is the
measured concentration of the NO3- pool and t represents the incubation time (in days). In all
equations, the final isotopic enrichment was corrected for the initial 15N enrichment assessed from the t0 samples (non-incubated).
Absolute rates of net NH4+ uptake (ρ, in nmoles l-1 d-1) were computed according to Dugdale and
Wilkerson (1986). (Eq. 2) rNH 4 + net = RPON RDIN x t x [PON]
where RPON and RDIN represent the 15N atom % excess enrichment in the PON and DIN pools,
respectively, and [PN] represents the final PN concentration. To correct NH4+ uptake rates for
isotopic dilution, we made RDIN in Eq. 2 equal to the mean of measured isotopic enrichments of
the NH4+ pool at the beginning and end of incubations. In cases where it is desirable to remove
the effect of biomass on rates, specific uptake rates were calculated by omitting the multiplication by PON in Eq. 2.
In vitro ammonification rates (Ar, in nmoles l-1 d-1) were determined according to the
Blackburn-Caperon model (Blackburn 1979; Blackburn-Caperon et al. 1979) described by Laws (1984):
(Eq. 3) Ar = ln RfNH4+ / RoNH4+ [NH4+] F / [NH4 +] I æ è ç ç ö ø ÷ ÷ æ è ç ç ö ø ÷ ÷ x [NH4 +] I - [NH4+] F t æ è çç ö ø ÷÷
where [NH4+]I and [NH4+]F represent initial and final ammonium concentrations measured by
fluorometry before and after the incubation period t and RΟ and Rf are the initial and final excess
enrichments of the NH4+ pool.
2.4.8 Nomenclature, data handling and statistical analyses
For samples originating from the euphotic zone (upper mixed layer and SCM), all the rates obtained from incubations in the light are considered as “unperturbed”. Nitrification rates obtained in the dark with no manipulation of pH or substrate are considered as “potential”. All other rates are “perturbed”. For samples originating from below the euphotic zone (vertical profiles), all the rates were obtained in the dark and are considered “unperturbed”.
Spatial comparisons of nitrification rates were established using dark values only to attenuate the effect of day-to-day variations in incident light on samples from the euphotic zone. Horizontal comparisons of dark nitrification rates were established with samples originating from the euphotic zone only since those were the most numerous (3 stations for vertical profiling + 8 experimental stations).
Prior to statistical analyses, all variables were tested for normality and homoscedasticity, using Shapiro-Wilk test and residual diagrams, respectively. When required, a square-root transformation was applied to the data. Multiple linear regression models were used to investigate covariation among multiple predictors. Here, we assessed the effect of nine environmental variables (ambient light, depth, ambient temperature, salinity, pH, chl a and the concentrations of NH4+, NO2- and NO3-) on vertical and horizontal distributions of N fluxes and all significant
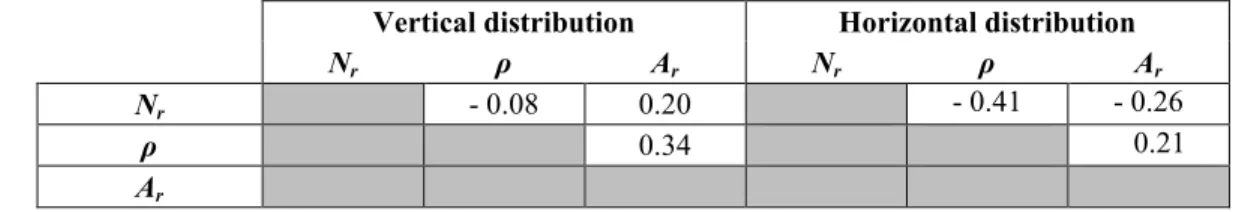
variables (P < 0.05) were isolated. Moreover, the degree of linear dependence between nitrification, NH4+ uptake and ammonification rates were assessed using Pearson coefficients.
Analyses of variance (ANOVA mixed models) were used to assess the difference between treatments at experimental stations. Regressions, Pearson coefficients and ANOVA analyses were carried out using SAS version 9.2 software. A principal component analysis (PCA) was conducted to explore interactions between environmental parameters and water masses characteristics with R 3.0.2 software (package ade4).
2.5 Results
2.5.1 General
The environmental and biological variables measured during fall 2012 are summarized in Tables
2.1 and 2.2. Water temperature ranged from -0.7˚C to 6.6˚C at the surface (average of 3.4˚C in
the euphotic zone), increased with depth and was generally higher in the relatively salty Atlantic-derived waters on the Greenland side than in the Pacific waters flowing south on the Canadian side. Concentrations of all inorganic nitrogenous nutrients were generally low to moderate in the euphotic zone, with higher values at the SCM than in the upper mixed layer. The highest concentrations of ammonium (0.91 µM), nitrite (0.48 µM) and nitrate (4.61 µM) at the surface were observed in the Atlantic waters occupying the eastern half of the Labrador Sea. Chlorophyll
a concentrations were generally low (< 1.5 µg l-1), except at the SCM of station 04 in northern Baffin Bay (14.7 µg l-1).
2.5.2 Vertical distribution of N cycling rates in the dark
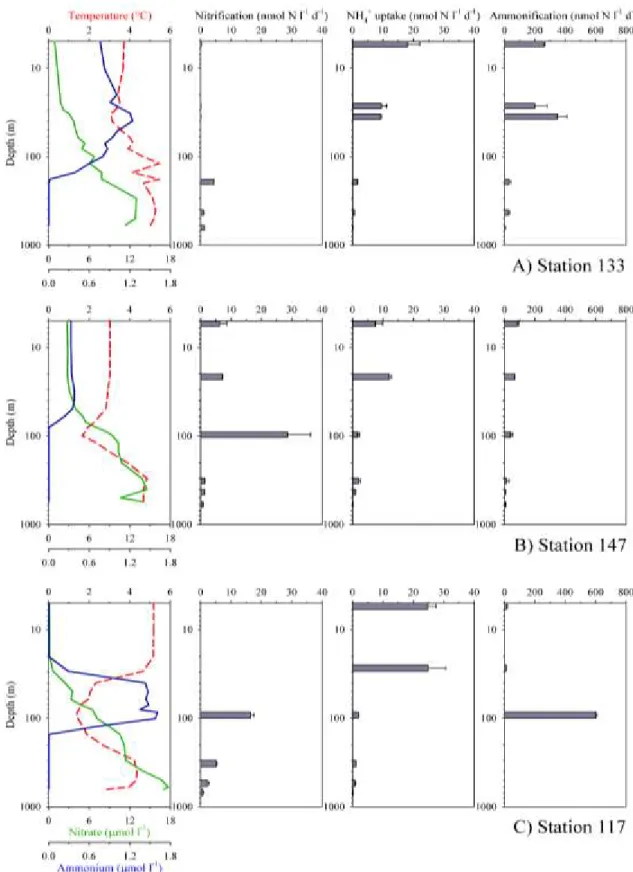
Dark rates of nitrification, ammonium uptake and ammonification on the vertical profiles ranged from 0.1 to 34.0 nmol l-1 d-1, 0.1 to 29.0 nmol l-1 d-1 and 0.0 to 607 nmol l-1 d-1, respectively (Fig. 2.3). Potential nitrification rates varied considerably across stations and depths, but the vertical pattern was qualitatively similar at all stations. The highest rate was generally measured in intermediate waters (180 m at St 133, 90 m at St 147 and 86 m at St 177) with the highest value recorded at station 147 on the west side of Labrador Sea. By contrast, maximum rates of dark NH4+ uptake and ammonification were observed in the euphotic zone, except for ammonification
at station 117, where the vertical maximum was at 100 m. All rates declined to very low values in deep waters. Dark ammonification rates were generally much greater than the sum of nitrification and NH4+ uptake, except in the deep part of station 147.
T able 2. 1 E nv ir on m en tal var iab les m ea su red at statio ns wh er e ver tical pr of iles o f N flu xes wer e ass es sed . Z : dep th , T : wate r tem per atu re, S: salin ity , pH1 : in s itu p H m ea su red b ef or e in cu batio n, C hl a: ch lo ro ph yll a co nce ntr atio n, NH 4 + : am m on iu m co nce ntr atio n, N O3 - : nitra te co nce ntr atio n, NO 2 - : nitrite co nce ntr atio n, % PW : p er ce ntag e of Pacif ic wate r. % P W (%) 12.1 9.40 2.30 000. 0.00 7.90 21.8 14.7 808. 8.80 4.70 0.0 25.8 25.9 20.2 6.90 0.00 12.9 [NO 2 - ] (µm ol l -1 ) 0. 23 0. 15 0. 38 0. 15 0. 43 0. 14 0. 35 0. 34 0. 46 0. 11 0. 21 0. 16 0. 36 0. 22 0. 18 0. 11 0. 31 0. 10 [NO 3 - ] (µm ol l -1 ) 0. 09 0. 15 6. 70 11 .4 16 .7 17 .1 1. 31 1. 73 2. 99 13 .0 12 .9 11 .4 4. 02 2. 79 8. 67 13 .8 14 .6 14 .0 [NH 4 + ] (µm ol l -1 ) 0. 00 0. 00 1. 61 0. 00 0. 00 0. 00 0. 84 0. 91 1. 21 0. 00 0. 00 0. 00 0. 33 0. 34 0. 00 0. 00 0. 00 0. 00 Chl a (µg l -1 ) 1. 60 1. 33 0. 02 - - - 0. 42 0. 49 0. 30 - - - 0. 80 0. 79 0. 09 - - - pH 1 8. 05 8. 04 7. 98 7. 95 7. 93 7. 87 8. 02 8. 03 8. 01 7. 95 7. 94 7. 96 7. 75 8. 01 7. 94 7. 92 7. 92 7. 92 S (‰) 32.2 32.2 33.7 .734 34.8 34.7 31.5 32.0 .532 34.9 35.0 35.0 32.4 33.3 33.8 34.9 34.9 34.9 T (˚C) 5.20 5.17 1.40 4.24 4.34 2.87 3.74 3.53 3.08 5.14 5.29 5.03 3.03 3.03 1.79 4.86 4.67 4.69 Z (m) 0-5 20 85 300 500 634 0-5 25 33 180 400 595 0-5 20 90 300 400 551 Sta tio ns 117 133 147
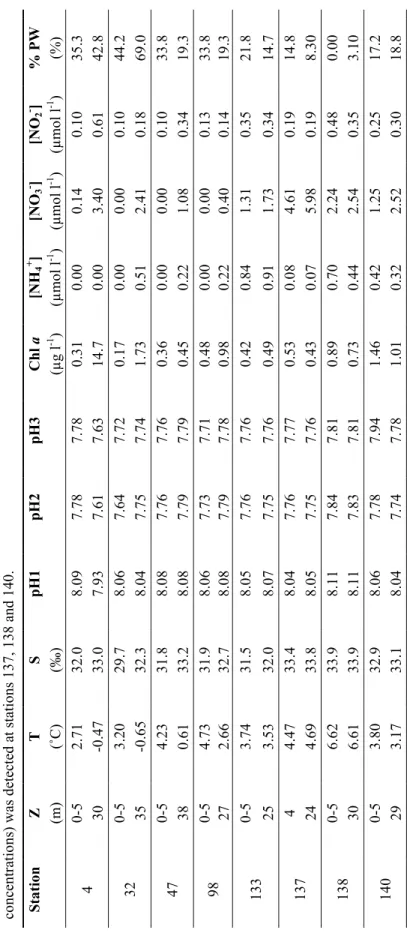
T able 2. 2 E nv ir on m en tal var iab les at statio ns wh er e ex per im en tal tr ea tm en ts wer e ass ess ed . Z : d ep th , T : wate r tem per atu re, S: salin ity , pH1 : in s itu pH m ea su red b ef or e in cu batio n, p H2 : pH af ter th e ad ditio n of HC l + NaH C O3 , p H3 : pH af ter 2 4 h in cu batio n, C hl a: ch lo ro ph yll a co nce ntr atio n, NH 4 + : am m on iu m c on ce ntr ati on , NO 3 - : nitra te co nce ntr atio n, NO 2 - : nitrite co nce ntr atio n, % PW : per ce ntag e of Pac if ic wate r. No SC M (h ig her c hl a co nce ntr atio ns ) was d etec ted a t statio ns 1 37 , 1 38 an d 14 0. % P W (%) 35.3 42.8 44.2 69.0 33.8 19.3 33.8 .319 21.8 14.7 14.8 308. 0.00 3.10 17.2 18.8 [NO 2 - ] (µ m ol l -1 ) 0. 10 0. 61 0. 10 0. 18 0. 10 0. 34 0. 13 0. 14 0. 35 0. 34 0. 19 0. 19 0. 48 0. 35 0. 25 0. 30 [NO 3 - ] (µ m ol l -1 ) 0. 14 3. 40 0. 00 2. 41 0. 00 1. 08 0. 00 0. 40 1. 31 1. 73 4. 61 5. 98 2. 24 2. 54 1. 25 2. 52 [NH 4 + ] (µ m ol l -1 ) 0. 00 0. 00 0. 00 0. 51 0. 00 0. 22 0. 00 0. 22 0. 84 0. 91 0. 08 0. 07 0. 70 0. 44 0. 42 0. 32 Chl a (µg l -1 ) 0. 31 14 .7 0. 17 1. 73 0. 36 0. 45 0. 48 0. 98 0. 42 0. 49 0. 53 0. 43 0. 89 0. 73 1. 46 1. 01 pH 3 7. 78 7. 63 7. 72 7. 74 7. 76 7. 79 7. 71 7. 78 7. 76 7. 76 7. 77 7. 76 7. 81 7. 81 7. 94 7. 78 pH 2 7. 78 7. 61 7. 64 7. 75 7. 76 7. 79 7. 73 7. 79 7. 76 7. 75 7. 76 7. 75 7. 84 7. 83 7. 78 7. 74 pH 1 8. 09 7. 93 8. 06 8. 04 8. 08 8. 08 8. 06 8. 08 8. 05 8. 07 8. 04 8. 05 8. 11 8. 11 8. 06 8. 04 S (‰) 32.0 33.0 29.7 32.3 31.8 33.2 31.9 .732 31.5 32.0 33.4 .833 33.9 33.9 32.9 33.1 T (˚C) 2. 71 -0 .4 7 3. 20 -0 .6 5 4. 23 0. 61 4. 73 2. 66 3. 74 3. 53 4. 47 4. 69 6. 62 6. 61 3. 80 3. 17 Z (m) 0-5 30 0-5 35 0-5 38 5 0- 27 0-5 25 4 24 0-5 30 0-5 29 Sta tio n 4 32 47 98 133 137 138 140
Figure 2.3 Vertical distribution of physico-chemical variables (temperature in red, NH4+ concentration in blue and
NO3- concentration in green) and dark rates of nitrification, NH4+ uptake and ammonification (nmol l-1 d-1) in (A)
Atlantic derived-water (St 133), (B) Pacific-derived-water (St 147) and (C) a mixture of both water types (St 117). Note that the y-axes use the logarithmic scale. Error bars provide the standard deviation of triplicates.