Activation des cellules dendritiques par des
composantes de bioaérosols
Mémoire
Magali Boucher
Maîtrise en microbiologie-immunologie - avec mémoire
Maître ès sciences (M. Sc.)
Activation des cellules dendritiques par des
composantes de bioaérosols
Mémoire
Magali Boucher
Sous la direction de :
David Marsolais, directeur de recherche
Caroline Duchaine, codirectrice de recherche
Résumé
Plusieurs environnements de travail sont hautement contaminés par des bioaérosols qui sont souvent associés à l’induction de diverses pathologies respiratoires. Il est donc important de mieux définir l’impact des composantes des bioaérosols sur l’immunité mucosale pulmonaire. La cellule dendritique est à l’interface de l’individu et de son environnement et aurait un rôle dans l’initiation de réponses immunopathologiques induites par les bioaérosols. Le but de ce projet était donc de comparer comment divers agents, combinaisons d’agents, ou des échantillons issus d’environnements hautement contaminés par des bioaérosols modulaient l’activation des cellules dendritiques in vitro. Nos résultats montrent que le degré d’activation des cellules dendritiques dérivées de la moelle osseuse in vitro discriminent un agent fortement immunogène, les endotoxines, d’agents faiblement immunogènes tels les β-D glucanes et les archées Methanosphaera stadtmanae et Methanobrevibacter smithii. Nous montrons également qu’une stimulation combinée de ces agents active de façon additive les cellules dendritiques, confirmant ainsi l’importance d’étudier l’impact des bioaérosols comme un ensemble, et non pas seulement certaines composantes individuellement. De plus, la cinétique d’activation des cellules dendritiques est modulée par la nature de la stimulation, ce qui confirme l’hypothèse d’interaction entre les composantes des bioaérosols sur la réponse immune. Enfin, l’activation des cellules dendritiques permet de stratifier par classe divers environnements de travail, ce qui est corroboré par un modèle d’inflammation pulmonaire in vivo. Ce projet élargit donc notre connaissance des mécanismes sous-jacents à l’induction de réactions immunes pathologiques par les bioaérosols complexes.
Abstract
Several occupational settings are highly contaminated with bioaerosols, which are often associated with the induction of various respiratory pathologies. It is therefore important to define the impact of the components of bioaerosols on mucosal immunity. Dendritic cells are at the interface of the individual and his environment and play a role in the initiation of immunopathological responses induced by bioaerosols. The purpose of this project was to compare how various agents, agent combinations, or samples from environments highly contaminated with bioaerosols modulated dendritic cell activation in vitro. Our results show that the degree of activation of dendritic cells derived from the bone marrow differentiates between a highly immunogenic agent, endotoxins, from weakly immunogenic agents such as β-D glucans and archaea Methanosphaera stadtmanae and Methanobrevibacter smithii. We also show that combined stimulation of these agents additively activates dendritic cells, thus confirming the importance of studying the impact of bioaerosols as a whole, and not just individual components. In addition, the kinetics of activation of dendritic cells is modulated by the nature of the stimulation, which confirms the hypothesis of interaction between the components of bioaerosols on the immune response. Finally, the activation of dendritic cells stratifies various working environments by class, which is corroborated by an in vivo lung inflammation model. This project therefore broadens our understanding of the mechanisms underlying the induction of immunopathological reactions by complex bioaerosols.
Table des matières Résumé ... iii Abstract ... v Table des matières ... vi Liste des tableaux ... ix Liste des figures ... x Liste des abréviations ... xi Remerciements ... xiii Avant-propos ... xiv INTRODUCTION ... 1 CHAPITRE I: REVUE DE LITTÉRATURE ... 2 1.1 Les bioaérosols ... 2 1.1.1 Composantes immunogènes des bioaérosols ... 2 1.1.1.1 Les bactéries ... 2 1.1.1.2 Les endotoxines ... 3 1.1.1.3 Les peptidoglycanes ... 4 1.1.1.4 Les moisissures ... 5 1.1.1.5 Microorganismes contenus dans les bioaérosols dont les propriétés inflammatoires ont été caractérisées ... 6 1.1.1.6 Autres composantes immunogènes ... 8 1.2 L’échantillonnage et l’étude des bioaérosols ... 9 1.2.1 Les échantillonneurs d’air ... 9 1.2.1.1 Le SKC BioSampler ... 10 1.2.1.2 Le Coriolis μ® ... 10 1.2.1.3 Smart Air Sampler System 3100 (SASS 3100) ... 11 1.2.2 Caractérisation des bioaérosols ... 11 1.3 Environnements contaminés par les bioaérosols ... 13 1.4 Valeurs limites d’exposition occupationnelles ... 14 1.5 Maladies occupationnelles causées par l’exposition aux bioaérosols non infectieux ... 15 1.5.1 Effets des endotoxines ... 15 1.5.2 Maladies d’hypersensibilité ... 15 1.5.3 Syndrome de choc toxique aux poussières organiques ... 16 1.5.4 Maladies pulmonaires obstructives chroniques ... 17 1.5.5 Asthme et inflammation des voies respiratoires ... 17 1.6 Notions d’immunité pulmonaire ... 18 1.6.2 La cellule dendritique ... 20 1.6.2.1 Signaux d’activation des cellules dendritiques ... 21 1.6.2.2 Maturation des cellules dendritiques et présentation de l’antigène ... 23
CHAPITRE II : PROBLÉMATIQUE, HYPOTHÈSE ET OBJECTIFS ... 25 2.1 Problématique ... 25 2.2 Hypothèse et objectifs ... 25 CHAPITRE III : Les composantes des bioaérosols influencent la cinétique et la magnitude d’activation des cellules dendritiques. ... 27 3.1 Résumé ... 28 3.2 Abstract ... 29 3.3 Introduction ... 30 3.4 Material and Methods ... 32 3.4.1 BMDC culture and stimulation ... 32 3.4.2 Flow cytometry analyses ... 32 3.4.3 ELISA ... 33 3.4.4 Collection and processing of air samples ... 33 3.4.5 Endotoxin and total organic dust quantification ... 33 3.4.6 Total DNA extraction ... 33 3.4.7 Quantitative real-time polymerase chain reaction (qPCR) ... 34 3.4.8 Statistical analyses ... 34 3.5 Results ... 36 3.5.1 Differing impact of bioaerosol components on dendritic cell activation ... 36 3.5.2 Combination of agents quantitatively and qualitatively influences BMDC activation ... 38 3.5.3 Relative BMDC activation stratifies occupational settings ... 39 3.5.4 Endotoxin content underestimates the potential of BMDC activation by complex samples ... 42 3.6 Discussion ... 44 3.7 Conclusions ... 47 3.8 Acknowledgments ... 48 3.9 Footnotes ... 49 3.10 References ... 50 3.11 SUPPLEMENTARY MATERIALS ... 55 3.11.1 Supplementary material and methods ... 56 3.11.1.1 Media and reagents ... 56 3.11.1.2 Quantification of endotoxin recovery from different air samplers ... 56 3.11.2 Supplementary results ... 57 3.11.2.1 The SASS® 3100 Dry Air Sampler yields concentrated air sample eluates with valid endotoxin levels. ... 57 3.11.3 Supplementary figure ... 58 CHAPITRE IV : Le modèle inflammation pulmonaire généré in vivo par les éluats d’air issus d’environnements de travail ... 59 4.1 Matériel et méthodes du modèle in vivo ... 59 4.1.1 Expérimentations relatives au modèle murin ... 59 4.1.2 ELISA ... 60 4.1.3 Analyses statistiques ... 60
4.2 Résultats ... 60 CHAPITRE V: DISCUSSION ... 63 5.1 Les méthodes de culture cellulaire et de récolte d’échantillon d’air sont robustes ... 64 5.2 Les composantes des bioaérosols ont des effets additifs sur l’activation des cellules dendritiques ... 66 5.3 Limitations du modèle de cellules dendritiques pour prédire l’inflammation générée in vivo ... 66 5.4 Limitations de l’étude ... 68 CONCLUSIONS ET PERSPERCTIVES ... 71 Conclusions ... 71 Perspectives ... 71 Bibliographie ... 75
Liste des tableaux
Liste des figures
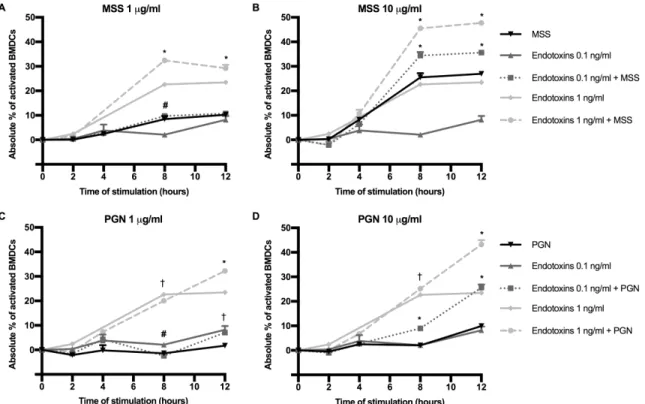
Figure 3.1 Differential BMDC activation by individual or combined bioaerosol
components. ... 37
Figure 3.2 Combination of agents modulates the kinetics and the magnitude of
BMDC activation. ... 39
Figure 3.3 Characterization of environmental samples.. ... 41 Figure 3.4 Differential BMDC activation by environmental samples.. ... 42 Figure 3.5 BMDC activation correlates with the amount of total organic dust,
endotoxins and total bacteria in airborne samples.. ... 43
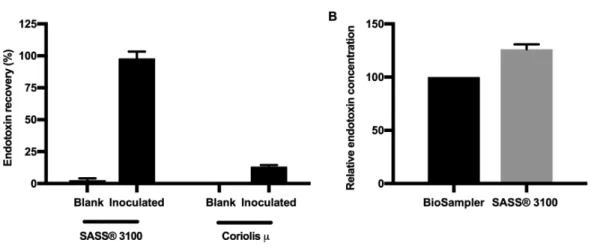
Figure 3.6 SASS 3100 efficiently samples endotoxins.. ... 58 Figure 4.1 Le potentiel immunogène des éluats d'air d'environnements de travail
Liste des abréviations
ADN : Acide désoxyribonucléique ARL : récepteurs de type AIM2 ARN : Acide ribonucléique
BMDC : Bone marrow-derived dendritic cells CD : Cluster of differenciation
CMH : Complexe majeur d’histocompatibilité DAMPs : Danger-associated molecular patterns DC : Dendritic cells
ELISA : Enzyme-Linked Immunosorbent Assay EU : Endotoxin Unit (Unité d’endotoxine)
GM-CSF : Granulocyte macrophage colony-stimulating factor IFN-γ : Interféron gamma
IL- : Interleukine
IOM : Institut of Occupational Medecine LBA : Lavages bronchoalvéolaires LPS : Lipopolysaccharide
MBS : Methanobrevibacter smithii MHC : Major histocompatibility complex mL : mililitre
MSS : Methanosphaera stadtmanae
PAMPs : Pathogen-associated molecular patterns
RLR : récepteurs de type RIG-I (retinoic acide-inducible gene-1-like receptors) PBS : Phosphate buffered saline
PCR : Polymerase chain reaction PE : Phycoérythrine
PGN : Peptigoglycane
SASS : Smart Air Sample System
SDRA : Syndrome de détresse respiratoire aigu
STEPO : Syndrome toxique des poussières organiques (ODTS) SR : Saccharopolyspora rectivirgula
TCR : Récepteur des cellules T TNF : Tumor necrosis factor % : Pourcentage
«Elle était un fil d’or qui courait droit, dans la trame d’un tapis tissé par un fou.» -Alessandro Baricco
Remerciements
Mon projet de maîtrise n’aurait pas eu lieu sans l’aide de plusieurs personnes. Je tiens tout d’abord à remercier mon directeur de recherche David Marsolais de m’avoir accueillie dans son laboratoire. Merci de m’avoir fait confiance pour faire rouler le projet et de m’avoir aidé à évoluer dans le monde de la recherche. Je remercie également tous les membres de l’équipe.
J’aimerais aussi remercier ma codirectrice Caroline Duchaine et les membres de son équipe dont Marc, Valérie, Jonathan et Vanessa, qui m’ont grandement aidé pour l’échantillonnage des environnements terrains, mais également pour tout le volet portant sur les bioaérosols.
Un remerciement spécial pour Pascale, sans qui je n’aurais pas accompli la moitié de ce j’ai entrepris pendant ma maîtrise. Merci de m’avoir écouté chanter comme un pied, de m’entendre chialer et de m’avoir écouter et aider pour mon travail et ma vie personnelle. Je te souhaite beaucoup de bonheur et au plaisir de te revoir à la piscine avec tes petits monstres.
Merci à Carole-Ann d’avoir contribué à mon alcoolisme et de m’avoir encourager à me pratiquer au chant dans nos soirées karaoké. Tu as été une collègue parfaite qui me donnait le goût d’aller travailler et maintenant que je quitte, je suis heureuse de te considérer comme l’une de mes amies.
Je tiens également à remercier les organismes subventionnaires de Institut de recherche Robert-Sauvé en santé et en sécurité du travail (IRSST) ainsi que le Réseau en Santé Respiratoire du Québec pour le soutient financier tout au long de ma maîtrise.
Un dernier remerciement pour mes parents, qui m’ont toujours encouragé et soutenu dans ce qui me semblait être ma voie, malgré le fait que j’en ai eu plusieurs. Je vous aime.
Avant-propos
Ce mémoire comporte six chapitres. Le premier chapitre comporte une brève introduction sur les bioaérosols et les cellules dendritiques. Le deuxième chapitre présente l’hypothèse et les objectifs de ce mémoire. Le troisième présente la majorité des méthodologies et des résultats obtenus dans le cadre de cette maîtrise sous la forme d’un article scientifique. Les résultats qui n’ont pas été insérés dans l’article scientifique sont présentés dans le quatrième chapitre. Les résultats du quatrième chapitre et la discussion de ce mémoire ont été publiés par l’IRSST dans la collection des Études et recherches (# de rapport 2010-0061). Des modifications mineures ont été apportées au texte pour des fins d style et de formatage. Enfin, les cinquième et sixième chapitres portent sur la discussion ainsi que les conclusions et perspectives, respectivement.
Article scientifique
L’article «Organic components of airborne dust influence the magnitude and kinetics of dendritic cell activation» a été publié dans le journal Toxicology in vitro. À titre de première auteure, j’ai effectué la majorité des expériences, l’échantillonnage des environnements terrains, l’analyse des résultats, ainsi que l’ébauche de l’article scientifique. Dre Pascale Blais Lecours a participé aux expériences et à la rédaction de l’article. Dre Valérie Létourneau et Marc Veillette ont collaboré à l’échantillonnage, à la caratérisation des bioaérosols et ont participé à la révision de l’article scientifique. Dre Caroline Duchaine a participé à l’élaboration du projet, a fourni une expertise scientifique tout au long du projet et a participé à la rédaction de l’article. Dr David Marsolais a élaboré le projet de recherche, supervisé les travaux ainsi que la rédaction de l’article scientifique.
INTRODUCTION
Plusieurs environnements de travail sont hautement contaminés par des bioaérosols qui peuvent engendrer une variété de pathologies respiratoires, dont les réactions d’hypersensibilité et le syndrome toxique des poussières organiques (Lecours et al. 1986), En ce moment, il n’y a aucun consensus sur la nature des composantes néfastes des bioaérosols et il demeure difficile d’établir des valeurs critiques d’exposition en se basant sur la quantification d’agents individuels (Letourneau et al. 2010). Cela témoigne de la complexité des différentes intéractions entre les composantes des biosérosols. Il est donc important de mieux définir l’impact de ces interactions sur les déterminants de la réponse immune pulmonaire. Ainsi, on reconnait un rôle primordial pour la cellule dendritique dans l’initiation de la réponse immune pulmonaire et cette dernière est centrale à l’initiation de réponses immunopathologiques induites par les bioaérosols (Banchereau et al. 2000).
Le but de ce projet est de déterminer comment différentes composantes des bioaérosols influencent l’activation des cellules dendritiques. La modulation de l’expression des marqueurs CD86 et CMH II offre une plage dynamique suffisante pour discriminer les agents immunogènes (endotoxines (Holst et al. 1996), espèces d’archaea (Blais Lecours et al. 2011), peptidoglycane, moisissures et Saccharopolyspora rectivirgula (Blais Lecours et al. 2012) des contrôles. L’analyse des agents individuels et leurs combinaisons sur l’activation des cellules dendritiques à mener à l’obtention d’un modèle biologique robuste afin de discriminer l’immunigénicité des bioaérosols. Le modèle cellulaire a également permis de stratifier le statut sanitaire de l’air échantillonné provenant de plusieurs environnements de travail, qui a été confimé avec un modèle d’inflammation murin in vivo.
Une meilleure compréhension de l’effet des bioaérosols sur le développement de pathologies respiratoires permettra l’élaboration d’outils biologiques visant à évaluer les indices sanitaires des environnements de travail.
CHAPITRE I: REVUE DE LITTÉRATURE 1.1 Les bioaérosols
Les bioaérosols sont des particules liquides ou solides d’origine biologique retrouvées en suspension dans l’air. Ces particules incluent tous les organismes vivants ou morts dont les bactéries entières et fragmentées, les moisissures et leurs spores, les virus, ainsi que les fragments allergènes des plantes, d’insectes et d’animaux (Douwes et al. 2003). Les bioaérosols sont souvent associés à diverses pathologies pulmonaires. En effet, plusieurs microorganismes et leurs composantes ont des propriétés infectieuses, allergènes, inflammatoires et/ou toxiques (Heederik et al. 2007). Il est à noter que la problématique infectieuse des bioaérosols ne fait pas l’objet de ce mémoire.
1.1.1 Composantes immunogènes des bioaérosols 1.1.1.1 Les bactéries
Les bactéries colonisent tant l’humain que l’animal, on les retrouve donc en quantité importante dans certains environnements fréquentés par ces derniers, dont plusieurs milieux de travail confinés. Effectivement, les environnements cloisonnés où se retrouvent une forte concentration animale ou une grande quantité de matière biologique sont plus sujets à l’accumulation de bactéries dans l’air. Par exemple, on retrouve environ 108 bactéries/m3 d’air dans une porcherie, ce qui correspond à l’inhalation de 1010 bactéries par jour chez l’ouvrier agricole en
production porcine (Nehme et al. 2008). Les bactéries peuvent être fragmentées lors de l’aérosolisation, ce qui résulte en la libération des composantes de leur membrane ou de leur cytosol. Plusieurs études confirment que des expositions aiguës et/ou chroniques à des bactéries ou à leurs composantes puissent occasionner des effets néfastes sur la santé respiratoire (Poole and Romberger 2012).
1.1.1.2 Les endotoxines
Les endotoxines sont des molécules ancrées à la surface des membranes externes des bactéries à Gram négatif. Elles sont libérées lors de la lyse ou de la division cellulaire. Elles peuvent être alors aérosolisées et par la suite inhalées (Mattsby-Baltzer et al. 1991). Les endotoxines sont des lipopolysaccharides (LPS) bioactifs composés d’un lipide ainsi que d’une région glucidique. Les termes endotoxines et LPS sont souvent utilisés pour désigner les mêmes agents dans la littérature (Holst et al. 1996; Schwarz et al. 2017). Pour des raisons de clarté, le terme endotoxine sera utilisé dans ce mémoire. Les endotoxines sont composées d’une longue chaine d’hétéropolysaccharides nommée chaine O-spécifique, d’un noyau d’oligosaccharides et d’un lipide A, qui lui confère sa toxicité (Mayeux 1997). Les chaines O-spécifiques varient entres les divers espèces bactériennes, alors que les noyaux d’oligosaccharides diffèrent au niveau des souches bactériennes. Les séquences d’acides gras des lipides A sont quant à elles généralement conservées, mais des modifications mineures dans ces dernières ont des répercussions énormes sur la réponse immune (Albiger et al. 2007; Backhed et al. 2003; Dixon and Darveau 2005). Donc, on retrouve une variété d’endotoxines dans l’air dont l’impact pro-inflammatoire varie entre les espèces bactériennes.
La réponse inflammatoire face aux endotoxines dépend de plusieurs facteurs comme le temps d’exposition, la concentration, la génétique de l’individu exposé, ainsi que les effets protecteurs ou synergiques des autres agents présents dans les bioaérosols (Vandenbulcke et al. 2006).
Les effets cytotoxiques et inflammatoires des endotoxines ont été évalués sur divers types cellulaires. Il a été démontré que le récepteur de type Toll (TLR) 4, impliqué dans l’immunité innée, permet la reconnaissance cellulaire des endotoxines. Effectivement, l’activation du TLR4 par les endotoxines des cellules dendritiques dérivées de moelle osseuse induit leur activation ainsi que la sécrétion de cytokines pro-inflammatoires (Kaisho et al. 2001). De plus, les endotoxines purifiées de diverses espèces bactériennes induisent une sécrétion
différentielle d’IL-8 dans les cellules épithéliales alvéolaires A549 (Hansen et al. 1999). Les macrophages alvéolaires murins augmentent leur synthèse d’IL-6 ainsi que de TNF suite à l’exposition de 1 µg/ml d’endotoxines (Raoust et al. 2009). Malgré le pouvoir inflammatoire reconnu des endotoxines, aucun effet dose-réponse ne permet de prédire l’induction de pathologies respiratoires suite à leur exposition (Poole and Romberger 2012). Certaines études font état des travailleurs asymptomatiques exposés à de fortes concentrations d’endotoxines (Rask-Andersen 1989), tandis que d’autres études démontrent des déclins de la fonction respiratoire lorsque les sujets sont exposés à de faibles doses d’endotoxines. Par exemple, Zock et al. ont démontré que les travailleurs de l’industrie de transformation de patates exposés à 21 EU/m3 d’air rapportaient plus de symptômes que le groupe exposé à de plus fortes concentrations d’endotoxines (56 EU/m3 d’air). Par contre, le groupe exposé aux fortes concentrations de cet agent présentait un déclin de la fonction pulmonaire plus important (Zock et al. 1998). Ainsi, les endotoxines sont notoirement pro-inflammatoires, mais leur impact sur l’induction de pathologies associées à l’exposition aux bioaérosols demeure énigmatique.
1.1.1.3 Les peptidoglycanes
Les peptidoglycanes sont des composantes majoritaires des membranes des bactéries à Gram positif et sont présents de façon minoritaire chez les bactéries à Gram négatif. Les peptidoglycanes composent le squelette de la cellule et permettent à la bactérie de résister à la pression osmotique. Ils se composent principalement de peptides dont les acides muramique et N-acétyle-glucosamine, ainsi que d’une portion glucidique (Willey et al. 2011). Il existe encore peu d’études sur les effets des peptidoglycanes sur les fonctions pulmonaires. Par contre, il est connu que l’inhalation de peptidoglycanes peut causer une augmentation de l’infiltration de cellules polynucléées dans les alvéoles ainsi qu’une production de cytokines pro-inflammatoires (Leemans et al. 2002), ce
qui supporte que ces dernières peuvent également causer une réponse inflammatoire au poumon.
1.1.1.4 Les moisissures
Des dizaines de milliers de moisissures se dispersent dans l’air des environnements de travail où la matière organique et l’humidité sont abondantes. Elles produisent des spores ou des conidies qui sont essentielles à leur reproduction et à leur dissémination. La taille des spores varie de 1,5 à 12 µm selon l’espèce (Cox and Wathes 1995; Ruzer and Harley 2005). Elles sont donc inhalables et potentiellement nocives à la santé respiratoire. En effet, certaines spores de moisissures peuvent provoquer des infections des voies respiratoires comme l’aspergillose causée par Aspergillus fumigatus.
Mis à part les infections, les moisissures peuvent induire des allergies, des pneumopathies d’hypersensibilité, de l’asthme, de l’inflammation pulmonaire ainsi que des chocs toxiques (Cooley et al. 2004; Portnoy et al. 2005). En effet, les moisissures des genres Penicillium, Aspergillus, Cladosporium sont fréquemment retrouvées dans les environnements de travail et sont des sources importantes d’allergènes (Samson 1985).
Les (1—>3)-β-D-glucanes sont des polymères de glucose avec divers branchements 1—>3 et composent la paroi cellulaire des moisissures, des plantes et de certaines bactéries. Les β-D-glucanes ont été retrouvées dans l’air des porcheries et des usines de broyage de bois à des concentrations de 1,37 ng/m3 et de 2,32 ng/m3 (Alwis et al. 1999). La stimulation des cellules totales du sang humain avec des doses élevées de β-D-glucanes (25 µg) a induit la production de cytokines pro-inflammatoires dont TNF, IL-1β, IL-6 et IL-8, ce qui confirme leur potentiel inflammatoire (Wouters et al. 2002). Toutefois, l’étude de Fogelmark et al. démontre des effets protecteurs et additifs entre les endotoxines et les glucanes. Effectivement, l’infiltration neutrophilique causée par l’inhalation d’endotoxines dans un modèle d’inflammation aiguë murin est réduite par l’inhalation combinée
de β-D-glucanes (Fogelmark et al. 1992). Par contre, l’exposition chronique aux deux agents réduit l’adaptation du système immunitaire aux endotoxines seules. Cela se traduit par une persistance de l’accumulation neutrophilique pulmonaire et du dommage pulmonaire (Fogelmark et al. 1994). Par contre, aucune conclusion des études épidémiologiques ne permet de faire des associations étiologiques entre l’exposition aux moisissures ou aux β-D-glucanes et l’induction de pathologies respiratoires (Douwes 2005).
Les moisissures produiront divers types de métabolites ou de composés secondaires suite à la dégradation des matières organiques, dont des composés volatiles organiques et des mycotoxines. Les composés volatils organiques sont induits lors de la prolifération fongique et sont reconnus pour causer de l’irritation des muqueuses des voies respiratoires. Les mycotoxines sont des particules de faibles poids moléculaires non volatiles qui peuvent être aérosolisées si la matière où elles se trouvent est agitée. La plupart des études sur les mycotoxines effectuées sur des modèles animaux ont utilisé une voie d’administration par ingestion (Robbins et al. 2000). Par contre, des effets cytotoxiques ont été répertoriés dans plusieurs modèles in vitro (Bunger et al. 2004). De plus, Schutze et al. ont démontré une aggravation de la réaction allergique des souris asthmatiques lorsqu’elles sont exposées à des mycotoxines (Schutze et al. 2010). Encore une fois, bien que les composantes isolées de moisissures puissent causer des réactions inflammatoires, leur effet sur la santé humaine semble mitigé dans le contexte de l’exposition à des mélanges de composantes, tels que retrouvés dans les bioaérosols
1.1.1.5 Microorganismes contenus dans les bioaérosols dont les propriétés inflammatoires ont été caractérisées
Saccharopolyspora rectivirgula est une actinomycète thermophile se retrouvant majoritairement dans la paille et le foin humides utilisés dans les secteurs agricoles. Cette bactérie est l’agent étiologique de la maladie du poumon du
fermier, une forme d’alvéolite allergique extrinsèque, qui s’inscrit dans le registre des pneumopathies d’hypersensibilité. Sa prolifération et son aérosolisation sont optimales lorsque la température augmente à l’intérieur des balles de foin en raison de leur mauvais entreposage (mouillées, non enveloppées, bâtiments non ventilés) (Cormier 2014). Les cas fulgurants de poumon de fermier sont dorénavant rares. Néanmoins ses niveaux détectables dans les fermes laitières et les usines de compostage (Blais Lecours et al. 2012; Schafer et al. 2013) suggèrent que cet agent délétère à la santé humaine puisse encore contribuer à l’impact immunopathologique des bioaérosols.
Les archées sont des organismes vivants partageant les caractéristiques des eucaryotes et des bactéries. Les archées ont été récemment quantifiées en quantité importante (108 par m3 d’air) dans l’air des porcheries (Nehme et al. 2009), des fermes laitières (105 par m3 d’air) (Blais Lecours et al. 2012), des poulaillers (106 par m3 d’air) (Just et al. 2013) et des usines de traitement des eaux usées (104 par m3 d’air) (Blais Lecours et al. 2014b), ce qui s’explique par le fait que ces dernières colonisent le tractus intestinal des humains et des animaux. Methanosphaera stadtmanae (MSS) et Methanobrevibacter smithii (MBS) sont les espèces d’archées les plus retrouvées en milieux de travail.
MSS induit une accumulation de leucocytes après trois semaines d’exposition intranasale dans un modèle murin (Blais Lecours et al. 2011). De plus, l’activation des cellules dendritiques dérivées de monocytes humains confirme que MSS induit une réponse inflammatoire plus importante que MBS, ce qui était supporté par une forte accumulation de TNF et de IL-1β dans le surnageant cellulaire (Bang et al. 2014). Cet effet différentiel entre les archées pourrait être dû à la composition de leurs lipides membranaires, les archaeols et les caldarchaeols (Krishnan and Sprott 2008; Sprott et al. 2003), puisque diverses espèces d’archées possèdent différentes proportions de ces lipides (Patel and Sprott 1999). Toutefois, on ne connaît toujours pas les facteurs qui expliquent les différences pro-inflammatoires de différentes espèces d’archées.
1.1.1.6 Autres composantes immunogènes
Plusieurs autres composantes des bioaérosols peuvent avoir des propriétés infectieuses et/ou immunogènes. Effectivement, les virus peuvent être retrouvés dans plusieurs environnements de travail. Par exemple, plusieurs virus comme l’adénovirus, le virus de l’hépatite A ou de l’herpès simplex de type 1 ont été retrouvés dans les aérosols produits dans un centre de traitement des eaux usées (Brisebois et al. 2017). Outre leur potentiel infectieux, les composantes des virus, même inactivés ont également la capacité d’induire l’activation des cellules du système immunitaire via l’activation des récepteurs aux signaux de danger, dont les TLRs (Akira and Takeda 2004).
Les protéases ont également des pouvoirs inflammatoires, mais leurs effets pulmonaires demeurent très peu connus. Les travailleurs de l’industrie des fruits de mer sont constamment exposés aux protéases de poisson lors de la transformation des aliments. En effet, une stimulation combinée d’endotoxines et de trypsine de saumon induit une augmentation synergique de l’expression de NF-κB et d’IL-8 dans les cellules épithéliales A549 (Bhagwat et al. 2015). De plus, les protéases pourraient influencer la réponse immune en activant certaines interleukines (Cayrol et al. 2018) et en activant des récepteurs activés par les protéases (PAR) (Bang et al. 2009; Larsen et al. 2008). Le tout peut altérer la perméabilité de l’épithélium, ce qui se traduit par la détérioration de la fonction de la capture et la présentation de l’antigène dans les muqueuses respiratoires. En conclusion de cette section, on comprend donc que plusieurs composantes des bioaérosols ont des effets potentiellement délétères. Toutefois, il semble que l’interaction entre ces dernières puisse moduler leur impact sur la santé humaine. Ceci pourrait expliquer, du moins en partie, notre capacité limitée à prévoir l’impact délétère des bioaérosols sur la base de la mesure de déterminants simples et d’agents isolés suivant l’échantillonnage terrain.
1.2 L’échantillonnage et l’étude des bioaérosols
L’analyse des bioaérosols est un champ d’expertise complexe rempli de défis techniques. Effectivement, il n’existe aucune méthodologie permettant de caractériser l’ensemble de la charge diversifiée des bioaérosols dans un échantillon. Il est donc primordial de jumeler divers outils de détection et de quantification des bioaérosols afin d’obtenir un portrait général des contaminants de l’air. Des choix ont donc dû être effectués quant aux méthodes d’échantillonnage, d’analyse des microorganismes viables, d’extraction d’ADN et d’entreposage des échantillons en regard des paramètres étudiés dans ce mémoire. Ces choix ont d’ailleurs été guidés par une série d’expériences présentées au chapitre IV. Afin de familiariser le lectorat avec cette problématique, la prochaine section fait état des méthodes classiques d’échantillonnage et d’analyse en aérobiologie.
1.2.1 Les échantillonneurs d’air
Une multitude d’échantillonneurs d’air munis de fonctions et de particularités différentes sont disponibles sur le marché. Certains sont des échantillonneurs à haut débit, d’autres permettent la récolte de bactéries selon leur taille; les endotoxines environnementales; les virus, la poussière totale et autres. Il existe peu d’études comparatives de tous les échantillonneurs d’air, mais de nouvelles solutions technologiques sont proposées. Une étape de validation est donc souvent requise de manière à optimiser l’échantillonnage de l’air pour des besoins précis.
La sélection de l’échantillonneur dépend du type d’échantillonnage ainsi que la nature de l’analyse des échantillons. Pour ce projet, l’échantillonnage des endotoxines, la concentration des éluats d’échantillons d’air ainsi que l’utilisation d’un éluant physiologique étaient les critères de sélection absolus. En effet, l’échantillonnage d’air visant à jumeler la culture cellulaire et le volet d’exposition dans un modèle murin obligeaient l’utilisation d’un éluant physiologique. Ainsi,
nous avons sélectionné trois échantillonneurs d’air à comparer dans notre étude, soit le BioSampler, qui est l’échantillonneur de choix pour la quantification des endotoxines, le Coriolis µ® et le SASS 3100, deux échantillonneurs à haut débit permettant une récolte concentrée des particules retrouvées dans l’air.
1.2.1.1 Le SKC BioSampler
Le SKC BioSampler est un échantillonneur d’air fait uniquement de verre, ce qui le rend idéal à l’échantillonnage des endotoxines, vu leur susceptibilité d’adsorption aux plastiques (AssociatesofCapeCod 1988). Il s’agit d’un échantillonnage d’impaction par centrifugation. Il est composé de trois buses permettant de diviser le flot d’air afin de minimiser l’impact des particules échantillonnées sur les parois de l’échantillonneur et de créer un vortex limitant la production d’aérosols. L’échantillonneur est cependant utilisé à un flux d’air de 12,5 L/min pour un maximum de 0,25 m3 d’air échantillonné, ce qui limite grandement la concentration des échantillons d’air.
1.2.1.2 Le Coriolis µ®
L’échantillonneur d’air Coriolis µ® est basé sur une technologie cyclonique. Le flux d’air permet l’impaction des particules sur les parois du récipient rempli de liquide. Le Coriolis µ® peut échantillonner de 100 L à 300L/minutes jusqu’à concurrence de 10 minutes, permettant une concentration importante de l’échantillon d’air dans une solution aqueuse, ce qui est compatible avec une utilisation ultérieure in vitro. Toutefois, les récipients du Coriolis µ® sont constitués de polymères qui nécessitent l’utilisation de détergents pour l’extraction des endotoxines, ce qui n’est pas compatible avec la culture cellulaire et les modèles in vivo. Effectivement, des concentrations faibles de détergent altèrent les membranes lipidiques des cellules de mammifère, ce qui engendre la mort. D’ailleurs les détergents nécessaires à la récupération des endotoxines sont souvent utilisés pour la lyse cellulaire en vue d’études biochimiques (Seddon et al. 2004). Si ce phénomène est incompatible avec les essais in vitro sur cellules fonctionnelles, l’utilisation de
détergents risque également d’attaquer le surfactant pulmonaire in vivo (administration directe dans les voies aériennes), ce qui est susceptible de causer de la détresse respiratoire (Jain et al. 2017). De plus, la dissolution des membranes cellulaires in vivo causera également un relargage de signaux de dangers, et ainsi induira de l’inflammation aiguë.
1.2.1.3 Smart Air Sampler System 3100 (SASS 3100)
Le SASS 3100 est un échantillonneur d’air à haut débit, pouvant échantillonner jusqu’à 310 L/min. La récolte des échantillons d’air se fait sur un filtre chargé permettant d’emprisonner les particules dans un champ électrostatique. Le fabriquant suggère l’utilisation de détergent dans l’éluant afin de maximiser la récolte des bioaérosols et des endotoxines échantillonnées. Cependant, le taux de recouvrement des endotoxines n’a pas été évalué avec ou sans l’ajout de détergent. La comparaison de la récupération des endotoxines sans détergent entre le SKC BioSampler et le SASS 3100 fait l’objet des résultats supplémentaires du chapitre III.
1.2.2 Caractérisation des bioaérosols
La caractérisation des composantes des bioaérosols est essentielle à la compréhension de leur potentiel immunopathologique. Elle permet également d’identifier des agents ou des associations d’agents impliqués dans l’induction de la pathogenèse de maladies respiratoires. Pour ce faire, diverses méthodes de caractérisation sont utilisées afin de maximiser l’identification des microorganismes présents dans les échantillons. Par exemple, afin de quantifier les microorganismes viables, on utilise des milieux gélosés propices à la croissance de l’organisme ciblé. Par contre, des milliers de microorganismes sont encore inconnus ou non cultivables (Blais-Lecours et al. 2015). Donc, il est essentiel d’utiliser une variété de techniques de quantification. Les méthodes de caractérisation sont complémentaires, mais aucune ne permet de connaitre la composition totale d’un échantillon d’air. En effet, la caractérisation effectuée ne
pourra donc pas prédire complètement le potentiel immunogène d’un échantillon d’air selon sa composition, mais pourra suggérer un indice valable du potentiel inflammatoire des composantes l’air.
La biologie moléculaire permet l’identification de microorganismes individuels ou d’un groupe plus global comme les bactéries totales d’un échantillon. La technique qPCR permet la quantification des bactéries totales dans un échantillon complexe en ciblant le gène 16S de l’ARN ribosomal bactérien (Bach et al. 2002) ou archéen (Baker et al. 2003; Reysenbach and Pace 1995). Elle permet alors de quantifier les bactéries et les archées totales d’un échantillon d’air. Elle permet également de cibler des régions spécifiques de l’ARN ribosomal 16S d’organismes comme Saccharopolyspora rectivirgula (Schafer et al. 2011) et du gène mtaB1 de l’archée Methanobrevibacter smithii (Blais Lecours et al. 2014a) et nifH de Methanospahera stadtmanae (Johnston et al. 2010). Il est également possible de caractériser en profondeur le contenu bactérien et fongique des échantillons d’air obtenus. Le séquençage à haut débit permet l’identification rapide des espèces de microorganismes présents dans un échantillon.
Les composantes cytosoliques ou de la paroi des microorganismes doivent être quantifiées à l’aide de méthodes physiques, chimiques et/ou enzymatiques. Les endotoxines peuvent être quantifiées à l’aide de l’essai de lysat d’amebocytes de limules (LAL) (Obayashi et al. 1985). Le sang des limules coagule lorsqu’il entre en contact avec des endotoxines. Ceci permet de quantifier les endotoxines dans les échantillons avec l’ajout de produits colorimétriques à l’essai permettant une lecture en mode cinétique au spectrophotomètre. Pour cet essai, il est essentiel d’utiliser un inhibiteur des β-D-glucanes puisqu’ils interviennent dans la cascade enzymatique de l’essai et créent des faux positifs. Une méthode de quantification similaire est utilisée pour β-D-glucanes de façon spécifique (Iossifova et al. 2007). L’acide muramique est utilisé comme marqueur spécifique des peptidoglycanes par spectrométrie de masse. Des essais enzymatiques à base de plasma de larve de vers de soie sont également utilisés (Tsuchiya et al. 1996). Cependant, cet
essai n’est pas spécifique puisqu’il quantifie les β-D-glucanes et les peptidoglycanes de façon concomitante (Tsuchiya et al. 1996).
La poussière organique totale est souvent utilisée comme paramètre d’analyse pour la qualité de l’air, puisqu’elle correspond à la totalité des aérosols échantillonnés en masse. Alors que les cassettes IOM (Institut of Occupational Medecine) munies d’un filtre en polycarbonate étaient l’outil de choix utilisé par le passé pour quantifier la poussière totale dans un échantillon d’air (Thorne et al. 1997), il est maintenant possible d’utiliser des appareils portatifs tel le DustTrak™ DRX Aerosol Monitor Model 8534 (TSI, St Paul, MN), permettant de quantifier sur place les particules de poussières présentes dans l’air (Chung et al. 2001). Les données du DustTrack stratifient les particules échantillonnées en fonction de leurs tailles. Les résultats sont classés selon le diamètre aérodynamique des particules entre 10 et 1 µm.
1.3 Environnements contaminés par les bioaérosols
Plusieurs environnements de travail se situent dans un intervalle de faiblement à hautement contaminés en bactéries totales, en endotoxines et en poussières organiques totales. Ceux portant de fortes charges de particules organiques comprennent les environnements de travail cloisonnés, donc à confinement élevé, qui sont plus susceptibles d’être très contaminés par les bioaérosols (Thorne et al. 2016). On peut penser au milieu de travail agricole, tels les établissements de production porcine, de fermes laitières et de poulaillers. Des études ont répertorié de 0,28 à 6,62 mg/m3 d’air de poussières totales dans des porcheries (Predicala
and Maghirang 2003), d’environ 8 et 1 mg/m3 d’air dans les poulaillers (Blais
Lecours et al. 2014b) et les fermes laitières (Basinas et al. 2014; Cathomas et al. 2002) respectivement. Certains milieux de travail contemporains industriels sont soumis à la même problématique de l’exposition aux bioaérosols. Effectivement, entre 107-108 bactéries ont été quantifiées par l’ARN 16 S dans les usines de traitement des eaux usées (Blais Lecours et al. 2014b). Les usines de compostage
possèdent une concentration variant entre 105-106 bactéries dans l’air de l’espace de travail (Bru-Adan et al. 2009). Les usines de machinage, les usines de production de papier et les usines de la foresterie ont toutes des particules organiques présentes dans l’air (Thorne et al. 2016). D’autres environnements sont beaucoup moins touchés par cette problématique, comme les écoles et les garderies, ainsi que les édifices à bureaux, qui ne dénombrent qu’un maximum de 104 organismes/m3 d’air (Thorne et al. 2016).
1.4 Valeurs limites d’exposition occupationnelles
Un faible nombre de valeurs limites d’exposition existe en raison de la difficulté à établir des relations de cause à effet entre les composantes des bioaérosols et le développement de pathologies. La majorité de ces normes sont établies sur la quantité de poussières organiques totales de farine, de bois ou de coton par exemple, allant de 0,2 à 5 mg/m3 d’air (Eduard et al. 2012). On retrouve également une limite d’exposition pour la protéase subtilisine de Bacillus subtilis, qui est de 60 ng/m3 (Basketter et al. 2010). Par contre, aucune limite d’exposition n’existe pour les autres composantes des bioaérosols pourtant reconnues pour leurs effets nocifs sur la santé pulmonaire humaine.
Certaines recommandations ont toutefois été formulées quant à l’exposition aux endotoxines et aux spores de moisissures. Des concentrations allant de 50 à 90 EU/m3 ont été suggérées pour les endotoxines (Eduard et al. 2012; Heederik and Jeroen 1997). Cependant, la recommandation peut rarement s’appliquer puisque plusieurs environnements de travail excèdent cette limite, et par le manque de corrélation entre la concentration des endotoxines et l’induction des pathologies respiratoires (Poole and Romberger 2012). Les recommandations pour les spores sont plutôt basées sur les niveaux les plus bas où des effets négatifs sont observés. Les moisissures pathogènes produisant des mycotoxines auront des seuils plus bas que ceux des moisissures non pathogènes. En somme, les seuils de tolérance répertoriés pour les individus non allergiques se situent à
105 spores/m3 d’air pour une grande majorité de moisissures (Eduard 2009). Il demeure pourtant plusieurs composantes ayant un potentiel inflammatoire qui ne possèdent pas de valeurs limites d’exposition.
1.5 Maladies occupationnelles causées par l’exposition aux bioaérosols non infectieux
L’exposition aux bioaérosols est souvent associée à diverses pathologies respiratoires non infectieuses. En effet, plusieurs composantes des bioaérosols ont des propriétés immunogènes, allergènes, inflammatoires et/ou toxiques, ce qui augmente l’éventail des maladies respiratoires occupationnelles. Certaines maladies sont de type non allergique comme le STEPO, ainsi que de type allergique ce qui inclut l’asthme allergique et l’alvéolite allergique extrinsèque.
1.5.1 Effets des endotoxines
Les endotoxines sont impliquées dans l’induction de l’inflammation pulmonaire qui, ensuite, peut engendrer des complications à long terme. Plusieurs études in vivo ont permis de mieux comprendre les effets des endotoxines sur la réponse inflammatoire et immunitaire (Dearman et al. 2009; Letourneau et al. 2010; Liu et al. 2009; Punsmann et al. 2013; Timm et al. 2009). L’inhalation d’endotoxines induit une infiltration de neutrophiles dans les voies aériennes ainsi qu’aux poumons, le tout orchestré par des facteurs chimiotactiques sécrétés par les macrophages alvéolaires, dont IL-8 (Rylander 2002; Snella 1986). Également, une exposition chronique de quatre semaines aux endotoxines aérosolisées provoque une modification dans l’architecture du parenchyme pulmonaire menant à l’emphysème (Brass et al. 2008).
1.5.2 Maladies d’hypersensibilité
Une exposition chronique à des composantes spécifiques peut induire diverses formes de pneumopathies d’hypersensibilité ou d’alvéolite allergique extrinsèque
(Selman et al. 2012). Il s’agit d’une pathologie immunoallergique reliée à une exposition répétée à un antigène (Bourke et al. 2001). Effectivement, le travailleur sera préalablement sensibilisé à l’antigène lors de la première exposition et développera des anticorps spécifiques contre cet antigène. Donc, lors des expositions ultérieures, le travailleur développera une inflammation pulmonaire chronique qui impliquera, à long terme, de la fibrose pulmonaire et une diminution des fonctions pulmonaire (Selman et al. 2012). Plusieurs types de pneumopathies d’hypersensibilité sont reliés à un antigène présent dans l’air de l’environnement occupationnel. Par exemple, la pneumopathie des éleveurs d’oiseaux est induite par des protéines aviaires des excréments et des plumes des volatils tandis que le poumon du fermier est causé par la bactérie Saccharopolyspora rectivirgula (Selman et al. 2012). Les premiers symptômes de la pathologie seront un souffle court, de la fièvre et la toux. De plus, les lavages bronchoalvéolaires des patients atteints de l’alvéolite allergique extrinsèque sont riches en lymphocytes, ce qui est une particularité diagnostique de la pathologie (Cormier et al. 1986).
1.5.3 Syndrome de choc toxique aux poussières organiques
Contrairement aux maladies d’hypersensibilité, le STEPO est immuno-inflammatoire, donc n’implique pas la réponse immunitaire acquise (Von Essen et al. 1990). Le STEPO se traduit par des syndromes pseudo-grippaux incluant la fièvre, des maux de tête, des myalgies, de la dyspnée, de la toux sèche et des nausées (Seifert et al. 2003). Ces symptômes surviennent dans l’heure suivant l’exposition aux poussières organiques, mais sont dépendants de la dose inhalée. Ces malaises disparaissent entre 24 et 72 heures pour la majorité des travailleurs (Rask-Andersen 1989), mais demeurent récurrents.
Les agents étiologiques sont encore mal connus, mais plusieurs sont suspectés, dont les endotoxines, les peptidoglycanes, les β-D-glucanes et les mycotoxines. Lecours et al. ont effectué des lavages bronchoalvéolaires sur deux patients atteints de STEPO et ont démontré une augmentation de l’infiltration des cellules polynucléées au niveau pulmonaire ainsi qu’un nombre de lymphocytes normal
(Lecours et al. 1986), contrairement aux cas d’alvéolite allergique extrinsèque démontrant une lymphocytose alvéolaire (Cormier et al. 1986). Également, une exposition de neuf sujets sains à l’air de bâtiments de production porcine a révélé une augmentation des cytokines pro-inflammatoires IL-6, IL-8 ainsi que TNF dans les lavages bronchoalvéolaires et dans les lavages nasaux, ainsi qu’un recrutement de neutrophiles aux poumons des volontaires (Cormier et al. 1998).
1.5.4 Maladies pulmonaires obstructives chroniques
Les poussières organiques peuvent également contribuer à induire des maladies pulmonaires obstructives chroniques (MPOC). Une incidence prononcée des individus œuvrant dans l’agriculture est répertoriée (Heederik 1994). L’inflammation chronique des voies respiratoires provoque des détériorations du tissu pulmonaire. Les fonctions pulmonaires, dont la compliance, diminueront drastiquement. Cette catégorie de pneumopathies englobe l’emphysème et les bronchites chroniques. L’emphysème se traduit par la dénaturation des parois des alvéoles, limitant ainsi l’apport en oxygène pour tout le système (Sharafkhaneh et al. 2008). Une inflammation chronique des muqueuses des bronches occasionnera des bronchites chroniques. La pathologie est diagnostiquée lorsqu’il y a des expectorations pendant plus de trois mois sur une durée de deux ans (May et al. 2012). De plus, il y aura une neutrophilie, une monocytose et une lymphocytose dans le tissu pulmonaire (Balbi et al. 1994). Plusieurs travailleurs affectés par des bronchites chroniques seront plus à risques de développer de l’asthme ultérieurement (Beckett 2000).
1.5.5 Asthme et inflammation des voies respiratoires
Enfin, plusieurs composantes présentes dans les environnements de travail sont susceptibles au développement ou à l’exacerbation de l’asthme chez le travailleur. En effet, on retrouve plus de cas d’exacerbation de l’asthme reliée au travail que de cas d’asthme occupationnel induit par l’environnement de travail (May et al. 2012). L’asthme est caractérisé par une infiltration accrue d’éosinophiles et de
neutrophiles dans le tissu pulmonaire, ainsi que d’une hyperréactivité bronchique. Ces symptômes chroniques induiront du remodelage tissulaire, se traduisant par des fonctions pulmonaires réduites (Lemanske and Busse 2003). De plus, la poussière organique peut induire de l’inflammation des voies respiratoires supérieures. L’irritation des muqueuses du nez et du larynx peut occasionner des rhinites, des laryngites et des sinusites. L’inflammation des muqueuses nasales provoque une congestion nasale et des sinus ainsi que des éternuements (May et al. 2012).
Ainsi, plusieurs pathologies respiratoires sont associées à l’exposition aux bioaérosols. En effet, le système immunitaire est constamment sollicité afin de combattre ou de tolérer les antigènes exogènes inhalés à chaque inspiration.
1.6 Notions d’immunité pulmonaire
À chaque respiration, l’être humain inhale une variété de particules, de gaz et de microorganismes. La taille et la concentration de ces particules inhalées affectent leur trajectoire dans l’arbre bronchique. Les particules peuvent alors se sédimenter, s’impacter et se déposer sur les muqueuses du système respiratoire (Lambrecht et al. 2013). Les particules de grandes tailles (> 10 µm) iront se loger dans les voies respiratoires supérieures soit le nez et le nasopharynx, où elles pourront être expulsées par éternuement. Les particules de moins de 5 µm pourront se rendre au poumon, mais la plupart seront trappées par les microvillosités du pharynx et expulsées du système respiratoire par des mécanismes mécaniques. Les particules de plus petite taille (< 2 µm) pourront se faufiler jusqu’aux alvéoles où le dommage pulmonaire est de plus grande envergure. Le système immunitaire sera alors sollicité afin de combattre un éventuel danger sur la détérioration des capacités pulmonaires (Brown et al. 1950; Sturm 2012).
Il est important de souligner que les réponses inflammatoires ayant lieu aux poumons ont le potentiel d’interférer avec les échanges gazeux puisque
l’inflammation est souvent associée à l’accumulation de fluides, et à l’épaississement de l’espace entre les alvéoles et les capillaires (Goodman et al. 2003), ce qui diminue l’efficacité des échanges gazeux (Zhang et al. 2000). Ainsi, le contrôle de l’inflammation pulmonaire est un processus critique et fortement régulé.
1.6.1 Rôle et fonctionnement général de l’immunité innée
L’immunité innée est la première réaction du système immunitaire suite à une insulte pulmonaire. Plusieurs cellules du tractus respiratoire jouent un rôle important dans l’immunité pulmonaire. En effet, les cellules épithéliales constituent la première ligne de défense entre l’individu et son environnement. Elles possèdent plusieurs récepteurs à leur surface afin de libérer divers médiateurs inflammatoires et des chimiokines qui déclencheront la réponse immunitaire face au danger potentiel (Weitnauer et al. 2016). Ces cytokines et chimiokines auront pour but d’attirer d’autres leucocytes afin de neutraliser rapidement les agents potentiellement nocifs. (Lambrecht et al. 2013). Les macrophages alvéolaires auront quant à eux comme mission de phagocyter et de détruire les antigènes inhalés, ce qui contribue au phénomène d’ignorance immunitaire et donc à un maintien optimal de la fonction pulmonaire (Zhang et al. 2000). Si l’inflammation s’instaure, les neutrophiles seront attirés au site de lésion pulmonaire pour détruire les microorganismes potentiellement nocifs par la libération de lysozyme et de défensines (Weitnauer et al. 2016). Il y aura libération de cytokines inflammatoires telles le TNF et l’IL-1 par les cellules présentes au poumon, dont les macrophages alvéolaires, les monocytes, les mastocytes, les cellules épithéliales et dendritiques et les neutrophiles. L’établissement d’un gradient de chimiokines par ces cellules permet de recruter davantage de neutrophiles et de cellules dendritiques au site inflammatoire. C’est alors que l’amplification de l’inflammation se produit et que les risques d’altération des échanges gazeux surviennent. De plus, si l’agent causal persiste, la cellule dendritique assurera le lien avec la réponse immunitaire
acquise, ce qui constitue une étape cruciale dans le développement des maladies d’hypersensibilité.
Ainsi, les interactions fonctionnelles entre tous les types cellulaires sont donc essentielles au maintien des échanges gazeux et des fonctions pulmonaires, en limitant l’inflammation et en permettent la jonction entre l’immunité innée et l’immunité adaptative. Lorsque cette réponse est dérégulée ou maintenue en raison d’une exposition constante à des agents causaux, l’apparition de pathologies ou de symptômes respiratoires devient possible.
1.6.2 La cellule dendritique
Les cellules dendritiques sont des sentinelles de l’immunité pulmonaire reliant l’immunité innée et l’immunité adaptative. Elles présentent les peptides des antigènes captés aux lymphocytes pour déclencher une réponse immune ou tolérogène (Steinman et al. 2003). Plusieurs cellules dendritiques sont résidentes du tissu pulmonaire et se situent en dessous de la barrière épithéliale des voies respiratoires. Les projections des dendrites des cellules dendritiques vont capter les antigènes inhalés dans le lumen des voies respiratoires sans endommager l’intégrité de la barrière épithéliale (Vermaelen and Pauwels 2005).
Certaines cellules dendritiques sont résidentes du tissu pulmonaire, alors que d’autres migreront de la circulation sanguine au poumon lorsqu’il y a dommage tissulaire (Chung et al. 2004). Cet afflux de cellules dendritiques est également causé par un gradient chimiotactique qui est dépendant du stimulus inflammatoire. Cette abondance de cellules dendritiques permettra d’augmenter l’efficacité de la capture d’antigènes. Suite à l’activation de leurs récepteurs de signaux de danger et à l’internalisation de l’antigène, les cellules dendritiques contribueront à amplifier l’inflammation via la libération de cytokines dont le TNF. Ensuite, elles migreront aux organes lymphoïdes drainants pour y effectuer la présentation des antigènes aux cellules de la réponse immune acquise (Condon et al. 2011). Ainsi, ces
dernières jouent un rôle essentiel dans l’initiation de la réponse immune pulmonaire.
1.6.2.1 Signaux d’activation des cellules dendritiques
La détection de molécules étrangères implique plusieurs mécanismes du système immunitaire. Les microorganismes retrouvés dans les bioaérosols possèdent des motifs moléculaires associés aux pathogènes (PAMPs), tels les lipopolysaccharides, les peptidoglycanes, les mannoses et les glucanes (Hammer and Ma 2013). Ces molécules, normalement absentes de l’environnement extracellulaire, permettent aux cellules dendritiques et autres cellules de l’immunité de les détecter aisément à l’aide de divers récepteurs de reconnaissance de motifs (PRRs) (Oh and Lee 2014). Les PRRs peuvent également détecter des molécules endogènes sécrétées par des cellules en nécrose ou en apoptose. Ces molécules appelées motifs moléculaires associés au danger (DAMPs) sont reliées au stress du système respiratoire, par exemple (Matzinger 2002).
Plusieurs PRR sont présents à la surface des cellules dendritiques et dans leur cytosol. Les récepteurs de type Toll (TLRs), permettent de détecter une multitude de composantes microbiennes. Cette détection mènera à l’activation de diverses voies de signalisation provoquant la translocation dans le noyau des facteurs de transcription NF-κB ou AP-1, par exemple, menant à la sécrétion de cytokines pro-inflammatoires (Hammer and Ma 2013). Certains TLRs détectent l’ADN et l’ARN bactérien ou viral, et sont situés dans le cytosol au niveau des endosomes. Ces TLRs activent les voies de signalisation IRF3 et IRF7 menant à la sécrétion des interférons de type 1 (Akira and Takeda 2004; Satoh and Akira 2016).
Le tableau 1.1 énumère les différents TLRs présents chez les cellules dendritiques et leurs ligands respectifs. Plusieurs de ces TLRs forment des hétérodimères afin de détecter leurs ligands, par exemple TLR1/TLR2 ou TLR2/TLR6, tandis que d’autres forment des homodimères (TLR4) (Satoh and Akira 2016).
Tableau 1. 1 Les TLRs et leurs ligands
TLRs Ligands Références
1 Lipopeptides triacylés (Takeuchi et al. 2002)
2 Peptidoglycane (Gram+ et Gram -) Acide lipoteichoique (Gram+) Endotoxines atypiques Lipoprotéines Zymosan (levures) (Schwandner et al. 1999; Takeuchi et al. 1999) (Werts et al. 2001) (Aliprantis et al. 1999) (Underhill et al. 1999)
3 ARN double brin Poly — (I : C)
(Alexopoulou et al. 2001)
4 Endotoxines (Poltorak et al. 1998)
5 Flagelline (protéine du flagelle) (Hayashi et al. 2001)
6 Lipopeptides diacylés Zymosan (Fungi)
Acide lipoteichoique (Gram+)
(Takeuchi et al. 2001) (Ozinsky et al. 2000) (Schwandner et al. 1999)
7 Poly-U
ARN simple brin
(Diebold et al. 2006) (Heil et al. 2004)
8 ARN simple brin (Heil et al. 2004)
9 ADN CPG (bactérie et virus) (Hemmi et al. 2000) Reproduit de : Akira S, Takeda K. 2004. Toll-like receptor signalling. Nature reviews Immunology 4:499-511.
D’autres récepteurs sont impliqués dans la détection de molécules exogènes. Effectivement, les récepteurs de type NOD (central nucleotide-binding oligomerization domain) (NLRs) sont des récepteurs intracellulaires détecteurs des signaux de danger (Sirard et al. 2007). Lorsqu’activés, ces récepteurs peuvent s’autoassembler et former un complexe protéique appelé inflammasome. Cette structure permet la sécrétion massive de l’IL-1β et de l’IL-18 par l’activation de la caspase-1 (Van de Veerdonk and Netea 2011). Certains NLRs ne forment pas d’inflammasome, mais détectent également des PAMPs intracellulaires. NOD1 et NOD2 sont des récepteurs intracellulaires qui détectent des composantes du peptidoglycane dont l’acide D-glutamyl mésodiaminopimelic, commune à toutes les
bactéries Gram négatifs et quelques Gram positifs, et le muramyldipeptide, composantes des toutes les bactéries (Moreira and Zamboni 2012).
D’autres récepteurs intracellulaires comme les récepteurs de type RIG-I (RLRs) (retinoic acide-inducible gene-1-like receptors) sont des senseurs cytoplasmiques de l’ARN viral (Chan and Gack 2016). Les récepteurs de type AIM2 (ALRs) sont également des récepteurs intracellulaires permettant la détection de l’ADN double brin et l’induction des gènes des interférons de type 1 et l’activation de la voie NF-κB (Gray et al. 2016). Ils peuvent également être impliqués dans l’activation de l’inflammasome (Chan and Gack 2016).
D’autres récepteurs et leurs ligands peuvent activer les cellules dendritiques sans impliquer la détection d’antigènes. Effectivement, les récepteurs de cytokines qui se situent sur la membrane plasmique des cellules dendritiques peuvent détecter l’inflammation déjà implantée et faire entrer ces cellules dans un processus de maturation. Des cellules en nécrose et des corps apoptotiques peuvent aussi provoquer l’activation des cellules dendritiques, ce qui est aussi le cas pour les protéines relarguées par ces cellules (Guermonprez et al. 2002).
1.6.2.2 Maturation des cellules dendritiques et présentation de l’antigène
La maturation des cellules dendritiques est un processus dynamique. Une fois les antigènes ingérés par endocytose, les endosomes fusionnent avec des lysosomes et dégradent les antigènes en peptides par des cathepsines (Driessen et al. 1999). Les peptides peuvent alors être reconnus par les complexes majeurs d’histocompatibilité, qui sont les molécules impliquées dans la présentation antigénique. Les enzymes endosomales sont également impliquées dans la dégradation de la chaîne invariante (li), qui empêche les CMH II de s’assembler aux peptides antigéniques en bloquant leur site de reconnaissance. Lors de l’activation des cellules dendritiques, il y a une augmentation de la production des CMH II dans le réticulum endoplasmique, une augmentation de l’acidité des lysosomes et l’activation des protéases, ce qui permet la liaison des peptides
antigéniques avec leur CMH II respectif. Les complexes CMH II-peptides encore à la surface des endosomes fusionnent avec la membrane plasmique (Pierre et al. 1997) ce qui permet de présenter l’antigène aux lymphocytes. Pendant ce processus, les cellules dendritiques migrent vers les tissus lymphoïdes secondaires drainants afin d’activer le système immunitaire adaptatif.
Lorsque les cellules migrent aux ganglions, elles présentent leur complexe CMH II-peptides aux lymphocytes T afin qu’il y ait une reconnaissance avec le récepteur des cellules T (TCR). L’activation des lymphocytes T naïfs nécessite trois signaux d’activation (Joffre et al. 2009). Premièrement, le complexe CHM II-peptide doit s’appareiller parfaitement au TCR du lymphocyte. Deuxièmement, les cellules dendritiques doivent posséder des molécules de co-stimulation à la surface de leur membrane afin de stabiliser la connexion entre les deux cellules. Les molécules d’activation telles le CD86 (B7.2), CD80 (B7.1) et CD40 sont surexprimées à la surface des cellules dendritiques activées et se lient aux CD28 ou CTLA-4 et CD40L du lymphocyte T, respectivement (Banchereau et al. 2000). Enfin, seule la cellule dendritique présentant des molécules d’activation à sa surface et sécrétant certaines cytokines selon le stimulus permettra la différenciation complète des lymphocytes T naïfs en effecteurs (Guermonprez et al. 2002). Par exemple, si la cellule dendritique sécrète de l’IL-12 p40, les lymphocytes T se différencieront en Th1 effecteurs alors que la sécrétion de IL-4 et IL-13 induit une différenciation en Th2 effecteur (Joffre et al. 2009).
Enfin, les cellules dendritiques sont essentielles au maintien de l’homéostasie pulmonaire. Lorsqu’activées, elles sécrètent du TNF, et expriment le CD86 et le CMH II à leur surface. Ainsi, leur degré d’activation peut être évalué par des anticorps fluorescents analysés par cytométrie en flux.
CHAPITRE II : PROBLÉMATIQUE, HYPOTHÈSE ET OBJECTIFS
2.1 Problématique
Malgré toutes les informations mises à jour sur les pathologies respiratoires occupationnelles causées par les bioaérosols, il existe encore aujourd’hui peu de limites d’exposition officielles. Ce manque est vraisemblablement issu de notre mauvaise compréhension des bioaérosols et du rôle de leurs diverses composantes et de leurs interactions dans la pathogenèse des maladies occupationnelles.
Il existe actuellement un manque dans les méthodes visant à déterminer la nature nocive de l’air des environnements de travail. Il n’existe pas de méthodes permettant de caractériser l’ensemble des composantes des bioaérosols. Cela interfère à l’identification de déterminants clés ou la création d’indice de salubrité clair pouvant limiter les conséquences d’une exposition à des environnements riches en bioaérosols. (Eduard et al. 2012; May et al. 2012; Poole and Romberger 2012).
Il existe ainsi un besoin pour l’établissement de méthodes visant à mieux comprendre le potentiel immunogène des bioaérosols complexes. Cette percée pourrait contribuer à avancer l’état des connaissances sur la pathogénécité des bioaérosols et peut-être même mener à l’identification de facteurs ou d’indices mesurables qui pourraient s’intégrer dans une stratégie de prévention primaire.
2.2 Hypothèse et objectifs
Puisque les cellules dendritiques sont situées à l’interface de l’hôte et de son environnement et qu’elles expriment un large éventail de récepteurs pour des signaux de danger retrouvés dans les bioaérosols. L’hypothèse de ce projet est
que les cellules dendritiques sont différentiellement activées en réponse à des agents ou des échantillons présentant des potentiels inflammatoires différents. Les objectifs spécifiques de ce projet étaient de :
1. Mettre au point une culture de cellules dendritiques permettant de discriminer des agents immunogènes présentant différents potentiels inflammatoires
2. Élaborer un protocole efficace d’échantillonnage des endotoxines et des bioaérosols complexes en solution aqueuse.
3. Évaluer le potentiel pro-inflammatoire de l’air d’environnements de travail avec les cultures de cellules dendritiques.
4. Comparer l’activation des cellules dendritiques in vitro induite par les échantillons d’air avec l’inflammation pulmonaire aiguë induite in vivo. Dans leur ensemble les expériences proposées contribueront à mieux comprendre les déterminants de l’activation des cellules dendritiques dans des échantillons d’airs complexes et d’en apprécier leur potentiel prédictif sur la réponse immune pulmonaire in vivo.